对于重组蛋白的分离纯化,一般都会在进行载体构建时,选择N端或C端加上一个标签,如GST,HIS6,FLAG和MBP等,带了这些标签的蛋白就可以通过亲和吸收的填料来到达初步纯化的目的,亲和纯化相对简单,带有标签的蛋白就会吸附到相应的填料上,而不带标签的蛋白会直接流出,简单的清洗杂蛋白后,只需要再把吸附在上面的蛋白洗脱下来即可,几乎不需要摸索分离纯化的条件。含有所需蛋白的分泌液或者裂解液一般体积都相对比较大,最好使用蛋白存化系统(Clear First 2000)的上样泵上样;进完样后,进行杂蛋白的清洗,再用特异的洗脱液将蛋白洗脱,通过自动接收器接收分离后样品即可,整个过程基本可以实现自动化操作。
方案详情

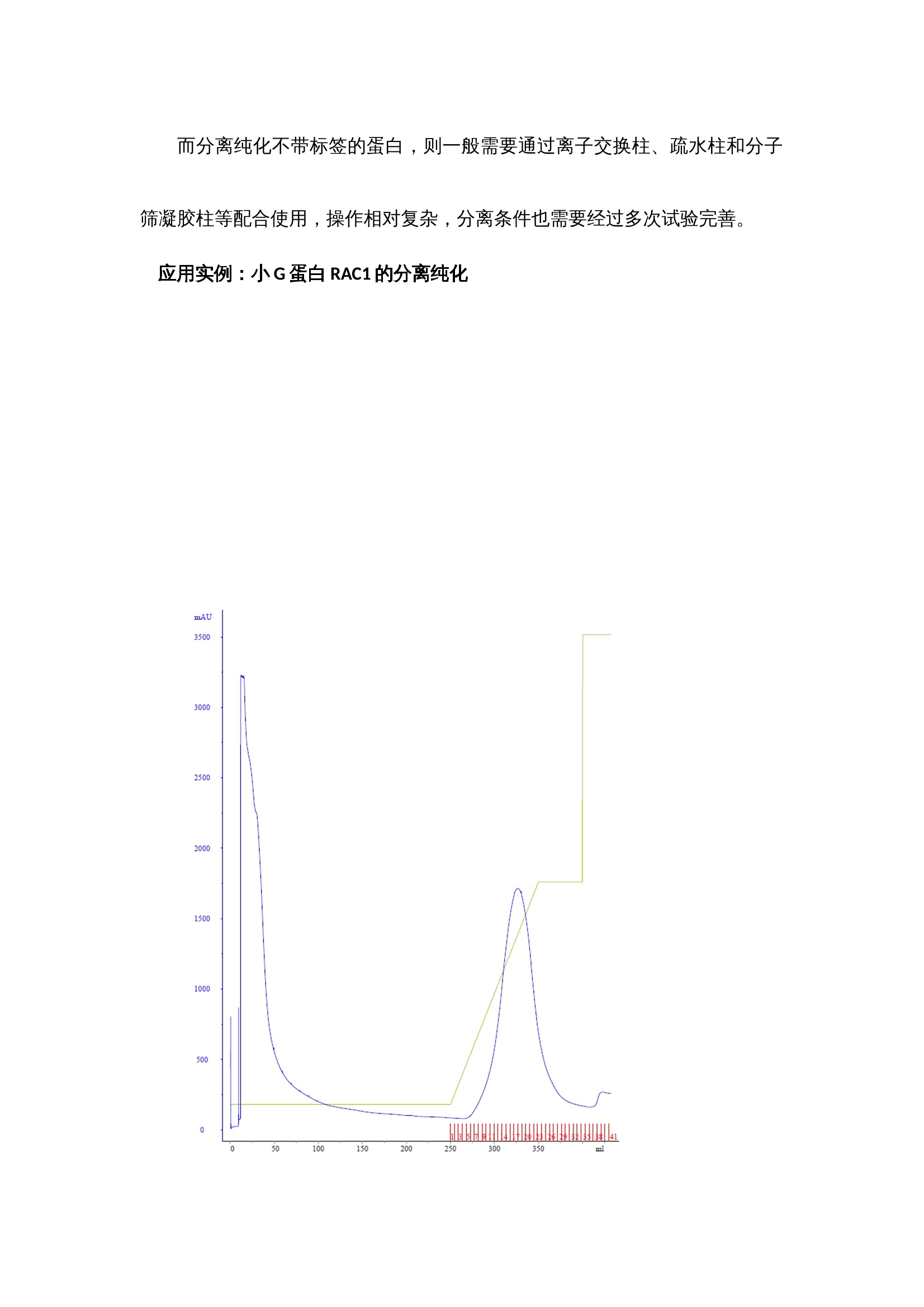
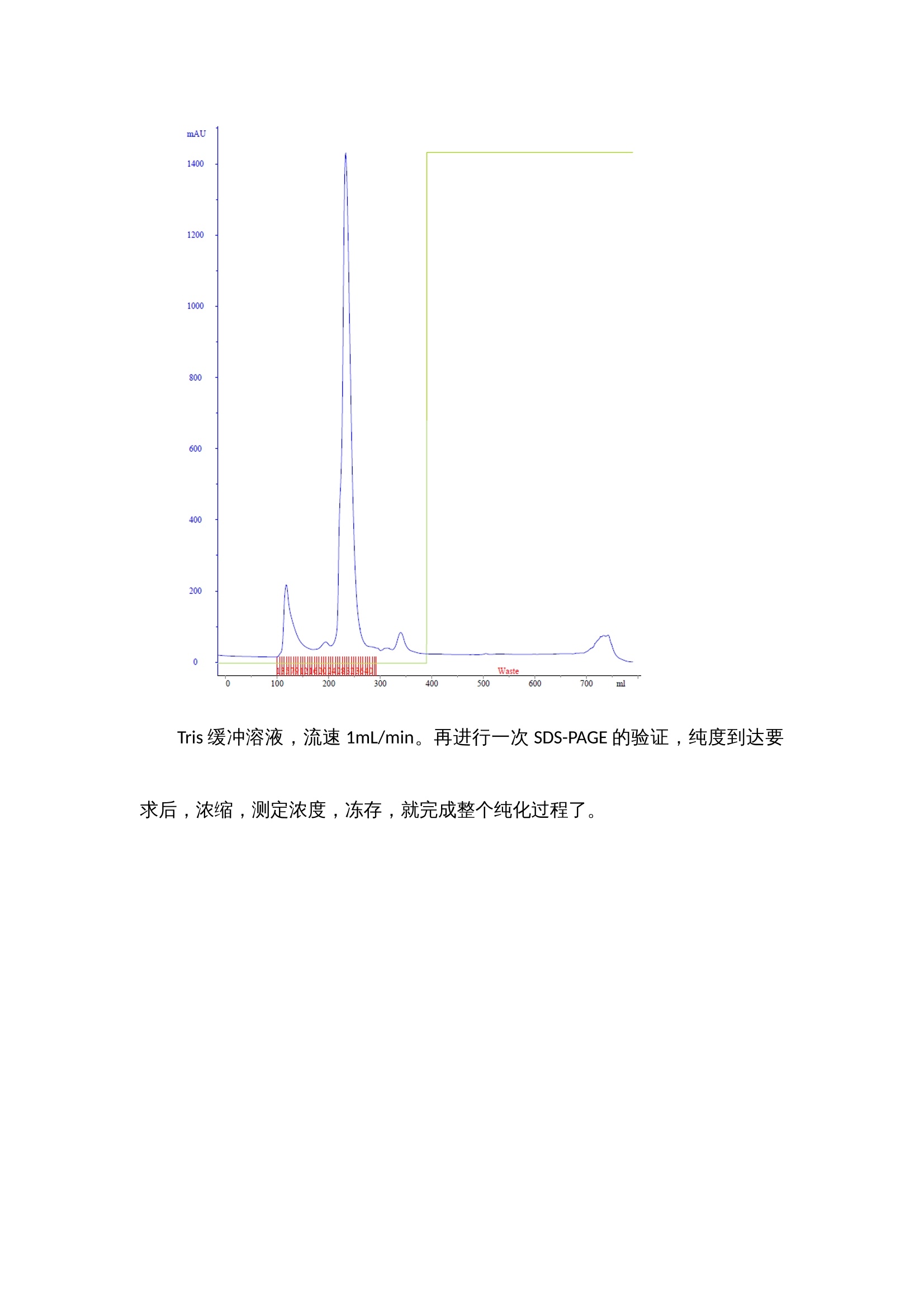
蛋白纯化产品解决方案 蛋白的分离纯化是生物相关研究领域内必不可少的一个步骤。从复杂的多样的蛋白中分离所需的蛋白,是一件比较困难的事。 对于重组蛋白的分离纯化,一般都会在进行载体构建时,选择N端或C端加上一个标签,如GST,HIS6,FLAG和MBP等,带了这些标签的蛋白就可以通过亲和吸收的填料来到达初步纯化的目的,亲和纯化相对简单,带有标签的蛋白就会吸附到相应的填料上,而不带标签的蛋白会直接流出,简单的清洗杂蛋白后,只需要再把吸附在上面的蛋白洗脱下来即可,几乎不需要摸索分离纯化的条件。含有所需蛋白的分泌液或者裂解液一般体积都相对比较大,最好使用蛋白存化系统(Clear First 2000)的上样泵上样;进完样后,进行杂蛋白的清洗,再用特异的洗脱液将蛋白洗脱,通过自动接收器接收分离后样品即可,整个过程基本可以实现自动化操作。 根据蛋白纯化系统软件上的出峰位置,从自动收集架上有选择性的选取部分样品管进行SDS-PAGE(蛋白电泳)验证,考马斯亮蓝染色,观察条带的分子量大小与所需蛋白是否吻合,观察是否还有其他的杂带,若有杂带,估测下所需蛋白的含量,一般超过90%就不需要进一步的纯化,只需要进行脱盐处理即可(有时可能还需要切掉标签蛋白部分)。若想对所得蛋白进行更进一步的验证,Western blot,将蛋白转至NC膜上,用标签抗体或该蛋白的特异性单抗进行孵育,清洗后,再孵育上带有HRP的二抗,再一次清洗后,就可以将NC膜放进化学发光成像系统中,再讲混合好的A、B液滴在膜上,就可以用化学发光成像系统进行拍摄,观察产生条带(斑点)位置,浓淡等,从而进一步验证蛋白的正确性。 若是所需蛋白的纯度达不到要求,需要进一步过凝胶色谱柱,通过分子量的差异去除杂蛋白,达到纯化的目的(过凝胶柱之前一般需要进行脱盐和浓缩)。 得到纯的蛋白后,最后一般都要进行浓度的测定,现在最普及的是用BCA试剂盒测定,按操作说明加好孵育后,用酶标仪(ReadMax 1900全波长光吸收酶标仪)在562 nm处读取OD值,在通过酶标仪上的结果处理,即可计算得出待测蛋白的浓度,无需人员通过EXCEL自己计算。这样就基本完成了蛋白分离纯化的整个过程。 对于单克隆抗体的纯化,将血清进行简单的离心和过滤后,就可以过键合protein A的凝胶填料柱,和纯化标签蛋白类似的方法纯化即可。 而分离纯化不带标签的蛋白,则一般需要通过离子交换柱、疏水柱和分子筛凝胶柱等配合使用,操作相对复杂,分离条件也需要经过多次试验完善。 带His6标签的小G蛋白RAC1通过Ni-NTA填料柱进行亲和纯化,流速2mL/min,A泵是10nM咪唑的Tris缓冲溶液,B泵是500mM咪唑的Tris缓冲溶液,2%的B清洗250 mL,2%—40%B梯度洗脱100 mL,40%B洗脱50 mL,再用100%B洗50mL。得到的样品通过SDS-PAGE验证: 观察图片上的条带,可观察到目标蛋白的大小和浓度都不错,但还是有一些杂蛋白的条带,需要进一步纯化。脱盐浓缩后,过Superdex 200凝胶柱 Tris缓冲溶液,流速1mL/min。再进行一次SDS-PAGE的验证,纯度到达要求后,浓缩,测定浓度,冻存,就完成整个纯化过程了。 蛋白纯化产品解决方案蛋白的分离纯化是生物相关研究领域内必不可少的一个步骤。从复杂的多样的蛋白中分离所需的蛋白,是一件比较困难的事。对于重组蛋白的分离纯化,一般都会在进行载体构建时,选择N端或C端加上一个标签,如GST,HIS6,FLAG和MBP等,带了这些标签的蛋白就可以通过亲和吸收的填料来到达初步纯化的目的,亲和纯化相对简单,带有标签的蛋白就会吸附到相应的填料上,而不带标签的蛋白会直接流出,简单的清洗杂蛋白后,只需要再把吸附在上面的蛋白洗脱下来即可,几乎不需要摸索分离纯化的条件。含有所需蛋白的分泌液或者裂解液一般体积都相对比较大,最好使用蛋白存化系统(Clear First 2000)的上样泵上样;进完样后,进行杂蛋白的清洗,再用特异的洗脱液将蛋白洗脱,通过自动接收器接收分离后样品即可,整个过程基本可以实现自动化操作。根据蛋白纯化系统软件上的出峰位置,从自动收集架上有选择性的选取部分样品管进行SDS-PAGE(蛋白电泳)验证,考马斯亮蓝染色,观察条带的分子量大小与所需蛋白是否吻合,观察是否还有其他的杂带,若有杂带,估测下所需蛋白的含量,一般超过90%就不需要进一步的纯化,只需要进行脱盐处理即可(有时可能还需要切掉标签蛋白部分)。若想对所得蛋白进行更进一步的验证,Western blot,将蛋白转至NC膜上,用标签抗体或该蛋白的特异性单抗进行孵育,清洗后,再孵育上带有HRP的二抗,再一次清洗后,就可以将NC膜放进化学发光成像系统中,再讲混合好的A、B液滴在膜上,就可以用化学发光成像系统进行拍摄,观察产生条带(斑点)位置,浓淡等,从而进一步验证蛋白的正确性。若是所需蛋白的纯度达不到要求,需要进一步过凝胶色谱柱,通过分子量的差异去除杂蛋白,达到纯化的目的(过凝胶柱之前一般需要进行脱盐和浓缩)。得到纯的蛋白后,最后一般都要进行浓度的测定,现在最普及的是用BCA试剂盒测定,按操作说明加好孵育后,用酶标仪(ReadMax 1900全波长光吸收酶标仪)在562 nm处读取OD值,在通过酶标仪上的结果处理,即可计算得出待测蛋白的浓度,无需人员通过EXCEL自己计算。这样就基本完成了蛋白分离纯化的整个过程。对于单克隆抗体的纯化,将血清进行简单的离心和过滤后,就可以过键合protein A的凝胶填料柱,和纯化标签蛋白类似的方法纯化即可。而分离纯化不带标签的蛋白,则一般需要通过离子交换柱、疏水柱和分子筛凝胶柱等配合使用,操作相对复杂,分离条件也需要经过多次试验完善。应用实例:小G蛋白RAC1的分离纯化带His6标签的小G蛋白RAC1通过Ni-NTA填料柱进行亲和纯化,流速2mL/min,A泵是10nM咪唑的Tris缓冲溶液,B泵是500mM咪唑的Tris缓冲溶液,2%的B清洗250 mL,2%—40%B梯度洗脱100 mL,40%B洗脱50 mL,再用100%B洗50mL。得到的样品通过SDS-PAGE验证:观察图片上的条带,可观察到目标蛋白的大小和浓度都不错,但还是有一些杂蛋白的条带,需要进一步纯化。脱盐浓缩后,过Superdex 200凝胶柱Tris缓冲溶液,流速1mL/min。再进行一次SDS-PAGE的验证,纯度到达要求后,浓缩,测定浓度,冻存,就完成整个纯化过程了。
确定




还剩4页未读,是否继续阅读?
上海闪谱生物科技公司为您提供《小G蛋白RAC1中分离纯化检测方案(蛋白质纯化)》,该方案主要用于生物发酵中分离纯化检测,参考标准--,《小G蛋白RAC1中分离纯化检测方案(蛋白质纯化)》用到的仪器有ClearFirst-2000M型蛋白纯化系统、ReadMax 1900型光吸收全波长酶标仪
推荐专场
相关方案
更多

















