方案详情
文
糖基化是最重要的一种翻译后修饰,指的是将糖基部分连接到蛋白质上。糖基化模式的改变对免疫原性和整体生物活性有很大影响。因此,糖基化表征对基于生物医药的应用至关重要。虽然现在已有多种分析技术被应用于分析 N-糖基化,但低水平糖基化的精确测定仍面临着极大的挑战。
本应用简报展示了利用毛细管电泳和质谱 (CEMS) 对重组单克隆抗体 (mAb) 糖基化进行分析。此方法包括利用 N-糖苷酶 F (PNGase F) 酶解 mAb 得到多糖,对多糖进行荧光标记( 8-氨基吡-1,3,6-三磺酸三钠盐,ATPS),并利用 Agilent 7100 CE 串联 Agilent 6520 精确质量 Q-TOF LC/MS 进行分析。从使用的重组 mAb 中,我们共鉴定出 7 种多糖,从每种多糖成分的相对百分比可知,主要及次要糖基化修饰均有存在。本应用简报证明了高分离速度的 CE 与高灵敏度检测限的 MS 相结合,使 CE-MS 成为一种替代 LC/MS 方法对 mAb 或其它糖蛋白进行糖基化表征的有效且最有前景的方法。
方案详情

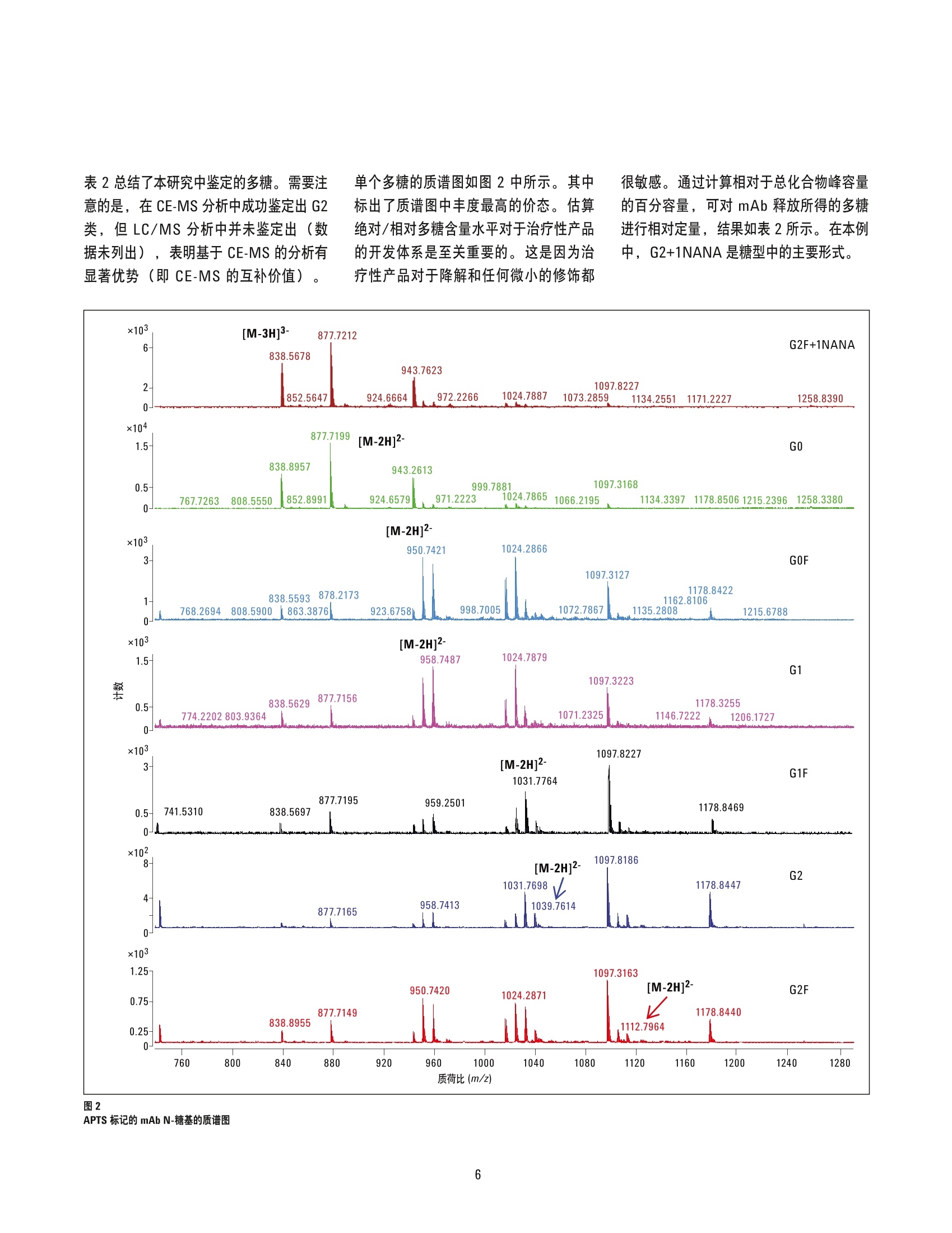
单克隆抗体N-糖基化的毛细管电泳和质谱分析 应用简报 生物制药 作者 Suresh Babu C.V and Ravindra GudihalAgilent Technologies India Pvt. LtdBangalore, India 摘要 糖基化是最重要的一种翻译后修饰,指的是将糖基部分连接到蛋白质上。糖基化模式的改变对免疫原性和整体生物活性有很大影响。因此,糖基化表征对基于生物医药的应用至关重要。虽然现在已有多种分析技术被应用于分析N-糖基化,但低水平糖基化的精确测定仍面临着极大的挑战。 本应用简报展示了利用毛细管电泳和质谱(CEMS) 对重组单克隆抗体(mAb)糖基化进行分析。此方法包括利用 N-糖苷酶 F (PNGase F) 酶解 mAb 得到多糖,对多糖进行荧光标记(8-氨基吡-1,3,6-三磺酸三钠盐, ATPS), 并利用 Agilent 7100 CE 串联 Agilent 6520 精确质量Q-TOF LC/MS 进行分析。从使用的重组 mAb 中,我们共鉴定出7种多糖,从每种多糖成分的相对百分比可知,主要及次要糖基化修饰均有存在。本应用简报证明了高分离速度的 CE 与高灵敏度检测限的 MS 相结合, 使 CE-MS 成为一种替代 LC/MS 方法对mAb 或其它糖蛋白进行糖基化表征的有效且最有前景的方法。 前言 近年来, 单克隆抗体(mAb)已成为生物制药行业具有潜力的新兴蛋白候选药物。其药物研发流程包括一系列精细的控制和评估步骤,需要仔细、严格地监测目标化合物的治疗稳定性及有效性。因此,在商业化前的每个阶段对 mAb 进行全面表征是极其有益的。在大量研究成熟的蛋白翻译后修饰中,已知糖基化在很多生物过程中都扮演着重要的角色(例如蛋白降解和转录)).,从而影响健康和疾病进展1。而鉴定重要蛋白分子中连接的糖基则需要一种可靠、稳定、灵敏的分析技术。 近来,:毛细管电泳(CE)在糖蛋白分析领域得到了众多关注,主要是由于其可以缩短分析时间,并保持高效分离。使用一种荧光发色团 (ATPS,阴离子)对酶解所得多糖进行标记, CE分离后,利用高灵敏度的激光诱导荧光 (LIF) 或质谱 (MS)进行检测。 APTS 标记将负电荷传递给多糖,可提高电泳分离能力,并使之更适用于电喷雾电离(负模式),使整个分离和检测过程与荧光标记化学高度兼容。将CE 与MS串联有益于鉴定未知的糖基化修饰或质量信息,并进行峰指认²。 本应用简报展示了利用 CE-QTOF MS对重组mAb所得的N-糖基进行分析。APTS标记的 CE-MS方法有助于鉴定 mAb 上的所有糖基。此外,还可得到每种多糖的相对百分比,以表征主要及次要糖基化修饰。 材料与方法 化学试剂 单克克抗体, PNGase F 和 PVA 涂层毛细管来自安捷伦科技有限公司。8-氨基己酸和1M氰基硼氢化钠的四氢呋喃(THF)溶液购自西格玛奥德里奇公司(美国密苏里州圣路易斯)。APTS 购自 Invitrogen公司 Molecular Probes(美国俄勒冈州尤金)。多糖标准品购自 Prozyme 公司(美国加州海沃德)。 PhyTip柱购自PhyNexus 公司(美国加州圣何塞)。 酶解去糖基化,多糖提取和 APTS 标记 利用 PNGase F 进行 mAb 去糖基化。在mAb (15 mg/mL) 中加入 PNGase F(溶于 0.25 M Tris 缓冲液, pH 值7.6)37℃下过夜。加热后,去糖基化的蛋白沉淀,然后离心。干燥含有多糖的上清液,然后通过还原胺化进行 APTS 标记。 在干燥的多糖样品中,加入2.5 pL50 mMAPTS 的1.2M柠檬酸溶液,2.5pL1M氰基硼氢化钠的 THF 溶液, 水浴37°C下过夜。加入50 pL水稀释反应混合物以停止反应。利用含有 PhyNexus 正相聚酰胺树脂的 PhyTip(使用前以 95%ACN平衡)去除未连接的多余染料。上样后,用95% ACN 冲洗柱子,最终用20%ACN洗脱得到 N-糖基。 CE-MS仪器方法 CE-ESI-MS分析中使用 7100 CE系统(配有CE-MS毛细管卡套,部件牛G1603A),串联6520精确质量 Q-TOF (配有双离子源及正交共轴鞘液接口,部件号G1607B)3.使用空缓冲液和标准品最优化分离条件和喷雾稳定性。鞘液 CE-MS 接口处维持一个较低的流速(5pL/min) 以保持 CE 分离的高效性,并为电喷雾电离提供一个稳定流及其它必要的喷雾条件。Q-TOF 参数由MS 调谐系统自动最优化,并利用ESI调谐混合物对 MS 系统进行校正。 表 1列出了 CE-MS的参数。所有化合物列表由 MassHunter 分子特征提取(MFE)算法提取所得。 毛细管电泳 (CE) CE: Agilent 7100 毛电管电泳系统 样品: mAb 所得的N-糖基 进样: 30 mbar 下40秒 毛细管: PVA, 总长60 cm, 50 um 内径 缓冲液: 40mM e-氨基己酸 pH 值4.5 电压: -25kV 外压力: 10 mbar 温度: 20°C 质谱 (MS) MS: Agilent 6520 精确质量飞行时间液质联用系统 电离模式 ESI 采集模式: MS(质量范围400-3,200 m/z) 鞘液: 异丙醇:水(1:1v/v), 含有 0.2%NH,, 流速5 pL/min 干燥气流量: 5 L/min 雾化器: 8psi 干燥气温度: 250°C 裂解电压: 175V 毛细管电压: 3,200 V 采集时间: 980.3 ms/谱图 采集速率: 1.02谱图/s 尽管 CE-LIF 常用于多糖分析, 但 CE-MS能提供分子量信息,所以在鉴定电泳结果中的未知迁移条带方面具有优势。在本应用简报中,将 CE 与配有鞘液接口的Q-TOF MS串联,以指认 mAb所得多糖的质量信息。方案1描述了 mAb 糖谱的 CE-MS 分析步骤。简单地说,抗体释放的多糖先进行 APTS标记,然后进行 CE-MS 分析。图1为重组mAb 中释放所得的N-糖基的 CE-MS 总化合物谱。利用 PVA 涂层毛细管,所有 mAb 多糖均可在15分钟分离时间内实现迁移。通过重复实验,我们成功鉴定了未带电荷的N-糖基类化合物, 包括 G0、GOF、G1、G1F、G2 和 G2F。此外,还观察到了单唾液酸化的多糖 G2F+1NANA。所有峰的指认均基于Q-TOF分析测得的精确分子量。 方案1 mAb 糖谱 CE-MS 分析的概述图 图1 表2总结了本研究中鉴定的多糖。需要注意的是,在 CE-MS分析中成功鉴定定 G2类,但LC/MS分析中并未鉴定出(数据未列出), 表明基于 CE-MS的分析有显著优势(即 CE-MS的互补价值)。 糖链缩写 单同位素测定质量 测得丰度最高的电荷状态 糖链结构 单同位素理论质量 相对百分比 GO 1,757.4575 877.7212(-2) 1,757.4512 20.8 GOF 1,903.5121 950.7484(-2) 1,903.5091 34.0 G1 1,919.5071 958.7389(-2) 1,919.5040 2.3 G1F 2,065.5649 1,031.7756(-2) 2,065.5619 4.2 G2 2.081.5666 1,039.7751(-2) - 2,081.5568 3.1 G2F 2,227.6228 1,112.8041(-2) 2,227.6147 1.2 G2+1NANA 2,518.7191 838.5664(-3) 咖 2,518.7101 34.4 表2 CE-MS鉴定的mAb N-糖基总结 表2总结了本研究中鉴定的多糖。需要注意的是,在 CE-MS分析中成功鉴定出 G2类,但LC/MS分析中并未鉴定出(数据未列出)).,表明基于 CE-MS 的分析有显著优势(即CE-MS的互补价值) 单个多糖的质谱图如图2中所示。其中标出了质谱图中丰度最高的价态。估算绝对/相对多糖含量水平对于治疗性产品的开发体系是至关重要的。这是因为治疗性产品对于降解和任何微小的修饰都 很敏感。通过计算相对于总化合物峰容量的百分容量,可对mAb 释放所得的多糖进行相对定量,结果如表2所示。在本例中, G2+1NANA是糖型中的主要形式。 这些结果清晰地指出 CE-MS 可成为检测糖谱的一种有效的替代分析工具。串联CE-MS分离可避免污染,这是因为样品处理步骤很少, CE 分离使用的缓冲液与电喷雾电离高度兼容。与 CE-LIF 相比,该方法在糖谱分析中更为灵敏、精确。 结论 本应用简报提供了一个基于 Agilent CE-MS的mAb糖谱分析方法。Agilent MassHunter和BioConfirm 软件包的强大数据处理能力能够成功、详尽地鉴定并得出 mAb 糖型谱。此外,通过分离主要和次要多糖形式,可合理解析糖基化模式。 ( 参考文献 ) ( 1 . Li Y,Tao SC, Bova GS, Liu AY, Chan DW, Z hu H, Zhang H. Detection and verification of glycosylation p atternsof glycoproteins from clinical specimens using l ectin microarrays and l e ctin- based immunosorbent assays. Anal. Chem., 83 ( 22), pp8509-8516,2011. ) ( 2. Gennaro LA, Salas-Solano 0.On-line CE-LIF-MS technology for the directcharacterization of N-linked glycans from therapeutic a ntibodies. Anal. Chem., 8 0 (10), pp 3838-3845,2008. ) ( 3. Suresh Babu C.V and Ravindra Gudihal, "Glycopeptide Analysis of Antibodiesby Capillary Electrophoresi s and Q-TOF Mass Spectromet r y",(利用毛细管电泳和Q-TOF 质谱仪分析抗体的糖肽) ). ,安 ) ( 捷伦出版号5990-7138EN,2011. ) www.agilent.com/chem/ce C安捷伦科技(中国)有限公司,2012 2012年9月1日出版 5991-1020CHCN Agilent Technologies Agilent Technologies 糖基化是最重要的一种翻译后修饰,指的是将糖基部分连接到蛋白质上。糖基化模式的改变对免疫原性和整体生物活性有很大影响。因此,糖基化表征对基于生物医药的应用至关重要。虽然现在已有多种分析技术被应用于分析 N-糖基化,但低水平糖基化的精确测定仍面临着极大的挑战。本应用简报展示了利用毛细管电泳和质谱 (CEMS) 对重组单克隆抗体 (mAb) 糖基化进行分析。此方法包括利用 N-糖苷酶 F (PNGase F) 酶解 mAb 得到多糖,对多糖进行荧光标记( 8-氨基吡-1,3,6-三磺酸三钠盐,ATPS),并利用 Agilent 7100 CE 串联 Agilent 6520 精确质量 Q-TOF LC/MS 进行分析。从使用的重组 mAb 中,我们共鉴定出 7 种多糖,从每种多糖成分的相对百分比可知,主要及次要糖基化修饰均有存在。本应用简报证明了高分离速度的 CE 与高灵敏度检测限的 MS 相结合,使 CE-MS 成为一种替代 LC/MS 方法对 mAb 或其它糖蛋白进行糖基化表征的有效且最有前景的方法。
确定







还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《单克隆抗体中糖基化分析检测方案(毛细管电泳仪)》,该方案主要用于治疗类生物药品中含量测定检测,参考标准--,《单克隆抗体中糖基化分析检测方案(毛细管电泳仪)》用到的仪器有Agilent 7100 毛细管电泳系统
推荐专场
相关方案
更多
该厂商其他方案
更多