
方案详情
文
用气相色谱-质谱联用(GC-MS)分析方法同时测定红枣中6种酚酸(水杨酸、4-羟基苯甲酸、香草酸、2,5-二羟基苯甲酸、原儿茶酸和对香豆酸)。并对色谱柱、升温程序及衍生化条件进行了优化。最终使用的色谱柱为Rtx-5毛细管色谱柱(0.25 mm×30 m,0.25μm);升温程序为初始柱温100℃,以10℃/min升至200℃,然后再以5℃/min上升到250℃,保持5 min,总共运行时间为25 min;选择(双三甲基硅烷基)三氟乙酰胺(BSTFA,含1%的三甲基氯硅烷)为衍生化试剂,样品衍生化的温度为35℃,时间30 min。在此最优分析条件下,6种酚酸得到良好的分离,各酚酸含量与峰面积之间呈现良好的线性关系(r2≥92.6),方法的检出限为1~6μg/L,回收率为92.6%~104.3%,且相对标准偏差均小于5%。该方法可成功用于3种红枣样品中的此6种酚酸的测定,也为其他食品中这6种酚酸的测定提供新的检测方法。
方案详情

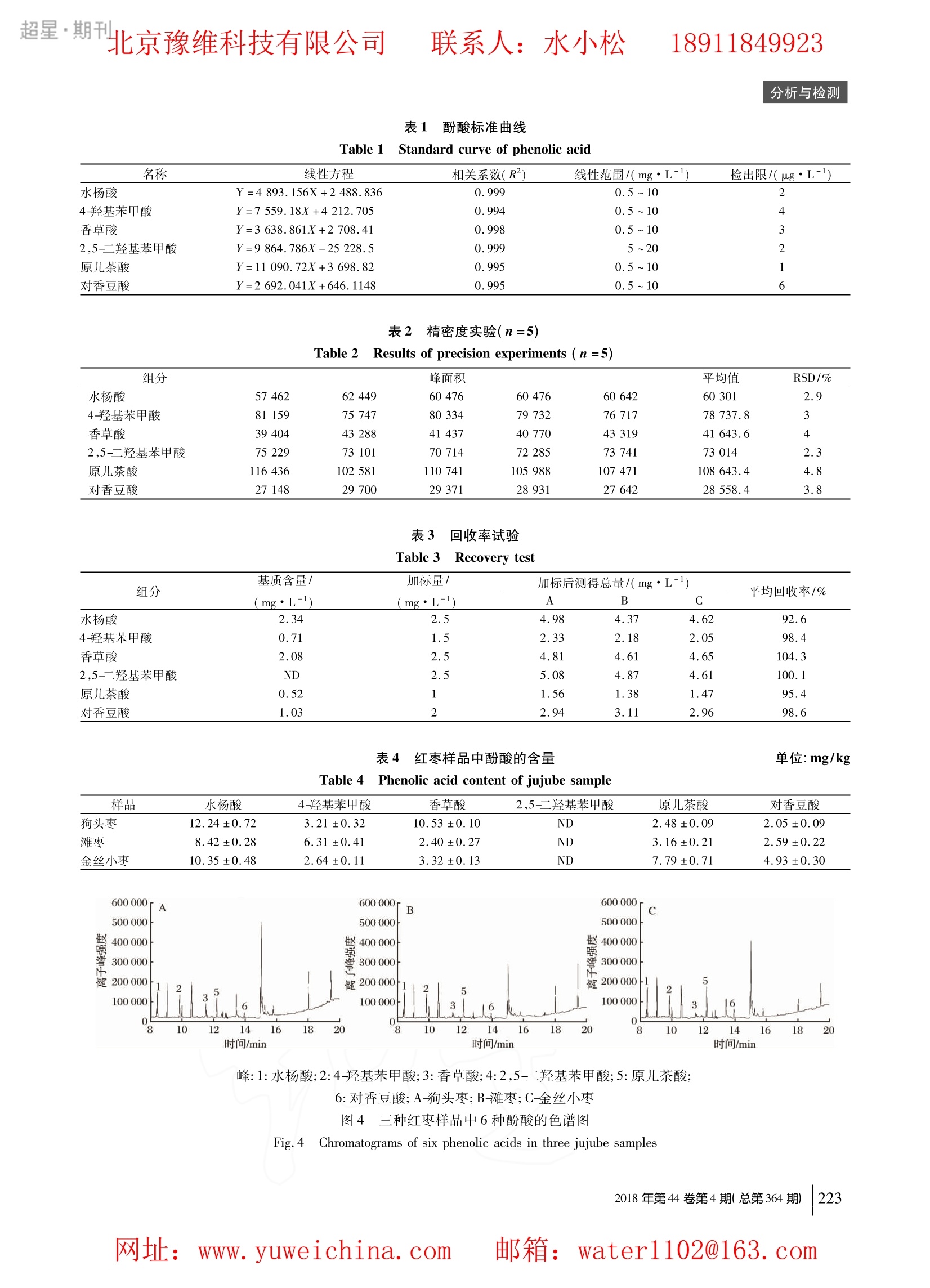
超星·期刊联系人:水小松 18911849923 超星·期刊北京豫维科技有限公司联系人:水小松 18911849923分析与检测 食品与发酵工业 FOOD AND FERMENTATION INDUSTRIES DOI:10.13995/j. cnki. 11-1802/ts.015267 引用格式:韩雪,张富新,邵玉宇,等.气相色谱-质谱联用法同时测定红枣中六种酚酸[J].食品与发酵工业,2018,44(4):220-225.HAN Xue, ZHANG Fu-xin, SHAO Yu-yu,et al. Simultaneous determination of 6 kinds of phenolic acids in jujube by GC-MS [J]. Food and Fer-mentation Industries,2018 ,44(4):220-225. 气相色谱-质谱联用法同时测定红枣中六种酚酸 韩雪,张富新,邵玉宇,彭海霞,王毕妮 (陕西师范大学食品工程与营养科学学院,陕西西安,710119) 摘 要 采用气相色谱-质谱联用(GC-MS)分析方法同时测定红枣中6种酚酸(水杨酸、4-羟基苯甲酸、香草酸、2,5-二羟基苯甲酸、原儿茶酸和对香豆酸)。并对色谱柱、升温程序及衍生化条件进行了优化。最终使用的色谱柱为 Rtx-5 毛细管色谱柱(0.25 mm×30 m,0.25 p.m);升温程序为初始柱温100℃,以10℃ /min 升至200℃,然后再以5℃/min 上升到250℃,保持5 min,总共运行时间为25 min;选择(双三甲基硅烷基)三氟乙酰胺(BST-FA,含1%的三甲基氯硅烷)为衍生化试剂,样品衍生化的温度为35℃,时间30 min。在此最优分析条件下,6种酚酸得到良好的分离,各酚酸含量与峰面积之间呈现良好的线性关系(r≥92.6),方法的检出限为1~6 ug/L,回收率为92.6%~104.3%,且相对标准偏差均小于5%。该方法可成功用于3种红枣样品中的此6种酚酸的测定,也为其他食品中这6种酚酸的测定提供新的检测方法。 关键词 红枣;酚酸;气相色谱-质谱联用 红枣是鼠李科植物枣树的果实,具有很高的营养和保健价值山。红枣中含有多种生物活性成分,包括多糖、三萜类、黄酮和酚酸类化合物等12-51。。酚酸是芳香族羧酸的羟基衍生物,研究表明,酚酸类化合物具有很强的抗氧化活性,在预防心脑血管疾病、癌症、骨质疏松症和神经退行性疾病中发挥着重要作用16-8]。目前枣果中被检出的酚酸有11种,包括6种羟基肉桂酸型酚酸(咖啡酸、对香豆酸、阿魏酸、肉桂酸、绿原酸、芥子酸)、4种苯甲酸型酚酸(没食子酸、原儿茶酸、对羟基苯甲酸、香草酸)以及鞣花酸。WABG等[10]在研究枣果各部位不同类型酚酸分布与含量时共发现了8种酚酸; GAO 等11-13]在我国枣果中检出了7种酚酸类物质,其组成和含量因品种不同而存在差异。因此,对红枣中酚酸类化合物的分析检测具有重要意义。 目前用于酚酸的分析方法主要有分光光度法和高效液相色谱法。张向前等114.利用紫外分光光度法对红枣中的9种酚酸进行检测,但是分光光度法只能 ( 第一 作 者:硕士研究生(王毕妮教授为通讯作者,E-mail: bini-wang@ snnu.edu. cn) 。 ) ( 基金项目:国家自然科学基金面上项目(No.31771973);陕西省科技成果转化专项资金(20 1 6KTCG01-12;“中央高校基本科研 业务费专项资金资助”( GK20 1 603097, GK201703063);陕西省 科技计划项目(2012K02-06,2016NY-207) ) ( 收稿日期:2017-07-21;改回日期:2017-09-20 ) 测定同类结构的总酚含量,不能区分结构类似的酚类物质含量。侯丽娟等15.使用高效液相色谱法对6种不同品种、不同年份的葡萄酒样品中的12种酚酸进行检测。 HPLC 虽然定量准确,但难以鉴定未知化合物的结构,且分析时间较长。还有利用毛细管电泳161和傅立叶近红外光谱171检测,但是由于检测复杂等原因这2种方法应用并不多。因此,建立一种能够简单快速并且具有较高灵敏度的检测植物中酚酸类化合物的方法意义重大。 GC-MS分析方法不仅简单、灵敏度高,还能够鉴定未知化合物的结构。 MILENAL18J等采用 GC-MS分析方法对红酒中的酚酸进行了研究; CHRISTIAN_19等利用 GC-MS分析方法对酚类物质经微生物发酵后的产物进行了分析;赵艳玲1201建立了 GC-MS 同时测定植物叶片中的4种酚酸的程序方法。本实验采用GC-MS分析方法对红枣中的酚酸进行分析,目的在于建立一种能够在较短时间内同时测定出红枣中6种酚酸的方法,并对3种红枣中这6种酚酸的含量进行分析。 材料与方法 1.1 实验材料与仪器 QP-2010Ultra 气质联用仪,日本岛津; Rtx-5毛细管色谱柱(0.25 mm×30 m,0.25 pm),美国 Agilent公司;分析天平,北京赛多利斯电子天平有限公司;立 式离心机,张家港轻工设备厂;旋转式蒸发器,上海安亭有限公司; HY-4调速多用振荡器,江苏金坛市国胜实验仪器器; JYL-C93T 榨汁搅拌机,九阳股份有限公司。 狗头枣、滩枣、金丝小枣,均购置于超市;水杨酸(≥99%)4-羟基苯甲酸(≥99%)、香草酸(≥97%)、2,5-二羟基苯甲酸(≥98%)、原儿茶酸(≥97%)、对香豆酸(≥97%)、BSTFA( 含1%的 TMCS),美国 Sig-ma 公司;甲醇(色谱纯),上海科密欧公司;乙酸乙酯(分析纯),上海科密欧公司。 1.2 色谱条件 气相色谱条件:Rtx-5毛细管色谱柱(0.25mm×30m,0.25 p.m);分流比20:1;载气为高纯度氦气,流速为1.0 mL/min;接口温度250℃,进样口温度280℃;进样量为1 p.L。色谱柱升温程序:初始柱温为100℃,以10℃/min 升至200℃,然后再以5℃/min上升到250℃,保持5 min,总共运行时间为25 min。质谱条件:离子源EI;电离能量70eV,倍增器电压350V;离子源温度200℃;四极杆温度150℃;扫描质量范围为33~500 m/z,扫描速度0.5s/次。 1.3 混合标准溶液配制 分别称取各种酚酸标品 0.010 g,配制成0.1g/L的各标准酚酸储备液。再对各标准酚酸储备液进行不同程度的稀释,分别配制为0.5、1、5、10、20 mg/L的各标准酚酸溶液以待用。 1.4 样品制备 样品的制备参考韩国民121的方法,略有改动。将红枣清洗干净后去核,加水(1:4,g:mL)打浆,用与红枣浆等体积的乙酸乙酯萃取,再在6000 r/min 条件下离心10 min,重萃萃取4次后,合并上清液,在45℃下真空浓缩,用甲醇定容至10mL,分装至离心管中冻存以备用。 1.5 衍生化条件的优化 本实验采用 BSTFA( 含1% TMCS) 为衍生化试剂,并利用混合标准溶液对衍生化的时间及温度进行了优化。 1.6 样品的衍生化处理 取待测液1.0mL,用氮气吹干,加入0.5 mLBSTFA(含1%TMCS) 在35℃下反应30 min. 1.7 酚酸的定性与定量 将采集到的质谱图与 NIST14 标准库库及标准品中各种酚酸的保留时间对照进行定性。采用峰面积外标法,对不同浓度的标准混合溶液进行分析,以各 组分的峰面积和质量浓度进行一元线性回归,建立定量工作曲线,根据建立的标准工作曲线进行定量。 2 结果与分析 2.1 气相色谱条件的选择 2.1.1 气相色谱柱的选择 色谱柱的选择基本上要遵循“相似相溶”的基本原理,根据目标化合物的性质选择合适的色谱柱22。酚酸类化合物属于极性物质,可采用弱极性柱和极性柱,根据柱子的适用温度范围及化合物的沸点,弱极性柱 Rtx-5毛细管色谱柱较合适;由于测定的6种酚酸大部分为低挥发性高沸点化合物,但经衍生化后沸点降低,因此选择薄液膜比较合适。实验结果表明,Rtx-5 毛细管色谱柱(0.25 mm×30 m,0.25 pum)分离效果较好。 2.1.2 柱温的选择 在气相色谱中,柱温是一个很重要的操作参数,是影响目标物分离效率及分析速度的关键条件。根据化合物的沸点,刚开始升温程序为初始柱温45℃,1~6.5 min 以 10 ℃ /min 上升到100℃,6.5~26.5min 以7.5℃/min 上升至250℃,再以20℃ /min 升至300℃,保持1 min,总共运行30 min。此时容易受到衍生化试剂峰的影响,2,5-二羟基苯甲酸与香草酸没有彻底分离,且因为温度过高而导致基线漂移。当把升温程序改为以10℃ /min 升至200℃,然后再以5℃/min上升到250℃,保留5 min,总共运行时间为25 min 后,不仅衍生化试剂峰影影响降低,且基线平稳,2,5-二羟基苯甲酸也与香草酸分离,还缩短了检测时间。 2.2 衍生化条件的优化 2.2.1 衍生化试剂的选择 酚酸类化合物属于极性化合物,未经衍生化处理直接进样进行 GC-MS分析,色谱峰较少,得不到多酚类物质的谱峰231。栾天罡等124.利用 GC-MS 对葡萄酒中的多酚类化合进行检测,发现未经衍生化的样品直接进样时没有得到多酚类化合物的色谱峰。因此,要对多酚类物质进行 GC-MS 分析,获得好的出峰效果,必须首先通过衍生化处理降低样品极性。常见的衍生化法有硅烷化法、酯化法和酰化法,酚羟基的衍生化最常采用甲基硅烷化法251。为降低衍生化时间过长而带来的误差,本实验采用硅烷化能力最强的BSTFA 作为衍生化试剂。 2.2.2 反应时间对衍生化反应的影响 2018年第44卷第4期(总第364期) 食品与发酵工业 FOOD AND FERMENTATION INDUSTRIES 保持反应温度为35℃不变,在反应时间为15、30、45、60 min 时,考察衍生化反应产物随反应时间的变化情况。如图1所示,以衍生化产物的色谱峰面积对时间作图,在15~30 min 内,6种酚酸的衍生化产物的峰面积随反应时间的延长而增大。当反应时间超过30 min后,色谱峰面积均不断减小,可能是衍生化反应产物随着时间的延长而变得不稳定,容易生成衍生化副产物261。经过比较,最终选择的衍生化时间为30 min. 图1 不同反应时间的衍生化产物色谱信号 Fig.1 The chromatographic response of derivativesto different reaction time 2.2.3 反应温度对衍生化反应的影响 保持反应时间为30 min 不变的情况下,在反应温度为25、35、45、55℃时,考察衍生化反应产物随反应时间的变化情况。如图2所示,以衍生化产物的色谱峰面积对温度作图,在25~35℃内,6种酚酸衍生化产物的峰面积随反应时间的延长而增大。当温度超过35℃后,色谱峰面积均不断减小,可能是衍生化产物随着温度的升高而变得不稳定[26]。经过比较,最终选择的衍生化温度为35℃。 图2 不同反应温度的衍生化产物色谱信号 Fig. 2 The chromatographic response of derivativesto different reaction temperatures 2.3 线性关系及检出限 取1.0 mL按1.3方法配制的6种酚酸的混合标准溶液,衍生化后从低浓度到高浓度依次进样,按照 ( 2 018 V o l. 44 No. 4 (Total 3 64) ) 1.2的色谱条件进行检测,所得色谱图见图3。利用酚酸的浓度与对应的峰面积绘制标准曲线,并对所得的标准曲线进行线性回归。将混合标准溶液用甲醇逐级稀释,当色谱峰的峰高为噪音的3倍时,得出6种酚酸的检出限,实验结果见表1。 峰:1:水杨酸;2:4-羟基苯甲酸;3:香草酸; 4:2,5-二羟基苯甲酸;5:原儿茶酸;6:对香豆酸 图3 6种酚酸混合标准溶液的色谱图 Fig.3 The chromatogram of a mixture of 6 kinds ofphenolic acids 由图3可以看出,6种酚酸的分离效果较好,且保留时间比较集中,分别为8.363、9.831、11.508、11.598、12.200、13.937 min。由表1可以看出,6种酚酸的峰面积与质量浓度的相关系数都在0.994~0.999 之间,在浓度范围之内线性关系良好。此外,6种酚酸的检出限分别为2、4、3、2、1、6pg/L,说明检测的灵敏度较高。 2.4 精密度测试 以浓度为 10 mg/L 的混合标准溶液连续进样5次,根据所得峰面积计算精密度,结果见表2.6种酚酸的 RSD 分别是2.9%、3.0%、4.0%、2.3%、4.8%、3.8%,均小于5%,表明仪器精密度良好。 2.5 样品回收率 选择狗头枣为加标基质,加入混合标准溶液,按照1.4和1.5对样品进行处理及衍生化,再按照1.2的色谱条件进行检测。根据测出的标准品的量与加入标准品的量来计算回收率,所得结果见表3。由表3结果可得,6种酚酸的平均回收率分别为92.6%、98.4%、104.3、100.1%、95.4%、98.6%,证明该方法的准确性较高,可以用于检测红枣中酚酸的检测分析。 2.6 样品分析结果 将3种不同品种的的枣按照1.4和1,5进行处理及衍生化,再按照1.2的色谱条件进行检测,得到其色谱图(图4),检测结果如表4所示。由表4可以看出,除2,5-二羟基苯甲酸外,其余5种酚酸在3种 超星·期刊 表1 酚酸标准曲线 Table 1 Standard curve of phenolic acid 名称 线性方程 相关系数(R) 线性范围/(mg·L-) 检出限/(ug·L-) 水杨酸 Y=4893.156X+2 488.836 0.999 0.5~10 2 4-羟基苯甲酸 Y=7 559.18X+4 212.705 0.994 0.5~10 4 香草酸 Y=3 638.861X+2708.41 0.998 0.5~10 3 2,5-二羟基苯甲酸 Y=9 864.786X-25 228.5 0.999 5~20 2 原儿茶酸 Y=11090.72X+3 698.82 0.995 0.5~10 1 对香豆酸 Y=2 692.041X+646.1148 0.995 0.5~10 6 表2精密度实验(n=5) Table 2Results of precision experiments (n=5) 组分 峰面积 平均值 RSD/% 水杨酸 57462 62449 60476 60476 60642 60301 2.9 4-羟基苯甲酸 81159 75747 80334 79732 76717 78737.8 3 香草酸 39404 43288 41437 40770 43319 41643.6 4 2,5-二基基苯甲酸 75229 73101 70714 72285 73741 73014 2.3 原儿茶酸 116436 102581 110741 105988 107471 108 643.4 4.8 对香豆酸 27148 29700 29371 28931 27642 28558.4 3.8 表3 回收率试验 Table 3]Recovery test 组分 基质含量/ 加标量/ 加标后测得总量/(mg·L-) 平均回收率/% (mg·L-) (mg·L-) A B C 水杨酸 2.34 2.5 4.98 4.37 4.62 92.6 4-羟基苯甲酸 0.71 1.5 2.33 2.18 2.05 98.4 香草酸 2.08 2.5 4.81 4.61 4.65 104.3 2,5-二羟基苯甲酸 ND 2.5 5.08 4.87 4.61 100.1 原儿茶酸 0.52 1 1.56 1.38 1.47 95.4 对香豆酸 1.03 2 2.94 3.11 2.96 98.6 表4红枣样品中酚酸的含量 单位:mg/kg Table 4Phenolic acid content of jujube sample 样品 水杨酸 4-羟基苯甲酸 香草酸 2,5-二羟基苯甲酸 原儿茶酸 对香豆酸 狗头枣 12.24±0.72 3.21±0.32 10.53±0.10 ND 2.48±0.09 2.05±0.09 滩枣 8.42±0.28 6.31±0.41 2.40±0.27 ND 3.16±0.21 2.59±0.22 金丝小枣 10.35±0.48 2.64±0.11 3.32±0.13 ND 7.79±0.71 4.93±0.30 峰:1:水杨酸;2:4-羟基苯甲酸;3:香草酸;4:2,5-二羟基苯甲酸;5:原儿茶酸; 6:对香豆酸;A-狗头枣;B-滩枣;C-金丝小枣 图4 三种红枣样品中6种酚酸的色谱图 Fig.4 Chromatograms of six phenolic acids in three jujube samples 2018年第44卷第4期(总第364期) 食品与发酵工业 F0OD AND FERMENTATION INDUSTRIES 红枣中均被检出,检测到酚酸的总量在22.88~30.51 mg/kg之间。不同品种红枣中的酚酸含量均存在一定差异,水杨酸在每种品种的红枣中含量相对较高,占酚酸总量的35.6%~40.1%。水杨酸与香草酸是狗头枣中主要的酚酸物质,占酚酸总量的74.6%;金丝小枣水水杨酸含量最高,其次为原儿茶酸与对香豆酸,共占酚酸总量的79.5%;滩枣中水杨酸与4-羟基苯甲酸含量较高,占酚酸总量的64.4%.WANG等127在5种不同品种的红枣(哈密大枣、木枣、狗头枣、金丝小枣、滩枣)中检测出没食子酸、原儿茶酸、咖啡酸和对香豆酸。 3 结论 (1)本实验采用气相质谱联用法对红枣中的6种酚酸的检测条件进行筛选,并对衍生化的条件进行了优化,确定了最佳衍生化时间和温度为30 min 和35℃。使用Rtx-5 毛细管色谱柱(0.25mm×30 m,0.25 pm) 进行分离,升温程序为初始柱温100℃,以10℃/min 升至200℃,然后再以5℃/min 上升到250℃,保持5 min,总共运行时间为25 min。实验结果表明,该方法可以快速有效的对红枣中6种酚酸进行定性定量分析,并且该方法的线性关系良好,回收率为92.6%~104.3%,仪器精密度均小于5%,方法检出限也能够满足检测要求。 (2) 使用该方法对狗头枣、金丝小枣及滩枣中的此6种酚酸进行分析。检测结果显示在此3种品种的红枣中均检测到了水杨酸、对羟基苯甲酸、香草酸、原儿茶酸和对香豆酸,不同品种的红枣中所含酚酸的含量各不相同。其中水杨酸的含量在每种红枣中的含量均比较高,占检测到的酚酚总量的35.6%~40.1%。说明该方法适用于红枣中此6种酚酸的检测。 ( 参 考 文 献 ) ( [ 1] 闫忠心,鲁周民,刘坤,等.我国红枣资源加工利用研究现状与展望[J].西北农林科技大学学报:自然科学 版,2010,38(6):102-108. ) ( [ 2 ] 鲁周民,刘坤,闫忠心,等.枣果实营养成分及保健作 用研究进展[J].园艺学报,2010,37(12): 2 017- 2024. ) ( [ 3 ] WANG D, TI A N S, P EI L, et a l . An t ioxidant activities, total polyphenolic, flavonoids and cyclic adenosine mono-phosphate c ontents i n six cultivars of Chinese Jujube JJ. ) Journal of Bionanoscience, 2013, 7(3):317-322. ( 4] KOU X , C H EN Q, LI X , e t a l. Qu a ntitative assessment o f bioactive compounds and th e an t ioxidant ac t ivity of 1 5 ju - jube cultivar s [J]. Foo d Chemistry , 2015, 173: 1 0 37- 1044. ) ( [5] GUO S, D UAN J A , TANG Y, et al . H i gh-performance liquid chromatography-two wavelength det e ction of triterpe- noid acids f rom the fruits of Ziziphus jujuba containing vari-ous c ultivars in different regions and classification using ch- emometric a nalysis [J ] . Journal of Pharmaceutical & Bio- medical Analysis, 2009, 49(5) : 1296. ) ( 6 ZHANG X X , ZHANG S, HU A NG X Y, et al. Anti-li-poperoxidation of several organic p olyphenol a c ids in v i tro [J ] . N atural Product Research & Development, 2014, 2 6 (3):398-402. ) ( 7] KHURANA S. VENKATARAMAN K, HOLLING- SWORTH A, et al. Po l yphenols: be n efits to the c ardiovas- cular System in health and in aging [J]. Nutrients, 2013, 5(10):3779-827. ) ( [8] ZHAO H X, ZHANG H S, YANG S F. P h enolic com- pounds and i t s antioxidant activities in ethanolic e xtracts from seven c ultivars of Chinese jujube [J]. Food Science &Human Wellness, 2014,3(3-4):183-190. ) ( [9] 丁胜华,王蓉蓉,吴继红,等.枣果实中生物活性成分与生物活性的研究进展[J].现代食品科技,2016, (5):332-348. ) ( 10 WANG B N, LIU H F , ZH E NG J B, e t a l . Dis t ribution of phenolic a cids i n d ifferent t issues o f jujube a nd t h eir a ntioxidant activity [J ]. J ournal of A g ricultural & Food Chemistry, 2011, 59(4): 1 288. ) ( 11 ] GAO Q H, WU C S , Y U JG, e t al . Textural characteris-tic, antioxidant activity, sugar, o rganic acid, and phenol- i c profiles of 10 promising Jujube ( Ziziphus jujuba Mill.) Selections [ J ]. Journal o f Food Science, 2012, 77( 1 1): C1218-C1225. ) ( [12] KHURANA S, VENKATARAMAN K, HOLLING- SWORTH A, et a l. Polyphenols: be n efits t o the c ardio- vascular system i n h ealth and i n a ging [J ] . Nu t rients, 2013,5(10):3779-3827. ) ( |13 ZHAO H X, ZHANG H S, YANG S F. Phenolic com- pounds a n d it s a n tioxidant activities i n e t hanolic extractsfrom seven c ultivars of Chinese jujube [ J] . F ood Science & Human Wellness, 2014,3(3-4): 1 83-190. ) ( 14 张向前,陈宗礼,杨选文,等.陕北红枣中酚类物质的紫外光谱分析 [J ] .中国农学通报,2010,26(24): 83-88. ) ( 15 5] 侯丽娟,马艳莉,夏亚男,等. HPLC 检测葡萄酒中12 种单体酚的方法研究[J].食品工业,2016,(4):202 ) ( -206. ) ( [ 16] GATEA F, T E ODOR E D, M AT E I A O, et a l . Capillaryelectrophoresis method f or 2 0 polyphenols separation in propolis and p lant extracts [J]. Food Analytical Methods, 2015,8(5):1 1 97-1206. ) ( [ 17] HUANG Y, DU G, MA Y , et a l . Nea r -infrared d e termi-nation of polyphenols using l i near and nonlinear re g ression algorithms [J].Optik-International J o urnal for Li g ht and Electron Optics, 20 1 5,1 2 6( 1 9):2030-2034. ) ( [ 18 MILENA I ,MASA IR , M I TJA K. Simultaneous GC-MS determination of free and bound phenolic acids in s loveni-an r ed wines a nd c hemometric characterization [J]. A ctaChimica Slovenica , 2016 , 63:661-669. ) ( [ 19] CHRISTIAN H G, FERDI A D, DORIS M J , et al. GC- MS methods f o r metabolic profiling of microbial fermenta-tion products o f d ietary polyphenols i n h u man and in vitro intervention studies [J]. Journal of Chromatography B, 2008,871:212-219. ) ( 20 赵艳玲,蒋湘宁.植物叶片酚酸类物质微量提取分离 与 GC-MS 分析[J].山东林业科技,2012,42(2): 8-11. ) ( [ 21 ] 韩国民,陈锋,侯敏,等.葡萄酒中14种单体酚的高 效液相色谱测定 [J ] .食品科学,2011,32(2): 1 80- ) ( 183. ) ( 22 ] OWEN R W,HAUBNER R, HULL W E, et al. Isolation and structure elucidation of the m a jor individual po l yphe- nols in carob fibr e [J] . Food & Chemical T oxicology An I nternational Journal P ublished f o r t h e Br i tish I nd ustrial Biological Research Association , 2003 , , 41( 12) :1 727-1738. ) ( 23 3] 栾天罡,李攻科,张展霞.固相微萃取-衍生化法与气 相色谱-质谱联用分析葡萄酒中多酚类化合物[J].中 山大学学报:自然科学版,2001,40(1):54-57. ) ( 24 李雪莹,林晨,王李平,等 . 衍生化气相色谱法在食品安全检测中的应用[J] . 广州化工,2016,44(8): 21-23. ) ( 25 乔阳,杜丽平,肖冬光.不同极性色谱柱在滇红香气成分分析中的对比研究[J].茶叶科学,2016(1): 38-44. ) ( 26 洪瑾,格桑德吉,王敏,等.柱前衍生化 HPLC 法分离苏氨酸对映体[J ] .中国科技论文,2012(12): 913-916. ) ( 27 WANG B N, CAO W, GAO H, et a l . Simultaneous de- termination of si x phenolic compounds i n Jujube by L C- ECD [J ] . Chromatographi a , 2010, 71(7/8) : 703- 707. ) Simultaneous determination of 6 kinds of phenolic acids in jujube by GC-MS HAN Xue, ZHANG Fu-xin, SHAO Yu-yu, PENG Hai-xia, WANG Bi-ni (College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710119, China) ABSTRACT(GC-MS was used to simultaneously determine six kinds of phenolic acids in jujube including salicylicacid, 4-hydroxybenzoic acid, vanillic acid, 2,5-dihydroxybenzoic acid, protocatechuic acid and p-coumaric acid.Meanwhile, the column, temperature programmed and derivatized condition were optimized. Finally, the Rtx-5 capil-lary column (0.25 mm×30 m,0.25 um) was chosen. The temperature program was initially at 100 ℃, then raisedto 200 ℃ at a rate of 10 ℃ /min and then increased at 5 ℃ /min up to 250 ℃ and held for 5 min. The total runningtime was 25 min. The samples were derivatized by BSTFA( containing 1% TMCS) at 35 ℃ for 30min. Six kinds ofphenolic acids were completely separated under this optimum condition. The phenolic acid content and the peak areashowed a good linear relationship(r≥ 92.6). The detection limits were 1-6 ug/L, the recoveries were 92.6%-104.3%, and the relative standard deviation were less than 5%. This method has been applied for the simultaneousdetermination of six kinds of phenolic acids in jujube. The study provides a reference to determine these six kinds ofphenolic acids in other products as well. Key wordsjujube; phenolic acid; gas chromatography-mass spectrometry 2018年第44卷第4期(总第364期) Vol.No. ( Total 网址:: www. yuweichina. com 邮箱:watercom 址:: www.yuweichina.com 邮箱:watercom 气相色谱- 质谱联用法同时测定红枣中六种酚酸用气相色谱-质谱联用(GC-MS)分析方法同时测定红枣中6种酚酸(水杨酸、4-羟基苯甲酸、香草酸、2,5-二羟基苯甲酸、原儿茶酸和对香豆酸)。并对色谱柱、升温程序及衍生化条件进行了优化。最终使用的色谱柱为Rtx-5毛细管色谱柱(0.25 mm×30 m,0.25μm);升温程序为初始柱温100℃,以10℃/min升至200℃,然后再以5℃/min上升到250℃,保持5 min,总共运行时间为25 min;选择(双三甲基硅烷基)三氟乙酰胺(BSTFA,含1%的三甲基氯硅烷)为衍生化试剂,样品衍生化的温度为35℃,时间30 min。在此最优分析条件下,6种酚酸得到良好的分离,各酚酸含量与峰面积之间呈现良好的线性关系(r2≥92.6),方法的检出限为1~6μg/L,回收率为92.6%~104.3%,且相对标准偏差均小于5%。该方法可成功用于3种红枣样品中的此6种酚酸的测定,也为其他食品中这6种酚酸的测定提供新的检测方法。
确定





还剩4页未读,是否继续阅读?
北京豫维科技有限公司为您提供《红枣中酚酸检测方案(毛细管柱)》,该方案主要用于蜜饯中营养成分检测,参考标准--,《红枣中酚酸检测方案(毛细管柱)》用到的仪器有
该厂商其他方案
更多








