摘要
差示扫描量热仪(DSC)测量的是样品与参比之间的热流速率与时间或温度的关系。随着计算机的不断升级、软件的不断优化,对反应体系进行快速可靠的动力学计算已经成为可能。动力学计算是预测反应体系的基础,甚至是复杂温度复杂时间的反应,这包括部分扩散控制的反应体系,对于动态和等温反应而言 DSC 都可以实现。对于研究者来说,表观动力学模型对于常规的预测是一种十分简单、快速灵活、很有价值的方法。本文将以环氧树脂固化的三个实验进行阐述。
方案详情

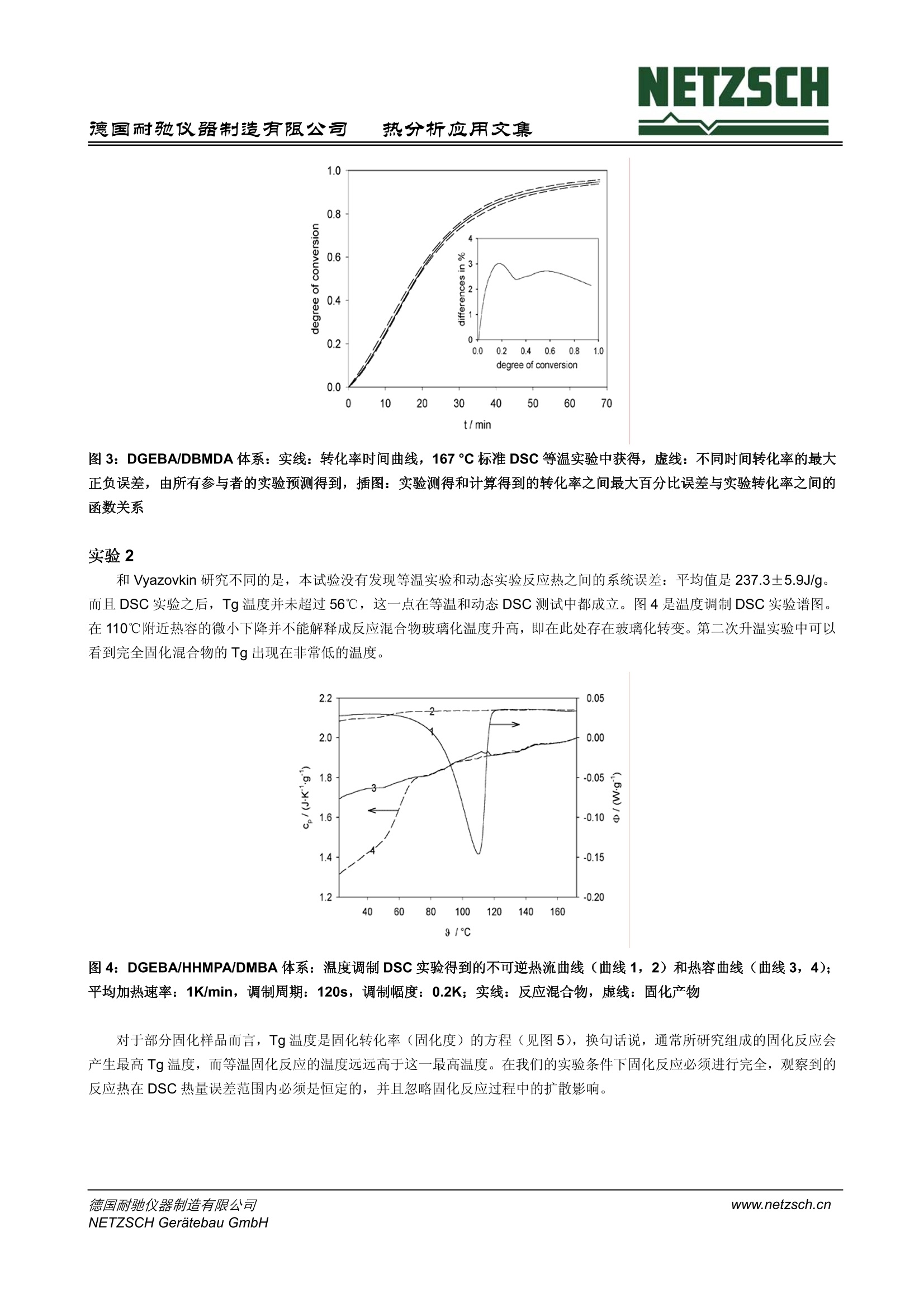
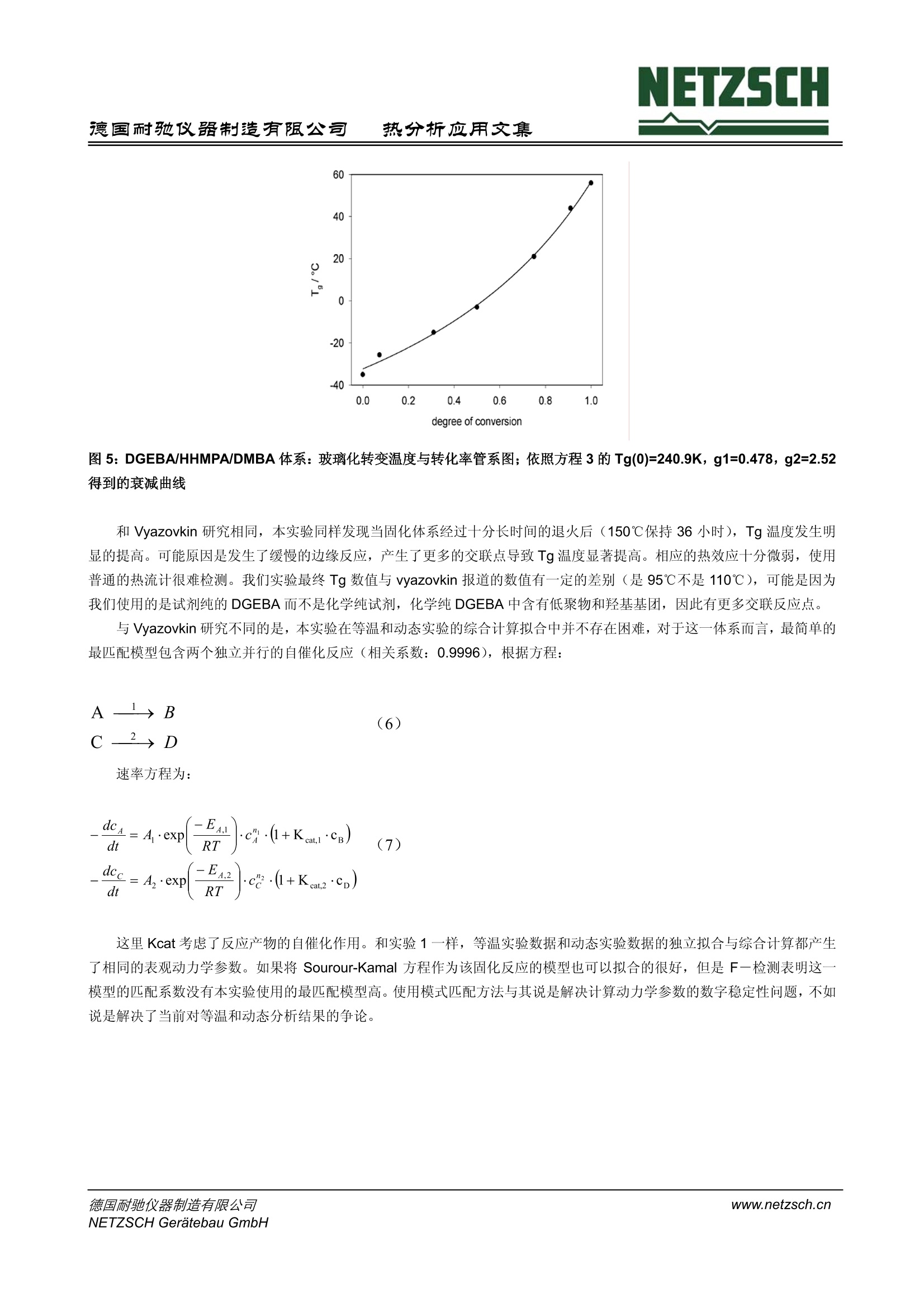
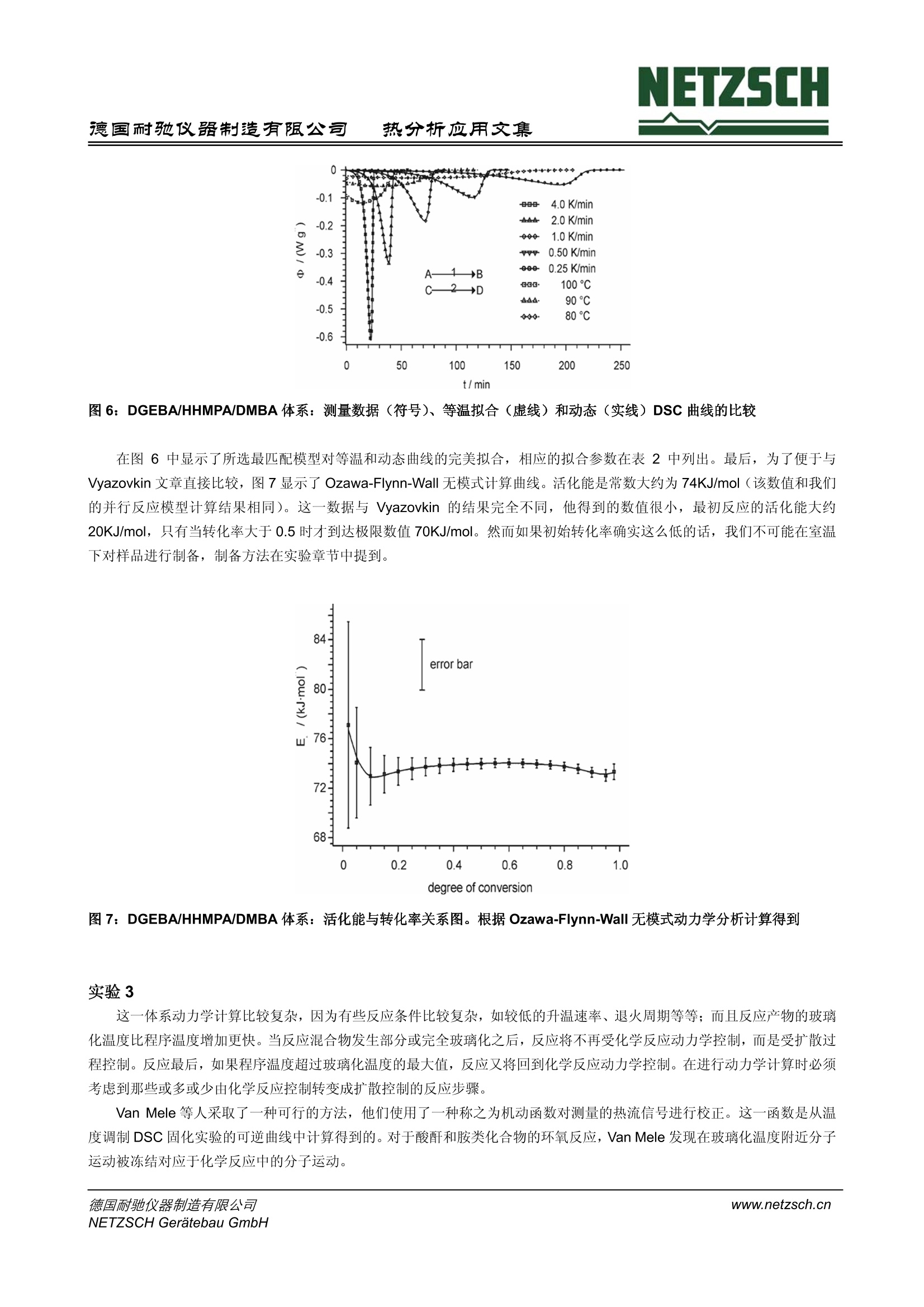
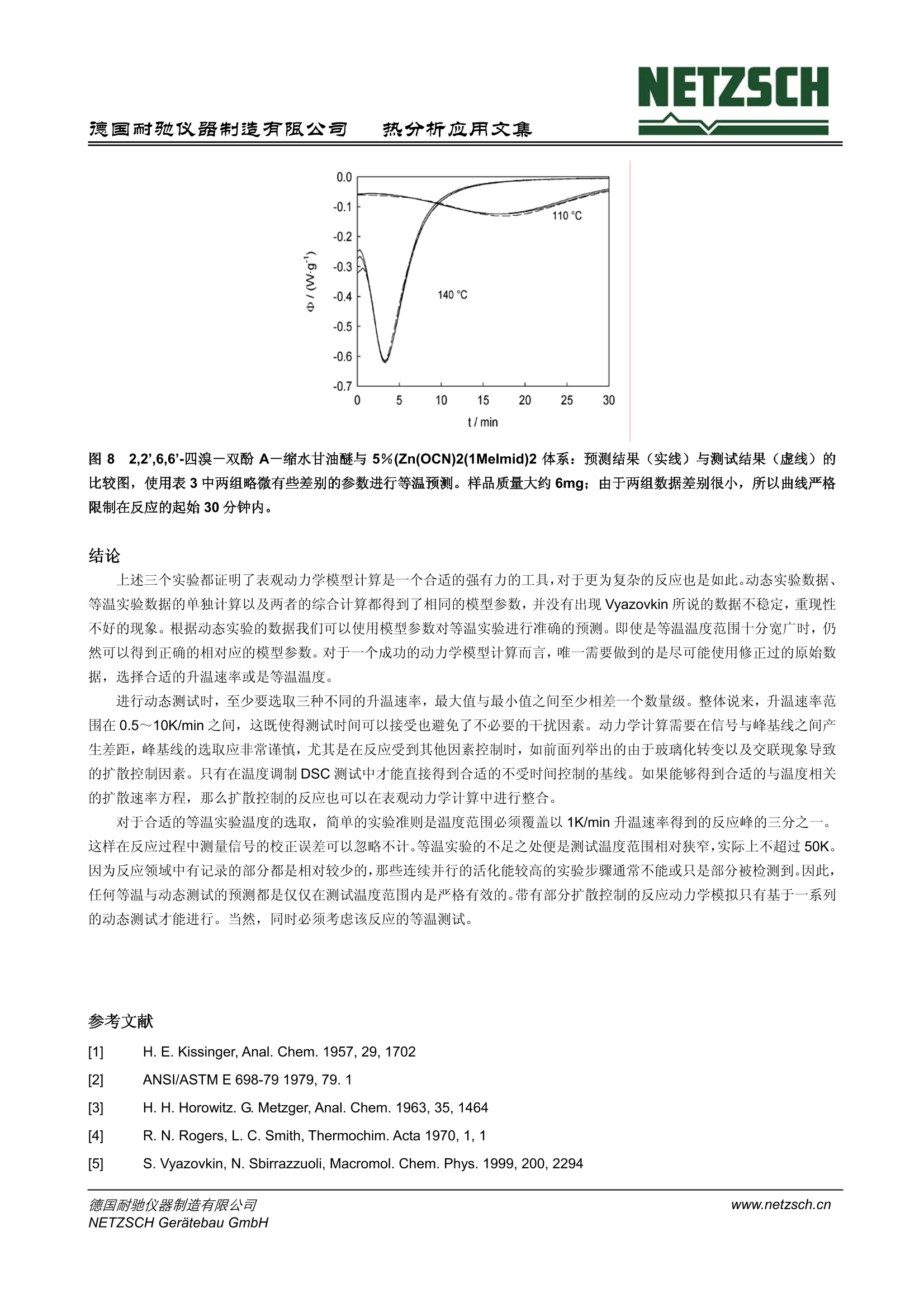
NETZSCH德国耐驰仪器制造有限公司热分析应用文集 NETZSCH热分析应用文集德国耐驰仪器制造有限公司 聚合物反应的 DSC 表观动力学研究 H. J. Flammersheim, University of Jena, Chemical Department, Jena/Germany J. R.Opfermann,NETZSCH-Geratebau GmbH, Selb/Germany 编译:张红曾智强 耐驰仪器(上海)有限公司 摘 要 差示扫描量热仪 (DSC)测量的是样品与参比之间的热流速率与时间或温度的关系。随着计算机的不断升级、软件的不断优化,对反应体系进行快速可靠的动力学计算已经成为可能。动力学计算是预测反应体系的基础,甚至是复杂温度复杂时间的反应,这包括部分扩散控制的反应体系,对于动态和等温反应而言 DSC 都可以实现。对于研究者来说,表观动力学模型对于常规的预测是一种十分简单、快速灵活、很有价值的方法。本文将以环氧树脂固化的三个实验进行阐述。 关键词 DSC,动力学,树脂固化 前 言 目前。反应体系的动力学研究是 DSC 方法的常规研究应用之一。计算机性能的不断优化使得动力学软件的使用成为可能,这一软件可以充分利用整个测试过程的信息进行计算。对于仅仅适用于计算活化能的单点分析法和宽转化率的计算(Vyazovkin 曾经写过一篇简讯,关于环氧树脂固化反应计算[5])由于自身的不完善已经不再为研究者所用。而现在常用的表观动力学计算则是通过一些形式参数对整个反应进行描述,从而省去了对反应机理做相当费时的解释。研究开始之前要对下面三个方面进行说明: 1.整个反应可以用总的反应速率方程进行表征,它源自一个十分简化的反应机理。典型的例子是经常被聚合物化学文献采用的 Sourour-Kamal 方程。 Smith 推导出当n=2, m=1时,方程可以适合描述稀溶液体系的环氧树脂安胺类加聚反应,对于非溶液体系的反应,这一方程只适用于转化率小于0.5的较低转化率反应。当n跟m被视为取值自由、温度依依的参数时,这一方程非常适合较高转化率、转化率曲线形状S型的不同反应。同样 Sestak-Berggren 方程也适用。 dt 2.当所研究的反应采用不同升温速率或不同温度的测量模式时,由Friedman创建的微分等转化率法和由Ozawa,Flynn和 Wall 创建的积分等转化率法为代表的无模式分析方法可以计算不受转化率控制的活化能。Vyazovkin 积分等转化率法假设-个多步反应是由多个独立反应加和而成,它对反应行为的解释同样可以对等温条件下反应行为进行预测。 3. 目前人们倾向于使用表观动力学模型进行计算,因为它对反应曲线的拟合更加灵活、简便和快速。这一方法可以对任何复杂多样的化学反应机理提供合理的解释,简单的一步反应更不用说了。偶氮氮的同分异构体实验就是一个研究十分成 功的例子。 NETZSCH 热分析动力学软件便是通过表观多步反应步骤对整个反应过程进行描述,这些反应步骤的活化参数是恒定的。简单反应是指已知速率方程的均相或非均相反应,包括独立反应、平行反应、对峙反应和连续反应。使用统计学检验模型,也可对实验进行描述。运用简单反应对实验的解释以及参数选择都需要谨慎行事。通常,表观动力学模型拟合的反应步骤并不是真实的基元反应,其目的也不是找到真实的模型而是找到一个模型尽可能真实的描述这一实验现象,并且可以对其他复杂条件下的反应行为进行预测。 目前 NETZSCH 热分析动力学模型可适用于等温和动态反应。将数据载入到分析窗口,在对其进行动力学计算之前,每条曲线都应进行温度校正和平滑处理。该软件提供 Ozawa-Flynn-Wall 和 Friedman 的无模式计算法,对于已选反应模型的活化参数的计算而言,这一无模式方法的计算结果是十分有用的初始数值。 Vyazovkin 和 Lesnikovich 强调了模式匹配计算模型的他足之处,他们认为计算所得到的有效匹配模型局限性很大,即最佳的模型并不一定是最真实的模型。尤其是在假设使用一步反应机理去描述多步反应时或是把最佳模型当作是真实模型时,模式匹配模型必须进行修正。而且, Vyazovkin等人认为: 模式匹配模型通常不能可靠的描述多步反应的动力学机理。 模式匹配模型一个主要问题是计算得到的数据稳定性重现性不好,尤其是在计算动态反应时。 拟合环氧树脂固化曲线时,该模型可以从等温固化数据中得到活化能数据,但不能从动态固化数据中得到活化能数据,而实际上这两者的数据是应该一致的。 最近Theriault 等人出版的文章中也有相似的报道:动态 DSC 测试的数据进行拟合不能用于描述受时间控制的交联反应动力学,只能使用等温 DSC 测试进行拟合。 本文研究下面三个实验,其中一个实验是 Vyazovkin 等人早已研究过的,这三个实验结果将明显的表明上述的观点不再成立。 实验过程 实验1 双酚A-缩水甘油醚 (DGEBA, Epilox 514Q, Leuna-Werke,经蒸馏重结晶纯化)与N,N'-二苯甲基-4,4'-二氨基-二苯基甲烷(DBMDA, 自制)以 1:1的比例进行无溶剂线性聚合反应。德国热分析协会聚合物工作组对此做了一系列的研究,该反应机理的基本步骤是已知的。产物高分子(Mn>10000)的玻璃化转变温度为 Tg=(88±3)C。 Tg温度随着反应的进程不断升高,在等温和动态实验中 Tg 总是明显的低于程序温度,这就避免部分扩散控制的反应导致整个反应复杂化。由于反应物与产物的热容不同,所以多数简单结构的峰基线可以看作是反应起点和终点的线性连接。 将固体成分彻底混合得到微观非均相反应混合物,在环氧化物熔点温度以下这一体系是非常稳定的。 我们对此混合物进行如下两个系列实验: 使用至少三个不同升温速率进行动态测试。典型速率为 0.5 K/min、1 K/min 和 5K/min。等温实验分别在400、430,460K 进行。 在实验开始之前已经进行了温度校正、热焓校正、热流速率校正以及零点校正。 实验2 混合 DGEBA 和六氢化-4-甲基邻苯二甲酸酐(简写HHMPA, Aldrich,纯度97%,顺、反异构体混合物)进行固化研究,引发剂为N,N-二甲基甲酰胺(简写 DMBA, Aldrich,纯度99%)。它们的混合配比为100:48:1,完全按照 Vyazovkin 和Sbirrazzuoli 研究采用的配比。混合物中易挥发的样品被放置在密闭容器中,并保存在液氮中,直到测量时才取出。实验中,动态实验采用0.25、0.5、1.0、2.0和 4.0K/min 五个不同升温速率,等温实验在分别80℃、90℃和100℃进行。其它实验采用温度调制模式,平均加热速率为0.5-2K/min, 调制幅度为0.2-0.5K, 调制周期为120 s。 另外, Tg 温度永远低于反应温度,以便形成与实验1相同的简单结构基线。 实验3 将商用环氧树脂(2,2',6,6'-四溴一双酚A-缩水甘油醚, RUETAPOX VE 3579, 玻璃无定形态, Tg=25℃)和5%自制的晶体粉末促进剂(Zn(OCN)2(1Melmid)2 进行混合,释放出1一甲基醚唑,并在熔点以上约70°℃开始固化反应。这一固体反应混合物可以在25℃以下无限期放置。使用铝箔标准容器进行样品制备。 测试采用 TMDSC 方式,平均加热速率为0.1、0.25、0.5、0.75、1.0、1.5、2.0、3.5和5.0 K/min), 周期均为100s,调制幅度根据加热速率可作±0.15~±1.0K调整。随着反应进程的加深,反应混合物会部分或全部发生玻璃化,其玻璃化程度与升温速率有关。因此,其峰基线的形状会比其它实验更为复杂。在图1中我们可以清晰的看出:最初的环氧树脂在25℃发生析晶,在体系 Tg, max (163C)之前产生了与加热速率相关的玻璃化转变(同时 cp减小)和二次结晶(同时cp增大)。反应产物第二次升温曲线(曲线4)说明在 Tg, max 附近仅出现一个 cp台阶。使用 TMDSC可以从总热流曲线的可逆成分中快速获得真实的反应峰基线。 图1:2,2',6,6'-四溴一双酚A-缩水甘油醚和5%的 (Zn(OCN)2(1Melmid)2体系的热容函数, 由 MDSC 测量的可逆曲线中获得。曲线1,2,3:第一次升温,速率为0.1,0.5和 2.0 K/min;曲线4:反应产物的平均热容。第二次升温实验得到 此外,对部分扩散控制体系的动力学计算需用到方程 Tg= f(a.), 具体的实验数据在其它文献中有详细的阐述。关于 Tg(a)的衰减方程,动力学软件中采用了 Hesekamp 的方程: 实验结果与讨论 实验1 11个来自不同工业、大学和生产公司的实验室参与了研究,他们的实验数据,尽管管独立分散的数据,但都得出相同的明确的结论:最匹配模型的表观动力学参数是可靠的。所有参与者的数据都是根据一系列实验结果独立计算的。完美匹配的简单表观动力学模型对应于一个包含两个竞争反应的过程。 (4) 其速率方程为: 其中e和p代表反应物和产物的含量,A和EA 代表 Arrhenius 参数, n, m 代表表观反应级数。 在动力学计算中,如果需对第-一步并存反应的表观反应级数进行优化,那么这个值总是非常接近2。因此,在后续的计算中,这个参数保持为常数2。第二步反应是自催化反应,它的表观反应级数n 和m 被假设为自由优化参数。这个模型与Sourour-Kamal 方程非常接近。n和m的最佳值总是大约为1.5和1。因此,如果表观反应级数保持这些常数恒定,即使是对活化参数进行不适当地改变,这个模型同样也会十分吻合。详细的阐述发表在文献[23]。对动态和等温实验数据进行单独计算或综合计算都会得到几乎相同的表观动力学参数。图2清楚的显示了所选模型与实验曲线高度匹配。其他10位参与者也得出同样类似的结论。 图2: DGEBA/DBMDA体系:实验数据(符号)与拟合模型(线)的 DSC 曲线比较,实验数据来自其中一位参与者的测试结果;实线:动态实验,虚线:等温实验 图3给出了反映拟合质量的令人信服的论据。在主图中,实线是从167℃标准 DSC 等温实验中获得的转化率随时间变化曲线。使用11位参与者的动态实验数据,同样可以计算得到相同温度下的转化率时间曲线。图中的虚线表示实验曲线和所有计算得到的等温曲线之间最大的正负误差,这说明所有计算曲线之间的误差都很小并且与实验曲线吻合的非常好。图3中的插图同样阐明这一点,对于所有参与者来说,插图建立了实验测得和计算得到的转化率之间最大百分比误差与实验转化率之间的函数关系。因此先前关于使用模式匹配模型不好的说法以及它无法从动态实验中预测等温实验的论断并不成立。 热分析应用文集 图3: DGEBA/DBMDA体系:实线:转化率时间曲线,167℃标准DSC等温实验中获得,虚线:不同时间转化率的最大正负误差,由所有参与者的实验预测得到,插图:实验测得和计算得到的转化率之间最大百分比误差与实验转化率之间的函数关系 实验 2 和Vyazovkin 研究不同的是,本试验没有发现等温实验和动态实验反应热之间的系统误差:平均值是237.3±5.9J/g。而且 DSC 实验之后, Tg温度并未超过56℃,这一点在等温和动态 DSC 测试中都成立。图4是温度调制 DSC实验谱图。在110℃附近热容的微小下降并不能解释成反应混合物玻璃化温度升高,即在此处存在玻璃化转变。第二次升温实验中可以看到完全固化混合物的 Tg出现在非常低的温度。 9 /℃ 图4: DGEBA/HHMPA/DMBA体温:温度调制 DSC 实验得到的不可逆热流曲线(曲线1,2)和热容曲线(曲线3,4);平均加热速率: 1K/min,调制周期:120s,调制幅度: 0.2K;实线:反应混合物,虚线:固化产物 对于部分固化样品而言, Tg 温度是固化转化率(固化度)的方程(见图5),换句话说,通常所研究组成的固化反应会产生最高Tg温度,而等温固化反应的温度远远高于这一最高温度。在我们的实验条件下固化反应必须进行完全,观察到的反应热在 DSC 热量误差范围内必须是恒定的,并且忽略固化反应过程中的扩散影响。 热分析应用文集 图5: DGEBA/HHMPA/DMBA体系:玻璃化转变温度与转化率管系图;依照方程3的Tg(0)=240.9K, g1=0.478, g2=2.52得到的衰减曲线 和 Vyazovkin 研究相同,本实验同样发现当固化体系经过十分长时间的退火后(150℃保持36小时), Tg温度发生明显的提高。可能原因是发生了缓慢的边缘反应,产生了更多的交联点导致 Tg 温度显著提高。相应的热效应十分微弱,使用普通的热流计很难检测。我们实验最终Tg 数值与 vyazovkin 报道的数值有一定的差别(是95℃不是110℃),可能是因为我们使用的是试剂纯的 DGEBA 而不是化学纯试剂,化学纯 DGEBA 中含有低聚物和羟基基团,因此有更多交联反应点。 与 Vyazovkin 研究不同的是,本实验在等温和动态实验的综合计算拟合中并不存在困难,对于这一体系而言,最简单的最匹配模型包含两个独立并行的自催化反应(相关系数:0.9996),根据方程: 速率方程为 这里 Kcat 考虑了反应产物的自催化作用。和实验1一样,等温实验数据和动态实验数据的独立拟合与综合计算都产生了相同的表观动力学参数。如果将 Sourour-Kamal 方程作为该固化反应的模型也可以拟合的很好,但是F一检测表明这一模型的匹配系数没有本实验使用的最匹配模型高。使用模式匹配方法与其说是解决计算动力学参数的数字稳定性问题,不如说是解决了当前对等温和动态分析结果的争论。 图6: DGEBA/HHMPA/DMBA体系:测量数据(符号)、等温拟合(虚线)和动态(实线) DSC 曲线的比较 在图6中显示了所选最匹配模型对等温和动态曲线的完美拟合,相应的拟合参数在表2中列出。最后,为了便于与Vyazovkin 文章直接比较,图7显示了 Ozawa-Flynn-Wall 无模式计算曲线。活化能是常数大约为74KJ/mol(该数值和我们的并行反应模型计算结果相同)。这一数据与 Vyazovkin 的结果完全不同,他得到的数值很小,最初反应的活化能大约20KJ/mol,只有当转化率大于0.5时才到达极限数值 70KJ/mol。然而如果初始转化率确实这么低的话,我们不可能在室温下对样品进行制备,制备方法在实验章节中提到。 图7: DGEBA/HHMPA/DMBA体系:活化能与转化率关系图。根据 Ozawa-Flynn-Wall 无模式动力学分析计算得到 实验 3 这一体系动力学计算比较复杂,因为有些反应条件比较复杂,如较低的升温速率、退火周期等等;而且反应产物的玻璃化温度比程序温度增加更快。当反应混合物发生部分或完全玻璃化之后,反应将不再受化学反应动力学控制,而是受扩散过程控制。反应最后,如果程序温度超过玻璃化温度的最大值,反应又将回到化学反应动力学控制。在进行动力学计算时必须考虑到那些或多或少由化学反应控制转变成扩散控制的反应步骤。 Van Mele 等人采取了一种可行的方法,他们使用了一种称之为机动函数对测量的热流信号进行校正。这一函数是从温度调制 DSC 固化实验的可逆曲线中计算得到的。对于酸酐和胺类化合物的环氧反应, Van Mele 发现在玻璃化温度附近分子运动被冻结对应于化学反应中的分子运动。 Rabinwitch 方程最适合来描述这一过程: 通常, Arrhenius 方程来描述 Kchem, 它是温度的函数。而描述 Kdiff 的方程文献上有好几种,本文选择使用 Wise 近来推荐的修正 WLF方程。 运用各种形式的 WLF 方程通常都有一个限制:它们适用于温度高于 Tg的液体状态。低于 Tg 温度时,方程7提供的Kdiff,T将会显著减小。因此本文假设: ● 当T≥Tg时,使用给定的 WLF 方程 当T≤Tg 时, 使用 Arrhenius 方程 两个方程都满足 Kdiff 的边界条件,并且在 T=Tg处其一阶微分是连续的。另外,只要反应机理未知, WLF 方程中的参数C 将不作讨论。在反应物被冻结时,表观动力学计算并不能清楚地反映变化的链段长度是如何影响哪些反应步骤。可完全适合所有加热速率的最简单动力学模型(相关系数>0.9995)对应于一个包含两个连续反应的过程: 表观成分B对应的速率方程为: A组分含量下降,C组分含量上升各自对应于方程中的第一步和第二步。本文选用两组数据进行动力学分析,每组数据都有八个不同的升温速率。对于两个不同的体系,测试曲线和和合曲线的比较表明数据吻合的十分好(图2和图6)。在动力学计算中,如果要对两个连续反应的反应级数进行优化,那么数值非常接近n1=1, n2=2。因此在后续计算中两者就被定义为n=1, n2=2。第二步反应是组分C的自催化反应,只有这一步反应是受扩散控制的,因为在试验时,如果这一步不是扩散控制,将无法找到适合的模型进行拟合。同时我们发现从统计学角度出发WLF方程中的参数C2并不重要,因此将它设定为常数50K。于是, Kdiff的计算结果与Wise的结果是一致的。两组实验数据的模型参数在表3中列出。使用这些数据我们可以对这些体系的等温固化情况进行预测并且可以与实验测试曲线进行比较。最后,在较低的温度下,由于链段部分冻结,转化率在较长的周期里都低于1。实验预测了不同温度下转化率的数值(110℃,计算得0.58,实测0.57和0.61;140℃,计算得0.80,实测0.79和0.79;170℃,计算得0.94,实测0.93和0.94;) 热分析应用文集 图8 2,2',6,6'-四溴一双酚A-缩水甘油醚与 5%(Zn(OCN)2(1Melmid)2体系:预测结果(实线)与测试结果(虚线)的比较图,使用表3中两组略微有些差别的参数进行等温预测。样品质量大约6mg;由于两组数据差别很小,所以曲线严格限制在反应的起始30分钟内。 结论 上述三个实验都证明了表观动力学模模计算是一个合适的强有力的工具,对于更为复杂的反应也是如此。动态实验数据、等温实验数据的单独计算以及两者的综合计算都得到了相同的模型参数,并没有出现 Vyazovkin 所说的数据不稳定,重现性不好的现象。根据动态实验的数据我们可以使用模型参数对等温实验进行准确的预测。即使是等温温度范围十分宽广时,仍然可以得到正确的相对应的模型参数。对于一个成功的动力学模型计算而言,唯一需要做到的是尽可能使用修正过的原始数据,选择合适的升温速率或是等温温度。 进行动态测试时,至少要选取三种不同的升温速率,最大值与最小值之间至少相差一个数量级。整体说来,升温速率范围在0.5~10K/min之间,这既使得测试时间可以接受也避免了不必要的干扰因素。动力学计算需要在信号与峰基线之间产生差距,峰基线的选取应非常谨慎,尤其是在反应受到其他因素控制时,如前面列举出的由于玻璃化转变以及交联现象导致的扩散控制因素。只有在温度调制 DSC 测试中才能直接得到合适的不受时间控制的基线。如果能够得到合适的与温度相关的扩散速率方程,那么扩散控制的反应也可以在表观动力学计算中进行整合。 对于合适的等温实验温度的选取,简单的实验准则是温度范围必须覆盖以 1K/min 升温速率得到的反应峰的三分之一。这样在反应过程中测量信号的校正误差可以忽略不计。等温实验的不足之处便是测试温度范围相对狭窄,实际上不超过 50K.因为反应领域中有记录的部分都是相对较少的,那些连续并行的活化能较高的实验步骤通常不能或只是部分被检测到。因因,任何等温与动态测试的预测都是仅仅在测试温度范围内是严格有效的。带有部分扩散控制的反应动力学模拟只有基于一系列的动态测试才能进行。当然,同时必须考虑该反应的等温测试。 ( 参考文献 ) ( [1] H. E. Kissinger , Anal. Chem. 1957,29, 1 702 ) ( [21 ANSI/ASTM E 698-79 1979,79.1 ) ( H. H. Horowitz. G. Metzger, Anal. Chem. 1963,35, 1464 ) ( [4] R. N. Rogers, L. C. Smith, Thermochim. Acta1970, 1, 1 ) ( [51 S . Vyazovkin, N . Sbirrazzuoli, Macromol. Chem. Phys . 1999,200,2294 ) [6] G. Hohne, W. Hemminger and H. J. Flammersheim, Differential Scanning Calorimetry, Springer Verlag, 1996, p.139-153 71 S. Sourour, M. R. Kamal, Thermochim. Acta 1976, 14, 41 81 I.T.Smith, Polymer 1961,2, 95 [91 M. E. Ryan,A. Dutta, Polymer 1979,20,203 呵J. Sestak, G. Berggren, Thermochim. Acta 1971,3,1倒個勿倒 H. Friedman, J.Polym. Sci. Part C 1965, 6,183 T. Ozawa, Bull. Chem. Soc.Jpn. 1966, 38,1881 J.H. Flynn, L. A. Wall, Pol. Letters 1966, 4, 232 S. Vyazovkin, Int. J. Chem. Kinet. 1996, 28, 95 J. Opfermann, F. Giblin, J. Mayer, E. Kaisersberger, Amer. Lab. 1995, Feb.,1 N. Eckardt, H. J. Flammersheim, H. K. Cammenga, J. Therm. Anal. 1998, 52, 177 S. V. Vyazovkin, A. I. Lesnikovich, J. Therm. Anal.1989,35,2169 R. P. Theriault, J. Wolfrum, G. W.Ehrenstein, Kunststoffe 1999, 89, 112 J. E. Klee, R. E. Grutzner, H. H. Horhold, H. J. Flammersheim,Macromol. Chem. Phys. 1998, 199,1603 [201 H. J. Flammersheim,J. Opfermann, Thermochim. Acta 1999, 337,141 211 S. M. Sarge, W. Hemminger, E. Gmelin, G. W. H. Hohne, H. K. Cammenga, W. Eysel, Thermochim. Acta 1994,247,129 D. Hesekamp, Chem. Eng. Technol.1998,21, 2 H.J. Flammersheim, Thermochim. Acta, 2000, 361,21 G. Van Assche, A. Van Hemelrijck, H. Rahier, B. Van Mele, Thermochim. Acta 1995,268, 121 G. Van Assche, A. Van Hemelrijck, H. Rahier, B. Van Mele, Thermochim. Acta 1996, 286,209 G. Van Assche, A. Van Hemelrijck, H. Rahier, B. Van Mele, Thermochim. Acta 1997, 304/305, 317 J. Opfermann, J. Therm. Anal. Cal. 2000, 60, 641 E.Rabinowitch, Trans. Faraday Soc. 1937, 33, 1225 F. G. A. E. Huguenin, M. T. Klein, Ind. Eng. Chem. Prod. Res. Dev. 1985, 24, 166 Y. Deng, G. C. Martin, Macromolecules 1994, 27, 5141 P.J.Karkanas, J. K. Partridge, D. Atwood, Polym. Int. 1996, 41, 183 C. W.Wise, W. D. Cook, A. A. Goodwin, Polymer 1997, 38, 3251 德国耐驰仪器制造有限公司NETZSCH Geratebau GmbHwww.netzsch.cn 德国耐驰仪器制造有限公司www.netzsch.cnNETZSCH Geratebau GmbH
确定






还剩8页未读,是否继续阅读?
德国耐驰热分析为您提供《耐驰:聚合物反应的 DSC 表观动力学研究》,该方案主要用于其他中差示扫描量热仪表观动力学研究检测,参考标准--,《耐驰:聚合物反应的 DSC 表观动力学研究》用到的仪器有耐驰 DSC204F1 差示扫描量热仪
推荐专场
相关方案
更多
该厂商其他方案
更多
















