
方案详情
文
建立了悬浮液进样流动注射在线微波消解-冷蒸气原子荧光光谱法测定生物和环境样品中Hg的方法。样品分散在50%(V/V)王水中,通过磁力搅拌保证样品溶液的均一性与稳定性。方法的检出限为0.06μg/L。方法简单快速,灵敏度高,样品损失少,而且没有样品交叉污染。应用此方法测定了5种标准参考物质以及5个实际样品中的Hg含量,并与传统的高压焖罐强酸消解方法进行了比较,两种方法所得结果一致,标准参考物质的测定值与标准值很好地吻合。
方案详情

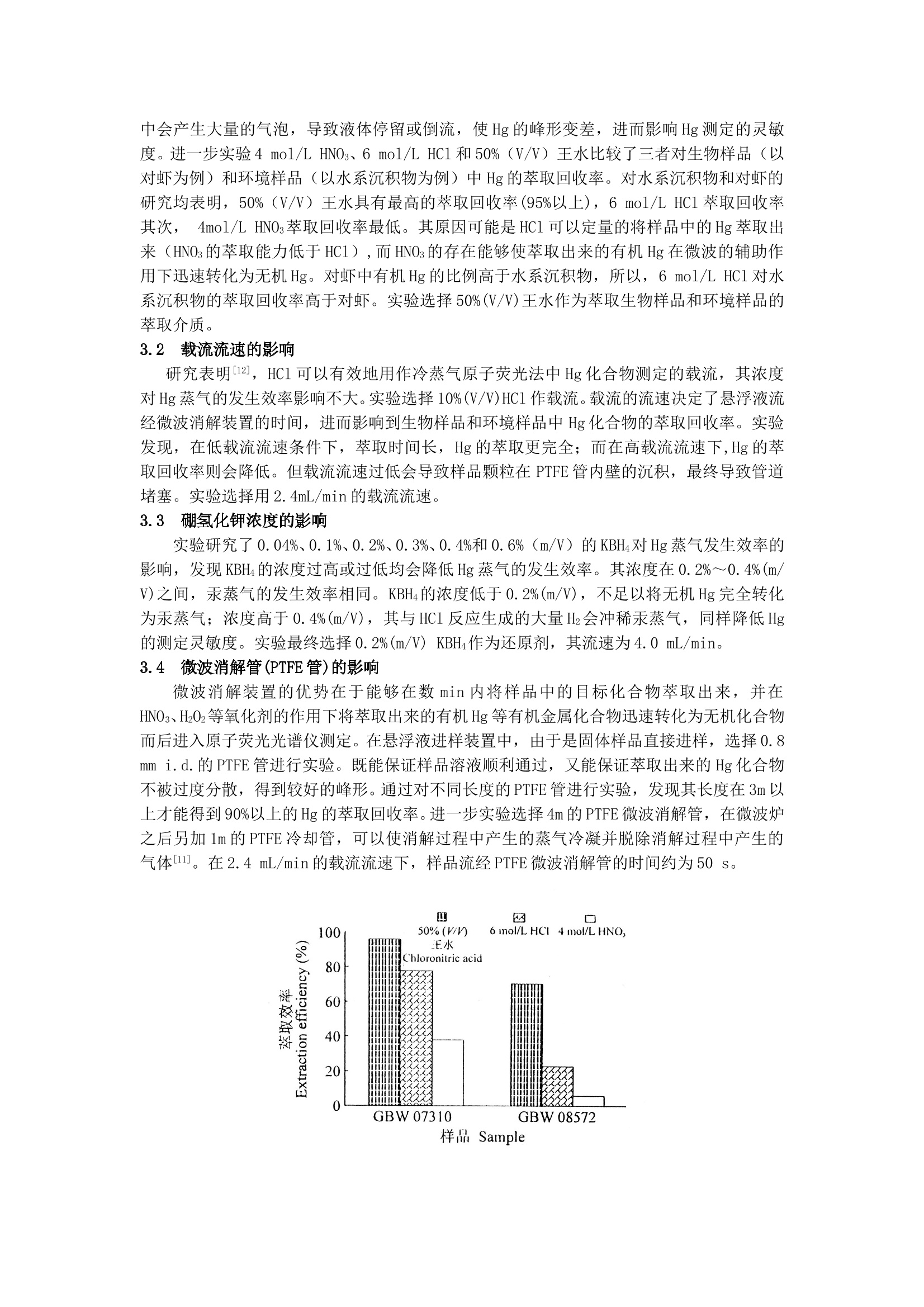
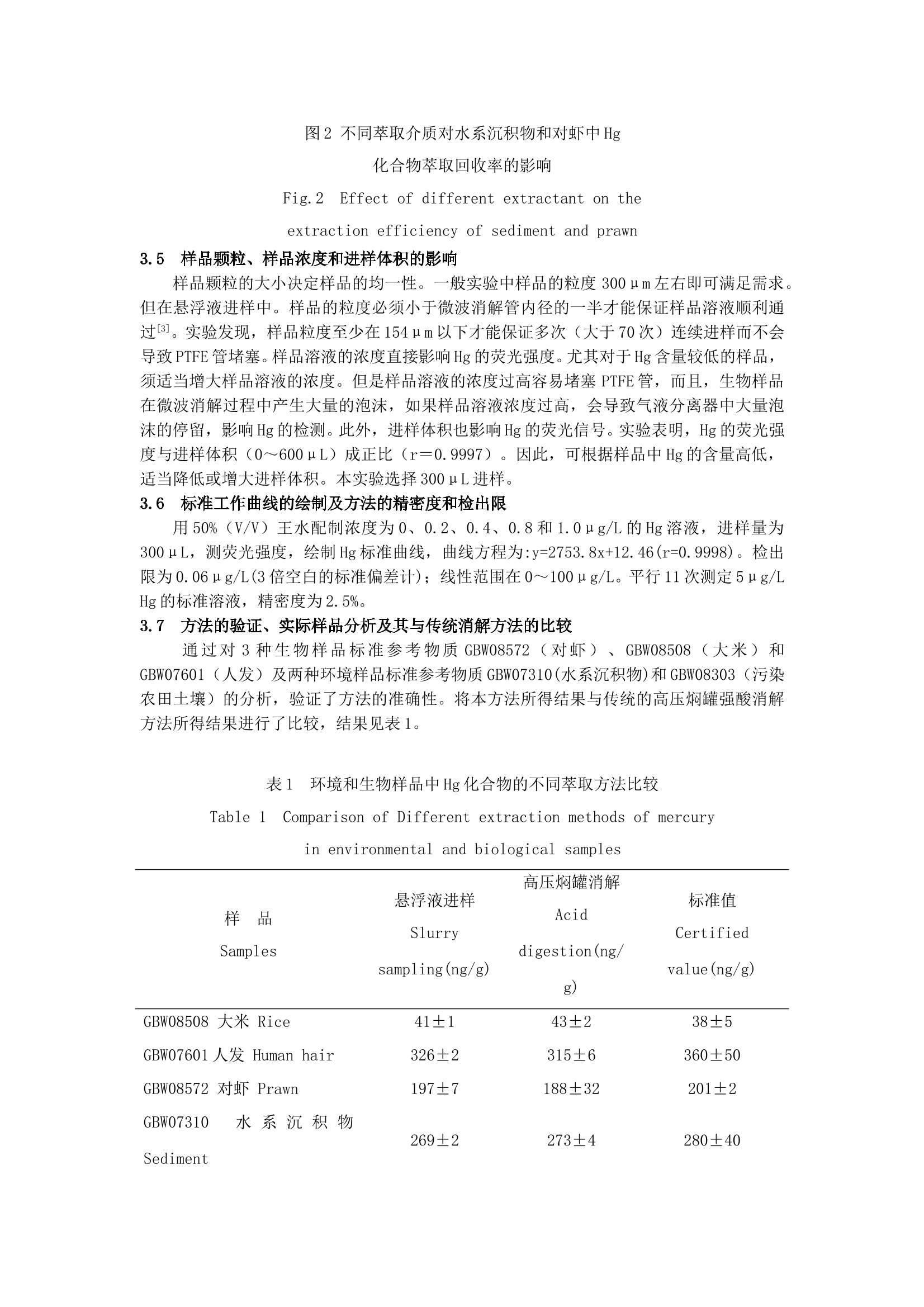
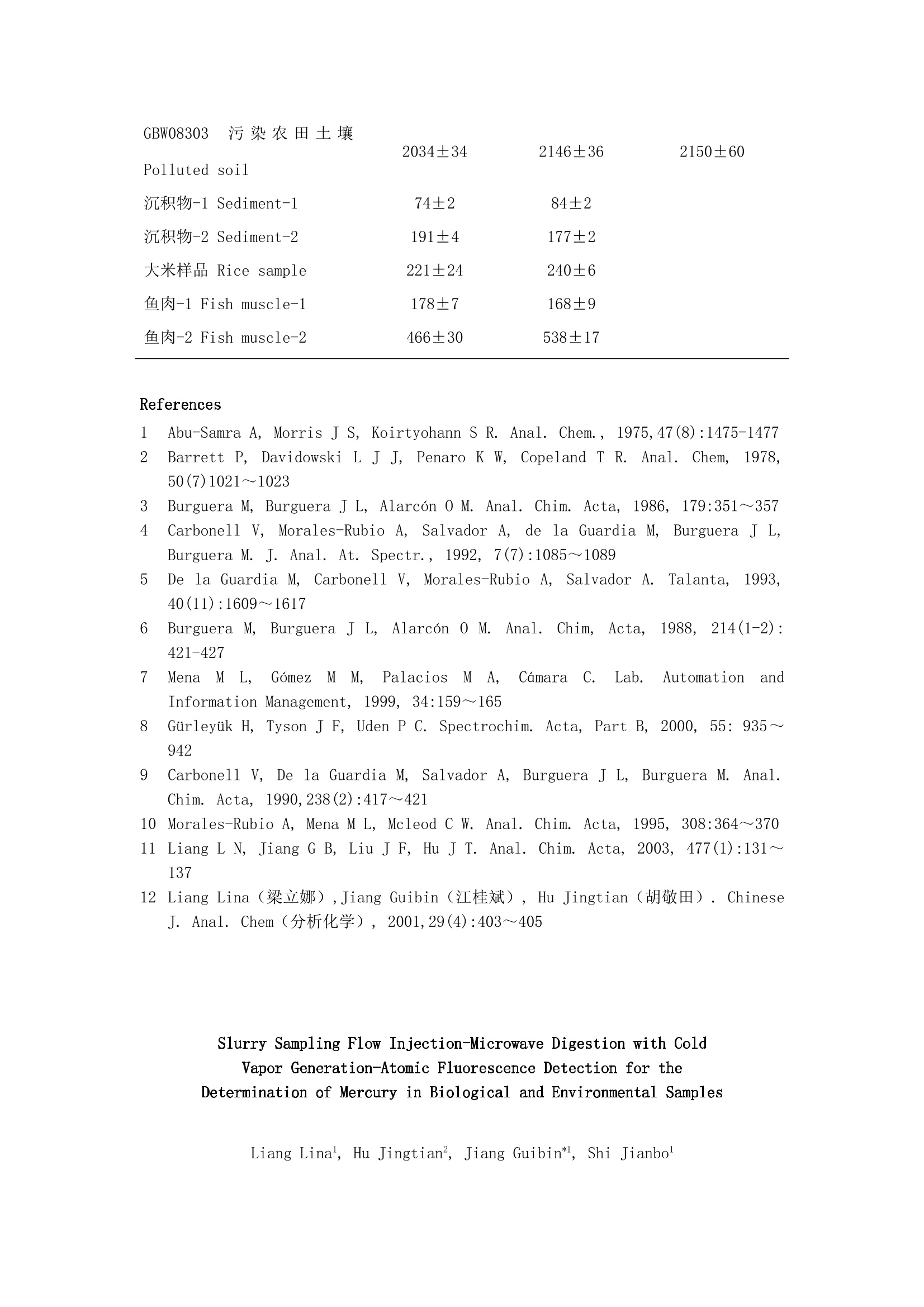
悬浮液进样流动注射在线微波消解-冷蒸气原子荧光光谱法 测定生物和环境样品中的汞 梁立娜1 胡敬田2 江桂斌*1 史建波1 1(中国科学院生态环境研究中心,北京 100085) 2(山东大学化学院,济南250100) 摘 要:建立了悬浮液进样流动注射在线微波消解-冷蒸气原子荧光光谱法测定生物和环境样品中Hg的方法。样品分散在50%(V/V)王水中,通过磁力搅拌保证样品溶液的均一性与稳定性。方法的检出限为0.06μg/L。方法简单快速,灵敏度高,样品损失少,而且没有样品交叉污染。应用此方法测定了5种标准参考物质以及5个实际样品中的Hg含量,并与传统的高压焖罐强酸消解方法进行了比较,两种方法所得结果一致,标准参考物质的测定值与标准值很好地吻合。 关键词:悬浮液进样,微波消解,汞,流动注射,原子荧光光谱法 1 引言 Hg及其化合物在工农业生产中的大量应用,造成了土壤、农作物、水体、沉积物以及食品、生物样品的Hg污染。因此,Hg化合物的灵敏测定备受关注。 1975年Abu-Samra[1]和1978年Barrett[2]首次将微波消解方法应用到生物样品前处理中,用于元素总量的测定,将样品的前处理时间由几小时缩短到几分钟,提高了样品的回收率,节省了试剂并减少了对环境造成的污染。1986年,Burguera等[3]首次将流动注射(FI)原子吸收分析(AAS)与微波消解在线联用技术引入测定生物组织中的金属元素。此后,该方法被广泛用来测定环境和生物样品中的Cu、Mn[4,5]、Zn、Cd[6]、Se[7]、As[8]、Pb[9]等元素。原子荧光光谱仪(AFS)在氢化物发生元素的测定中有广泛应用。FI-MD-AFS在线联用技术已经成功应用于环境样品中Hg[10]的测定,但在生物样品中的应用少见报道。本研究建立了悬浮液进样流动注射在线微波消解-冷蒸气原子荧光光谱法测定生物和环境样品中Hg的方法,该方法已成功地用于生物和环境样品中Hg的快速测定。 2 实验部分 2.1 仪器装置与测定条件 AF-610A原子荧光光谱仪(北京瑞利分析仪器公司);高强度Hg空心阴极灯(北京市朝阳天宫仪器厂),测定波长253.7nm,负高压280V,灯电流40mA;载气流速200mL/min。采用低温原子化方式;FIA-3100流动注射分析仪(北京万拓分析仪器有限公司),带75、150、300、450和600μL定量环。10%(V/V)HCl和0.2%(m/V)硼氢化钾通过流动注射分析仪的蠕动泵泵入,流速分别为2.4和4.0mL/min。原子荧光光度计的工作软件为本实验室研发[11]。微波消解装置是在家用Glanze微波炉的后部钻两个大小合适的孔,分别引入和导出PTFE消解管,打孔处用锡铂屏蔽微波辐射。仪器装置如图1所示。 2.2 试剂 HgCl2(MC)(Merck公司),溶于5%(V/V)HNO3中配制成1 g/L存储液,于4℃冰箱中保存。所需工作溶液依次逐级稀释,工作溶液现用现配。KBH4(河北廊坊物化探研究所,分析纯)溶于0.2%(m/V)KOH(北京化工厂,优级纯)溶液中配制成0.2%(m/V)的溶液。HNO3(Merck公司)、高氯酸和HCl(北京化工厂)均为优级纯试剂。50 mL HNO3与150 mL HCl混合,搅拌,冷却后与200mL纯水混合配制成50%(V/V)王水。所用水为Milli-Q水。 2.3 样品前处理 校准参考物质 GBW08508(大米)和GBW07601(人发)需研磨后过筛孔0.154mm筛。其它标准参考物质可直接使用。采集的大米、鱼肉和沉积物样品经低温冷冻干燥,研磨粉碎,过孔径0.154mm筛。 图1 流动注射冷蒸气原子荧光光谱仪联用装置 Fig. 1 Hyphenation equipment of flow injection-cold rapor-atomic fluorescence spectrometer (FI-CVAFS) 在悬浮液进样法中,称0.1g样品于25mL锥形瓶中,加入50%(V/V)王水,在磁力搅拌器上至少搅拌10min后进样测定。 在高压焖罐强酸消解法中,称0.1 g土壤或沉积物样品于25 mLPTFE罐中,加入1 mL HNO3放置一夜,然后加入1 mL HClO4。将PTFE罐放入高压罐拧紧,在180℃恒温消解8h,使样品中的Hg化合物全部提取出来并转化成无机Hg。高压罐自然冷却后,取出PTFE罐,将消解液转入10mL刻度管中,并用Milli-Q水定容至刻度,注意消解之后的溶液包括残渣(不溶的硅酸盐物质不影响Hg的测定)一并转入刻度管,摇匀,静置,取上层清液,进入原子荧光光谱仪测定。生物样品的处理是向PTFE罐中加HNO3 2ml,在40℃低温电热板上预消解一夜。将PTFE罐放入高压罐中消解,在50℃恒温消解1 h,升温至160℃再恒温消解4h。其它处理步骤同土壤或沉积物样品。 3 结果与讨论 3.1 萃取介质的选择 实验以不同浓度的HNO3、HCl和王水为萃取介质,应用悬浮液进样流动注射在线微波消解-冷蒸气原子荧光光谱法,研究了不同浓度的以上3种介质对生物样品(以对虾为例)和环境样品(以水系沉积物为例)中Hg的萃取回收率。实验选择2.0、4.0和8.0 mol/L HNO3;1.2、3.0、6.0和9.0 mol/L HCl;12.5%、25%、50%、75%和100%(V/V)王水分别萃取了生物样品(以对虾为例)和环境样品(以水系沉积物为例)中的Hg,结果表明,酸的浓度对不同样品基体中Hg的萃取回收率影响不大。对HCl和王水而言,随酸度的升高,Hg的萃取回收率略有增大;对HNO3而言,随HNO3浓度的升高,在微波消解聚四氟乙烯管(PTFE)中会产生大量的气泡,导致液体停留或倒流,使Hg的峰形变差,进而影响Hg测定的灵敏度。进一步实验4 mol/L HNO3、6 mol/L HCl和50%(V/V)王水比较了三者对生物样品(以对虾为例)和环境样品(以水系沉积物为例)中Hg的萃取回收率。对水系沉积物和对虾的研究均表明,50%(V/V)王水具有最高的萃取回收率(95%以上),6 mol/L HCl萃取回收率其次, 4mol/L HNO3萃取回收率最低。其原因可能是HCl可以定量的将样品中的Hg萃取出来(HNO3的萃取能力低于HCl),而HNO3的存在能够使萃取出来的有机Hg在微波的辅助作用下迅速转化为无机Hg。对虾中有机Hg的比例高于水系沉积物,所以,6 mol/L HCl对水系沉积物的萃取回收率高于对虾。实验选择50%(V/V)王水作为萃取生物样品和环境样品的萃取介质。 3.2 载流流速的影响 研究表明[12],HCl可以有效地用作冷蒸气原子荧光法中Hg化合物测定的载流,其浓度对Hg蒸气的发生效率影响不大。实验选择10%(V/V)HCl作载流。载流的流速决定了悬浮液流经微波消解装置的时间,进而影响到生物样品和环境样品中Hg化合物的萃取回收率。实验发现,在低载流流速条件下,萃取时间长,Hg的萃取更完全;而在高载流流速下,Hg的萃取回收率则会降低。但载流流速过低会导致样品颗粒在PTFE管内壁的沉积,最终导致管道堵塞。实验选择用2.4mL/min的载流流速。 3.3 硼氢化钾浓度的影响 实验研究了0.04%、0.1%、0.2%、0.3%、0.4%和0.6%(m/V)的KBH4对Hg蒸气发生效率的影响,发现KBH4的浓度过高或过低均会降低Hg蒸气的发生效率。其浓度在0.2%~0.4%(m/V)之间,汞蒸气的发生效率相同。KBH4的浓度低于0.2%(m/V),不足以将无机Hg完全转化为汞蒸气;浓度高于0.4%(m/V),其与HCl反应生成的大量H2会冲稀汞蒸气,同样降低Hg的测定灵敏度。实验最终选择0.2%(m/V) KBH4作为还原剂,其流速为4.0 mL/min。 3.4 微波消解管(PTFE管)的影响 微波消解装置的优势在于能够在数min内将样品中的目标化合物萃取出来,并在HNO3、H2O2等氧化剂的作用下将萃取出来的有机Hg等有机金属化合物迅速转化为无机化合物而后进入原子荧光光谱仪测定。在悬浮液进样装置中,由于是固体样品直接进样,选择0.8 mm i.d.的PTFE管进行实验。既能保证样品溶液顺利通过,又能保证萃取出来的Hg化合物不被过度分散,得到较好的峰形。通过对不同长度的PTFE管进行实验,发现其长度在3m以上才能得到90%以上的Hg的萃取回收率。进一步实验选择4m的PTFE微波消解管,在微波炉之后另加1m的PTFE冷却管,可以使消解过程中产生的蒸气冷凝并脱除消解过程中产生的气体[11]。在2.4 mL/min的载流流速下,样品流经PTFE微波消解管的时间约为50 s。 图2 不同萃取介质对水系沉积物和对虾中Hg 化合物萃取回收率的影响 Fig.2 Effect of different extractant on the extraction efficiency of sediment and prawn 3.5 样品颗粒、样品浓度和进样体积的影响 样品颗粒的大小决定样品的均一性。一般实验中样品的粒度300μm左右即可满足需求。但在悬浮液进样中。样品的粒度必须小于微波消解管内径的一半才能保证样品溶液顺利通过[3]。实验发现,样品粒度至少在154μm以下才能保证多次(大于70次)连续进样而不会导致PTFE管堵塞。样品溶液的浓度直接影响Hg的荧光强度。尤其对于Hg含量较低的样品,须适当增大样品溶液的浓度。但是样品溶液的浓度过高容易堵塞PTFE管,而且,生物样品在微波消解过程中产生大量的泡沫,如果样品溶液浓度过高,会导致气液分离器中大量泡沫的停留,影响Hg的检测。此外,进样体积也影响Hg的荧光信号。实验表明,Hg的荧光强度与进样体积(0~600μL)成正比(r=0.9997)。因此,可根据样品中Hg的含量高低,适当降低或增大进样体积。本实验选择300μL进样。 3.6 标准工作曲线的绘制及方法的精密度和检出限 用50%(V/V)王水配制浓度为0、0.2、0.4、0.8和1.0μg/L的Hg溶液,进样量为300μL,测荧光强度,绘制Hg标准曲线,曲线方程为:y=2753.8x+12.46(r=0.9998)。检出限为0.06μg/L(3倍空白的标准偏差计);线性范围在0~100μg/L。平行11次测定5μg/L Hg的标准溶液,精密度为2.5%。 3.7 方法的验证、实际样品分析及其与传统消解方法的比较 通过对3种生物样品标准参考物质GBW08572(对虾)、GBW08508(大米)和GBW07601(人发)及两种环境样品标准参考物质GBW07310(水系沉积物)和GBW08303(污染农田土壤)的分析,验证了方法的准确性。将本方法所得结果与传统的高压焖罐强酸消解方法所得结果进行了比较,结果见表1。 表1 环境和生物样品中Hg化合物的不同萃取方法比较 Table 1 Comparison of Different extraction methods of mercury in environmental and biological samples 样 品 Samples 悬浮液进样 Slurry sampling(ng/g) 高压焖罐消解 Acid digestion(ng/g) 标准值 Certified value(ng/g) GBW08508 大米 Rice 41±1 43±2 38±5 GBW07601人发 Human hair 326±2 315±6 360±50 GBW08572 对虾 Prawn 197±7 188±32 201±2 GBW07310 水系沉积物 Sediment 269±2 273±4 280±40 GBW08303 污染农田土壤 Polluted soil 2034±34 2146±36 2150±60 沉积物-1 Sediment-1 74±2 84±2 沉积物-2 Sediment-2 191±4 177±2 大米样品 Rice sample 221±24 240±6 鱼肉-1 Fish muscle-1 178±7 168±9 鱼肉-2 Fish muscle-2 466±30 538±17 References 1 Abu-Samra A, Morris J S, Koirtyohann S R. Anal. Chem., 1975,47(8):1475-1477 2 Barrett P, Davidowski L J J, Penaro K W, Copeland T R. Anal. Chem, 1978, 50(7)1021~1023 3 Burguera M, Burguera J L, Alarcón O M. Anal. Chim. Acta, 1986, 179:351~357 4 Carbonell V, Morales-Rubio A, Salvador A, de la Guardia M, Burguera J L, Burguera M. J. Anal. At. Spectr., 1992, 7(7):1085~1089 5 De la Guardia M, Carbonell V, Morales-Rubio A, Salvador A. Talanta, 1993, 40(11):1609~1617 6 Burguera M, Burguera J L, Alarcón O M. Anal. Chim, Acta, 1988, 214(1-2): 421-427 7 Mena M L, Gómez M M, Palacios M A, Cámara C. Lab. Automation and Information Management, 1999, 34:159~165 8 Gürleyük H, Tyson J F, Uden P C. Spectrochim. Acta, Part B, 2000, 55: 935~942 9 Carbonell V, De la Guardia M, Salvador A, Burguera J L, Burguera M. Anal. Chim. Acta, 1990,238(2):417~421 10 Morales-Rubio A, Mena M L, Mcleod C W. Anal. Chim. Acta, 1995, 308:364~370 11 Liang L N, Jiang G B, Liu J F, Hu J T. Anal. Chim. Acta, 2003, 477(1):131~137 12 Liang Lina(梁立娜),Jiang Guibin(江桂斌), Hu Jingtian(胡敬田). Chinese J. Anal. Chem(分析化学), 2001,29(4):403~405 Slurry Sampling Flow Injection-Microwave Digestion with Cold Vapor Generation-Atomic Fluorescence Detection for the Determination of Mercury in Biological and Environmental Samples Liang Lina1, Hu Jingtian2, Jiang Guibin*1, Shi Jianbo1 1(Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085) 2(Department of Chemistry, Shandong University, Jinan 250100) Abstract The method of slurry sampling flow injection-microwave digestion with cold vapor generation-atomic fluorescence detection for the determination of mercury in biological and environmental samples is proposed. Samples were dispersed in 50(V/V) aqua regia and agitated magnetically to obtain well-proportioned and stable sample solutions. The detection limit of the method was 0.06μg /L, with the advantage of simple, quick, sensitive, low losing and no cross-contamination. The slurry sampling technique was compared with the conventional high-pressure strong acids digestion method. Good consistent was got with the two methods and the obtained values were in good agreement with the certified values. Keywords Slurry sampling, microwave digestion, mercury, flow injection, atomic fluorescence detection (Received 25 August 2003; accepted 25 June 2004)
确定



还剩4页未读,是否继续阅读?
北京北分瑞利分析仪器(集团)有限责任公司为您提供《大米中汞检测方案(原子荧光光谱)》,该方案主要用于大米中重金属检测,参考标准--,《大米中汞检测方案(原子荧光光谱)》用到的仪器有AF-640A环保/节约型双道原子荧光光谱仪
推荐专场
相关方案
更多
该厂商其他方案
更多















