采用ICS-5000毛细管离子色谱仪对枸杞多糖中的10种单糖进行了分离测定。优化了前处理过程中影响多糖水解的酸种类、酸浓度、水解温度和时间等参数,优化条件为使用2mol/L三氟乙酸溶液在100℃下水解120min,在该条件下,果糖回收率约为50%,其余单糖回收率在84%~104%之间。采用新型淋洗液自动发生装置电解产生液,CapillaryCarborPac PA20色谱柱分离,毛细管安培池测,10种单糖成分标准曲线线性关系良好,相关系数均大于99.9%;检出限2.5~75!g/L之间,为枸杞多糖中单糖组分测定提供了新的可行方法。
方案详情

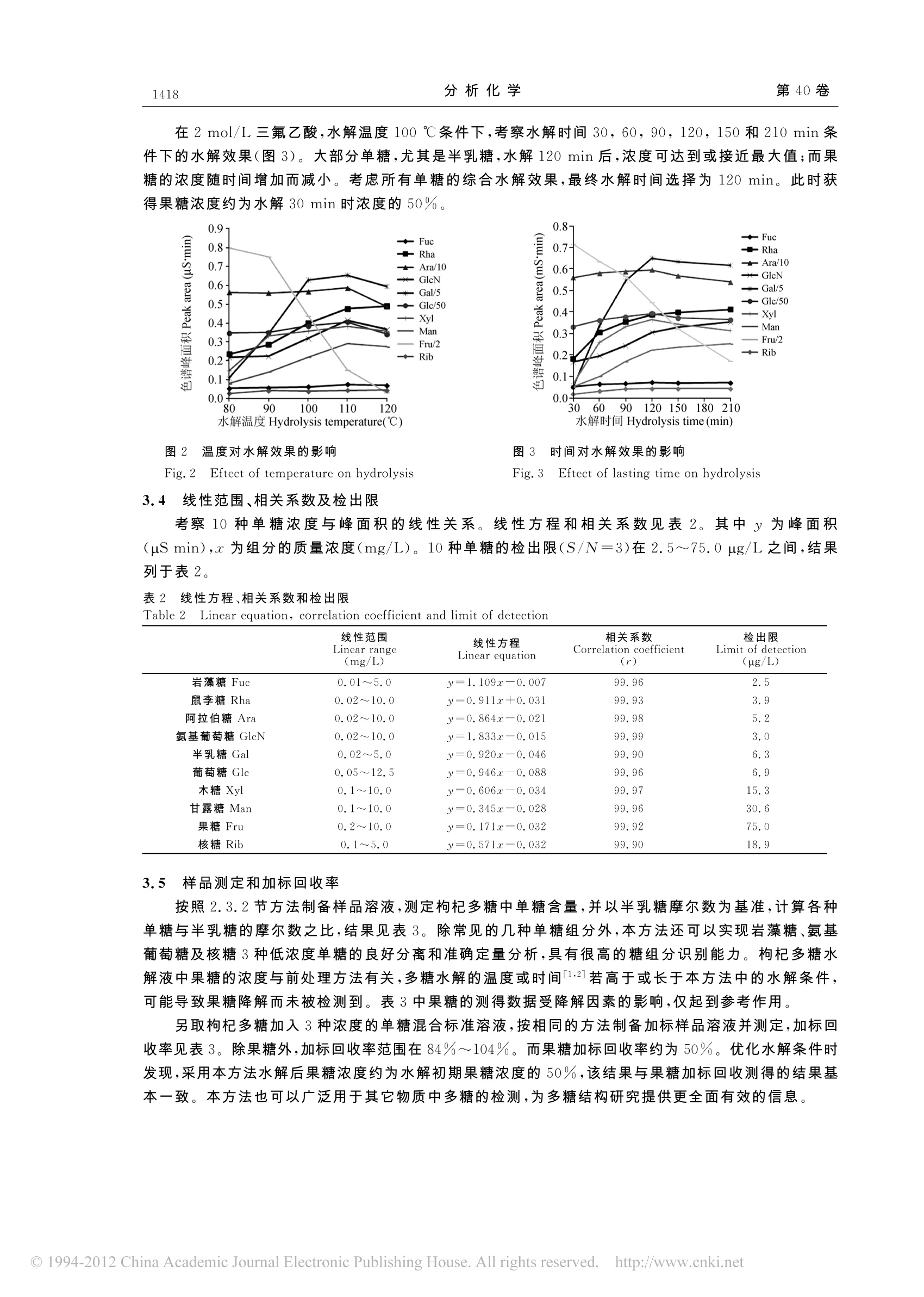
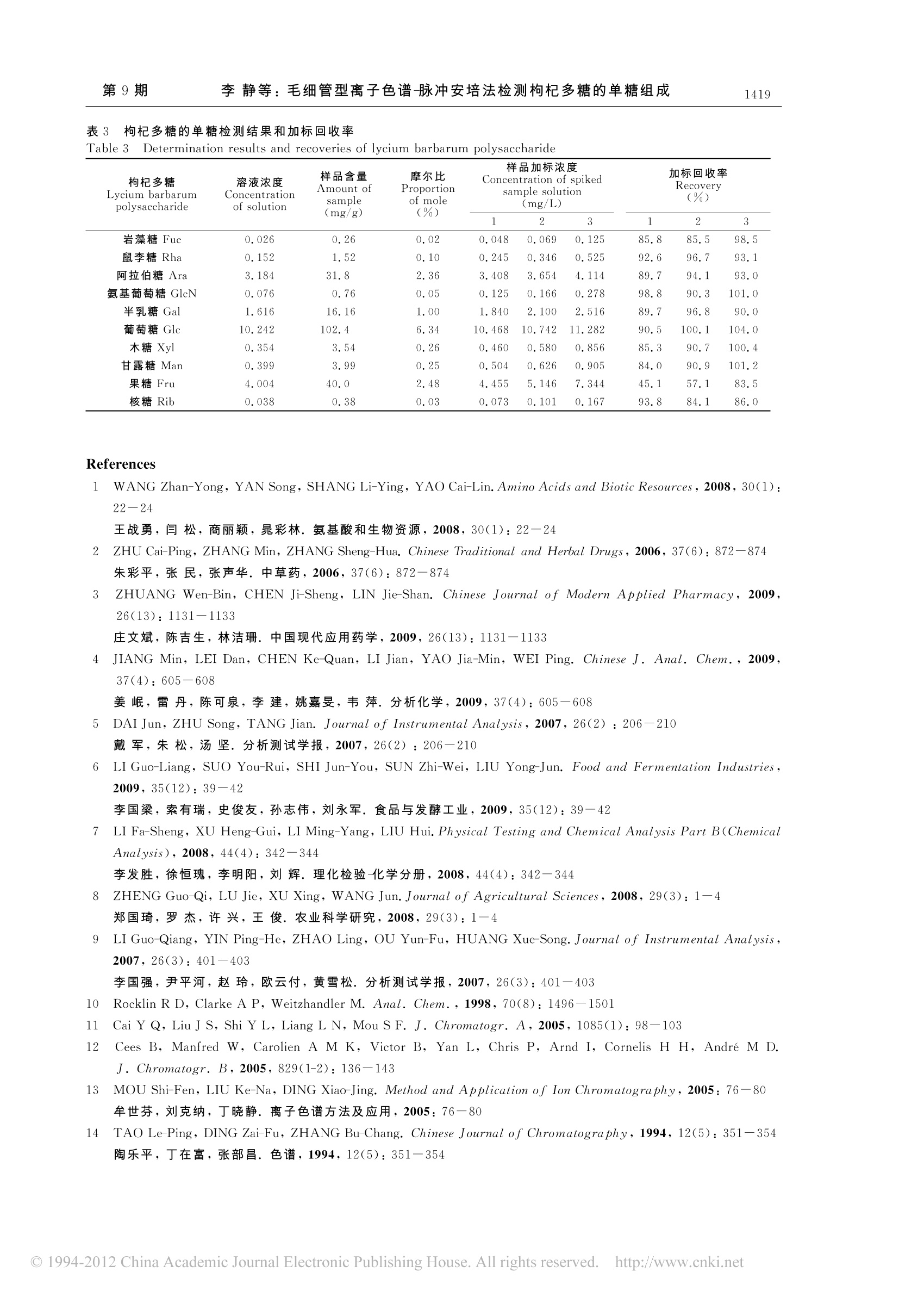
分析化学(FENXI HUAXUE) 研究报告Chinese Journal of Analytical Chemistry第40卷2012年9月第9期1415-1420 分析化学 第40卷1416 DOI: 10.3724/SP.J.1096.2012.20061 毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成 李静* 李仁勇 梁立娜(赛默飞世尔科技,北京100080) 摘 要 采用 ICS-5000 毛细管离子色谱仪对枸杞多糖中的10种单糖进行了分离测定。优化了前处理过程中影响多糖水解的酸种类、酸浓度、水解温度和时间等参数,优化条件为使用2 mol/L 三氟乙酸溶液在100℃下水解 120min,在该条件下,果糖回收率约为50%,其余单糖回收率在84%~104%之间。采用新型淋洗液自动发生装置电解产生淋洗液,Capillary CarborPac PA20 色谱柱分离,毛细管安培池检测,10种单糖成分标准曲线线性关系良好,相关系数均大于 99.9%;出限在2.5~75 pg/L之间,为枸杞多糖中单糖组分测定提供了新的可行方法。 关键词 毛细管离子色谱;脉冲安培检测;枸杞多糖;单糖 引 言 枸杞是一种传统中药材,枸杞多糖是其主要功能活性成分,具有抗癌、增强免疫力、降血糖、防衰老、抑制肿瘤生长和细胞突变等功效1~3]。准确测定枸杞多糖中单糖的组成对研究其化学结构和性质具有重要意义。 测定多糖中单糖组成方法有气相色谱法1.2]、液相色谱法_4.5]和毛细管电泳法L61等,这些方法大多需要经过复杂的衍生化处理,并且灵敏度和分离效果不理想。其中柱前衍生气相色谱法测定枸杞多糖报道较多1,2.8」,检测到的6种单糖分别为阿拉伯糖、鼠李糖、木糖、甘露糖、半乳糖和葡萄糖。o与之相比,离子色谱法则无需衍生即可分离测定样品中的糖类化合物,分离度好,检测灵敏度高19~11,可对枸杞多糖中10种单糖成分,尤其是低浓度单糖成分进行准确测定。 毛细管离子色谱分离-脉冲安培检测(Capillary IC-PAD)是离子色谱电化学检测发展的重要阶段。毛细管尺度的离子色谱系统以其高灵敏度、高效率、低消耗的特点,在单糖组分测定中展现了许多优势。本实验采用新型淋洗液自动发生装置产生淋洗液,Capillary CarborPac PA20 色谱柱分离,毛细管安培池检测,对枸杞多糖中单糖组成进行了考察。提供了毛细管离子色谱测定单糖成分的可行方案,为该方法的推广应用提供了实验基础。 2 实验部分 2.1 仪器与试剂 ICS-5000型毛细管离子色谱仪,OnGuard RP 前处理柱(美国Dionex 公司);电热恒温鼓风干燥箱(黄石市恒丰医疗器械公司);氮吹仪(天津恒奥科技发展公司);水解管(北京欣维尔玻璃仪器公司);0.22 um 尼龙滤膜。 10种单糖标准物质:岩藻糖、鼠李糖、阿拉伯糖、氨基葡萄糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖(Sigma公司);三氟乙酸(99.7%,美国J.T. Baker 公司);甲醇(色谱纯,百灵威公司);超纯水(Millipore,电阻率为18.2M cm);枸杞多糖(枸杞粉碎后经脱脂、蛋蛋白等纯化工艺制得)。 2.2 色谱条件 色谱柱:Capillary CarboPac PA20 分析柱(150mm×0.4 mm);Capillary CarboPac PA20G 保护柱(35 mm×0.4mm)。淋洗液:毛细管淋洗液自动发生装置 Capillary EGC-KOH Cartridge 产生的 KOH溶液;淋洗条件(1):0~15 min,8 mmol/L KOH;15.1~23 min,200 mmol/L KOH;23.1~28 min,8 ( 2012-01-17收稿;2012- 0 4-23接受 ) ( *E - mail : jill. li@ t he r mofisher. com ) mmol/L KOH。淋洗条件(2):0~20 min,3 mmol/L KOH;20.1~28 min, 200 mmol/LKOH;28.1~33 min,3 mmol/L KOH。淋洗液流速:8uL/min;柱温:30℃;检测方式.:脉冲安培检测,糖测定四电位波形(见表1);工作电极:金电极;参比电极:钯/氢(Pd/H)参比电极;进样量:0.4uL。 2.3 溶液配制 表1 糖测定四电位波形(Pd/H参比电极) 2.3.1 混合标准溶液的配制 糖标准品分别配制成1000 mg/L储准储备液。分别取单糖标准储备液配制混合标准溶液,混合标准溶液中岩藻糖和核糖浓度分别为5 mg/L,葡萄糖糖度 25mg/L,其余单糖浓度分别为10mg/L。上述混合标准溶液进一步稀释2,5,10,20,100,200和500倍,配制成系列混合标准溶液。 Table 1 Quadruple waveform for carbohydrate detection(Pd/H Ref. Electrode) 2.3.2 样品溶液的制备 准确称取0.5g枸杞多糖于50mL超纯水中,振荡使之充分溶解。在 时间 电位 积分 Waveform time(s) Potential(V) Integration 0.00 0.950 0.20 0.950 0.40 0.950 0.41 -1.150 0.42 -1.150 0.43 1.450 0.44 0.750 0.50 0.750 水解管中分别加入上述1mL枸杞多糖溶液 和4mol/L三氟乙酸溶液1mL,摇匀后,在100℃下恒温水解120 min,氮气吹干后加5 mL水溶解;取上述溶解液0.5 mL 稀释至10mL,稀释液分别过0.22 um尼龙滤膜和OnGuard RP前处理柱,弃去前面3mL流出液,收集后面溶液进样。 3 结果与讨论 3.1 毛细管离子色谱分离安培检测系系12 毛细管离子色谱系统的流速仅约为常规离子色谱系统的1%,淋洗液的消耗量很低,因而可以持续不停机工作,始终保持平衡稳定状态,可随时进样分析,节省以前所需的开机平衡时间,并提高了结果稳定性。对于完成一次常规分析所需的进样量也明显降低,适用于珍贵稀少样品的分析。 Capillary CarboPac PA20毛细管单糖分析柱,延续了 CarboPac 系列色谱柱快速高效,分离度好的优点。同时,可与毛细管淋洗液自动发生装置(Capillary EG)配合使用,由淋洗液发生装置产生比手工配制的淋洗液纯度更高,所得浓度也更加精确,可显著提高测试的长期稳定性。此外,高纯淋洗液使得仪器的工作状态更佳,所得基线更为平稳,基线噪音降低,分析灵敏度也相应提高。由于毛细管系统的流速很低,对淋洗试剂的消耗量很小,因此电解产生相同浓度淋洗试剂的电解所需电流会明显降低,为产生更高浓度的淋洗液提供了条件。目前可产生的淋洗液最高浓度已提高至200 mmol/L,显著提高了分析过程的使用灵活性。 为了与毛细管离子色谱的流速相匹配,对毛细管型安培池也进行了改进。池体流路的内径减小和参比池的设计改变,均可以有效降低安培池死体积。同时参比池的改进使得新型安培池可兼容pH/Ag/AgCl型复合参比电极和新型-/氢型参比电极。pH/Ag/AgCl参比电极使用的膜结构相对比较脆弱,并且参比电极电解质溶液在使用过程中会发生变化,因而参比电极的推荐使用时间约为6个月。而钯/氢型参比电极则采用固态参比电极技术,机械稳定性和化学稳定性都得了到根本性地提高,延长参比电极的使用寿命,并且其使用和保存方法都非常简便。毛细管离子色谱-安培检测系统的上述特点,使其能够在单糖组分测定中展现独特的优势。 3.2 色谱淋洗条件的优化 Capillary CarboPac PA20 毛细管色谱柱延续了 CarboPac 型色谱柱的特点,填料采用无孔基球附聚双官能季铵功能基。该色谱柱对单糖分离度高,峰型好,因而灵敏度高,分离速度快。枸杞多糖水解液中含有多种待测单糖组分,本研究采用两种色谱淋洗条件,对水解液中10种单糖进行了定性和定量分析,具体淋洗条件见2.2节。淋洗条件1用于测定岩藻糖(Fuc)、鼠李糖(Rha)、阿拉伯糖(Ara)、氨基葡萄糖(GlcN)、半乳糖(Gal)和葡萄糖(Glc)。淋洗条件2用于测定木糖(Xyl)、甘露糖(Man)、果糖 第9期 李静等:毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成(Fru)和核糖(Rib)。两种淋洗条件下样品分离色谱图见图 la和b。 图1 淋洗条件1(a)和淋洗条件2(b)样品分离色谱图 Fig.1 Chromatograms of samples using separation method1 (a) and method 2(b) Fuc: fucose; Rha: rhamnose; Ara: arabinose; GlcN: glucosamine; Gal: galactose; GLC: glucose; Xyl: xylose; Man: mannose;Fru: fructose; Rib: ribose. 使用阴离子交换色谱柱分离单糖。淋洗液中OH有两种作用,首先是作为淋洗离子,OH-浓度增大,淋洗强度增大,使单糖在色谱柱上保留减弱;同时,OH提供糖解离所需的高pH值环境,常见单糖的pK。基本在12~14之间,当糖还未完全解离为离子时,单糖的离子化程度随pH 值增加而增大,其在色谱柱上保留能力也会随之增强。单糖的保留行为是上述两种作用共同影响同结果 131. 鼠李糖和阿拉伯糖在不同浓度淋洗液中的分离情况是上述两种作用的共同体现。25℃时,阿拉伯糖的pKa=12.43,L型鼠李糖的pKa=12.04,二者差异相对较大。当淋洗液浓度低于10 mmol/L时,其pH<12,两种单糖都处于不完全电离状态。其中阿拉伯糖的电离度低于鼠李糖。两种单糖在低浓度淋洗液中保留时间基本相同,而当淋洗液浓度升高时,两种单糖的保留时间虽然都减小,但因为两糖的pK。差距较大,色谱保留时间的差别也随之逐渐增大,因此二者分离度增加。实验表明,淋洗液浓度在2~10 mmol/L范围内,鼠李糖和阿拉伯糖的分离度随淋洗液浓度升高而增大;淋洗液浓度在8mmol/L时即可实现基线分离。淋洗液浓度的增大,会影响其余单糖的分离度,因此淋洗液浓度选择8mmol/L为淋洗条件1。但此时,甘露糖和木糖分离效果较差,因两者pK。值相近。因此, OH-的淋洗强度对于分离效果的影响更占主导,淋洗液浓度越低时,单糖与离子交换基团相互作用时间长,从而获得更大分离度。实验表明,淋淋液浓度为 3 mmol/L时,可以实现木糖与甘露糖的有效分离,在实际样品中存在的其它干扰峰也能与待测单糖较好分离,选择3 mmol/L 为先洗条件2。两种淋洗条件分离完成后,均使用200 mmol/L KOH 冲洗 8 min,以保证测定结果的稳定性。 3.3 多糖水解条件优化 多糖的水解效果与所使用酸的种类和浓度、水解温度和水解时间有关。本研究分别对以上几种因素进行研究,得出了优化的枸杞多糖水解条件。 多糖水解常采用 HSO、HCl和三氟乙酸(TFA)[14]。其中,三氟乙酸具有更易挥发的特性,易通过氮吹等手段去除;并且其酸性相对较弱,水解过程中单糖降解的副反应小。因此,使用较为广泛。本实验采用三氟乙酸水解多糖后通过氮吹除酸,再以水溶解水解产物,所得溶液组成简单,容易控制稀释倍数,操作过程简单易行。 在反应温度和时间相同并适中的条件下,分别考察三氟乙酸浓度为1,2和4mol/L时的水解效果。在TFA浓度为2mol/L时,大部分单糖水解度达到最高。继续增大酸度,单糖分解,浓度降低。因此选择2 mol/L 三氟乙酸溶液进行水解。 使用2 mol/L 三氟乙酸水解,在相同水解时间下考察80,90,100,110和120℃时枸杞多糖的水解效果(图2),大部分单糖浓度随水解温度升高而增大,而果糖的浓度呈现急剧下降的趋势,说明果糖的稳定性与温度关系很大,高温会导致果糖的分解或转化。考虑到待测单糖的整体水解效果,水解温度选择为100℃。 在2 mo/L三氟乙酸,水解温度100℃条件下,考察水解时间30,60,90,120,150和210 min 条件下的水解效果(图3)。大部分单糖,尤其是半乳糖,水解120 min 后,浓度可达到或接近最大值;而果糖的浓度随时间增加而减小。考虑所有单糖的综合水解效果,最终水解时间选择为120 min。此时获得果糖浓度约为水解30 min 时浓度的50%。 图2 温度对水解效果的影响 图3 时间对水解效果的影响 Fig. 2 Eftect of temperature on hydrolysis Fig.3 Eftect of lasting time on hydrolysis 3.4 线性范围、相关系数及检出限 考察10种单糖浓度与峰面积的线性关系。线性方程和相关系数见表2。其中y为峰面积(uS min),x 为组分的质量浓度(mg/L)。10种单糖的检出限(S/N=3)在2.5~75.0 ug/L之间,结果列于表2。 表 2 线性方程、相关系数和检出限 Table 2 Linear equation, correlation coefficient and limit of detection 线性范围 线性方程 相关系数 检出限 Linear range (mg/L) Linear equation Correlation coefficient (r) Limit of detection (ug/L) 岩藻糖 Fuc 0.01~5.0 y=1.109x-0.007 99.96 2.5 鼠李糖 Rha 0.02~10.0 v=0.911x+0.031 99.93 3.9 阿拉伯糖 Ara 0.02~10.0 y=0.864x-0.021 99.98 5.2 氨基葡萄糖 GlcN 0.02~10.0 y=1.833x-0.015 99.99 3.0 半乳糖 Gal 0.02~5.0 v=0.920x-0.046 99.90 6.3 葡萄糖 Glc 0.05~12.5 y=0.946x-0.088 99.96 6.9 木糖 Xyl 0.1~10.0 y=0.606x-0.034 99.97 15.3 甘露糖 Man 0.1~10.0 y=0.345x-0.028 99.96 30.6 果糖 Fru 0.2~10.0 y=0.171x-0.032 99.92 75.0 核糖 Rib 0.1~5.0 y=0.571x-0.032 99.90 18.9 3.5 样品测定和加标回收率 按照2.3.2节方法制备样品溶液,测定枸杞多糖中单糖含量,并以半乳糖摩尔数为基准,计算各种单糖与半乳糖的摩尔数之比,结果见表3。除常见的几种单糖组分外,本方法还可以实现岩藻糖、氨基葡萄糖及核糖3种低浓度单糖的良好分离和准确定量分析,具有很高的糖组分识别能力。枸杞多糖水解液中果糖的浓度与前处理方法有关,多糖水解的温度或时间[1.21若高于或长于本方法中的水解条件,可能导致果糖降解而未被检测到。表3中果糖的测得数据受降解因素的影响,仅起到参考作用。 另取枸杞多糖加入3种浓度的单糖混合标准溶液,按相同的方法制备加标样品品液并并定,加标回收率见表3。除果糖外,加标回收率范围在84%~104%。而果糖加标回收率约为50%。优化水解条件时发现,采用本方法水解后果糖浓度约为水解初期果糖浓度的50%,该结果与果糖加标回收测得的结果基本一致。本方法也可以广泛用于其它物质中多糖的检测,为多糖结构研究提供更全面有效的信息。 表3 枸杞多糖的单糖检测结果和加标回收率 Table 31Determination results and recoveries of lycium barbarum polysaccharide 枸杞多糖 溶液浓度 样品含量 样品加标浓度 摩尔比 Concentration of spiked 加标回收率 Amount of Proportion sample solution Recovery Lycium barbarum polysaccharide Concentration of solution sample (mg/g) of mole (%) (mg/L) 1 2 3 1 (%) 2 3 岩藻糖 Fuc 0.026 0.26 0.02 0.048 0.069 0.125 85.8 85.5 98.5 鼠李糖 Rha 0.152 1.52 0.10 0.245 0.346 0.525 92.6 96.7 93.1 阿拉伯糖 Ara 3.184 31.8 2.36 3.408 3.654 4.114 89.7 94.1 93.0 氨基葡萄糖GlcN 0.076 0.76 0.05 0.125 0.166 0.278 98.8 90.3 101.0 半乳糖 Gal 1.616 16.16 1.00 1.840 2.100 2.516 89.7 96.8 90.0 葡萄糖 Glc 10.242 102.4 6.34 10.468 10.742 11.282 90.5 100.1 104.0 木糖Xyl 0.354 3.54 0.26 0.460 0.580 0.856 85.3 90.7 100.4 甘露糖Man 0.399 3.99 0.25 0.504 0.626 0.905 84.0 90.9 101.2 果糖Fru 4.004 40.0 2.48 4.455 5.146 7.344 45.1 57.1 83.5 核糖 Rib 0.038 0.38 0.03 0.073 0.101 0.167 93.8 84.1 86.0 ( References ) ( WANG Zhan-Yong, YAN Song, SHANG Li-Ying, YAO Cai-Lin. Amino Acids and Biotic Resources, 2 008, 30(1):22 - 24 ) ( 王战勇,闫松,商 丽 颖,晁彩林.氨基酸和生物资源,2008,30(1):22-24 ) ( 2 ZHU Cai- P ing, ZHANG M i n, ZHANG Sheng-Hua. Chinese Traditional and Herbal Drugs , 2006,37(6) : 872一 8 74 朱彩平,张民,张声华.中草药,2006,37(6):872-874 ) ( 3 ZHUANG We n -Bin, CHEN Ji-Sheng, LIN Jie - Shan. Ch i nese J o urnal of Modern Applied P h armacy, 2009,26(13):1131 - 1133 ) ( 庄文斌,陈吉生,林洁珊.中国现代应用药学,2009,26(13):1131-1133 ) ( 4 JIANG Min, LEI D a n, C H EN Ke-Quan, LI Jian, YAO Jia-Min, WE I Pin g . Chinese J. Anal. Ch e m., 200 9 ,37(4):605-608 ) ( 姜岷,雷丹,陈可泉,李建,姚嘉旻,韦萍.分析化学,2009,37(4):605-608 ) ( 5 DAI Jun, ZHU Song, TANG Jian. J o urnal of Instrumental Analysis, 2007,26(2):2 0 6-210 戴军,朱松,汤坚.分析测试学报,2007,26(2):206-210 ) ( 6 LI Guo-Liang, SUO Y o u-Rui, S H I Jun-You, SU N Zhi-Wei, LIU Yong-Jun. Food and Fermentation Industries, 2009, 3 5(12): 39-42 ) ( 李国梁,索有瑞,史俊友,孙志伟,刘永军.食品与发酵工业,2009,35(12):39一 4 2 ) ( 7 LI Fa-Sheng, XU Heng-Gui, LI Ming-Y a ng,LI U Hui. Physical Te s ting and Chemical Analysis P a rt B (Chemical Analysis) , 2008,44(4):342-344 ) ( 李发胜,徐恒瑰,李明阳,刘辉.理化检验-化学分册 , 2008,44(4):342344 ) ( 8 ZHENG Guo-Qi, LU Jie , XU Xing, WAN G Jun. Journal of Ag r icultural Sciences, 2008, 29(3): 1 -4 郑国琦,罗杰,许兴,王俊.农业科学研究,2008,29(3):1-4 ) ( 9 LI Guo-Qiang, YIN Ping-He, ZHAO Ling, OU Yun-Fu, H U ANG Xue-Song. Journal of Instrumental Analysis, 2007,26(3):401 -4 03 ) ( 李国强,尹平河,赵玲,欧云付,黄雪松.分析测试学报,2007,26(3):401-403 ) ( 10 Rocklin R D, Clarke A P, Weitzhandle r M . Anal . Chem. , 1998, 70(8) : 1 496一1501 ) ( 1 1 Cai Y Q, Liu J S, Shi Y L, Liang L N, Mou S F. J. Chromatogr. A, 2005, 1085(1): 9 8-1 0 3 ) ( 12 C e es B, Manfred W, Carolie n AM K ,V i ctor B, Y an L, Chris P , Arnd I , Corneli s H H, Andre M D. J. Chromatogr. B, 2005 , 829(1-2):13 6- 143 ) ( 13 MOU Shi-Fen, L I U Ke-Na, DI N G Xiao-Jing. Me t hod and Application of Ion Chromatography, 200 5 :76 80 牟世芬,刘克纳,丁晓静.离子色谱方法及应用,2005:76-80 ) ( 14 TAO L e -Ping, D ING Z a i-Fu, ZHANG Bu-Chang. Ch i nese Journal of Chromatography, 1994, 12(5):35 1 -354 陶乐平,丁在富,张部昌.色谱,1994,12(5):351-354 ) Determination of Monosaccharide Constituents in Lycium BarbarumPolysaccharide Using Capillary Ion Chromatography withPulsed Amperometric Detection LI Jing*, LI Ren-Yong, LIANG Li-Na (Thermo Fisher Scientific, Bejing 100080, China) Abstract A method for the determination of ten kinds of monosaccharide in Lycium barbarumpolysaccharide was established using ICS-5000 Capillary IC system. In the pretreatment process, thetype and concentration of acid, the hydrolysis temperature anddlasting time were selected oroptimized. The optimized hydrolysis condition was 100 ℃ lasting 120 min with 2 mol/L trifluoroaceticacid solution. Under this condition the recovery rate of fructose was about 50%. Recovery rate of therest monosaccharide was 84% to 104%. In the experiment, new type of Eluent Generator, CapillaryCarborPac PA20 column, and improved capillary amperometric detection cell were used. Thecalibration curves of ten kinds of monosaccharide showed good linearity with correlation coefficientabove 0. 999. The LOD isbetween2. 5 to 75 pg/L. IIttisS 5suitable for the determination ofmonosaccharide constituents in Lycium barbarum polysaccharide. Keywords Capillary ion chromatography; IPulsed amperometricc (detection:Lyciumbarbarumpolysaccharide; Monosaccharide (Received 17 January 2012; accepted 23 April 2012) ++++一+飞++一++++一++子+子++飞+子++一++子++十+十++子++子+++子++子++十十++子+什+十++++十+一一 《分析化学》参考文献著录格式变更说明 参考文献以引用先后顺序编号(注于正文相应处),文献作者应全部写出。作者需对文献的作者、题目、发表的刊物、年代、卷期页等核实无误,切忌转引二手文献。遇到中文文献,则会如下所示,中英分开排;期刊、专著和译著引用格式及标记如下: Aminuddin M, Miller J N. Talanta,1995,42(6):775-778 ( LU Xiao-Quan, MO Jin-Yuan. Chines e J . Anal. Chem. , 1996,24(9) : 1100-1106 ) 卢小泉,莫金垣.分析化学,1996,24(9):1100一1106 ( DONG Shao-Jun, C H E Guang-Li, XIE Yuan-Wu. Chemically Modified Elect r odes. Beij i ng: Science Press, 1995:440一483 ) ( 董绍俊,车广礼,谢远武.化学修饰电极.北京:科学出版社,1995:440一4 8 3 ) ( 4 Sucha L,K o trly S. T ranslated by ZHOU Xi-Shun, DAI Mi n g, LI Ju n -Yi . Solution Equilibria in Analytical Chem- ist r y . Beijing: People's Education Press, 1979: 25-30 ) ( Sucha L, Ko t rly S.分析化学中的溶液平衡.周锡顺,戴明 , 李俊义译.北京:人民教育出版社,1979:25-3 0 ) ( Malinowski E R. F actor Analysis in Chemistry. 2nd ed., New York: W i ley Interscience, 1991: 4 0 ) ( 6 Stevens T M , MillerJr TE. U . S. P atent, 4 290775, 1981 ) ( 7 GB/T 5 0 09.101-2 0 03, Determination of Antimony in P olyester Re s in and Pr o ducts for Food Containers a n d Pack- aging Materials. N a tional S t andards of t h e People's R e public of C hina ) ( 食品容器及包装材料用聚酯树脂及其成型品中锑的测定.中华人民共和国国家标准.GB/T 5009.101-2003 ) ( NATA. T e chnical Note #1 7 - Guidelines for the Validation and Verification of Chemical Test Methods, h ttp://www. nata. asn. a u/ g o/p u blications/t e chnical-p u blications,2006 ) ◎China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 毛细管离子色谱分离-脉冲安培检测(Capillary IC-PAD)是离子色谱电化学检测发展的重要阶段。毛细管尺度的离子色谱系统以其高灵敏度、高效率、低消耗的特点,在单糖组分测定中展现了许多优势。本实验采用新型淋洗液自动发生装置产生淋液,CapillaryCarborPacPA20色谱柱分离,毛细管安培池检测,对枸杞多糖中单糖组成进行了考察。提供了毛细管离子色谱测定单糖成分的可行方案,为该方法的推广应用提供了实验基础。
确定




还剩4页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《枸杞多糖的单糖组成中毛细管型离子色谱-脉冲安培法检测方案(离子色谱仪)》,该方案主要用于其他食品中食品添加剂检测,参考标准--,《枸杞多糖的单糖组成中毛细管型离子色谱-脉冲安培法检测方案(离子色谱仪)》用到的仪器有Thermo scientific Aquion IC离子色谱
推荐专场
相关方案
更多
该厂商其他方案
更多