
方案详情
文
自1990 年推出了第一台商业化的SPR 生物传感器-Biacore,Biacore 对HIV 的研究做出了很大的贡献。现在我们特地翻译了这篇《应用SPR 技术揭密HIV》的综述,望能给各位专家,老师和同道提供有益的启示。
方案详情

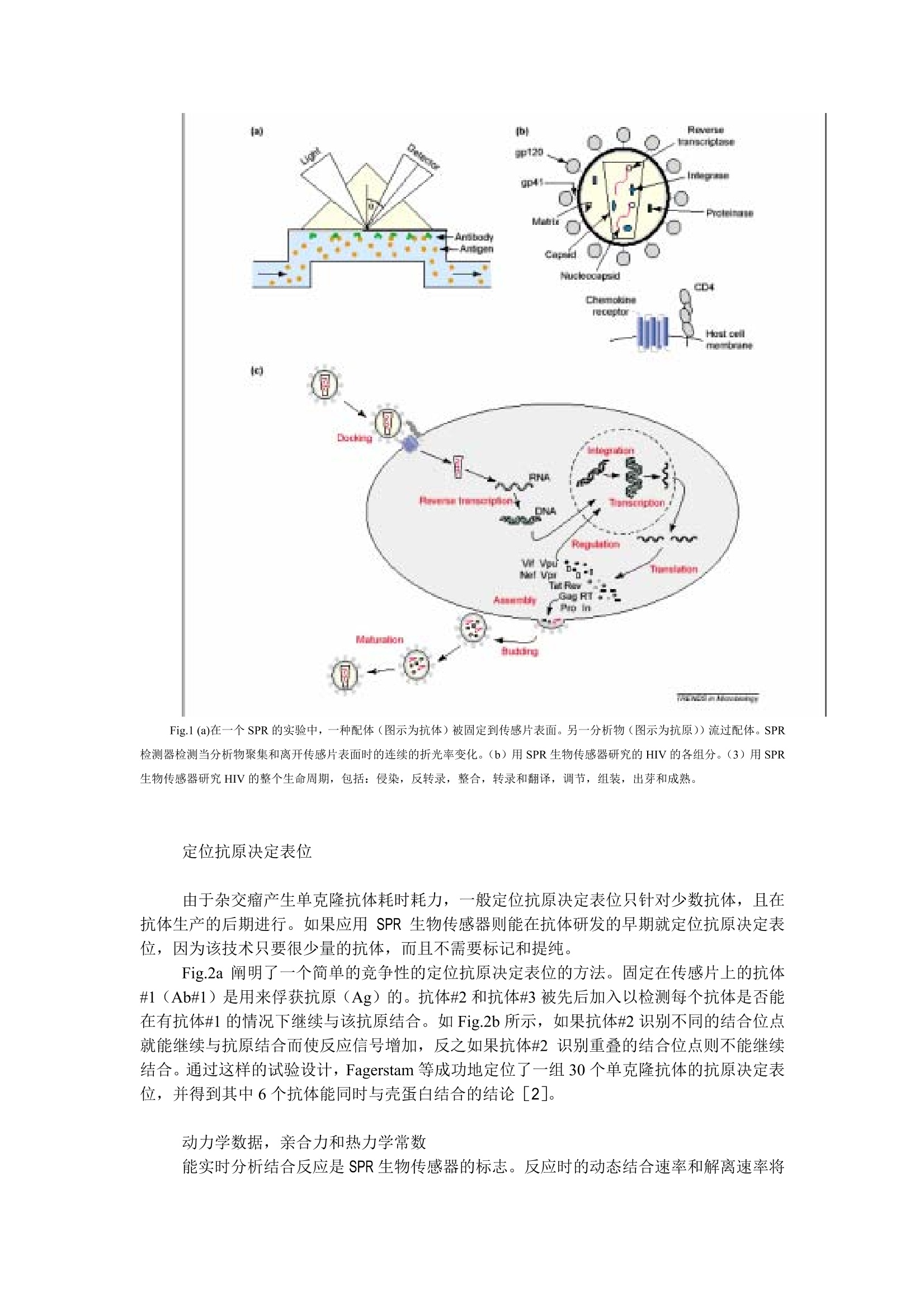
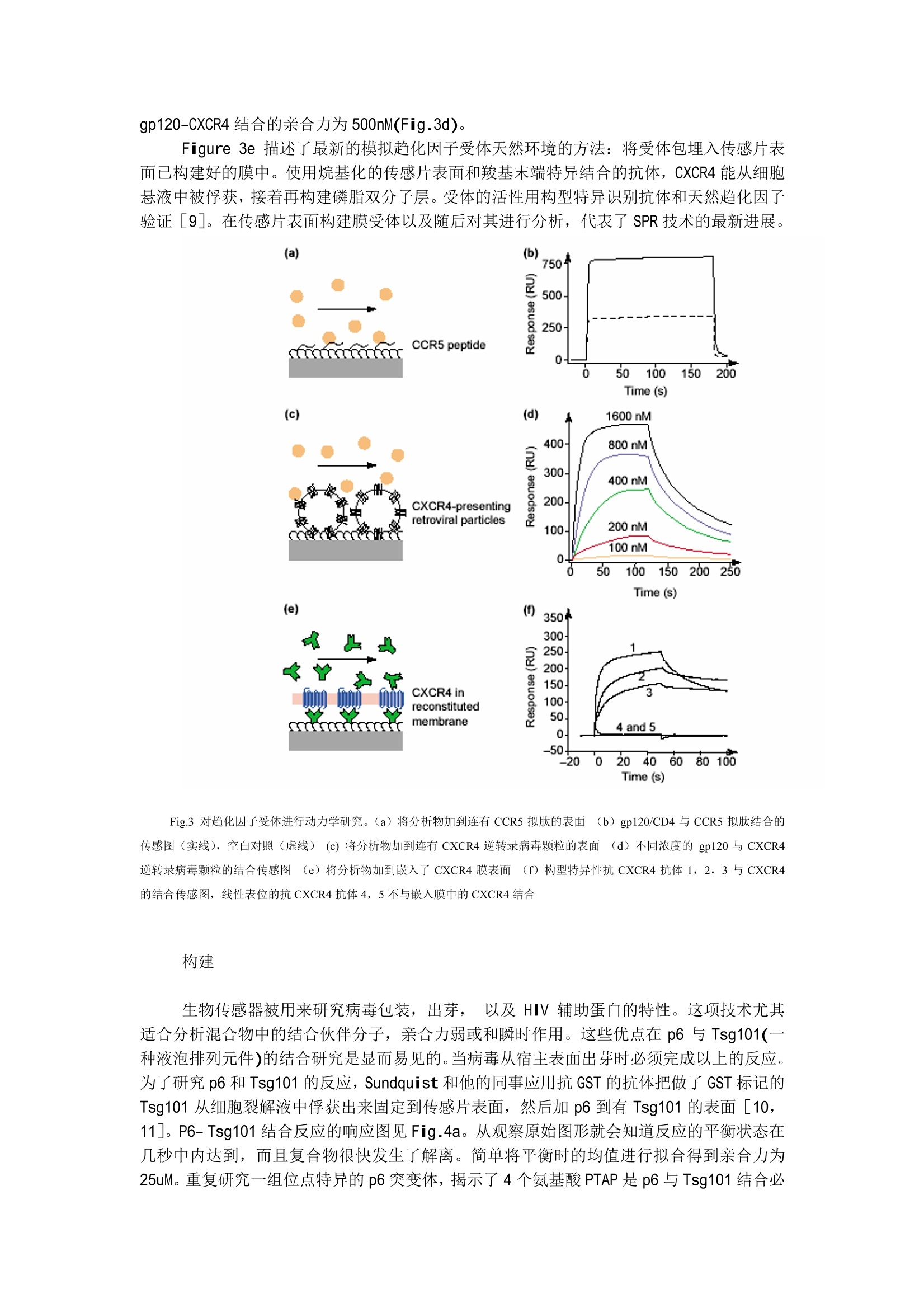
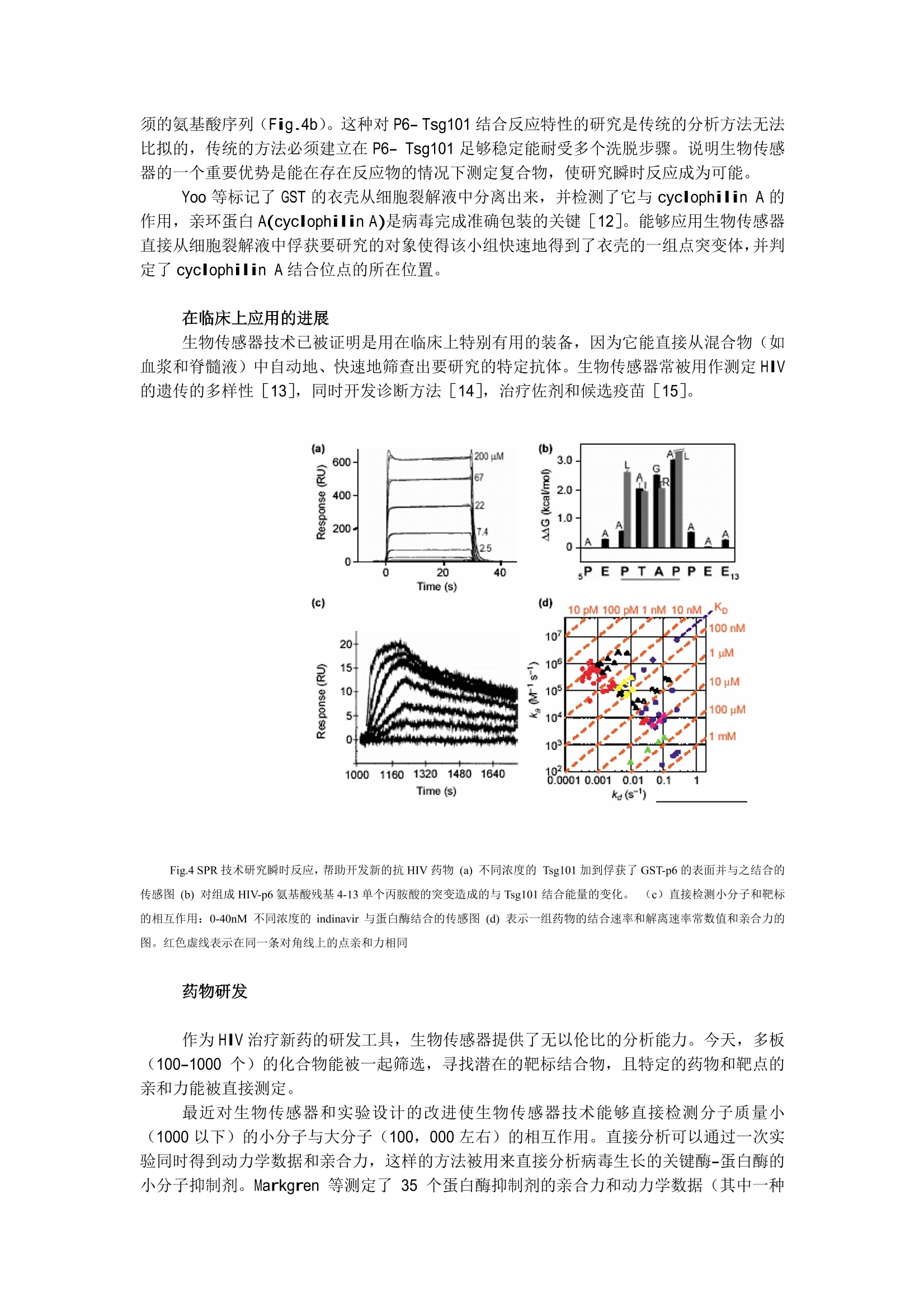
应用 SPR技术揭密 HIV 前言 自1990年推出了第一台商业化的 SPR 生物传感器-Biacore, Biacore 对 HIV 的研究做出了很大的贡献。值此在我们又面临新的病源——SARS病毒的威胁之际,我们特地翻译了这篇《应用 SPR技术揭密 HIV》[1]的综述,望能给各位专家,老师和同道提供有益的启示。 近年来,表面等离子共振(SPR)技术被广泛地应用在与 HIV 相关的各种功能的研究中,加深了人们对 HIV 的认识。无论是蛋白质,核算,脂类,碳水化合物,还是小分子化合物,SPR 生物传感器都能实时地分析其相互作用。而且不需要对分析物进行任何标记。因此,这项技术被用来分析病毒生命周期每个阶段的各种生物分子间的相互作用,从病毒侵染,复制,出芽到成熟每个阶段的与疫苗开发和抑制药物研究相关的基础研究。SPR 生物传感器提供一个独特和细致的视角来深入了解 HIV。 病毒生命周期的每个过程都由分子间的相互作用来控制,也是研究 HIV 的核心问题。因此大量的科研工作在 SPR 生物传感器上完成也就不足为奇了。如 Fig.1a 所示,将参与结合的一种伙伴分子例如抗体固定在传感片表面,另一种伙伴分子(在这个例子中为抗原)流过传感片表面。它们结合形成复合物以及复合物的解离都会改变传感片表面的折光率, SPR 能连续地监测这种折光率的变化。 SPR生物传感器对分子质量的检测灵敏度特别高, 因此不必对待测样品进行荧光或同位素标记就能识别蛋白质的多个结合位点,还能定量的测定生物分子反应的动力学数据,亲和力和热力学常数。与其他检测结合反应的技术不同,如酶联免疫反应 (ELISA)或基于小珠的技术要求反映物与产物分开,且反应平衡受到洗脱的影响; SPR 生物传感器能在存在游离反应物的情况下检测反应复合物的产量,实现了对亲和力极低的相互作用和瞬时反应的研究。因此,应用 SPR 生物传感器定量的研究结合反应几乎没有误差。与其他生物物理的方法比较, :如热量滴定的方法, SPR 生物传感器具有需要的样品量少(一般只需要几微克)和自动化程度高(目前的技术可分析100~400个样品/天)的优点。 为了更好的分享用 SPR 技术得到的关于 HIV 的知识,我们将分四部分:抗体特征病毒生命周期,临床上的应用和药物研发来介绍 SPR 生物传感器在 HIV 研究中的应用。我们还举例说明了如何完成基本的实验并概况了最新的研究方向如模拟膜表面技术和直接检测小分子抑制剂。 SPR 生物传感器在研究 HIV 中的广泛应用,说明了这项技术能被普遍地应用于微生物体系的研究。 抗体特征 几乎 HIV (Fig.1b)所有的结构与功能成分都以抗体为探针, SPR 生物传感器对了解这些抗体特性起到了重要的作用。这项技术被用来识别重叠的抗原结合位,同时获得抗体和抗原反应的动力学数据,亲和力和热力学常数。 Fig.1 (a)在一个 SPR的实验中,一种配体(图示为抗体)被固定到传感片表面。另一分析物(图示为抗原))流过配体。SPR检测器检测当分析物聚集和离开传感片表面时的连续的折光率变化。(b)用SPR生物传感器研究的 HIV 的各组分。(3)用SPR生物传感器研究 HIV 的整个生命周期,包括:侵染,反转录,整合,转录和翻译,调节,组装,出芽和成熟。 定位抗原决定表位 由于杂交瘤产生单克隆抗体耗时耗力,一般定位抗原决定表位只针对少数抗体,且在抗体生产的后期进行。如果应用 SPR 生物传感器则能在抗体研发的早期就定位抗原决定表位,因为该技术只要很少量的抗体,而且不需要标记和提纯。 Fig.2a 阐明了一个简单的竞争性的定位抗原决定表位的方法。固定在传感片上的抗体#1(Ab#1)是用来俘获抗原(Ag)的。抗体#2和抗体#3被先后加入以检测每个抗体是否能在有抗体#1的情况下继续与该抗原结合。如 Fig.2b 所示,如果抗体#2识别不同的结合位点就能继续与抗原结合而使反应信号增加,反之如果抗体#2识别重叠的结合位点则不能继续结合。通过这样的试验设计, Fagerstam 等成功地定位了一组30个单克隆抗体的抗原决定表位,并得到其中6个抗体能同时与壳蛋白结合的结论[2]。 动力学数据,亲合力和热力学常数 能实时分析结合反应是 SPR 生物传感器的标志。反应时的动态结合速率和解离速率将 Fig.2 SPR 技术研究抗体和抗原的作用。(a)定位抗原表位的实验方法。#1抗体固定在传感片表面,抗原由#1抗体俘获,然后再加其他抗体(#2或#3)。(b)典型的先加抗原,再加#2抗体的传感图,#2抗体能继续与抗原结合,说明#2抗体与#1抗体的结合位点不重叠。(c)动力学分析的实验方法。(d)重叠在一起的抗原分别与#2抗体与#1抗体的结合的传感图。 提供高分辨率的关于复合物形成和复合物稳定性的信息。Figure 2c 描述了一种典型的抗原-抗体动力学分析的模式。。一般将抗体固定在 CM5 传感片表面,让抗原流过传感片。对HIV 体系的动力学研究是由 Karlsson 等最先开始的,他们测定了壳蛋白与抗体作用的速率和平衡常数。Figure 2c 描述了壳蛋白与两种不同抗体的作用。两种抗体与壳蛋白结合的亲合力是接近的(约35nm),但是反应的动力学完全不同,其结合速率相差约5倍,而解离速率相差约6倍。Karlsson 等的工作真实反应了动力学数据比平衡常数提供了更详细的关于结合反应和反应复合物的信息[5]。有助于更客观得评价结合反应。 动力学分析抗体与其他 HIV 靶标的作用还包括:(1)通过研究 Fab 片段与 RT 的作用来选择高亲合力的和酶抑制的片段[4];(2)了解抗 NC 锌指区抗体的特性[3]. 把握 HIV生命周期 Fig.1c是 HIV生命周期的图解说明。其中的很多方面都用生物传感器在研究,尤其是HIV元件与宿主细胞的组分相互作用的动力学和亲和力研究。 入侵 如今,病毒必须同时与 CD4 和趋化因子受体结合(Fig.1b)才能侵染T细胞是得到大家公认的事实。最近,用基于 SPR 技术的实验在L1传感片表面上模拟了细胞膜,并检测 gp120与7个趋化因子受体的结合(例如CCR5和 CXCR4)。 Figure3演示了3种不同的用 SPR 生物传感器研究趋化因子-受体复合物的方法。Cormier 等和 Misumi 等将类似 CCR5 的关键区域的肽片段固定到传感片表面并证明它们能与抗 CCR5 的抗体结合。通过把 gp120-CD4复合物加到不同的来自 CCR5 片段,他们发现了 CCR5 结合 gp120 的关键部位,并了解了该部位的特性(Fig 3a,3b)[6,7]。在模拟自然膜环境中的趋化因子受体的努力中, Hoffman 等构建了在表面表达 CXCR4 或 CCR5 受体的逆转录酶病毒颗粒[8]。如 Fig.3c所示,这些颗粒能被直接固定在传感片表面。对构型敏感的 CXCR4 特异抗体与 CXCR4 受体的结合是二价形式的且 gp120-CXCR4结合的亲合力为500nM(Fig.3d)。 Figure 3e 描述了最新的模拟趋化因子受体天然环境的方法:将受体包里入传感片表面已构建好的膜中。使用烷基化的传感片表面和羧基末端特异结合的抗体, CXCR4能从细胞悬液中被俘获,接着再构建磷脂双分子层。受体的活性用构型特异识别抗体和天然趋化因子验证[9]。在传感片表面构建膜受体以及随后对其进行分析,代表了 SPR 技术的最新进展。 Fig.3 对趋化因子受体进行动力学研究。(a)将分析物加到连有 CCR5 拟肽的表面(b) gp120/CD4 与 CCR5拟肽结合的传感图(实线),空白对照(虚虚)(c)将分析物加到连有 CXCR4 逆转录病毒颗粒的表面(d)不同浓度的 gp120 与 CXCR4逆转录病毒颗粒的结合传感图(e)将分析物加到嵌入了CXCR4膜表面j(f)构型特异性抗 CXCR4 抗体1,2,3与 CXCR4的结合传感图,线性表位的抗 CXCR4 抗体4,5不与嵌入膜中的 CXCR4结合 构建 生物传感器被用来研究病毒包装,出芽, 以及 HIV 辅助蛋白的特性。这项技术尤其适合分析混合物中的结合伙伴分子,亲合力弱或和瞬时作用。这些优点在 p6与Tsg101(一种液泡排列元件)的结合研究是显而易见的。当病毒从宿主表面出芽时必须完成以上的反应。为了研究 p6 和 Tsg101 的反应, Sundquist 和他的同事应用抗 GST 的抗体把做了 GST 标记的Tsg101 从细胞裂解液孚俘获出来固定到传感片表面,然后加p6到有Tsg101的表面[10,11]。 P6-Tsg101 结合反应的响应图见 Fig.4a。从观察原始图形就会知道反应的平衡状态在几秒中内达到,而且复合物很快发生了解离。简单将平衡时的均值进行拟合得到亲合力为25uM。重复研究一组位点特异的 p6突变体,揭示了4个氨基酸 PTAP 是 p6 与 Tsg101结合必 须的氨基酸序列(Fig.4b)。这种对 P6- Tsg101 结合反应特性的研究是传统的分析方法无法比拟的,传统的方法必须建立在 P6- Tsg101足够稳定能耐受多个洗脱步骤。说明生物传感器的一个重要优势是能在存在反应物的情况下测定复合物,使研究瞬时反应成为可能。 Yoo 等标记了 GST 的衣壳从细胞裂解液中分离出来,并检测了它与cyclophilin A 的作用,亲环蛋白A(cyclophilin A)是病毒完成准确包装的关键[12]。能够应用生物传感器直接从细胞裂解液中俘获要研究的对象使得该小组快速地得到了衣壳的一组点突变体,并判定了 cyclophilin A结合位点的所在位置。 在临床上应用的进展 生物传感器技术已被证明是用在临床上特别有用的装备,因为它能直接从混合物(如血浆和脊髓液)中自动地、快速地筛查出要研究的特定抗体。生物传感器常被用作测定HIV的遗传的多样性[13],同时开发诊断方法[14],治疗佐剂和候选疫苗[15]。 Fig.4 SPR 技术研究瞬时反应,帮助开发新的抗 HIV药物(a)不同浓度的 Tsg101 加到俘获了 GST-p6的表面并与之结合的传感图(b)对组成HIV-p6氨基酸残基4-13单个丙胺酸的突变造成的与 Tsg101结合能量的变化。 (c)直接检测小分子和靶标的相互作用: 0-40nM不同浓度的 indinavir 与蛋白酶结合的传感图(d)表示一组药物的结合速率和解离速率常数值和亲合力的图。红色虚线表示在同一条对角线上的点亲和力相同 药物研发 作为HIV治疗新药的研发工具,生物传感器提供了无以伦比的分析能力。今天,多板(100-1000个)的化合物能被一起筛选,寻找潜在的靶标结合物,且特定的药物和靶点的亲和力能被直接测定。 最近对生物传感器和实验设计的改进使生物传感器技术能够直接检测分子质量小(1000以下)的小分子与大分子(100,000左右)的相互作用。直接分析可以通过一次实验同时得到动力学数据和亲合力,这样的方法被用来直接分析病毒生长的关键酶-蛋白酶的小分子抑制剂。Markgren 等测定了35个蛋白酶抑制剂的亲合力和动力学数据(其中一种 indinavir 的分析原始图见Fig.4c)[17,18]。在此基础上,Hamalainen 等建立了一种高通量的筛选方法,在动力学的层面上对290个蛋白酶抑制剂进行了分析[16].Figure.4d 显示了这290个抑制剂中部分化合物的结合速率值和解离速率值[19]。在同一对角线上的数据点的亲合力相同,但是各自的动力学数据相差很大。因此,我们不难发现,两个亲合力相同的化合物与药物靶点的结合情况可能非常不同,只有动力学数据才能提供更丰富的信息来帮助判断选择更恰当的化合物进入下一步的研究。 由于篇幅有限,请与我们公司联系索要更多相关文献。 定货信息 SPR 生物传感器 Biacore 3000 BR-1100-53 SPR 生物传感器 Biacore 2000 BR-1100-37 SPR 生物传感器 Biacore X BR-1100-29L1传感片 99-1000-07 CM5 传感片 BR-1003-99 References 1. Rebecca L.Rich & David G. Myszka (2003) Spying on HIV with SPRTrends in Microbiology Vol.11 No.3 124-133 2. Fa gerstam, L.G. et al.(1990) J. Mol. Recog. 3, 208-214 3. De Rocquigny, H. et al.(2000) AIDS Res. Hum. Retroviruses 16, 1259-1267 4.Ohba, H. et al. (2001)J. Gen. Virol. 82, 813-820 5.Cormier, E.G. et al. (2000) Proc. Natl. Acad. Sci. U. S. A. 97, 5762-5767 6. Cormier,E.G. et al. (2001) J. Virol. 75,5541-5549 7.Hoffman, T.L. et al. (2000) Proc. Natl. Acad. Sci.U.S. A. 97,11215-11220 8. Misumi, S.et al. (2001) vaccine. J. Virol. 75, 11614-11620 9.Stenlund, P. et al. Anal. Biochem. Capture and reconstitution of G protein-coupledreceptors on a biosensor surface. (in press) 10. Garrus,J.E. et al. (2001) Cell 107,55-65 11.Pornillos, O. et al. (2002) EMBO J. 21, 2397-2406 12. Yoo, S. et al.(1997) J. Mol. Biol. 269, 780-795 13.VanCott, T.C. et al.(1995)J. Immunol. Methods 183, 103-117 14. Richalet-Se’cordel, P.M. et al. (1994) J. Immunol.Methods 176, 221-234 ( 15. Pincus, S. et al. (1997) J . Immunol.158,3511-3520 ) ( 16. Ha ma la inen, M.D. et al. (2000) J. Biomol. Screen. 5,353-360 ) ( 17.Markgren, P - O.et al. ( 2000) Anal. Biochem. 2 7 9, 71-78 ) ( 18. Markgren, P -O. e t al. (2001) Anal. Biochem. 291,2 0 7- 21 8 ) ( 19. M arkgren, P-O. et al. (2002)J. Med. Chem. 45, 5430-5439 )
确定



还剩4页未读,是否继续阅读?
Cytiva(思拓凡)为您提供《HIV中SPR 技术检测方案(大分子作用仪)》,该方案主要用于其他中SPR 技术检测,参考标准--,《HIV中SPR 技术检测方案(大分子作用仪)》用到的仪器有
相关方案
更多








