本文采用安捷伦三重四极杆液质联用系统,建立了同时检测主要谷物中 16 种真菌毒素的分析方法。小麦、玉米、稻谷等样品经粉碎后采用乙腈-水-乙酸溶液(70:29:1,v/v/v)提取,样品溶液经 Agilent Eclipse Plus C18 色谱柱 (2.1 ×100 mm, 1.8 μm) 分离,使用配有安捷伦喷射流 (AJS) 电喷雾离子源的安捷伦三重
四极杆液质联用系统进行监测,同时采用 14 种 13C 标记的真菌毒素作为稳定同位素内标来提高方法的准确度。本方法前处理操作简单,耗时短,线性相关性良好,相关系数 R2 > 0.996;在小麦、玉米基质中 16 种真菌毒素 3 个水平的加标回收率基本都在 85%-120% 之间,平行样品测定的 RSD 在 0.7%-8.2% 之间。采用本方法对 FAPAS 阳性样品进行测定,测定值符合 FAPAS 的规定值,验证了方法的准确性。在此基础上建立了同时测定 16 种真菌毒素的 UHPLC-MS/MS 电子方法 (e-Method),使方法建立与优化大大简化。通过在国内外多个实验室不同型号的安捷伦液质联用系统上采用 e-Method 进行实验室间验证,证实了检测方法的准确性和 e-Method 的可行性。
方案详情

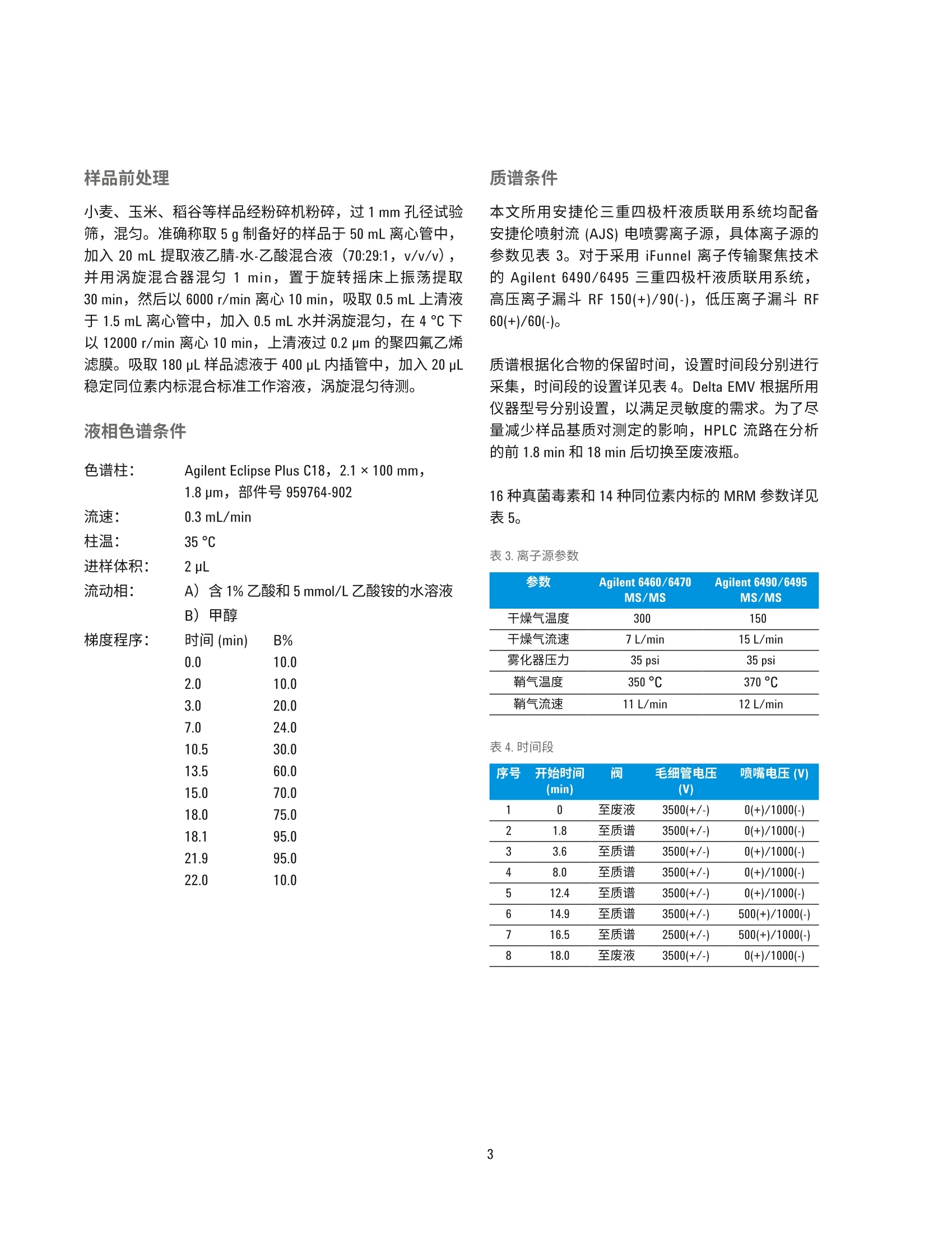
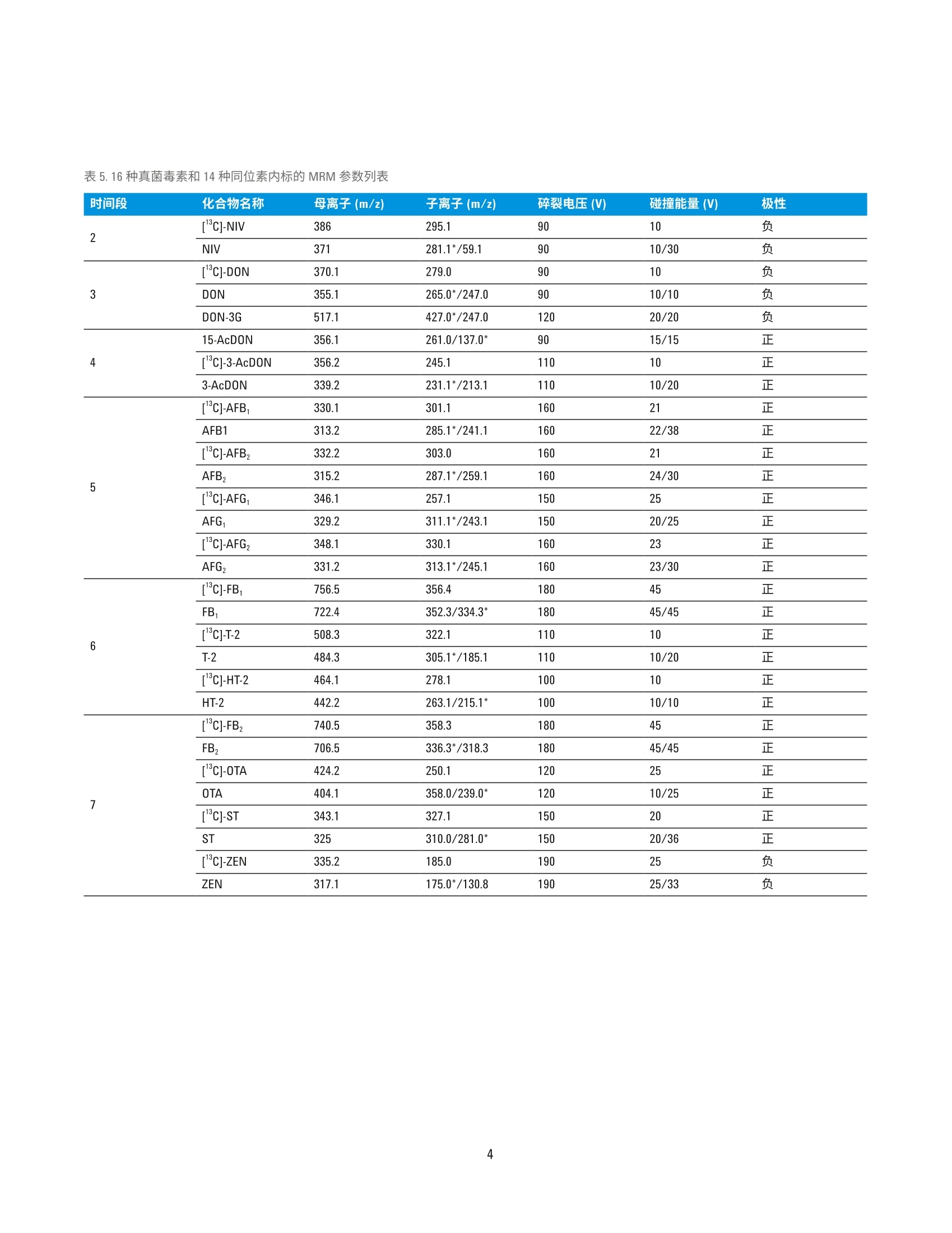
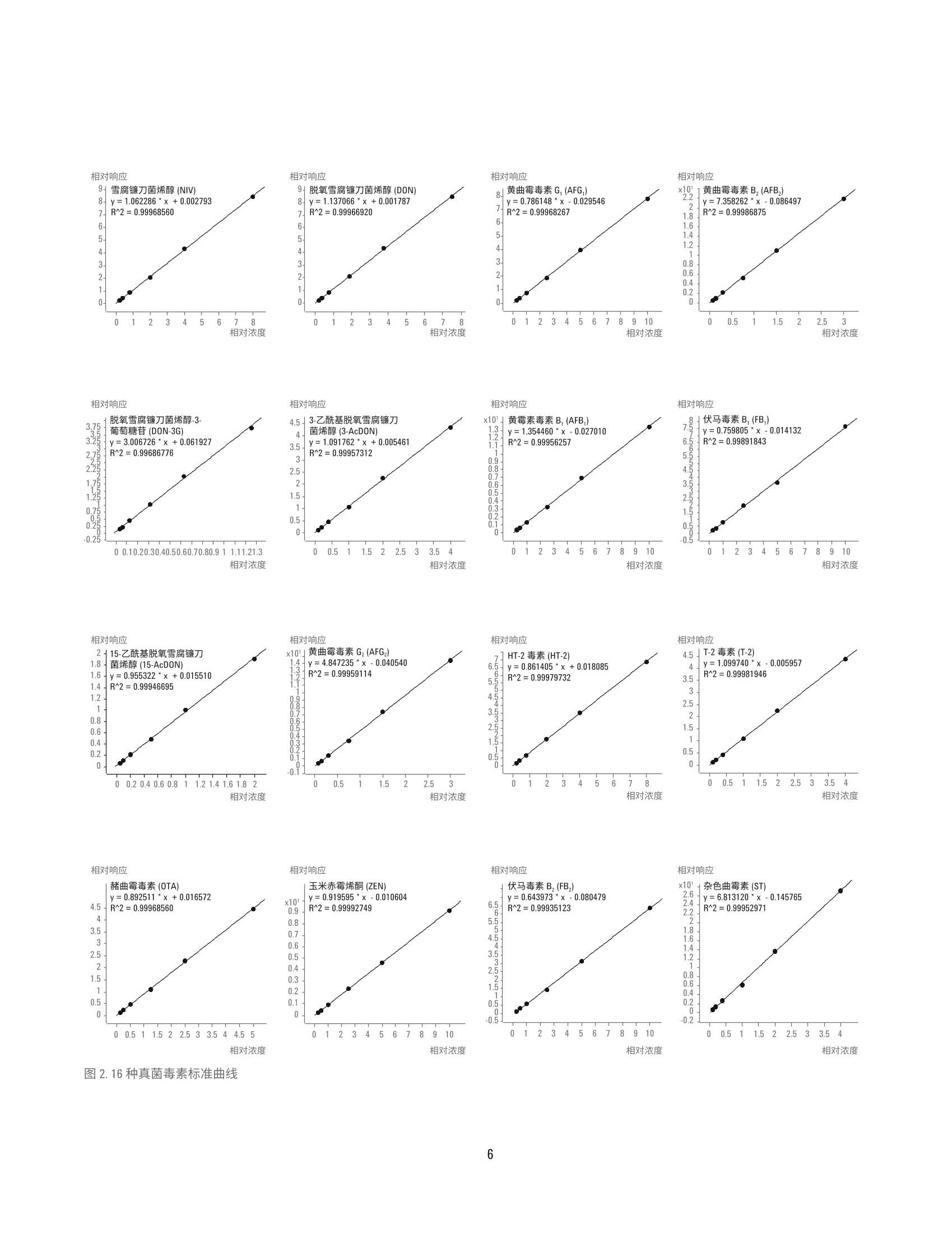
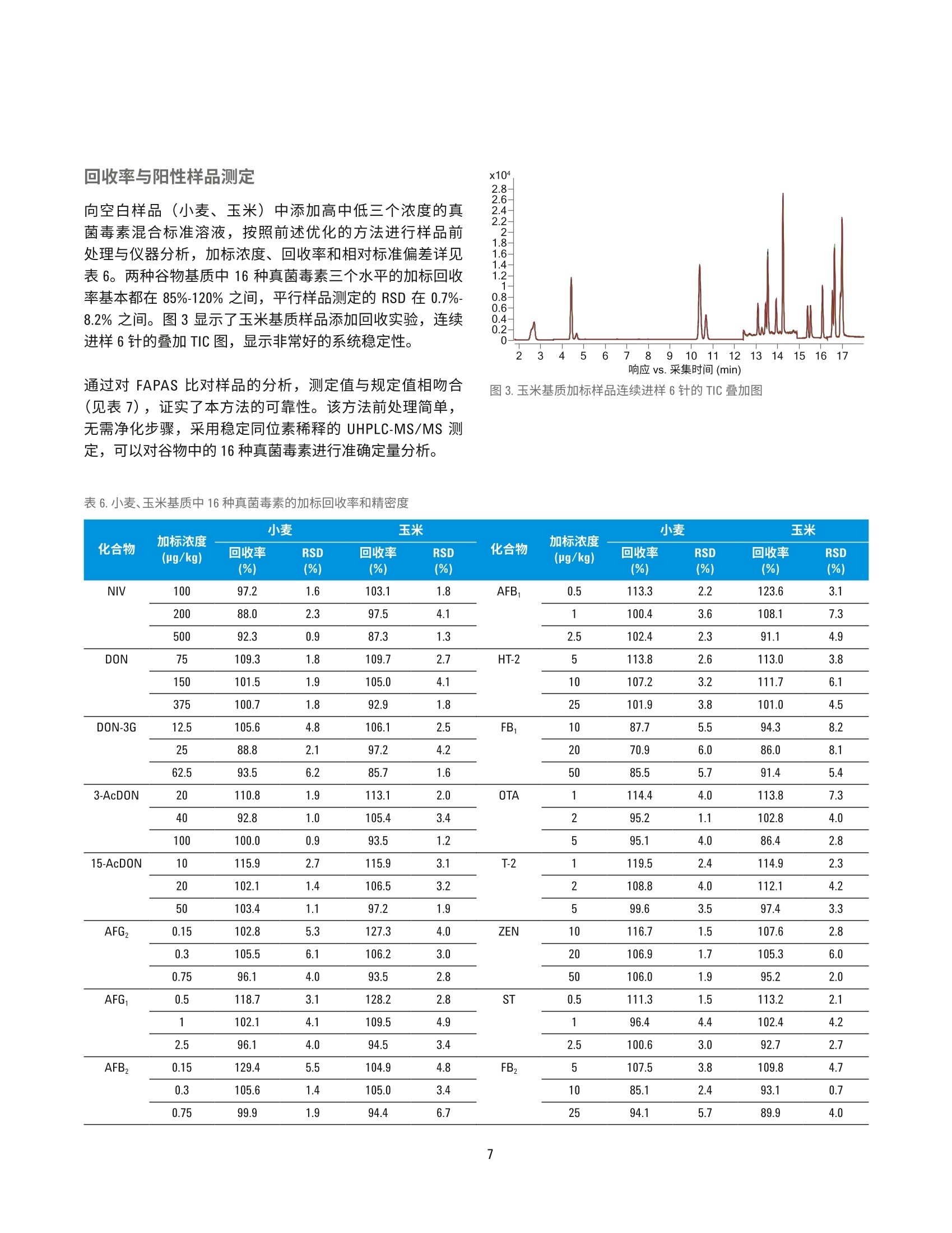
回收率与阳性样品测定 国家粮食局科学研究院 郭启雷、吕美玲、吴翠玲、陈玉红 ( 安捷伦科技(中国)有限公司 ) 食品检测与农业 摘要 本文采用安捷伦三重四极杆液质联用系统,建立了同时检测主要谷物中16种真菌毒素的分析方法。小麦、玉米、稻谷等样品经粉碎后采用乙腈-水-乙酸溶液(70:29:1, v/v/v)提取,样品溶液经 Agilent Eclipse Plus C18 色谱柱(2.1×100 mm, 1.8 pm)分离,使用配有安捷伦喷射流 (AJS)电喷雾离子源的安捷伦三重四极杆液质联用系统进行监测,同时采用14种c标记的真菌毒素作为稳定同位素内标来提高方法的准确度。本方法前处理操作简单,耗时短,线性相关性良好,相关系数R’>0.996;在小麦、玉米基质中16种真菌毒素3个水平的加标回收率基本都在85%-120%之间,平行样品测定的 RSD 在0.7%-8.2%之间。采用本方法对 FAPAS 阳性样品进行测定,测定值符合 FAPAS 的规定值,验证了方法的准确性。在此基础上建立了同时测定16种真菌毒素的 UHPLC-MS/MS 电子方法(e-Method), 使方法建立与优化大大简化。通过在国内外多个实验室不同型号的安捷伦液质联用系统上采用 e-Method 进行实验室间验证,证实了检测方法的准确性和e-Method 的可行性。 真菌毒素是真菌生长过程中产生的一系列有毒有害物质,目前在自然界中已发现的真菌毒素大约有400多种1.2,对人类和动物具有致癌、致畸和致突变等毒性I3.4]。粮食中的真菌毒素种类很多,常见的有黄曲霉毒素(AFT)、赭曲霉毒素(OTA)、玉米赤霉烯酮(ZEN)、脱氧雪腐镰刀菌烯醇(DON)、伏马毒素(FB)和 T-2毒素(T-2)等。对食食中真菌毒素污染及时、快速的监测、检测和控制,为人类提供安全的口粮、为动物提供安全的饲料,成为摆在各国面前的一个重要课题。目前,真菌毒素的检测方法主要有薄层色谱法、荧光光度法、酶联免疫法、液相色谱法和液相色谱-质谱联用法等。对于多残留分析和污染物分析,液相色谱-串联质谱已被证明是一个强大的工具,可实现不同谷物中多种真菌菌素的同时测定,具有高灵敏度和高选择性。本文采用安捷伦三重四极杆液质联用系统,建立了同时快速检测主要谷物中常见的16种真菌毒素的可靠定量方法。该方法可以满足对谷物中常见多种真菌毒素的高通量快速监测。 实验部分 试剂和样品 所有试剂和溶剂均为色谱纯级或者分析纯级。甲醇、乙腈购自德德默克(MERCK)。甲酸、乙酸、乙酸铵购自美国 Sigma-Aldrich 公司。16种真菌毒素包括雪腐镰刀菌烯醇 (NIV)、脱氧雪腐镰刀菌烯醇 (DON)、脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(DON-3G)、3-乙酰基脱氧雪腐镰刀菌烯醇(3-AcD0N)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-AcDON)、黄曲霉毒素B (AFB,)、黄曲霉毒素 Bz(AFB,)、黄曲霉毒素G(AFG,)、黄曲霉毒素 Gz (AFG,)、赭曲霉毒素 A (OTA)、T-2毒素(T-2)、HT-2毒素(HT-2)、玉米赤霉烯酮(ZEN)、伏马毒 表1.16种真菌毒素混合标准工作溶液的浓度 名称 浓度 (ug/mL) 名称 浓度(ug/mL) AFB, 0.1 NIV 20 AFB, 0.03 DON 15 AFG, 0.1 DON-3G 2.5 AFG, 0.03 3-AcDON 4 15-AcDON 2 HT-2 1 ZEN 2 ST 0.1 OTA 0.2 FB, 2 T-2 0.2 FB, 1 素B (FB,)、伏马毒素 Bz (FB,)、杂色曲霉毒素 (ST), 14种同位素内标包括[C]-NIV、[C-D0N、[C]-3-AcDON、[3C]-AFB,、[13C]-AFB2、[3C]-AFG、[13C,J-AFGz、[Czo]OTA、[Cz4]-T-2、[3Czz]-HT-2、[13C8·ZEN、[C34]-FB、[C34]FB2、[Crg]-ST购自 Romer实验室(奥地利)。 ( 仪器和设备 ) 采用 Agilent 1290 Infinity 液相色谱系统进行分离,其配备安捷伦组件有以下两种方案: ( · G4220A 型二元泵 、 G4226A 型自动进样器、G1316C 型主 温箱 ) ( · G7120A型高速泵、G7167B 型高通量进样器、G7116B 型 多柱柱温箱 ) 采用配有安捷伦喷射流 (AJS) 电喷雾离子源的 Agilent6460/6470/6490/6495三重四极贡液质联用系统进行检测。 采用 Agilent MassHunter 工作站软件进行数据采集、确证和定量分析。 标准品制备 分别配制16种真菌毒素的单标储备液, 其中AFB、AFB,AFG,和 AFG,采用甲醇做溶剂, FB、FB,采用乙腈:水(50:50,v/v)做溶剂,其余化合物采用乙腈做溶剂,于-20°C保存。分别移取一定体积的16种真菌毒素单标储备液于 10 mL容量瓶中,用水定容至刻度,配制真菌毒素混合标准工作液,于-20°℃保存,浓度详见表1。分别移取一定体积的14种真菌毒素稳定同位素单标溶液溶 10 mL 容量瓶中,用水定容至刻度,配制稳定同位素内标混合标准工作液,于-20℃避光保存,浓度详见表2。 表2.14种稳定同位素内标混合标准工作液的浓度 名称 浓度 (pg/mL) 名称 浓度 (ug/mL) [C]-AFB 0.01 [Cs]-NIV 2.5 [3C]-AFB, 0.01 [C1s]-DON 2 [C]-AFG, 0.01 [CJ-3-AcD0N 1 [C]-AFG, 0.01 T’C 1-ZEN 0.2 T3C,1-0TA 0.04 TC31-FB, 0.5 [Cz]-T-2 0.05 [3C]-FB, 0.3 [C,,]-HT-2 0.125 [CJ-ST 0.025 小麦、玉米、稻谷等样品经粉碎机粉碎,过1mm 孔径试验筛,混匀。准确称取5g制备好的样品于50mL离心管中,加入20mL 提取液乙腈-水-乙酸混合液 (70:29:1, v/v/v),并用涡旋混合器混匀1 min, 置于旋转摇床上振荡提取30 min, 然后以6000 r/min 离心10min, 吸取0.5mL上清液于1.5mL离心管中,加入0.5mL水并旋旋混匀,在4℃下以12000 r/min 离心 10 min, 上清液过 0.2 pm 的聚四氟乙烯滤膜。吸取 180 pL样品滤液于400pL内插管中,加入20pL稳定同位素内标混合标准工作溶液,涡旋混匀待测。 液相色谱条件 色谱柱: Agilent Eclipse Plus C18, 2.1×100 mm, 1.8 pm,部件号959764-902 流速:0.3 mL/min柱温:35°C 进样体积: 2pL 流动相: A) 含1%乙酸和5mmol/L 乙酸铵的水溶液B)甲醇 梯度程序: 质谱条件 本文所用安捷伦三重四极杆液质联用系统均配备安捷伦喷射流 (AJS)电喷雾离子源,具体离子源的参数见表3。对于采用 iFunnel 离子传输聚焦技术的 Agilent 6490/6495 三重四夜杆液质联用系统,高压离子漏斗 RF 150(+)/90(-),低压离子漏斗 RF60(+)/60(-)。 质谱根据化合物的保留时间,设置时间段分别进行采集,时间段的设置详见表4。 Delta EMV 根据所用仪器型号分别设置,以满足灵敏度的需求。为了尽量减少样品基质对测定的影响, HPLC 流路在分析的前1.8 min 和18 min 后切换至废液瓶。 16种真菌毒素和14种同位素内标的 MRM 参数详见表5。 表3.离子源参数 参数 Agilent 6460/6470 Agilent 6490/6495 MS/MS MS/MS 干燥气温度 300 150 干燥气流速 7 L/min 15 L/min 雾化器压力 35 psi 35 psi 鞘气温度 350 °C 370°C 鞘气流速 11 L/min 12 L/min 表4.时间段 序号 开始时间 阀 毛细管电压 喷嘴电压(V) (min) (V) 1 0 至废液 3500(+/-) 0(+)/1000(-) 2 1.8 至质谱 3500(+/-) 0(+)/1000(-) 3 3.6 至质谱 3500(+/-) 0(+)/1000(-) 4 8.0 至质谱 3500(+/-) 0(+)/1000(-) 5 12.4 至质谱 3500(+/-) 0(+)/1000(-) 6 14.9 至质谱 3500(+/-) 500(+)/1000(-) 7 16.5 至质谱 2500(+/-) 500(+)/1000(-) 8 18.0 至废液 3500(+/-) 0(+)/1000(-) 表5.16种真菌毒素和14种同位素内标的 MRM 参数列表 结果与讨论 UHPLC-MS/MS条件优化 根据每种化合物灵敏度的不同,选择浓度为 0.5-2.0 pg/mL的单标溶液分别优化质谱参数。真菌毒素类化合物可能形成[M+H]*、[M+NH]*、[M+Na]*、[M-H]、[M+HC0O]和[M+CH,C0O]等不同形式的加合离子,各种加合离子的响应强弱与化合物本身的性质和流动相体系的组成有关。 NIV的[M+H]*和[M-H]的响应均较弱,在含有乙酸的流动相体系中[M+CH,COO]的响应有非常显著的提高; DON-3G 有同样的趋势,最终我终选择 NIV、DON、DON-3G 采用负模式检测,均采用[M+CH,COO]为母离子。同样在负模式下检测的还有 ZEN, 选择[M-H]为母离子。采用正模式检测的真菌毒素中,15-AcDON、T-2、HT-2 选择[M+NH4]*作为母离子,其余真菌毒素选择 [M+H]*为母离子。对于绝大多数化合物来说,正模式下喷嘴电压设置为0V时,灵敏度最高,但对于FB,、FB2,设置适当的喷嘴电压反而会使响应提高。在本方法中FB、FB,出峰的时间段,设置喷嘴电压为500V, 虽然同一采集时间段的其他化合物会损失一定的灵敏度,但响应较低的FB,、FB,的响应均可提高50%以上,提高了本方法的整体检测能力。 为保证不同的真菌毒素[M+H]*、[M+NH十]*、[M-H]-和[M+CH,COO]等加合离子的形成,在流动相中加入足够浓度的乙酸和乙酸铵。由于 3-AcD0N 和 15-AcDON是同分异构体,虽然已针对性地选择不同的离子对,仍然存在离子对干扰的可能,为了减少在复杂基质中的误判,需要优化色谱条件实现二者的基线分离。我们采用 Eclipse Plus C18色谱柱,通过优化的梯度洗脱程序,实现了 3-AcDON 和15-AcD0N这对同分异构体的基线分离,在18 min 内实现了 16种真菌毒素的良好分离,如图1所示。16种真菌毒素中12种采用正模式检测,4种采用负模式检测,我们根据保留时间设置不同的时间段分别进行采集,ZEN 和 OTA 在同一个时间窗口共流出,因此在相应的时间段设置了快速极性切换模式。 图1.16种真菌毒素混合标准溶液的 MRM 叠加图 标准曲线 根据试样中被测样液的毒素含量情况,准确移取适量真菌毒素混合标准工作液,用乙腈-水-乙酸溶液支1(35:64.5:0.5,v/v/v)逐级稀释配制成不同浓度的系列混合标准工作液。然后向 400pL内插管中加入20 pL 14 种稳定同位素内标混合标准工作液,再分别吸取180uL 配制好的系列标准工作液于内插管中,涡旋混匀后上机检测,绘制内标标准曲线。如图2所示内标标准曲线,16种真菌毒素都显示出良好的线性关系,相关系数 R’>0.996。由于 DON-3G,15-AcDON 没有对应的商品化稳定同位素内标,分别采用与之结构相近的[C:J-D0N、[C,]-3-AcD0N 作为其内标。 图2.16种真菌毒素标准曲线 向空白样品:(小麦、玉米)中添加高中低三个浓度的真菌毒素混合标准溶液,按照前述优化的方法进行样品前处理与仪器分析,加标浓度、回收率和相对标准偏差详见表6。两种谷物基质中16种真菌毒素三个水平的加标回收率基本都在85%-120%之间,平行样品测定的RSD 在 0.7%-8.2%之间。图3显示了玉米基质样品添加回收实验,连续进样6针的叠加 TIC图,显示非常好的系统稳定性。 通过对 FAPAS 比对样品的分析,测定值与规定值相吻合(见表7),证实了本方法的可靠性。该方法前处理简单,无需净化步骤,采用稳定同位素稀释的 UHPLC-MS/MS 测定,可以对谷物中的16种真菌毒素进行准确定量分析。 图3.玉米基质加标样品连续进样6针的 TIC 叠加图 化合物 加标浓度 小麦 玉米 加标浓度 (pg/kg) 小麦 玉米 回收率 RSD 回收率 RSD 化合物 回收率 RSD 回收率 RSD (pg/kg) (%) (%) (%) (%) (%) (%) (%) (%) NIV 100 97.2 1.6 103.1 1.8 AFB, 0.5 113.3 2.2 123.6 3.1 200 88.0 2.3 97.5 4.1 1 100.4 3.6 108.1 7.3 500 92.3 0.9 87.3 1.3 2.5 102.4 2.3 91.1 4.9 DON 75 109.3 1.8 109.7 2.7 HT-2 5 113.8 2.6 113.0 3.8 150 101.5 1.9 105.0 4.1 10 107.2 3.2 111.7 6.1 375 100.7 1.8 92.9 1.8 25 101.9 3.8 101.0 4.5 DON-3G 12.5 105.6 4.8 106.1 2.5 FB 10 87.7 5.5 94.3 8.2 25 88.8 2.1 97.2 4.2 20 70.9 6.0 86.0 8.1 62.5 93.5 6.2 85.7 1.6 50 85.5 5.7 91.4 5.4 3-AcDON 20 110.8 1.9 113.1 2.0 OTA 1 114.4 4.0 113.8 7.3 40 92.8 1.0 105.4 3.4 2 95.2 1.1 102.8 4.0 100 100.0 0.9 93.5 1.2 5 95.1 4.0 86.4 2.8 15-AcDON 10 115.9 2.7 115.9 3.1 T-2 1 119.5 2.4 114.9 2.3 20 102.1 1.4 106.5 3.2 2 108.8 4.0 112.1 4.2 50 103.4 1.1 97.2 1.9 5 99.6 3.5 97.4 3.3 AFG, 0.15 102.8 5.3 127.3 4.0 ZEN 10 116.7 1.5 107.6 2.8 0.3 105.5 6.1 106.2 3.0 20 106.9 1.7 105.3 6.0 0.75 96.1 4.0 93.5 2.8 50 106.0 1.9 95.2 2.0 AFG 0.5 118.7 3.1 128.2 2.8 ST 0.5 111.3 1.5 113.2 2.1 1 102.1 4.1 109.5 4.9 1 96.4 4.4 102.4 4.2 2.5 96.1 4.0 94.5 3.4 2.5 100.6 3.0 92.7 2.7 AFB, 0.15 129.4 5.5 104.9 4.8 表 7. FAPAS 样品的规定值与分析测定值 分析物 规定值(pg/kg) 测定值(ug/kg) DON 1247±193 1239.4 AFB, 5.42±1.19 5.2 FB: 797±202 760.3 FB, 360±91.5 330.3 T-2 160±33.7 145.7 HT-2 105±23.1 108.2 ZEN 286±55.2 303.4 OTA 2.4±0.53 2.3 UHPLC-MS/MS 电子方法(e-Method) 的使用 e-Method 介绍 液质联用多残留检测方法参数较多,实验室在建立新的LC-MS/MS 方法时,需要优化大量的仪器参数;在进行方法参数编辑时,也需要花费大量的时间和精力。为提高用户的工作效率,安捷伦科技依托液质联用系统的先进性能,并结合其质谱软件的独特功能,建立了可以实现plug-and-play”功能的 e-Method,实验操作人员只需确认仪器配置,选择相应的 e-Method,经过简单的调试后,即可进行样品采集和定量分析,大大节约了方法开发时间和使用难度,使实验室检测流程更加标准化,同时也更易于在实验室间推广应用。 e-Method包含以下三部分内容: ( 1.*.m文件:此为 MassHunter 采集软件可直接调用的方 法,此格式的方法文件中包含液相色谱参数、三重四极杆液质联用系统离子源参数和16种真菌毒素、14种稳 定同位素内标的多反应监测 MRM 模式的采集参数 ) 2.*.quantmethod.xml 文件:此为 MassHunter 定量分析软件可直接使用的目标化合物定量方法文件,16种真菌毒素采用内标法定量,同位素内标标准曲线的系列浓度设置符合粮油检测行业标准《粮油检测主要谷物中16种真菌毒素的测定》的规定 ( 3. .*.pdf文 件 :此文档中包含了 e-Method 的使用说明和备注 信息 ) e-Method 采集方法的调用 确认仪器配置,打开采集软件后,即可直接调用与仪器型号对应的*.m 采集方法文件。逐一检查液相部分和质谱部分的参数设置,即可进行样品分析。 采用该方法对标准曲线系列的浓度最低点标准溶液进样分析,检查每个化合物的保留时间以确认在具体的实验室条件下,方法中时间段的设置是否合适,如有必要,可根据实际出峰情况调整时间段起始时间点的设置;检查每个化合物的峰面积以确认方法中AEMV 的设置是否合适,如有必要,可根据实际出峰情况调整相应时间段 AEMV 的设置。 e-Method 定量方法的调用和更新 在进行定量分析时,打开 MassHunter Quantitative Analysis定量软件,选择新建 batch, 将准备进行定量分析的数据导入 batch 中。选中较高浓度的标准品数据,然后如图4所示调入e-Method 中的定量方法*.quantmethod.xml,进入定量方法的编辑界面。 Agilent MassHunter Quantitative Analysis (for QQQ)-Method-[C:\MassHunter\Methods\Mycotoxins] MethodUpdate Library Report Tools Help File Edit View AnalyzeeNNew 卜 Incurred Blank OffsettLayout: l Open Open Method from Existing File... Append 卜 Open Method from Existing Batch... Open and Apply from Existing File... vels: 11 国Edit F10 Validate 图4.定量方法的调用 在定量方法的编辑界面,如图5所示选择更新保留时间“Update Retention Times...”, 选择需要更新保留时间的化合物,一般选择“Select All”, 软件将自动根据实际采集的数据更新定量方法中的保留时间。按照类似的流程可以更新离子对比例“Update Qualifier Ratios...”。 Agilent MassHunter Quantitative Analysis (for QQQ)-Method -[C:AMassHunter\Methods\Mycotoxins] 图5.保留时间和离子对比例的更新 *.quantmethod.xml 文件中的16种真菌毒素的标准曲线系列浓度设置符合粮油检测行业标准《粮油检测主要谷物中16种真菌毒素的测定》的规定。实验人员也可以根据实际情况,在定量方法编辑界面“Concentration Setup”下更改标准曲线的系列浓度。 应用 e-Method 进行实验室间验证 采用本文建立的 e-Method 在国内外多个实验室进行了实验室间验证,涉及到的仪器包括 Agilent 6460/6470/6490/6495三重四极杆液质联用系统,均获得良好的结果,证明了检测方法的准确性和 e-Method 的可行性。 e-Method 的应用使LC-MS/MS 检测方法更容易在实验室间推广和标准化,使方法的建立与优化大大简化,仪器操作简便快速,有效缩短了分析周期并提高实验效率。 结论 本文建立了一个可实现快速、准确测定主要谷物中真菌毒素的分析方法,此方法成功应用于小麦、玉米、稻谷等主要谷物中16种真菌毒素的检测。方法采用乙腈-水-乙酸溶液(70:29:1, v/v/v) 进行样品提取,样品溶液经配有 EclipsePlus C18 色谱柱的 1290 Infinity ll液相色谱系统分离,使用配有安捷伦喷射流 (AJS)电喷雾离子源的安捷伦三重四极杆液质联用系统进行监测,同时采用14种1C标记的真菌毒素作为稳定同位素内标克服基质效应的影响,提高了方法的准确度。利用本文建立的方法对 FAPAS 阳性样品进行分析,测定值符合 FAPAS 的规定值。该方法前处理操作简单,耗时短,线性相关性良好,灵敏度、回收率和精密度都满足谷物中真菌毒素检测的需求,有望应用于谷物中真菌毒素的常规检测。 e-Method 的建立和应用简化了方法的开发,真正实现了“plug-and-play”的功能,有利于 LC-MS/MS 检测方法在实验室间的推广和标准化。 本文所述采用安捷伦三重四极杆液质联用系统测定谷物中16种真菌毒素的 e-Method 可从以下页面中获取: www.agilent.com/zh-cn/promotions/020617-mycotoxin-grain-cn ( 参考文献 ) ( 1. Huertas-Perez J F , Arroyo-Manzanares N, Gamiz-Gracia L , et a l.Simple and efficient methodology to determine mycotoxins in cereal syrups. Food Chemistry, 2015, 1 77(6):274-279 ) ( 2. Jinap S , Yibadatihan S, Mahyudin N A. Simultaneous determination of multi-mycotoxins in palm kernel cake (PKC)using liquid chromatography-tandem mass spectrometry (LC-MS/MS). Food Additives Contaminants. Part A, 2 0 14,31(14):2071-2079 ) ( 3. Hussein H S and B r asel J M . Toxicity, m etabolism, a n d impact ofmycotoxins on humans an d animals. Toxicol, 2001, 167:1 0 1-134 ) ( 4 . Bennett J W a n d Klich M. M y cotoxins. Clin. Microbiol. Rev. 2003, 16:497-516 ) ( 5. 宋卫得、苏征、惠希东等,液质联用技术在食品真菌毒素检测中的研究进展。食品工业科技,2016, 37(17):395-399 ) 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线:800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 本文中的信息、说明和技术指标如有变更,恕不另行通知。 @安捷伦科技(中国)有限公司,2017 2017年2月16日,中国印刷 5991-7862CHCN Agilent Technologies Agilent Technologies 本文采用安捷伦三重四极杆液质联用系统,建立了同时检测主要谷物中 16 种真菌毒素的分析方法。小麦、玉米、稻谷等样品经粉碎后采用乙腈-水-乙酸溶液(70:29:1,v/v/v)提取,样品溶液经 Agilent Eclipse Plus C18 色谱柱 (2.1 ×100 mm, 1.8 μm) 分离,使用配有安捷伦喷射流 (AJS) 电喷雾离子源的安捷伦三重四极杆液质联用系统进行监测,同时采用 14 种 13C 标记的真菌毒素作为稳定同位素内标来提高方法的准确度。本方法前处理操作简单,耗时短,线性相关性良好,相关系数 R2 > 0.996;在小麦、玉米基质中 16 种真菌毒素 3 个水平的加标回收率基本都在 85%-120% 之间,平行样品测定的 RSD 在 0.7%-8.2% 之间。采用本方法对 FAPAS 阳性样品进行测定,测定值符合 FAPAS 的规定值,验证了方法的准确性。在此基础上建立了同时测定 16 种真菌毒素的 UHPLC-MS/MS 电子方法 (e-Method),使方法建立与优化大大简化。通过在国内外多个实验室不同型号的安捷伦液质联用系统上采用 e-Method 进行实验室间验证,证实了检测方法的准确性和 e-Method 的可行性。
确定






还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《谷物中真菌毒素检测方案(液相色谱仪)》,该方案主要用于其他粮食加工品中真菌毒素检测,参考标准--,《谷物中真菌毒素检测方案(液相色谱仪)》用到的仪器有Agilent 1260 Infinity II Prime HPLC 液相色谱系统
推荐专场
相关方案
更多
该厂商其他方案
更多
















