本文采用胰蛋白酶酶解蛋白的方法,得到各种蛋白的肽谱,比较几款不同的反相色谱柱在分离蛋白酶解片断时的差异,同时借助质谱,评价蛋白酶解产物- 多肽在酸性或者碱性流动相条件下表现出分离性能的差异。
方案详情

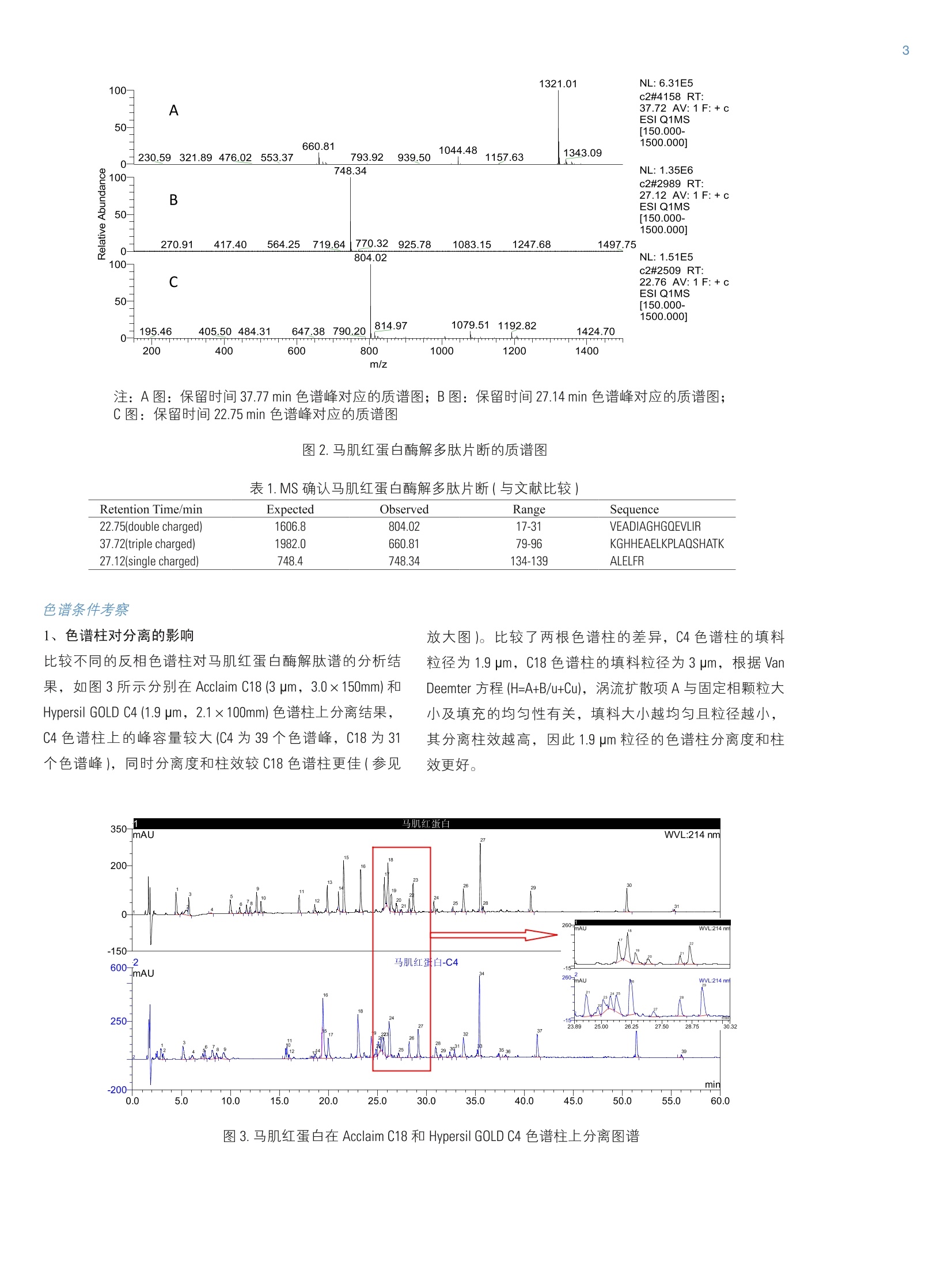
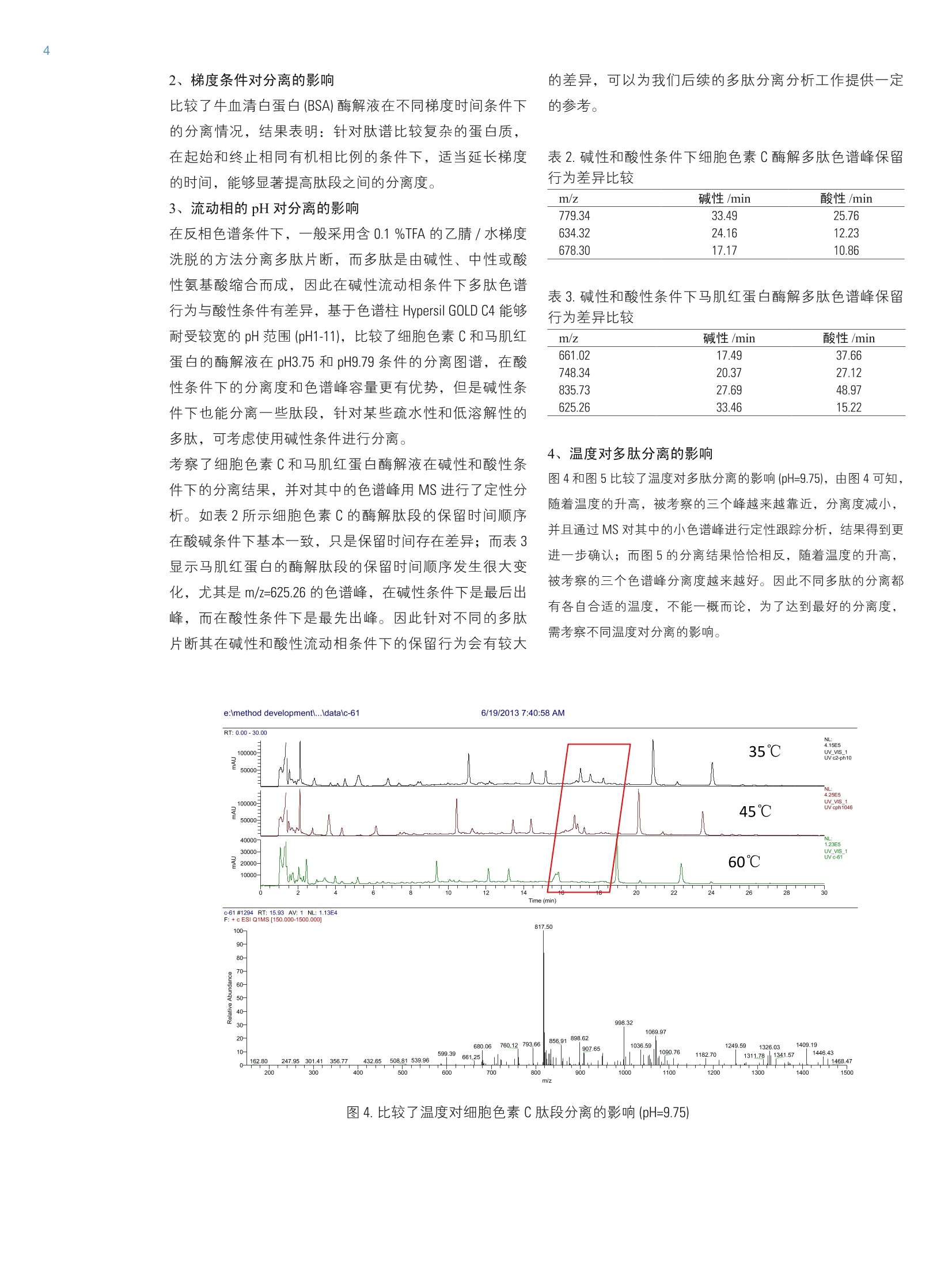
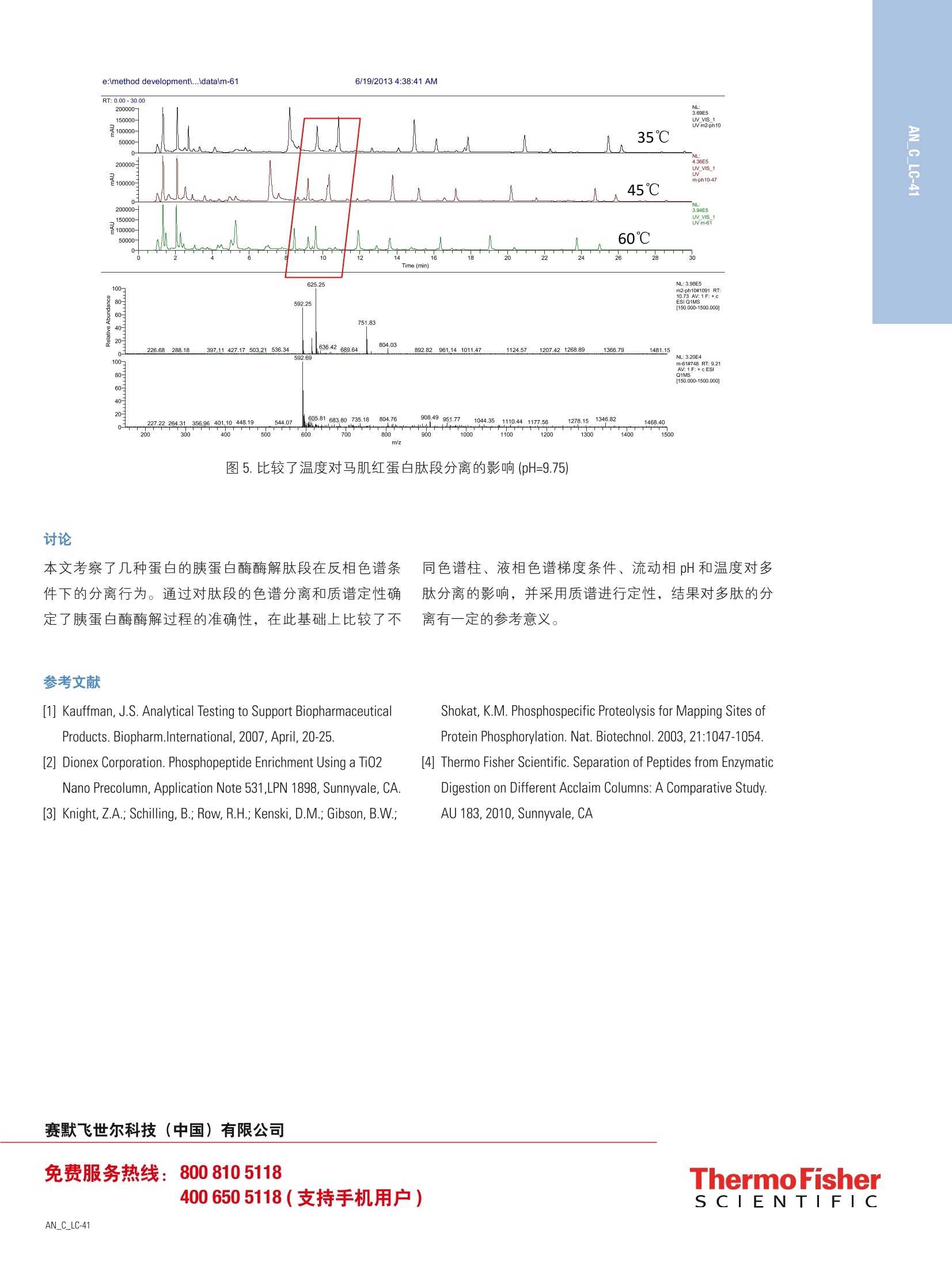
4 引言 在生物体内,蛋白的翻译后修饰过程是蛋白发挥各种不同生化功能的基础,这些翻译后修饰包括括基化、氧化、甲基化和磷酸化等。作为生物药物的蛋白在生产、运输、保存过程中会产生变体,从而影响到药物的活性和稳定性。因此蛋白的肽谱经常被用来研究蛋白的翻译后修饰过程以及蛋白变体的存在。同时也用于生物制药行业蛋白产品初级结构的确认13,从而更好地控制生化药品的质量和确保病人的用药安全。 本文采用胰蛋白酶酶解蛋白的方法,得到各种蛋白的肽谱,比较几款不同的反相色谱柱在分离蛋白酶解片断时的差异,同时借助质谱,评价蛋白酶解产物-多肽在酸性或者碱性流动相条件下表现出分离性能的差异。 仪器配置 Thermo Ultimate 3000 系统:泵:DGP-3600RS;自动进样器: WPS-3000TRS;柱温箱: TCC-3000RS;检测器: DAD-3000RS质谱: TSQ Vantage 色谱软件: Chromeleon 6.8 测试条件 与紫外检测器兼容的液相色谱条件 色谱柱: 1- Acclaim 120 C18, 3mmx150mm, 3pm(P/N063691,S/N001119);2-Acclaim 120 C8,2.1mm×100mm, 3pm (P/N059123,S/N001337);3-Hypersil GOLD C4, 2.1mm×150mm, 1.9pm(S/N1008512×7,LOT10603); 流动相::95%超纯水+5%乙腈+0.1%TFA:5%超纯水+95%乙腈+0.08%TFA,梯度洗脱: Time/min A/% B/% 0 98 2 40 40 60 40.1 20 80 45 20 80 45.1 98 2 60 98 2 流速:0.5mL/min (ID=3mm), 0.25 mL/min (ID=2.1mm) 分析时间:60 min 检测器波长:214nm 进样量:20uL 柱温:35℃与质谱兼容的液相色谱条件色谱柱: 1-Acclaim 120 C18, 3mmx150mm, 3pm (P/N063691,S/N001119);2-Acclaim 120 C8, 2.1mm×100mm, 3pm (P/N059123,S/N001337);3-Hypersil GOLD C4, 2.1mm×150mm, 1.9pm (S/N1008512×7,LOT10603); 流动相:A:2%乙腈,B: 98%乙腈, C: 10 mmol/L醋酸 铵,用乙酸调节 pH=3.75,D: 10mmol/L醋酸铵, 用氨水调节 pH=9.79,梯度洗脱: Time/min A/% B/% C/D% -5.0 78 2 20 0.0 78 2 20 60 30 50 20 60.1 0 80 20 65 0 80 20 65.1 78 2 20 75 78 2 20 分析时间: 60 min 质谱条件:离子化方式:: ESl, PositiveVoltage: 3000 V; Capillary Temperature: 350.0℃Vaporizer Temperature:400.0℃Sheath Gas Pressure: 40.0 arb,Ion Sweep GasPressure: 0 arbAuxiliary Gas Pressure: 12.0 arb; Scan Range: 150-1500 m/z 质谱扫描参数: Scan time 0.286 s 分辨率: Q1Peak Width 0.7 FWHM. 进样量: 20pL 柱温:35℃ 准备牛血清白蛋白(BSA)、马肌红蛋白、细胞色素C以及胰蛋白酶(Trypsin) 四种蛋白标准品。 胰蛋白酶酶解过程: 1、称量5mg蛋白到离心管中,加入1ml的6mol/L的盐酸胍溶液(盐酸胍固体溶解于100mmol/L的 NHHC03,pH=8.0),溶解混匀; 2、加入20 ul 的 0.5 mol/L 的二硫苏糖醇(DTT)到离心管中,混匀。在56℃保温60 min; 3、冷却到室温; 4、加入40 ul 的 0.5 mol/L 的碘乙酰胺到混合溶液中,混匀。避光在室温下放置 30 min; 5、加入80 pl的0.5 mol/L 的 DTT到混合溶液中,混匀。室温放置30 min; 6、透析(3.5KD分子量)烷基化的蛋白样品,在2L的50mmol/L 的甲酸铵溶液中室温透析24小时,其中更换一次透析溶液; 7、将2mg的胰蛋白酶溶解于200pl的碳酸氢铵溶液(0.1mol/L)中。取20 pl的胰蛋白酶溶液(1 ug/pl)到蛋白混合液中。混匀,37℃酶解20小时;在沸水中加热 15 min 终止酶解反应; 8、酶解液用 0.22 pm 有机滤膜过滤,直接上机分析。 结果和讨论 前处理过程的考察 1、胰蛋白酶酶解原理 利用蛋白水解酶可将蛋白质水解,产生小肽和多肽片断(一般将10个氨基酸以下的称为寡肽或者小肽,10个氨基酸以上的称为多肽)。胰蛋白酶为蛋白酶的一种,是肽链内切酶,选择地水解蛋白质中所有的由赖氨酸 (Lys) 或(精氨酸)Arg的羧基所构成的肽键。酶水解的优点是专一性强,利用不同的水解酶可有专一的切点,在蛋白质的一级结构的测定上非常有用。 2、胰蛋白酶酶解过程考察 按照样品前处理方法的胰蛋白酶酶解过程,分别对三种蛋白(细胞色素C、牛血清白蛋白和马肌红蛋白)进行酶解,处理后样品在反相色谱条件下进行分析。如图1所示为马肌红蛋白酶解液的液相色谱图,图2为其中几个色谱峰的MS定性图谱,表1将部分马肌红质谱数据与文献中的质谱数据进行比较,能够确认马肌红蛋白酶解的几个特征肽谱,表明胰蛋白酶酶解和分离的结果与文献④一致,满足分析要求。 TIC F:+c ESI Q1MS [150.000- 1500.0001 图1.马肌红蛋白酶解液液相色谱图 注:A图:保留时间37.77 min 色谱峰对应的质谱图;B图:保留时间 27.14 min 色谱峰对应的质谱图; C图:保留时间22.75 min 色谱峰对应的质谱图 图2.马肌红蛋白酶解多肽片断的质谱图 表1.MS确认马肌红蛋白酶解多肽片断(与文献比较) Retention Time/min Expected Observed Range Sequence 22.75(double charged) 1606.8 804.02 17-31 VEADIAGHGQEVLIR 37.72(triple charged) 1982.0 660.81 79-96 KGHHEAELKPLAQSHATK 27.12(single charged) 748.4 748.34 134-139 ALELFR 1、色谱柱对分离的影响 比较不同的反相色谱柱对马肌红蛋白酶解肽谱的分析结果,如图3所示分别在 Acclaim C18 (3um, 3.0×150mm)和Hypersil GOLD C4 (1.9 pm, 2.1×100mm) 色谱柱上分离结果,C4色谱柱上的峰容量较大(C4为39个色谱峰, C18为31个色谱峰),同时分离度和柱效较 C18色谱柱更佳(参见 放大图)。比较了两根色谱柱的差异,C4色谱柱的填料粒径为1.9 pm, C18 色谱柱的填料粒径为3pm,根据VanDeemter 方程(H=A+B/u+Cu),涡流扩散项A与固定相颗粒大小及填充的均匀性有关,填料大小越均匀且粒径越小,其分离柱效越高,因此1.9 pm 粒径的色谱柱分离度和柱效更好。 图3.马肌红蛋白在 Acclaim C18 和 Hypersil GOLD C4 色谱柱上分离图谱 2、梯度条件对分离的影响 比较了牛血清白蛋白(BSA)酶解液在不同梯度时间条件下的分离情况,结果表明:针对肽谱比较复杂的蛋白质,在起始和终止相同有机相比例的条件下,适当延长梯度的时间,能够显著提高肽段之间的分离度。 3、流动相的pH对分离的影响 在反相色谱条件下,一般采用含 0.1%TFA的乙腈/水梯度洗脱的方法分离多肽片断,而多肽是由碱性、中性或酸性氨基酸缩合而成,因此在碱性流动相条件下多肽色谱行为与酸性条件有差异,基于色谱柱 Hypersil GOLD C4 能够耐受较宽的 pH 范围(pH1-11),比较了细胞色素C和马肌红蛋白的酶解液在 pH3.75 和 pH9.79条件的分离图谱,在酸性条件下的分离度和色谱峰容量更有优势,但是碱性条件下也能分离一些肽段,针对某些疏水性和低溶解性的多肽,可考虑使用碱性条件进行分离。 考察了细胞色素C和马肌红蛋白酶解液在碱性和酸性条件下的分离结果,并对其中的色谱峰用 MS 进行了定性分析。如表2所示细胞色素C的酶解肽段的保留时间顺序在酸碱条件下基本一致,只是保留时间存在差异;而表3显示马肌红蛋白的酶解肽段的保留时间顺序发生很大变化,尤其是 m/z=625.26 的色谱峰,在碱性条件下是最后出峰,而在酸性条件下是最先出峰。因此针对不同的多肽片断其在碱性和酸性流动相条件下的保留行为会有较大 的差异,可以为我们后续的多肽分离分析工作提供一定的参考。 表2.碱性和酸性条件下细胞色素C酶解多肽色谱峰保留行为差异比较 m/z 碱性/min 酸性/min 779.34 33.49 25.76 634.32 24.16 12.23 678.30 17.17 10.86 表3.碱性和酸性条件下马肌红蛋白酶解多肽色谱峰保留行为差异比较 m/z 碱性 /min 酸性/min 661.02 17.49 37.66 748.34 20.37 27.12 835.73 27.69 48.97 625.26 33.46 15.22 4、温度对多肽分离的影响 图4和图5比较了温度对多肽分离的影响 (pH=9.75),由图4可知,随着温度的升高,被考察的三个峰越来越靠近,分离度减小,并且通过 MS 对其中的小色谱峰进行定性跟踪分析,结果得到更进一步确认;而图5的分离结果恰恰相反,随着温度的升高,被考察的三个色谱峰分离度越来越好。因此不同多肽的分离都有各自合适的温度,不能一概而论,为了达到最好的分离度,需考察不同温度对分离的影响。 图4.比较了温度对细胞色素C肽段分离的影响 (pH=9.75) 图5.比较了温度对马肌红蛋白肽段分离的影响(pH=9.75) 本文考察了几种蛋白的胰蛋白酶酶解肽段在反相色谱条件下的分离行为。通过对肽段的色谱分离和质谱定性确定了胰蛋白酶酶解过程的准确性,在此基础上比较了不 ( 参考文献 ) ( [1] K auffman, J.S. Analytical Testing to Support BiopharmaceuticalProducts. Biopharm.International, 2 0 07, April,20-25. ) ( [2] Dionex Corporation. P hosphopeptide Enrichment Using a Ti0 2 Nano Precolumn, Application Note 531,LPN 1898, Sunnyvale, CA. ) ( [3] K night, Z . A.; Schilling, B .; R ow, R . H. ; K e nski, D . M.; Gibson, B.W.; ) 同色谱柱、液相色谱梯度条件、流动相 pH和温度对多肽分离的影响,并采用质谱进行定性,结果对多肽的分离有一定的参考意义。 ( S hokat, K.M. P h osphospecific Pr o teolysis fo r Mapping Sites ofProtein Phosphorylation. Nat. Biotechnol. 2003,21:1047-1054. ) ( [4] T h ermo Fisher S c ientific. S eparation of Peptides from En z ymaticDigestion on Different Acclaim Columns: A Comparative Study. AU 183, 2010, Sunnyvale, CA ) ThermoFisherSCIENTIFIC SCIENTIFICAN_C_LC-
确定


还剩3页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《蛋白中胰蛋白酶酶解多肽产物的条件优化检测方案(液相色谱仪)》,该方案主要用于治疗类生物药品中含量测定检测,参考标准--,《蛋白中胰蛋白酶酶解多肽产物的条件优化检测方案(液相色谱仪)》用到的仪器有
相关方案
更多
该厂商其他方案
更多









