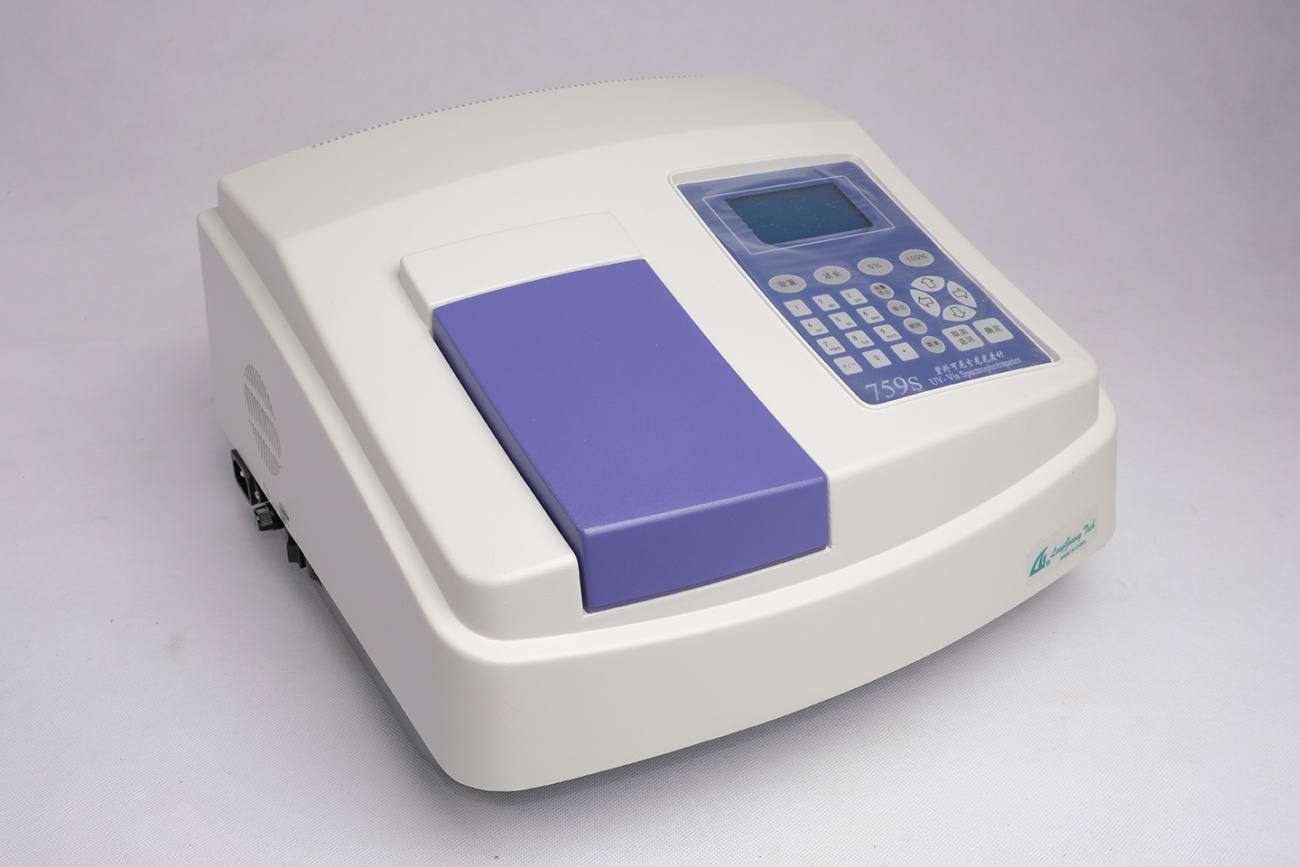
UV-1300分光光度法测液相反应的化学平衡常数UV-1300分光光度法测液相反应的化学平衡常数UV-1300分光光度法测液相反应的化学平衡常数
方案详情

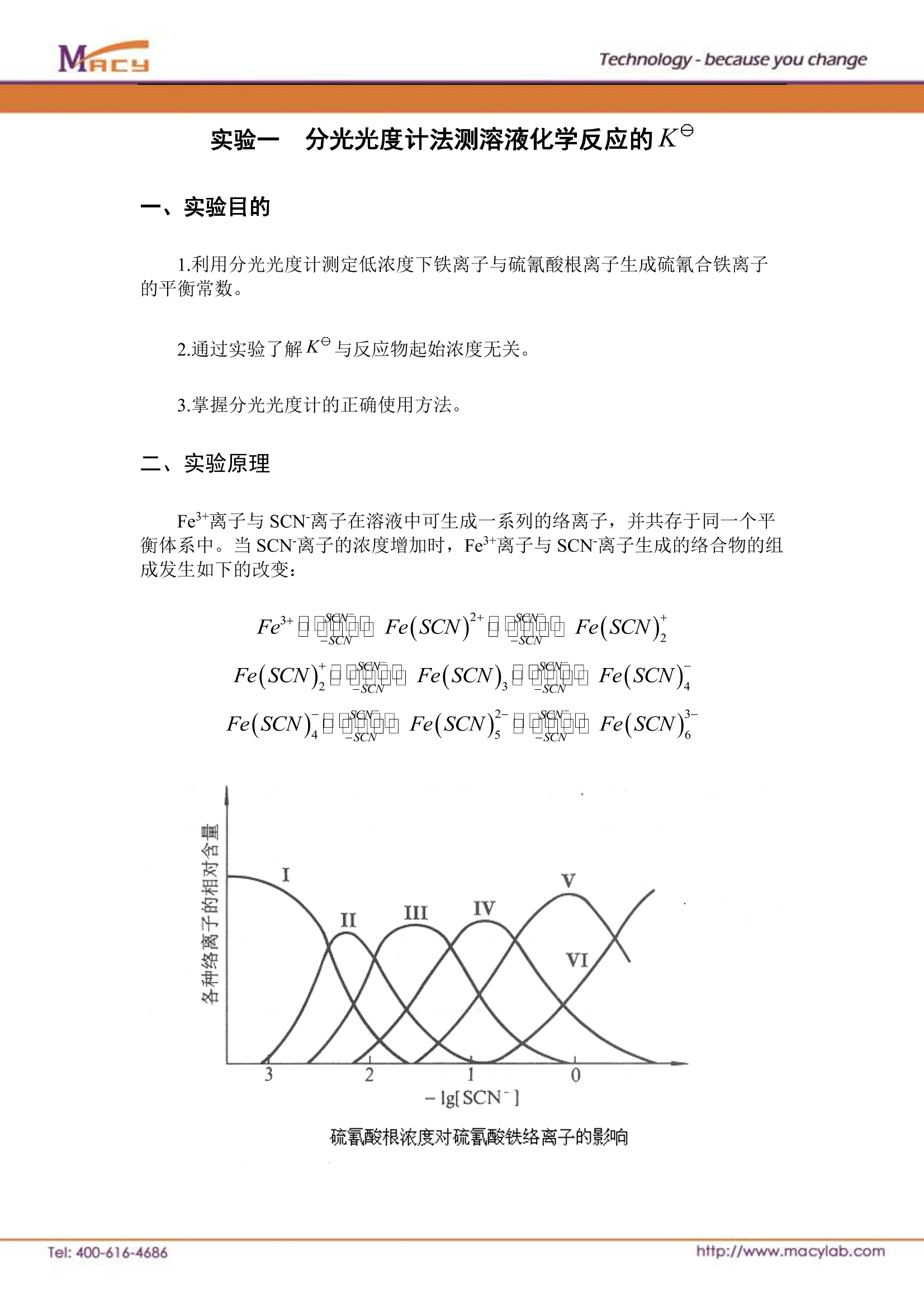
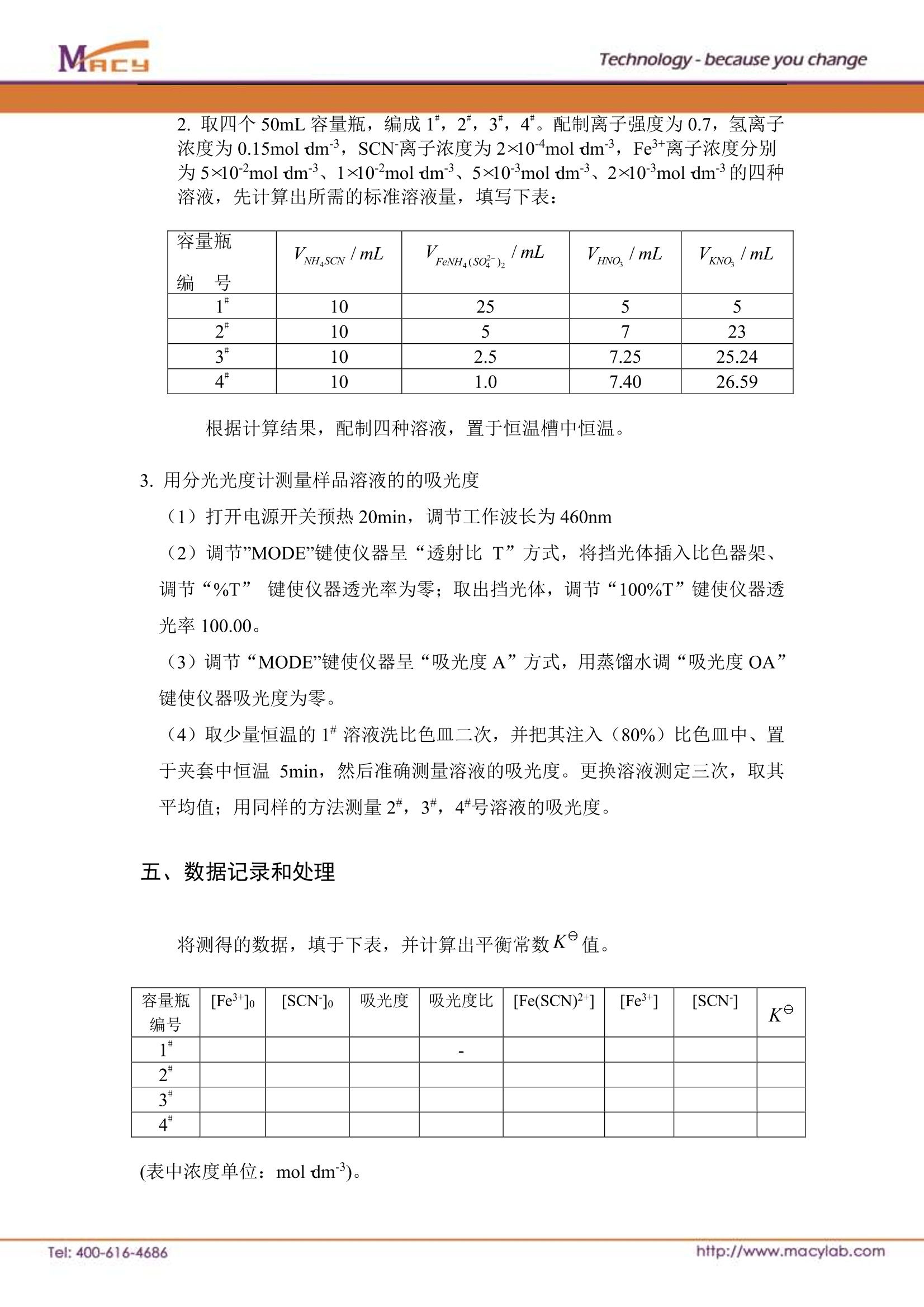
Technology-because you change 实验一5分光光度计法测溶液化学反应的K 一、实验目的 1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。 2.通过实验了解K°与反应物起始浓度无关。 3.掌握分光光度计的正确使用方法。 二、实验原理 Fe+离子与 SCN 离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。当 SCN离子的浓度增加时, Fe+离子与 SCN离子生成的络合物的组成发生如下的改变: 硫氰酸根浓度对硫氰酸铁络离子的影响 而这些不同的络离子颜色也不同。由图可知,当Fe3+离子与浓度很低的 SCN离子(一般应小于 5x10moldm-3)时,只进行如下反应: 即反应被控制在仅仅生成最简单的 Fe(SCN)2+络离子。其标准平衡常数 根据朗伯-比尔定律,吸光度与溶液中 Fe(SCN)2+络离子浓度成正比。 (A为吸光度,K为常数,L为液层厚度)。借助于分光光度计测定溶液的吸光度,可计算出平衡时 Fe(SCN)2+络离子的浓度以及Fe+离子和 SCN离子的浓度,从而求出该反应的平衡常数K。 由于: (1)Fe+离子在水溶液中存在下列水解平衡 达平衡时 K°与酸度有关。依此,各实验溶液的pH 值必须相同。 (2)溶液中离子反应的平衡常数受离子强度影响较大。依此,各被测溶液的离 子强度I=--mZ?必须保持一致。2 (3)CI、PO4等多种阴离子可与Fe+离子络合,降低 Fe(SCN)2+络离子浓度、减弱溶液颜色、甚至完全消失。依此,实验中必须设法避免C1、PO4等阴离子的参与。 三、仪器与药品 1.仪器 分光光度计1台(带自制恒温夹套);超级恒温槽1台;50mL容量瓶4只;移液管 10mL 支、25mL2支。 2.药品(A.R) 1×10mol dmNH4SCN(需准确标定); 0.1mol dmFeNH4(SO4)2(需准确标定Fe+浓度, 并加 HNO3 使溶液的 H*浓度为 0.1mol dm3); 1mol dmHNO3;1mol dm-KNO3。 四、操作步骤 1.将恒温夹套与恒温槽连接后放入分光光度计的暗合中。将恒温水调到(25±0.1)℃。 1,2一比色址槽:3.4一透光窗: 5一恒温水套:: 6.7一恒温循环水出人口 2.取四个50mL容量瓶,编成1,2,3,4。配制离子强度为0.7,氢离子浓度为 0.15mol dm3, SCN离子浓度为 2×10mol dm², Fe+离子浓度分别为5×10moldm3、1×10mol dm3、5×10mol dm3、2×10moldm²³的四种溶液,先计算出所需的标准溶液量,填写下表: 容量瓶编号 VNH,ScN /mL V i/mLFeNH(SO)2 Vnvo./mL VKNO,/mL 1* 10 25 5 5 2* 10 5 7 23 3” 10 2.5 7.25 25.24 4 10 1.0 7.40 26.59 根据计算结果,配制四种溶液,置于恒温槽中恒温。 3.用分光光度计测量样品溶液的的吸光度 (1)打开电源开关预热20min, 调节工作波长为 460nm (2)调节”MODE”键使仪器呈“透射比T”方式,将挡光体插入比色器架、调节“%T”键使仪器透光率为零;取出挡光体,调节“100%T”键使仪器透光率100.00。 (3)调节“MODE”键使仪器呈“吸光度A”方式,用蒸馏水调“吸光度OA”键使仪器吸光度为零。 (4)取少量恒温的1#溶液洗比色皿二次,并把其注入(80%)比色皿中、置于夹套中恒温 5min, 然后准确测量溶液的吸光度。更换溶液测定三次,取其平均值;用同样的方法测量2#,3#,4#号溶液的吸光度。 五、数据记录和处理 将测得的数据,填于下表,并计算出平衡常数K值。 容量瓶编号 [Fe+]o [SCN-]o 吸光度 吸光度比 [Fe(SCN)2+] [Fe+] [SCN-] K 1# 一 2* 3# 4* (表中浓度单位: mol dm3)。 按 Fe+ 十 SCN Fe(SCN)+ 对1容量瓶Fe+离子与 SCN离子反应达平衡时,可认为 SCN离子全部消耗,此平衡时硫氰合铁离子的浓度 [Fe(SCN)2+]等于开始时硫氰酸根离子的浓度: 以1*溶液的吸光度为基准,则对应于2,3,4"溶液的吸光度可求出各吸光度比,而2,3,4*各溶液中 [Fe(SCN)2+]、[Fe+]、[SCN-]可分别按下式求得: [SCN]=[SCN-]o-[FeSCN2+] 六、注意事项 1.使用分光光度计时,先接通电源,预热20min。为了延长光电管的寿命,在不测定数值时,应打开暗盒盖。 2.使用比色皿时,应注意溶液不要装得太满,溶液约为80%即可。并注意比色皿上白色箭头的方向,指向光路方向。 3.温度影响反应平衡常数,实验时体系应始终恒温。 4.实验用水最好是二次蒸馏水。 【思考题】 1.如果Fe+、SCN离子浓度较大时则不能按公式 计算K值,为什么? 2.为什么可用 [FeSCN2+]=吸光度比·.SCN-r1来计算[Fe(SCN)*]? Tel: ttp://www.macylab.com http://www.macylab.comTel:
确定




还剩4页未读,是否继续阅读?
上海美析仪器有限公司为您提供《UV-1300分光光度法测液相反应的化学平衡常数》,该方案主要用于其他中--检测,参考标准--,《UV-1300分光光度法测液相反应的化学平衡常数》用到的仪器有美析UV-1300紫外可见分光光度计、美析紫外可见分光光度计UV-1300PC
推荐专场
相关方案
更多
该厂商其他方案
更多