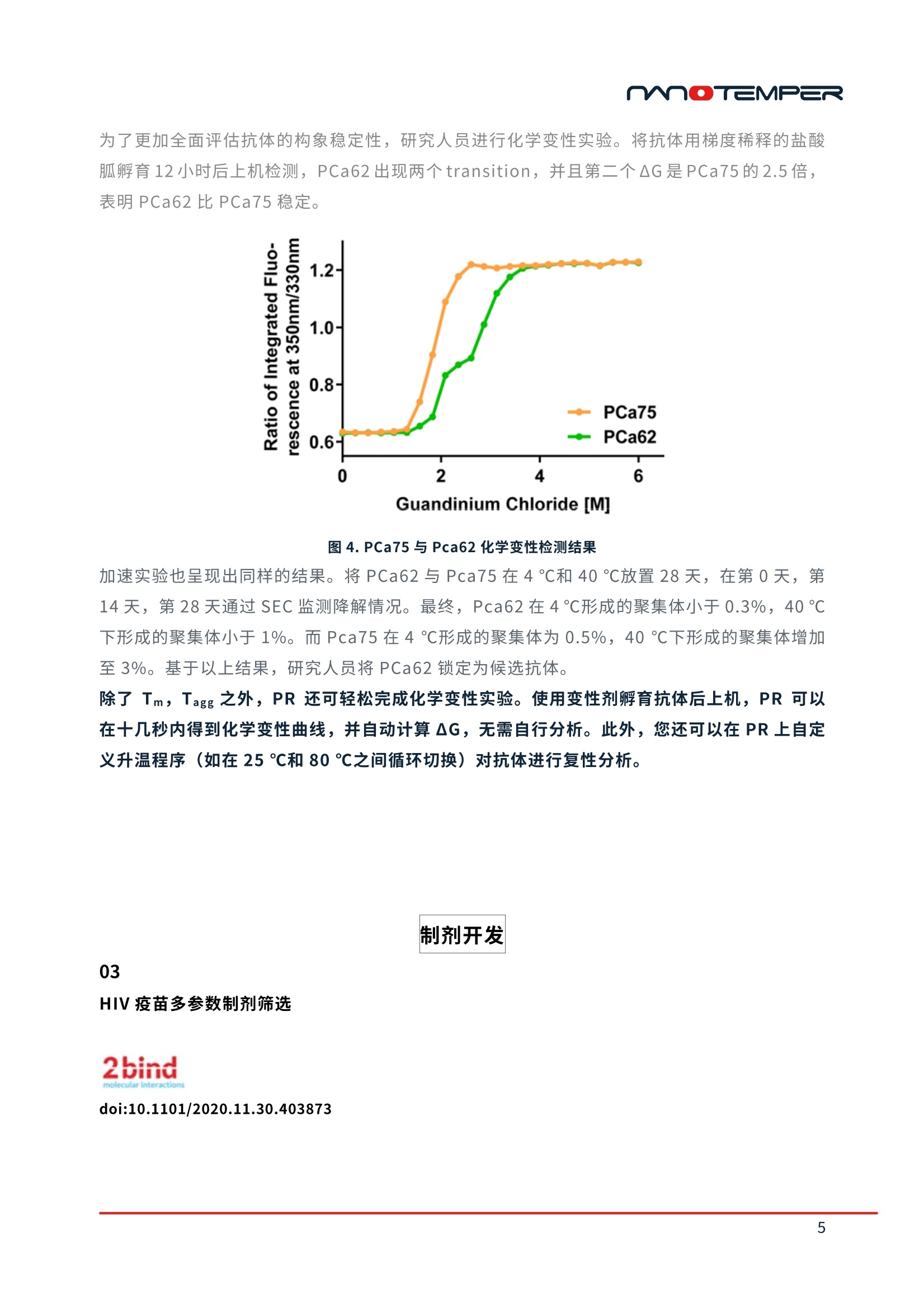
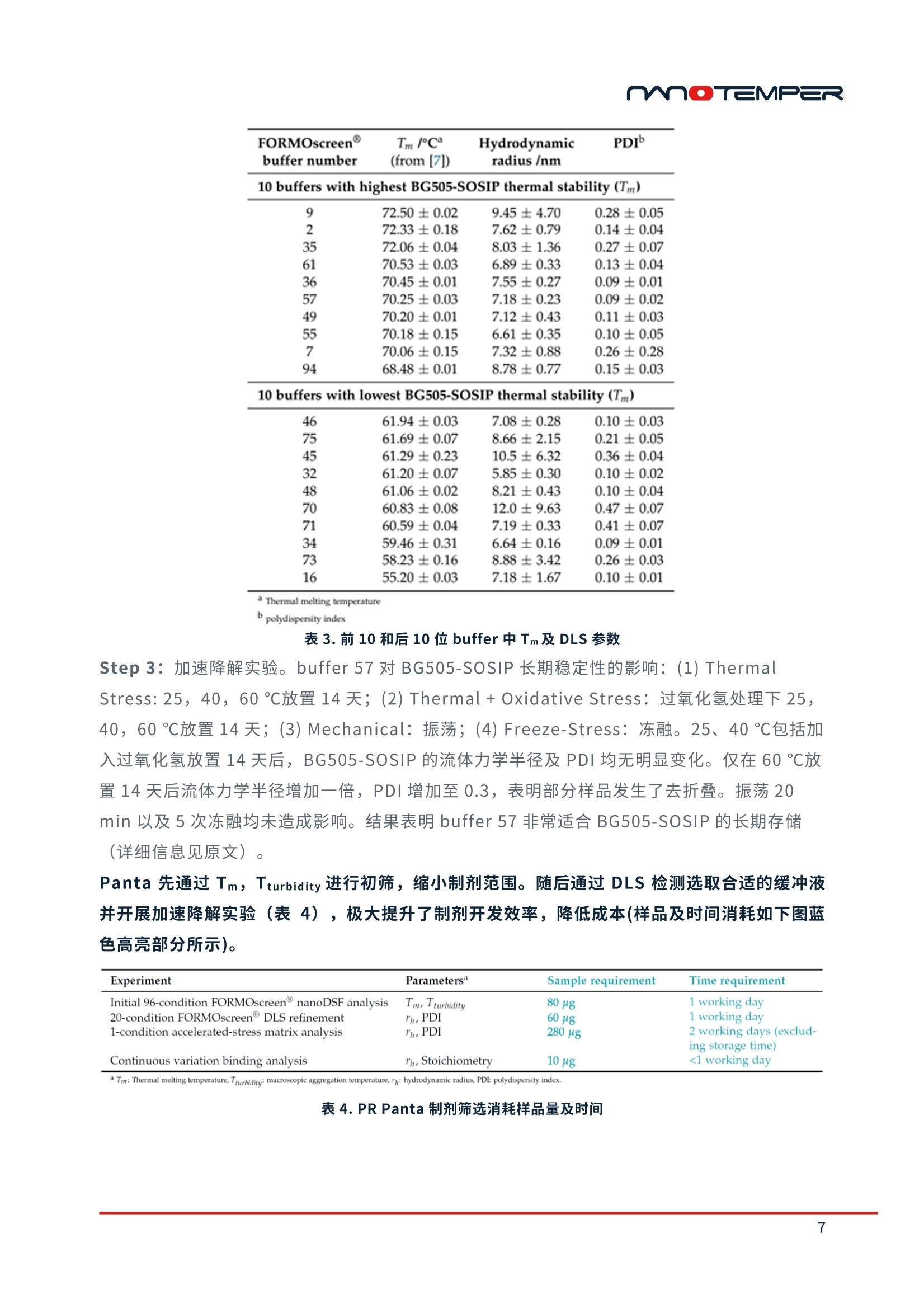
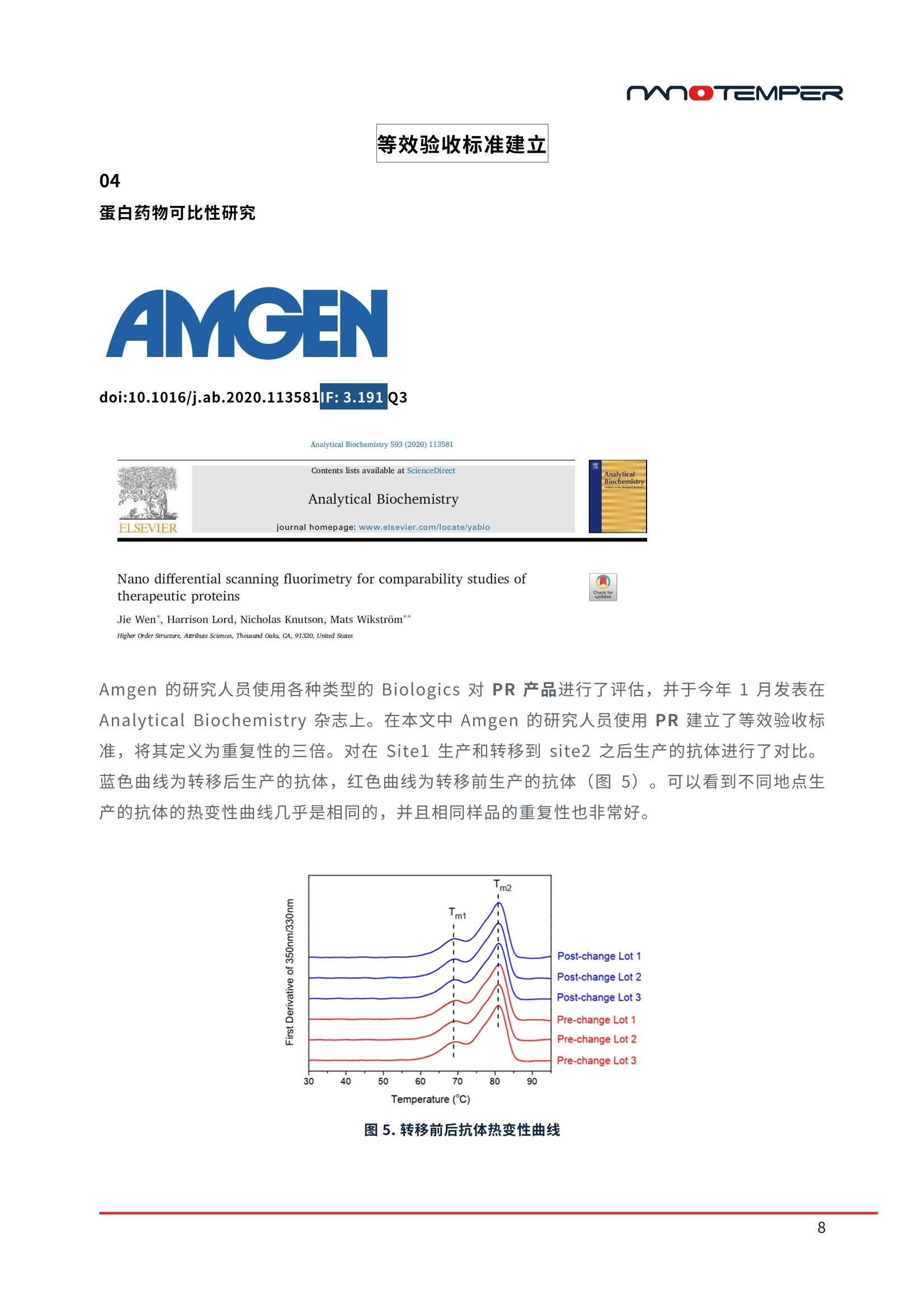
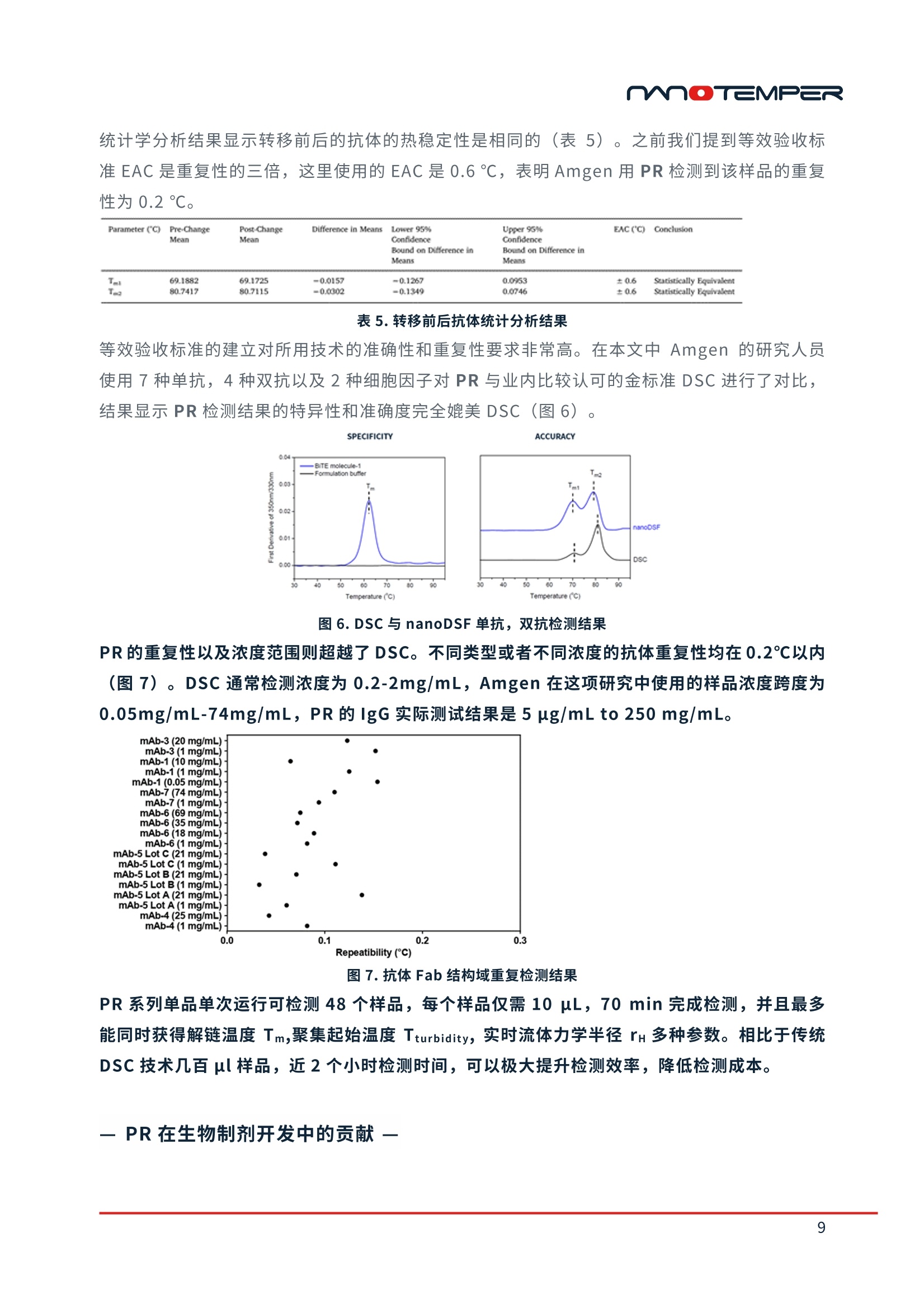
精选案例 | PR系列蛋白稳定性分析仪过去,很多生物制药企业主要基于生物学活性来筛选生物药候选分子,却极少在研发前期考量其可生产性等因素。致使很多前期给予厚望的候选分子在后期生产工艺开发阶段时,遇到稳定性等技术方面的困难,使其无法顺利商业化,从而导致大量资源消耗及低效研发回报率。近来,越来越多的研发机构开始将生物药尤其是抗体稳定性纳入前期开发流程中以便及早降低其开发风险。今天小编将和大家分享并一起学习Merck、Janssen、Amgen等知名药企在以下3个研究领域中的应用案例:1) 抗体可开发性评估;2) 制剂开发;3) 等效验收标准建立的工作流程。抗体可开发性评估01通过早期发现筛选预测抗体可开发性doi:10.1080/19420862.2020.1743053IF: 6.440 Q22020年3月,Merck的研发人员在mAbs杂志发表了抗体可开发性评估流程(图1)。在早期筛选阶段,使用高通量分析方法对152个单克隆抗体进行表征(如纯度、热稳定性、结合活性等),后将大量实验数据上传至数据管理系统,进行关联分析排序,从而有效选择出最小风险的抗体进行下游开发(图2)。图1. 高通量分析表征,可开发性数据管理系统制作关联分析热图,根据关联性强弱进行分群(图2)。相关系数为1,红色区域为强烈的正相关;相关系数为0,灰色区域无相关性;相关系数为-1,蓝色区域为强烈的负相关。图2. spearman相关系数热图表1为相关性最高的实验结果(如spearman相关系数ρ>0.5,p<0.001),解链起始温度Tonset,解链温度Tm以及聚集起始温度Tagg有很高的相关性,并且Tonset,Tm及Tagg与高等电点,抵抗聚集体形成之间呈现非常强的关联,接下来研究人员将这些指标应用到抗体的筛选中。表1. 相关性最强的实验结果mAb87,由低pH调节到7时出现白色沉淀,造成20%的蛋白损失并出现2%可溶性聚集,可能是因为pI较低造成。随后研究人员generate了9个variants以提高pI。根据10种抗体的热稳定性Tm,SEC,毛细管电泳等检测结果(图3),发现mAb107(红框处)的纯度、热稳定性、聚集倾向以及等电点均有明显的提升。图3. mAb87及其variants可开发性比较选取mAb87,mAb107及其突变体mAb111进行纯化检测,研究人员发现mAb107及其突变体mAb111几乎所有的下游工艺开发属性均得到了提升,如溶解度提升,自相互作用变弱。50 ℃放置10天后,流式细胞仪计算颗粒数量,从mAb87的8053个降低至不到2000个(详细信息见原文)。结果表明通过SEC、热稳定性Tonset、Tm、胶体稳定性Tagg进行早期的可开发性属性评估,可以快速锁定有效的候选分子。在进行早期可开发性评估时,通常可用于检测的样品量较少并且需要检测结合活性、稳定性等多种参数。PR只需10 μL样品,一次运行可检测48个样品并同时得到解链起始温度Tonset、解链温度Tm、聚集起始温度Tagg三种关键参数,帮助用户降低成本,提升筛选效率,快速发现最合适的候选抗体。02提高前列腺癌靶向抗体的稳定性doi:10.1038/s41598-020-66636-zIF: 4.996 Q2Janssen使用转基因鼠生产靶向前列腺癌抗原的抗体PCa75,PCa75表现出良好的功能属性,与靶标的亲和力为247 pM。但Fab片段的Tm仅有61.8 ℃(图4),其热稳定性与胶体稳定性并不理想。因此研究人员generate了10个突变抗体,对其稳定性、结合活性及免疫原性进行了对比。其中PCa62 Fab Tm及Tagg显著提升。EpiMatrix score结果(表2)也显示PCa62免疫原性风险较低(EpiMatrix score>20更易产生免疫原性,score<-20则倾向免疫惰性)。综合以上结果,研究人员认为PCa62是最有希望成药的分子。表2. 抗体EpiVax scores,Fab Tm,Tagg检测结果为了更加全面评估抗体的构象稳定性,研究人员进行化学变性实验。将抗体用梯度稀释的盐酸胍孵育12小时后上机检测,PCa62出现两个transition,并且第二个ΔG是PCa75的2.5倍,表明PCa62比PCa75稳定。图4. PCa75与Pca62化学变性检测结果加速实验也呈现出同样的结果。将PCa62与Pca75在4 ℃和40 ℃放置28天,在第0天,第14天,第28天通过SEC监测降解情况。最终,Pca62在4 ℃形成的聚集体小于0.3%,40 ℃下形成的聚集体小于1%。而Pca75在4 ℃形成的聚集体为0.5%,40 ℃下形成的聚集体增加至3%。基于以上结果,研究人员将PCa62锁定为候选抗体。除了Tm,Tagg之外,PR还可轻松完成化学变性实验。使用变性剂孵育抗体后上机,PR可以在十几秒内得到化学变性曲线,并自动计算ΔG,无需自行分析。此外,您还可以在PR上自定义升温程序(如在25 ℃和80 ℃之间循环切换)对抗体进行复性分析。制剂开发03HIV疫苗多参数制剂筛选doi:10.1101/2020.11.30.403873据统计,有约60%的公司遭遇过制剂开发问题导致的项目延迟甚至失败,尽早启动制剂开发能够帮助企业降低药物研发风险。近期2bind公司借助NanoTemper今年刚上市的PR Panta完成了HIV-1疫苗BG505-SOSIP的制剂开发,预印本已发布于bioRxiv。2bind的研究人员使用FORMOscreen® buffer筛选试剂盒与NanoTemper的Panta仪器寻找能够提升HIV-1疫苗BG505-SOSIP热稳定性,均一性及耐受性的制剂条件。Step 1: 检测BG505-SOSIP在96中buffer中的解链温度,与BG505-SOSIP在PBS中的Tm(65.7 ℃)进行对比(表3), buffer 9中其Tm增加了6.8 ℃,而buffer 16中Tm降低了10.5 ℃。Step 2:通过Panta的DLS模块测定了Tm排序前10和后10样品的流体力学半径和多分散性指数PDI。buffer 9中Tm最高,但其流体力学半径和标准偏差都是Tm排序前10中最大的, PDI为0.28表明样品是不均一的*。buffer 57的Tm比buffer 9低2.25℃,但57的流体力学半径为7.18 nm,PDI仅有0.09,表明样品高度均一。因此,buffer 57是目前最佳的制剂条件。* Note:PDI<0.1表示样品高度均一0.1<PDI<0.25表示样品均一性较好PDI>0.25表明样品不均一,出现聚集表3. 前10和后10位buffer中Tm及DLS参数Step 3:加速降解实验。buffer 57对BG505-SOSIP长期稳定性的影响:(1) Thermal Stress: 25,40,60 ℃放置14天;(2) Thermal + Oxidative Stress:过氧化氢处理下25,40,60 ℃放置14天;(3) Mechanical:振荡;(4) Freeze-Stress:冻融。25、40 ℃包括加入过氧化氢放置14天后,BG505-SOSIP的流体力学半径及PDI均无明显变化。仅在60 ℃放置14天后流体力学半径增加一倍,PDI增加至0.3,表明部分样品发生了去折叠。振荡20 min以及5次冻融均未造成影响。结果表明buffer 57非常适合BG505-SOSIP的长期存储(详细信息见原文)。Panta先通过Tm,Tturbidity进行初筛,缩小制剂范围。随后通过DLS检测选取合适的缓冲液并开展加速降解实验(表4),极大提升了制剂开发效率,降低成本(样品及时间消耗如下图蓝色高亮部分所示)。表4. PR Panta制剂筛选消耗样品量及时间等效验收标准建立04蛋白药物可比性研究doi:10.1016/j.ab.2020.113581IF: 3.191 Q3Amgen的研究人员使用各种类型的Biologics对PR产品进行了评估,并于今年1月发表在Analytical Biochemistry杂志上。在本文中Amgen的研究人员使用PR建立了等效验收标准,将其定义为重复性的三倍。对在Site1生产和转移到site2之后生产的抗体进行了对比。蓝色曲线为转移后生产的抗体,红色曲线为转移前生产的抗体(图5)。可以看到不同地点生产的抗体的热变性曲线几乎是相同的,并且相同样品的重复性也非常好。图5. 转移前后抗体热变性曲线统计学分析结果显示转移前后的抗体的热稳定性是相同的(表5)。之前我们提到等效验收标准EAC是重复性的三倍,这里使用的EAC是0.6 ℃,表明Amgen用PR检测到该样品的重复性为0.2 ℃。表5. 转移前后抗体统计分析结果等效验收标准的建立对所用技术的准确性和重复性要求非常高。在本文中Amgen的研究人员使用7种单抗,4种双抗以及2种细胞因子对PR与业内比较认可的金标准DSC进行了对比,结果显示PR检测结果的特异性和准确度完全媲美DSC(图6)。图6. DSC与nanoDSF单抗,双抗检测结果PR的重复性以及浓度范围则超越了DSC。不同类型或者不同浓度的抗体重复性均在0.2℃以内(图7)。DSC通常检测浓度为0.2-2mg/mL,Amgen在这项研究中使用的样品浓度跨度为0.05mg/mL-74mg/mL,PR的IgG实际测试结果是5 µg/mL to 250 mg/mL。图7. 抗体Fab结构域重复检测结果PR系列单品单次运行可检测48个样品,每个样品仅需10 μL,70 min完成检测,并且最多能同时获得解链温度Tm,聚集起始温度Tturbidity, 实时流体力学半径rH多种参数。相比于传统DSC技术几百μl样品,近2个小时检测时间,可以极大提升检测效率,降低检测成本。— PR在生物制剂开发中的贡献 —— 参考文献 —Bailly M , Mieczkowski C , Juan V , et al. Predicting Antibody Developability Profiles Through Early Stage Discovery Screening. mAbs, 2020, 12(1):1743053. Venkataramani S , Ernst R , Derebe M G , et al. In Pursuit of Stability Enhancement of a Prostate Cancer Targeting Antibody Derived from a Transgenic Animal Platform. Scientific Reports, 2020, 10.Corinna P, et al. Multi-parameter formulation development for an HIV-vaccine protein with direct validation of epitope binding integrity and stoichiometry. bioRxiv, 2020.Wen J , Lord H , Knutson N , et al. Nano differential scanning fluorimetry for comparability studies of therapeutic proteins. Analytical Biochemistry, 2020, 593:113581.moTEMPER M O TEMPER 精选案例|PR系列蛋白稳定性分析仪 过 去 ,很多生物制药企业主要基于生物学活性来筛选生物药候选分子,却极少在研发前期考量 其可 生产 性 等因素。致使很多前期给予厚望的候选分子 在 后期生产工艺开发阶 段 时,遇到稳定 性等技术方面的困 难,使 其无法顺利商业化,从而导致大量资源消耗及低效研发回报率。近 来,越来越多的研 发 机构 开 始将生物药尤其是抗体稳定性纳入前期开发流程中 以 便及早降低其 开发风险。 今 天 小编将和大家分 享 并一起学 习 M erck 、J ansse n 、A m ge n 等 知 名 药企在以下3个研究领 域 中 的应用案 例 : 1)抗体 可 开发性评 估; 2)制剂 开 发; 3)等效 验 收标准建立的 工 作流 程 。 抗体可开发性评估 01 通过早期发现筛选预测抗体可开发性 mAbs ISSN: 1942-0862 (Pr i nt ) 1942-0870 (Online ) journal homepage : h t tps://www.tandfo n l i n e.com/l oi /kmab20 Predicting Antibody Developability Profiles Through Early Stage Discovery Screening Marc Bailly, Carl Mieczkowski, Veronica Juan, Essam Metwally, Daniela Tomazela,Jeanne Baker , Makiko Uchida, Ester Kofman, Fahimeh Raoufi ,Soha Motlagh, Yao Yu, j ihea Park, Smita Raghava,j ohn Welsh, Michael Rauscher, Gopalan Raghunathan, Mark Hsieh ,Yi-Ling Chen, Hang Thu Nguyen,Nhung Nguyen, Dan Cipriano & Laurence Fayadat-Dilman 2020年 3月,Me r c k 的研发人员在 mA b s 杂志发表了抗体可开发性评估流程(图1)。在早 期筛选阶段,使用 高 通量分析方法对152个单克隆抗体进行表征(如纯度、热稳定性、结合活 性等),后将 大 量实验数据上传至数据管理系统,进行关联分析排序,从 而 有效选择出最小风险 的抗体进行下游开发(图2)。 图1.高通量分析表征,可开发性数据管理系统 制作 关 联分析热图 ,根据关联性强弱进行分群(图 2)。相 关 系数为 1,红色区域为强烈的 正 相 关;相关系数为 0,灰色区域无相 关 性;相关系数为-1,蓝色区域为强烈的 负 相关。 图 2. spearman 相关系数热图 表1为相 关 性最高的实验结 果 (如 sp e arman 相 关 系数 p >0.5, p <0.001) ,解链起始温 度 Tonset,解链温度 T m 以 及聚 集 起始温度 Ta gg 有 很 高 的相 关 性,并且 T o ns et , T m 及 Tag g 与 高 等 电 点,抵抗聚集体形成之间 呈 现 非 常强 的 关 联,接 下 来研究人员将这些 指 标应用到抗体的筛选 中。 Variable by Variable Spearman p P-Value Pearsonr P-Value cIEF pl Nano-DSF Tonset(Q 0.7642 <.0001 0.7498 <.0001 UP-SEC Low pH Retention time (min) HIC Retention time (min) 0.7479 <.0001 0.7489 <.0001 Nano-DSF Tagg (C) Nano-DSF Tm1 (℃) 0.7299 <.0001 0.7952 <.0001 Nano-DSF Tm1(C) Nano-DSF Tonset(Q 0.7243 <.0001 0.7901 <.0001 UP-SEC Low pH (% main) Nano-DSF Tonset (Q 0.7203 <.0001 0.6632 <.0001 cIEF pl UP-SEC Low pH (% main) 0.6725 <.0001 0.6399 <.0001 Nano-DSF Tagg(℃ Nano-DSF Tonset(Q 0.6698 <.0001 0.7362 <.000 UP-SEC Low pH Retention time (min) UP-SEC Low pH (% main) 0.6386 <.0001 0.4945 <.0001 UP-SEC Low pH (% main) UP-SEC Retention time (min) 0.5790 <.0001 0.3925 <.0001 clEF pl Nano-DSF Tm1 (℃ 0.5669 <.0001 0.6723 <.0001 clEF pl Nano-DSF Tagg (Q 0.5489 <.0001 0.6603 <.0001 UP-SEC Low pH (% main) Nano-DSF Tm1 (℃) 0.5488 <.0001 0.6077 <.0001 UP-SEC Low pH Retention time (min) UP-SEC Retention time (min) 0.5317 <.0001 0.7948 <.0001 表1.相关性最强的实验结果 mA b 87, 由低 pH 调节到 7时出现白 色 沉淀,造成20%的蛋白损失并出现 2%可 溶性聚集,可 能是因为 p l 较低造成。随后研究人员 ge n er at e 了 9 个 v a ri an t s 以提高 pl 。根据10种抗体 的热稳定性 T m, S EC, 毛细管电泳等检测结 果 (图3)),发现mA b107(红 框处)的纯度、热 稳定性、聚集 倾 向以及等电点均 有 明显的提升。 mAbBVariants %PuritybyUP-SEC Tmonset(C) Tm(Fab)(C) Tagg %PuritybyNRCE-SDS AC-SINSOAmax(nm))in PBSpH7.4 AC-SINSAAmax(nm))insodiumacetatepH 5.5 %PuritybyHP-RP plmeasuredby clEF VH1 M64VIVL2IgG4S228P(mAb87) 955 558 63.7 627 94.1 534 555 928 633 VH1 M64VIVL2 mutatedIgG1(mAb102) 949 604 658 642 100 536 563 959 7.76 VH1 M64V1VL5 mutatedIgG1(mAb103) 961 621 676 661 993 537 548 972 862 VH1 M64VIVlLG6 1mutated(mAb104) 902 556 619 572 993 537 542 949 884 VH1 M64VIVL7 mutatedlgG1(mAb105) 944 596 653 639 993 538 545 95.1 88 VH1 M64V1VL8 mutatedIgG1(mAb1061 94.1 59.1 652 652 993 537 548 953 885 VH1 M64VIVS2L258IgPG4(mAb107) 982 57.9 65.7 64.1 100 541 576 974 721 VHTM64VTVL6IgG4S228P(mAb108) 91.7 54.9 61.1 584 100 537 575 949 745 VH1 M64VIVL7 IgG4S228P(mAb109) 978 57.9 642 61.7 100 537 575 974 745 VH1 M64V1VL8IgG4S228P(mAb110) 973 581 641 59.8 100 538 576 974 7.45 O pti m al P r operties In t e r m e d i ate P rop e r t ies Su b opt i mal Prop e r f i e s 图3.mAb87 及其 variants 可开发性比较 选取 m A b87, mA b 107 及其突变 体 m Ab 111进行纯化检测,研究人员 发 现 mA b107 及 其突 变体 m A b 111 几 乎所 有 的下游工艺开发属性均得到了提升,如溶解度提升,自 相互作 用 变弱。50℃放置 10天后,流式 细 胞仪 计 算颗粒数量,从 m A b 87的8053个 降低至不到2000个(详 细信息见原文)。结果表明通过 SE C 、热稳定性 T ons e t、T m、胶体稳定性 Tagg 进行早期的可开 发 性 属性评 估,可以快速锁定 有 效的候选分子。在进行早期可开发性评估时,通常可用于检测 的样品量较少并且需要检测结合活性、稳定性等多种参数。PR 只需 10 uL样品,一次运行可 检测48个样品并同时得到解链起始温度 Tonset、解链温度Tm、聚集起始温度 Tagg 三种关键参 数,帮助用户降低成本,提升筛选效率,快速发现最合适的候选抗体。 提高前列腺癌靶向抗体的稳定性 www .na t ur e.co m /sc i e n ti f i c r e po r t s SCIENTIFIC REPORTS n at u r erese a rch Q C heck for upd a tes OPEN In Pursuit of Stability Enhancement of a Prostate Cancer Targeting Antibody Derived from aTransgenic Animal Platform SathyaVenkataramani,Robi n Ernst , Mehabaw Getahu n Derebe , Rober t Wright ,Jes s ica Kopenhaver,StevenA . J acobs , Sa n jaya Sing h &RajkumarGanesan Janssen 使用转基因鼠生产靶向前列腺癌抗原的抗体 PCa75, PCa75 表现出良好的功能属 性,与靶标的亲和力为247p M。但 Fab 片段的Tm仅有61.8℃(图4),其热稳定性与胶体 稳定性并不理想。因此研究人员 generate 了 10个突变抗体,对其稳定性、结合活性及免疫 原性进行了对比。其中 PCa62 Fab Tm 及 Tagg显著提升 。EpiMatrix score 结果(表2)也显 示 PCa62 免疫原性风险较低 ((EpiMatr i x score>20 更易产生免疫原性, score<-20 则倾向免 疫惰性)。综合以上结果,研究人员认为 PCa62 是最有希望成药的分子。 Variants HC mutations LCmutation EpiVaxScore(HeavyChain) EpiVaxScore(LightChain) Fab(Tm)C mAb(Tagg)C Kp(SPR,pM) 14 20 81 1 PCa75 R P H A 1.99 -19.3 61.8 61.5 247.0 PCa46 P L Q A -44.3 -19.3 68.3 70.5 279.2 PCa47 P L H A -8.9 -19.3 68.1 70.2 284.5 PCa50 R L Q A -29.6 -19.3 66.2 67.8 281.6 PCa51 R L H A 5.75 -19.3 65.9 68 298.6 PCa60 R L Q A -29.6 -33.6 69.7 72.3 323.9 PCa62 P L Q D -44.3 -33.6 69.4 75.7 323.3 PCa63 P L H D -8.93 -33.6 69.6 75.6 325.3 PCa64 P P Q D -37.3 -33.6 68.2 70 372.3 PCa65 P P H D -2.02 -33.6 68.5 70 405.8 PCa66 R L Q D -29.6 -33.6 69.4 72.2 405.4 表 2.抗体 EpiVax scores, Fab Tm,Tagg检测结果 为了更加全面评估抗体的构象稳定性,研究人员进行化学变性实验。将抗体用梯度稀释的盐酸 胍孵育12小时后上机检测, PCa62出现两个transition,并且第二个△G是PCa75的2.5倍,表明 PCa62 比 PCa75 稳定。 图 4. PCa75 与 Pca62 化学变性检测结果 加速实验 也 呈现出同样的结 果 。将 P C a62 与 Pca75 在 4℃和40℃放 置 28天,在第0天 ,第 14天 ,第 28天通过 SE C 监测降解情况。最终, Pc a 62 在 4℃形成的聚集体小于 0.3%,40℃下形 成 的聚集体 小于1%。而 Pc a75 在4℃形成的聚集体为 0.5%,40℃下 形 成 的聚集体增 加 至 3%。基于 以 上结 果 ,研究人员将 PCa62锁定为候选抗体。 除了 Tm, Tagg 之外, PR 还可轻松完成化学变性实验。使用变性剂孵育抗体后上机, PR 可以 在十几秒内得到化学变性曲线,并自动计算AG, 无需自行分析。此外,您还可以在PR上自定 义升温程序 ((如在25℃和80℃之间循环切换)对抗体进行复性分析。 制剂开发 03 HIV疫苗多参数制剂筛选 doi:10.1101/2020.11.30.403873 mn ● TEMPER molecular interactions O 2bi n d GmbH & NanoTemper Technol o g i e s GmbH . All r i g ht s reserved . Mu l ti-param e ter form ul a t ion d eve l opm e nt for a n HI V-vacc i ne pr o tein with dir e ct va l ida tio n of e pi t op e bi n ding integr i ty and stoichiome t ry Corinna P opp+, Philipp Sch r amm?+. Ralf Wagner, D avid Peterhoff. Christopher B attle,Christian Kleu s ch2*. Maximilian G . Plach1* 据统计 ,有 约60%的公司遭遇过制剂开发问题导致的项目延迟甚至失败,尽 早启动制剂开发能 够帮助企 业 降低药物研发 风 险。近期 2b i n d 公司 借 助 N a n o T e m pe r 今年刚上市的 P R P an ta 完 成 了 H I V -1 疫 苗 BG 505-SOS I P 的制剂开发,预印 本 已发布 于 b i oR xi v 。 2b i n d 的研究人员使用 F ORM Osc r e en ° buf f er 筛选试剂盒与 N ano Te m p e r 的 Pan t a 仪 器 寻 找能够提升 H I V-1疫苗 B G 505-SO S IP 热稳定性,均 一 性及耐受性的制剂条 件 。 S tep 1: 检测 B G505-S O SI P 在 96 中 b u ffe r 中的解链温 度 ,与 B G505-S OSIP 在 P BS 中的 Tm (65.7℃) 进行对比(表3),b u f f e r 9 中其 T m增加了 6.8℃,而 b uff e r 16 中 Tm降低 了10.5℃。 Step 2: 通过 P a n t a 的 DLS 模 块测定了 T m 排序前 10和后 10样 品的流体力学半径和多分散 性指数 PD I 。 b u ff er 9中 Tm最高,但其流体力学半径和标准偏差都是Tm 排序前 10中 最 大 的,PDI 为 0.28表明样品是不均 一 的 *。b uff er 57 的 Tm比 bu f fer 9 低2.25℃,但57的流体力学 半径为 7.18 nm, P D I 仅 有 0.09,表明 样 品高度均 一 。因此, b uff e r 57 是 目 前最佳的制剂条 件。 *Note: P D I <0.1表 示 样品高度 均 一0.1
0.25 表明样 品不均一 ,出 现聚 集 FORMOscreen Tm/C Hydrodynamic PDI buffer number (from [7]) radius /nm 10 buffers with highest BG505-SOSIP thermal stability (Tm) 9 72.50±0.02 9.45±4.70 0.28±0.05 2 72.33±0.18 7.62±0.79 0.14±0.04 35 72.06±0.04 8.03±1.36 0.27±0.07 61 70.53±0.03 6.89±0.33 0.13±0.04 36 70.45±0.01 7.55±0.27 0.09±0.01 57 70.25±0.03 7.18±0.23 0.09±0.02 49 70.20±0.01 7.12±0.43 0.11±0.03 55 70.18±0.15 6.61±0.35 0.10±0.05 7 70.06±0.15 7.32±0.88 0.26±0.28 94 68.48±0.01 8.78±0.77 0.15±0.03 10 buffers with lowest BG505-SOSIP thermal stability (Tm) 46 61.94±0.03 7.08±0.28 0.10±0.03 75 61.69±0.07 8.66±2.15 0.21±0.05 45 61.29±0.23 10.5±6.32 0.36±0.04 32 61.20±0.07 5.85±0.30 0.10±0.02 48 61.06±0.02 8.21±0.43 0.10±0.04 70 60.83±0.08 12.0±9.63 0.47±0.07 71 60.59±0.04 7.19±0.33 0.41±0.07 34 59.46±0.31 6.64±0.16 0.09±0.01 73 58.23±0.16 8.88±3.42 0.26±0.03 16 55.20±0.03 7.18±1.67 0.10±0.01 “Therma l mel t ing temperature °polydispersity index 表 3.前10和后10 位 buffer 中 Tm 及 DLS 参数 S tep 3: 加速降解实验。 buff er 57 对 BG 505-SO SI P 长 期稳定性的影响: (1) Th e rma l S t r ess : 25, 40, 60℃放置 14天;(2) Th e rmal + O xi d a t i ve St r ess: 过氧化 氢 处 理 下 25,40,60℃放置14天 ;(3) M ec h anica l :振荡; (4) Fr eeze-Str ess: 冻 融。25、40℃包 括加 入 过氧化 氢 放置14天后, B G 505-SOSI P 的流体力学半径及 P D I 均 无明 显变化。仅在60℃放 置 14天后流体力学半径增加一倍,PDI增加至 0.3,表明部分样品发 生 了去折叠。振荡20min 以及5次冻融均未造成影 响 。结果表明 b uff er 57 非常适合 B G 505-S O S I P 的长期存储 (详细信息见原文) Panta 先通过 Tm, Tturbidity 进行初筛,缩小制剂范围。随后通过 DLS 检测选取合适的缓冲液 并开展加速降解实验(表4),极大提升了制剂开发效率,降低成本(样品及时间消耗如下图蓝 色高亮部分所示)。 Experiment Parameters° Sample requirement Time requirement Initial 96-condition FORMOscreennanoDSF analysis Tm, Tturbidity 80卫g 1 working day 20-condition FORMOscreen DLS refinement r,PDI 60g 1 working day 1-condition accelerated-stress matrix analysis rh,PDI 280g 2 working days (exclud- ing storage time) Continuous variation binding analysis rh, Stoichiometry 10阻g <1 working day a Tm: Thermal melting temperature, Thurbidity: macroscopic aggregation temperature, r: hydrodynamic radius, PDl: polydispersity index. a T m : Therma l m e l t ing tem p era t u r e , T h urbid ity : ma c r o scopic aggregat i on t em p era t u r e , r : h y d r odynamic r ad i u s , PDl : polyd i spersity i ndex. 表 4. PR Panta 制剂筛选消耗样品量及时间 等效验收标准建立 蛋白药物可比性研究 doi:10.1016/j.ab.2020.113581IF: 3.191(Q3 Nano differential scanning fluorimetry for comparability studies of therapeutic proteins Jie Wen *, Harrison Lord, Nicholas Knutson, M ats Wikstrom** Hig he r O r d er Structur e , A mtribute Scie nces, Thousand Oak s , CA, 91320, United S ta t es A m ge n 的研究人员使用 各 种类型的 B i ol o g i c s 对 PR 产品 进行了评估,并 于 今 年 1月 发 表在 An a lyti ca l B io c h e m i st r y 杂 志上。在本文中 A mg e n 的 研究人员使 用 P R 建立 了 等效验收标 准,将其 定 义为重复性的三倍。对在 Si t e l 生产和转移到 s i te2 之 后 生产的抗体进行了对比。蓝色 曲 线为转移后生产的抗体,红色曲线为转移前生产的抗体(图5)。可以 看 到不同地点生 产 的抗体的热变性曲线几乎是相同的,并 且 相 同 样品的重复性也非常好。 图5.转移前后抗体热变性曲线 统计学分析结果显示转移前后的抗体的热稳定性是相同的(表5)。之前我们提到等效验收标 准 EA C 是重复性的三倍,这里使用的 EA C 是 0.6℃,表明Amge n 用 P R 检测 到 该样品的重复 性为0.2℃。 表5.转移前后抗体统计分析结果 等效验收标准的建立对所用技术的准确性和重复性要求非常高。在 本 文中 A mg en 的 研 究人员 使用7种单抗,,44种双抗以及2种细胞因 子 对 PR 与业 内比较认可 的 金标准 D SC 进行了对 比 ,结果显示 P R 检测结果的特异性和准确度完全媲美 D SC(图6)。 图 6. DSC 与 nanoDSF单抗,双抗检测结果 PR的重复性以及浓度范围则超越了DSC。不同类型或者不同浓度的抗体重复性均在0.2℃以内 (图7)。DSC 通常检测浓度为 0.2-2mg/mL, Amgen 在这项研究中使用的样品浓度跨度为 0.05mg/mL-74mg/mL, PR的IgG 实际测试结果是 5 ug/mL to 250 mg/mL。 mAb-3 (20 mg/mL) mAb-3 (1 mg/mL) mAb-1 (10 mg/mL) mAb-1(1mg/mL) mAb-1 (0.05 mg/mL) mAb-7 (74 mg/mL) mAb-7 (1 mg/mL) mAb-6 (69 mg/mL) mAb-6 (35 mg/mL) mAb-6 (18 mg/mL) mAb-6 (1 mg/mL) mAb-5 Lot C (21mg /mL) mAb-5 Lot C (1mg/mL) mAb-5 Lot B (21 mg /mL) mAb-5 Lot B (1mg/mL) mAb-5 Lot A (21 mg /mL) mAb-5 Lot A (1mg/mL)) mAb-4 (25 mg/mL) mAb-4(1 mg/mL) 0.0 图 7.抗体 Fab 结构域重复检测结果 PR系列单品单次运行可检测48个样品,每个样品仅需 10 uL, 70 min 完成检测,并且最多 能同时获得解链温度 Tm,聚集起始温度 Ttu r bidity, 实时流体力学半径 rn多种参数。相比于传统 DSC 技术几百ul样品,近2个小时检测时间,可以极大提升检测效率,降低检测成本。 -PR在生物制剂开发中的贡献一 一参考文献一 Bai l l y M , Mie c zkows k i C , J u anV , et al. P re d ict i ng An t ibody Deve l opabil i ty Profiles T h rough Ear l y Stage Discovery Scree n i n g. mAbs, 2020,12(1):1743053.Venka t a r aman i S , Er n st R , D erebe M G , e t al.I n P ursu i t o f Stab i l i ty E n hancem e nt o f a P rostate Ca nce r Tar ge t in g A ntibod y D eri v ed from a Transge n ic Anima l P la t f orm. S cientific Reports, 2020, 10. C o r i nn a P, e t a l. Mult i -p arameter fo rm ulatio n deve l opment f or an H I V-vacc i ne pr ot ei n w ith d i rec t valida ti o n o f ep it ope b i ndi n g in t egrity a n d stoichiome t ry . bio R xiv, 2020. AMGE N Wen J , Lo rd H , K nutson N , et a l . N a n o d i f ferential scanni n g f l uor i metry f or compara b i l ity s tu dies of t herap e uti c prot ei n s . Ana l ytical B iochemistry , 2020, 593:113581.