了解勃林格殷格翰如何为其单克隆抗体寻找最佳缓冲条件
方案详情

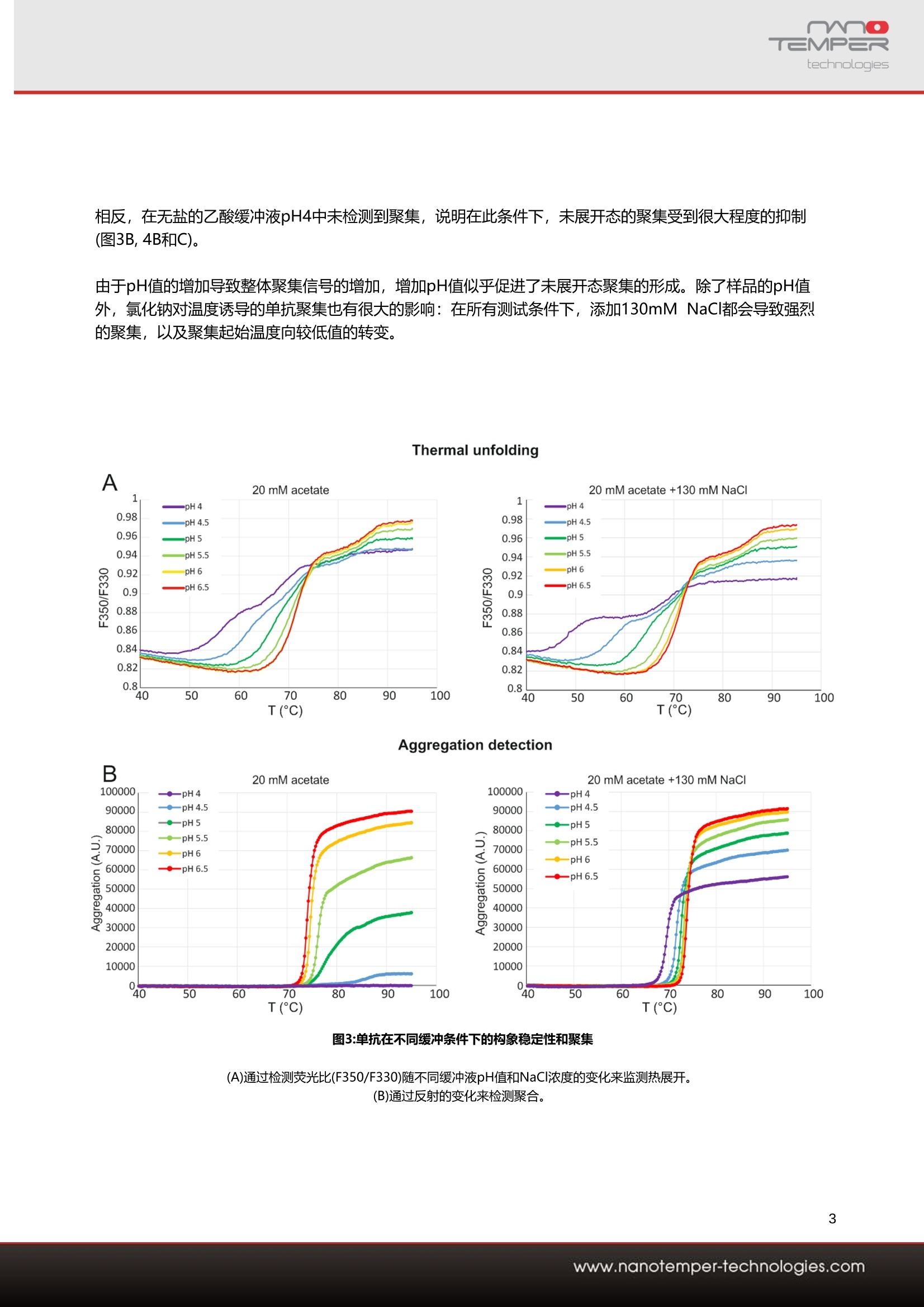
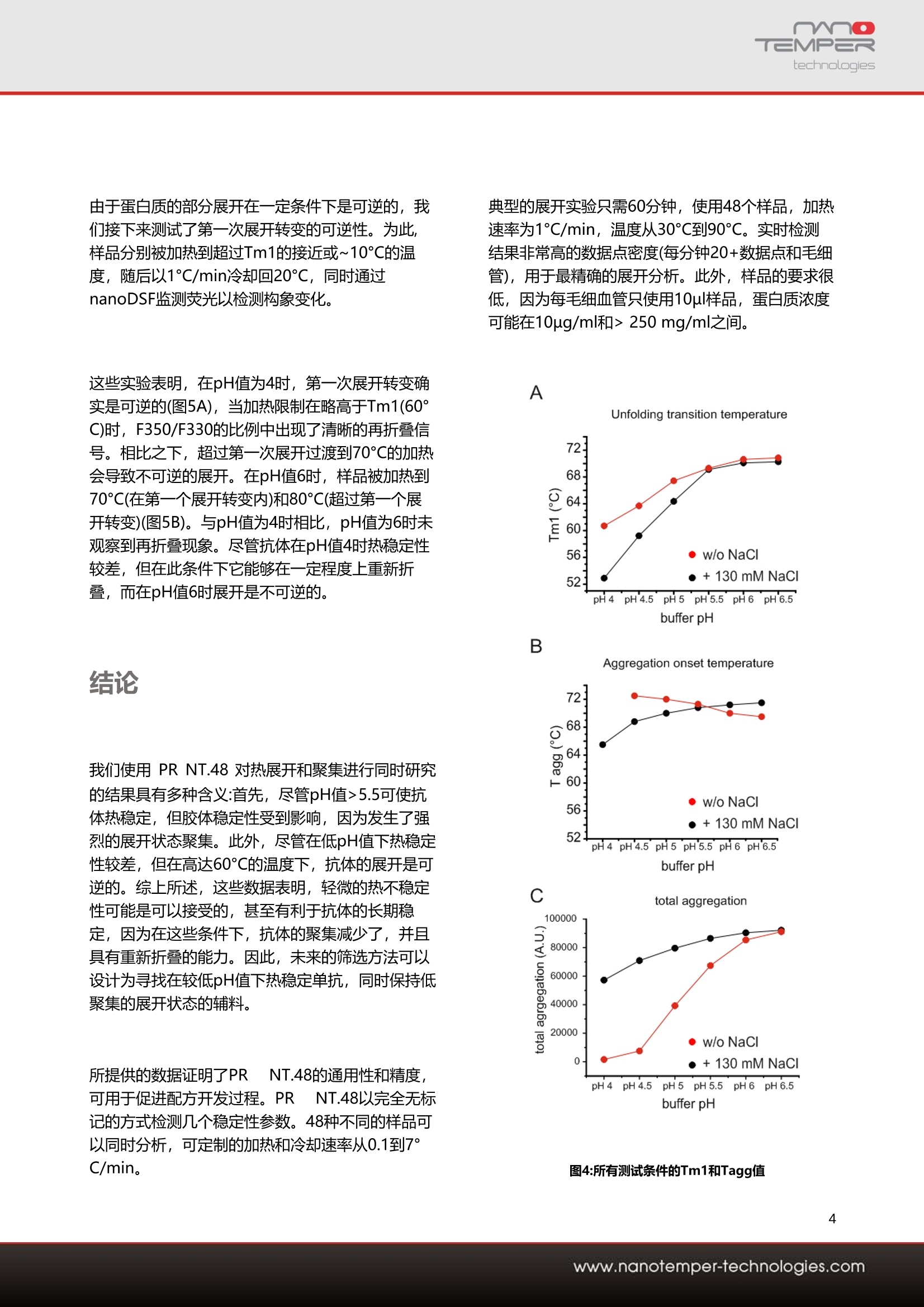
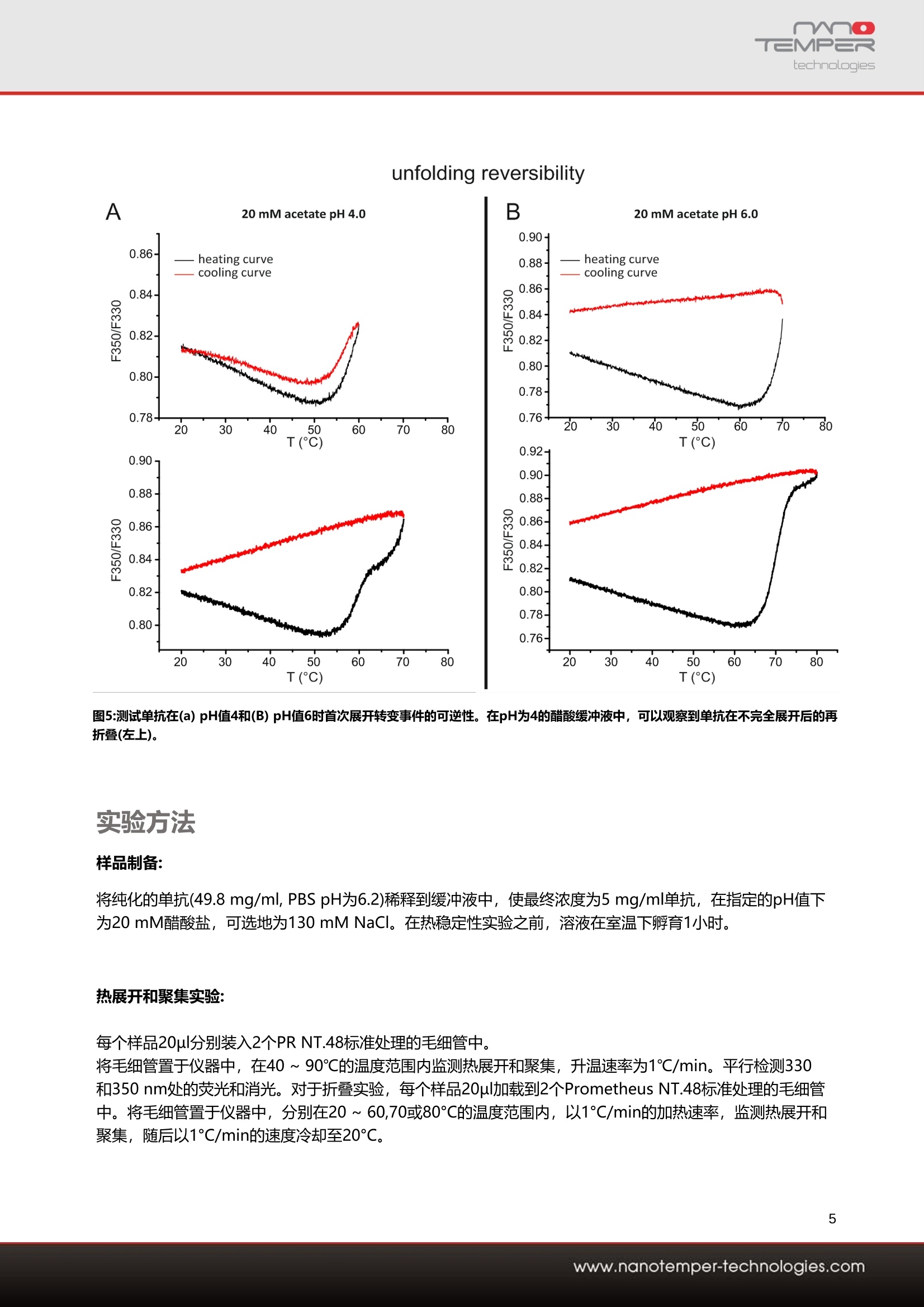
1用户背景介绍勃林格殷格翰(Boehringer-Ingelheim)是一家致力于人类生物制药化学和动物健康产品的医药公司,也是世界上最大的私有制药企业。名列全球前20位,高度研发驱动的领先医药公司,核心业务是包括处方药、 动物保健和生物制药,业务范围遍及全国各主要省市和地区。主要的研究领域包括:免疫及呼吸疾病、心血管及代谢疾病、中枢神经疾病、肿瘤。勃林格殷格翰成为第一家跨国公司在中国建立生物药物的制造企业。2014年,与百济神州签署战略合作协议,为其临床试验提供生物制药的生产。同年底,生物制药中试生产车间在上海张江工厂落成。2020年6月,勃林格殷格翰日前启动跨国药企在华首个外部创新合作中心。该中心采用了跨国药企中首个“三合一”业务模式,即集学术合作、业务拓展及许可、风险投资于一体。此举将整合公司的创新经验和合作伙伴在各自相关领域的独特技术和专业技能,共同开发创新药物和疗法,进而惠及更多患者。2为什么早期发现对蛋白质科研人员至关重要?单克隆抗体(mAb)是当今治疗性生物制剂的主要成分。由于其高度特异性和效力,它们被用于治疗多种疾病-从不同的癌症类型到自身免疫缺陷。新的蛋白质工程方法导致越来越多的治疗性mAb,它们还可以被修饰为双特异性、与其他生物制剂结合或用小分子药物修饰。而单克隆抗体(mAb)等生物药物的数量不断增加,以及mAb 变体之间的丰富异质性,需要一个彻底的开发过程,以最大限度地提高mAb的法规遵从性。因此,在开发过程的早期阶段就需要生物物理分析方法,以指导和简化进一步的抗体处理,并预测抗体的开发能力。抗体的构象和胶体稳定性是预测其稳定性和可开发性的关键参数,因为它们影响长期储存稳定性。开发管道中mAb和mAb变体的数量不断增加,需要使用能够快速评估这些参数的生物物理方法。在开发的早期阶段筛选条件和抗体构建体旨在确定最有希望的候选物,以满足药物批准的监管要求。在本案例中,勃林格殷格翰使用治疗性单克隆IgG1抗体的小规模配方筛选,以验证PR NT.48在确定关键稳定性参数方面的优异能力。通过PR NT.48搭载的nanoDSF技术跟踪色氨酸荧光发射的变化来评估热梯度中mAb构象稳定性。同时,PR NT.48可以检测胶体稳定性的变化和温度引起的聚集,是通过检测两次通过样品的光束的背反射强度实现的(图1)。图1:检测蛋白质聚集的背反射原理示意图(左) 光通过毛细管,被反向反射到检测器,光强度被量化。(右) 粒子散射光,导致入射光的消光和背反射光的反射--蛋白质聚集的直接测量。使用PR NT.48同时进行背向反射和荧光分析提供了几个重要信息:可直接关联热稳定性和胶体稳定性,这意味着可以识别引起聚集的展开事件,更重要的是,可以确定聚集起始温度。可确定抗体的未折叠状态的总体聚集程度,这在不同的配方和抗体类型之间可能有显著差异。让我们一起来看看勃林格殷格翰的开发团队_Global Formulation Development group,如何借助PR NT.48同时定量来预测配方筛选中的长期mAb稳定性,生物制剂在热梯度中的构象和胶体稳定利用热稳定性信息与聚集(胶体稳定性)监测相结合,为其单克隆抗体寻找理想的缓冲条件。 T三MP=Rtechnologies 应用案例 -单克隆抗体的展开和聚集 单克隆抗体的胶体稳定性及构象稳定性分析 Franziska Soltl 1, Jonathan Derix1, Patrick Garidel, Michaela Blech2and Dennis Breitsprecher1 1 NanoTemper Technologies GmbH, Munich, Germany ? Boehringer Ingelheim Pharma GmbH & Co. KG, Global Bioprocess & Pharmaceutical Development, Global Formulation Development, Biberach, Germany 摘要 随着单克隆抗体(mAbs)等生物药物数量的不断增 长,以及mAb变体之间的丰富异质性,需要一个系 统的开发过程来最大限度地提高单克隆抗体的合规 性。因此,在开发过程的早期阶段就需要生物物理 分析方法来指导和简化进一步的抗体处理,并预测 抗体的可开发性。 在本案例研究中,展示了如何通过同时定量生物制 剂的构象和胶体稳定性,验证PR NT.48 可用于预 测配方筛选中的长期单抗稳定性。 介绍 单克隆抗体(mAbs)是当今大多数治疗性生物制剂。由于其高度特异性和效力,它们被用于治疗许多疾 病,从不同的癌症类型到自身免疫缺陷。新的蛋白 质工程方法发现越来越多的治疗性单克隆抗体,这 些单克隆抗体还可以被修饰成双特异性,与其他生 物制剂偶联或用小分子药物修饰。 抗体的构象和胶体稳定性是预测其稳定性和可开发 性的关键参数,因为它们影响对药物批准至关重要 的长期储存稳定性[1,2]。开发管线中越来越多的单 克隆抗体和单克隆抗体变体需要生物物理方法来快 速评估这些参数[3,4]。 irreversible aggregation 图1:抗体构象与胶体稳定性的关系 (A)折叠和未展开抗体和聚集物之间的平衡和非平衡状态。 (B)显示未展开状态强聚集结果的示意图。随着时间的推移,不可 逆聚集导致聚集物的积累,最终导致单克隆抗体的完全聚集。 (C)抗体在热梯度中定向展开和聚集的示意图 在开发早期阶段筛选条件和抗体结构的目的是确定 最有希望的候选药物,以满足药物批准的监管要 求。在这里,使用小规模配方筛选治疗性单克隆 IgG1抗体,验证 PR NT.48 在确定关键稳定性参数 方面的能力。 确定蛋白质构象稳定性的一种方法是跟踪它们在温 度梯度中的去折叠[5-9]。增加样品的温度会导致蛋 白质从折叠状态转变为去折叠状态(图1C)。发生这 种转变的温度Tm被用作蛋白质热稳定性的参数。 PR NT.48 使用nanoDSF跟踪色氨酸发射荧光的变 化来评估单抗在热梯度中的构象稳定性[8,9]。由于 在毛细管中荧光检测的高灵敏度,甚至可以检测到 抗体构象的微小变化,从而可以明确地识别到不同 单抗子结构域的多个展开事件。 同时, PR NT.48 可以检测胶体稳定性和温度诱导 聚集的变化。这是通过检测两次通过样品的被反射 光束的强度来实现的(图2)。 在聚集时,由于光散射、背射光的强度减小,因此 可以作为样品中总聚集的度量。重要的是,反向反 射和荧光同时检测,允许最大的扫描速度和数据点 密度。 图2:用于检测蛋白质聚集的反射原理示意图 (左)光通过毛细管,被反射到探测器和光强度被量化。(右)粒子散射光,导致入射光的消失,从而减少后反射光,这是 蛋白质聚集的直接衡量标准。 同时评估构象和胶体稳定性是预测长期稳定性 的有力方法。每个抗体一——不管其构象稳定性 如何——都处于原生(折叠)和未折叠构象状态 之间的平衡状态(图1A)。如果抗体的未展开状 态表现出强烈的形成聚集物的倾向,它会析出 溶液,导致更多抗体在质量作用定律的驱动下 成为未展开的状态(图1B)。因此,必须防止未 展开抗体的强烈聚集,例如,通过确定防止聚 集的最佳配方组成或分子修饰。 使用 斗PR NT.48 同时进行反向反射和荧光分析提 供了几个重要信息:首先,可以直接关联热稳定性 和胶体稳定性,这意味着可以识别引起聚集的展开 事件,更重要的是,可以确定聚集的起始温度。其 次,可以确定抗体未展开状态的总体聚集程度,这 在不同的配方和抗体类型之间可能有显著差异。 结论 我们测试了IgG1抗体在pH值为4-6.5、pH值为1mg/ml的醋酸缓冲液中,以及含有和不含有 130mM NaCl 时的热稳定性。为此,每个样品10pl 被加载到标准处理的 PR NT.48毛细管中,并以 1°C/min的加热速率从40°℃加热到95°℃。 在F350/F330比率下得到的展开信号显示了两个明 确确认的展开跃迁(图3A)。pH值的降低导致展开转 变的中点向较低的温度转移(图3A和4A)。 在130mM NaCI的存在下,这种效应更加明显,这 表明盐的加入导致抗体的构象不稳定。总的来 说, pH和盐依赖性在第一次展开转变中最为明显。 抗体聚集的平行分析是通过使用背反射检测的光衰 减度进行的。有趣的是,聚合数据显示, 在pH值较 高的缓冲条件下,聚集最为明显(图3B和4C)。这些 结果表明, Tagg的变化与第一次展开转变温度 Tm1的pH依赖的大变化无关(图3和4B), 这表明相 应的单克隆抗体结构域的展开并不是聚合的原因。 相反,在无盐的乙酸缓冲液pH4中未检测到聚集,说明在此条件下,未展开态的聚集受到很大程度的抑制 (图3B, 4B和C)。 由于pH值的增加导致整体聚集信号的增加,增加pH值似乎促进了未展开态聚集的形成。除了样品的pH值 外,氯化钠对温度诱导的单抗聚集也有很大的影响:在所有测试条件下, 添加130mM NaCI都会导致强烈 的聚集,以及聚集起始温度向较低值的转变。 Thermal unfolding A 20 mM acetate 20 m M acetate +130 mM NaCI -p H4 -p H 4 0.98 -p H 4.5 0.98 -pH 4.5 0.96 -pH 5 0.96 pHS 0.94 -pH 5.5 0.94 -p H 5.S O 0.92 -p H 6 O -pH 6m m 0.92 -p I P H 6.5 -p H 6.5 0.9 0.9 0.88 0.88 0.86 0.84 0.82 0.8 40 50 60 70 80 T(C) 0.860.840.820.890 100 40 50Aggregation detection 100000 60 70 80 90 100 T(C) 图3:单抗在不同缓冲条件下的构象稳定性和聚集 (A)通过检测荧光比(F350/F330)随不同缓冲液pH值和NaCI浓度的变化来监测热展开。 (B)通过反射的变化来检测聚合。 由于蛋白质的部分展开在一定条件下是可逆的,我 们接下来测试了第一次展开转变的可逆性。为此,样品分别被加热到超过Tm1的接近或~10°℃的温 度,随后以1°C/min冷却回20°℃,同时通过 nanoDSF监测荧光以检测构象变化。 这些实验表明,在pH值为4时,第一次展开转变确 实是可逆的(图5A),当加热限制在略高于Tm1(60°C)时, F350/F330的比例中出现了清晰的再折叠信 号。相比之下,超过第一次展开过渡到70°℃的加热 会导致不可逆的展开。在pH值6时,样品被加热到 70°℃(在第一个展开转变内)和80℃(超过第一个展 开转变)(图5B)。与pH值为4时相比, pH值为6时未 观察到再折叠现象。尽管抗体在pH值4时热稳定性 较差,但在此条件下它能够在一定程度上重新浙 叠,而在pH值6时展开是不可逆的。 结论 我们使用 PR NT.48 对热展开和聚集进行同时研究 的结果具有多种含义:首先,尽管pH值>5.5可使抗 体热稳定,但胶体稳定性受到影响,因为发生了强 烈的展开状态聚集。此外,尽管在低pH值下热稳定 性较差,但在高达60°℃的温度下,抗体的展开是可 逆的。综上所述,这些数据表明,轻微的热不稳定 性可能是可以接受的,甚至有利于抗体的长期稳 定,因为在这些条件下,抗体的聚集减少了,并且 具有重新折叠的能力。因此,未来的筛选方法可以 设计为寻找在较低pH值下热稳定单抗,同时保持低 聚集的展开状态的辅料。 所提供的数据证明了PR NT.48的通用性和精度,可用于促进配方开发过程。PR NT.48以完全无标 记的方式检测几个稳定性参数。48种不同的样品可 以同时分析,可定制的加热和冷却速率从0.1到7°C/min。 典型的展开实验只需60分钟,使用48个样品,加热 速率为1°C/min,温度从30°℃到90°℃。实时检测 结果非常高的数据点密度(每分钟20+数据点和毛细 管),用于最精确的展开分析。此外,样品的要求很 低,因为每毛细血管只使用10pl样品,蛋白质浓度 可能在10ug/ml和>250 mg/ml之间。 图5:测试单抗在(a) pH值4和(B) pH值6时首次展开转变事件的可逆性。在pH为4的醋酸缓冲液中,可以观察到单抗在不完全展开后的再 折叠(左上)。 实验方法 样品制备: 将纯化的单抗(49.8 mg/ml, PBS pH为6.2)稀释到缓冲液中,使最终浓度为5 mg/ml单抗,在指定的pH值下 为20mM醋酸盐,可选地为130 mM NaCl。在热稳定性实验之前,溶液在室温下孵育1小时。 热展开和聚集实验: 每个样品20pl分别装入2个PR NT.48标准处理的毛细管中。 将毛细管置于仪器中,在40~90℃的温度范围内监测热展开和聚集,升温速率为1℃/min。平行检测330和350 nm处的荧光和消光。对于折叠实验,每个样品20pl加载到2个Prometheus NT.48标准处理的毛细管 中。将毛细管置于仪器中,分别在20~60,70或80°℃的温度范围内,以1°C/min的加热速率,监测热展开和 聚集,随后以1℃/min的速度冷却至20°℃。 参考文献 1. Uchiyama, S., Liquid formulation for antibody drugs. Biochim Biophys Acta, 2014.1844(11): p.2041-2052. 2. Brader, M.L., et al., Examination of t hermal unfolding and aggregation profiles of a series of developable therapeutic monoclonal antibodies. Mol Pharm, 2015.12(4): p.1005-17. 3. Rouet, R., D. Lowe, and D. Christ, Stability engineering of the human antibody repertoire. FEBS Lett,2014.588(2): p.269-77. 4Tiller, K.E. and P.M . Tessier, Advances in Antibody Design. Annu Rev Biomed Eng, 2015.5 Cerasoli, E., et al., Temperature denaturation and aggregation of a multi-domain protein (IgG1)investigated with an array of complementary biophysical methods. Anal Bioanal Chem, 2014.406(26): p. 6577-86. 6. Menzen, T. and W. Friess, Temperature-ramped studies on the aggregation, unfolding, and interaction of a therapeutic monoclonal antibody. J Pharm Sci, 2014.103(2): p.445-55. 7. Menze n , T. and W. Friess, High-throughput melting-temperature analysis of a monoclonal antibody by differential scanning fluorimetry in the presence of surfactants. J Pharm Sci, 2013. 102(2): p. 415-28. 8. Garidel , P.K., A.R.; Blech, M., Orthogonal spectroscopic techniques for the early developability assessment of t herapeutic protein candidates. Spectroscopy Europe,2014.26(4): p. 9-13. 9. Garidel, P ., Right Angle Light Scattering protein thermostability screening: for research and development. Spectroscopy Europe, 2012. 24(1): p. 13-18. 相关产品&技术 PR系列蛋白稳定性分析仪 多种型号满足不同检测需求 PR NT.48 解锁生物制剂的热稳 定性、化学变性和背 反射参数,操作简便 PR Ponto + Robotic Autosompler 灵活。 PR Ponto 全自动上样装置,可满足数百种生物候 选分子和条件的筛选,实现超高通量筛 集合nanoDSF、DLS、背反射 选。 和SLS技术获得完整的稳定性 表征参数,一 应俱全。 集合4种技术,让您更完整地了解候选分子 联系我们 诺坦普科技(北京)有限公司 Tel: 010-84462100 技术支持:: support@nanotemper.cn 官网: https://nanotempertech.com/zh _cn/ 微信公众号: NanoTemper
确定





还剩6页未读,是否继续阅读?
诺坦普科技(北京)有限公司为您提供《应用案例-单克隆抗体的展开和聚集》,该方案主要用于生物药品药物研发中临床前研究检测,参考标准--,《应用案例-单克隆抗体的展开和聚集》用到的仪器有NanoTemper PR Panta蛋白稳定性分析仪、NanoTemper PR Panta+机械臂自动上样器 全自动多功能蛋白稳定性分析仪
推荐专场
相关方案
更多
该厂商其他方案
更多

















