方案详情
文
南方医科大学 博士学位论文
喷砂酸蚀钛种植体表面接触成骨现象及其影响因素的动物学实验研究
文章来源:中国知网
博士研究生:赖春花
导师姓名:周磊 教授
专业名称:外科学
培养类型:在职
培养层次:博士
所在学院:第一临床学院
论文提交日期:2014年5月
课题来源:国家自然科学基金(81170998)、广东省医学科研基金(B2012032)
方案详情

文章来源:中国知网博士研究生:赖春花导师姓名:周磊 教授专业名称:外科学培养类型:在职培养层次:博士所在学院:第一临床学院论文提交日期:2014年5月课题来源:国家自然科学基金(81170998)、广东省医学科研基金(B2012032)研究背景:在当今所有的种植体材料中,纯钛因其良好的生物相容性和机械加工性能已经广泛应用于口腔种植领域。种植牙因为美观、舒适、并能很好的恢复咀嚼功能,作为人类的第三副牙齿,近年来被广泛接受。但是种植牙仍存在一些问题,如骨结合率较低,愈合时间较长,种植体植入体内到临床负重一般都需要周的时间,这一定程度上限制了种植修复的临床应用。研究表明,大部分种植失败发生于种植体早期愈合的过程中,愈合速度越慢,种植体受到各种风险因素的影响越大,种植失败的风险越高。影响种植体表面早期成骨有两个因素:受区的生物学特性;种植体的表面特性。在种植早期,种植体植入机体后,与骨组织间存在两种不同的愈合模式:接触成骨和距离成骨。接触成骨,指成骨细胞与种植体表面接触后直接分泌骨基质,其骨生长方向是由种植体表面向种植窝周围的骨组织表面生长。而距离成骨与之相反,是新生骨基质沉积在种植体附近和种植窝周围的原有骨组织表面,其生长的方向为种植窝周围骨组织向种植表面生长。研究发现:接触成骨在种植体表面直接形成的编织骨有利于增加种植体初期和早期机械稳定性。尽快建立接触成骨所需的条件,有利于促进骨组织形成。骨组织愈合的速率和程度依赖于种植体表面接触成骨的程度。受区的生物学特性是指受区骨的解剖生理学,包括骨代谢特点、骨密度、血供、生长因子、成骨细胞来源等。不同的骨质结构导致了不同的骨生物力学和不同的骨愈合骨改建能力。研究证明:不同的动物在相同部位植入相同的材料,实验结果有差异,在同一动物,将生物材料植入不同的部位,结果也有差异。Guehennec LL将骨代用品分别植入兔的股骨、颅骨和胫骨,观察4周,发现骨愈合在兔股骨是48.5%,颅骨是22.9%,胫骨是12.6%。这可能是由于不同部位的骨结构不同,包括皮质骨和松质骨分布特点不同。不同的骨质结构导致了不同的骨愈合骨改建能力。同一植入部位不同区域的骨愈合能力也有所差异。本课题组曾在兔胫骨距离干骺端三个不同距离处分别植入三枚种植体,结果显示,距离于骺端最近的骨-种植体接触率最高,接触成骨最明显,骨愈合最快。然而,在颌骨的不同部位,种植体表面的成骨是否有差异呢?在颌骨的哪一区域,接触成骨效果最好呢?目前尚无较肯定的研究结果。种植体的表面特性是指种植体的表面形貌、元素组成、分子结构、电荷状态、表面自由能、亲疏水性特性等。种植体表面经过处理,可改变其表面特性,促进接触成骨,缩短骨整合所需的时间。为了有效地缩短种植体骨结合所需的时间,在过去的二十年中,一系列钛表面处理技术不断涌现:如钛浆涂层、羟基磷灰石涂层、喷砂酸蚀、激光处理,微弧氧化等。其中,喷砂酸蚀是被研究得最多的一种表面处理方法,无论从其表面形貌、表面粗糙度还是生物相容性和骨引导性等方面,都有许多的研究报道,它已成为国际上使用最为广泛的种植体表面之一,其表面良好的机械生物相容性已经得到了公认。大量的研究已经证实:喷砂酸蚀的种植体表面具有良好的早期骨结合效果,是一种比较成熟的表面处理方法。然而,传统的喷砂加酸蚀表面处理制备完成后被置于空气中干燥会由相对亲水性变成疏水性。研究显示,疏水性表面将减少蛋白吸附,同时润湿性不足也会影响材料表面接触血液成分的初始状态以及后续的细胞反应。种植体表面润湿性在很大程度上取决于表面自由能。表面自由能增加能使材料表面润湿性增加。种植体润湿性和表面自由能的增加可以增强种植体表面与生物环境的相互作用,从而影响到种植体生物活性的发挥,甚至骨结合的长期效果。不同的表面处理方法会影响表面自由能的大小。自年由等领导的研究小组,首次使用紫外线对二氧化钛膜进行表面处理,发现经紫外线处理过的二氧化钛膜层由疏水性能向超亲水性能转变,并将其成果发表在上之后,研究人员开始关注紫外线改性钛表面。到目前为止,较多的研究证明:紫外光催化反应是改性钛表面,提高表面自由能并获得超亲水特性的一种简单、方便和高效的方法。本课题组前期对紫外线辐照喷砂酸蚀纯钛表面进行了理化分析和细胞学实验,结果显示:表面处理降低了碳氢化合物的含量低,同时,与表面相比,表面具有亲水性和高表面能促进了成骨细胞的粘附、增殖、分化和矿化;体外矿化诱导能力检测显示,表面诱导羟基磷灰石矿化沉积的速度是表面的倍。这些结果与国外有关紫外线研究是一致的。大量的研究表明:那些由于长时间存放而老化的种植体在受到紫外线辐照后,其表面活性得以复活,提高表面自由能并同时获得亲水特性,促进了蛋白吸附、成骨细胞粘附、增殖、分化和矿化,甚至骨结合,显示出良好的生物相容性。然而,就目前而言,国内外有关紫外线辖照的研究大部分集中在理化性质和细胞学实验,体内实验方面的研究相对较缺乏。那么,在体内实验中,通过紫外线辐照纯钛表面,改变喷砂酸蚀纯钛表面这一经典表面的自由能,钛种植体表面的成骨现象又是怎样的呢?实验目的:鉴于以上问题和争议,本研究的第一个目的是研究受区生物学特性与喷砂酸蚀钛种植体表面接触成骨的关系;第二个目的是研究紫外光处理对喷砂酸蚀钛种植体接触成骨的影响。研究方法:1.实验动物:成年雄性健康的Beagle犬共4只,12月龄,体重为14-15kg。牙齿牙列完整,无慢性牙周病及龋齿,口腔粘膜色泽正常,咬合关系无明显异常。2.Beagle犬拔牙:4只Beagle犬适应性饲养1周后,术前12小时禁饮食,术前半小时肌注青霉素钠40万u,速眠新和戊巴比妥钠复合麻醉下微创拔除双侧第二、三、四前磨牙和第一磨牙,术后连续三天给予青霉素80万单位肌注,以预防感染。术后进软食一周。拔牙创愈合三个月。3.种植体选择:种植体为WEGO种植体,长度为9mm,直径为38mm,表面处理是SLA,作为对照组。4.种植体UV辐照:选用Philips的UVC灭菌灯,使用UVC灭菌灯前先用75%酒精棉球擦拭灯管,再在无菌环境下距离材料表面10cm,对SLA种植体表面照射48h。SLA+UV处理,作为实验组。5.分组:使用随机数字表按随机分配的原则,将4只成年雄性健康Beagle犬分为2周组和4周组,每组各有2只。采用左右半口对照设计,每只Beagle犬每边下颌骨植入5颗种植体,一边为实验组(SLA+UV),一边为对照组(SLA),每只Beagle犬植入10颗种植体,4只Beagle犬共植入40颗种植体。其中SLA组和SLA+UV组各有20个样本。SLA组的20个样本先用于分析受区生物学特性与接触成骨的关系。而后SLA组的20个样本和SLA+UV组的20个样本用于分析对比SLA表面处理和SLA+UV表面处理钛种植体表面接触成骨现象。6.种植手术:拔牙创愈合三个月后。术前12小时禁饮食,术前半小时肌注青霉素钠40万u。速免新和戊巴比妥钠肌肉注射麻醉后,常规消毒铺巾,下颌骨槽脊顶切开,翻瓣,球钻定位,逐级预备种植窝,成型钻成形种植窝,植入种植体,种植窝大小与种植体是一致的,使种植体外螺纹贴着种植窝骨壁。对位缝合创口。术后常规抗炎处理。7.荧光双标记法:所有成年雄性健康Beagle犬于处死前的第13、14天在皮下注射盐酸四环素25mg/kg;处死前的第3、4天皮下注射钙黄绿素5mg/kg,每种试剂使用时连续注射两天,每日注射一次。8.标本处理:分别在2周和4周各处死两只Beagle犬,获得带种植体的Beagle犬下颌骨,以0.9%生理盐水反复冲洗,将标本切分成单独种植体,用10%中性福尔马林固定液浸泡,置于4℃恒温冰箱保存48-72小时,然后换成70%乙醇浸泡。9.显微CT检查:取4个含种植体标本,进行显微CT数据扫描,并取种植体粗螺纹区周围45μm-300微米及300-600微米的空间进行三维重建。10.不脱钙的种植体骨切片的制备:EXAKT510系统自动脱水,包埋后,用EXAKT 300CP切片机切片,然后用EXAKT400CS系统自动磨片至30μm,荧光观察,再用亚甲基蓝酸性品红染色。11.对比显微CT的结果和硬组织切片,选择更能反映种植体表面成骨的实验方法。12.取喷砂酸蚀组切片,观察种植体在颌骨不同部位的成骨差异,第一部分是种植体螺纹底部到皮质骨大约300μm距离的部分,第二部分是种植体螺纹底部到皮质骨大约300μm-600μm距离的部分,第三部分是种植体螺纹底部到皮质骨大于600μm距离的部分。13.对喷砂酸蚀组及喷砂酸蚀加紫外光辐照组按实验目的行荧光双标记及染色观察分析,评估种植体周围的骨愈合情况和计算BIC。14.统计学处理:测定数据结果均采用x±s表示,使用SPSS13.0统计分析软件,正态分布数据先用析因设计的方差分析分析处理组与时间段之间是否有交互效应,如有再用单因素方差分析(one-way ANOVA),预先用Levene’s test检验方差是否齐性,如方差齐则采用样品均数见的两两比较的LSD,方差不齐则采取校正的方法Welch 方法,多重比较用 Dunnett’s T3 法。当P<0.05时,认为差异具有统计学意义。实验结果:1.实验动物情况:4只Beagle犬术后6-9小时清醒进食,无死亡动物。种植手术伤口未见异常,均可达到一期愈合,无明显出血。无种植体松动。2.样本大体观察:种植体顶部被周围骨组织和纤维组织等包埋,未见明显骨吸收的现象,种植体无松动。3.微型CT观察:可通过调整切面,观察到种植体周围每个面的成骨情况。可进行目标整体分割测量,在任意方向得到切片,得到较完整数据。对种植体粗螺纹周围45μm-300μm范围,300μm-600μm范围进行三维重建,两周时和四周时均可见较多新生骨小梁长入螺纹内部,但由于金属伪影的影响显示不清,无法进行三维重建。硬组织切片只能取一个方向的截面,但是对种植体表面0-45μm区域显示清晰,可以很好地观察到种植体表面成骨的方向,可以清晰地观察到接触成骨现象。4.喷砂酸蚀种植体与皮质骨的不同距离对接触成骨的影响:亚甲基蓝酸性品红染色:可见种植体螺纹与皮质骨距离不同,螺纹内新骨的量不同。2周:种植体螺纹凹槽底部与皮质骨大概300μm时,即皮质骨是贴着种植体外螺纹的,此时有部分新骨长入螺纹内部,种植体表面包括螺纹凹槽底部可见新生骨小梁,有接触成骨;种植体螺纹凹槽底部与皮质骨大概600μm时,可见少量新生骨小梁顺着螺纹壁攀爬,种植体螺纹斜壁有少量新生骨小梁,螺纹凹槽底部未见明显新生骨小梁;种植体螺纹凹槽底部与皮质骨距离大于600μm时,未见明显新骨生成。4周:种植体螺纹凹槽底部与皮质骨大概300μm时,此时很多新骨长入螺纹内部,分布于螺纹腔及螺纹底壁,斜壁,可见接触成骨;种植体螺纹凹槽底部与皮质骨大概300-600μm时,可见少量新生骨小梁顺着螺纹壁攀爬,螺纹底壁新生骨小梁不明显。种植体螺纹凹槽底部与皮质骨距离大于600μm时,极少量新骨生成。骨组织计量学:两周及四周时,对种植体螺纹凹槽底部到皮质骨的距离300μm,300-600μm,≥600μm这三个组种植体周围的,新生骨面积进行测量,发现:新生种植体螺纹凹槽底部到皮质骨的距离300μm时BIC及新生骨面积>种植体螺纹凹槽底部到皮质骨的距离300-600μm时BIC及新生骨面积>种植体螺纹凹槽底部到皮质骨的距离大于或等于600μm的及新生骨面积,差异均有统计学意义,螺纹凹槽底部与皮质骨越近,种植体——骨接触效果越好。5.紫外光处理喷砂酸蚀纯钛种植体表面早期成骨效应组织学观察:(1)荧光分析:2周组:可见种植体周围及种植体螺纹内都有散在荧光,荧光主要集中在种植体螺纹处,皮质骨区域比骨髓腔区域荧光分布多。SLA荧光主要集中在螺纹斜壁上和种植体周围,SLA+UV组,除了种植体周围和螺纹壁上外,螺纹底部也有更多荧光分布。4周组:可见种植体周围及种植体螺纹内都有散在荧光,荧光主要集中在种植体螺纹处,与2周比,可见骨髓腔区域(即离皮质骨远的地方)也有新骨生成,且新生骨小梁较2周时粗大。SLA+UV组较SLA组更多荧光分布。目SLA+UV组较SLA组荧光条带粗。 (2)骨磨片亚甲基蓝-酸性品红染色:2周,SLA组可见螺纹腔底部无明显新骨生成,新生骨小梁多来源于周围基骨,沿着种植体螺纹腔斜壁爬行而来,新生骨小梁细长,颜色稍深;SLA+UV组:见新生骨小梁不仅沿着种植体螺纹腔斜壁爬行,在离基骨远的螺纹腔底壁,也有较多新骨生成。4周,SLA组可见新骨由周围基骨往螺纹腔内延伸,螺纹腔中间有新生骨小梁,也有新生骨小梁沿着螺纹腔斜壁往内生长,螺纹腔底壁散在分布着少量新生骨小梁,种植窝骨壁见大量新形成的哈弗氏系统,螺纹内部未见明显的哈弗氏系统。SLA+UV组:见新生骨小梁不仅分布于离周围成熟骨近的螺纹腔斜壁,在离基骨远的螺纹腔底壁也见大量新生骨小梁,接触成骨非常明显,同时,螺纹腔侧壁和底壁新生骨小梁都较2周时增粗明显,除了种植窝骨壁见大量新形成的哈弗氏系统,螺纹内部也有新生成的哈弗氏系统。(3)染色片的骨组织计量学分析:两周和四周时,SLA+UV组种植体——骨结合率>SLA组种植体——骨结合率,差异有统计学意义。两周和四周时:SLA组与SLA+UV组新生骨面积百分数差异无统计学意义。结论1.本实验采用Beagle犬下颌骨延期种植模型,拔牙后3个月植入种植体,Beagle犬下颌骨与人接近,可比性强,较符合种植临床实际情况。新的备洞和种植体植入模式,能更清晰地观察到不同表面处理方法对成骨的影响。2.显微CT可以测定骨三维结构,具有连续性和完整性的优势。可以宏观地观察到种植体周围骨质情况,但是由于金属伪影的存在,显微CT对种植体表面接触成骨现象显示不够清晰。硬组织是一种单层组织切片,制作过程较复杂,而且会破坏标本的完整性,从而使得一个标本不能同时用于结构参数分析以外的其他检测。但是它对于种植体表面成骨的细微变化反映较清晰。3.SLA钛种植体表面可观察到接触成骨,接触成骨与受区的生物学特性相关,与皮质骨距离近的区域,接触成骨效果好,种植体BIC高,BA也高;与皮质骨距离大于600μm的区域,接触成骨不明显。4.SLA+UV组接触成骨效果好,在两周和四周时,SLA+UV组种植体——骨结合率均好于SLA组种植体——骨结合率。关键词:纯钛种植体、表面处理、动物实验、喷砂酸蚀、紫外光图1-6 种植手术--备洞模式图Figure 1-6 Implant surgery 南方医科大学博士学位论文 喷砂酸蚀钛种植体表面接触成骨现象及其影响因素的动物学实验研究 文章来源:中国知网 博士研究生:赖春花 导师姓名:周磊教授 专业名称:外科学 培养类型:在职 培养层次:博士 所在学院:第一临床学院 论文提交日期:2014年5月 课题来源:国家自然科学基金(81170998)、广东省医学科研基金(B2012032) 摘要 研究背景: 在当今所有的种植体材料中,纯钛因其良好的生物相容性和机械加工性能已经广泛应用于口腔种植领域。种植牙因为美观、舒适、并能很好的恢复咀嚼功能,作为人类的第三副牙齿,近年来被广泛接受。但是种植牙仍存在一些问题,如骨结合率较低,愈合时间较长,种植体植入体内到临床负重一般都需要周的时间,这一定程度上限制了种植修复的临床应用。研究表明,大部分种植失败发生于种植体早期愈合的过程中,愈合速度越慢,种植体受到各种风险因素的影响越大,种植失败的风险越高。 影响种植体表面早期成骨有两个因素:受区的生物学特性;种植体的表面特性。 在种植早期,种植体植入机体后,与骨组织间存在两种不同的愈合模式:接触成骨和距离成骨。接触成骨,指成骨细胞与种植体表面接触后直接分泌骨基质,其骨生长方向是由种植体表面向种植窝周围的骨组织表面生长。而距离成骨与之相反,是新生骨基质沉积在种植体附近和种植窝周围的原有骨组织表面,其生长的方向为种植窝周围骨组织向种植表面生长。研究发现:接触成骨在种植体表面直接形成的编织骨有利于增加种植体初期和早期机械稳定性。尽快建立接触成骨所需的条件,有利于促进骨组织形成。骨组织愈合的速率和程度依赖于种植体表面接触成骨的程度。 受区的生物学特性是指受区骨的解剖生理学,包括骨代谢特点、骨密度、血供、生长因子、成骨细胞来源等。不同的骨质结构导致了不同的骨生物力学和不同的骨愈合骨改建能力。研究证明:不同的动物在相同部位植入相同的材料,实验结果有差异,在同一动物,将生物材料植入不同的部位,结果也有差异。Guehennec LL 将骨代用品分别植入兔的股骨、颅骨和胫骨,观察4周,发现骨愈合在兔股骨是48.5%,颅骨是22.9%,胫骨是12.6%。这可能是由于不同部位的骨结构不同,包括皮质骨和松质骨分布特点不同。不同的骨质结构导致了不同的骨愈合骨改建能力。同一植入部位不同区域的骨愈合能力也有所差异。 本课题组曾在兔胫骨距离干骺端三个不同距离处分别植入三枚种植体,结果显示,距离于骺端最近的骨-种植体接触率最高,接触成骨最明显,骨愈合最快。然而,在颌骨的不同部位,种植体表面的成骨是否有差异呢?在颌骨的哪一区域,接触成骨效果最好呢?目前尚无较肯定的研究结果。 种植体的表面特性是指种植体的表面形貌、元素组成、分子结构、电荷状态、表面自由能、亲疏水性特性等。种植体表面经过处理,可改变其表面特性,促进接触成骨,缩短骨整合所需的时间。为了有效地缩短种植体骨结合所需的时间,在过去的二十年中,一系列钛表面处理技术不断涌现:如钛浆涂层、羟基磷灰石涂层、喷砂酸蚀、激光处理,微弧氧化等。其中,喷砂酸蚀是被研究得最多的一种表面处理方法,无论从其表面形貌、表面粗糙度还是生物相容性和骨引导性等方面,都有许多的研究报道,它已成为国际上使用最为广泛的种植体表面之一,其表面良好的机械生物相容性已经得到了公认。大量的研究已经证实:喷砂酸蚀的种植体表面具有良好的早期骨结合效果,是一种比较成熟的表面处理方法。 然而,传统的喷砂加酸蚀表面处理制备完成后被置于空气中干燥会由相对亲水性变成疏水性。研究显示,疏水性表面将减少蛋白吸附,同时润湿性不足也会影响材料表面接触血液成分的初始状态以及后续的细胞反应。种植体表面润湿性在很大程度上取决于表面自由能。表面自由能增加能使材料表面润湿性增加。种植体润湿性和表面自由能的增加可以增强种植体表面与生物环境的相互作用,从而影响到种植体生物活性的发挥,甚至骨结合的长期效果。 不同的表面处理方法会影响表面自由能的大小。自年由等领导的研究小组,首次使用紫外线对二氧化钛膜进行表面处理,发现经紫外线处理过的二氧化钛膜层由疏水性能向超亲水性能转变,并将其成果发表在上之后,研究人员开始关注紫外线改性钛表面。到目前为止,较多的研究证明:紫外光催化反应是改性钛表面,提高表面自由能并获得超亲水特性的一种简单、方便和高效的方法。 本课题组前期对紫外线辐照喷砂酸蚀纯钛表面进行了理化分析和细胞学实验,结果显示:表面处理降低了碳氢化合物的含量低,同时,与表面相比,表面具有亲水性和高表面能促进了成骨细胞的粘附、增殖、分化和矿化;体外矿化诱导能力检测显示,表面诱导羟基磷灰石矿化沉积的速度是表面的倍。这些结果与国外有关紫外线研究是一致的。 大量的研究表明:那些由于长时间存放而老化的种植体在受到紫外线辐照后,其表面活性得以复活,提高表面自由能并同时获得亲水特性,促进了蛋白吸附、成骨细胞粘附、增殖、分化和矿化,甚至骨结合,显示出良好的生物相容性。 然而,就目前而言,国内外有关紫外线辖照的研究大部分集中在理化性质和细胞学实验,体内实验方面的研究相对较缺乏。那么,在体内实验中,通过紫外线辐照纯钛表面,改变喷砂酸蚀纯钛表面这一经典表面的自由能,钛种植体表面的成骨现象又是怎样的呢? 实验目的: 鉴于以上问题和争议,本研究的第一个目的是研究受区生物学特性与喷砂酸蚀钛种植体表面接触成骨的关系;第二个目的是研究紫外光处理对喷砂酸蚀钛种植体接触成骨的影响。 研究方法: 1. 实验动物:成年雄性健康的 Beagle犬共4只,12月龄,体重为 14-15kg。牙齿牙列完整,无慢性牙周病及龋齿,口腔粘膜色泽正常,咬合关系无明显异常。 2. Beagle 犬拔牙:4只Beagle 犬适应性饲养1周后,术前12小时禁饮食,术前半小时肌注青霉素钠40万u,速眠新和戊巴比妥钠复合麻醉下微创拔除双侧第二、三、四前磨牙和第一磨牙,术后连续三天给予青霉素80万单位肌注,以预防感染。术后进软食一周。拔牙创愈合三个月。 3. 种植体选择:种植体为 WEGO 种植体,长度为9mm, 直径为 38mm, 表面处理是 SLA, 作为对照组。 4. 种植体UV辐照:选用 Philips的 UVC灭菌灯, 使用 UVC 灭菌灯前先用75%酒精棉球擦拭灯管,再在无菌环境下距离材料表面10cm, 对 SLA 种植体表面照射 48h。 SLA+UV 处理,作为实验组。 5. 分组:使用随机数字表按随机分配的原则,将4只成年雄性健康 Beagle 犬分为2周组和4周组,每组各有2只。 采用左右半口对照设计,每只 Beagle 犬每边下颌骨植入5颗种植体,一边为实验组(SLA+UV),,一边为对照组(SLA), 每只 Beagle 犬植入10颗种植体,4只 Beagle 犬共植入40颗种植体。其中 SLA 组和 SLA+UV 组各有20个样本。 SLA 组的20个样本先用于分析受区生物学特性与接触成骨的关系。而后 SLA 组的20个样本和 SLA+UV组的20个样本用于分析对比 SLA 表面处理和 SLA+UV 表面处理钛种植体表面接触成骨现象。 6. 种植手术:拔牙创愈合三个月后。术前12小时禁饮食,术前半小时肌注青霉素钠40万u。 速免新和戊巴比妥钠肌肉注射麻醉后,常规消毒铺巾,7下颌骨槽脊顶切开,翻瓣,球钻定位,逐级预备种植窝,成型钻成形种植窝,植入种植体,种植窝大小与种植体是一致的,使种植体外螺纹贴着种植窝骨壁。对位缝合创口。术后常规抗炎处理。 7. 荧光双标记法:所有成年雄性健康 Beagle 犬于处死前的第13、14天在皮下注射盐酸四环素 25mg/kg; 处死前的第3、4天皮下注射钙黄绿素5mg/kg, 每种试剂使用时连续注射两天,每日注射一次。 8. 标本处理:分别在2周和4周各处死两只 Beagle犬,获得带种植体的 Beagle 犬下颌骨,以0.9%生理盐水反复冲洗,将标本切分成单独种植体,用10%中性福尔马林固定液浸泡,置于4℃恒温冰箱保存48-72小时,然后换成70%乙醇浸泡。 9. 显微 CT检查:取4个含种植体标本, 进行显微 CT数据扫描,并取种植体粗螺纹区周围45 _m-300 微米及300-600微米的空间进行三维重建。 10.不脱钙的种植体骨切片的制备: EXAKT510系统自动脱水,包埋后,用 EXAKT 300CP 切片机切片,然后用 EXAKT400CS 系统自动磨片至30um, 荧光观察,再用亚甲基蓝酸性 品红染色。 11.对比显微 CT的结果和硬组织切片,选择更能反映种植体表面成骨的实验方法。 12.取喷砂酸蚀组切片,观察种植体在颌骨不同部位的成骨差异,第一部分是种植体螺纹底部到皮质骨大约300um 距离的部分,第二部分是种植体螺纹底部到皮质骨大约300pm-600 u m 距离的部分,第三部分是种植体螺纹底部到皮质骨大于 600um 距离的部分。 13.对喷砂酸蚀组及喷砂酸蚀加紫外光辐照组按实验目的行荧光双标记及染色观察分析,评估种植体周围的骨愈合情况和计算BIC。 14.统计学处理: 测定数据结果均采用x±s表示,使用 SPSS13.0统计分析软件,正态分布数据先用析因设计的方差分析分析处理组与时间段之间是否有交互效应,如有再用单因素方差分析(one-wayANOVA), 预先用 Levene's test 检验方差是否齐性,如方差齐则采用样品均数见的两两比较的 LSD, 方差不齐则采取校正的方法Welch方法,多重比较用Dunnett’sT3法。当P<0.05时,认为差异具有统计学意义。 实验结果: 1. 实验动物情况:4只Beagle 犬术后6-9小时清醒进食,无死亡动物。种植手术伤口未见异常,均可达到一期愈合,无明显出血。无种植体松动。 2. 样本大体观察:种植体顶部被周围骨组织和纤维组织等包埋,未见明显骨吸收的现象,种植体无松动。 3. 微型 CT观察:可通过调整切面,观察到种植体周围每个面的成骨情况。可进行目标整体分割测量,在任意方向得到切片,得到较完整数据。对种植体粗螺纹周围45_m-300um范围,300 um-600 um 范围进行三维重建,两周时和四周时均可见较多新生骨小梁长入螺纹内部,但由于金属伪影的影响显示不清,无法进行三维重建。硬组织切片只能取一个方向的截面,但是对种植体表面0-45um区域显示清晰,可以很好地观察到种植体表面成骨的方向,可以清晰地观察至接触成骨现象。 4. 喷砂酸蚀种植体与皮质骨的不同距离对接触成骨的影响: 亚甲基蓝酸性品红染色:可见种植体螺纹与皮质骨距离不同,螺纹内新骨的量不同。2周:种植体螺纹凹槽底部与皮质骨大概300um时,即皮质骨是贴着种植体外螺纹的,此时有部分新骨长入螺纹内部,种植体表面包括螺纹凹槽底部可见新生骨小梁,有接触成骨;种植体螺纹凹槽底部与皮质骨大概600um 时,可见少量新生骨小梁顺着螺纹壁攀爬,种植体螺纹斜壁有少量新生骨小梁,螺纹凹槽底部未见明显新生骨小梁;种植体螺纹凹槽底部与皮质骨距离大于600um时,未见明显新骨生成。4周:种植体螺纹凹槽底部与皮质骨大概300um时, 此时很多新骨长入螺纹内部,分布于螺纹腔及螺纹底壁,斜壁,可见接触成骨;种植体螺纹凹槽底部与皮质骨大概300-600um 时,可见少量新生骨小梁顺着螺纹壁攀爬,螺纹底壁新生骨小梁不明显。种植体螺纹凹槽底部与皮质骨距离大于 600 um时,极少量新骨生成。 骨组织计量学:两周及四周时,对种植体螺纹凹槽底部到皮质骨的距离 300um, 300-600 um, ≥600 pm这三个组种植体周围的,新生骨面积进行测量,发现:新生种植体螺 纹凹槽底部到皮质骨的距离 300pm 时BIC 及新生骨面积>种植体螺纹凹槽底部到皮质骨的距离300-600 _ m 时 BIC 及新生骨面积>种植体螺纹凹槽底部到皮质骨的距离大于或等于 600 um 的及新生骨面积,差异均有统计学意义,螺纹凹槽底部与皮质骨越近,种植体-一骨接触效果越好。 5. 紫外光处理喷砂酸蚀纯钛种植体表面早期成骨效应组织学观察: (1)荧光分析:2周组:可见种植体周围及种植体螺纹内都有散在荧光,荧光主要集中在种植体螺纹处,皮质骨区域比骨髓腔区域荧光分布多。SLA 荧光主要集中在螺纹斜壁上和种植体周围, SLA+UV组,除了种植体周围和螺纹壁上外,螺纹底部也有更多荧光分布。4周组:可见种植体周围及种植体螺纹内都有散在荧光,荧光主要集中在种植体螺纹处,与2周比,可见骨髓腔区域(即离皮质骨远的地方)也有新骨生成,且新生骨小梁较2周时粗大。 SLA+UV 组较 SLA 组更多荧光分布。目 SLA+UV 组较 SLA 组荧光条带粗。 (2)骨磨片亚甲基蓝-酸性品红染色:2周, SLA组可见螺纹腔底部无明显新骨生成,新生骨小梁多来源于周围基骨,沿着种植体螺纹腔斜壁爬行而来,新生骨小梁细长,颜色稍深;SLA+UV组:见新生骨小梁不仅沿着种植体螺纹腔斜壁爬行,在离基骨远的螺纹腔底壁,也有较多新骨生成。4周, SLA 组可见新骨由周围基骨往螺纹腔内延伸,螺纹腔中间有新生骨小梁,也有新生骨小梁沿着螺纹腔斜壁往内生长,螺纹腔底壁散在分布着少量新生骨小梁,种植窝骨壁见大量新形成的哈弗氏系统,螺纹内部未见明显的哈弗氏系统。SLA+UV组:见新生骨小梁不仅分布于离周围成熟骨近的螺纹腔斜壁,在离基骨远的螺纹腔底壁也见大量新生骨小梁,接触成骨非常明显,同时,螺纹腔侧壁和底壁新生骨小梁都较2周时增粗明显,除了种植窝骨壁见大量新形成的哈弗氏系统,螺纹内部也有新生成的哈弗氏系统。 (3)染色片的骨组织计量学分析:两周和四周时, SLA+UV 组种植体-—一骨结合率>SLA组种植体- 骨结合率,差异有统计学意义。两周和四周时: SLA组与 SLA+UV 组新生骨面积百分数差异无统计学意义。 结论 1.本实验采用 Beagle 犬下颌骨延期种植模型,拔牙后3个月植入种植体, Beagle 犬下颌骨与人接近,可比性强,较符合种植临床实际情况。新的备洞和种植体植入模式,能更清晰地观察到不同表面处理方法对成骨的影响。 2. 显微 CT 可以测定骨三维结构,具有连续性和完整性的优势。可以宏观地观察到种植体周围骨质情况,但是由于金属伪影的存在,显微 CT 对种植体表面接触成骨现象显示不够清晰。硬组织是一种单层组织切片,制作过程较复杂,而且会破坏标本的完整性,从而使得一个标本不能同时用于结构参数分析以外的其他检测。但是它对于种植体表面成骨的细微变化反映较清晰。 3. SLA 钛种植体表面可观察到接触成骨,接触成骨与受区的生物学特性相关,与皮质骨距离近的区域,接触成骨效果好,种植体 BIC高, BA也高;与皮质骨距离大于600um 的区域,接触成骨不明显。 4. SLA+UV 组接触成骨效果好,在两周和四周时, SLA+UV 组种植体-——骨结合率均好于 SLA组种植体——骨结合率。 关键词:纯钛种植体、表面处理、动物实验、喷砂酸蚀、紫外光 前言 随着种植材料的不断改进,种植修复因为咀嚼功能恢复良好、舒适美观、无需备牙等优点而广受患者青睐。种植牙因为美观、舒适,并能很好的恢复咀嚼功能,作为人类的第三副牙齿,近年来被广泛接受。但是种植牙仍存在一些问题,如骨结合率较低,愈合时间较长,种植体植入体内到临床负重一般都需要6-12周的时间,这一定程度上限制了种植修复的临床应用[1,2]研究表明,大部分的种植失败发生于种植体早期愈合的过程中,愈合速度越慢,种植体受到各种风险因素的影响越大,种植失败的风险越高[3]。 影响种植体早期成骨有两个因素:11、受区的生物学特性;2、种植体的表面特性。 一、接触成骨和距离成骨 种植体植入机体后,需经过一段时间的骨创面的生长愈合后才能达到骨结合。主要分为四个阶段。 第一阶段:种植体植入24小时内,创伤区域血液充满,继而形成血凝块,在这第一阶段里,血小板粘附到种植体表面后发生活化,开始释放一系列的生长因子和细胞因子。 第二阶段:该阶段常常被称为骨引导,包括正在分化的成骨细胞的补充及迁移到种植体表面。该阶段中成骨细胞通过结缔组织性支架发生粘附,迁移及成骨作用。该过程中骨引导发挥重要的作用。 第三阶段:主要命名为编织骨形成,骨祖细胞开始分化为成熟的成骨细胞,同时在种植表面分泌和释放骨基质,骨细胞分泌的骨基质粘附主要粘附在坚硬的表面(如骨组织或种植体表面)并逐渐钙化。 第四阶段:编织骨组织的不断改建和成熟[4,5]。总之,种植体周围成骨方式主要是通过骨基质直接沉积在种植体表面而形成。正是由于骨基质分泌后沉积的方向的不同,种植体植入之后的骨组织存在两种不同的愈合模式:接触成骨和距离成骨[2,4,7]。接触成骨是指成骨细胞在种植体表面接触后直接分泌骨基质,其生长方向是由种植体表面向种植窝周围的旧骨组织表面生长。而距离成骨与之相反,是新生骨基质沉积在种植体前言附近和种植窝周围的旧的骨组织表面,其生长的方向为旧骨组织向种植表面生长[8]。 Davies 等研究显示:这两种愈合方式在揭示种植表面设计在骨结合中的作用以及阐明种植/骨组织界面之间的结构不同发挥重要的作用[6]。接触成骨的最主要的过程是能够尽早的建立生物学基质(血凝块),间充质细胞可从中迁移,接触到种植体表面后,增殖和分化成为成骨细胞,最终在种植体表面引导生产新的骨基质[4]。研究发现:接触成骨在种植体表面直接形成的编织骨有利于增加种植体初期和早期的机械稳定性[9]。研究表明,大部分的种植失败发生于种植体早期愈合的过程中,愈合速度越慢,种植体受到各种风险因素的影响越大,种植失败的风险越高[10]。骨结合早期阶段,尽早建立接触成骨,有利于骨组织尽快沉积在种植体的表面以获得更好的初期稳定性,也有利于完成骨整合[3]。骨组织愈合的速率和程度依赖于种植体表面接触成骨的程度[11]。因此,促进接触成骨,是加快种植体与骨界面的愈合速率的关键。 二、影响种植早期表面接触成骨的因素 影响种植体早期成骨有两个因素:1、受区的生物学特性;2、种植体的表面特性。 1. 受区的生物学特性 受区的生物学特性是指受区骨的解剖生理学,包括骨代谢特点、骨密度、血供、生长因子、成骨细胞来源等。不同的骨质结构导致了不同的骨生物力学和不同的骨愈合骨改建能力。研究表明,不同的动物在相同部位植入相同的材料,实验结果有差异。这可能是由于它们的骨的新陈代谢和骨生理学不同[7,12-15]。同时在同一动物,将生物材料植入不同的部位,结果也有差异。Guehennec LL 将骨代用品分别植入兔的股骨,颅骨和胫骨,观察4周,发现骨愈合,新骨生成在兔股骨是48.5%,颅骨是22.9%,胫骨是12.6%。这可能是由于不同部位的骨结构不同,包括皮质骨和松质骨分布特点不同。不同的骨质结构导致了不同的骨愈合骨改建能力[16,17]。同一植入部位不同区域的骨愈合能力也有所差异, Rong 将在兔胫骨距离干骺端三个不同距离处分别植入三枚种植体,结果显示,距离干骺端最近的骨-种植体接触率最高,接触成骨最明显,骨愈合最快[18]。 然而,在颌骨的不同部位,种植体表面的成骨是否有差异呢?在颌骨的哪一区域,接触成骨效果最好呢?目前尚无较肯定的研究结果。 2. 种植体的表面特性 种植体的表面特性是指种植体的表面形貌、元素组成、分子结构、电荷状态、表面自由能、亲疏水性特性等。种植体表面经过处理,可改变其表面性能,从而促进接触成骨,缩短骨整合所需的时间,提高种植的成功率。因此,为了达到这一目的,大量的学者在种植体表面处理方面进行了相关的体内外研究,虽然至今已有30年余,但对种植体表面形貌及理化性质的研究仍然是当今口腔种植学领域十分热门的研究之一。钛种植体表面处理是指用物理和化学的处理方法,处理出适度粗糙的表面,使其具有良好的生物黏附力、表面张力、表面亲水性、骨组织亲和性和适宜的申势能等[19]。多年来,经过学者们不断的研究,种植体表面处理技术发展迅速,现达几十种甚至上百种之多,但根据其处理方式可大致归类为以下四种: (1)表面加成法:钛浆涂层(titani um Plasma sprayed TPS), 羟基磷灰石(hydroxyapatile, HA)涂层; (2)表面去除减少法:可吸收研磨介质(resorbable blast media, RBM), 喷砂酸蚀(SandBlast and Acid Etching, SLA); (3)表面氧化:电化学氧化法,阳极氧化法,微弧氧化(Micro-arc Oxidation,MAO); (4)表面修饰法(离子注入法,激光处理,生物活性分子修饰,化学蚀刻技术,酸处理,碱热处理)[20-22]。 每一种处理方法均有其优缺点,其中, SLA 是被研究的最多的一种表面处理方法,无论从其表面形貌、表面粗糙度还是生物相容性和骨引导性等方面,都有许多的研究报道,它已成为国际上使用最为广泛的种植体表面之一,其表面良好的机械生物相容性已经得到了公认。目前世界上一些著名品牌的种植体也就是采用 SLA 的表面处理方法,如瑞士的 stra umman@种植体系统、德国的 Ankylos@系统等。喷砂酸蚀是先用大颗粒喷砂获得 10-30um 孔洞并形成一级粗糙,再加上混合酸高温酸蚀来添加1~3um微孔形成二级粗糙度,研究表明:一级粗糙度类似于骨陷窝有利于成骨细胞的附着,,二二级粗糙度可以刺激成骨细胞增殖分化,这种多级立体表面形貌有利于骨结合的形成[23-26]。研究表明:在喷砂加酸蚀中,喷砂的大孔利于血管的长入和骨代谢物的排泄,微孔利于骨细胞等吸附成骨,结果明显增加了种植体的扭矩值[23,24,26]。 但是,传统的喷砂酸蚀种植体在制备完成后被置于空气中干燥会发生表面特性的改变,会由相对亲水性变成疏水性。研究显示,疏水性表面将减少蛋白吸附,同时润湿性不足也会影响材料表面接触血液成分的初始状态以及后续的细胞反应[27]。 研究显示,种植体表面的润湿性在很大程度上取决于表面自由能并影响到生理环境下的接触 程度,润湿性和表面自由能的增加可以增强种植体表面与生物环境的相互作用,从而影响到种植体生物活性的发挥,甚至骨结合的长期效果[28,29]。 什么叫表面自由能?广义表面自由能是指保持相应的特征变量不变,每增加单位表面积时,相应热力学函数的增值。狭义的表面自由能:保持温度、压力和组成不变,每增加单位表面积时 Gibbs 自由能的增加值。称为表面 Gibbs 自由能,或简称表面自由能或表面能,用符号r 表示,单位为J/m,焦耳/平方米。应该注意的是,表面能并非系统表面上的能量,而是表面上的分子比同量的内部分子所额外超出的能量。 材料表面自由能可以通过与不同介质接触的润湿程度来进行计算和比较。 液体在固体表面形成液滴的接触角0与固、液、气三个界面自由能之间有如下的关系: 式(1)称为杨氏方程,亦称润湿方程。式中:yi是与液体的饱和蒸气平衡时液体的表面自由能、x是固体的表面自由能、Ys是固液间的界面自由能, mJ/m²。 对于不同表面自由能的表面特性,国内外已经有不少研究。表面自由能增加能使材料表面润湿性增加[30]。研究表明,与全血接触的过程中,高表面能的亲水性表面粘附了更高浓度的补体 C1、凝血酶、凝血酶原,血小板较少;而低表面能的疏水性表面则粘附有较多的纤维蛋白原和血小板[31]。研究显示细胞在金属材料上的粘附率与材料的表面自由能成正比[32]。不同的表面处理方法会影响表面自由能的大小。自1997年由Wang 等领导的研究小组,首次使用紫外线(Ultraviolet,UV)对二氧化钛膜进行表面处理,发现经UV处理过的二氧化钛膜层由疏水性能向超亲水性能转变,并将其成果发表在 Nature 上之后,研究人员开始关注紫外线改性钛表面[33]。到目前为止,较多的研究证明:紫外光催化反应是改性钛表面,提高表面自由能并获得超亲水特性的一种简单、方便和高效的方法。 光催化反应,又称“本多-藤岛反应”,它是由于 Ti0是一种半导体材料,禁带宽度为 3.2ev,当Ti0受到大于3.2ev能量的光照射时会产生光催化作用。根据 可知当受到波长小于等于 387.5nm的光照射时,光催化作用就会产生,价带的电子就会获得光子能量越至导带,形成光生电子,价带上的电子跃迁到导带上,使二氧化钛表面处的Ti4+转变为 Ti3+, 而价带中则相应生成光生空穴而光生空穴具有很强的氧化能力,可以把吸附在 Ti02 表面的 OH-和 H20分子氧化成·OH自由基,·OH自由基是短暂存在的强氧化剂,可以将 Ti02 表面的碳氢化合物氧化成 C02和H20。具体反映如下: ·OH+dye→…→CO2+H2O H++dye→…→CO2+H2O dye:染料或碳氢化合物 由以上反应机理可知,TiO 光催化降解有机物,实质上是一种自由基反应,反应完成后,在材料表面留下大量的亲水性基团-0H, 使其获得超亲水特性。 Zhao 等报道紫外线照射的钛试样表面润湿性大大增加,可能的原因是由于紫外线可以激活纯钛表面 TiOz的光催化降解作用以分解其上粘附的有机物,进而使得表面亲水性和自由能发生变化[34]。Toworfe GK 等发现经紫外处理的钛表面具有更高的表面能,高表面能表面可促进种植体与生物环境的相互作用[35,36] Eriksson 学者对钛片植入后至八周的亲水性和非亲水性钛片植入鼠胫骨动物实验研究表明亲水性种植体表面存在骨组织形成的标记物,这表明具有亲水性种植体表面上可以促进骨组织的直接形成[37]。大量的研究表明:那些由于长时间存放而老化的种植体在受到 UV 辐照后,其表面活性得以复活,提高表面自由能并同时获得亲水特性,促进了蛋白吸附、成骨细胞粘附、增殖、分化和矿化,甚至骨结合,显示出良好的生物相容性[9,38-42]。 本课题组前期对紫外线辐照纯钛表面进行了理化性质和细胞学实验:在钛片上制备 SLA 表面处理和 UV+SLA 表面处理,扫描电子显微镜、光学干涉轮廓仪分别检测表面的形貌特征、粗糙度,结果显示两者具有相似的三维立体多级孔洞形貌和中等粗糙度;X线光电子能谱仪检测元素成分发现 UV+SLA 表面处理碳氢化合物含量较 SLA 表面处理低,UV 辐照可以促进碳氢化合物的分解;接触角测量仪检测润湿性发现:UV-SLA表面获得了大量的亲水性基团-0H, 与SLA 表面相比, UV-SLA 表面具有亲水性和高表面能。MG63成骨细胞体外生物活性检测显示:超亲水性 UV-SLA 表面,促进了 MG63 成骨细胞的粘附、增殖、分化和矿化。体外矿化诱导能力检测显示, UV-SLA 表面诱导羟基磷灰石矿化沉积的速度是 SLA 表面的8倍[43]。这些结果与国外有关紫外线研究是一致的。 目前普遍认为:紫外线辐照纯钛表面能清除其表面的碳氢化合物的污染,使纯钛表面由疏水性变成亲水性,使之获得髙表面能,体外实验发现其蛋白粘附能力和细胞增殖能力增加。那么,在体内实验中,通过紫外线辅照纯钛表面,改变喷砂酸烛纯钛表面这一经典表面的自由能,钛种植体表面的成骨现象又是怎样的呢?接触成骨现象是增多了还是减少了呢?我们查阅国内外文献,发现目前尚无研究紫外线辐照喷砂酸烛纯钛种植体表面接触成骨现象的体内实验。 三、研究目的和意义: 鉴于以上问题和争议,本研究的第一个目的是研究受区生物学特性与喷砂酸蚀钛种植体表面接触成骨的关系;第二个目的研究紫外光处理对喷砂酸蚀馱种植体接触成骨的影响。 引言 种植体植入后,有两种成骨方式,接触成骨和距离成骨。接触成骨是指成骨细胞在种植体表面接触后直接分泌骨基质,其生长方向是由种植体表面向种植窝周围骨组织表面生长。而距离成骨与之相反,新生骨基质沉积在周围的成熟骨组织表面,其生长的方向为由周围成熟骨组织向种植体表面生长[6,8]。 传统的种植体动物实验中,种植体植入方式是预备种植窝(预备种植窝的钻针直径是比种植体直径小,将种植体旋入种植窝,这样,在种植体植入过程中就会有一部分骨质嵌入种植体螺纹内部,在最后的病理切片中,我们看到种植体螺纹里除了有新生骨外,还有较多周围成熟骨。在临床操作中,这种方式可以促进种植体初期稳定,利于种植体的成功,但是,在动物实验中,这种方式不利于观察新生骨的生长方向。我们设计的动物模型是将种植窝预备到种植体外螺纹直径大小,将种植体植入种植窝,使种植体外螺纹靠着种植窝壁,这样可以稳定种植体螺纹内与种植窝骨壁之间的距离,从而统一了成骨的初始状态。种植体螺纹底部距离周围成熟骨有一定距离,这样能清楚地观察到种植体表面对新骨生成的影响,可以较清楚地观察到新生骨的生长方向。 目前研究种植体骨整合的动物模型有鼠、兔、犬、猪、羊。其中犬下颂骨结构,成骨方式与人较相似,故本实验选用犬下颂骨,建立实验动物模型。 1.1材料与仪器 1.1.1实验药物: 速眠新Ⅱ注射液 解放军农牧大学兽医研究所 碧兰麻 法国 3%戊巴比妥钠 广东佛山化工实验厂 青霉素钠 广州白云山天心制药股份有限公司 氯化钠注射液 四川科伦药业股份有限公司 生理氯化钠注射液 浙江巨能乐斯药业有限公司 1.1.2包埋药品: 多聚甲醛溶液 苏州市第二化工研究所有限责任公司 甲基丙烯酸甲酷、氢氧化钠 广州化学试剂厂 防水型氰基丙稀酸酯、环氧树脂 广州化学试剂厂 无水过氧化苯甲酰、邻苯二甲酸酯 上海凌峰化学试剂有限公司 1.1.3染色试剂及材料: 盐酸四环素荧光标记物 sigma 钙黄绿素荧光标记物 sigma 亚甲基蓝 sigma 酸性品红 sigma 高锰酸钾 天津市化学试剂三厂 苦味酸 天津市染料化学第二厂 磷酸氢二钠 广州化学试剂厂 定性滤纸 青岛雅各化学试剂销售有限公司 1.1.4仪器 FRIOS种植机 费亚丹 WEGO种植器械盒 威高洁丽康生物材料有限公司 straumman种植器械盒 瑞士 高压蒸汽灭菌器(2540MK) 美中互利工业公司 EXAKT510脱水仪 德国艾卡特公司 EXAKT520光固化包埋机 德国艾卡特公司 EXAKT300CP切片机 德国艾卡特公司 EXAKT400CS磨片机 德国艾卡特公司 超纯水Milli-QUltra-Pure Millipore, Billeria, MA,USA 电子天平(0.0001g) BP110S,Sartorius, Germany 高压蒸汽消毒灭菌器2540MK 美中互利工业公司 恒温干燥箱cd-63450 Heraeus Germany 双向磁力搅拌器 金坛市顺华仪器有限公司 光学显微镜 Olympus Japan 荧光显微镜 Olympus Japan Image Pro Express6.0图像处理软件 Olympus Japan 1.1.5手术器械 WEGO 种植器械盒, stra u mman 种植器械盒,手术刀柄,刀片,骨膜剥离器,持针器,血管谢,号丝线,组织剪,巾甜,铺巾 1.1.6种植体 选用 WEGO 种植体, 规格:3.8×9 mm, 种植体的表面处理:: SLA (威高洁丽康生物材料有限公司提供) 图1-1 种植体 Figure1-11IDental implant 1.2实验动物及实验方法 1.2.1实验动物 成年雄性健康的 Beagle 犬共4只,12月龄,体重为14-15kg。提供机构为高要市康达实验动物科技有限公司,许可证号:SCXK (粤)2012-0081。Beagle犬拔牙,种植体植入手术及饲养均在中山大学实验动物中心进行。实验动物质量合格证编号:0096666。 Beagle 犬全口共42颗牙。牙齿牙列完整,无慢性牙周病及龋齿,口腔粘膜色泽正常,咬合关系无明显异常。 常温分笼饲养,自由摄食饮水。适应性饲养1周,培养软食习惯,认知实验者。实验过程中对动物的处置符合动物伦理学要求。 图1-2 beagle犬 Figure 1-2 Beagledog 1.2.2拔牙手术 4只 beagle 犬术前12小时禁饮食,术前半小时肌注青霉素钠40万 u.麻醉方法:速眠新和戊巴比妥钠复合麻醉,速眠新Ⅱ按 0.1mL/kg 的剂量在 beagle 犬后腿肌肉注射,待麻醉起效后,再用3%戊巴比妥钠按 1mL/kg 剂量继续肌肉注射[44]。麻醉成功后,常规消毒铺巾,口腔内牙槽骨颊舌侧加碧兰麻 0.8mL 局部浸润麻醉。 测量犬下颌骨长度,宽度,高度。为后面种植手术做参考。 先分根,微创拔除双侧下颌第2、3、4前磨牙和第1磨牙,修整牙槽骨,缝合拔牙创口。术后连续三天给予青霉素万单位肌注以预防感染。术后进软食一周。两周后拆线。 图1-3 拔牙Figure1-3 Tooth extration 1.2.3实验动物分组 拔牙后3个月,根据2、4周的观察周期,使用随机数字表按随机分配的原则,将4只成年雄性健康 Beagle 犬分为2组,每组各有2只。计划每只 beagle 犬每边下颌骨植入5颗种植体,每只beagle 犬植入10颗种植体,4只beagle 犬共植入40颗种植体。 1.2.4.种植手术: 术前种植计划: 可利用的骨长度,即第一前磨牙远中至第二磨牙近中约55mm, 计划每侧下颌骨植入5枚种植体,第一颗种植体距离第一双尖牙远中约10mm, 第五颗种植体距离第二磨牙近中约5mm。 严格按外科的无菌操作方法,速眠新按 0.1mL/kg, 3%戊巴比妥钠按 1mL/kg 对 Beagle 犬进行肌肉注射[44]。麻醉成功后,用0.3~0.5%碘伏消毒 Beagle 犬头部皮肤和口腔黏膜各消毒3次,铺巾,沿下颌骨牙槽脊顶切开,翻瓣,暴露骨面,常规球钻定位(离第一前磨牙1cm处开始,以避开尖牙牙根),逐级预备种植窝,用成型钻对种植窝进行成形,植入种植体,取出中央螺丝,置埋入式愈合基台,对位缝合创口。 术后连续五天给予青霉素80万单位肌注,以预防感染。术后进软食一周。二二周后拆线。 图1-4种植体植入位点设计 Figure2-4 The sites of implant 1.2.5实验动物生活状态观察 定期观察 Beagle 犬术后术区的愈合情况和生活状态变化,每天坚持清洗 Beagle 犬及狗笼,专业实验室技术人员喂养及观察动物伤口的愈合情况。 1.2.6荧光双标记法 所有成年雄性健康 Beagle 犬于处死前的第13、14天在皮下注射盐酸四环素 25mg/kg; 处死前的第3、4天皮下注射钙黄绿素5mg/kg, 每种试剂使用时连续注射两天,每日注射一次[45]。 盐酸四环素注射液的配制:将盐酸四环素粉剂溶于生理盐水中,浓度为 25 mg/ml。现配现用,4度冰箱避光保存。 钙黄绿素注射液配制:将钙黄绿素粉剂溶于 1.4%NaHC03溶液中,浓度为 5mg/ml。现配现用,4度冰箱避光保存。 四环素在荧光显微镜下呈黄色,而钙黄绿素则呈绿色,以显示出两次注射标记物期间新骨形成的情况。 1.2.7切取标本 4只Beagle 犬均以3%戊巴比妥钠过量注射麻醉致死,切开术区牙槽嵴顶粘膜,分离出种植区域,2周组可以看到种植体顶端,4周组可以依稀辨认种植体顶端,用镊子去净种植体顶部的软组织,避免划损其周的骨组织及纤维结缔组织,插针定位, X-ray 检查(以做切分标本时的参考),最后修整标本后以0.9%生理盐水反复冲洗,用10%中性福尔马林固定液浸泡,置于4℃恒温冰箱保存48-72小时。 1.2.8不脱钙的含种植体骨磨片的制备 1)组织固定、脱水和包埋 新鲜组织块置于 10%中性福尔马林固定液中固定 48-72h后流水冲洗24h, 再将颌骨标本夹固于 EXAKT300CP 切片机夹具上,参照之前的 X-ray定位,用金刚锯条切割分切带种植体的骨组织,修切暴露出少许种植的螺纹为宜,标本大小约5mm×10mm×10mm, 做好标本编号标记, 在 EXAKT510脱水仪中用 70%~100%的酒精进行梯度脱水,脱水具体过程及时间如下: 脱水溶液 脱水时间 70%酒精 12小时 90%酒精 12小时 95%酒精Ⅰ 30小时 95%酒精ⅡI 30小时 100%酒精Ⅰ 24小时 100%酒精ⅠI 12小时 脱水完成后将组织块在 EXAKT510 渗透系统中进行树脂渗透,再置于 EXAKT520 光照聚合系统中,用白光和蓝光控制聚合,聚合时间在8小时内,尽可能减少人工具聚合过程中的裂隙或温度过热。 2)组织切片 标本完成树脂聚合反应后, 在EXAKT401 真空胶粘压缩系统中使用 Technovit4000 黏接剂将包埋好的标本黏合于载玻片I,将载玻片1真空吸附于 EXAKT300CP 切片机夹具上,进一步修切包埋后的组织块,充分暴露一侧的种植体,尽可能的校正种植体长轴方向,完成后,取下夹具上的载玻片1,将其吸附于 EXAKT400CS 磨片机上并对带种植体的标本表面进行抛光,抛光完成后,用 Technovit7210VLC 胶水在 EXAKT401 载片黏合装置上将载玻片2黏合于标本的抛光面侧,此时,载玻片1、带种植体的包埋组织标本和载玻片2合成一体,形成一个两侧载玻片的双夹结构。将载玻片1的一侧吸附在 EXAKT300CP切片机的夹具上,通过自动步进定位装置切割厚度,将其厚度设定为 150~200um切下载玻片2侧约150um厚的切片,再将切下的带骨切片载玻片2吸附在带滚动磨盘装置和电子测量控制系统EXAKT400CS 微磨片装置,设定磨片的厚度为30um。分另使用各级 SiC 和AI203沙纸进行自动磨片,将其磨至预定的厚度(30um), 最后再用细砂纸对切片表面进行抛光,整个过程要有 AW100 测量控制系统进行控制,最终制作出作厚度约为30um的带种植体的光滑骨磨片,以作荧光观察和亚甲基蓝-酸性品红染色观察分析[46] 图1-8 切片,磨片 1.2.9骨切片染色 将切磨好的骨切片使用双蒸水进行超声清洗 10min, 自然干燥后用亚甲基蓝-酸性品红染色: 一、染色液的配制: 1、亚甲基蓝染液;溶液A;蒸馏水75ml, 亚甲基蓝1g, 溶液B;蒸馏水75ml高锰酸钾 1.5g。将溶液A、B混合,100℃水浴直至沉淀重新溶解,然后冷却至室温后过滤。用滤纸过滤3次,棕色瓶子装。 2、苦味酸酸性品红染液:酸性品红0.25g,冰醋酸0.5ml, 甘油10ml, 蒸馏水90ml 然后加苦味酸至饱和。滤纸过滤1次,棕色瓶子装。 二、染色步骤: 1、亚甲基蓝染液:60℃水浴染色10分钟,滤纸吸干染液,然后自然晾干;60℃蒸馏水漂洗,3分钟左右,空气中干燥后进行下一步。 2、酸性品红染液:把组织片完全沟在苦味酸酸性品红染液上,染色约3分钟,滤纸吸干染液;空气中干燥后进行下一步。 三、脱水和透明 1、95%、100%酒精各脱水约5分钟。 2、二甲苯透明,这里透明的时间根据切片厚薄而异, 30u的切片一般10分钟。 3、树脂封片。把切片取出,最好别让切片完全干燥,以保留少量二甲苯在上面为宜。快速把切片放在干洁的玻片上,滴一小滴树脂在切片中央,盖上盖玻片,由中央往四周均匀用力压紧盖玻片,让树脂往四周流动,然后保持加压2天左右待树脂干。 图1-9 染色 1.3结果 1.3.1拔牙时观察 beagle 犬牙列情况: 犬恒牙列共有42颗牙齿,上颌20颗,分别为:6颗切牙,2颗尖牙,8颗前磨牙,4颗磨牙;下颌22颗,分别为:6颗切牙,2颗尖牙,8颗前磨牙,6颗磨牙牙齿左右对称分布, 下颌比上颌多两颗磨牙, 前磨牙依次增大,以第四前磨牙体积最大,前磨牙都有近远中两个牙尖,牙尖尖锐,近中牙尖明显大于远中尖。 图1-10 观察 beagle 犬牙列情况 1.3.2 Beagle 犬下颌骨情况 12月龄,体重为14-15kg 的 Beagle犬,下颌骨从第二前磨牙到第一磨牙长度约5.5cm,高度 2cm, 宽度0.7cm。 1.3.3实验动物情况 实验观察期间术区无红肿、化脓,手术伤口无炎症感染,均可达到一期愈合, Beagle 犬活动未受影响,生活正常,无死亡动物。二周后拆线。种植体无松动。每只 Beagle 犬植入10枚种植体,4只beagle 犬共40枚种植体,均无松动。 图1-11 伤口愈合情况 1.3.4样本大体观察 种植体顶部被周围骨组织和纤维组织等包埋,未见种植体无松动,未见骨吸收的现象。在2周的标本中,可见种植体顶部主要为纤维样软组织覆盖;在4周的标本中,种植体顶部为较疏松的骨质所覆盖。 图1-12 样本大体观察 1.3.5骨组织形态学观察 亚田基蓝-酸性品红染色观察;红色的是骨小梁,蓝色的是间质。新生骨小梁较周围成熟骨颜色深,新生骨小梁较细长;间质内可见较多成骨细胞,成纤维细胞,血管,类骨质。区分新骨,旧骨有两个办法,一是通过形态和颜色,新生骨小梁较细长,颜色较深,二是通过位置,位于螺纹腔内部的骨小梁都是新生骨。 可以观察到种植窝预备的痕迹--种植窝是贴着种植体外螺纹的,可以清晰地观察到新骨和原有骨的界限。2周和4周时都可以看到部分新骨从周围的基骨往螺纹腔内长入,部分骨小梁先附着于种植体表面,往基骨方向生长。两个不同的骨生长方向。可观察到接触成骨和距离成骨。4周时较两周时新生骨小梁粗大,接触成骨更加明显。 图1-13 切片(亚甲基蓝-酸性品红染色: A,CX40; B,D×100) 1.4讨论 1.、实验动物的选择: 采用动物模型研究种植体的骨愈合情况,主要在于可以通过人为手段进行干预,在较短时 间内,能够系统地观察种植体周围骨愈合的生理变化,为临床试验提供可靠的资料。它要求实验动物的实验过程以及实验模式最大限度地模拟临床表现,这样才能使实验结果更具可靠行及可利用性。 在种植义齿的研究中,目前一一般选择猴、猪、羊、犬、兔和鼠为实验对象建立动物模型,各种实验动物各有优缺点,猴作为实验对象能够形成较好的实验模型,但价格昂贵,且难以饲养。猪和羊体积较大,操作搬运不方便,在一定程度上限制了它们的应用。鼠和兔虽价格便宜,但体积小,不方便种植体的选择,且抗感染能力差[18.47-51]。虽然没有一种动物能完全符合理想的动物模型要求,但综合各种因素,其中相对最适合的研究动物是犬。犬骨具有与人骨相似的次级骨单位结构,其含水量、无机成分、蛋白成分等比猪羊更接近人骨。成年犬包括beagle犬、杂种犬、猎犬、家犬等。其中 Beagle 犬由于体形适中、性情温顺、遗传性状稳定、实验结果重复性好、适应性强等优点,已被 WHO 推荐为标准实验用犬。beagle 犬的牙槽骨的宽度和骨质与人的牙槽骨较为接近,是建立研究种植体表面处理较为理想的动物。多数以 Beagle 犬为模型动物的实验,都选用雄性犬。雌性犬性格安静胆小,体型较小,更易进行麻醉检查等操作,雄性犬活泼好动,成年雄性犬体型明显大于雌性,操作稍困难,但雄性犬下颌骨高度和宽度明显优于雌性犬,种植条件好,可选用用于人类的较小直径种植体:而雌性犬骨条件较差,人类的较小直径种植体种植都较困难,需另外定制较小直径种植体,增加实验难度。所以般选用雄性 Beagle 犬作为实验动物[52-55]。 2、种植部位的选择: 选 beagle 犬作为种植体研究的动物模型,有的选非口腔内牙槽骨,如下颌骨下缘、股骨、胫骨等处植入种植体建拉模型[56.57]。该方法操作方便,易于设计、观察和控制,但与临床实际相差较大。选口腔内牙槽嵴建立原位模型,更近似于人类口腔情况,实验结果更可信。本实验选用 beagle 犬下颌骨。 3、种植方式的选择: 可选择即刻种植,也可以选择延期种植。 延期种植与即刻种植最大的区别在于,延期种植要求在拔除患牙后3-6个月后再行Ⅰ期种植体植入术,而即刻种植则在拔除患牙的同时在拔牙位点植入种植体。Beagle 犬即刻种植模型多用于研究即刻种植时骨改建的情况,或者对比即刻和延期的临床效果差异,或者是某一种植体在即刻种植中的优势[58-61]。对于种植体表面处理的研究,多选用延期种植[53.54.62.63]本实验选择延期种植,它保证了拔牙窝的充分愈合,统一了种植的初始状态,控制实验误差,增加了细间可比性。 4、关于拔牙: 第一前磨牙区域牙槽骨较窄,且第一前磨牙位置下方有尖牙牙根,可利用骨高度较小,所 以本实验没有拔除第一前磨牙,而是拔除从第二前磨牙到第一磨牙。前磨牙依次增大,以第四前磨牙体积最大,第二,三,四前磨牙,第一磨牙都有近远中两个牙尖,牙尖尖锐,近中牙尖明显大于远中尖,有近远中两个牙根,根分叉大,牙根较细长,冠根比例约13,牙根远长于牙冠,因此仅以颊舌向力量用牙钳拔除困难,易导致根折。本实验先在近远中牙尖分界处用金刚砂车针磨开分根,再分别挺松近远中牙根,牙钳夹出。注意分根时车针要磨到根分叉,有落空感,否则在牙挺挺松近远中根时容易导致断根,挺松牙根时力量要适当,否则可能也可能会断根,因为 beagle 犬下颌骨比较硬,牙根比较硬,比较脆,而且牙根细长, 一旦断根,掏根将会大大增加拔牙难度,增加手术创 伤。这种拔牙方法无需去除牙槽骨,即可将犬牙完整拔除,对牙槽骨损伤小,最大限度的保存了牙槽窝骨壁,有利于种植体周牙槽骨的保留,同时也避免了断根。 5、关于种植体植入位点: 图1-14 植入位点 可利用的骨长度,即第一前磨牙远中至第二磨牙近中约55mm, 每颗种植体直径是 3.8mm,每侧下颌骨植入5枚种植体, beagle 犬下颌骨越往后骨宽度越宽,第一颗种植体距离第一双尖牙远中约10mm, 因为 beagle犬尖牙牙根往后弯曲直第一双尖牙近中根根尖下方(如图A),第五颗种植体距离第二磨牙近中约5mm, 以避开第二磨牙近中根,种植体之间间距5mm, 以方便后期标本分离。 6、种植窝的备洞特点: 种植体植入后,有接触成骨和距离成骨。传统研究种植体表面处理的动物模型多选用延期种植,种植窝的预备大小与种植体大小一致,使部分旧骨嵌入种植体螺纹内,以使种植体的初期稳定性更好[55.64-66]。但这样就不能很好地观察到新骨的生长方向。本实验使种植体外螺纹靠着种植窝壁,这样可以稳定种植体螺纹内与种植窝骨壁之间的距离,从而统一了成骨的初始状态(如图1-6)。这样只要是出现在螺纹腔里面的骨组织都是新生的骨组织,种植体螺纹底部距离周围成熟骨有一定距离,这样能清楚地观察到种植体表面对新骨生成的影响。可以较清楚地观察到新生骨的生长方向和新生骨的量。另外,从图1-13病理切片中观察到,新骨旧骨区分非常容易,一是可以通过形态和颜色,新生骨小梁较细长,新生骨小梁的颜色也较成熟骨深,二是通过位置,位于螺纹腔内部的骨小梁都是新生骨。我们在4周和2周的切片中都能发现接触成骨。 7、关于硬组织切片: 传统切皮质骨和含金属植入物的骨标本常用 Leica 骨切片机或慢速金刚环锯。这些器械切出的切片较厚,常超过 100um, 需要用磨片机甚至手工进行磨片[67-69]。手工磨片耗时十分长,而且磨出的切片厚度不一,甚至产生同一切片不同部位的厚薄不匀,导致镜下观察时难以聚焦,影响照片质量。严重时还会引起种植体和骨组织分离和植体部分脱离;并且在手工磨片的过程中,容易导致切片上残留杂质而难以清洗干净,影响切切片的最后效果。对于这些常规设备难以制作的硬组织切片,目前多用德国 EXAKT 硬组织切磨系统进行制备[701。本实验就是选用德国 EXAKT 硬组织切磨系统进行硬组织切片。德国 EXAKT 硬组织切磨系统主要包括以下这些机器:E300/310(CP/CL)组织切片机、E400CS/AW组织磨片机、E401/402平行载片粘合压力装置、E510脱水浸透仪、E520光固化包埋机、E530干燥渗透聚合装置等。德国 EXAKT 硬组织切磨系统可制作出最终片厚能达到<20um的厚度。本实验制作的切片厚度为30um。当然,可以制作更薄的骨切片来观察分析,但骨切片越 薄,越容易发生骨组织和种植体分离现象,考虑到切片制作的成本和节省标本,尽可能的降低脱片率,故我们采用了30um厚度的切片。本实验的切片各部位厚度均匀,在显微镜下容易聚焦,即使在高倍镜下也可显示清晰的骨结构和荧光标记。且骨结构形态保持完好,这对研究种植体骨界面的愈合具有重要意义。 我们总结用德国 EXAKT 硬组织切磨系统进行带种植体的硬组织切片制作经验,主要有以下几点:1、样本大小:样本需经过修整,样本越小漫润效果越好,后期包埋产生气泡的可能性也会越小,而且样本小能缩短脱水浸润包埋时间,但带种植体的标本一般体积都较大,我们应该将样本厚度尽量修整到 5mm 以内。2、样本修整时需充分冲水冷却,本实验早期修整样本时未充分冲水冷却样本导致部分切片有烧灼发黑的痕迹。3、尽量沿种植体长轴修整标本,这样每个标本才能多切几张切片,且每张切片才能显示种植体中心部分周围成骨情况,可用X线片辅助确定种植体在标本中的位置。4、磨片时要大量冲水冲走碎屑,否则碎屑残留会影响切片效果。 小结 本实验采用 beagle 犬下颌骨延期种植模型,拔牙后3个月植入种植体, beagle 大下颌骨与人接近,可比性强,较符合种植临庆实际情况。 新的备洞和种植体植入模式,能清楚地观察到不同的成骨方式,能清晰地观察到不同表面处理方法对成骨的影响。 前言 种植体与骨组织的生物相容性程度集中反映在种植体与骨组织间的界面结合和周围组织对种植体的反应上[71]。目前研究种植体周围骨愈合的办法有很多:如PET、微型CT、硬组织切片、石蜡切片和正电子发射计算机断层显像(Positron Emission Tomography, PET)等。每种方法都有其优缺点,究竟哪种方法能够更客观、高效、准确地反映种植体周围骨愈合情况呢?又或者哪些方法能够对种植体周围的接触成骨定性定量呢?故本次研究的目的是对比各种实验方法,寻找最佳的反映纯钛种植体表面接触成骨现象的检测方法。显微CT, 又称微型 CT小动物CT, 它是一种非侵入性和非破坏性的成像技术,它可以在不破坏样本的情况下对样本进行扫描,了解样本的内部显微结构,获得三维图像。它可以对种植体周围骨质进行骨分析,从而更加详细地了解骨密度,骨小梁分布等情况[72]。显微 CT 能对样本内的感兴趣区域进行分析,可进行目标体整体分割测量,在任意方向直接测定骨三维结构,具有连续性和完整性的优势,所获取的分析数据真实,而且重复性好,同时可产生非失真性图像,可以辨别很多细小的病理变化。因此,目前显微 CT 在种植体的动物实验中运用较多。 硬组织切片,一般指不脱钙硬组织切片,它是标本不经过脱钙,直接脱水、透明、塑料包埋、切片,再磨成一定厚度,最后染色得到的切片。它不破坏骨组织结构和成分,能够保持种植体与骨界面的组织结构,观测时不失真,可直观反应界面的生长结合情况,可研究骨组织形态结构和计算骨量,是目前研究种植体骨界面重要的检测手段[73]。 石蜡切片是常规制片技术中最为广泛应用的方法。石蜡切片不仅用于观察正常细胞组织的形态结构,也是病理学和法医学等学科用以研究、观察及判断细胞组织的形态变化的主要方法。但是它要求组织脱钙,去除种植体,种植体与周围骨质形成骨整合后,去除种植体非常困难,往往会破坏种植体-骨界面。而且,脱钙过程可引起组织结构皱缩,影响骨结构的定量分析。更重要的是以四环素为代表的骨荧光标记物与新骨内钙盐螯合[74.75],脱钙可使荧光标记消失,影响对骨改建的动态分析。所以石蜡切片在研究种植体骨界面应用较少。 PET, 即正电子发射计算机断层显像。是目前国际上最尖端的医学影像诊断设备之一,也是目前在细胞分子水平上进行人体功能代谢显像最先进的医学影像技术。它可以动态地观察种植体周围骨代谢的情况,可定性和定量,精确灵敏度高。但是因为对设备要求高,在国内目前很少用于动物实验。 所以,本实验选择对比显微 CT 和硬组织切片,寻找最佳的反映纯钛种植体表面接触成骨现象的检测方法。 2.1材料与仪器 2.1.1实验药物: 速眠新Ⅱ注射液 解放军农牧大学兽医研究所 碧兰麻 法国 3%戊巴比妥钠 广东佛山化工实验厂 青霉素钠 广州白云山天心制药股份有限公司 0.9%氯化钠注射液 四川科伦药业股份有限公司 生理氯化钠注射液 浙江巨能乐斯药业有限公司 2.1.2包埋药品: 多聚甲醛溶液 苏州市第二化工研究所有限责任公司 甲基丙烯酸甲酯、氢氧化钠 广州化学试剂厂 防水型氰基丙烯酸酯、环氧树脂 广州化学试剂厂 无水过氧化苯甲酰、邻苯二甲酸酯 上海凌峰化学试剂有限公司 2.1.3染色试剂及材料: 盐酸四环素荧光标记物 sigma 钙黄绿素荧光标记物 sigma 亚甲基蓝 sigma 酸性品红 sigma 高锰酸钾 一 天津市化学试剂三厂 苦味酸 天津市染料化学第二厂 磷酸氢二钠 广州化学试剂厂 定性滤纸 青岛雅各化学试剂销售有限公司 2.1.3仪器: 高压蒸汽灭菌器(2540MK) 美中互利工业公司 EXAKT510 脱水仪, 德国EXAKT公司 EXAKT520 光固化包埋机 EXAKT300CP 切片机 EXAKT400CS 磨片机 超纯水Milli-Q Ultra-Pure Millipore,Billeria,MA,USA 电子天平(0.0001g) BP110S,Sartorius, Germany 恒温干燥箱cd-63450 Heraeus Germany 双向磁力搅拌器 金坛市顺华仪器有限公司 光学显微镜 Olympus Japan 荧光显微镜 Olympus Japan Image Pro Express6.0图像处理软件 Olympus Japan 显微CT机 德国Y-XLON公司Y.Cheetah机型 2.1.3手术器械: FRIOS 种植机, WEGO 种植器械盒, straumman 种植器械盒,手术刀柄,刀片,骨膜剥离器,持针器,血管钳,1号丝线,组织剪,巾钳,铺巾 2.1.4种植体: 选用 WEGO 种植体, 规格:3.8×9mm, 种植体的表面处理: SLA(威高洁丽康生物材料有限公司提供) 2.2实验动物及实验方法 2.2.2实验动物: 成年雄性健康的 Beagle 犬共4只,15月龄,体重为 16-17kg。实验动物使用许可证号:SYXK(粤)2012-0081。使用动物质量合格证明编号:0096666。 动物种植体植入手术及饲养均在中山大学实验动物中心进行。 2.2.3实验动物分组 拔除双侧下颌第二前磨牙至第一磨牙后三个月。使用随机数字表按随机分配的原则,将4只成年雄性健康 Beagle 犬分为2组,每组各有2只。计划每只beagle 犬每边下颌骨植入5颗种植体,每只beagle 犬植入10颗种植体,4只beagle 犬共植入40颗种植体。 2.2.4种植手术: 速眠新II按 0.1mL/kg, 3%戊巴比妥钠按 1mL/kg 对 Beagle 犬进行肌肉注射[44]。麻醉成功后,常规消毒铺巾,下颌骨牙槽脊顶切开,翻瓣,球钻定位,逐级预备种植窝,成型钻成形种植窝,植入种植体,取出中央螺丝,拧入埋入式愈合基台。对位缝合创口。术后常规抗炎处理。 2.2.5标本处理 分别在2周和4周各处死两只 Beagle犬,获得带种植体的 Beagle 犬下颌骨,以0.9%生理盐水反复冲洗,插针定位, X-ray 检查,将标本切分成单独种植体,用10%中性福尔马林固定液漫泡,置于4℃恒温冰箱保存48-72小时,然后 换成70%乙醇浸泡。 图2-1 分割标本 2.2.6显微CT检查 扫描前取出标本,用保鲜膜包好,以免标本脱水干燥,影响组织结构观察。 扫描仪器参数设置-扫描电压: 90KV, 电流: 45uA,投影数:720个 projection, 整合时间0.5s,图像分辨率15um。 取种植体粗螺纹区周围45_m-300 u m 及 300-600 pm 的空间进行三维重建,计算骨组织参数。骨分析参数:骨体积分数(Bone volume Fraction, BV/TV)骨小梁体积/总体积。 2.2.7不脱钙的种植体骨切片的制备 带种植体的 Beagle 犬下颌骨标本, EXAKT510 系统自动脱水,包埋后,用 EXAKT300CP 切片机切片,然后用 EXAKT400CS 系统自动磨片至30_m(同第一章)。 2.2.8骨切片染色 将切磨好的骨切片使用双蒸水进行超声清洗 10min, 自然干燥后用亚甲基蓝-酸性品红染色(同第一章)。 2.2.9骨组织形态学观察 图像分析软件: 使用 Media cybernetics公司Image-Pro Express6.0中文版图像分析软件,该版本专为Microsoft Windows 32 位操作系统: Windows 2000 以及 Windows XP Professional 而设计。该图像分析软件采用了 Microsoft Windows 的 GUI(图形用户界面)的方式,简单方便。它可以从照相机,显微镜,录像机或是扫描仪获取图像数据。 图2-2 显微 CT平面图 2.3结果 2.3.2显微CT结果 1.平面图: 显微 CT 可通过调整切面,观察到种植体周围每个面的成骨情况。可进行目标体整体分割测量,在狂意方向得到切片,得到较完整数据。可对样本内的感兴趣区域进行分析。 可见图A是2周时种植体周围情况,种植体周围骨质相对稀疏。图B是4周时种植体周围的情况,我们可以宏观地观察到种植体周围大量新骨生成。 2.三维重建 对种植体周围骨质进行三维重建,但是由于金属伪影的影响,种植体周围45um范围内是一个模糊的边界。我们的重建范围是 45pm-300 um, 300 pm-600um, 粗螺纹周围45_m-300um内重建为橙色, 300 um-600 um范围重建为灰色。 2周时:图A是选取种植体粗螺纹周围 45um-300 _m, 300um-600 u m 空间的骨质,图B是去除了种植体的情况,图C是种植体粗螺纹周围45_m-300 um的重建,图D是种植体粗螺纹周围 45 _m-300 pm, 300 pm-600 um的重建。可三维旋转,观察不同面的骨质情况。45_m-300um层面可见螺纹内有新骨长入。300 um-600um骨质致密,无法区分新骨和旧骨。 图2-3 2周三维重建 4周:重建图形类型两周的情况相同。45 _m-300um层面可见螺纹内较多新骨长入,可以很直观地观察到较两周时骨量是增多的。300 um-600 um骨质致密,无法区分新骨和旧骨。 图2-4 4周三维重建 2.3.2硬组织切片结果: 只能选择一个截面,本实验选的是颊舌向切面。 可以看到红色的是骨小梁,蓝色的是间质。新生骨小梁较周围成熟骨颜色深,新生骨小梁较细长;间质内可见较多成骨细胞,成纤维细胞,血管,类骨质。 通过形态、颜色和位置可以区分新骨和旧骨,新生骨小梁较细长,颜色较深,旧骨红色偏浅,位于螺纹腔内部的骨小梁都是新生骨。 2周时,可以看到种植体周围较多新生骨小梁,种植体表面也可以看到稀疏的新生骨小梁。 种植体螺纹深度为 300um, D可以看到 45um 的比例尺,可以发现种植体表面0-45 um的范围 内有新生骨小梁,新生骨小梁紧贴种植体表面生长(绿色箭头处),此为接触成骨。种植体周 围 300-600 um 处有新生骨小梁,也有基骨,新骨旧骨之间界限明显。4周时,种植体周围骨小梁较两周时增粗,种植体表面也可以看到较粗的新生骨小梁。图C和图D的比例尺是 45um,硬组织切片是可以清晰地看到紧贴着种植体表面0-45um的范围内有些区域是有新生骨小梁的,图C可以看到新生骨小梁在种植体表面向基骨方向生长(绿色箭头处),接触成骨明显,图D主要是新生骨由基 骨向种植体表面生长(蓝色箭头处)。 图2-52周硬组织切片(亚中基蓝-酸性品红染色: AX40, B、C、DX100) 图2-64周硬组织切片(亚甲基蓝-酸性品红染色: AX40, B、 C、D×100) 2.4讨论 1.显微 CT 是一种新型的采用X线成像原理进行超高分辨率三维成像设备,可以在不破坏样本的情况下,通过对骨骼,牙齿等硬组织进行高分辨率X先成像,获得高精度三维图像,并进行结构,体积和密度的分析。显微 CT 目前能成功地应用于种植体周围骨分析,能对种植体周围骨小梁密度、厚度、分散程度及骨体积分数进行测量。 传统研究骨组织微观结构多选用骨组织切片,它是一种二维结构切片,供光学显微镜或电子显微镜观察的骨组织薄片,可以获得骨小梁面积、骨小梁厚度、骨小梁数目、孔隙数等信息数据。但是它是一种单层组织切片,需要人为评估骨小梁的微结构,存在人为评估误差,显微 CT 评价骨微结构的空间参数包括:骨体积分数、骨小梁数目、骨小梁间隙、骨连接密度,所有这些都是由显微 CT 形态测量软件测的,研究表明,这些参数比传统方法测得的结果更加精确[76]。显微 CT 能对样本内的感兴趣区域进行分析,可进行目标体整体分割测量,在任意方向直接测定骨三维结构,具有连续性和完整性的优势,所获取的分析数据真实,而且重复性好,同时可产生非失真性图像,可以辨别很多细小的病理变化。而切片只能反应一个断面的情况,而且制作骨组织切片对技术和人员的技术要求比较高,不同人所做的结果存在一定的误差[77]。显微 CT 的标本制备过程就简单了很多,可将新鲜的取材标本直接放入扫描,也可将标本固定,脱水或包埋好后放入扫描。它不仅省去了制作切片标本中的复杂的切片制备染色过程,而且在其测试后还可将同一标本做进一步的切片处理。而组织学切片方法 会破坏标本的完整性,从而使得一个标本不能同时用于结构参数分析以外的其他检测。 2.精确、方便、快捷、高效是显微CT的一大优点,但是目前显微 CT 也存在的很多问题。研究显示显微 CT 是以线吸收程度产生影像,对新生软骨、类骨质等目标不是特别敏感,目前尚无法进行类骨质观测,因此显微 CT 与病理切片在骨形态计量应用中是互补的,而不能完全替代。 显微 CT对松质骨块标本,可进行同水平多标本扫描,重建显示无明显伪影存在。但是带金属钉松质骨标本水平双标本同扫时,会相互产生伪影,周边骨组织测试影响较大,且无法进行有效的密度校正[78]。研究表明,用显微 CT测 量骨密度时,种植体周围有晕光,即部分容积效应,影响种植体表面的骨密度测量。金属伪影的产生与标本金属种类,金属的含量,标本的大小,扫描条件,重建条件有关。本实验为了减少伪影,将下颌骨五个标本分成单独一个个小标本进行扫描分析。 研究表明,用显微 CT 测量骨密度时,种植体周围有晕光,即部分容积效应,影响种植体表面的骨密度测量 Corinne Schouten 等人将种植体表面 0-500 um, 500 um-1000 um, 1000pm-1500 u m三层分析成骨情况,表明内层由于金属伪影的影响,结果被高估了[79]。为了减少伪影,有的研究还将植体制成塑料的,钛浆喷涂表面,这样就可以减少金属伪影,可以在任意层面进行三维重建[80]。 Stoppie类似地将植体植入羊的股骨髁突,结果显示种植体表面 60 um处是一个模糊的边界[81]。 Butz 将植体植于鼠的股骨,对比显微 CT 和组织切片的结果,结果显示种植体表面到其24um范围内,金属伪影会影响实验结果[82]。 Osterwyck 将 4mm 直径,12mm长的植体植入羊的股骨髁突,对比显微 CT 和组织切片的结果,关于骨小梁结构的结果是相似的[83]。 在本实验中,我们发现种植体周围45um范围内金属伪影比较明显,所以采用种植体周围45um-300 um, 300 pm-600 um 的重建空间。可以看到种植体螺纹处较多新骨长入。但是对于种植体周围45卜m由于伪影的影响,无法清晰地显示出来。 但是我们从硬组织切片中可以看出,种植体表面 0-45um 区域可以看到新生骨小梁沿着种植体表面生长,此区域是最能反映接触成骨的区域,硬组织切片能观察到种植体表面成骨的细微变化,所以,本实验后面的分析主要选用硬组织切片。 小结 1、显微 CT 可以测定骨三维结构,具有连续性和完整性的优势。可以宏观地观察到种植体周围骨质情况,但是由于金属伪影的存在,显微 CT对种植体表面接触成骨现象显示不够清晰。 2、硬组织是一种单层组织切片,制作过程较复杂,而且会破坏标本的完整性,从而使得一个标本不能同时用于结构参数分析以外的其他检测。但是它对于种植体表面成骨的细微变化反映较清晰。 前言 种植体植入后,有两种成骨方式:接触成骨和距离成骨。接触成骨是指成骨细胞在种植体表面接触后直接分泌骨基质,其生长方向是由种植体表面向种植窝周围的旧骨组织表面生长。而距离成骨与之相反,是新生骨基质沉积在种植体附近和种植窝周围的旧的骨组织表面,其生长的方向为旧骨组织向种植表面生长[6.84]。研究发现:接触成骨在种植体表面直接形成的编制骨有利于增加种植体初期和早期的机械稳定性[85]。尽快建立接触成骨所需的条件的优化,有利于促进骨组织形成。骨组织愈合的速率和程度依赖于种植体表面接触成骨的程度[7]。因此,一种新的种植体的表面处理能否促进接触成骨是评估该种植体是否优越的一个重要指标。 为了缩短种植体-骨结合所需的时间,增加种植体骨结合率,促进接触成骨,使人工牙种植具有更高的安全性。在过去的二十年中,一系列表面处理技术相继涌现出来:如钛浆涂层、羟基磷灰石涂层、可吸收研磨介质、喷砂酸蚀,微弧氧化等。目前,有研究已证实这些优化了的表面处理技术能够通过改善种植体表面的表面形貌、元素组成、分子结构、电荷状态、表面自由能、亲疏水性特性等,从而改变种植体表面的生物学特性,尤其酸蚀喷砂表面处理在临床上应用最广泛,已成为国际上使用最为广泛的种植体表面之一,其表面良好的机械生物相容性和骨组织引导性已经得到了口腔种植界的公认[86,87]。喷砂结合酸蚀是先用大颗粒喷砂获 10~30 um 孔洞并形成一级粗糙,再加上混合酸高温酸蚀来添加1~3um微孔形成二级粗糙度,研究表明:一级粗糙度类似于骨陷窝有利于成骨细胞的附着,二级粗糙度可以刺激成骨细胞增殖分化,这种多级立体表面形貌有利于骨结合的形成[88-91]。 然而,种植体能否早期形成骨整合,促进接触成骨,除了受接触成骨除了受植入材料本身特性影响外,还与受区相关。研究表明,不同的植入位点,不同的骨质密度都会影响成骨[18]本实验通过将喷砂酸蚀表面处理的种植体植入 beagle 犬下颌骨,观察种植体在颌骨不同部位的成骨差异,为临床实验提供理论依据及实验参考。 3.1材料与仪器 3.1.1实验药物: 速眠新Ⅱ注射液 解放军农牧大学兽医研究所 3%戊巴比妥钠 广东佛山化工实验厂 青霉素钠 广州白云山天心制药股份有限公司 0.9%氯化钠注射液 四川科伦药业股份有限公司 生理氯化钠注射液 浙江巨能乐斯药业有限公司 3.1.2包埋药品 多聚甲醛溶液 苏州市第二化工研究所有限责任公司 甲基丙烯酸甲酯、氢氧化钠 广州化学试剂厂 防水型氰基丙烯酸酯、环氧树脂 广州化学试剂厂 无水过氧化苯甲酰、邻苯二甲酸酯 上海凌峰化学试剂有限公司 3.1.3染色试剂及材料 盐酸四环素荧光标记物 sigma 钙黄绿素荧光标记物 sigma 亚甲基蓝 sigma 酸性品红 sigma 高锰酸钾 天津市化学试剂三厂一 苦味酸 天津市染料化学第二厂 磷酸氢二钠 广州化学试剂厂 定性滤纸 青岛雅各化学试剂销售有限公司 3.1.4实验器械: 高压蒸汽灭菌器(2540MK) 美中互利工业公司 EXAKT510脱水仪 德国EXAKT EXAKT520光固化包埋机 德国EXAKT EXAKT300CP切片机 德国EXAKT EXAKT400CS磨片机 德国EXAKT 3.1.5手术器械: FRIOS 种植机, WEGO 种植器械盒, ITI种植器械盒,手术刀柄,刀片,骨膜剥离器,持针器,血管钳,,11号丝线,组织剪,巾钳,铺巾 3.1.6种植体: 选用 WEGO 种植体,规格:3.8×9mm, 种植体的表面处理: SLA(威高洁丽康生物材料有限公司提供) 3.2实验动物及实验方法 3.2.1实验动物: 成年雄性健康的 Beagle 犬共4只,15月龄,体重为 16-17kg。实验动物使用许可证号:SYXK(粤)2012-0081。使用动物质量合格证明编号:0096666。 动物种植体植入手术及饲养均在中山大学实验动物中心进行。 3.2.2实验动物分组: 拔除双侧下颌第二前磨牙至第一磨牙后三个月。使用随机数字表按随机分配的原则,将4只成年雄性健康 Beagle 犬分为2周组和4周组,每组各有2只。 计划每只 beagle 犬每边下颌骨植入5颗种植体,每只 beagle 犬植入10颗种植体,4只beagle 犬共植入40颗种植体。有20颗种植体为 SLA 表面处理,2周有10颗,4周有10颗。 3.2.3种植手术 速眠新Ⅱ按 0.1mL/kg, 3%戊巴比妥钠按1mL/kg 对 Beagle 犬进行肌肉注射[44],麻醉成功后,常规消毒铺巾,下颌骨牙槽脊顶切开,翻瓣,球钻定位,逐级预备种植窝,成型钻成 形种植窝,植入种植体,对位缝合创口。术后常规抗炎处理。 3.2.4标本处理 分别在2周和4周各处死两只 Beagle犬,获得带种植体的 Beagle犬下颌骨,固定于10%中性福尔马林,分离标本。 3.2.5不脱钙的种植体骨切片的制备 带种植体的 Beagle 犬下颌骨标本, EXAKT510 系统自动脱水,包埋后,用 EXAKT300CP 切片机切片,然后用 EXAKT400CS 系统自动磨片至30um(同第一章)。 3.2.6骨切片染色 将切磨好的骨切片使用双蒸水进行超声清洗10min, 自然干燥后用亚甲基蓝--酸性品红染色(同第一章)。 3.2.7组织形态计量学指标的测定 1.图像分析软件: 使用 Media cybernetics 公司 Image-Pro Express 6.0中文版图像分析软件,该版本专为Microsoft Windows 32 位操作系统: Windows 2000 以及 Windows XP Professional 而设计。该图像分析软件采用了 Microsoft Windows 的GUI(图形用户 界面)的方式,简单方便。它可以从照相机,显微镜,录像机或是扫描仪获取图像数据。 2.分析测量的主要指标: 骨-种植体结合率(bone implant contact, BIC) 骨面积(bone area, BA) 每个标本取3张切片求其平均值。 3.骨组织形态计量学方法: 通过相机与显微镜相连,在低倍(40倍)镜下,将显微镜下图像输入到计算机内,采用手工描画的办法进行相关测量和计算。 (1)图像采集步骤 A.显微镜下调焦,打开 IPE6.0 采集对话框; B.点击“采集”调用采集菜单; C.点击“预览”出现预览框; D.改变曝光时间,调节白平衡获得清晰图像; E调整好后,点击拍摄完成拍照 F.保存图片 (2)手工长度,面积等测量 A采集显微镜下图像或打开已保存的图像资料; B.对当前图片所拍照时所使用的放大比例进行当前空间校准; C点击“测量”菜单下“手动测量”按钮,选择需要测量的参数; D.将测量结果导出 EXCEL 中进行进一步计算。 5. 在 Image-pro Express 6.0图象分析仪下将染色后带种植体的骨磨片粗螺纹段分成三部分:1种植体螺纹凹槽底部与周围皮质骨约300 _m的区域;2..种植体螺纹凹槽底部与周围皮质骨约300 _m-600 um的区域;3.种植体螺纹凹槽底部与周围皮质骨大于 600um的区域;分别测量记录每一部分的种植体-骨结合率(BIC%)和每一部分螺纹内的新生骨面积百分 数(BA%)。 ● BIC%=新生骨与种植体接触面的总长度/种植体-骨界面总长度×100% ● BA%=螺纹内新成骨面积/螺纹内腔总面积×100% 图3-1 测量BIC 3.2.8统计学方法 统计学方法: 测定数据结果均采用x±s表示,使用 SPSS13.0统计分析软件,当满足正态分布数据先用析因设计的方差分析分析处理组与时间段之间是否有交互效应,若有,则分析各因素的单独效应,若无,则逐一分析各因素的主效应即可。用单因素方差分析(one-way ANOVA), 预先用 Levene's test 检验方差是否齐性,如方差齐则采用样品均数间的两两比较的LSD,方差不齐如采取校正的方法 Welch 方法,多重比较用 Dunnett's T3法。检标准 P<0.05时认为存在统计学差异。 3.3实验结果 3.3.1大体观察 4只Beagle 犬术后6-9小时清醒进食,12小时后均可站立行走,无死亡动物。种植手术伤口未见异常,无明显出血。无种植体松动。 3.3.2微型CT观察 先用微型 CT 进行大体观察。 图3-2是失牙后4个月颌骨中心部位情况,可见颌骨中央不同部位骨密度不同,其中颌骨中心部位通常骨密度最低,它的骨小梁稀疏甚至空虚。这样,植入种植体后种植体与皮质骨的距离不同,种植体周围的骨质密度也不同。 图3-2拔牙后4个月 2 周——从微型 CT取粗螺纹上段,中段,下段的横断面图,观察与皮质骨的不同距离种植 体周围的骨质情况。种植体植入后两周,从上段到中段,再到下段,与皮质骨的距离依次增加,种植体周围骨质越来越稀疏。 图3-332周 4周——种植体周围较多新骨生成,比2周时种植体周围骨增多,取种植体粗螺纹上段,中段, 下段的微型 CT 横断面图,发现:从上段到中段,再到下段,与皮质骨的距离依次增加,种植体周围骨质越来越稀疏。 3.3.3骨组织形态学观察: 亚甲基蓝酸性品红染色:红色的是骨小梁,蓝色的是间质。螺纹腔内见新生骨小梁较周围成熟骨颜色深,新生骨小梁较细长;间质内可见较多成骨细胞、成纤维细胞、血管、类骨质。测量种植体螺纹深度为 300um。 2周,4周都可以看到种植体表面较多新生骨小梁,新生骨由种植体表面往基骨方向生长,此为接触成骨。可见种植体螺纹与皮质骨距离不同,螺纹内新骨的量不同。 将种植体粗螺纹处分三部分:1种植体螺纹凹槽底部与周围皮质骨约300um的区域;2.种植体螺纹凹槽底部与周围皮质骨约 300 um-600 um的区域;3.种植体螺纹凹槽底部与周围皮质骨大于 600um的区域;分别进行观察分析。 2周:图B:种植体螺纹凹槽底部与周围皮质骨约300_m的区域,即皮质骨是贴着种植体外螺纹的,此时较多新骨长入螺纹内部,种植体表面可看到接触成骨,我们可见螺纹内的新生骨小梁的颜色比螺纹外旧骨稍深,图C:种植体螺纹凹槽底部与周围皮质骨约300_m-600 um的区域,可见少量新生骨小梁顺着螺纹壁攀爬。图D:种植体螺纹凹槽底部与周围皮质骨大于 600 u m的区域,未见新骨生成。 图3-52周(业牛品蓝-求他染: AX20. B、C、DX40) 4周:种植体螺纹与皮质骨距离不同,螺纹内新骨的量不同。图B:种植体螺纹凹槽底部与周围皮质骨约300um的区域,此时较多新骨长入螺纹内部,种植体表面可看到接触成骨,图C:种植体螺纹凹槽底部与周围皮质骨约300 _ m-600 u m的区域,可见少量新生骨小梁顺着螺纹壁攀爬。图D是种植体螺纹凹槽底部与周围皮质骨大于600um的区域,少量新骨生成。 图3-64周(亚甲艾蕾-酸性品红染: AX20.B. C、DX100) 3.3.4骨组织计量学: 1、在 Image-pro Express 6.0图象分析仪下: 取种植体螺纹凹槽底部与周围皮质骨约300um的区域,种植体螺纹凹槽底部与周围皮质骨约 300 u m-600 _m的区域,种植体螺纹凹槽底部与周围皮质骨大于600um的区域,分别测量记录每一部分的种植体-骨结合率(BIC%)和每一部分螺纹内的新生骨面积百分数(BA%)。 BIC%=新生骨与种植体接触面的总长度/种植体-骨界面总长度×100% BA%=螺纹内新成骨面积/螺纹内腔总面积×100% 2、种植体螺纹到皮质骨的距离对 BIC的影响: 经析因方差分析,结果显示种植体螺纹到皮质骨的距离在不同时间段间差异有统计学意义(F=23.104, P=0.000);不同处理组间差异有统计学意义(F=62.470, P=0.000)。不同时间段和不同处理组两因素间无交互作用(F=0.365, P=0.696)。 对两周各处理组间进行单因素方差分析,种植体螺纹凹槽底部与周围皮质骨的距离300pm, 300-600 um, ≥600 pm这三个组的 BIC 分别为(50.61±14.00)%,(33.74±17.14)%,(7.20±8.81)%。数据进行统计对比分析后发现各组日数据的差异有统计学意义 (F=25.325, P=0.000)。进一步两两比较:种植体螺纹凹槽底部到皮质骨的距离300um与种植体螺纹凹槽底部到皮质骨的距离300-600 um 比较(P=0.011),种植体螺纹凹槽底部到皮质骨的距离300-600 um与种植体螺纹凹槽底部到皮质骨的距离≥600 um比较 (P=0.000),种植体螺纹凹槽底部到皮质骨的距离 300um与种植体螺纹凹槽底部到皮质骨的距离>600 um比较(P=0.000)。差异均有统计学意义。即种植体螺纹凹槽底部到皮质骨的距离300um>种植体螺纹凹槽底部到皮质骨的距离 300-600um 的BIC>种植体螺纹凹槽底部到皮质骨的距离大于或等于600um 的 BIC, 螺纹凹槽底部与皮质骨近,种植体-骨接触效果越好。 对四周各处理组间进行单因素方差分析,种植体螺纹凹槽底部到皮质骨的距离300um300-600 um, ≥600um这三个组的 BIC分别为(69.68±12.77)%,,(52.00±1.045)%,(19.64±15.25)%。数据进行统计对比分析后发现各组间数据的差异有统计学意义(F=38.266, P=0.000)。进一步两两比较:种植体螺纹凹槽底部到皮质骨的距离 300 um 与种植体螺纹凹槽底部到皮质骨的距离 300-600um比较(P=0.005),种植体螺纹凹槽底部到皮质骨的距离300-600 u m 与种植体螺纹凹槽底部到皮质骨的距离≥600um比(P=0.000),种植体螺纹凹槽底部到皮质骨的距离 300um 与种植体螺纹凹槽底部到皮质骨的距离≥600u m 比较(P=0.000)。差异均有统计学意义。即种植体螺纹凹槽底部到皮质骨的距离 300um>种植体螺纹凹槽底部到皮质骨的距离 300-600 u m 的BIC>种植体螺纹凹槽底部到皮质骨的距离大于或等于600 um 的BIC, 螺纹凹槽底部与皮质骨越近,种植体-骨接触效果越好。 表3-1种植体螺纹凹槽底部到皮质骨的不同距离的 BIC 值(X±s,%) 时间段 处理组 2周 4周 合计 F值 p值 300 50.61±14.00 69.68±12.77 60.15±16.30 -3.183 0.005 300-600 33.74±17.14° 52.00±10.45 42.87±16.69 -2.876 0.012 2600 7.20±8.8151 19.64±15.25* 13.42±13.70 -2.234 0.038 合计 30.52±22.51 47.11±24.51 38.81±24.79 23.104° 0.000 F值 25.325 38.266 62.470° 0.365* 0.696 p值 0.000 0.000 0.000 #*:交互效应;:主效应: One way ANOVAa: P<0.05 vs group 300 ; b: P<0.05 vs group 300-600 从线图显示,种植体螺纹凹槽底部到皮质骨的距离 300um的区域的 BIC 在各个时间段都是最多的,其次是种植体螺纹凹槽底部到皮质骨的距离 300-600pm的区域的BIC, 种植体螺纹凹槽底部到皮质骨的距离 600u m 的区域的 BIC 最少。螺纹凹槽底部与皮质骨越近, BIC越好。从2周到4周,各个组的增长速度相当。 图3-7种植体螺纹凹槽底部到皮质骨的不同距离的 BIC值(线图)图3-8种植体螺纹凹槽底部到皮质骨的不同距离的BIC 值(箱式图) 3、种植体螺纹凹槽底部到皮质骨的距离对 BA 的影响: 经析因方差分析,结果显示种植体螺纹凹槽底部到皮质骨的距离在不同时间段间差异有统计学意义(F=28.875, P=0.000);不同处理组间差异有统计学意义(F=77.111, P=0.000)。不 同时间段和不同处理组两因素间无交互作用(F=1.217, P=0.304)。对两周各处理组间进行单因素方差分析,种植体螺纹凹槽底部到皮质骨的距离 300um,300-600 um, >600um 这二个组的 BA分别为(26.71±8.69)%,(17.78±6.45)%,(1.78±2.58)%。数据进行统计对比分析后发现各组间数据的差异有统计学意义(F=55.667,P=0.000)。进一步两两比较种植体螺纹凹槽底部到皮质骨的距离 300 um 与种植体螺纹凹槽底部到皮质骨的距离300-600 um比较(P=0.004),种植体螺纹凹槽底部到皮质骨的距离300-600 um与种植体螺纹凹槽底部到皮质骨的距离>600 um 比较(P=0.000),种植体螺纹凹槽底部到皮质骨的距离 300卜m与种植体螺纹凹槽底部到皮质骨的距离>600 _m比较(P==0.000),差异均有统计学意义。即种植体螺纹凹槽底部到皮质骨的距离300u m 的BA>种植体螺纹凹槽底部到皮质骨的距离 300-600 _m 的BA>种植体螺纹凹槽底部到皮质骨的距离大于 600um的BA, 螺纹凹槽底部与皮质骨越近,成骨效果越好。对四周各处理组间进行单因素方差分析,种植体螺纹凹槽底部到皮质骨的距离 300um,300-600 um, >600 um这三个组的BA分别为(39.16±5.08)%,(23.63±6.73%,(11.41±8.69)%。数据进行统计对比分析后发现各组间数据的差异有统计学意义(F=39.599,P=0.000)。进一步两两比较种植体螺纹凹槽底部到皮质骨的距离 300 um 与种植体螺纹凹槽底部到皮质骨的距离 300-600pm 比较(P=0.000),种植体螺纹凹槽底部到皮质骨的距离300-600um 与种植体螺纹凹槽底部到皮质骨的距离大于 600um 比较(P=0.001),种植体螺纹凹槽底部到皮质骨的距离300_m 与种植体螺纹凹槽底部到皮质骨的距离大于 600um比较(P=0.000), 差异均有统计学意义。即种植体螺纹凹槽底部到皮质骨的距离 300um的BA>种植体螺纹凹槽底部到皮质骨的距离300-600 u m 的 BA>种植体螺纹凹槽底部到皮质骨的距离大于600um的BA,; 螺纹凹槽底部与皮质骨近,成骨效果好。 表3-2种植体螺纹凹槽底部到皮质骨的不同距离的 BA 值 (X±s,%) 处理组 时间段 2周 4周 合计 F值 p值 300 26.71±8.69 39.16±5.08 32.94±9.42 -3.913 0.011 300-600D 17.78±6.45 23.63±6.73" 20.70±7.09 -1.985 0.063 ≥600 1.78±2.58D 11.41±8.69 6.60±7.96 -3.36I 0.007 合计 15.42±12.18 24.74±13.37 20.08+13.53 28.875° 0.000° F值 55.667 39.599 77.111 1.217* 0.304 p值 0.000 0.000 0.000 互效应::主效应; COne way ANOVA a: P<0.05 vs group 300; b: P<0.05 vsgroup 300-600 从线图显示,种植体螺纹凹槽底部到皮质骨的距离 300_m的区域的新生骨面积在各个时间段都是最多的,其次是种植体螺纹凹槽底部到皮质骨的距离300-600 um的区域的新生骨面积,种植体螺纹凹槽底部到皮质骨的距离 600um的区域的新生骨面积最少。螺纹凹槽底部与皮质骨越近,新生骨面积越好。从2周到4周,种植体螺纹凹槽底部到皮质骨的距离300um的区域的新生骨面积的增长速度最快。 图3-9种植体螺纹凹槽底部到皮质骨的不同距离的BA值(线图) 图3-10种植体螺纹凹槽底部到皮质骨的不同距离的BA值(箱式图) 3.4讨论 通过对 beagle 犬下颌骨的解剖观察分析,我们发现失牙后4个月颌骨中心部位通常骨小梁稀疏甚至空虚,颌骨中央不同部位骨密度不同。这样,植入种植体后种植体与皮质骨的距离不同,种植体周围的骨质密度也不同。为了更好地研究种植体周围不同骨质情况是否会影响其骨结合的效果,本实验为了减少干扰因素,只选择一种较为成熟的表面处理方法来处理种植体,因此本实验选择喷砂加酸蚀这一表面处理方法。在本实验中,预备的种植窝大小是与种植体外螺纹匹配的,也就是说种植体植入后种植体的外螺纹贴着种植窝骨壁的,而种植体粗螺纹深度为 300um, 也就是说我们界定的三个距离: 1. 种植体与皮质骨300um就是指种植体粗螺纹外就是皮质骨,种植体粗螺纹处于皮质骨的区域; 2. 种植体与皮质骨300-600um, 是指种植体粗螺纹外离皮质骨有一段距离,大约种植体粗螺纹处于松质骨的区域; 3. 种植体与皮质骨 600um, 是指种植体粗螺纹外离皮质骨距离比较大了,大约种植体粗螺纹处于骨髓腔区域。而且这三者骨密度是截然不同的。 我们通过统计分析,对比2周时各组 BIC 及螺纹内新生骨面积,我们发现种植体螺纹凹槽底部到皮质骨的距离 300um时种植体骨结合率及螺纹内新生骨面积是高于种植体螺纹凹槽底部到皮质骨的距离 300-600pm的,而种植体螺纹凹槽底部到皮质骨的距离 300-600pm的种植体骨结合率及螺纹内新生骨面积是高于种植体螺纹凹槽底部到皮质骨的距离大于或等于 600 um 的(P<0.01)。四周时的结果也是类似的。距离皮质骨近的区域骨整合效果好,皮质骨区域骨整合效果是好于松质骨区域的,松质骨区域又是好于骨髓腔区域的。这种差异可能是由于植入部位颌骨位置及骨密度不同所引起的。可能是种植体螺纹凹槽底部到皮质骨的距离 300um区域周围都是皮质骨,成骨来源多,周围成骨细胞丰富,而种植体螺纹凹槽底部到皮质骨的距离大于或等于 600pm的区域是一个几乎充满骨髓的管腔部分,此处成骨细胞的数量可能是最低的[92]。研究证明,患有骨质疏松症的大白兔,其早期的种植体骨结合率较正常大白兔的骨结合率为低,并且其骨的愈合时间有所延迟。本课题组早期实验曾将种植体植入兔胫骨,对比骨皮质区与骨松质区成骨差异时发现皮质骨区成骨速度远快于松质骨区:2周时,皮质骨区新骨形成面积是松质骨区的215倍,4周时是13倍,6周时是11倍[93]。Lu 等人的研究在研究新西兰大白兔胫骨的骨再生能力时,发现含有松质骨处的再生能力明显优于骨髓腔处,这与本实验所观察到的骨结合现象相一致[92]。 Mori 等的研究发现尽管是骨质较疏松的胫骨,虽然其种植体的骨结合速率较骨质正常的种植体骨结合率慢,但种植体依然可以在后期获得较好的骨结合。我们的实验时间是2周和4周,观察的是种植体植入的早期种植体周围成骨情况,所以没有得到后期的结果。 而另外,我们统计得出2周时种植体螺纹凹槽底部到皮质骨的距离300_m时的 BIC 是 (50.61±14.00);种植体螺纹凹槽底部到皮质骨的距离300-600 u m 时 BIC (33.74± 17.14);种植体螺纹凹槽底部到皮质骨的距离大于或等于 600 u m 时 BIC 是(7.20± 8.81);三者差别有统计学意义,与皮质骨距离近的,接触成骨效果好。4周时种植体螺纹凹槽底部到皮质骨的距离 300um 时的 BIC 是(69.68±12.77);种植体螺纹凹槽底部到皮质骨的距离 300-600 u m 时 BIC(52.00±10.45);种植体螺纹凹槽底部到皮质骨的距离大于或等于 600 u m 时 BIC是(19.64±15.25);三者差别有统计学意义,与皮质骨距离近的,接触成骨效果好。 我们可以看到种植体螺纹凹槽底部到皮质骨的距离 300 um 时标准差是大于种植体螺纹凹槽底部到皮质骨的距离 300-600um, 而种植体螺纹凹槽底部到皮质骨的距离 300-600um时标准差又大于种植体螺纹凹槽底部到皮质骨的距离≥600um。推断其原因可能是种植体处于皮质骨区域周围情况较稳定,而处于松质骨区域及骨髓腔区域受局部血供影响明显,般该松质骨区域血管多的,最后统计出来的骨结合率及新生骨面积就高,骨髓腔区域有些螺纹周围没有明显新骨生成,有些螺纹周围有原始骨小梁的地方骨结合率及新生骨面积就高。但这个猜测需要进一步的研究去证实。 接触成骨除了受植入材料本身特性影响外,还与受区的生物学特性相关。 小结 1、酸蚀喷砂纯钛种植体表面可观察到接触成骨,接触成骨与受区的生物学特性相关,与皮质滑距离近的区域,接触成骨效果好,种植体 BIC高, BA也高;与皮质骨距离大于600um的区域,接触成骨不明显。 前言 经喷砂加酸蚀处理的种植体表面,无论从其表面形貌、表面粗糙度、生物相容性和骨引导性等方面,都有许多的研究报道,它是目前国际上种植系统使用最为广泛的表面之一,其表面良好的机械生物相容性和促进骨结合的能力已经得到了公认,大量的研究已经证实:喷砂酸蚀的种植体表面具有良好的早期骨结合效果,是一种比较成熟的表面处理方法[86.87.94.95]。然而,传统的喷砂加酸蚀表面处理制备完成后被置于空气中干燥会由相对亲水性变成疏水性。研究显示,疏水性表面将减少蛋白吸附,同时润湿性不足也会影响材料表面接触血液成分的初始状态以及后续的细胞反应[96]。 研究显示,种植体表面的润湿性在很大程度上取决于表面自由能。表面自由能增加能使材料表面润湿性增加[97]。研究表明,与全血接触的过程中,高表面能的亲水性表面粘附了更高浓度的补体 C1、凝血酶、凝血酶原;而低表面能的疏水性表面则粘附有较多的纤维蛋白原和血小板[31]。研究显示细胞在金属材料上的粘附率与材料的表面自由能成正比[98]。种植体润湿性和表面自由能的增加可以增强种植体表面与生物环境的相互作用[99.100],从而影响到种植体生物活性的发挥,甚至骨结合的长期效果。 不同的材料处理方法影响表面自由能的大小,其中,紫外光催化反应是改性半导体材料,提高表面自由能并获得超亲水特性的一种简单、方便和高效的方法。研究表明:经紫外处理的钛表面具有更高的表面能,高表面能表面可促进种植体与生物环境的相互作用[35.36]。有文献报道紫外线照射的钛试样表面润湿性大大增加,可能的原因是由于紫外线可以激活纯钛表面 Ti0的光催化降解作用以分解其上粘附的有机物,进而使得表面亲水性和自由能发生变化[34] 体外实验证明:那些由于长时间存放而老化的种植体在受到UV辐照后, 其表面活性得以复活,提高表面自由能并同时获得亲水特性,促进了蛋白吸附、成骨细胞粘附、增殖、分化和矿化,甚至骨结合,显示出良好的生物相容性[38-40,101-103] 本实验在原酸蚀喷砂处理纯钛种植体表面增加紫外线辐照处理,改变其表面能,在体内实验中,在同样的生物学环境下,对比经典的喷砂加酸蚀处理表面,观察其表面接触成骨现象。 4.1材料与仪器 4.1.1 实验药物: 速眠新Ⅱ注射液 解放军农牧大学兽医研究所 3%戊巴比妥钠 广东佛山化工实验厂 青霉素钠 广州白云山天心制药股份有限公司 0.9%氯化钠注射液 四川科伦药业股份有限公司 生理氯化钠注射液 浙江巨能乐斯药业有限公司 盐酸四环素荧光标记物 sigma 钙黄绿素荧光标记物 sigma 亚甲基蓝 sigma 酸性品红 sigma 高锰酸钾 天津市化学试剂三厂 苦味酸 天津市染料化学第二厂 磷酸氢二钠 广州化学试剂厂 4.1.2实验器械: 4.1.3手术器械: FRIOS 种植机, WEGO 种植器械盒, Straumann 种植器械盒,手术刀柄,刀片,骨膜剥离器,持针器,血管钳,1号丝线,组织剪,巾钳,铺巾 4.1.4种植体: 选用 WEGO 种植体,规格:3.8×9mm, 种植体的表面处理: SLA(威高洁丽康生物材料有限公司提供) 4.2实验动物及实验方法 4.2.1表面处理: SLA+UV 表面处理:无选用 Philips 的 UVC 灭菌灯, 使用 UVC 灭菌灯前先用75%酒精棉球擦拭灯管,再在无菌环境下距离材料表面 10cm, 对 SLA 种植体表面照射 48h。一共有种植体40枚, 20 枚为 SLA 表面处理,20 枚为 SLA+UV 表面处理。 4.2.2实验动物: 成年雄性健康的 Beagle 犬共4只,15月龄,体重为16-17kg。实验动物使用许可证号:SYXK(粤)2012-0081。使用动物质量合格证明编号:0096666。 动物种植体植入手术及饲养均在中山大学实验动物中心进行。 4.2.3实验动物分组: 拔除双侧下颌第二前磨牙至第一磨牙后三个月。使用随机数字表按随机分配的原则,将4只成年雄性健康 Beagle 犬分为2周组和4周组,每组各有2只。采用左右半口对照设计,左右随机,一一边为实验组(SLA+UV 组),,一边为对照组(SLA组),每只 beagle 犬每边下颌骨植入5颗种植体,每只 beagle 犬植入10颗种植体。共有2周时 SLA 组10个样本,2周时SLA+UV组 10个样本,4周时 SLA 组10个样本,4周时 SLA+UV组10个样本,4只beagle犬共有40个样本。 图4-1 beale犬下颌骨植入位点分组情况 4.2.4种植手术: 术前种植计划: 可利用的骨长度,即第一前磨牙远中至第二磨牙近中约55mm, 计划每侧下颌骨植入5枚种植体,第一颗种植体距离第一双尖牙远中约10mm, 第五颗种植体距离第二磨牙近中约5mm。 速眠新Ⅱ按 0.1mL/kg,,33%戊巴比妥钠按 1mL/kg 对 Beagle 犬进行肌肉注射[44]。麻醉成功后,常规消毒铺巾,下颌骨牙槽脊顶切开,翻瓣,球钻定位,逐级预备种植窝,成型钻成形种植窝,植入种植体,对位缝合创口。术后常规抗炎处理。 图4-2外科手术操作 4.2.5荧光双标记法 所有成年雄性健康 Beagle 犬于处死前的第13、14天在皮下注射盐酸四环素 25mg/kg; 处死前的第3、4天皮下注射钙黄绿素 5mg/kg, 每种试剂使用时连续注射两天,每日注射一次[45]。 盐酸四环素注射液的配制:将盐酸四环素粉剂溶于生理盐水中,浓度为 25mg/ml。现配现用,4度冰箱避光保存。 钙黄绿素注射液配制:将钙黄绿素粉剂溶于 1.4%NaHC03溶液口,浓度为5mg/ml。现配现用,4度冰箱避光保存。 四环素在荧光显微镜下呈黄色,而钙黄绿素则呈绿色,以显示出两次注射标记物期间新骨形成的情况。 4.2.6标本处理: 分别在2周和4周以3%戊巴比妥钠过量注射麻醉致死两只 Beagle犬,获得带种植体的Beagle 犬下颌骨,固定于10%中性福尔马林, EXAKT510 系统自动脱水,包埋后,用EXAKT300CP 切片机切片,然后用 EXAKT400CS 系统自动磨片至30um, 再用亚甲基蓝酸性品红染 色。 4.2.7骨组织形态计量学指标的测定 在 Image-pro Express6.0图象分析仪下:取种植体螺纹凹槽底部到皮质骨大约300 um的距离段,分别测量记录每一部分的种植体-骨结合率(BIC%)和每一部分螺纹内的新生骨面积百分数(BA%)。 ● BIC%=新生骨与种植体接触面的总长度/种植体骨界面总长度×100% BA%=螺纹内新成骨面积/螺纹内腔总面积×100% 测定数据结果均采用x±s表示,使用 SPSS13.0统计分析软件,正态分布数据先用析因设计的方差分析分析处理组与时间段之间是否有交互效应,如有再用单因素方差分析(one-way ANOVA), 预先用 Levene's test 检验方差是否齐性,如方差齐则采用样品均数见的两两比较的 LSD, 方差不齐则采取校正的方法 Welch 方法,多重比较用 Dunnett'sT3法。检验标准 P<0.05 时认为存在统计学差异。 4.3.1大体观察 4只beagle 犬术后6-9小时清醒进食,12小时后均可站立行走,无死亡动物。种植手术伤口未见异常,无明显出血。无种植体松动。 4.3.2组织形态学观察 1)骨磨片的荧光观察 将切磨好的骨切片使用双蒸水进行超声清洗10min, 自然干燥后,在避光的条件下使用荧光显微镜在荧光下对种植体表面的骨形成情况进行观察及拍摄,整个过程使用同一组拍照参数,适当调整曝光时间,以调整荧光的亮度。在荧光显微镜下盐酸四环素荧光标记为橙黄色,钙黄绿素荧光标记为绿色。对比 SLA 组及 SLA+UV组时,尽量选同一部位,同一放大倍数进行比较。 2周组:图A和图B是镜下总体观,可见种植体周围及种植体螺纹内都有散在荧光,荧光主要集中在种植体螺纹处,皮质骨区域比骨髓腔区域荧光分布多。图C和图D是图A和图B的红框框区的放大, SLA 荧光主要集中在螺纹斜壁上和种植体周围, SLA+UV组,除了种植体周围和螺纹壁上外,螺纹凹槽底部也有更多荧光分布。进一步增加放大倍数,图E,图F, 图G, 图H:红色箭头处指出橙黄色的盐酸四环素荧光沉积,这是种植体刚植入后三四天的新骨生成情况,主要分布在螺纹与种植窝接触的地方和种植窝壁上:钙黄绿素绿色荧光沉积代表的是种植体植入后第十,十一天新骨生长的情况,可见 SLA+UV 组螺纹凹槽底部有较多荧光分布(蓝色箭头),而 SLA 组则螺纹底部荧光不明显。螺纹斜壁有荧光分布。 4周组: 图A和图B是镜下总体观,可见种植体周围及种植体螺纹内都有散在荧光,荧光主要集中在种植体螺纹处,与2周比,可见骨髓腔区域(即离皮质骨远的地方)也有新骨生成,且新生骨小梁较2周时粗大。SLA+UV 组较 SLA组更多荧光分布。且SLA+UV 组较 SLA 组荧光条带粗。进一步增加放大倍数,图E,图F, 图G, 图H:见SLA组和 SLA+UV 组的螺纹斜壁上和螺纹凹槽底上都有荧光条带附着, 其中 SLA+UV组荧光条带粗且螺纹凹槽底部紧贴种植体橙黄色荧光较多。 501 C (SLA组) D (SLA+UV组) A (SLA组) B (SLA+UV组) E(SLA红) F (SLA+UV组) 图4-44周荧光观察(A、BX20, C、DX40, E、F、G、HX100) 2)骨磨片亚甲基蓝-酸性品红染色: 2周,红色的是骨小梁,蓝色的是间质。螺纹腔内见新生骨小梁较周围成熟骨颜色深,新生骨小梁较细长;间质内可见较多成骨细胞,成纤维细胞,血管,类骨质。 SLA 组可见种植体表面有少量新骨生成,新骨主要集中于离基骨较近的种植体螺纹腔斜壁,新骨沿着种植体螺纹腔斜壁爬行,种植体螺纹凹槽底部仅有少量新骨生成:SLA+UV组:见新生骨小梁不仅沿着种植体螺纹腔斜壁爬行,在离基骨远的螺纹腔凹槽底壁,也有较多新骨生成,新骨直接在远离基骨的种植体表面生长,接触成骨较 SLA 组更明显。 AISLA注J D SLAIVT: 1000 E (SLA 组) F (SLA+UV组) CISAI DSI.A-DV; 图4-52周(亚甲基蓝酸性品红染色: A、B×20, C、DX40, E、F×100) 4周,红色的是骨小梁,新骨形成的地方红色较深,旧骨的地方红色偏浅,蓝色的是间质。在种植窝周围,2周时可以观察到的种植窝预备的痕迹现在已经不明显,骨改建活跃,有旧骨吸收,新骨生成,种植窝骨壁由于旧骨吸收变成锯齿状,新骨生成使种植窝骨壁颜色变深,种植窝骨壁见大量新形成的哈弗氏系统,哈弗氏管内含结缔组织,血管。间质内可见较多成骨细胞,成纤维细胞,血管,类骨质。 SLA 组可见新骨由周围基骨往螺纹腔内延伸,螺纹腔中间有新生骨小梁,也有新生骨小梁沿着螺纹腔斜壁往内生长,螺纹腔底壁散在分布着少量新生骨小梁,种植窝骨壁见大量新形成的哈弗氏系统(图C和图E绿色箭头处),螺纹内部未见明显的哈弗氏系统,间质内见较多血管组织生成, SLA+UV组:见新生骨小梁不仅不仅分布于离周围成熟骨近的螺纹腔斜壁,在离基骨远的螺纹腔底壁也见大量新生骨小梁,接触成骨非常明显,同时,螺纹腔侧壁和底壁新生骨小梁都较2周时增粗明显,除了种植窝骨壁见大量新形成的哈弗氏系统(图D和图F绿色箭头处),螺纹内部也有新生成的哈弗氏系统(图D和图F蓝色箭头处)。间质内新生骨小梁周围见大量成骨细胞。间质内也见较多血管组织生成。SLA+UV 组接触成骨较SLA 组更明显。 D (SLA+UV组) A (SLA组) 图4-64周(亚甲基蓝酸性品红染色: A、BX20, C、DX40, E、FX100) 4.3.3骨组织形态计量学检查结果: 对比 SLA 和 SLA+UV 两种表面处理的对种植体一骨结合率的影响: 1. 经析因方差分析,结果显示两种表面处理不同时间段间差异有统计学意义 (F=20.459,P=0.000);不同处理组间差异有统计学意义(F=20.739, P=0.000);不同时间段和不同处理组两因素间无交互作用(F=0261,P=0.612)。 对每一时间段的2个处理组进行比较。 对二周各处理组间进行单因素方差分析, SLA 组种植体一骨结合率是(50.61± 14.00)%, SLA+UV 组种植体一骨结合率是(69.80±11.51)%,差异有统计学意义 (F=3.348, P=0.004)。即 SLA+UV 组种植体-骨结合率>SLA 组种植体-骨结合率。 对四周各处理组间进行单因素方差分析, SLA 组种植体-骨结合率是(69.68± 12.77)%, SLA+UV 组种植体-骨结合率是(85.00±9.09)%,差异有统计学意义(F=- 3.090, P=0.006)。即 SLA+UV 组种植体-骨结合率>SLA组种植体一骨结合率。 对比 SLA 和 SLA+UV 两种表面处理的对新生骨面积百分数影响: 2. 经析因方差分析,结果显示两种表面处理不同时间段间差异有统计学意义(F=21.802, P=0.000);不同处理组间差异无统计学意义(F=2.633, P=0.113);不同时间段和不同处理组两因素间无交互作用(F=0.168, P=0.684)。 对每一时间段的2个处理组进行比较。 对二周各处理组间进行单因素方差分析, SLA 组新生骨面积百分数是(26.71±8.69)%,SLA+UV 组新生骨面积百分数是(31.69+9.80)%,差异无统计学意义。。(F=-1.203,P=0.245),尚不能认为 SLA+UV组种植体新生骨面积百分数与 SLA 组种植体新生骨面积百分数有差别。 对四周各处理组间进行单因素方差分析, SLA 组种植体新生骨面积百分数是(39.16±5.08)%, SLA+UV 组种植体新生骨面积百分数是(42.14±6.56)%,差异无统计学意义(F=-1.133, P=0.272)。尚不能认为 SLA+UV组种植体新生骨面积百分数与 SLA 组种植体新生 骨面积百分数有差别。 从线图显示, SLA+UV 组 BIC 在各个时间段都是比 SLA 组多。 图4-7对比两种表面处理的BIC(线图) 表4-2对比两种表面处理的BA (Xis,%) Table 4-2 Compare the bone area of two kinds of surface treatment ( X±s,%) 处理组 时间段 F值 p值 2周 4周 对照 (SLA) 26.71±8.69 39.16±5.08 -3.913 0.001 实验 (SLA+UV) 31.69±9.80 42.14±6.56 -2.799 0.012 F值 -1.203 -1.133 p值 0.245 0.272 图4-8对比两种表面处理的 BIC (箱式图) 从线图显示, SLA+UV组新生骨面积在各个时间段都是比 SLA 组多。 -SLA+UV 图4-9对比两种表面处理的新生骨面积(线图) 图4-10对比两种表面处理的新生骨面积(箱试图) 4.4讨论 1.关于 SLA 早在二三十年前,就有学者研究发现:种植体表面形貌结构是影响种植体骨结合重要因素,粗糙的表面比光滑表面明显增加种植体表面积,更有利于骨结合,更能促进骨结合的速度[104]。至今,对种植体表面形貌及理化性质的研究是目前口腔种植学领域十分热门的研究。研究表明:种植体表面理化特征和形貌不仅可以决定骨组织细胞的附着、增殖和分化,而且在很大程度上决定种植体与骨组织间的愈合速率[105,106]。 种植体表面改性目的是在不影响材料本身的固有的特性下改变其表面的生物活性,经典的表面处理方法就是改变种植体表面本身的物理性质或表面化合物的分子和原子状态,又或者在其表面喷涂一些生物相容性好的物质。喷砂酸蚀处理是一种经典表面处理方法,并得到了口腔种植体界的公认。它将物理喷砂方法和化学酸蚀处理结合起来,获得较好的表面二级粗糙度,明显增加了钛种植体的骨愈合速度,临床实验证实可以缩短牙种植体骨结合时间至6周甚至更短的时间[87]。目前在市场上以瑞士 Straumann 牙种植体公司推出的 SLA 表面的 Straumann 牙种植体系列最具有代表性,还有 Camlog ITI, XiVE 等。这种表面形貌具有两个层次上二级窝洞的粗糙结构,喷砂形成的不规则的大起伏后,再酸蚀后形成了大量直径约为 1~2um的酸蚀微孔,酸蚀在清除喷砂残余颗粒的同时也改造了喷砂的不规则表面,因此形成了这一独特的种植体粗糙表面形式。喷砂加酸蚀处理的种植体表面,无论从其表面形貌、表面粗糙度、生物相容性和骨引导性等方面,都有许多的研究报道,它是目前国际上种植系统使用最为广泛的表面之一其表面良好的机械生物相容性和促进骨结合的能力已经得到了公认,大量的研究已经证实:喷砂酸蚀的种植体表面具有良好的早期骨结合效果,是一种比较成熟的表面处理方法[94,95]。 2.钛的老化 然而,有研究发现,钛表面存在老化现象。不管什么表面形态,钛在黑暗环境中放置4周都会引起老化,比起新鲜表面处理,蛋白吸附会减少[40]。生物材料和细胞之间的亲和性可以吸附在材料表面的细胞和蛋白质的相互作用来决定[40].细胞在材料表面的粘附首先是蛋白质的吸附,这是建立成功的骨整合关键的第一步。蛋白质吸附后接着是细胞的接触、附着及在材料表面的伸展、增殖和分化[107]。实验证明:将钛避光保存不同的时间后发现,随避光保存时间增:加,钛表面的碳氢化合物增加,钛表面的蛋白粘附能力减低,钛表面细胞粘附增值能力也随之降低[9,38,39]。 材料表面的亲水性是表面能具有代表性的标志,改变材料表面亲水性会改变其表面能,从而影响蛋白质吸附的能力,也会影响细胞与材料的的进一步反应[108.109]。研究表明,钛表面在空气中放置,表面性质会发生改变,表面的碳氢化合物会增加,会变得疏水性[110]。Att W的研究表明:种植表面处理后随着时间的变化出现的生物老化现象及骨传导性能的下降等[38]。 以往的研究表明经过喷砂酸蚀表面处理纯钛种植体在无菌和密闭的环境中存储,随着存储时间的增加,碳原子的含量逐渐增加,,一一方面增大了种植体的体积,另外一方面减少成骨细胞的接触和蛋白的吸附[39,40]。近年来,大量的研究发现,临床上使用的种植体表面存在的碳氢化合物的污染,种植体表面的生物活性的下降与其表面碳原子的增加两者之间具有统计学意义上相关性[111,112]。 3.UV 的作用: UV 可以阻止钛的老化。大量的研究表明:那些由于长时间存放而老化的种植体在受到UV 辐照后,其表面活性得以复活,并同时获得亲水特性,促进了蛋白吸附、成骨细胞粘附、增殖、分化和矿化,甚至骨结合,显示出良好的生物相容性[38-40, 42,101,103,113,114] UV 阻止钛的老化主要通过改变润湿性,去除表面碳氢化合物,改变电荷等方面从而促进蛋白吸附,促进成骨细胞增殖分化。 (1)润湿性 润湿性是指物体自身具有的润湿能力的大小。它是种植体的一种重要的表面特性,其受到表面形貌、粗糙度、化学组成、电荷、基团等的影响,并影响到生物材料的生物活性。当种植体植入人体时,其表面将首先与体液和血液中的不同成分进行接触并反应。不同的表面润湿性将影响其生物活性的发挥。因此,润湿性是生物材料的重要表面特征之一。 接触角在一定程度上反映了材料表面的润湿性即亲水性或疏水性。接触角一般用表面接触角分析仪测量,Vogler 的研究表明:接触角大于65度为疏水性表面,低于65度为亲水性[115]。对于材料的润湿性与细胞相容性间的关系目前研究结果有所争议。一类观点认为疏水的表面利于细胞的粘附、伸展、黏着斑形成及细胞间粘附分子分泌;而大多数研究表明细胞在亲水性的表面表现出更优良的细胞学行为,如粘附、生长增殖、细胞形态及内部骨架发育等均要 优于疏水性材料表面,但是两者之间的关系是辨证统一的[116.117]。也有研究指出疏水性表面比亲水性表面更有利于蛋白质吸附,其原因可能是亲水性表面沾附的水分子产生的一层能量屏障对蛋白吸附过程有一定的影响[118],这可以从另外一个方面影响细胞的生物学功能。大部分研究显示,疏水性表面将减少蛋白吸附,同时润湿性不足也会影响材料表面接触血液成分的初始状态以及后续的细胞反应[96]。亲水性表面具有更高的生物活性,利于成骨细胞的粘附和伸展,从而促进早期成骨[35,36]。亲水性表面已被证实可以增强材料表面与周围生物环境的反应,促进纤维结合蛋白吸附、细胞粘附、伸展、活力和成骨基因表达[119-1221。 早在 1997年, Wang 等就发现,用紫外线(Ultraviolet)对二氧化钛膜进行表面处理,二二氧化钛膜层会由疏水性能向超亲水性能转变的。而后,人们在此方面进行了一系列的研究。Fuminori 等发现,UV 处理的钛表面由疏水变成亲水表面,成骨细胞粘附的量增加[123]。Aita 等用 UVC 波段紫外线处理酸蚀纯钛表面后产生了超亲水性,促进了成骨细胞在改性纯钛表面的粘附、增殖与分化,动物实验中 4w 的BIC由75%上升至98.2%[124,125]。表面亲水性是材料生物相容性的一个重要因素,并很大程度上反映了材料的表面能[126]。经 UVC处理的表面具有更高的表面能,高表面能表面可促进种植体与生物环境的相互作用[35,36]。而 Rupp 等指出使用紫外线在纯钛的表面能够获得高亲水和疏水的共存是源子二氧化钛为半导体,在UV 的作用下发生的能量的吸收和电荷的转移形成的空穴作用而发生亲水性能的转变[127]。 (2)碳氢化合物的污染 近年来,大量的研究发现,临床上使用的种植体表面存在的碳氢化合物的污染,种植体表面 的生物活性的下降与其表面碳原子的增加两者之间具有统计学意义上相关性[111,128]。Uetsuka 和 Henderson 等指出 UV 辐照可以去除表面碳氢化合物,使Ti4+位点暴露,此位点促进了蛋白和细胞与材料表面相互作用,利于蛋白和细胞在表面的吸附[129,130]。同时,有研究显示,经由芳香烃受体介导,碳氢化合物污染不仅仅会影响基因的表达,同时还会造成成骨细胞碱性磷酸酶活性下降,甚至回能在细胞摄入后导致其功能紊乱[131]。 研究表明:UV照射有效地分解了钛表面的碳氢化合物污染,使C含量降低,并同时获得大量的亲水性基团-0H, 表现出超亲水特性[43]。 (3)电荷原因 2010年, Iwasa 等探讨紫外线作用于纯钛表面可能的静电机制时发现UV处理钛片发生电荷转变,纯钛表面由负电荷变为正电荷,若去除其表面的电荷或者采用用单价阴离子中和其表面电荷后,成骨细胞粘附也减少,此时,该钛片仍然能够保持超亲水性的界面[132]。实验证明:UV处理纯钛表面后,表面静电机制对细胞吸附和蛋白质的吸附具有一定的调节作用,且该作用对蛋白的吸附效应远远超过其亲水性对蛋白的吸附效应。Hori 等研究同时也指出UV 激发的静电机制对纯钛表面吸附的蛋白质的调节作用超过表面亲水性的对蛋白质吸附的影响作用[133]。 也有研究表明:经UVC 处理的表面具有更高的表面能,高表面能表面可促进种植体与生物环境的相互作用[35,36]。Miyauchi 等用紫外线处理纯钛进行体外细胞实验发现UV处理后的纯钛表面影响细胞外基质,优化细胞系列活动所需的环境。同时,由于黏着斑蛋白和肌动蛋白表达的增加, UV 处理二氧化钛表面的单个成骨细胞的粘附强度得到了提高[134,135]。Aita 等通过细胞实验指出,经UV处理后粗糙表面可以促进细胞的粘附增殖和分化,不需要 牺牲细胞的增殖而促进其分化。 总之,众多的学者对于 UV 促进骨整合的理论机制进行大量研究,具体化的机制研究仍在进行。 4.UV作用的动物实验: 在动物实验方面,关于紫外线处理纯钛表面的研究较少。 本课题组前期用小动物模型对UV 辐照钛表面促进成骨进行了前期研究,结果显示:用UV催化 SLA 表面处理的钛帽,植入兔颅骨, 2w, 4w, 6w的组织学切片显示:UVSLA组可以明显观察到新生骨组织沿着钛帽内侧部向上生长,新生骨小梁紧贴钛帽内侧壁生长,新生骨面积百分数 UVSLA 组较 SLA 组高[93]。 本课题组曾在小动物模型上初步探讨 UV 对成骨的影响。我们建立兔颅骨钛帽模型,将 SLA组和 SLA+UV 组表面处理的钛帽分别植入兔颅骨,观察2周、4周、6周发现:SLA+UV组钛帽内侧接触成骨较 SLA组明显,骨生长高度也 较 SLA 组高。计算钛帽内新生骨组织占整个钛帽总面积的百分比发现:2周、4周和6周SLA+UV组新生骨面积多于SLA 组(P<0.05)[136]。 5.Ti02光催化作用的原理 Ti02 是一种半导体材料,它的禁带宽度为32ev, 当Ti02受到大于 3.2ev 能量的光照射时会产生光催化作用。根据以下公式, 可知当受到波长小于等于 387.5nm 的光照射后通过在表面桥接位点产生氧空穴改变 TiOz 表面分子结构,使得 T4+位点转化为Ti3+位点,此位点容易吸附空气中解离的水形成化学吸附水(含有大量活性羟基)。另外, Ti02 的光催化作用可以降解表面的碳氢化合物等污染,从而使表面润湿性增强。材料表面的亲水性是表面能具有代表性的标志,目前大部分学者认为增加材料表面亲水性会增加其表面能,并在一定程度上具有增加蛋白质吸附的能力,从而有利于细胞与材料的的进一步反应。 6.关于紫外光波长 当Ti02受到波长小于或等于 387.5nm 的光照射时就会产生光催化作用,而小于此波长的光线为紫外光范围,紫外光根据波段分为 UVA UVB UVC 三个波段。UVA 波长250±20nm UVB 波长300±20nm UVC 波长360±20mm。 一般Ti02光催化作用多选用 UVA、UVC。Aita H 等在对比 UVC 和 UVA 对钛表面光催化效果的研究表明;经UVC和 UVA光催化的钛片都具有亲水性,但是UVC 细胞培养结果远远好于 UVA,经 UVC 光催化的钛片3小时细胞粘附是未处理的钛片的8倍,24小时是3倍,碱性磷酸酶活性增强2倍,且成骨相关基因表达增强[124]。 我们课题组前期对比 UVA 和 UVC 光催化的效果,用 UVA 和 UVC分别处理纯钛表面,用带能谱分析系统的扫描电子显微镜分析样品表面元素含量,发现两者都使纯钛表面后碳氢化合物含量减少, 而Ti02含量都有一定程度上的增加,表面有Ti-OH生成,其中UVC 处理的表面较UVA 处理的表面更多 Ti-0H生成; UVC波段紫外线光催化降解亚甲基蓝能力强于 UVA 波段紫外线; UVC 波段紫外线处理微弧氧化纯钛表面后诱导磷灰石能力强于 UVA 波段紫外线:在蛋白吸附和成骨细胞培养方面, UVC 波长紫外线较 UVA 波段紫外线促进了蛋白的吸附效果和成骨细胞 MG63 在表面的粘附、伸展、增殖与 ALP 活性作用效果更好。 所以,本实验选用 UVC对 SLA 表面种植体进行光催化处理。 7.关于接触成骨和距离成骨 种植体植入机体后,需经过一段时间的骨创面的生长愈合后才能达到骨结合。主要分为四个阶段。第一阶段:种植体植入24小时内,创伤区域血液充满,继而形成血凝块,在这第一阶段里,血小板粘附到种植体表面后发生活化,开始释放一系列的生长因子和细胞因子。第二阶段;该阶段常常被称为骨引导,包括正在分化的成骨细胞的补充及迁移到种植体表面。该阶段中成骨细胞通过结缔组织性支架发生粘附,迁移及成骨作用。该过程中骨引导发挥重要的作用。 第三阶段:主要命名为编织骨形成,骨祖细胞开始分化为成熟的成骨细胞,同时在种植表面分泌和释放骨基质,骨细胞分泌的骨基质粘附主要粘附在坚硬的表面(如骨组织或种植体表面)并逐渐钙化。第四阶段:编织骨组织的不断改建和成熟[4,5]。总之,种植体周围成骨方式主要是通过骨基质直接沉积在种植体表面而形成。正是由于骨基质分泌后沉积的方向的不同,种植体植入之后的骨组织存在两种不同的愈合模式:接触成骨和距离成骨[4,6,7]。接触成骨是指成骨细胞在种植体表面接触后直接分泌骨基质,其生长方向是由种植体表面向种植窝周围的旧骨组织表面生长。而距离成骨与之相反,是新生骨基质沉积在种植体附近和种植窝周围的旧的骨组织表面,其生长的方向为旧骨组织向种植表面生长[6,8]。Davies 等研究显示:这两种愈合方式在揭示种植表面设计在骨结合中的作用以及阐明种植/骨组织界面之间的结构和化和为的不同发挥重要的作[4]。 接触成骨的最主要的过程是能够尽早的建立生物学基质(血凝块),间充质细胞可从中迁移,接触到种植体表面后,增殖和分化成为成骨细胞,最终在种植体表面引导生产新的骨基质[9]。研究发现:接触成骨在种植体表面直接形成的编制骨有利于增加种植体初期和早期的机械稳定性[10]。尽快建立接触成骨所需的条件的优化,有利于促进骨组织形成。骨组织愈合的速率和程度依赖于种植体表面接触成骨的程度[7]。因此,一一种新的种植体的表面处理能否促进接触成骨是评估该种植体是否优越的一个重要指标。 骨磨片的荧光是代表某一时间点的新骨生成情况,在本实验中,骨磨片的荧光观察可以发现,2周时 SLA 组和 SLA+UV 组都可见橙黄色荧光主要分布螺纹与种植窝接触的地方和种植窝壁上,这说明种植体刚植入后三四天骨代谢活跃区是螺纹与种植窝接触的地方和种植窝壁上,SLA组绿色荧光分布在螺纹斜壁及种植体螺纹腔中央和种植体周围,这说明种植体植入后第十、十一天新骨由螺纹与种植窝接触的地方沿着种植窝壁往螺纹内生长,从种植体周围往种植体螺纹腔内生长,这主要是距离成骨;而 SLA+UV 组绿色荧光除了分布在螺纹腔中央和种植体周围外,还分布在螺纹斜壁及底壁,这可能是种植体植入后第十、十一天新骨除了由螺纹与种植窝接触的地方沿着种植窝壁往螺纹内生长外,有一部分新骨直接沉积在种植体表面, 说明 SLA+UV 组有接触成骨及距离成骨。4周时两组荧光强度都较两周时高,说明成骨较两周时更活跃,两组都可见橙黄色荧光和绿色荧光分布在螺纹底部,但是SLA+UV 组荧光条带粗且螺纹底部紧贴种植体的区域橙黄色荧光及绿色荧光都较 SLA 组多。说明 SLA+UV 接触成骨效果较 SLA组好。 骨磨片亚甲基蓝-酸性品红染色:2周时, SLA组可见螺纹腔底部无明显新骨生成,新生骨小梁多来源于周围基骨,沿着种植体螺纹腔斜壁爬行而来,新生骨小梁细长,这主要是距离成骨; SLA+UV组:见新生骨小梁不仅沿着种植体螺纹腔斜壁爬行,在离基骨远的螺纹腔底壁,也有较多新骨生成,接触成骨明显,文献资料显示;在种植体植入体内最初的5分钟内,血液中的脂质和蛋白质就已经吸附到材料表面,而细胞附着直至几个小时之后才发生[137]。种植体周围一些未分化间充质细胞、骨母细胞在蛋白吸附层以及一系列生长因子的引导下向种植体表面移行、贴壁,并分化成为成骨细胞,在生长因子的作用下增殖、分化、分泌基质、矿化成骨,骨沉积于种植体表面。同时,附着在种植体表面的成骨细胞还通过分泌不同类型,不同浓度,不同激活状况的生长因子来抑制邻近骨组织的破骨反应,增强成骨。可能在SLA+UV 组种植体表面成骨细胞就是在生长因子的作用下增殖、分化、分泌基质、矿化成骨, 骨沉积于种植体表面,形成良好的接触成骨。4周时, SLA 组可见新骨由周围基骨往螺纹腔内延伸,螺纹腔中间有新生骨小梁,也有新生骨小梁沿着螺纹腔斜壁往内生长,螺纹腔底壁散在分布着少量新生骨小梁,种植窝骨壁见大量新形成的哈弗氏系统,螺纹内部夫见明显的哈弗氏系统,间质内见较多血管组织生成, SLA+UV组::见新生骨小梁不仅不仅分布于离周围成熟骨近的螺纹腔斜壁,在离基骨远的螺纹腔底壁也见大量新生骨小梁,接触成骨非常明显,同时,螺纹腔侧壁和底壁新生骨小梁都较2周时增粗明显,除了种植窝骨壁见大量新形成的哈弗氏系统,螺纹内部也有新生成的哈弗氏系统。间质内新生骨小梁周围见大量成细胞。间质内也见较多血管组织生成。 本实验证明, SLA+UV组早在两周时,新生骨已经附着于种植体表面,四周时,种植体表面骨小梁增粗,同时哈弗氏系统形成,种植体周骨质趋于成熟。SLA+UV 组接触成骨较 SLA 组明显,而 Franchi 等学者指出在种植体表面和旧骨组织表面同时发生骨沉积有利于加快种植体生物学锚定[138]。骨结合早期阶段,尽早建立接触成骨,骨组织尽快沉积在种植体的表面能够获得更好的初期稳定性[11]。 进行统计学分析,我们也发现:二周和四周时,种植体周围 SLA+UV 组种植体-骨结合率都大于 SLA 组种植体-骨结合率(P<0.05)。虽然 SLA+UV组新生骨面积大于 SLA组,但是两者差别没有统计学意义。这证明了 UV 的作用 主要是使新骨早期附着在种植体表面,主要是促进种植体-骨界面的骨整合。 8.关于实验时间的选择 随着种植体表面处理技术的不断进步及种植外科手术技术的提高,一般的种植体在种植术后3~5月均能获得良好的骨结合效果,目前,判断一种种植系统是否成熟,其表面处理是否优越的一个重要标准是看它能否在早期形成良好的骨结合[139]。在最近的国内外相关研究表明:不同的种植体表面处理对骨结合效能影响的差别主要也是在骨改建的早期,尽管是骨质较疏松的胫骨,虽然其种植体的骨结合速率较较骨质正常的种植体骨结合率慢,但种植体依然可以在后期获得较好的骨结合,而在8周后,光滑对照组与实验组均能达到良好的骨结合效果[140]。Lang 的研究发现,在6周时, SLA 表面的种植体的BIC%与光滑面的种植体已经不存在统计学差异[141]。研究发现:4周时, SLA 表面的种植体与 RGD 改性 SLA 表面的种植体获得的 BIC 差距已相对变小[142]。Michael M对比 SLA 和 modSLA 发现两者在两周 BIC有差异,四周时 BIC 差异没有统计学意义[143]。一般种植体失败多发生于植入后2-4周,即初期稳定性和二期稳定性之间的低谷阶段,此时由于种植体与与骨之间的界面遭到破坏而导致了种植体失败。较多的研究也表明,2~4周的时间周期是适合于观察具有生物活性的种植体在早期的骨结合效应[141,143-145]。因此,本实验选择了4周为实验观察周期。 9.关于分组设计 本实验选用与人的牙槽骨较为接近的 beagle 犬下颌骨进行造模,研究种植体表面处理。选用左右半口对照设计,每只 beagle 犬每边下颌骨植入5颗种植体,一边为实验组,,一边为对照组,减少由于实验动物个体差异产生的误差[143]。 小结: SLA 组和 SLA+UV 组均可见接触成骨,但 SLA+UV 组接触成骨效果更好,2周和4周时, SLA+UV组种植体一骨结合率均好于 SLA 组种植体-骨结合率。 全文总结 种植体植入机体后,与骨组织间存在两种不同的愈合模式:接触成骨和距离成骨。骨组织愈合的速率和程度依赖于种植体表面接触成骨的程度。影响种植表面接触成骨有两个因素:1.受区的生物学特性;2.种植体的表面特性。 喷砂酸蚀是目前临床上应用最为广泛的种植体表面处理。研究证明紫外光处理喷砂酸蚀钛表面可以增加其表面自由能。本实验的第一个部分是建立 beagle 下颌骨牙槽脊原位模型,植入喷砂酸蚀这一经典表面处理的纯钛种植体,研究受区生物学特性与喷砂酸蚀钛种植体表面接触成骨的关系,第二个部分的是在原酸蚀喷砂处理纯钛种植体表面增加紫外线辐照处理,在同样的生物学环境下,观察其表面接触成骨现象。 实验结果证明: 1. beagle 犬下颌骨与人接近,可比性强,较符合种植临床实际情况。新的备洞和种植体植入模式,能更清晰地观察到不同表面处理方法对成骨的影响。 2. 显微 CT 可以测定骨三维结构,具有连续性和完整性的优势。可以宏观地观察到种植体周围骨质情况,但是由于金属伪影的存在,显微 CT 对种植体表面接触成骨现象显示不够清晰。硬组织是一种单层组织切片,制作过程较复杂,而且会破坏标本的完整性,从而使得一个标本不能同时用于结构参数分析以外的其他检测。但是它对于种植体表面成骨的细微变化反映较清晰。 3. SLA 钛种植体表面可观察到接触成骨,接触成骨与受区的生物学特性相关,与皮质骨距离近的区域,接触成骨效果好,种植体 BIC 高, BA也高;与皮质骨距离大于 600um 的区域,接触成骨不明显。 4. SLA+UV 组接触成骨效果好,在两周和四周时, SLA+UV 组种植体-骨结合率均好于 SLA 组种植体-骨结合率。 ( 1) Ogawa TNishimura. Different bone integration profiles of turned and acid-etched implants associated withmodulated expression of extracellular matrix genes. Int J Oral Maxillofac Implants.2003;18(2):200-210. ) ( 2) Weinlaender MKenney E BLekovic Vet alHistomorphometry of bone apposition around three types of endosseous dental implantsInt JOral Maxillofac Implants.1992;7(4):491-496. ) ( 3) Raghavendra SWood M CTaylorTDEarly wound healing aroundendosseous implants: a review of the literature. Int JOral Maxillofac Implants 200520(3):425-431. ) ( 4) Davies J E. Understanding peri-implant endosseous healing[J] . J Dent Educ.2003;67(8):932-949. ) ( 5) Berglundh TAbrahamsson ILang NPet alDe novo alveolar bone formation adjacent to endosseous implants[J].Clin Oral Implants Res2003;14(3);251-262 ) ( 6) Davies J EMechanisms of endosseous integration[J]. Int JProsthodont. 199811 (5)391-401 ) ( 7) Davies JE. Bone bonding at natural and biomaterial surfaces[J].Biomaterials 2007:28(34):5058-5067 ) ( 8) Puleo D A, Nanci A. Understanding and controlling the bone-implant interface[J] Biomaterials1999;20(23- 24):2311-2321. ) ( 9) Aita HHori NTakeuchi Met al . The effect ofultraviolet functionalization of titanium on integration withbone[J]Biomaterials2009:30(6):1015-1025. ) ( 10) Prokharau P AVermolen F J Garcia-Aznar JM Model for direct bone apposition on pre-existing surfaces, during peri-implant osseointegration[J]. J Theor Biol2012:304:131-142 ) ( 11) Boyan B DSchwartz ZResponse ofmusculoskeletal cells tobiomaterials[J].J Am Acad Orthop Surg2006;14:S157- S162. ) ( 12) Neo MHerbst HVoigt CFTemporal and spatial patterns ofosteoblast activation following implantation of beta-TCP parti-cles into bone J Biomed Mater Res 1998;39:71-76. ) ( 13) Jensen SS, Aaboe M,Pinholt EM. Tissue reaction and material characteristics of four bone substitutes. Int JOral Maxillofac Implants1996;11:55-66. ) ( 14) Arnaud E, Morieux C, Wybier M, de Vernejoul MC. Potentia-tion oftransforming growth factor(TGF 1) by natural coral and fibrin in a rabbit cranioplasty model.CalcifTissue Int. 1994;54:493-498. ) ( 15) Lu JX, Gallur A, Flautre B, Anselme K, Descamps M, Thierry B, Hardouin P. Comparative study of tissue reactions to calcium phosphate ceramics among cancellous,cortical and medullar bone sites in rabbits. JBiomed Mater Res 1998;42:357-367. ) ( 16) Ohyama TKubo YIwata HTakiWBeta-tricalcium phos-phate as a substitute for autograft in interbody fusion cages in the canine lumbar spine. J Neurosurg 2002;97:350-354. ) ( 17) Guehennec LL, Goyenvalle 上 E. Aguado E E. Small-animal Model I s S for Testing M Macroporous Ceramic Bone SubstitutesJournal of biomedical materials research(Part B). 2005;72(1):69-78 ) ( 18) Rong MD, Zhu AD, Guo ZH, et al. The effects of early osseointegration in different implant sites in rabbit tibias . J Mater SciMater Med. 2013:24:959-965 ) ( 19) Ponsonnet L, Reybier K, Jaffrezic N, et al. Relationship between surface properties (roughness, wettability and morphology) of titanium and dental implant removal torque. J Mech Behav Biomed Mater.2008;1(3) : 234-42 ) ( 20) Elias CN, Meirelles L. Improving osseointegration of dental implants.Expert Rev Med Devices.2010;7:241-56. ) ( 21) Wennerberg A, Albrektsson T. On implant surfaces: a review of current knowledge and opinions. Int J Oral Maxillofac Implants. 2010:25:63-74 ) ( 22) Kim KH, Ramaswamy N. Electrochemical surface modification of titanium in dentistryDent Mater J. 2009;2820-36. ) ( 23) Gittens RA, McLachlan T , Olivares-Navarrete R, et al. The effects of combined micron-/submicron-scale surfaceroughness and nanoscale features on cell proliferation and differentiation . Biomaterials. 2011;32:3395- ) ( 403. ) ( 24) Zhang EW, Wang YB, Shuai KG, et al. In vitro and in vivo evaluation of SLA titanium surfaces with furtheralkali or hydrogen peroxide and heat treatment. Biomed Mater.2011;6:0250-01. ) ( 25) Kim H, Choi SH, Ryu JJ, et al. The biocompatibility of SLA-treated titanium implants. Biomed Mater.2008; 3:0250-11. ) ( 26) Yang GL,He FM, Yang XF, , e et t a a l l . . B B o o n n e e r r e e s sponses to titanium implants surface-roughened by sandblasted anddouble etched treatments in a rabbit model. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008;106:516- 24. ) ( 27) Yahyapour N, , Eriksson C, Malmberg P, Nygren H. T Thrombin, kallikrein and complement C5b-9 adsorption onhydrophilic and hydrophobic titanium and glass after short time exposure to whole blood. Biomaterials.2004:25:3171-6. ) ( 28) Sista S, Wen C, Hodgson PD, Pande G. The influence of surface energy of titanium-zirconium alloy onosteoblast cell functions in vitro . J Biomed Mater Res A. 2011. ) ( 29) Kilpadi DV,Lemons JE. Surface energy characterization of unalloyed titanium implants. J Biomed Mater Res. 1994:28:1419-25 ) ( 30) 秦春凤,韩丽,张定堃,超微粉碎与粉体改性对青黛饮片润湿性及表面自由能的影响。中成药,2013;11:2475-05 ) ( 31) Hakan N. Initial reactions of whole blood with hydrophilic and hydrophobic titanium surfaces. Colloids andSurfaces B:Biointerfaces. 1996;6:329-33. ) ( 32) Hallab NJ, Bundy KJ, O'Connor K, Moses RL, Jacobs JJ. Evaluation of metallic and polymeric biomaterialsurface energy and surface roughness characteristics for directed cell adhesion Tissue Eng. 2001;7:55-71 ) ( 33) Wang R, Hashimoto K, Fujishima A, et al. Light-induced amphiphilic surfaces [J].Nature1997.388431-432. ) ( 34) Zhao,L . et al.,The role ofsterilization in the cytocompatibility of titania nanotubes.Biomaterials.2010:31:2055-63 ) ( 35) Kooten TG, Spi jker HTBusscher HJ.Plasma-treated polystyrene surfaces model surfaces for studying cell-biomaterial interactionsBiomaterials.2004:25(10):1735-47. ) ( 36) Toworfe GKComposto RJAdams CS et al.Fibronectin adsorption on surface-activated poly (dimethylsiloxane)and its effect on cellular function J Biomed Mater ResA20041:71(3):449-61 ) ( 37) Eriksson C, Nygren H, Ohlson K 《 . . Implantation of hydrophilic and hydrophobic titanium discs in rat tibia: cellular reactions on the surfaces during the first 3 weeks in bone[J]. Biomaterials. 2004;25(19);4759- 4766. ) ( 38) Att W, Hori N, Takeuchi M,et al.Time-dependent degradation of titanium osteoconductivity: an implication of biological aging of implant materials[J].Biomaterials.2009;30(29):5352-5363. ) ( 39) Hori N, Att W, Ueno T , et a1 . Age-dependent degradation of the protein adsorption capacity oftitanium[J].Dent Res. 2009;88(7):663-667 ) ( 40) Hori N, Ueno T, Suzuki T , et al.Ultraviolet light treatment for the restoration of age-related degradationof titanium bioactivity.Int J Oral Maxillofac Implants.2010;25:49-62 ) ( 41) Suzuki T,Hori N,Att W, et al.Ultraviolet treatment overcomes time-related degrading bioactivity oftitanium.Tissue Eng Part A. 2009;15:3679-88 ) ( 42) Ueno TYamada MHori Net al . Effect ofultraviolet photoactivation of titanium on osseointegration in a rat modelIntJOral Maxillofac Implants.2010;25:287-94. ) ( 43) Li SB,Ni J,Liu XN, et al . Surface characteristics and biocompatibility of sandblasted and acid-etched titanium surface modified byultraviolet irradiation: an in vitro study. JBiomed Mater Res B Appl Biomater.2012. ) ( 44) 罗亚桐、刘铭,刘勇,等。戊巴比妥钠与速眠新和戊巴比妥钠对家犬麻醉效果的比较。湖南师范大学学报(医学版)。 ) ( 2006;4(1):78-79. ) ( 45) 李青南.骨质疏松实验动物研究.2001:四川大学出版社 ) ( 46) 齐进. EXAKT切磨系统在带金属种植体软硬组织切片中的应用.中国组织工程研究,2012.16(35):6555-6559 ) ( 47) Yoon HC, Choi JY, Jung Uw, et al.Effects of different deths of gap on healing ofsurgically creat-ed coronal defects around implants in dogs: a pilot study.J Periodonto1 . 2008;79(2):355~361 ) ( 48) Mai R, Reinstorf A, Pilling F,et al.Histologic study of incorporation and resorption of a bone cement-collagen composite; an in vivo study in the minipig Oral Surg Oral Med Oral Pathol Oral RadiolEndod. 2008;105(3):e9~14. ) ( 49) Corinne S, Meijer GJ, Jeroen J . J,et al . The quantitative assessment of peri-implant bone responses usinghistomorphometry and micro-computed tomography. Biomaterials.2009;30:4539-4549 ) ( 50) Salata LA, Burgos PM, Rasmusson L, et al.Osseoinegration ofoxidized and turned implants in circumferentialbone defects with and without adjunctive therapies an experimental study on BMP-2 and autogenous bone graft in the dog mandible. Int J Oral Maxillofac Surg . 2007;36(1) : 62~71 ) ( 51) Kenzo Morinaga,Hirofumi Kido,Atsuko Sato. Chronological Changes in the Ultrastructure of Titanium-BoneInterfaces: Analysis by Light Microscopy, Transmission Electron Microscopy and Micro-Computed Tomography.Clinical Implant Dentistry and Related Research. 2009;11 ) ( 52) 鲍济波,谢志刚,张燕,等。口腔种植体 beagle 犬动物模型的建立。中国口腔种植学杂志,2012;2 ) ( 53) Al-Hamdan KAI-Moaber SHJunker Ret al. Effect of implant surface properties on peri-implant bone healing:ahistological and histomorphometric study in dogs. Clin Oral Implants Res.2011;V22N4:399-405. ) ( 54) Al-Hamdan SHJunker RJansen JA.Effect of implant surface properties on peri-implant bone healing: implant stability and microcomputed tomographic analysis Int J Oral Maxillofaclmplants.2012;V27N1:77-83. ) ( 55) Baffone GM, Botticelli D,Pantani Fet al.Influence of various implant platform configurations on peri-implant tissue dimensions: an experimental study in dog. Clin Oral Implants Res.2011V22N4:438-44 ) 56) Rodrigo GCharles MJose Net alThin Bioactive Ceramic-Coated Alumina-Blasted/Acid-Etched Implant SurfaceEnhances Biomechanical Fixation of Implants: An Experimental Study in Dogs.Clinical Implant Dentistry andRelated Research. 2011;13:5 ( 57) Rodrigo G, Charles M, Marcelo S,et al.Biomechanical and Histomorphometric Evaluation of a Thin lon BeamBioceramic Deposition on Plateau Root Form Implants:An Experimental Study in Dogs JBiomed Mater Res Part B:Appi Biomater 2009;90B:396-403. ) ( 58) Blanco J,Linares A, Perez J, et alRidge alterations following flapless immediate implant placement with orwithout immediate loading. Part Il:a histometric study in the Beagle dog.J Clin Periodontol.2011;V38N8762- 70 ) ( 59) Covani U, Cornelini R , Calvo JL,et al . Bone remodeling around implants placed in fresh extractionsockets.Int J Periodontics Restorative Dent. 2010;V30N6:601-7. ) ( 60) Araujo MG, Wennstrom JL,Lindhe J.Modeling of the buccal and lingual bone walls of fresh extraction sitesfollowing implant installationClin Oral I mplants Res.2006:V17N6:606-14 . ) ( 61) Vignoletti F, Discepoli N, Muller A, et al.Bone modelling at fresh extraction sockets: immediate implantplacement versus spontaneous healing: an experimental study in the beagle dog. J Clin Periodontol . 2012;V39N1:91-7. ) ( 62) Bornstein MM,Valderrama P, Jones AAet al . Bone apposition around two different sandblasted and acid-etchedtitanium implant surfaces:a histomorphometric study in canine mandibles.Clin Oral Implants Res. 2008;V19N3:233-41. ) ( 63) Schlegel KA, Prechtl C, MostT,et al.Osseointegration of SLActive implants in diabetic pigs. Clin Oral Implants Res. 2011;VN. ) 64) Maeztu MA, Braceras I, Alava JI. Gay-Escoda:Improvement of osseointegration of titanium dental implantsurfaces modified with CO ions:a comparative histomorphometric study in beagle dogs. Int.J.OralMaxillofac. Surg. 2008; 37:441--447. 65) Yasumasa Akagawa, Takayasu Kubo, Katsunori Koretake,et al.Initial bone regeneration around fenestratedimplants in Beagle dogs using basic fibroblast growth factor-gelatin hydrogel complex with varyingbiodegradation rates Journal of Prosthodontic Research.2009;53:41-47 66) Schwarz F, Herten M, Sager M, et al. Bone regeneration indehiscence-type defects at chemicallymodified(SLActives)and conventional SLA titanium implants: a pilot study in dogs. J ClinPeriodontol.2007;34:78-86. 67) Huang LF,Li QN,Liao JM,et al. Guangdong Jiepo Xue Tongbao. 1994;16(2):151-153. ( 68) Lin DJ, Chuang CC, Lin JH, et al. Bone formation at the surface of low modulus Ti-7.5 Mo implants in rabbit femurBiomaterials.2007;28(16)2582-2589 ) ( 69) Vashishth D, Koontz J, Qiu SJ, et al. In vivo diffuse damage in human vertebral trabecular bone Bone.2000;26(2):147-152 ) ( 70) Knabe C, Kraska B, Koch C, et al.A method forimmunohistochemical detection of osteogenic markers inundecalcified bone sections Bi otech Histochem. 2006;81(1):31-39. ) ( 71) Wu XP, Deng F, WangZQ, et alBiomechanical and histomorphometric analyses of the osseointegration of microscrews with different surgical techniques in beagle dogs [J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2008,10(5):644-650. ) ( 72) 雷霆,刘傥,禹晓东等。显微 CT 在骨科研究中的应用优势。昆明医学院学报。2012:1B : 274-276 ) ( 73) 吕荣,王军,徐新智,等。塑料包埋非脱钙骨技术在骨组织学与图像分析中的应用临床与实验病理学杂志。 2006;22(3):369- 3 70 ) ( 74) Frost HM,Villanueva AR, Roth H, et al.Tetracycline bone labeling. J New Drug. 1961;1:206-216 ) ( 75) Lee TC, Mohsin S, Taylor D, et al.Detecting microdamage in bone. J Anat. 2003;203(2):161-172. ) ( 76) Mulder L. Architecture and mineralization of developing cortical and trabecular bone ofthe mandible. Anat Embryol.2006;211(1):71-78. ) ( 77) Tamminen Is.Reproducibility and agreement of micro-CT and histomorphometry in human trabecular bone withdifferent metabolic status[J]. J Bone Miner Metab.2011:29(4):442-448. ) ( 78) 王军,毕龙,白建萍,等。显微 CT骨标本扫描的伪影评估与消减控制。中国体视学与图像分析。2009;1 ) ( 79) Gert JM, Jeroen JP, Paul HM, et al. The quantitative assessment of peri-implant bone responses usinghistomorphometry and micro-computed tomography . Corinne Schouten. 2009:30(27):4539-49. ) ( 80) Kenzo M,Hirofumi K, Atsuko S,et al . Chronological Changes in the Ultrastructure of Titanium-Bone Interfaces:Analysis byLight Microscopy,Transmission Electron Microscopy,and Micro-Computed TomographyClinical I mplant Dentistry and Related Research.2009;111):59-68 ) ( 81) Stoppie N, van der Waerden JP , Jansen JA,et al . Validation ofmicrofocus computed tomography in theevaluation of bone implant specimens.Clinical Implant Dentistry and Related Research. 2005;7(2):87-94. ) ( 82) Butz F, 0gawa T, Chang TL, et al . Three-dimensional bone-implant integration profiling usingmicro-computed tomography,Int J Oral Maxillofac Implants.2006;21:687-695. ) ( 83) Osterwyck HVDuyck JSloten JVet al . The use ofmicro-focus computerized tomography as a new technique forcharacterizing bone tissue around oral implants. J Oral I mplantol.2000;26:5-12 ) ( 84) Puleo D A, Nanci A. Understanding and controlling the bone-implant interface[J]. Biomaterials.1999;20(23- 24):2311-2321. ) ( 85) Prokharau P A, Vermolen F J,Garcia-Aznar J M. Model for direct bone apposition on pre-existing surfaces,during peri- i mplant osseointegration[J] . J Theor Biol . 2012;304:131-142. ) 86) Bornstein MM,Lussi A, Schmid B, et al.Early loading ofnonsubmerged titanium implants with a sandblastedandacid-etched(SLA) surface: 3-year results of a prospective study in partially edentulous patients. Int JOral Maxillofac Implants.2003:18(5):p.659-66. 87) Cochran DL, Buser D,Christian M, et al. The use ofreduced healing times on ITI implants with a sandblastedand acid-etched(SLA) surface: early results from clinical trials on ITI SLA implants.Clin Oral ImplantsRes2002;13(2): p.144-53. 88) Gittens RA,McLachlan T,Olivares-Navarrete R,et al. The effects of combined micron-/submicron-scale surfaceroughness and nanoscale features on cell proliferation and differentiation.Biomaterials. 2011;32:3395-403. 89) Zhang EW, Wang YB, Shuai KG,et al.In vitro and in vivo evaluation of SLA titanium surfaces with furtheralkali or hydrogen peroxide and heat treatment.Biomed Mater. 2011;6:025001. 90) Kim H, Choi SH, Ryu JJ, et al. The biocompatibility of SLA-treated titanium implants. BiomedMater.2008:3:025011. ( 91) Yang GL, He FM, Yang XF , et al. Bone responses to titanium implants surface-roughened by sandblasted anddouble etched treatments in a rabbit model . Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008:106:516- 24. ) ( 92) Lu JX, Gallur A,Flautre B, et al. Comparative study of tissue reactions to calcium phosphate ceramics amongcancellous, cortical,and medullar bone sites in rabbits. Journal of biomedical materials research.1998;42(3);p. 357-367. ) ( 93) 丁婧文,周磊,刘伟珍。紫外线处理微弧氧化种植体的早期成骨研究[J]广东牙病防治, Res。 2013;21(3):131-136。 ) ( 94) Buser D,Schenk RK, Steinemann S. Influence of surface characteristics on bone integration oftitaniumimplants. A histomorphometric study in miniature pigs. Journal ofbiomedical materials research, 1991.25(7):p.889-902. ) ( 95) Shtansky DV,Zhitnyak IY, Bashkova IA et al . The influence of elemental composition and surface topography on adhesion, proliferation and differentiation of osteoblasts.Biochemistry(Moscow) Supplement SeriesA:Membrane and Cell Biology, 2010.4(3):p.272-276. ) ( 96) Yahyapour N,Eriksson C, Malmberg P,Nygren H. Thrombin,kallikrein and complement C5b-9 adsorption onhydrophilic and hydrophobic titanium and glass after short time exposure to wholeblood . Biomaterials.2004:25:3171-6 ) ( 97) 秦春凤,韩丽,张定堃,超微粉碎与粉体改性对青黛饮片润湿性及表面自由能的影响。中成药,2013;11:2475-05 ) ( 98) Hallab NJ, Bundy KJ, O'Connor K, Moses RL, Jacobs JJ. Evaluation ofmetallic and polymeric biomaterial surfaceenergy and surface roughness characteristics for directed cell adhesion. Tissue Eng. 2001;7:55-71 . ) ( 99) Sista S, Wen C, Hodgson PD, Pande G. The influence of surface energy of titanium-zirconium alloy on osteoblast cell functions in vitro.J Biomed Mater Res A. 2011. ) ( 100) Kilpadi DV, Lemons JE . Surface energy characterization ofunalloyed titanium implants. J Biomed Mater Res. 1994;28 1419-25. ) ( 101) )A Aita H, Hori N, Takeuchi M, et al . The effect ofultraviolet functionalization of titanium on integration withboneJ1Biomaterials200930(6)1015-1025. ) ( 102) Suzuki T ,Hori N, Att W, et al.Ultraviolet treatment overcomes time-related degrading bioactivityoftitanium. Tissue Eng Part A. 2009;15:3679-88. ) ( 103) Att W, Hori N, Iwasa F, et al . The effect of UV-photofunctionalization on the time-related bioactivity of titanium and chromium-cobalt alloys.Biomaterials. 2009;30:4268-76(同57) ) ( 104) Albrektsson T, Branemark PI,Hansson HA, et al.Osseointegrated titanium implants . Requirements for ensuring a long-lasting,direct bone-to-implant anchorage in man. Acta Orthop Scand. 1981;52(2):p.155-70 ) ( 105) Celletti,R. Bone contact around osseointegrated implants:a histologic study of acid-etched and machined ) ( surfaces. J Long Term Eff Med Implants. 2006;16(2)131-43. ) 106)Chehroudi B, McDonnell D, Brunette D.M. The effects of micromachined surfaces on formation of boneliketissue on subcutaneous implants as assessed by radiography and computer image processing. Journal ofbiomedical materials research. 1998;34(3):p.279-290. 107)ZZinelis S,Silikas N, Thomas A, et al. Surface Characterization of SLActive Dental Implants.Eur JEsthetDent.2012;7(1):72-92 108)Alves CM,Yang Y, Carnes DL, et al.Modulating bone cells response onto starch-based biomaterials by surfaceplasma treatment and protein adsorption.Biomaterials.2007:28(2):307-15. 109)Dos Santos EA, Farina M, Soares GA,et al. Surface energy of hydroxyapatiteand beta-tricalcium phosphateceramics driving serum protein adsorption and osteoblast adhesion. JMater Sci Mater Med. 2008;19(6):2307-16. ( 110) Fuminori I,Norio H, Takeshi U,et al . Enhancement of osteoblast adhesion to UV-photofunctionalized titaniumvia an electrostatic mechanism, Biomaterials.2010;31:2717-2727 ) ( 111)K KikuchiL, Park JYVictor CetalPlatelet interactions with calcium-phosphate-coatedsurfaces.Biomaterials.2005;26(26)5285-5295. ) 112)TTakeuchi M, Sakamoto K,Martra G,et al.Mechanism of photoinduced superhydrophilicity on the Ti02photoca[143] talyst surface.J Phys Chem B. 2005;109(32):15422-15428 113)Suzuki T,Hori N, Att W,et al.Ultraviolet treatment overcomes time-related degrading bioactivityoftitanium.Tissue Eng Part A. 2009;15:3679-88. ( 114) Vogler EA.Structure and reactivity of water at biomaterial surfaces. Adv Colloid Interface Sci.1998;74:69- 117 ) ( 115) Lampin M, Warocquier C, Legris C,et al. Correlation between substratum roughness and wettability,cell adhesion, and cell migration J Biomed Mater Res.1997:36:99-108. ) ( 116)Lee JH, Lee SJ, Khang G, et al.Interaction of fibroblasts on polycarbonate membrane surfaces with different micropore sizes and hydrophilicity.J Biomater SciPolym Ed . 1999;10:283-94 ) ( 117) Grinnell,F. and M. K. Feld, Adsorption characteristics of plasma fibronectin in relationship to biologicalactivity. JBiomed Mater Res. 1981;15:363-81. ) ( 118) Zhang Y, Andrukhoy O,Berner S,et al. Osteogenic properties ofhydrophilic and hydrophobic titanium surfacesevaluated with osteoblast-like cells(MG63)in coculture with human umbilical vein endothelialcells (HUVEC) . Dent Mater. 2010:26:1043-51. ) ( 119) Sousa SR, Moradas-Ferreira P, Barbosa MA. Ti02 type influences fibronectin adsorption.J Mater Sci Mater Med.2005;16:1173-8 ) 120)Zhao G, Schwartz Z,Wieland M,et al.High surface energy enhances cell response to titanium substratemicrostructure. J Biomed Mater Res A. 2005:74:49-58. ( 121) Park JWKim YJ, Jang JH. Enhanced osteoblast response to hydrophilic strontium and/or phosphate ions- incorporated titanium oxide surfaces. Clin Oral Implants Res. 2010;21:398-408 ) ( 122) Fuminori I, Norio H, Takeshi U,et al . Enhancement of osteoblast adhesion to UV-photofunctionalized titaniumvia an electrostatic mechanism. Biomaterials.2010:31:2717--2727 ) ( 123) Aita H, Att W, Ueno T, er al.Ultraviolet lightmediated photofunctionalization of titanium to promote humanmesenchymal stem cell migration,attachment,proliferation and differentiation. Acta Biomater. 2009;5(8):3247-57 ) ( 124) Hideki Aita, Masahiro Yamada,Norio Hori,et al. The effect ofultraviolet functionalization oftitanium onintegration with bone. Biomaterials.2009:30:1015-10. ) ( 125 ) ) Kilpadi DV, Lemons JE. Surface energy characterization of unalloyed titanium implants. J Biomed Mater ) ( Res. 1994:28 (12)1419-25. ) ( 126) Rupp F,Haupt M,Klostermann H, et al . Multifunctional nature of UV-irradiated nanocrystalline anatase thin films for biomedical applications [J]. Acta Biomater.2010,6(12);4566-4577. ) ( 127)T Takeuchi M,Sakamoto K, Martra G,et al . Mechanism of photoinduced superhydrophilicity on the Ti02 photocatalyst surface[J]. J Phys Chem B. 2005,109(32);15422-15428. ) ( 128) Uetsuka H,Onishi H, Henderson MA, et al.Photoinduced redox reaction coupled with limited electron mobilityat metal oxide surface. J PhysChem B. 2004108:10621-10624. ) ( 129) Henderson MA, White JM. Selectivity changes during organic photooxidation on Ti02: role of 02 pressure andorganic coverge. J Catal.2006;238:153-164. ) ( 130) Ryan EP,Holz JD,Mulcahey M, et al. Environmental toxicants may modulate osteoblast differentiation by amechanism involving the aryl hydrocarbon receptor. J Bone Miner Res.2007:22:1571-80 ) ( 131) Iwasa F,Hori N,Ueno T, et al . Enhancement ofosteoblast adhesion to UV-photofunctionalized titanium via anelectrostatic mechanism[J].Biomaterials.2010;31(10):2717-2727. ) ( 132) Hori N,Ueno T,Minamikawa H,et al.Electrostatic control of protein adsorption on UV-photofunctionalizedtitanium[J]. Acta Biomater. 2010;6(10):4175-4180. ) ( 133) M Miyauchi T,Yamada M, Yamamoto A, et al . The enhanced characteristics of osteoblast adhesion tophotofunctionalized nanoscale Ti02 layers on biomaterials surfaces.Biomaterials.2010;31:3827-39. ) ( 134) Yamada M, Miyauchi T , Yamamoto A, et al.Enhancement of adhesion strength and cellular stiffness ofosteoblasts on mirror-polished titanium surface by UV-photofunctionalization. Acta Biomater.2010;6:4578- 88. ) ( 135) 刘伟珍,周磊,丁婧文等。改良自攻性纯钛帽植入兔颅骨的动物模型研究。广东牙病防治,2013:21(5):245-250 ) ( 136) M Meyer A E, Baier R E, Natiella J R, et al . Investigation oftissue/implant interactions during the firsttwo hours of implantation[J]. J Oral Implantol.1988;14(3):363-379. ) ( 137) Franchi M, Fini M, Martini D, et al . Biological fixation ofendosseous implants. Micron.2005:36(7-8):665-671 ) ( 138) W Wennerberg A, Galli S, Albrektsson T. Current knowledge about the hydrophilic and nanostructured SLActive surface.Clinical , Cosmetic and Investigational Dentistry.2011;3:p.59-67. ) ( 139) Mori H,Manabe M, Kurachi Y,et al . Osseointegration of dental implants in rabbit bone with low mineral density. Journal of oral and maxillofacial surgery.1997;55(4): p.351-361. ) ( 140) Abrahamsson I, Berglundh TLinder E, et al. Early bone formation adjacent torough and turned endosseousimplant surfaces. Clinical Oral Implants Research 2004;15(4):381-392. ) ( 141) Germanier Y, Tosatti S, Broggini N, et al.Enhanced bone apposition around biofunctionalized sandblasted and acid-etched titanium implant surfaces. A histomorphometric study in miniature pigs. Clin Oral Implants Res2006;17(3):251-7 . ) ( 142) Bornstein MM,Valderrama P, Jones AA, et al. Bone apposition around two different sandblasted and acid-etchedtitanium implant surfaces: a histomorphometric study in canine mandibles. Clin Oral Implants Res2008;V19N3233-41 ) ( 143) Schwarz F, Ferrari D,Herten M,et al.Effects of surface hydrophilicity and microtopography on early stagesof soft and hard tissue integration at non-submerged titanium implants : an immunohistochemical study indogs J Periodontol.2007;V78N11:2171-84 ) ( 144) Schwarz F , Herten M, Sager M,et al. Histological and immunohistochemical analysis of initial andearlyosseous integration at chemically modified and conventional SLA titanium implants: preliminary results of a pilot study in dogs.Clin Oral Implants Res.2007:18(4):481-8. ) 缩写词简表 英文缩写 英文全称 中文名称 TPS Titanium plasma sprayed 钛浆涂层 AO Anodic oxidation 阳极氧化 RBM Resorbable blast media 可吸收研磨介质 CO Contact Osteogenesis 接触成骨 DO Distant Osteogenesis 距离成骨 HA Hydroxyapatite 羟基磷灰石 MAO Micro-arc Oxidation 微弧氧化 SFE Surface free energy 表面自由能 SLA Sandblasting with large grit and acid-etching 大颗粒喷砂酸蚀 TiO2 Titanium oxide 二氧化钛 UV Ultraviolet 紫外线 BA Bone area 骨面积 BIC Bone implant contact X-ray diffraction 种植体-骨结合率 XRD X射线衍射 PET Positron Emission Tomography 正电子发射计算机 断层显像
确定












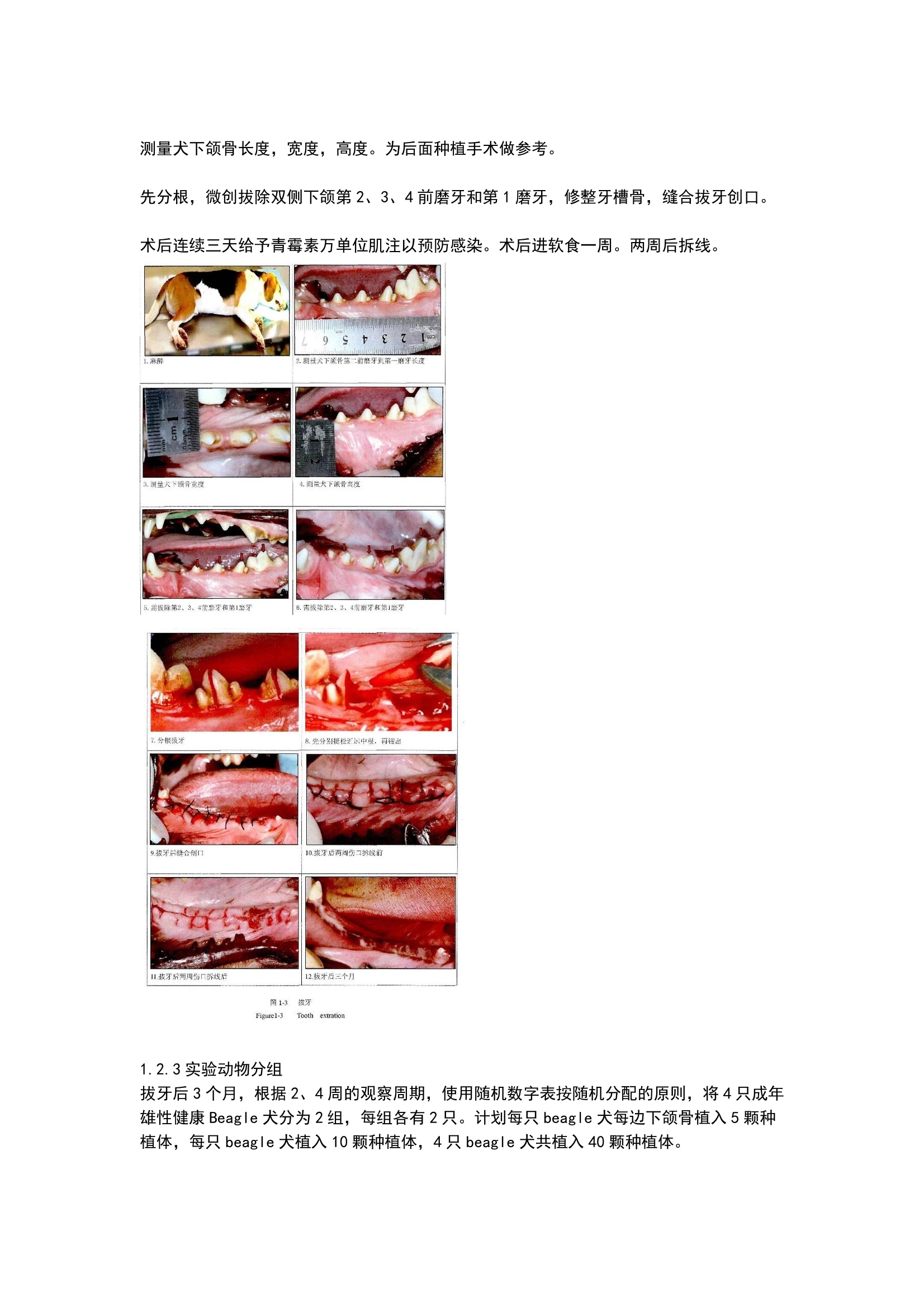
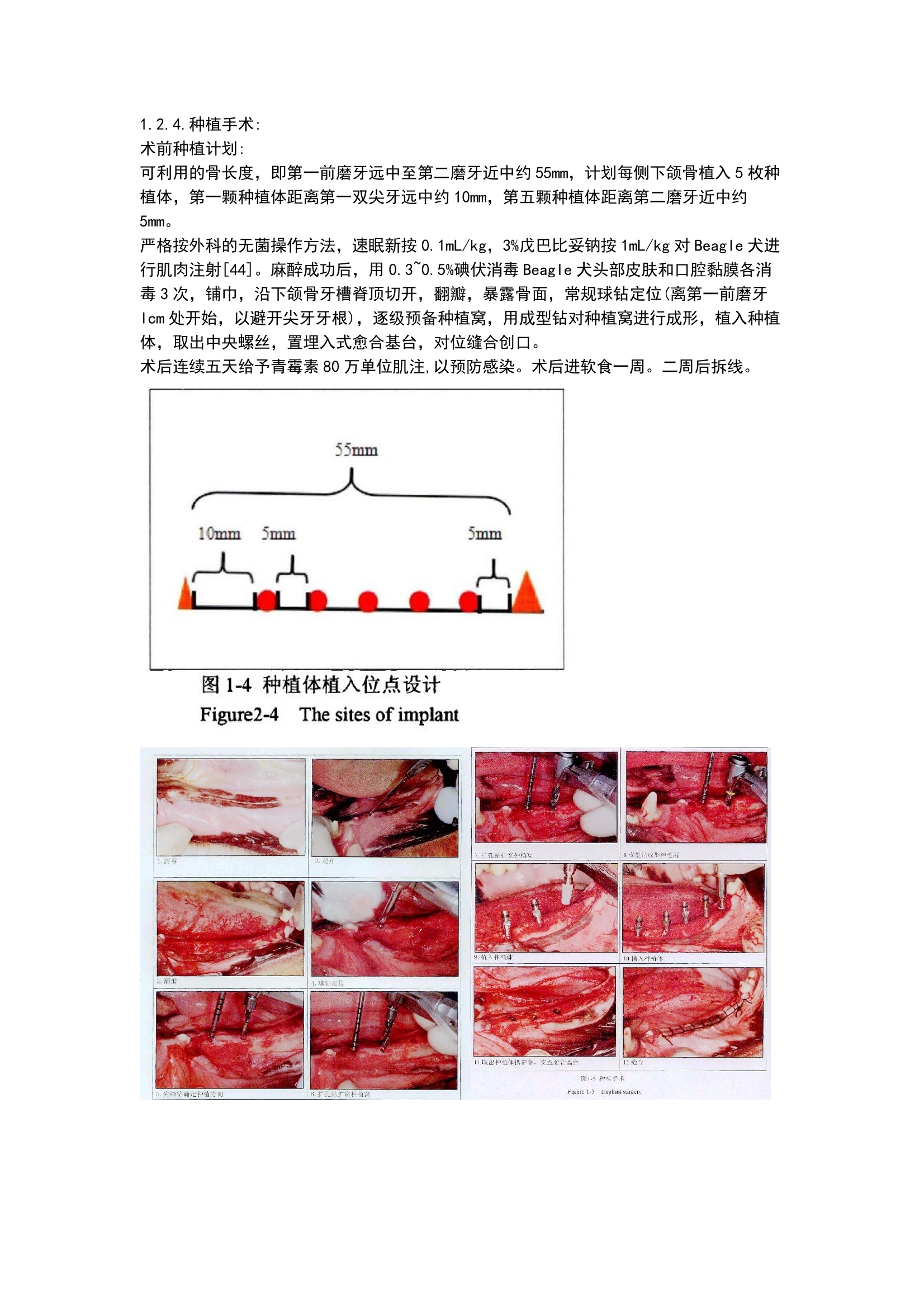


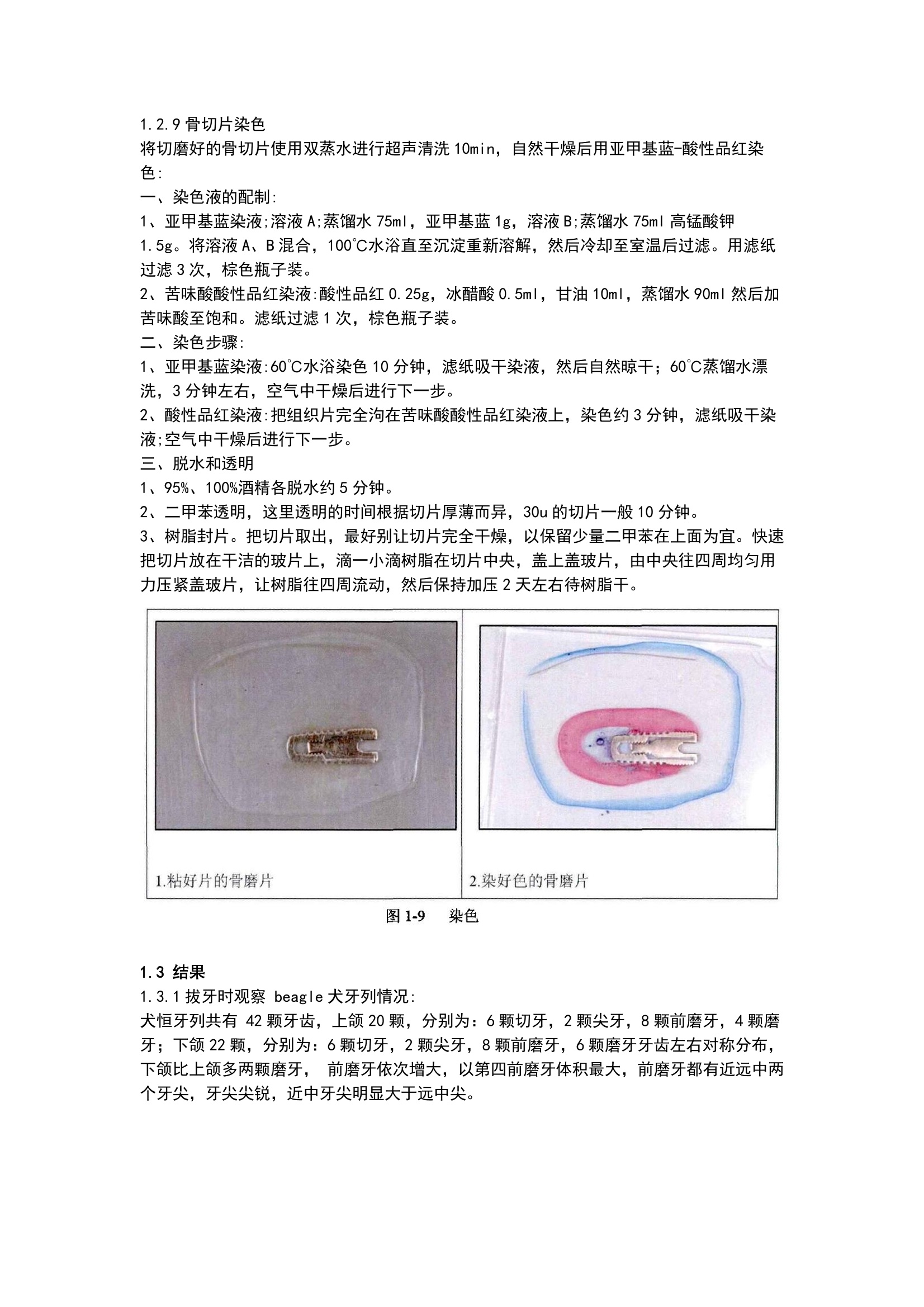
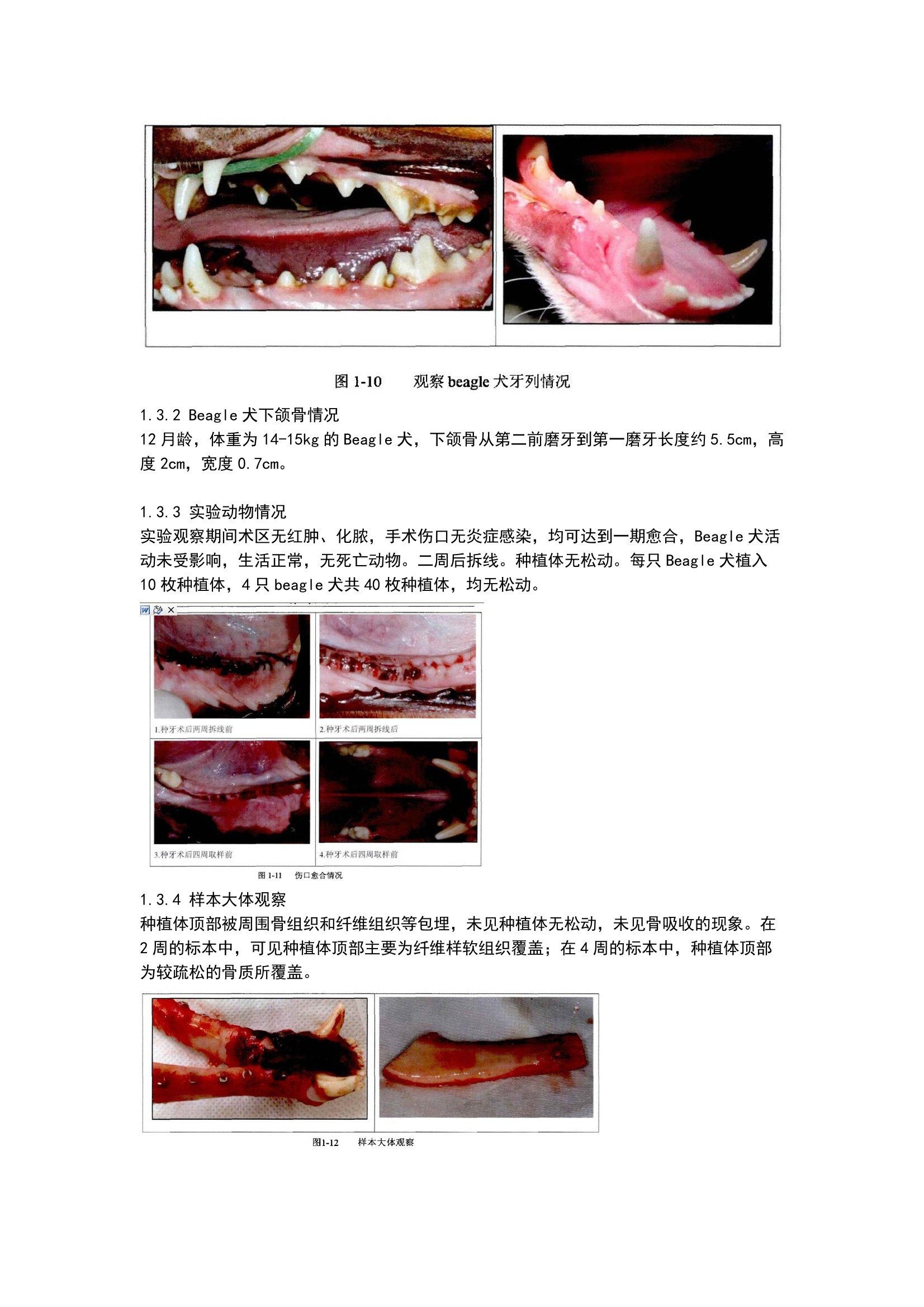
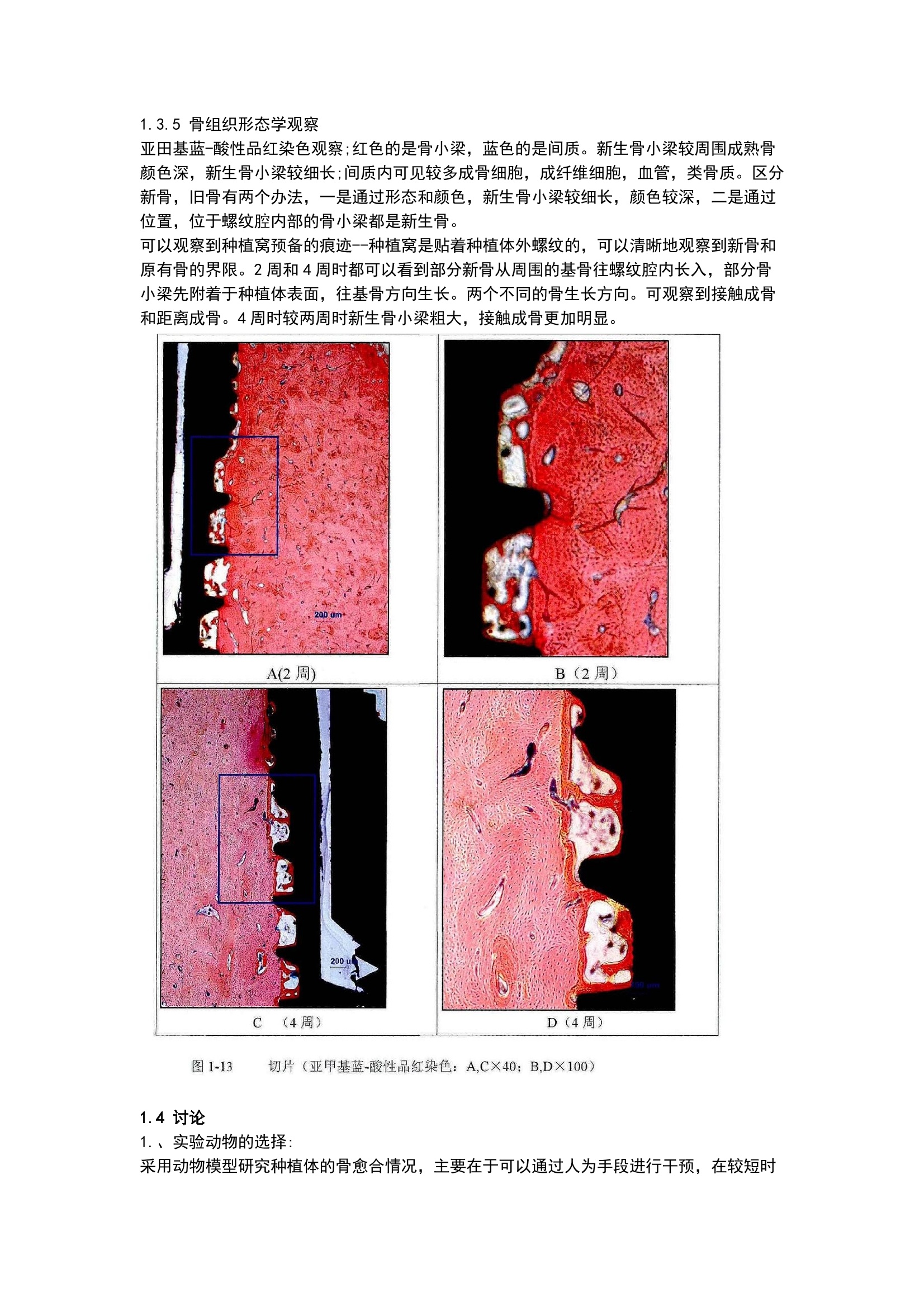




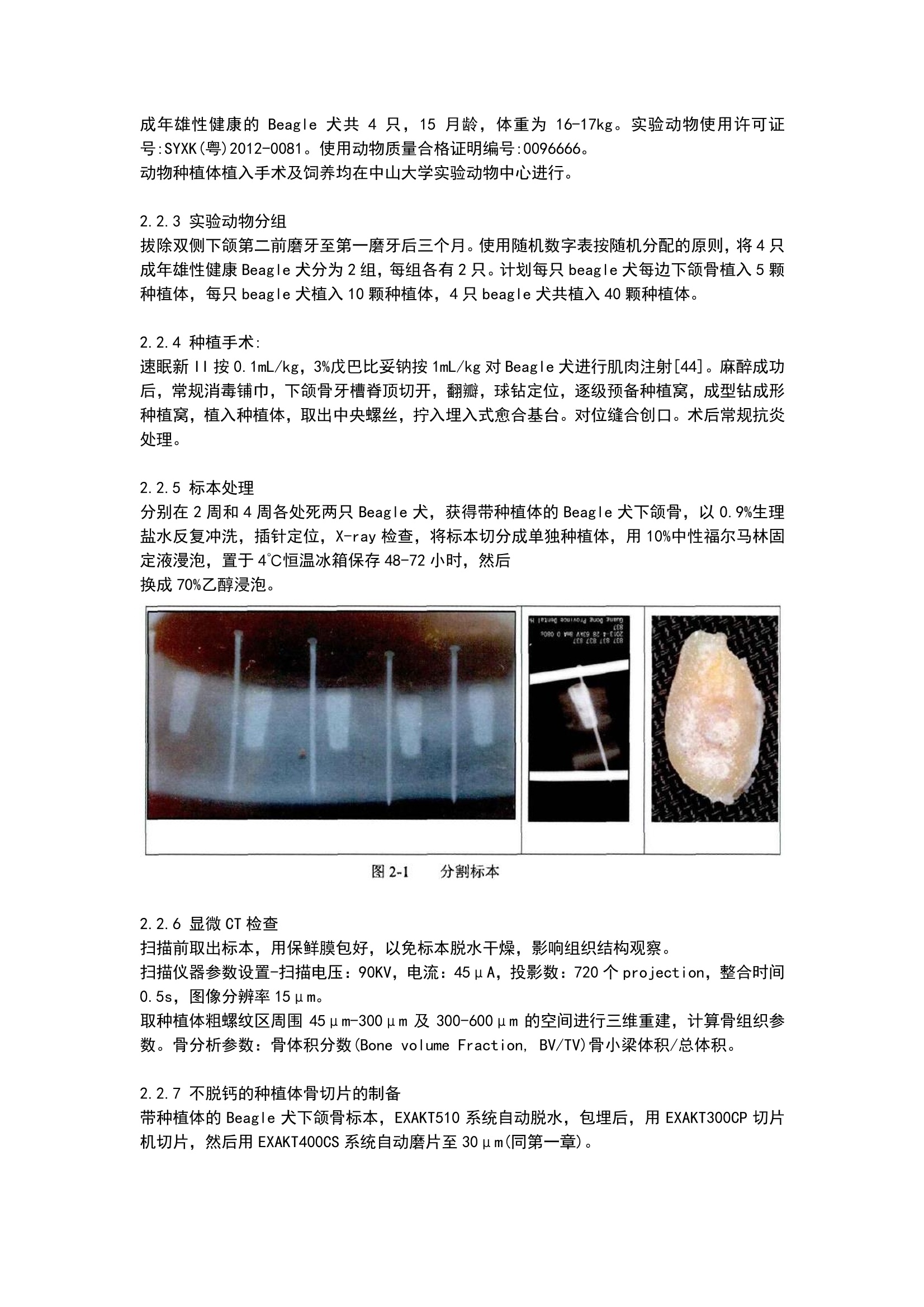






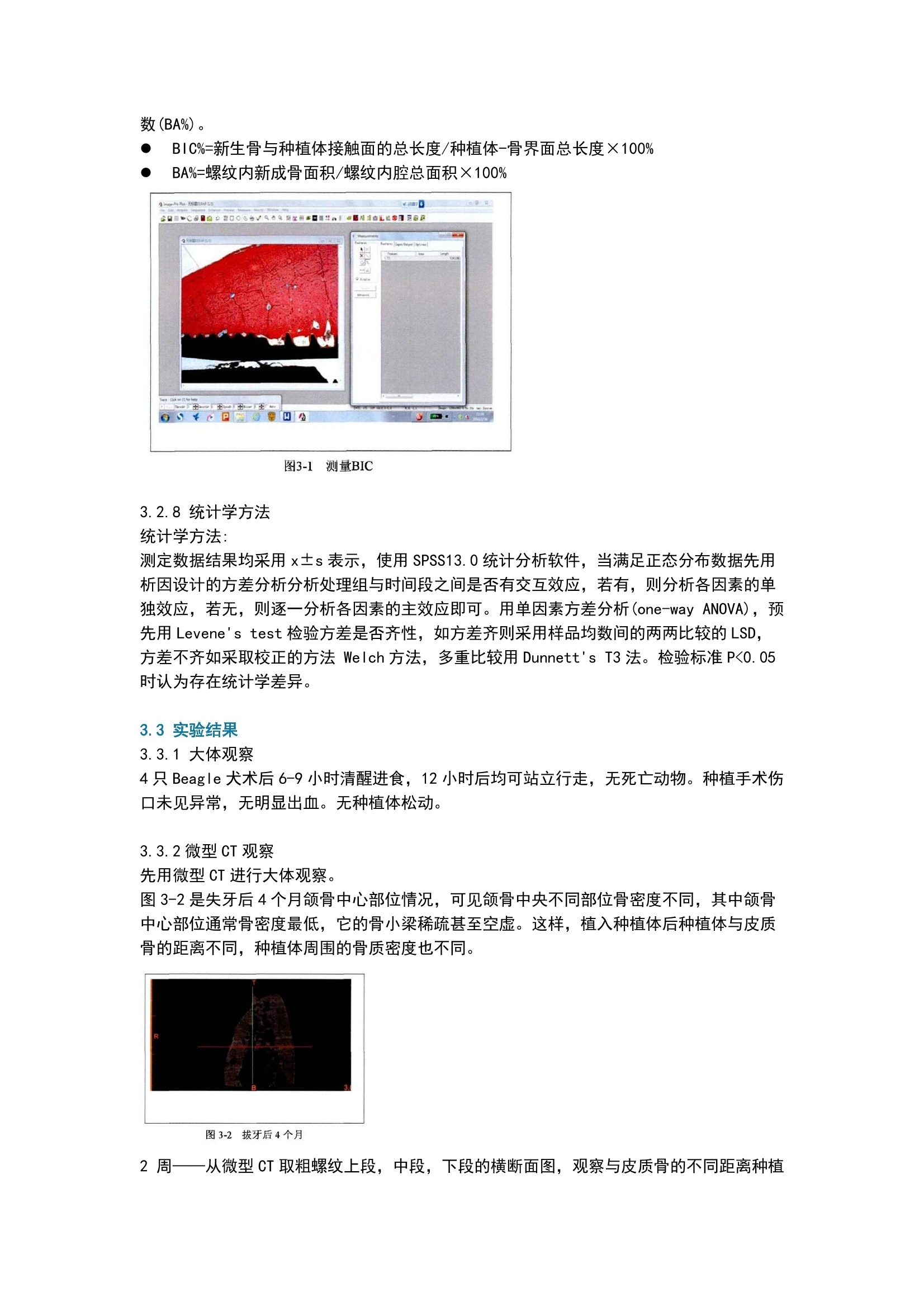










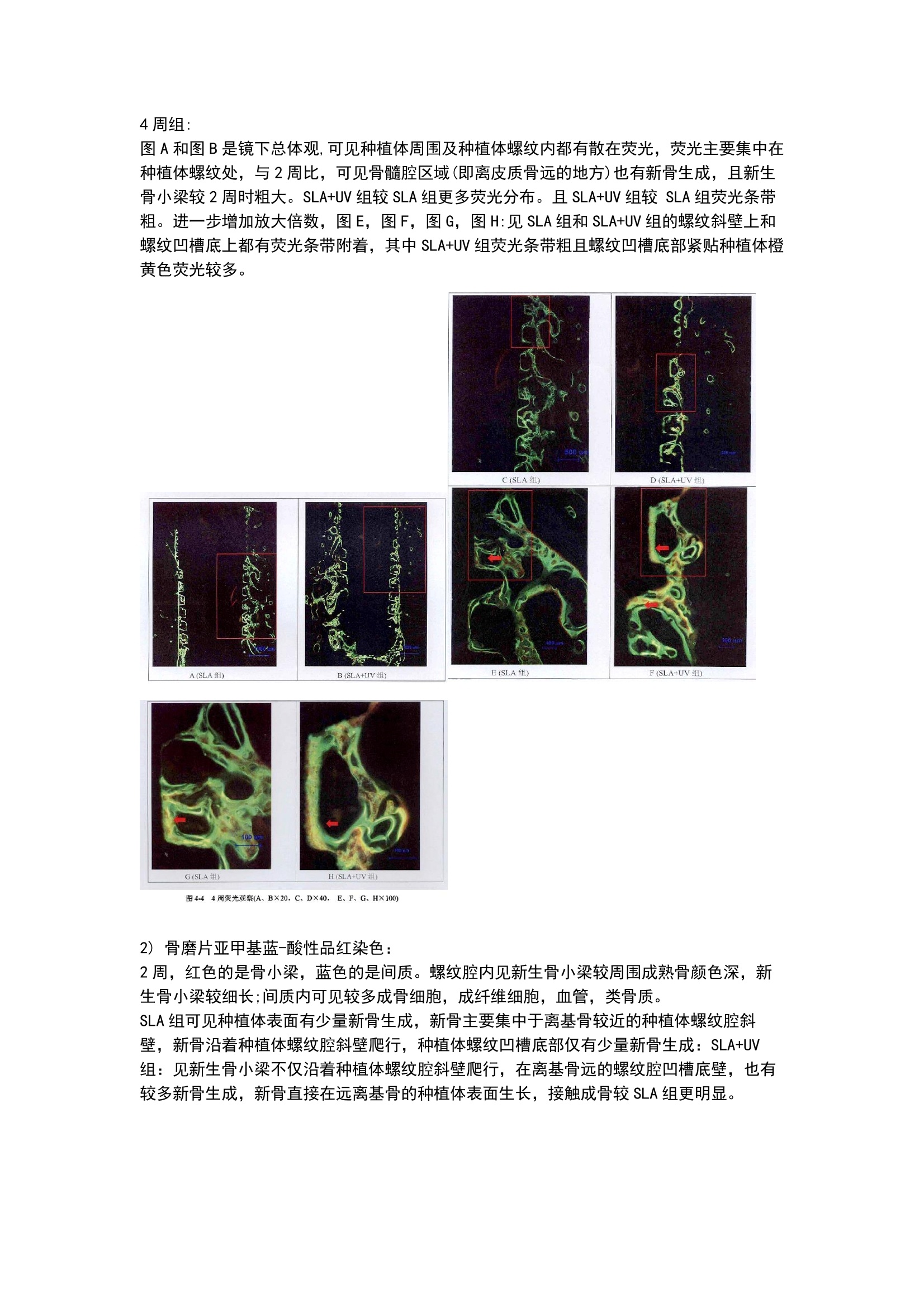


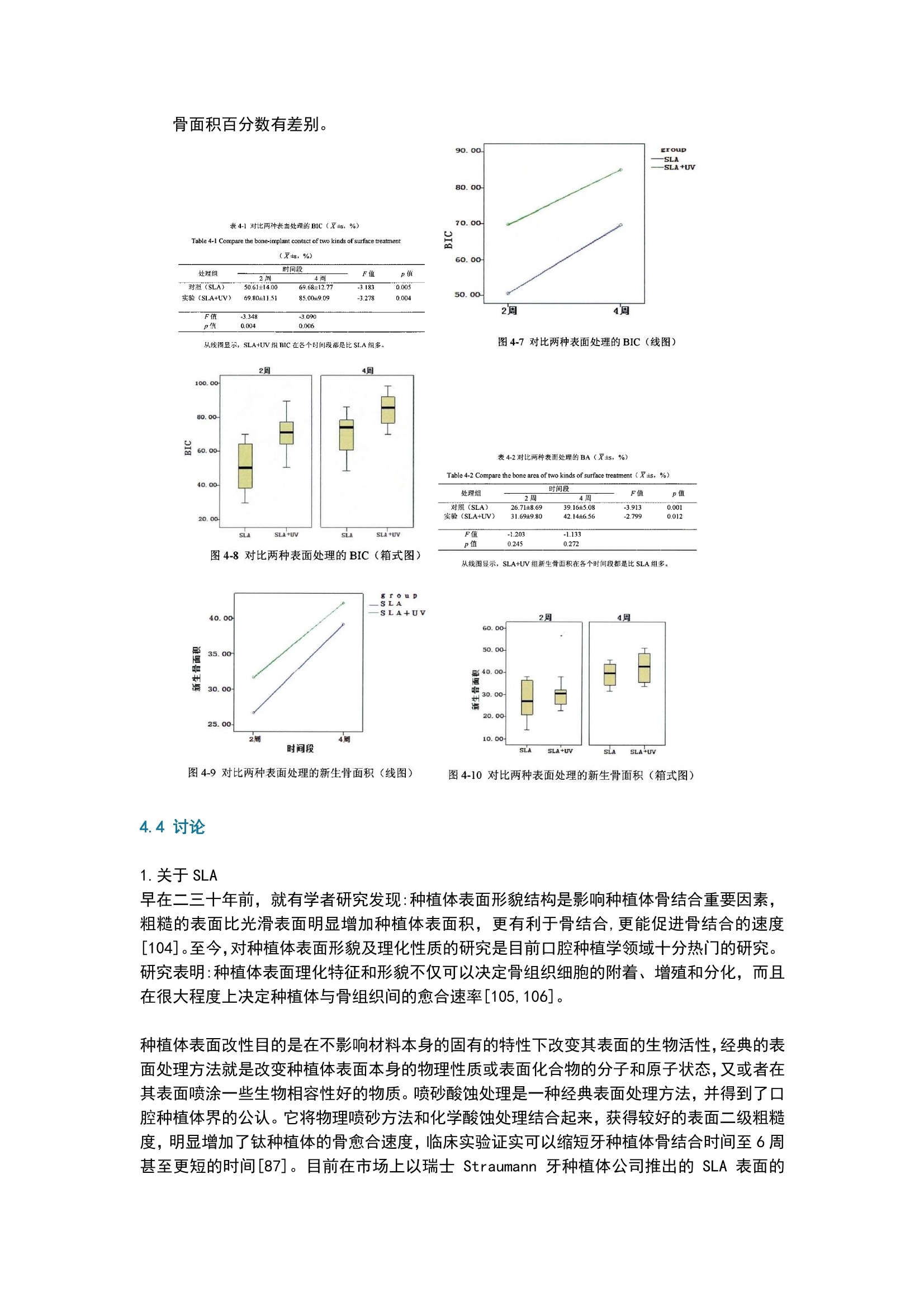














还剩59页未读,是否继续阅读?
北京共赢联盟国际科技有限公司为您提供《喷砂酸蚀钛种植体表面接触成骨现象及其影响因素的动物学实验研究》,该方案主要用于其他中喷砂酸蚀钛种植体检测,参考标准--,《喷砂酸蚀钛种植体表面接触成骨现象及其影响因素的动物学实验研究》用到的仪器有德国EXAKT金刚石带锯精密切磨系统300CP/CL、德国EXAKT全自动数显磨片机400CS、EXAKT脱水浸润仪E510、EXAKT 实验室耗材 包埋模具、EXAKT 台式切割机平行导轨
推荐专场
相关方案
更多
该厂商其他方案
更多


























