方案详情
文
免费下载赛多利斯超滤产品应用指南《简评赛多利斯超滤产品在生物纳米颗粒和医用纳米载体制备中的效果》,了解适用于多种纳米微粒类型的具体设备及MWCO建议。
方案详情

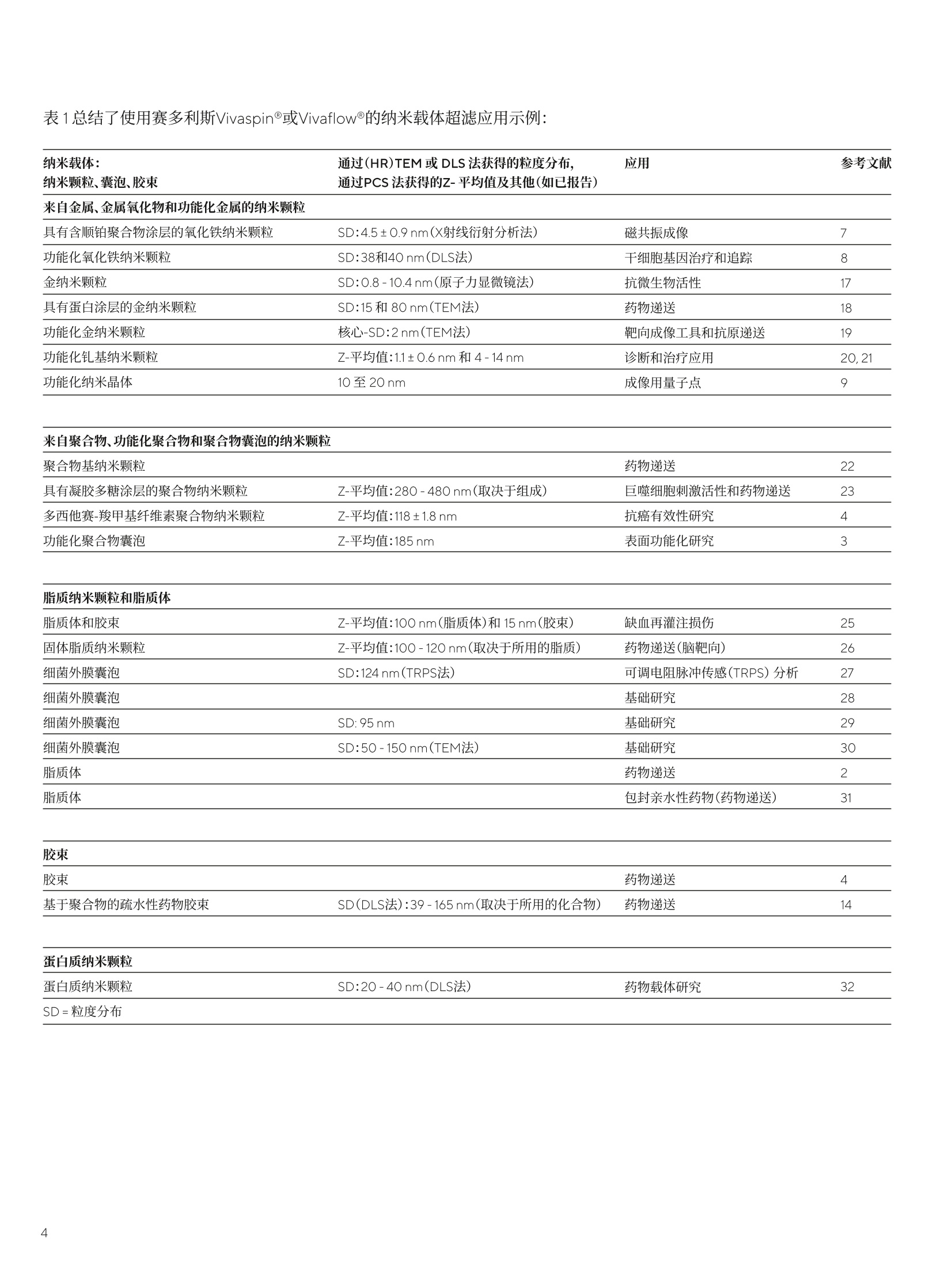
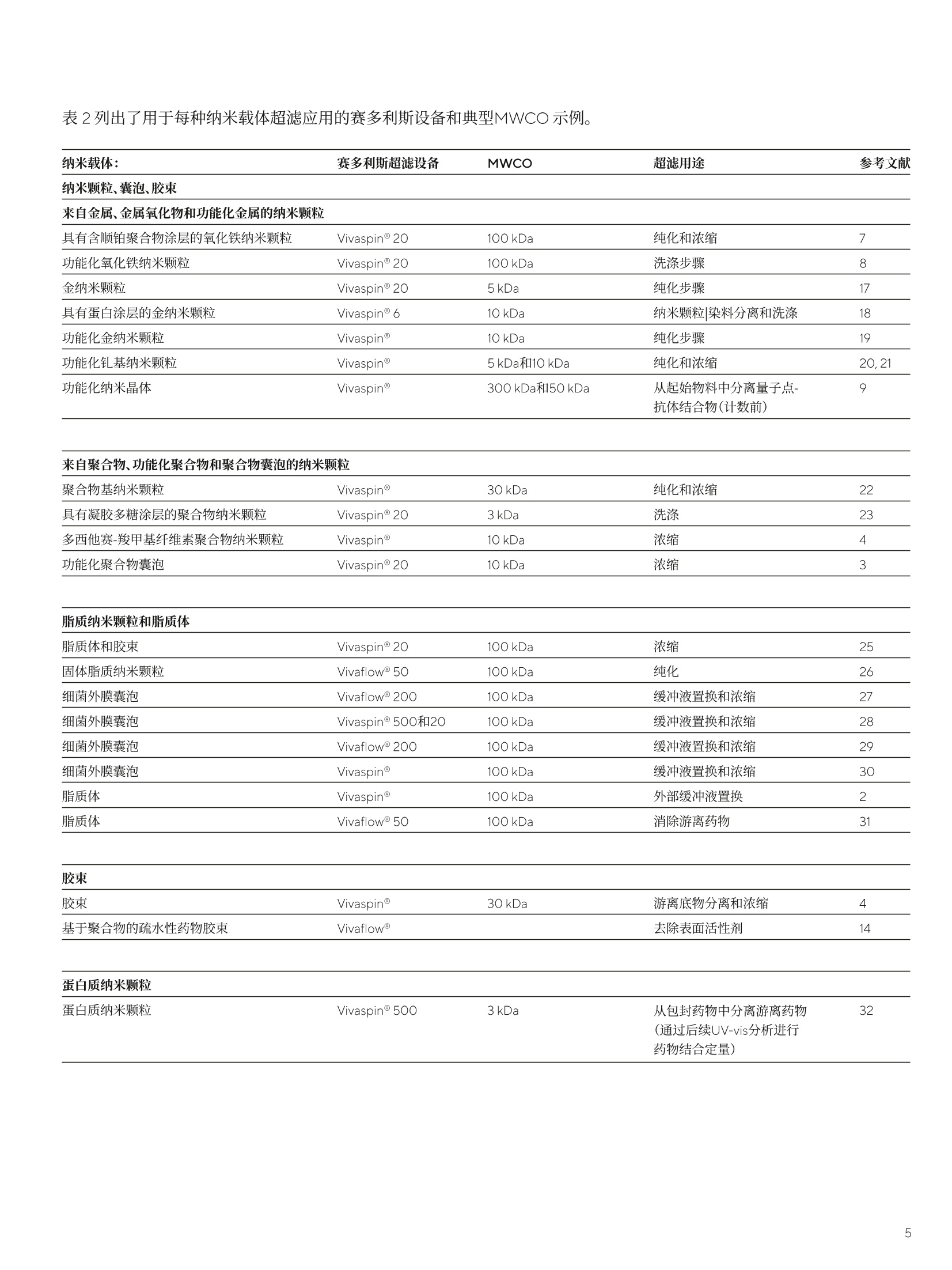
SARTORIUS应用指南 2021年11月5日 关键词或短语: 纳米颗粒、纳米载体、脂质体、囊泡、胶束 简评赛多利斯超滤产品在生物纳米颗粒和医用纳米载体制备中的效果 Hannes Landmann博士 Kristin Menzel博士? 1.Sartorius Lab Instruments GmbH & Co.KG,Otto-Brenner-Strasse 20, 37079, Goettingen, Germany, 2.Sartorius Stedim Biotech GmbH August-Spindler-Strasse 1137079 Goettingen, Germany *联系我们 电子邮箱: john.cashman@sartorius.com 摘要 本篇简评概述了各种生物纳米颗粒和医用纳米载体的超滤。本文中,采用超滤法从基质中纯化、浓缩和分离纳米颗粒。讨论的纳米材料包括金属、聚合物、脂质(囊泡和胶束形式)和蛋白质。针对这些典型应用和材料,提供用于选择具有最佳截留分子量(MWCO)的理想超滤设备的指南。 Paul Ehrlich 在1908年首次从理论角度描述组装到所谓"纳米载体"上的毒性药物时,受到"魔弹"*理念的启发。如今,纳米载体已在现代医学和生物技术中具有多种应用。这些特殊纳米材料的一项关键应用是药物靶向递送,从中用作活性成分的转运模块(即作为纳米颗粒、囊泡或胶束)。23.4.5与传统施用的药物相比,认为此方法更高效且对(人体)生物体的毒性更小。除药物递送外,在过去数十年中逐渐呈现使用纳米载体的各种其他领域;例如,使用金属基纳米颗粒进行磁共振成像或干细胞基因治疗78,或使用量子点进行光学成像。 纳米载体可按起始物料(即基于金属、脂质、聚合物和蛋白质)和制备后的形态(即囊泡、颗粒和胶束)进行分类。一般而言,在水介质中制备纳米颗粒混悬液或囊泡分散体时包括三个步骤:a)组装纳米载体(例如采用注射、薄膜水合或反相蒸发法),b)纯化(例如采用色谱、透析或超滤法)以及c)浓缩(例如通过超滤或蒸发法)。 本篇简评提供了有关纳米载体制备的近期文献示例。重点关注的是通过使用具有不同孔径(即截留分子量,MWCO)的赛多利斯Vivaspin@或Vivaflow@设备进行超滤而执行的浓缩和纯化步骤。Vivaspin@产品组合涵盖的体积范围为0.1至20mL, 而 Vivaflow@系统涵盖的体积范围为0.1至5L。因此,赛多利斯可提供无可比拟的广泛可处理样品体积、膜材料和MWCO以满足其预期用途的不同要求。在此背景下面临的挑战是合成后的缓冲液置换、脱盐和洗涤10.11、清除可溶性化合物12.13.14或聚集体。15 纯化对于以下方面而言至关重要:获得适合体内应用的等渗条件;防止聚集或凝聚;去除游离毒性药物、配体或其他可能引发副作用的基质。浓缩步骤对于以下方面而言至关重要:调整药物中的药用活性成分含量;达到预期治疗或诊断效果。 在纯化过程中,通过尺寸排阻色谱法(SEC)从所需纳米载体中分离游离物质(起始物料)时会不可避免地造成稀释,因而有必要执行后续浓缩步骤。相比之下,采用透析法进行纯化时不会发生显著稀释,但如果需要获得更高纳米载体浓度,可能仍须执行浓缩步骤。这两种分离方法均需投入大量、高成本且耗时的人工处理。理过在Vivaspin@离心时进行超滤或在Vivaflow@系统中使用蠕动泵,可克服这一缺点。该技术成本更低,并且只需极少人工投入即可快速实施。值得注意的是,纯化和浓缩步骤同时进行。16 纯化纳米载体后,通常要测定载药量(结合或包封效率)。结合或包封效率是用于描述和表征纳米载体的参考值之一。其他重要特性是Zeta电位和粒度分布(通过光子相关光谱[PCS]、高分辨率透射电子显微镜[HRTEM]成像或动态光散射[DLS]法测定)。在进行这些不同表征之前,混悬液或分散体的成功纯化和浓缩至关重要。 下标概述了关于采用超滤步骤对不同种类纳米载体进行纯化和浓缩的出版物。表2提供了有关使用哪些设备和MWCO的指南。 表1总结了使用赛多利斯Vivaspin@或Vivaflow@的纳米载体超滤应用示例: 纳米载体: 通过(HR)TEM 或 DLS法获得的粒度分布, 应用 参考文献 纳米颗粒、囊泡、胶束 通过PCS法获得的Z-平均值及其他(如已报告) 来自金属、金属氧化物和功能化金属的纳米颗粒 具有含顺铂聚合物涂层的氧化铁纳米颗粒 SD:4.5±0.9nm(X射线衍射分析法) 磁共振成像 7 功能化氧化铁纳米颗粒 SD:38和40nm(DLS法) 干细胞基因治疗和追踪 8 金纳米颗粒 SD:0.8-10.4nm(原子力显微镜法) 抗微生物活性 17 具有蛋白涂层的金纳米颗粒 SD:15和80 nm(TEM法) 药物递送 18 功能化金纳米颗粒 核心-SD:2nm(TEM法) 靶向成像工具和抗原递送 19 功能化钆基纳米颗粒 Z-平均值:1.1±0.6nm 和4-14 nm 诊断和治疗应用 20,21 功能化纳米晶体 10至20nm 成像用量子点 9 来自聚合物、功能化聚合物和聚合物囊泡的纳米颗粒 聚合物基纳米颗粒 药物递送 22 具有凝胶多糖涂层的聚合物纳米颗粒 Z-平均值:280-480nm(取决于组成) 巨噬细胞刺激活性和药物递送 23 多西他赛-羧甲基纤维素聚合物纳米颗粒 Z-平均值:118±1.8 nm 抗癌有效性研究 4 功能化聚合物囊泡 Z-平均值:185nm 表面功能化研究 3 脂质纳米颗粒和脂质体 脂质体和胶束 Z-平均值:100nm(旨质体)和15nm(胶束) 缺血再灌注损伤 25 固体脂质纳米颗粒 Z-平均值:100-120nm(取决于所用的脂质) 药物递送(脑靶向) 26 细菌外膜囊泡 SD:124nm(TRPS法) 可调电阻脉冲传感(TRPS)分析 27 细菌外膜囊泡 基础研究 28 细菌外膜囊泡 SD:95nm 基础研究 29 细菌外膜囊泡 SD:50-150nm(TEM法) 基础研究 30 脂质体 药物递送 2 脂质体 包封亲水性药物(药物递送) 31 胶束 胶束 药物递送 4 基于聚合物的疏水性药物胶束 SD(DLS法):39-165nm(取决于所用的化合物) 药物递送 14 蛋白质纳米颗粒 蛋白质纳米颗粒 SD:20-40nm(DLS法) 药物载体研究 32 SD=粒度分布 表2列出了用于每种纳米载体超滤应用的赛多利斯设备和典型MWCO示例。 纳米载体: 赛多利斯超滤设备 MWCO 超滤用途 参考文献 纳米颗粒、囊泡、交束 来自金属、金属氧化物和功能化金属的纳米颗粒 具有含顺铂聚合物涂层的氧化铁纳米颗粒 Vivaspin 20 100 kDa 纯化和浓缩 7 功能化氧化铁纳米颗粒 Vivaspin 20 100 kDa 洗涤步骤 8 金纳米颗粒 Vivaspin 20 5kDa 纯化步骤 17 具有蛋白涂层的金纳米颗粒 Vivaspin@6 10 kDa 纳米颗粒|染料分离和洗涤 18 功能化金纳米颗粒 Vivaspin 10 kDa 纯化步骤 19 功能化钆基纳米颗粒 Vivaspin 5kDa和10 kDa 纯化和浓缩 20,21 功能化纳米晶体 Vivaspin@ 300kDa和50 kDa 从起始物料中分离量子点- 9 抗体结合物(计数前) 来自聚合物、功能化聚合物和聚合物囊泡的纳米颗粒 聚合物基纳米颗粒 Vivaspin 30 kDa 纯化和浓缩 22 具有凝胶多糖涂层的聚合物纳米颗粒 Vivaspin 20 3kDa 洗涤 23 多西他赛-羧甲基纤维素聚合物纳米颗粒 Vivaspin 10kDa 浓缩 4 功能化聚合物囊泡 Vivaspin 20 10 kDa 浓缩 3 脂质纳米颗粒和脂质体 脂质体和胶束 Vivaspin@ 20 100 kDa 浓缩 25 固体脂质纳米颗粒 Vivaflow@50 100 kDa 纯化 26 细菌外膜囊泡 Vivaflow@200 100 kDa 缓冲液置换和浓缩 27 细菌外膜囊泡 Vivaspin@500和20 100 kDa 缓冲液置换和浓缩 28 细菌外膜囊泡 Vivaflow@ 200 100 kDa 缓冲液置换和浓缩 29 细菌外膜囊泡 Vivaspin 100 kDa 缓冲液置换和浓缩 30 脂质体 Vivaspin@ 100 kDa 外部缓冲液置换 2 脂质体 Vivaflow@ 50 100 kDa 消除游离药物 31 胶束 胶束 Vivaspin 30 kDa 游离底物分离和浓缩 4 基于聚合物的疏水性药物胶束 Vivaflow@ 去除表面活性剂 14 蛋白质纳米颗粒 蛋白质纳米颗粒 Vivaspin500 3 kDa 从包封药物中分离游离药物 32 (通过后续UV-vis分析进行 药物结合定量) ( (1)Strebhardt, K .& Ullrich, A.: P aul Ehrlich' s magic bullet concept:100 years of progress.8, 473-480 (2008). ) ( (2)Jakoby,J., Beuschlein, F., Mentz, S., Hantel, C. &Suss, R.:Liposomal doxorubicin for active t argeting: Surface modification of the n anocarrier evaluated in vitro and in vivo-challenges and prospects.Oncotarget6,(2015). ) ( (3)Klermund, L., P oschenrieder, S. T. & Castiglione,K.: Simple su r face functionalization of polymersomes usingnon-anti b acterial peptide anchors.J.Nanobiotechnology 14,48 (2016). ) ( (4)Mulder, W.J.M.et al.:Molecular imaging of m acrophages in atheroscleroticplaques using bimodal PEG-micelles.Magn. Reson. Med.58,1164-1170(2007). ) ( (5)Murthy,S. K.: Nanoparticles in modern me d icine: state of th e art a n d future challenges.Int.J . Nanomedicine 2, 129-41(2007). ) (6)Voigt, R. & Fahr, A.: ( Pharmazeutische Technologie fur Studium und Be r uf.Deutscher Apotheker Verlag, 1Oth Edition (2010). ) (7)Unterweger,H. et al.: ( Development and characterization of magnetic iron oxide n a noparticles with a cisplatin-bearin g polymercoating for targeted d rug deli v ery. Int J Nanomedicine 9, 3659-3676(2014). ) (8)Park, W. et al.: ( Multi-modal transfection agent based on monodisperse magnetic nanoparticles for stem cell gene delivery and tracking. Biomaterials 35,7239-7247(2014). ) ( (9)Chalmers,N.I. et al.: Use of quantum dot luminescent probes to achieve single-cell resolution of human oral bacteria in biofilms. Appl. Environ. Microbio l .73,630-636(2007). ) ( (10)Hoffman, L.W.,Andersson,G. G . , Sharma, A.,Clarke, S. R. &Voelcker, N. H.: New insights into the structure of PAMAM dendrimer|gold nanoparticle nanocomposites.Langmuir 27, 6759-6767(2011). ) (11)Rademacher,T. & Williams, P.:Nanoparticle-peptide compositions. (2014). (12)Allard, E. &Larpent, C.: Core-shell type dually fluorescent polymer nanoparticlesfor ratiometric pH-sensing.J. Polym. Sci. Part A Polym.Chem. 46,6206-6213(2008). (13)Prach,M., Stone, V. & Proudfoot, L.:Zinc oxide nanoparticles and monocytes: Impact of size,charge and solubility on activation status.Toxicol.Appl.Pharmacol.266,19-26(2013). (14)Zhang, Y.et al:Therapeutic surfactant-stripped frozen micelles.NatCommun 7,11649(2016). (15)Klasson, A. et al.: Positive MRI contrast enhancement in THP-1cells withGd203 nanoparticles. Contrast Media Mol. Imaging 3,106-111(2008). (16)Simonoska Crcarevska, M. et al.:Definition of formulation design space, in vitrobioactivity and in vivo biodistribution for hydrophilicdrug loaded PLGA/PEO-PPO-PEO nanoparticles usingOFAT experiments. Eur. J.Pharm. Sci. 49,65-80 (2013). (17)Boda,S. K. et al.:Cytotoxicity of Ultrasmall Gold Nanoparticles onPlanktonic and Biofilm Encapsulated Gram-PositiveStaphylococci. Small 11,3183-3193(2015). (18)Schaffler, M.et al.:Blood protein coating of gold nanoparticles as potentialtool for organ targeting. Biomaterials 35, 3455-3466(2014). (19)Arosio, D. et al.:Effective targeting of DC-sign by a-fucosylamidefunctionalized gold nanoparticles. Bioconjug. Chem.25,2244-2251(2014). (20)Miladi, I. et al.: Biodistribution of ultra small gadolinium-basednanoparticles as theranostic agent: application to braintumors.J. Biomater. Appl. 28,385-94(2013). (21)Faure, A. C. et al.:Control of the in vivo biodistribution of hybridnanoparticles with different poly(ethylene glycol)coatings. Small 5, 2565-2575(2009). (22)Benita,S.,Debotton, N. & Goldstein,D.: Nanoparticlesfor Targeted Delivery of Active Agent. (2008). (23)Tukulula, M. et al.: Curdlan-conjugated PLGA nanoparticles possessmacrophage stimulant activity and drug deliverycapabilities. Pharm.Res. 32, 2713-2726(2015). ( (24)Ernsting, M .J.,T a ng, W. L., MacCallum, N. W. & Li, S. D.: Preclinical pharmacokinetic, biodistribution, andanti-cancerefficacy studies of a docetaxel- carboxymethylcellulose nanoparticle i n mouse models Biomaterials 33,1445-1454(2012). ) ( (25)Geelen, T, Paulis, L. E ., Coolen,B. F., Nicolay, K. & Strijkers,G.J.:Passive targeting of lipid-based nanoparticles tomouse cardiac ischemia-reperfusion injury. Contrast Media Mol. Imaging 8, 117-126(2013). ) ( (26)Neves, A. R., Queiroz, J. F. & Reis, S. : B rain-targeted de l ivery of resveratrol using solid lip i d nanoparticles functionalized with apolipoprotein E. J .Nanobiotechnology 14, 27(2016). ) (27)Bogomolny, E. et al.: ( Analysis of bacteria-derived outer membrane vesiclesusing tunable resistive pulse sensing. Prog . Biomed. Opt.Imaging- Proc. SPIE 9338,4-9(2015). ) (28)Blenkiron, C. et al.: ( Uropathogenic Escherichia coli releases extracellular vesicles that are associated with RNA. PLoS One 1 1 , 1-16(2016). ) ( (29)Twu,O.e t al.: T richomonas vaginalis Exosomes Deliver Cargo to Host Cells and Mediate Host:Parasite Interactions.PLoS Pathog.9,22-24(2013). ) ( (30)Tong,T.T., Morgelin, M., Forsgren, A. & Riesbeck, K.:.Haemophilus i nfluenzae Survival during Complement-Mediated Attacks Is Promoted by Moraxella catarrhalis Outer Membrane Vesicles.J.Infect. D i s. 195,1661-1670 (2007). ) (31)Prado,J. M.D.,Antoranz, J. R. C., Barroeta, M.A. E.,Barroeta, B. E. & Diaz, M.C.:Liposomal formulations.(2009). (32)Achilli, E. et al.: ( Preparation of protein nanoparticle by dynamicaggregation an d ionizing-induced crosslinking.Colloids Surfaces A Physicochem. Eng. Asp. 486,161-17 1 (2015). ) 了解更多信息:.:www.sartorius.com/en/products/lab-filtration-purification/ultrafiltration-devices *德语"Zauberkugel"(来自Carl Maria von Weberopera编写的歌剧"Freischutz") Overview了解纳米微粒如何改善医疗领域的药物递送,以及如何使用超滤技术来对纳米微粒制备流程进行分析和优化。在过去的一个世纪里,新的研究方法通过不断加快发现甚至是设计新的靶点来改变着药物领域。与此同时,科学家们也在研究将药物运送并有效递送至体内靶点部位的新方法。纳米技术,尤其是纳米微粒的生产,作为一种改进传统药物递送方法的手段,受到了广泛关注。John Cashman,赛多利斯赛多利斯实验室超滤解决方案全球产品经理John Cashman解释说:“纳米微粒包含各种各样的有机和无机分子,它们可以通过其材质(如脂质、金属或聚合物)及最终使用形式(如膜泡或颗粒)来进行特性表征。这些微粒在诊断、疗法及疾病治疗领域具有巨大的应用潜力,包括成像及靶向给药”。在谈及目前用于应对SARS-CoV-2疫情的一些疫苗时,他解释说:“事实上,在第一批要获得监管批准的mRNA疫苗中,纳米微粒是其关键药物递送组分。这些疫苗利用脂质纳米微粒将mRNA转染到受体的免疫细胞中,从而帮助形成对COVID-19的免疫。”药物递送中的纳米微粒制备流程与分析纳米微粒的生产通常分为三个步骤:组装、纯化及浓缩。根据所涉及应用的不同,这些步骤的严格程度也可能会有所变化。例如,药物递送应用需要高纯度和高效率的纳米微粒,以确保治疗有效且不会产生不良的副作用。药物既可以与纳米粒表面偶联,也可以封装在由脂质组装的膜泡中,这个工艺也被称为纳米微粒的“功能化”。功能化很难达到100%有效性,为了确保其能成功实现,就需要进行各种分析性及验证性分析。为了确定给患者服用的药物数量并确保剂量正确,其中重要的一项常规分析就是测量纳米粒的偶联或包封效率。这样,就需要一种分离工艺(比如超滤),以从纳米粒结合药物中分离出游离药物,从而确定与纳米微粒偶联药物的含量。超滤主要根据分子的大小,使用具有超细孔径的膜来分离分子。Cashman解释道:“游离药物和纳米微粒结合药物的大小通常存在显著的差异,超滤就成为了分离这些药物的有效技术。只要使用功能化纳米微粒的尺寸比其标称膜孔径大很多的设备,即可截留纳米微粒结合的药物,而尺寸较小的游离药物分子则会通过膜。”这样,通过超滤就可将游离药物(在渗透液样品中)从功能化纳米微粒(在滞留物样品中)中分离出来。对透过液中的药物浓度与样品制备开始时添加的药物浓度进行比较,即可获得结合或包封效率测量值,以百分比表示。纳米微粒的可持续生产:石墨烯案例研究在纳米微粒的整个生产过程中,超滤是一种不可或缺的方法。这对于难以制备的纳米微粒来说尤其如此,例如石墨烯,这是医学中常用的一种物质。虽然最初的合成很简单,但所得到的石墨烯具有很强的酸性,并含有多种杂质。Cashman分享道:“正是身体内靶点部位的酸性环境(比如肿瘤微环境)会触发药物从石墨烯表面释放出来。这意味着石墨烯的pH值对靶向治疗的实现至关重要,因此,必须在生产后对石墨烯进行彻底洗涤及中和。”这种洗涤过程通常要完成多个离心步骤,一周时间制备出的量也相对较少,而且需要人工完成相当多的工作。除了在样品容量和可放大性方面受到限制外,离心处理后也会产生大量含有石墨烯的废物,这些废物如未进行适当的处理,可能会对环境产生危害。此外,离心也可能导致上清液部分的收率明显降低,上清液中通常含有较小的石墨烯片,因为相对于样品中较大的石墨烯片,它们的沉降速度较慢。这是离心处理的一个显著缺点,因为这些小尺寸的石墨烯片比大石墨烯片更具生物医学相关性。Vivaflow® TFF膜包在寻求经过改进且可持续的离心替代方案的过程中,赛多利斯与挪威斯塔万格大学生物工程团队的Abdelnour Alhourani合作开发出了一种用于石墨烯洗涤及pH中和的切向流过滤(TFF)方法。进行切向流过滤时,即可通过渗滤连续洗涤纳米微粒。Cashman说道:“与离心法相比,TFF法可节省95%的时间,并能减少手动操作时间及石墨烯废物,同时保持较高的石墨烯回收率。我们使用Vivaflow®进行TFF,这是一种切向流过滤系统,能够处理多达5升的初始样本量,其适用于研究和工艺开发实验室。”与离心法不同,这些设备中的超滤膜可有效截留各种尺寸的石墨烯颗粒。这不仅有助于防止产量降低,还可减少商业生产阶段起始物料的用量。此外,可以使用工艺规模的系统进行TFF,以进行数百升到数千升的生产。这样,它就可以克服离心法的容量限制,成为一种有效的可放大技术。优化纳米微粒制备流程的一些建议Cashman提到:“确保高处理速度及高回收率的关键是为所有目标分子选择正确的膜材料及截留分子量(MWCO)。理想的做法是,应为每种纳米微粒测试多种材料和截留分子量。”与石墨烯一样,有许多案例表明,使用超滤代替传统的技术可以提高处理速度,同时保持甚至提高产量。这在使用外泌体及其他膜泡形式的纳米微粒的情况中更为有益,因为它们通常需要在生产过程中进行浓缩。浓缩这类纳米微粒的传统方法是超速离心,而这种方法需要大量时间,并且处理大样本量的能力也十分有限。此外,在高离心力的作用下,施加在样品上的压力也会提高外为体受损,进而降低产量的风险。相比之下,超滤则是一种更快、更温和的可放大技术。Cashman分享道:“如果为了在确定纳米微粒功能化后的耦合或包封效率时获得理想结果,最好选择无支撑层(如三醋酸纤维素)的装置,因为这可以尽可能降低游离药物被吸附的几率。在诊断成像等一些应用中,需要使用试剂来标记纳米微粒,那么去除其中未结合的染料或同位素就变得很重要。与之前用于测量结合或包封效率的方法类似,超滤可有效滤除纳米微粒中的未结合的染料。”此外,透析可以与超滤一起使用,以提高未结合染料的去除效率。Download免费下载赛多利斯超滤产品应用指南《简评赛多利斯超滤产品在生物纳米颗粒和医用纳米载体制备中的效果》,了解适用于多种纳米微粒类型的具体设备及MWCO建议。点击下载 获取全文纳米微粒的多样化未来很明显,纳米微粒的潜力才刚刚被大家发现。除了医学研究,纳米微粒还可用于化妆品生产和自清洁表面涂层有关的应用。Cashman总结道:“纳米微粒的许多应用也在不断地变化,我们预计,超滤会继续在这些材料的纯化和分析样品制备中发挥重要的作用。”本文访谈内容摘自SelectScience,Editorial Article 31 Jan 2022
确定




还剩5页未读,是否继续阅读?
德国赛多利斯集团为您提供《生物纳米颗粒和医用纳米载体中超滤分析检测方案(微滤系统)》,该方案主要用于其他中前处理检测,参考标准--,《生物纳米颗粒和医用纳米载体中超滤分析检测方案(微滤系统)》用到的仪器有赛多利斯 Vivaflow 切向流膜包
推荐专场
相关方案
更多
该厂商其他方案
更多















