
《Arium® 用于痕量分析的超纯水》应用说明研究了采用不同来源的超纯水作为洗脱液,进行多项高效液相色谱-二极管阵列检测器(HPLC-DAD)和质谱(MS)系统的实验,从而证实了Arium® Mini Plus超纯水非常适合色谱法和质谱(MS)的应用。
方案详情

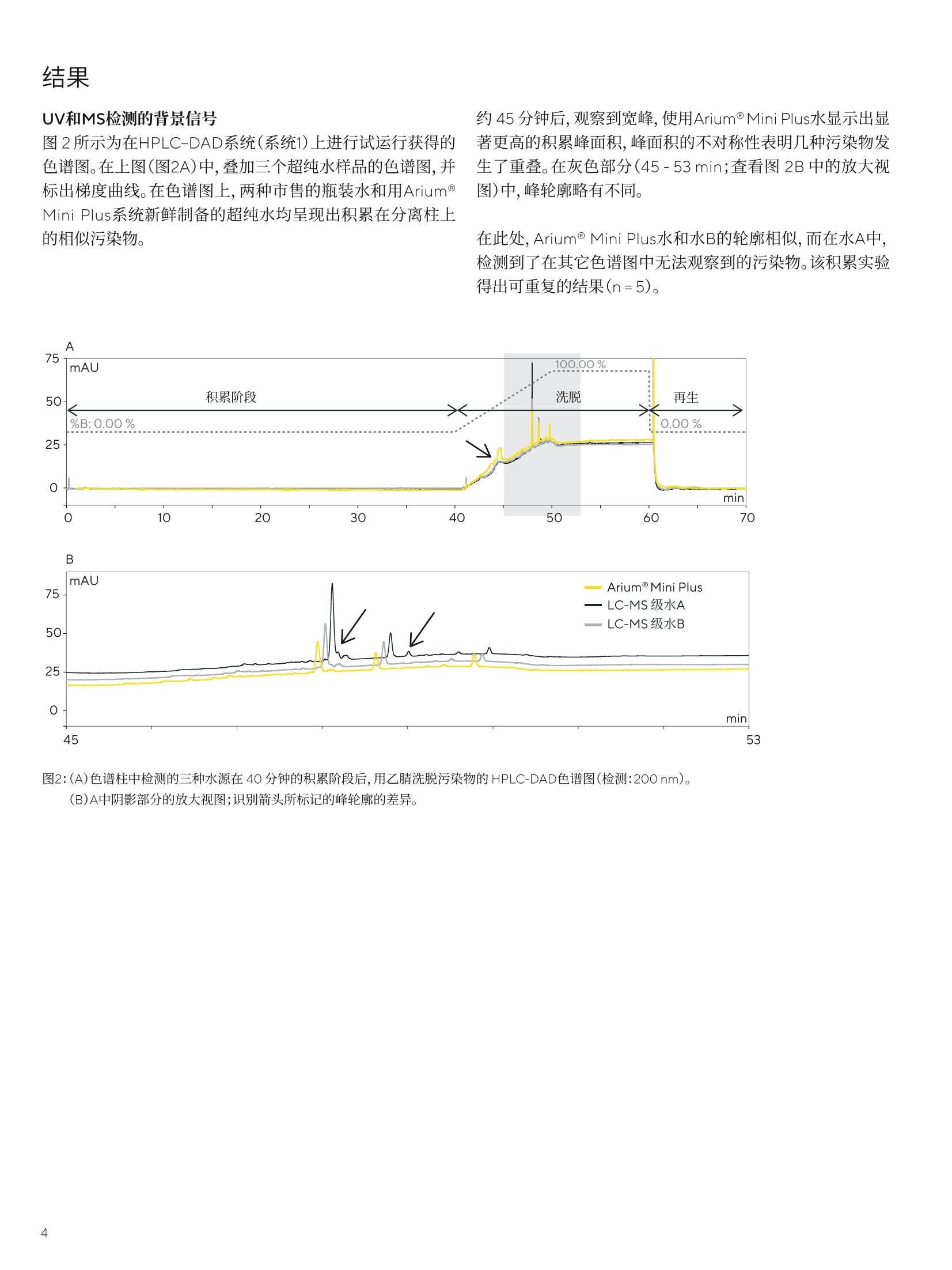
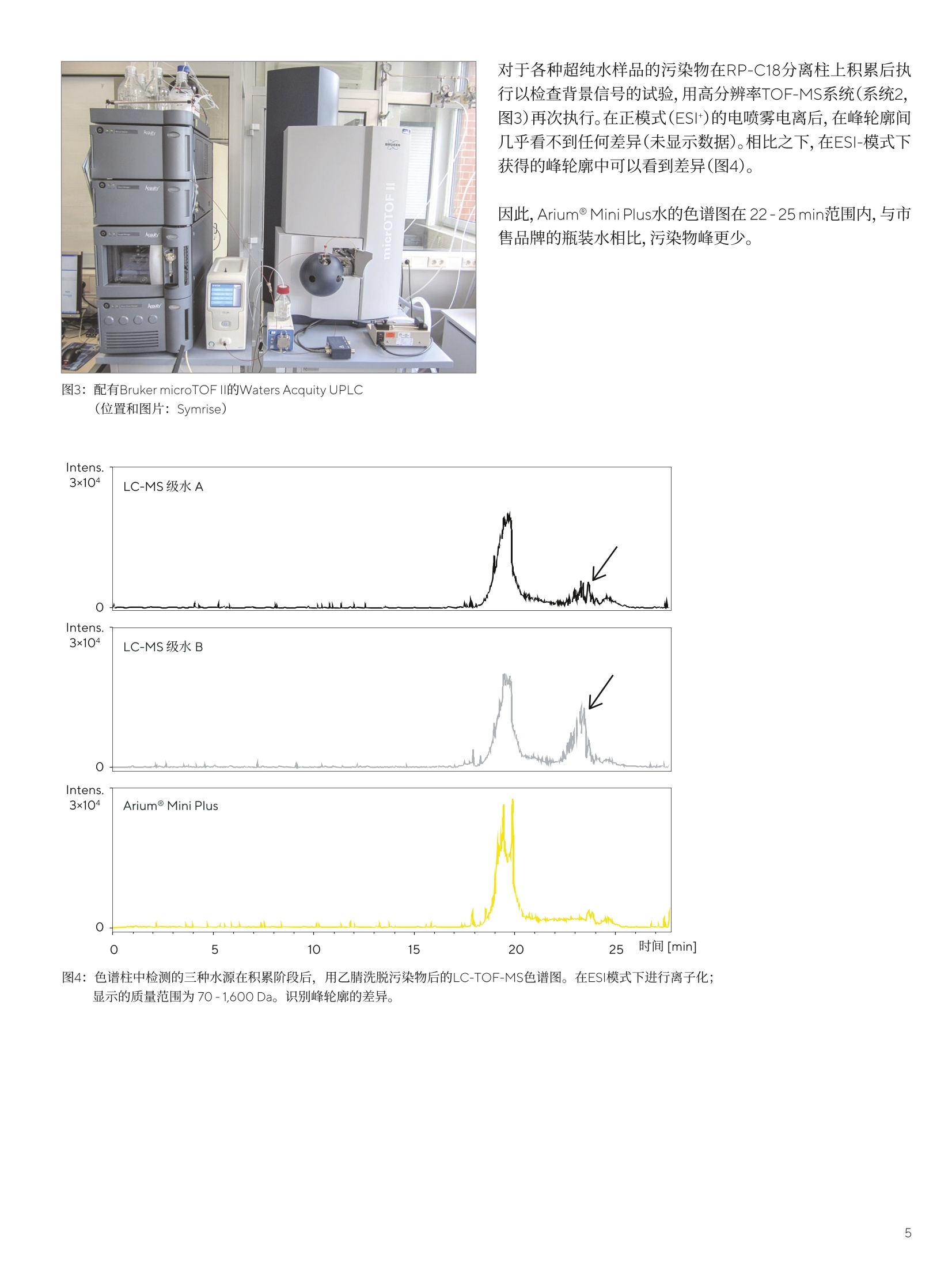
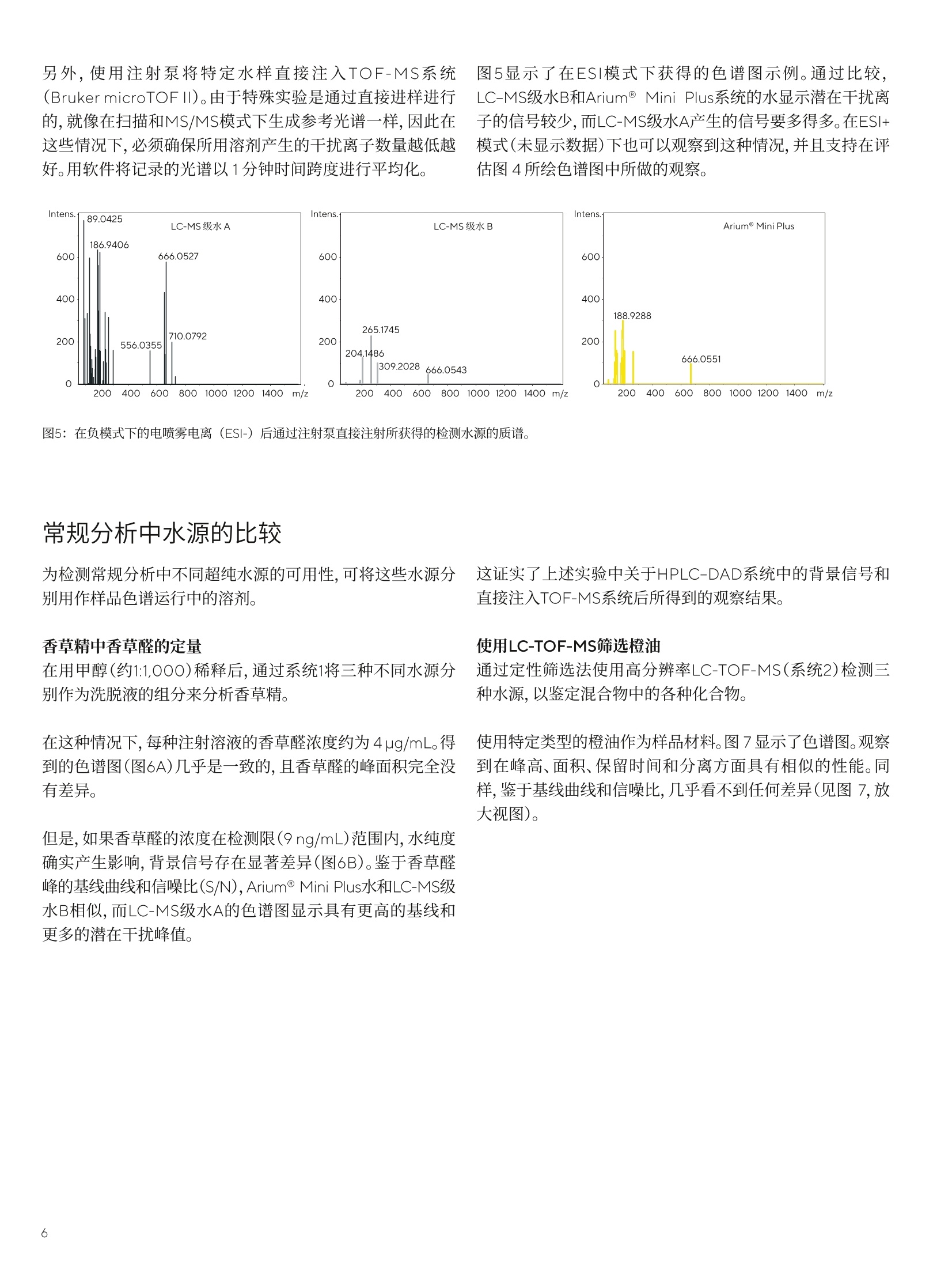
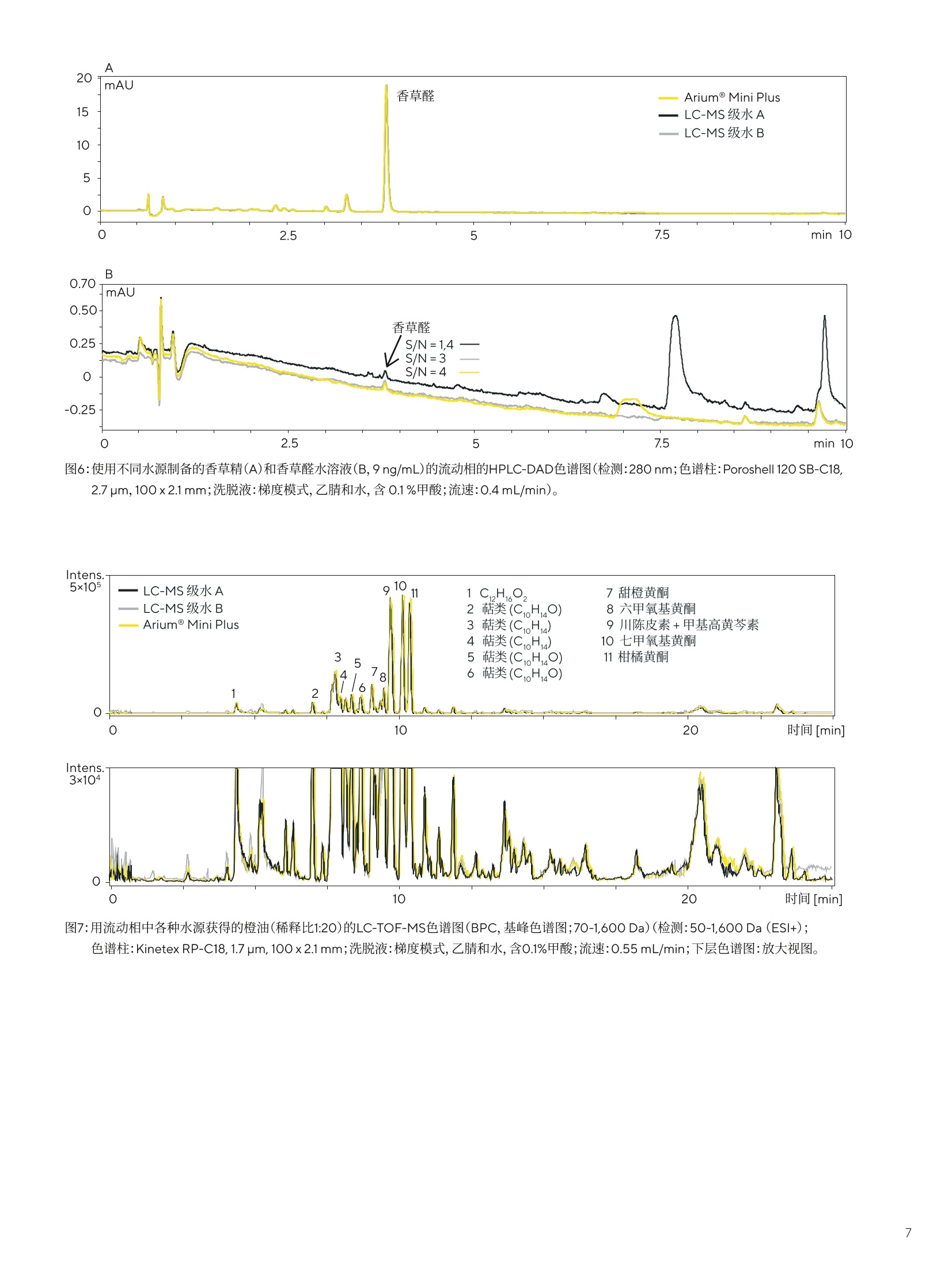
结果 讨论 应用说明 2020年11月12日 关键词或短语: Arium@ Mini Plus, 超纯水, HPLC-DAD,LC-TOF-MS,液相色谱法,香精香料工业 Arium用于痕量分析的超纯水 Rudiger Wittlake, Dr. Petra Slabizki, Hans-Thomas Herbst, Carsten Rottger, Dr. Elmar Herbig 1. Symrise AG, Holzminden, Germany 2.Sartorius Lab Instruments GmbH & Co.KG,Goettingen, Germany 摘要 在液相色谱的分析方法中,所用溶剂(特别是水)的纯度,对于无干扰和可重复的分析以及分析灵敏度,是一个决定性的因素,特别是在痕量分析的应用中。在一项研究中,采用不同来源的超纯水作为洗脱液,在多项高效液相色谱-二极管阵列检测器(HPLC-DAD)和质谱(MS)系统实验中进行比较。 在香精香料工业中,许多产品基于天然原料,例如香草豆、柑橘类水果、花朵和其它植物来源的材料。在此类原材料的来料质控检查、出厂产品的最终质控和新产品的研发过程中,会采用耦合各种检测器(例如,质谱仪、DAD或折射率(RI)检测器)的HPLC系统。 在研发和质控中都会使用到的的常规分析,例如使用HPLC-DAD在各种样品(例如,香草豆、香草提取物、香草糖、巧克力、饮料和调味剂)中进行香草醛定量。 除定量某些分析物以外,鉴定原始提取物和天然产品中部分未知物质的筛选方法也在研究中起着重大作用。此类方法中主要运用液相色谱(LC)系统,并与高分辨率飞行时间(TOF)-MS仪器结合使用。 避免高背景噪声 在液相色谱的分析方法中,所用溶剂(特别是水)的纯度,对于无干扰和可重复的分析以及分析灵敏度,是一个决定性的因素,特别是在痕量分析的应用中。洗脱液中的污染物会导致检测器发出相对高的基线噪声,从而使峰值的信噪比(S/N)较差。在DAD中,例如有机化合物类的污染物,会吸收UV/VIS范围内的光。在LC-MS应用中,应将离子(Nat、K*)浓度保持在尽可能低的水平,以防在电离过程中与分析物形成加合物。固定相富含的水污染物也可以用较高百分比的有机溶剂洗脱,并作为色谱图上潜在的共洗脱峰。 出于这些原因,可购买获得经过特殊处理和过滤纯化的不同等级(HPLC和LC-MS级)的超纯水。这些等级的水通常为1升或2.5升瓶装。另一种选择是采用经超纯水系统纯化的水,例如Arium@ Mini Plus超纯水系统(图1)。 采用此系统新鲜制备的超纯水所配置的HPLC-DAD和MS系统的洗脱液,在多个实验中将其与两种市售品牌的LC-MS级瓶装水进行比较。 针对该目的,每种特定水样在色谱系统中经过相对长的积累阶段,随后在两个不同检测器(DAD和TOF-MS)上进行梯度洗脱,检查色谱图中的背景信号(通常可作为基线检测)。另外,使用三种不同来源的超纯水作为流动相的一部分,进行代表性常规分析,例如用HPLC-DAD法进行的香草醛分析和用LC-MS法进行的天然产物筛选,并进行比较。 使用Arium@ Mini Plus制备的超纯水 生产超纯水时,可将Arium@ Mini Plus(图1)直接连接到自来水供水源上,然后经过两个阶段流程对自来水进行纯化。在第一阶段中,该紧凑型系统会生产纯水,即反渗透水(RO水),在第二阶段中生产超纯水。由于在RO纯化阶段流速较低,因此该阶段在流速方面有一定限制作用,于是采用Arium@水袋作为两个阶段之间的储水袋(参见图1的流路图)。 在Arium@ Mini Plus系统的第一阶段,隔膜泵使原水从系统入口流过预处理柱和RO模块。RO模块有两个出口,一个是渗透流,另一个是浓缩流。将浓缩流被连接到系统的出口,以排出从RO纯化流去除的水,即“浓水”。渗透流是纯化后的RO水(即纯水),将储存在水袋中,并在过程中进行电导率监测。 在第二个下游阶段,用另一个泵将纯水从水袋中输送至纯化柱,以便制备超纯水。在此阶段,使用可选的紫外灯(分别在波长为185 nm和254nm时具有氧化作用)并通过填充活性炭和离子交换树脂的纯化柱,将纯水转化为超纯水。在纯化期间,第二个电导率仪持续监测超纯水的水质,以保持0.055uS/cm的电导率(对应18.2MQxcm的电阻率),补偿至25℃。 然后,在最终的纯化步骤中,使用终端除菌过滤器分配超纯水。该过程如图1的示意图所示。 图1: Arium@ Mini Plus超纯水系统和流程图。为提高该图的清晰度,省略了阀门和流程控制器。 (照片和图表由赛多利斯提供) 除了Arium@ Mini Plus系统新鲜制备的超纯水以外,实验中所用的水源还包括两种经过认证的可用于LC-MS应用的市售纯水(LC-MSA级和B级水)。为了检查HPLC-DAD和LC-MS色谱图中的背景信号,将不同水源分别在标准流速且不添加改性剂(如甲酸或缓冲液)的条件下通过RP-C18柱,HPLC-DAD法采用时长40分钟,LC-MS法采用时长16分钟,从而对各种水源中存在的污染物进行浓缩(积累阶段)。 然后,通过100%水至100%乙腈来梯度洗脱潜在的污染物。在每次运行结束时,用相应水源对色谱柱进行再生。在两种不同的系统上执行这一步骤:HPLC-DAD(系统1,由位于德国瓦尔德布龙的Agilent供应)和LC-TOF-MS(系统2,由位于德国卡尔斯鲁厄的Waters, Eschborn and Bruker供应)。表1中列有设备参数。 表1:用于分析不同水源中污染物的系统1和2的设备参数 系统1 系统2 设备 分离柱 Agilent 1290 with DAD Waters Acquity UPLC, Bruker microTOFII Grom Sapphire C18, Kinetex RP-C18, 150×2.1 mm, 5 um 100×2.1 mm, 1.7 um (analytical+HPLC, 德国海伦贝格) (Phenomenex, 德国阿沙芬堡市) 流动相 A:水B:乙青 梯度 0 min. 100%A| 0%B 0 min. 100%A| 0%B 40 min. 100%A1 0%B 16 min. 100%A1 0%B 50 min. 0%A100%B 19 min. 5%A| 95%B 60 min. 0%A|100% B 23 min. 0%A|100%B 70 min. 100%A| 0%B 26 min. 100%A| 0%B 30 min. 100%A| 0%B 温度 40°C 50°C 流速 1mL/min. 0.55 mL/min. 检测 200nm 50-1,600 Da (ESI-and ESI+) 系统1用于常规分析,例如,香草醛定量分析;而系统2主要用于筛选化合物,例如天然产物中的化合物。在这两种应用中均使用不同水源进行测试。 UV和MS检测的背景信号 图2所示为在HPLC-DAD系统(系统1)上进行试运行获得的色谱图。在上图(图2A)中,叠加三个超纯水样品的色谱图,并标出梯度曲线。在色谱图上,两种市售的瓶装水和用Arium@Mini Plus系统新鲜制备的超纯水均呈现出积累在分离柱上的相似污染物。 约45分钟后,观察到宽峰,使用Arium@Mini Plus水显示出显著更高的积累峰面积,峰面积的不对称性表明几种污染物发生了重叠。在灰色部分(45-53min;查看图2B中的放大视图)中,峰轮廓略有不同。 在此处, Arium@ Mini Plus水和水B的轮廓相似,而在水A中,检测到了在其它色谱图中无法观察到的污染物。该积累实验得出可重复的结果(n=5)。 图2:(A)色谱柱中检测的三种水源在40分钟的积累阶段后,用乙腈洗脱污染物的 HPLC-DAD色谱图(检测:200nm)。(B)A中阴影部分的放大视图;识别箭头所标记的峰轮廓的差异。 对于各种超纯水样品的污染物在RP-C18分离柱上积累后执行以检查背景信号的试验,用高分辨率TOF-MS系统(系统2,图3)再次执行。在正模式(ESI*)的电喷雾电离后,在峰轮廓间几乎看不到任何差异(未显示数据)。相比之下,在ESI-模式下获得的峰轮廓中可以看到差异(图4)。 因此, Arium@ Mini Plus水的色谱图在 22-25min范围内,与市售品牌的瓶装水相比,污染物峰更少。 图3:配有Bruker microTOFII的Waters Acquity UPLC (位置和图片: Symrise) 图4:色谱柱中检测的三种水源在积累阶段后,用乙腈洗脱污染物后的LC-TOF-MS色谱图。在ESI模式下进行离子化;显示的质量范围为 70-1,600 Da。 识别峰轮廓的差异。 另外,使用注射泵将特定水样直接注入TOF-MS系统(Bruker microTOFII)。由于特殊实验是通过直接进样进行的,就像在扫描和MS/MS模式下生成参考光谱一样,因此在这些情况下,必须确保所用溶剂产生的干扰离子数量越低越好。用软件将记录的光谱以1分钟时间跨度进行平均化。 图5显示了在ESI模式下获得的色谱图示例。通过比较,LC-MS级水B和Arium Mini Plus系统的水显示潜在干扰离子的信号较少,而LC-MS级水A产生的信号要多得多。在ESI+模式(未显示数据)下也可以观察到这种情况,并且支持在评估图4所绘色谱图中所做的观察。 图5:在负模式下的电喷雾电离(ESI-)后通过注射泵直接注射所获得的检测水源的质谱。 为检测常规分析中不同超纯水源的可用性,可将这些水源分别用作样品色谱运行中的溶剂。 香草精中香草醛的定量 在用甲醇(约1:1,000)稀释后,通过系统1将三种不同水源分别作为洗脱液的组分来分析香草精。 在这种情况下,每种注射溶液的香草醛浓度约为 4pg/mL。得到的色谱图(图6A)几乎是一致的,且香草醛的峰面积完全没有差异。 但是,如果香草醛的浓度在检测限(9ng/mL)范围内,水纯度确实产生影响,背景信号存在显著差异(图6B)。鉴于香草醛峰的基线曲线和信噪比(S/N),Arium@ Mini Plus水和LC-MS级水B相似,而LC-MS级水A的色谱图显示具有更高的基线和更多的潜在干扰峰值。 这证实了上述实验中关于HPLC-DAD系统中的背景信号和直接注入TOF-MS系统后所得到的观察结果。 使用LC-TOF-MS筛选橙油 通过定性筛选法使用高分辨率LC-TOF-MS(系统2)检测三种水源,以鉴定混合物中的各种化合物。 使用特定类型的橙油作为样品材料。图7显示了色谱图。观察到在峰高、面积、保留时间和分离方面具有相似的性能。同样,鉴于基线曲线和信噪比,几乎看不到任何差异(见图7,放大视图)。 图6:使用不同水源制备的香草精(A)和香草醛水溶液(B,9ng/mL)的流动相的HPLC-DAD色谱图(检测:280 nm;色谱柱:Poroshell120 SB-C18,2.7 um, 100x2.1mm;洗脱液:度度模式,乙腈和水,含0.1%甲酸;流速:0.4 mL/min)。 图7:用流动相中各种水源获得的橙油(稀释比1:20)的LC-TOF-MS色谱图(BPC,基峰色谱图;70-1,600 Da)(检测:50-1,600 Da(ESI+); 色谱柱: Kinetex RP-C18, 1.7 um, 100x2.1mm;洗脱液:梯度模式,乙腈和水,含0.1%甲酸;流速:0.55 mL/min;下层色谱图:放大视图。 根据所开展的实验,可以看出Arium@ Mini Plus超纯水非常适合色谱法和质谱(MS)的应用。鉴于UV和MS检测中潜在的共洗脱峰和背景信号,发现Arium@Mini Plus水与售售瓶装超纯水的检测质量等级相当。 背景信号主要取决于色谱分析中所用溶剂的纯度,必须保持尽可能低,这是因为该信号对于分析方法的灵敏度和可靠的定量来说非常重要。除了LC-MS级水B外,具有较高信噪比的Arium@ Mini Plus水在需要高灵敏度的痕量分析中表现尤为出色,如HPLC-DAD色谱图中获得的香草醛峰示例所示。 与市售瓶装超纯水不同的是,超纯水系统能够新鲜纯化所需数量的水,具有明显的优势。从经济角度看,这一功能是购买瓶装超纯水的良好替代方案。新鲜纯化还可防止水长时间存放在打开的瓶子中,因为存储在打开瓶子中的水会因吸收实验室空气(1,2)和溶解空气中的二氧化碳或其它污染物而受到污染。可通过TOC(总有机碳)的增加水平来检测水中的有机污染物。在高TOC水平下,痕量组分的定性和定量可能受到影响[1],例如,基线偏移[1,2]或出现假峰[3]。 此外,如果瓶装水存放较长时间,例如Na离子会从玻璃瓶溶出,进而导致LC-MS系统的电离过程中形成更多的加合物。因此,用于评估(通常为[M+H]*或[M-H]-)离子的离子产率较低,会对方法的灵敏度产生负面影响[4]. 在不同色谱技术(另见4和5)中,用Arium@Pro系统制备的新鲜超纯水具有高适应性,并且在多样化的应用中,这些技术的使用日益增加,对促进实验室超纯水系统的接受度和普遍度大为有益。 在这里,作者对来自Sartorius Lab Instruments GmbH undCo. KG的Carsten Daume提供的实际帮助,以及来自Phenome-nex的Dirk Hansen博士审阅手稿和围绕该主题的建设性讨论而提供的指导表示感谢。 ( 参考文献 ) ( 1.S . Mabic , C . Regnault and J. Krol,"The MissunderstoodLaboratory Solvent: Reagent Water for HPLC", LCGCEurope, 18 (7), 410-414,2005. ) ( 2. M . Tarun a nd S. Mabic, "A practical guide to the effects ofwater purity on HPLC, LC-MS and related techniques,"2011, Millipore Corporation. ) ( 3.W.Gottwald,"RP-HPLC furAnwender,"publisher Gruber, U. and Klein, W. VHC Weinheim,1993. ) ( 4.T. Iven, K. FeuBner, C. Herrfurth and E. Herbig,“ S ignalst-offe der pflanzlichen Abwehr-HPLC-MS/ MS-Analyse von Jasmonaten",LABO, 2014,12,44-47. ) ( 5.K. Toppner, D. Hansen, and E . Herbig, " Reinstwasser fur die HPLC", LABO,2013, 6,22-27. ) ( Rudiger Wittlake、 Petra Slabizki 博 士、Hans- T homas Herbst和Carsten Rottger隶属于位于德国霍尔茨明登县的SymriseAG. Elmar Herbig博士隶属于德国哥廷根的Sartorius Lab Instruments GmbH und Co.KG. ) 销售与服务联系方式 更多联系信息,请访问 www.sartorius.com.cn 赛多利斯(上海)贸易有限公司 邮箱lab.cn@sartorius.com 服务热线 400 920 9889|800 820 9889 上海北京上海市浦东新区盛荣路 388北京市顺义区空港工业区 B弄百佳通产业园3号楼区裕安路 33号, 1013007-11层,200120电话+86 10 8042 6300 电话+86 21 6066 6100苏州广州 苏州市虎丘区科技城锦峰路广州市越秀区水荫路 117 号 158 号 101park-28 幢201,1105单元, 510075 215163电话+8620 3761 7284 电话+86512 6616 0490 成都西安成都市上东大街 246号新良西安市和平路 118 号和平银大厦2406室, 610012座1107室, 710001电话+86 28 8666 6877电话 +86 29 87512305 ( 技木规格如有变更,恕不另行通知。 ) ( 赛多利斯保留最终解释权和修改权。 ) ( 版本03|2022 ) 了解更多信息::www.sartorius.com Abstract在液相色谱的分析方法中,所用溶剂(特别是水)的纯度,对于无干扰和可重复的分析以及分析灵敏度,是一个决定性的因素,特别是在痕量分析的应用中。Download《Arium® 用于痕量分析的超纯水》应用说明研究了采用不同来源的超纯水作为洗脱液,进行多项高效液相色谱-二极管阵列检测器(HPLC-DAD)和质谱(MS)系统的实验,从而证实了Arium® Mini Plus超纯水非常适合色谱法和质谱(MS)的应用。下载全文Arium® Mini Plus 简介 在香精香料工业中,许多产品基于天然原料,在此类原材料的研发和质控中都会使用到常规分析,例如使用HPLC-DAD在各种样品中进行香草醛定量,运用液相色谱(LC)系统并与高分辨率飞行时间(TOF)-MS仪器结合鉴定原始提取物和天然产品中部分未知物质的筛选方法。为了避免高背景噪声,可购买获得经过特殊处理和过滤纯化的不同等级(HPLC和LC–MS级)的超纯水或者采用经超纯水系统纯化的水,例如Arium® Mini Plus超纯水系统(图1),来配置HPLC-DAD和MS系统的洗脱液。 使用Arium® Mini Plus 制备的超纯水 图1生产超纯水时,可将Arium® Mini Plus(图1)直接连接到自来水供水源上,然后经过两个阶段流程对自来水进行纯化。在第一阶段中,该系统的隔膜泵使原水从系统入口流过预处理柱和RO模块从而生产纯水,即反渗透水(RO水)并储存在水袋中。在第二阶段中用另一个泵将纯水从水袋中输送至纯化柱,以便制备超纯水。在纯化期间,电导率仪持续监测超纯水的水质,以保持0.055μS/cm的电导率(对应 18.2 MΩ x cm的电阻率),最终使用终端除菌过滤器分配超纯水。该过程如图 1 的示意图所示。 材料和方法 水源:- Arium® Mini Plus系统新鲜制备的超纯水- 两种经过认证的可用于LC–MS应用的市售纯水(LC–MS A级和B级水)方法:- 将不同水源分别在标准流速且不添加改性剂( 如甲酸或缓冲液)的条件下通过RP-C18柱,HPLC–DAD法采用时长 40 分钟,LC–MS法采用时长 16 分钟。- 通过 100 %水至 100 %乙腈来梯度洗脱潜在的污染物。在每次运行结束时,用相应水源对色谱柱进行再生。- 在两种不同的系统上执行这一步骤:HPLC-DAD和LC-TOF-MS,设备参数见表1。表1 结果 UV和MS检测的背景信号图 2 所示为在HPLC–DAD系统(系统1)上进行试运行获得的色谱图。在上图(图2A)中,叠加三个超纯水样品的色谱图,并标出梯度曲线。在色谱图上,三种水源均呈现出积累在分离柱上的相似污染物。在灰色部分(45 - 53 min;查看图 2B 中的放大视图)中,峰轮廓略有不同。在此处,Arium® Mini Plus水和水B的轮廓相似,而在水A中,检测到了在其它色谱图中无法观察到的污染物。该积累实验得出可重复的结果(n = 5)。图2图4所示为用高分辨率TOF-MS系统执行各种超纯水样品的污染物在RP-C18分离柱上的积累,在正模式(ESI+)的电喷雾电离后,在峰轮廓间几乎看不到任何差异(未显示数据)。相比之下,在ESI-模式下获得的峰轮廓中可以看到差异。因此,Arium® Mini Plus水的色谱图在 22 - 25 min范围内,与市售品牌的瓶装水相比,污染物峰更少。图4图5所示为使用注射泵将特定水样直接注入TOF-MS系统后在ESI模式下获得的色谱图示例。通过比较,LC–MS级水B和Arium® Mini Plus系统的水显示潜在干扰离子的信号较少,而LC-MS级水A产生的信号要多得多。在ESI+模式(未显示数据)下也可以观察到这种情况,并且支持在评估图 4 所绘色谱图中所做的观察。图5 常规分析中水源的比较 为检测常规分析中不同超纯水源的可用性,可将这些水源分别用作样品色谱运行中的溶剂。香草精中香草醛的定量在用甲醇(约1:1,000)稀释后,通过系统1将三种不同水源分别作为洗脱液的组分来分析香草精。当注射溶液的香草醛浓度约为 4 μg/mL时,得到的色谱图(图6A)几乎是一致的,且香草醛的峰面积完全没有差异。但是,如果香草醛的浓度在检测限(9 ng/mL)范围内,水纯度确实起产生影响,背景信号存在显著差异(图6B)。鉴于香草醛峰的基线曲线和信噪比(S/N),Arium® Mini Plus水和LC-MS级水B相似,而LC-MS级水A的色谱图显示具有更高的基线和更多的潜在干扰峰值。图6使用LC-TOF-MS筛选橙油通过定性筛选法使用高分辨率LC-TOF-MS(系统2)检测三种水源,以鉴定混合物中的各种化合物。使用特定类型的橙油作为样品材料。图 7 显示了色谱图。观察到在峰高、面积、保留时间和分离方面具有相似的性能。同样,鉴于基线曲线和信噪比,几乎看不到任何差异(见图 7,放大视图)。图7 讨论 根据所开展的实验,可以看出Arium® Mini Plus超纯水非常适合色谱法和质谱(MS)的应用。与市售瓶装超纯水不同的是,超纯水系统能够新鲜纯化所需数量的水,具有明显的优势。从经济角度看,这一功能是购买瓶装超纯水的良好替代方案。新鲜纯化还可防止水长时间存放在打开的瓶子中,因为存储在打开瓶子中的水会因吸收实验室空气和溶解空气中的二氧化碳或其它污染物而受到污染。此外,如果瓶装水存放较长时间,例如,Na离子会从玻璃瓶溶出,进而导致LC-MS系统的电离过程中形成更多的加合物。因此,用于评估(通常为[M+H]+或[M-H]-)离子的离子产率较低,会对方法的灵敏度产生负面影响。在不同色谱技术中,用Arium® Pro系统制备的新鲜超纯水具有高适应性,并且在多样化的应用中,这些技术的使用日益增加,对促进实验室超纯水系统的接受度和普遍度大为有益。更多详细解读 敬请下载全文
确定





还剩7页未读,是否继续阅读?
德国赛多利斯集团为您提供《超纯水中制备检测方案(超纯水器)》,该方案主要用于其他中其他检测,参考标准--,《超纯水中制备检测方案(超纯水器)》用到的仪器有赛多利斯 Arium Mini 实验室超纯水系统、赛多利斯超纯水系统 arium® pro
推荐专场
相关方案
更多
该厂商其他方案
更多















