
Incucyte®实时活细胞分析系统应用灵活,能够对不同培养方式获得的多种3D活细胞样本自动且连续地(数天、数周或数月)进行HD 相位和荧光图像的获取及分析。并且可以安装在标准化的组织培养箱内,确保细胞生长环境免受干扰。下面通过两个案例来看看Incucyte®的实力吧!
方案详情

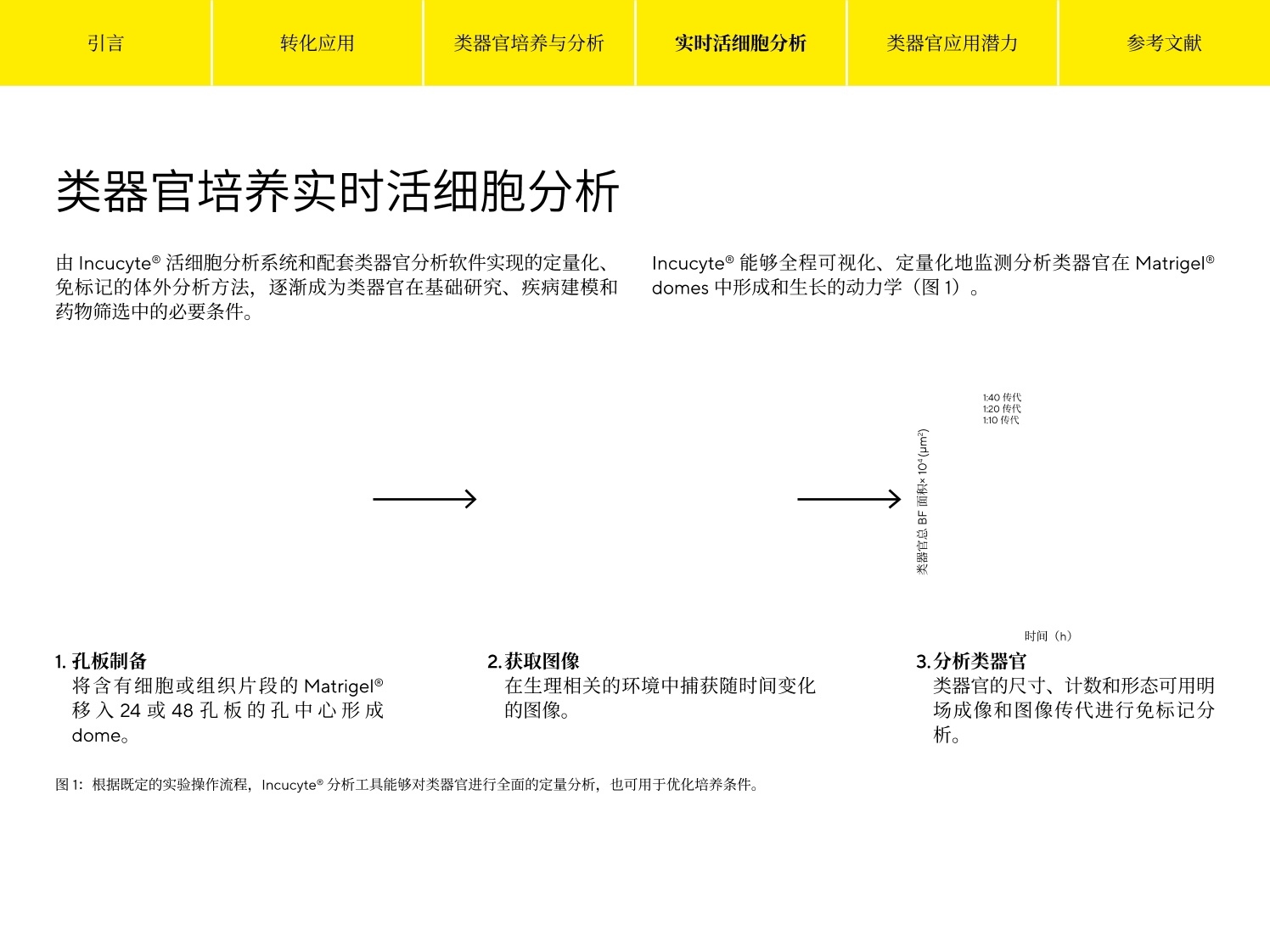
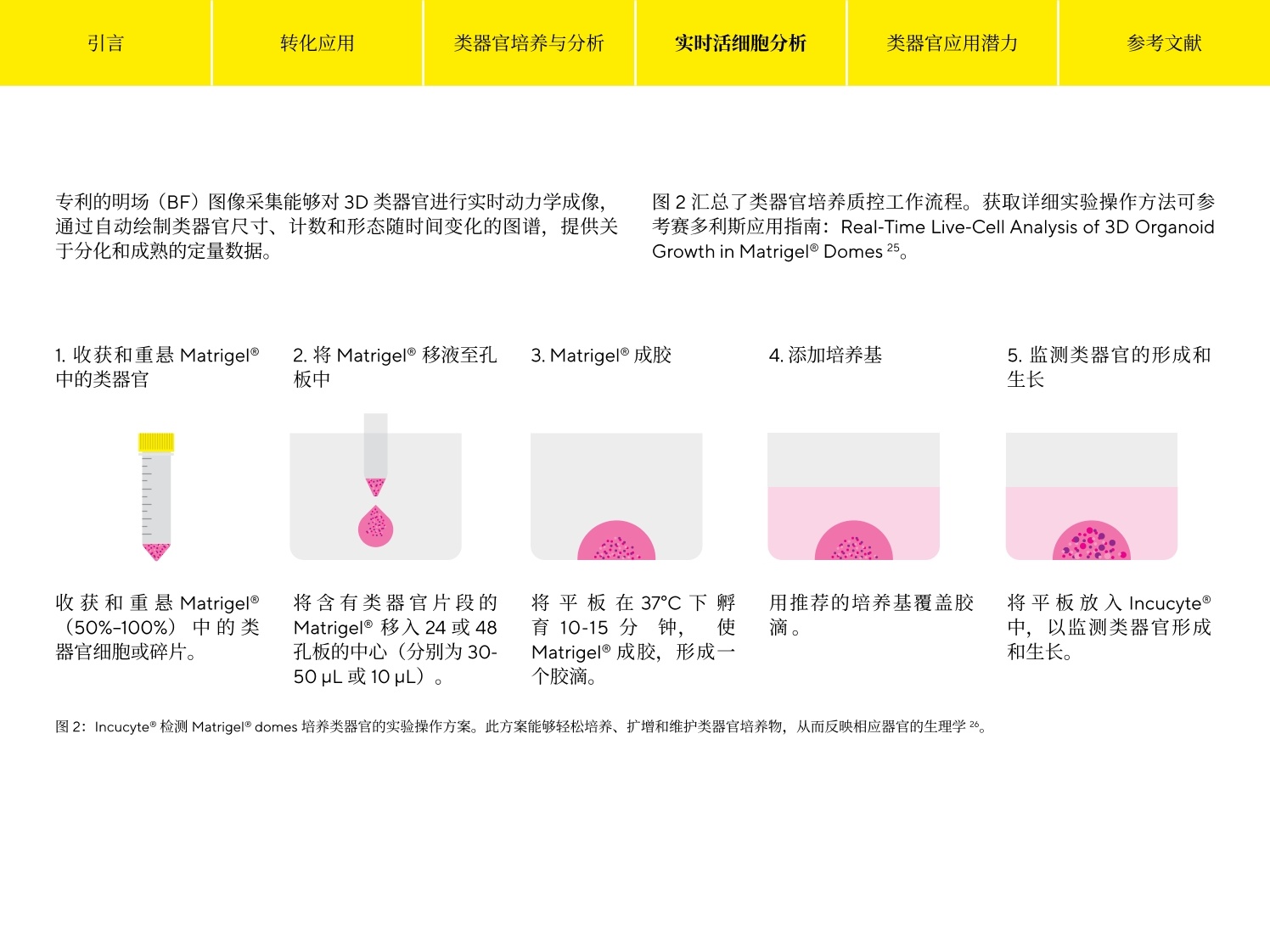
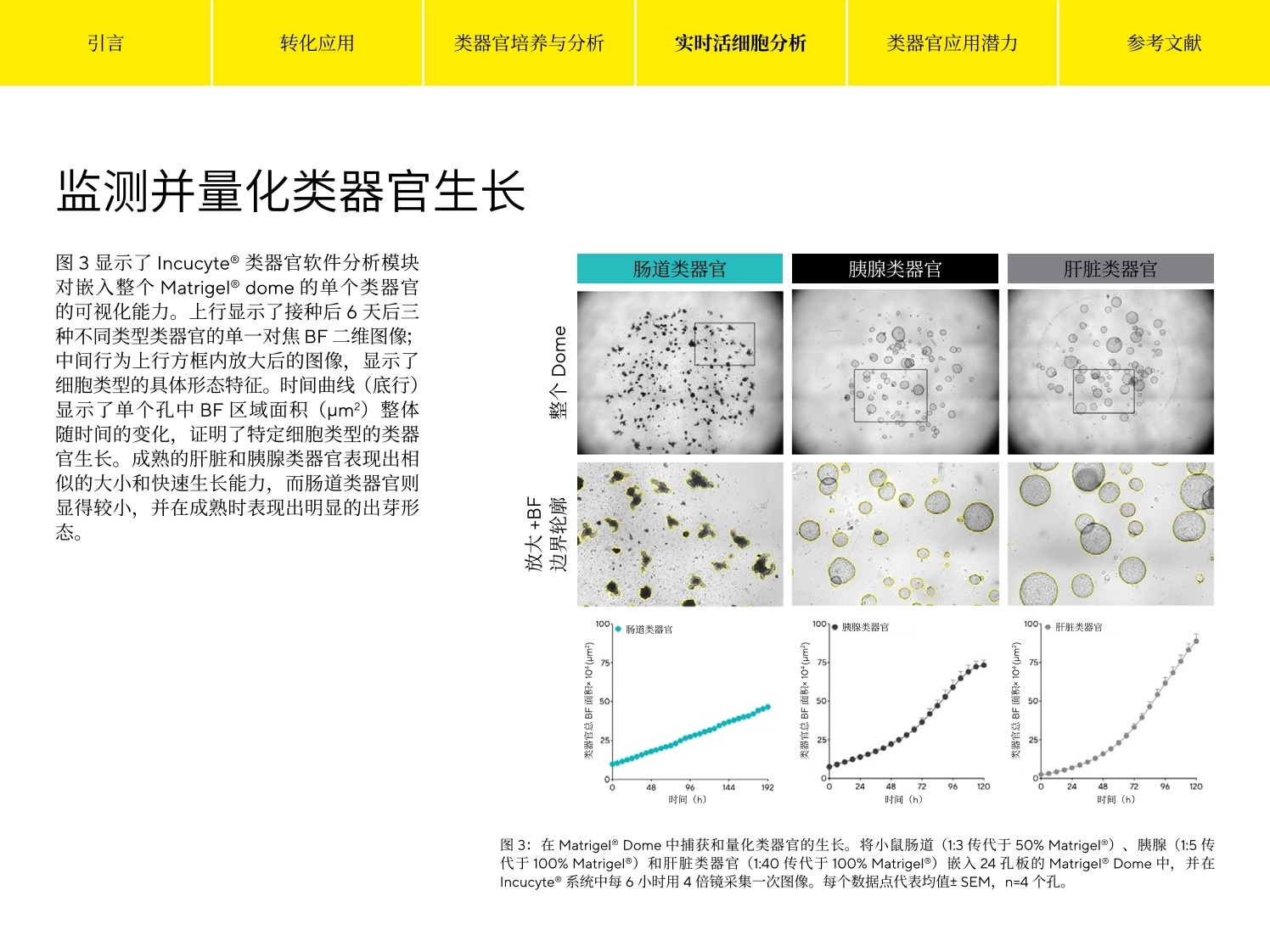
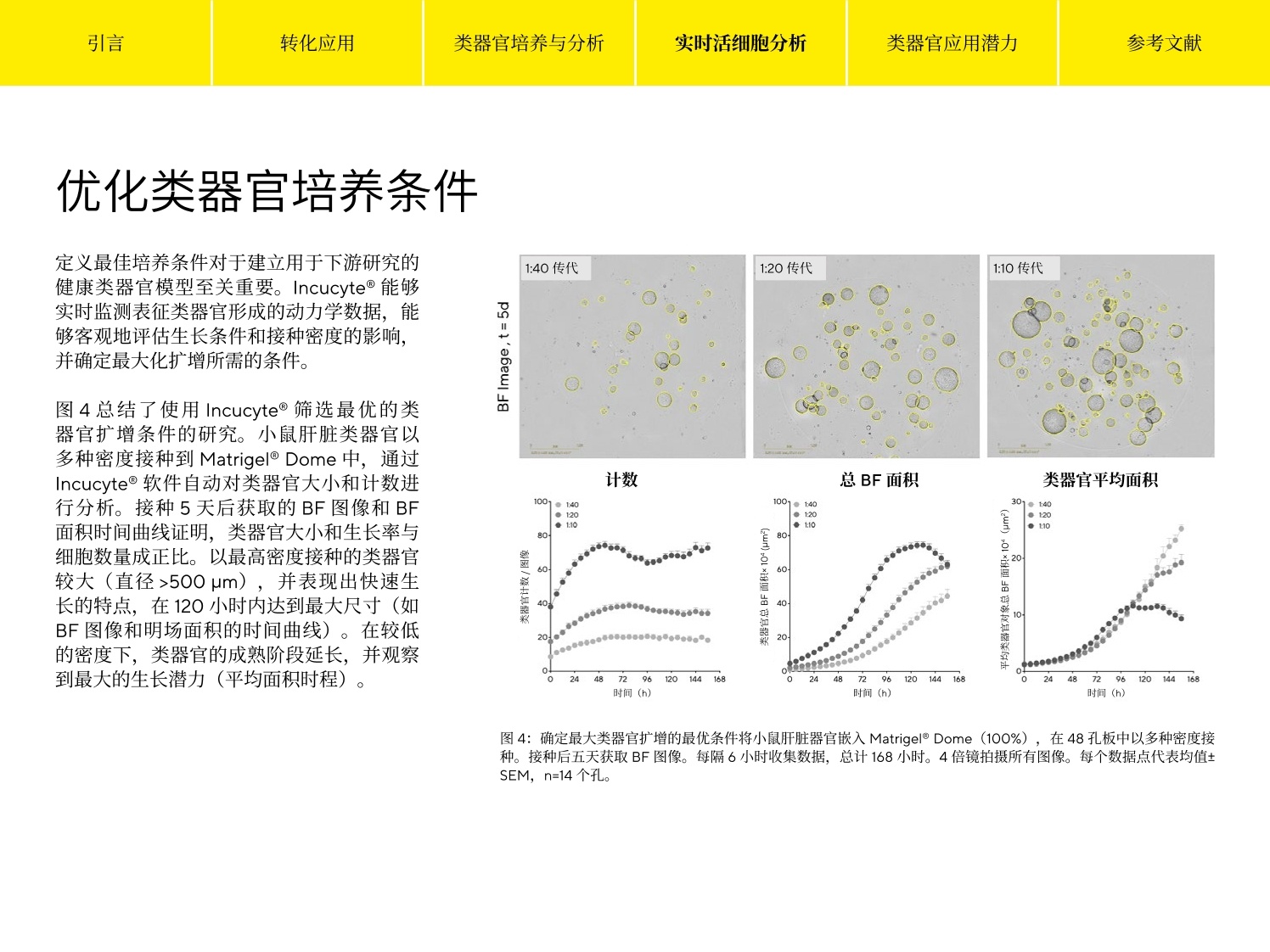
参考文献 引言 Simplifying Progress 类器官分析指南 引言 转化应用 类器官培养与分析 实时活细胞分析 类器官应用潜力 参考文献 引言 类器官正在迅速成为基础研究和药物发现的有力工具,涵盖广泛的生物医学应用,包括肿瘤学、再生医学、疾病建模及药物筛选等。这些与自身器官结构类似的三维(3D)组织可在体外生长,形成其原生器官的“微缩版本”。类器官培养的起始点可以是存在于组织中的特异性成人干细胞、从患者活检样本中提取的肿瘤干细胞、胚胎干细胞(ESCs)或多能干细胞(iPSCs)。在三维细胞外基质中进行培养,这些培养物能够高度保真地重现出已分化组织的体内架构、空间形态以及原始组织中细胞群的遗传多样性1。作为自我组织和自我更新的三维结构,类器官比传统的单层培养技术具有明显的优势,并提供了一个更符合生理学的环境,可更清晰地了解复杂的生物学。 在该电子书中,我们探讨了类器官热点应用,强调了3D 细胞培养和体外扩增的关键注意事项,并介绍了对这些复杂的自组织的细胞模型进行成像和分析的前沿技术。 引言 转化应用 类器官培养与分析 实时活细胞分析 类器官应用潜力 参考文献 转化应用 名称有什么意义? 类器官拥有从健康或病变的细胞和组织中自我培养的能力,并具有多功能性,被广泛应用于医学及药物研究中。尽管很多应用还处于早期开发阶段,但以更精确和详细的方式揭示疾病机制,并实现更加个性化的疾病治疗方法的可能性持续加速类器官技术的发展。毫无疑问,人类类器官将为疾病研究提供新的机会,并为现有的细胞系和动物模型提供重要补充。最近的几篇综述类文章对基于类器官的疾病模型系统的开发和应用进行了深入研究1,3,4,5,6。 类器官应满足多项标准2 是由能够建立或保留其原生组织特性的细胞群组成的三维结构。 ·如同器官本身,拥有多种细胞类型,能够呈现器官的某一个或某些特质 和功能 ·能够遵从在器官中一样的自组织规则呈现自组织现象 遗传性疾病建模 类器官保留了其原生组织的遗传特征,,非常适用于遗传性疾病的建模,如囊性纤维化(CF),是第一个使用类器官建模的人类疾病’。 CF 是由囊性纤维化跨膜传导调节器(CFTCR) 基因的突变引起的,该基因编码了与盐/水吸附和分泌调节相关的氯离子通道蛋白。这种突变影响包括肺部和肠道在内的各种器官的上皮细胞,导致粘液堆积和肺部感染以及慢性消化系统问题。源自 CF 患者的类器官不断发展,并用于预测药物对不同突变的有效性8,,以及监测患者血液中的药物水平,作为传统药代动力学测试的高效 无独有偶,类器官也作为其他遗传疾病的模型,包括α-1-抗胰蛋白酶缺乏症(A1AT) 10、原发性小头畸形"和影响视网膜并导致失明的莱伯氏先天性黑蒙1。这些示例表明类器官为新疗法的发现和开发提供了宝贵的贡献。 宿主-病原体相互作用 类器官也用于对影响人类的传染病建模。类器官用于探索宿主-病原体相互作用的主要优势是,它能够包含其原生的组织中存在的几乎所有细胞类型。因此,它能够非常接近地概括出病原体相互作用并造成损伤的体内环境。类器官已用于对胆囊中的沙门氏菌感染进行建模13,研究肠道中的霍乱毒素抑制剂14和胃中的幽门螺旋杆菌感染15 源自人 iPSC 的前脑特异性类器官已用于对妊娠期间由寨卡病毒感染引起的小头畸形进行建模。类器官概括了大脑皮层发育的关键特征,类器官的寨卡感染导致生长抑制和细胞凋亡增加,这意味着病毒在大脑发育过程中改变了神经发生,这是导致小脑畸形的原因1。 肿瘤学 肿瘤衍生的类器官为研究人员和药物开发人员提供了一个强大的新工具,以更好地了解这种疾病的复杂性并开发更有效的治疗方法。类器官可从肿瘤组织中有效生成,相对容易繁殖,并代表原发肿瘤的转录和突变情况。它还克服了癌细胞系面临的挑战,因为癌细胞系会随着时间的推移积累更多的突变,也同时解决了动物模型不能完全反映人类癌症的遗传特征的问题'。此外,肿瘤类器官也解决了来自患者的肿瘤异种移植(PDTX) 的关键缺陷。虽然 PDTX更“忠实”地概括了原发肿瘤,但这一过程是耗时耗力且成本很高的,不适合高通量筛选。 来自患者的肿瘤类器官涵盖多种应用18。来自不同癌症类型的类器官可用来创建一个生物库,与广泛的基因组测序、表达图谱、药物敏感性和患者临床数据相结合。获得这样一个前所未有的数据信息库并促进大规模的筛选工作,来加速发现和开发新的候选治疗方法。这些模型还可用于比较体外和体内药敏反应;因为类器官可以无限培养,体外给药方案可以多种多样,并且,结果与临床观察到的情况一致。 另外,这些信息可帮助确定类器官的标准护理治疗反应是否能够预测患者对治疗的反应。最后,来自患者的肿瘤类器官可用于选择特定治疗;随着越来越多的分子靶向药物的出现,这种能力将至关重要。 转化应用 类器官培养与分析 实时活细胞分析 类器官应用潜力 参考文献 再生医学 鉴于类器官能够分化出其所衍生器官中所有细胞类型的这种能力,它有潜力替代受损组织。目前已有对单个干细胞通过体外培养建立的小鼠结肠类器官,证明了该方法的可行性。将该类器官移植到结肠受损的小鼠体内时,功能受损或丧失的器官组织得到了恢复,上皮功能屏障也完全恢复19。 通过将类器官技术与基因疗法结合,也可能恢复受损器官的功能。利用基因编辑术修复了基因突变的类器官移植,有潜力用于治疗患有该疾病的患者。有一例对单基因遗传缺陷患者做基因纠正的案例为这一治疗疗念提供证据,研究人员使用CRISPR/Cas9纠正两例CF 患者小肠和直肠类器官中的 CFTR突变, 发现纠正后的等位基因 引言 转化应用 类器官培养与分析 实时活细胞分析 类器官应用潜力 参考文献 类器官培养与分析 作为自组织和自我更新的结构,类器官比传统的2D培养技术具有明显的优势,并在上述的许多应用中拥有不可比拟的潜力。传统的细胞培养技术与工艺可用于构建和扩增体外培养,并保持体内的类似特征、组织的特定功能和疾病状态的表型,使它们更适合作为基础科研和转化研究的工具。美国菌种保藏中心(又称美国模式菌种收集中心(ATCC)提供了一份关于常规类器官培养条件的信息指南,并介绍了关于构建、扩增和低温保存的指导21。在 STEMCELL公司的网站上也有一套完整的资源和方法22。此外,有几篇综述文章汇编了针对开发组织特定干细胞和患者肿瘤衍生的类器官的完整protocol 清单15,23。 虽然这些 protocol针对来自正常或者病变组织的多种类型的类器官,定义了其培养条件、接种密度、基质建议和其他关键参数,但对这些分化的微型组织进行定量分析一直是个挑战。目前,许多表征和优化类器官培养的方法无法客观地监测这些3D 结构的形成和随时间的增长。具体的缺点包括: ·孔与孔间类器官形成的重复性无法保证,缺少成熟的 protocol 检测和数据通量低 ·采集类器官图像的过程费时耗力 ▪需要借助第三方分析软件,且提供的分析结果信息不够全面 ·图像采集过程中的环境控制不到位,导致结果可信度不高 虽然可使用现有的细胞培养工具和技术建立类器官模型,但其复杂性促使人们需要精细且智能的定量分析方法。包括能够对类器官细胞间相互作用进行动态分析,从而提供准确、定量化的分析结果,这“对于充分理解这些系统的复杂性并建模至关重要”。24 Incucyte@能够全程可视化、定量化地监测分析类器官在Matrigel@domes 中形成和生长的动力学(图1)。 时间(h) 1.孔板制备 2.获取图像 3.分析类器官 将含有细胞或组织片段的Matrigel移入24或48孔板的孔中心形成dome. 在生理相关的环境中捕获随时间变化的图像。 类器官的尺寸、计数和形态可用明场成像和图像传代进行免标记分析. ( 图1:根据既定的实验操作流程, I ncucyte@分析工具能够对类器官进行全面的定量分析,也可用于优化培养条件。 ) 引言 转化应用 类器官培养与分析 实时活细胞分析 类器官应用潜力 参考文献 专利的明场(BF)图像采集能够对 3D 类器官进行实时动力学成像,通过自动绘制类器官尺寸、计数和形态随时间变化的图谱,提供关于分化和成熟的定量数据。 图2汇总了类器官培养质控工作流程。获取详细实验操作方法可参考赛多利斯应用指南: Real-Time Live-Cell Analysis of 3D OrganoidGrowth in Matrigel Domes 25。 1.收获和重悬 Matrigel@中的类器官 2.将Matrigel@移液至孔 3.Matrigel@成胶 4.添加培养基 板中 5.监测类器官的形成和生长 收获和重悬Matrigel@(50%-100%)中的类器官细胞或碎片。 将含有类器官片段的Matrigel@移入24或48孔板的中心(分别为30-50pL或10pL)。 将平板在37℃下孵育10-15分钟,使Matrigel@成胶,形成-个胶滴。 用推荐的培养基覆盖胶将平板放入 Incucyte@ 滴。 中,以监测类器官形成 和生长。 ( 图2: Incucyte@检测 Matrigel domes 培养类器官的实验操作方案。此方案能够轻松培养、扩增和维护类器官培养物,从而反映相应器官的生理学2。 ) 图3显示了 Incucyte@类器官软件分析模块对嵌入整个Matrigel dome 的单个类器官的可视化能力。上行显示了接种后6天后三种不同类型类器官的单一对焦BF二维图像;中间行为上行方框内放大后的图像,显示了细胞类型的具体形态特征。时间曲线(底行)显示了单个孔中BF区域面面(um²)整体随时间的变化,证明了特定细胞类型的类器官生长。成熟的肝脏和胰腺类器官表现出相似的大小和快速生长能力,而肠道类器官则显得较小,并在成熟时表现出明显的出芽形态。 图3:在 Matrigel Dome 中捕获和量化类器官的生长。将小鼠肠道(1:3传代于50% Matrigel@)、胰腺(1:5传代于 100% Matrigel@)和肝脏类器官(1:40 传代于100% Matrigel@) 嵌入24孔板的 Matrigel Dome 中,并在Incucyte@系统中每6小时用4倍镜采集一次图像。每个数据点代表均值±SEM, n=4个孔。 定义最佳培养条件对于建立用于下游研究的健康类器官模型至关重要。Incucyte@能够实时监测表征类器官形成的动力学数据,能够客观地评估生长条件和接种密度的影响,并确定最大化扩增所需的条件。 图4总结了使用 Incucyte@筛选最优的类器官扩增条件的研究。小鼠肝脏类器官以多种密度接种到 Matrigel Dome中,通过Incucyte@软件自动对类器官大小和计数进行分析。接种5天后获取的 BF图像和 BF面积时间曲线证明,类器官大小和生长率与细胞数量成正比。以最高密度接种的类器官较大(直径>500um),并表现出快速生长的特点,在120小时内达到最大尺寸(如BF图像和明场面积的时间曲线)。在较低的密度下,类器官的成熟阶段延长,并观察到最大的生长潜力(平均面积时程)。 引言 转化应用 类器官培养与分析 实时活细胞分析 类器官应用潜力 参考文献 图4:确定最大类器官扩增的最优条件将小鼠肝脏器官嵌入 Matrigel Dome (100%),在48孔板中以多种密度接种。接种后五天获取BF图像。每隔6小时收集数据,总计168小时。4倍镜拍摄所有图像。每个数据点代表均值+SEM, n=14个孔。 鉴定类器官最佳成熟阶段 细胞形态用于确定类器官培养物的适当传代频率。这些指标与特定细胞类型相关,而且包括出芽、类器官腔内碎片积累等细胞成熟的标志。通过Incucyte@平台实时追踪类器官偏心率(圆度)和暗度(亮度)的变化,可以快速、精确地评估最佳培养传代周期。 为了确定嵌入 Matrigel@ Dome 中的小鼠肝脏类器官的最佳传代频率,使用 Incucyte@对培养物进行了8天的图像采集(图5)。通常情况下,肝脏类器官在达到最大生长限并且没有萎陷时就可以进行传代27。 BF图像显示,接种两天后,培养物还没有准备好进行传代,因为大多数类器官的直径小于100 um,并且有清晰的腔隙。随后48小时内观察到偏心率的下降,类器官形成并更接近圆形(如最右侧偏心率时间曲线所示)。该培养物传代的最佳时期发生在第4天和第5天之间,此时 Dome 内的大多数类器官已达到最大尺寸,呈圆形且没有萎陷。第6天的图像和时程数据表明,达到最大尺寸的类器官已经萎陷且变暗。 第2天(接种后) 第4天(接种后) 第6天(接种后) 0.81 偏心率 ●暗度 75 0.7+ 70 0.61 65 0.5● 60 mm 1.50 mm 1.50 mm 1.50 +55 48 96 144 192 时间 (h) 在常规培养条件下,多个传代期间类器官的形态和生长能力应当是一致的。然而,采用人工质检方法监测关键参数来确定这一点往往费时费力,且会引入偏差。 相比而言, Incucyte@能够动态、客观地量化多个参数,以评估延长传代期时类器官的扩增和生长效率(图6)。当传代密度保持一致时,随着时间的推移,肠道类器官表现出重复性较高的计数、面积、偏心率和暗度值。此外,接种后第7天的BF图像证实了对特定出芽表型的维持状态。这些结果证明了 Incucyte@成像和分析能够对长时程类器官扩增提供可靠、可重复性评估。 图6:评估多次传代的类器官生长和分化效率。将肠道类器官嵌入50%的 MatrigelDome (1:3传代,24孔板),经过多次传代,确定其随着时间推移的生长和分化一致性。每隔6小时收集数据,总计192小时。4倍镜拍摄所有图像。每个数据点代表均值±SEM, n=6个孔。 从人类祖细胞建立类器官的能力为基础研究和转化研究开创了一个新纪元。作为能够自组织的组织,类器官可概括器官架构,为正常或疾病的生理过程提供一个更符合生理学特点的体外模型。虽然有详细的实验方法建立了几十种组织和癌症的类器官培养,但技术的进步对于实现快速、;、准确和客观的成像与分析至关重要。无论是定性评估还是用于2D单层细胞培养的技术,都无法自信地确定这些复杂的3D组织结构是否优质和健康——这可能影响下游试验的准确性和可重复性。 Incucyte@实时活细胞分析系统,结合Incucyte@类器官分析软件可实现对类器官形成和生长过程动态、定性、准确的评价。这一突破性的成像与分析技术对于类器官技术应用与发展具有重要的优势: ▪自动定位分析嵌入 Matrigel@ Dome 中的3D类器官 ▪使用集成、实时免标记的数据采集优化和定义培养条件和方案 ·根据综合的形态参数,,确定用于类器官培养物的传代或扩增的最佳期限 ·评估多次传代期间的培养质量 毫无疑问,人类类器官系统将继续改善,以更好地理解复杂的疾病机制。客观准确地定义诸如接种密度、传代频率和形态等参数,对于建立用于下游研究的健康培养物和释放类器官的全部潜力至关重要。 体外3D 培养的最终目标是能够对进行更多的细胞生理学相关的下游分析。通过全面的表征,科学家可对生物学有更深入的了解,确保干细胞在长期培养过程中得到更有力的维护,并在3D 类器官工作流程的每一步对细胞进行监测。控制不良变量的一个关键手段是标准化工作流程(包括类器官培养 QC和实验步骤)和指标,从而消除人的主观性解读。 1. Dutta, D.,Heo, l., and Clevers,H. (2017). Disease modeling instem cell-derived 3D organoid systems. Trends in MolecularMedicine. 23(5),393-410. 2. Sasai, Y. (2013). Cytosystems dynamics in self-organization oftissue architecture. Nature 493(7432), 318-326. 3. Fatehullah, A., Tan, S., and Barker, N. (2016).Organoids as an invitro model of human development and disease. Nat. Cell Biol.18(3),246-254. 4, Clevers, H. (2016). Modeling development and disease withorganoids. Cell. 165(7),1586-1597. 5. Lancaster, M.A., Huch, M. (2019). Disease modeling in humanorganoids. Disease Models and Mechanisms. 12(7),1-14. 6. Kim, J., Koo, B., Knoblich,J.A.(2020). Human organoids:model systems for human biology and medicine. NatureReviews Molecular Cell Biology. 21(10),571-584. /. Dekkers, J.F., Wiegerinck, C.L., de Jonge, H.R., Bronsveld, 1.,Janssens, H.M., de Winter-de Groot, K.M., Brandsma, A.M.,de Jong, N.W.M., Bijvelds, M.J.C., Scholte,B.J.,Nieuwenhuis,E.E.S., van den Brink, S., Clevers, H.,van der Ent, C.K.,Midden-dorp S., Beekman,J.M.(2013). A functional CFTR assay usingprimary cystic fibrosis intestinal organoids. Nat. Med.19(7),939-945.doi:10.1038/nm.3201 8. Dekkers, J.F., Berkers, G., Kruisselbrink,E., Vonk, A., de Jonge,H.R.,Janssens, H.M., Bronsveld, l., van de Graaf, E.A., Vleggaar,F.P.,Escher, J.C., de Rijke, J.B.,Majoor, C.J., Heijerman,H.G.M.,de Winter-de Groot, K.M., Clevers, H., van der Ent, C.K., Beek-man, J.M.(2016). Characterizing responses to CFTR-modu-lating drugs using rectal organoids derived from subjects withcystic fibrosis. Sci. Transl.Med. 8(344), 344ra384. 9. Vijftigschild,L.A.W., Berkers, G., Dekkers,J.F., Zomer-van Om-men, D.D., Matthes, E., Kruisselbrink, E.,Vonk, A., Hensen, C.E.,Heida-Michel,S., Geerdink,M.,Janssens, H.M., van de Graaf,E.A., Bronsveld, l., de Winter-de Groot, K.M., Majoor, C.J.,Heijerman, H.G.M., de Jonge, H.R., Hanrahan,J.W., van der Ent,C.K., Beekman,J.M.(2016).B2-Adrenergic receptoragonistsactivate CFTR in intestinal organoids and subjects with cysticfibrosis. Eur. Respir.J. 48(3),768-779. 10..FHuch, M., Gehart, H., van Boxtel, R., Hamer, K., Blokzijl, F.,Verstegen, M.M., Ellis, E., van Wenum, M., Fuchs, S.A., de Ligt,J., van de Wetering, M., Sasaki, N., Boers, S.J., Kemperman, H.,de Jonge,J., ljzermans,J.N.M., Nieuwenhuis, E.E.S., Hoekstra,R., Strom, S., Vries,R.R.G., et al.(2015).Long-term culture ofgenome-stable bipotent stem cells from adult human liver.Cell.160(1-2), 299-312. 11. Lancaster, M.A., Renner, M., Martin,C.A., Wenzel,D., Bicknell,L.S., Hurles, M.E., Homfray,T., Penninger,J.M.,Jackson,A.P.,and Knoblich,J.A.(2013).Cerebral organoids model humanbrain development and microcephaly. Nature 501(7467),373-379.doi:10.1038/nature12517 12. Parfitt, D.A., Lane, A., Ramsden, C.M., Carr ,A-J.F., Munro,P.M., Jovanovic, K., Schwarz, N.,Kanuga,N., Muthiah, M.N.,Hull, S., Gallo,J-M, da Cruz, L.,Moore, A.T.,Hardcastle,A.J.,Coffey, P.J., and Cheetham, M.E. (2016).Identification andcorrection of mechanisms underlying inherited blindness inhuman IPSC-derived optic cups. Cell Stem Cell 18(6), 769-781.doi:10.1016/j.stem.2016.03.021 13. Wilson, S.S., Tocchi, A., Holly, M.K., Parks, W.C., and Smith,J.G.(2015). A small intestinal organoid model of non-invasiveenteric pathogen-epithelial cell interactions. MucosalImmunol.8(2),352-361. 14. Zomer-van Ommen, D.D., Pukin, A.V., Fu, O., Quarles vanUfford, L.H.C., Janssens, H.M., Beekman,J.M., and Pieters, R.J.(2016). Functional characterization of cholera toxin inhibitorsusing human intestinal organoids.J.Med. Chem. 59(14), 6968-6972. 15. Bartfeld, S., Bayram,T., van de Wetering, M., Huch, M., Begthel,H., Kujala, P., Vries, R., Peters, P.J., and Clevers, H. (2015). Invitro expansion of human gastric epithelial stem cells andtheir responses to bacterial infection. Gastroenterology 148(1),126-136 e126. 16. Qian, X., Nguyen,H.N., Jacob, F.,Song, H., and Ming, G-l.(2017). Using brain organoids to understand Zika virus-induced microcephaly. Development 144(6), 952-957. 17. Drost, J. and Clevers, H.(2018).Organoids in cancer research.Nat.Rev. Cancer 18(7),407-418. 18. Weeber, F., Ooft, S.N., Dijkstra, K.K., and Voest, E.V.(2017).Tumor organoids as a pre-clinical cancer model for drugdiscovery. Cell Chemical Biology 24(9),1092-1100. 19.Yui, S., Nakamura, T., Sato, T.,Nemoto, Y., Mizutani, T., Zheng,X., Ichinose, S., Nagaishi,T., Okamoto, R., Tsuchiya, K., Clevers,H., and Watanabe,M. (2012). Functional engraftment of colonepithelium expanded in vitro from a single adult Lgr5(+) stemcell.Nat. Med. 18(4), 618-623. 20. SSchwank, G., Koo, B-K., Sasselli, V., Dekkers,J.F., Heo, l., Demir-can, T., Sasaki, N., Boymans, S., Cuppen, E., van der Ent, C.K.,Nieuwenhuis, E.E.S., Beekman,J.M., and Clevers, H. (2013).Functional repair of CFTR by CRISPR/Cas9 in intestinal stemcell organoids of cystic fibrosis patients. Cell Stem Cell 13(6),653-658. 21. Clinton,J., and McWilliams-Koeppen, P. (2019). Initiation,expansion, and cryopreservation of human primary tissue-derived normal and diseased organoids in embeddedthree-dimensional culture.Current Protocols in CellBiology,82(1),e66. 22. Intestinal Organoids. (2021). Stemcell Technologies. https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/overview.html 23. Driehuis, E., Kretzschmar, K., and Clevers,H. (2020).Establish-ment of patient-derived cancer organoids for drug-screeningapplications. Nat Protoc. 15(10),3380-3409. 24. Rios, A.C., and Clevers, H. (2018). Imaging organoids: a brightfuture ahead.Nature Methods 15(1), 24-26. 引言 转化应用 类器官培养与分析 实时活细胞分析 类器官应用潜力 参考文献 25..SSartorius Application Note: Real-Time Live-Cell Analysis of 3DOrganoid Growth in Matrigel@ Domes.(2021).https:/www.essenbioscience.com/en/forms/appliction-note-live-cell-analysis-3d-organoid/ 26. https:/www.essenbioscience.com/en/applications/cell-monitoring-workflows/organoid-qc/ 27. Mouse Hepatic Progenitor Organoid Culture: SupplementaryProtocols. (2017). Stemcell Technologies.https://www.stem-cell.com/mouse-hepatic-progenitor-organoid-culture-supple-mentary-protocols.html 销售与服务联系方式 电话+8621 6066 6100 ( 技术规格如有变更,恕不另行通知。 ) ( 赛多利斯保留最终解释权和修改权。 ) 图:使用综合形态定义特定细胞类型的传代频率。将肝脏类器官嵌入板中的 Matrigel@ Dome (:代)。每隔小时收集数据,总计时。倍镜拍摄所有图像。每个数据点代表均值±SEM, n=个孔。 关注赛多利斯实验室版本 如今越来越多的科学家将目光从2D细胞模型转移到3D细胞模型。3D细胞模型不仅保留了前者的通量,而且从药物渗透,到细胞表型等方方面面都表现出了更贴近体内生理学的性质。目前3D细胞培养的方式主要分两种:- 不依赖支架的培养方案,如超低细胞吸附孔板、悬滴法、磁力悬浮法、微重力培养法等- 基于支架的培养方案,如胞外基质凝胶、化学合成凝胶、3D打印等Incucyte®实时活细胞分析系统应用灵活,能够对不同培养方式获得的多种3D活细胞样本自动且连续地(数天、数周或数月)进行HD 相位和荧光图像的获取及分析。并且可以安装在标准化的组织培养箱内,确保细胞生长环境免受干扰。下面通过两个案例来看看Incucyte®的实力吧!不依赖支架的3D细胞培养美国斯坦福大学医学院的 Michael C. Bassik教授团队在Nature上发表文章[1],详细对比了在肺癌中肿瘤突变基因在2D单细胞层和3D细胞球体中的表型差异,并通过3D球体模型筛选出了被2D模型遗漏的靶点。该文采用了不依赖支架的培养方案,使用超低细胞吸附耗材进行3D细胞球体的培养。筛选策略如图所示:将sgRNA文库通过慢病毒感染NCI-H23细胞系(该细胞系带有KRASG12C突变),并将感染后的细胞分为两组,分别用3D细胞球体培养和2D单细胞层培养两种模式进行细胞增殖,结合ARS-853(KRAS抑制剂)对细胞表型进行筛选。在其中我们也看到了Incucyte® S3的身影!细胞的增殖和死亡均由Incucyte® S3进行实时监测。如上图所示,NCI-H23细胞自身带有mCherry(红色荧光)蛋白,同时在培养基中加入Sytox Green作为死细胞标记染料。细胞在孔中成球的状态和活/死细胞标记一目了然。基于支架的3D细胞培养来自芬兰图尔库大学生物技术中心的科研人员在Oncogene期刊中发表研究结果[2],发现热休克因子HSF2 能够抑制前列腺癌(PrCa)的肿瘤侵袭。HSF2通过调节GTP酶活性、细胞粘附、细胞外基质和肌动蛋白细胞骨架动力学等相关的基因来实现腺泡生成与侵袭行为之间的相互转换。使用Incucyte®对体外3D类器官培养物进行监测和分析,观察到了PC3肿瘤球中腺泡的产生及其侵袭行为。将siRNA转染细胞,转移到Matrigel中,监测肿瘤球形态8天。- 转染对照siRNA的细胞,最初成熟为分化良好的类器官,并在第8天左右自发形成侵袭性的多细胞结构,随后不久出现明显的侵袭。- 有趣的是,HSF2沉默进一步增加了侵袭性,并且在更早的时间点即检测到侵袭的发生。- 相反,HSF1沉默作为对照,干扰了腺泡分化,增加了细胞死亡率,从而阻止随后侵袭性结构的形成。CtrlHSF2 siRNAHSF1 siRNAIncucyte®实时活细胞分析系统与Incucyte®肿瘤球分析模块的结合,可对肿瘤侵袭进行可重复和高通量分析,提高对细胞活动的深入理解,做出更明智的决定。总结Incucyte®可提供集成式的完整的3D 肿瘤球分析方案,在组织培养箱内实时自动追踪和定量肿瘤球的形成、生长和健康状态。Incucyte®分析3D细胞模型的关键优势获得更多生理相关信息 - 在不干扰培养箱内肿瘤球的情况下,对 3D 肿瘤球培养物进行无标记生长定量和形态学研究。揭示细胞随时间的变化 - 使用无干扰型试剂进行实时活力测定,研究作用机制。生成可重现的定量数据 - 通过经实验室测试的方案、高质量图像和客观分析获得适用于药理学分析的可靠数据。提高分析效率 - 可同时自动采集、分析和绘制多达六个 96/384 孔板的数千张图像,更快地获得结果。Download下载《类器官分析指南》了解更多实时活细胞分析在3D细胞模型中的应用及操作点击下载 获取全文-参考文献-Han, K., Pierce, S.E., Li, A. et al. CRISPR screens in cancer spheroids identify 3D growth-specific vulnerabilities. Nature 580, 136–141 (2020). https://doi.org/10.1038/s41586-020-2099-xBjörk, J., Åkerfelt, M., Joutsen, J. et al. Heat-shock factor 2 is a suppressor of prostate cancer invasion. Oncogene 35, 1770–1784 (2016). https://doi.org/10.1038/onc.2015.241
确定












还剩15页未读,是否继续阅读?
德国赛多利斯集团为您提供《类器官中培养与分析检测方案(高内涵成像)》,该方案主要用于其他中生化检验检测,参考标准--,《类器官中培养与分析检测方案(高内涵成像)》用到的仪器有赛多利斯 Incucyte® SX5 活细胞分析仪
推荐专场
相关方案
更多
该厂商其他方案
更多














