方案详情
文
使用乙腈(或酸化乙腈)提取白菜、苹果、菠菜、金针菇、大米和茶叶等基质,经盐析、离心后取上清液,再应用睿科全自动QuEChERS净化仪系统,经由m-PFC(多壁碳纳米管)柱净化,萃取多种农药及其代谢物,洗脱液直接由GC-MS/MS分析检测。
方案详情

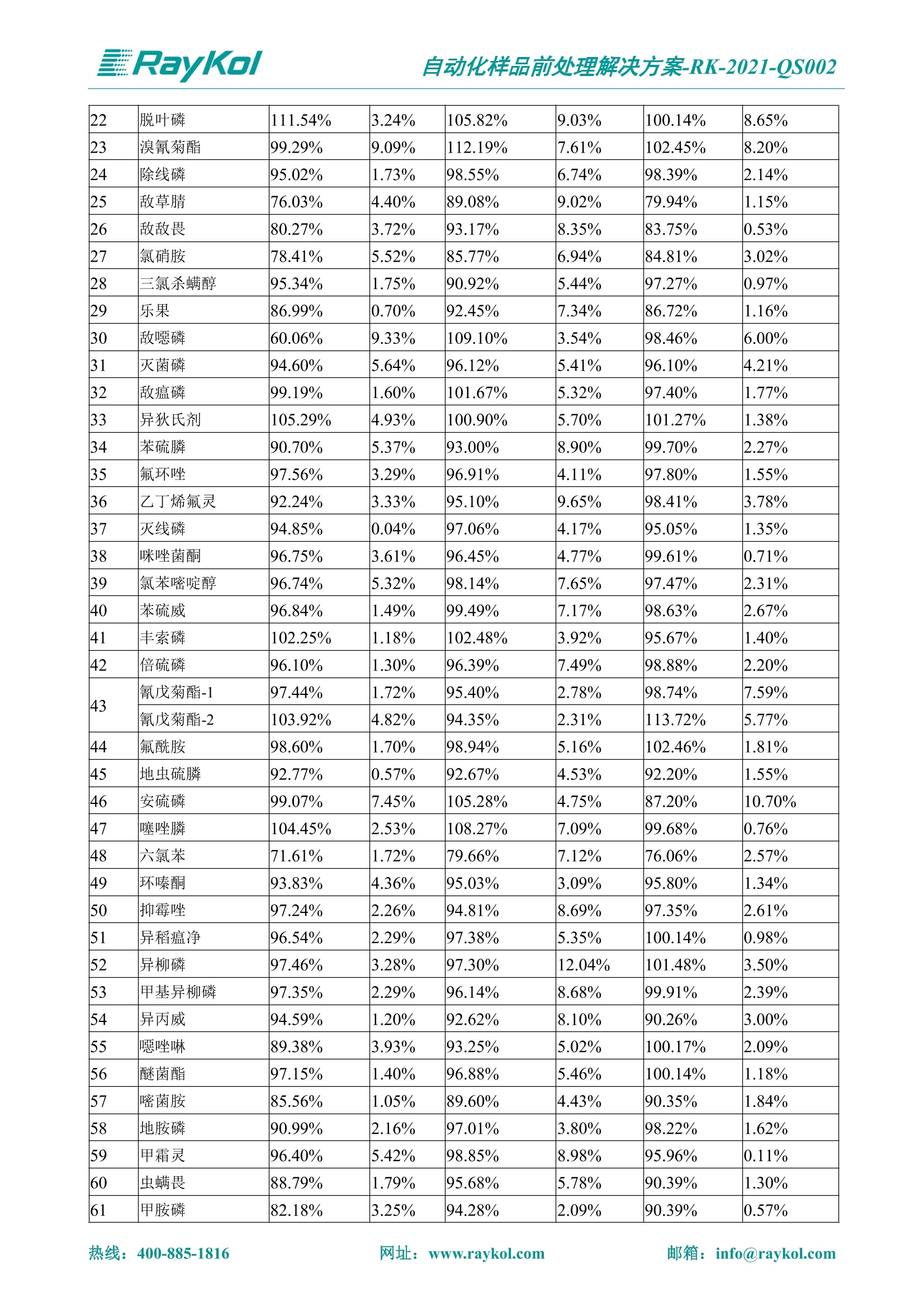
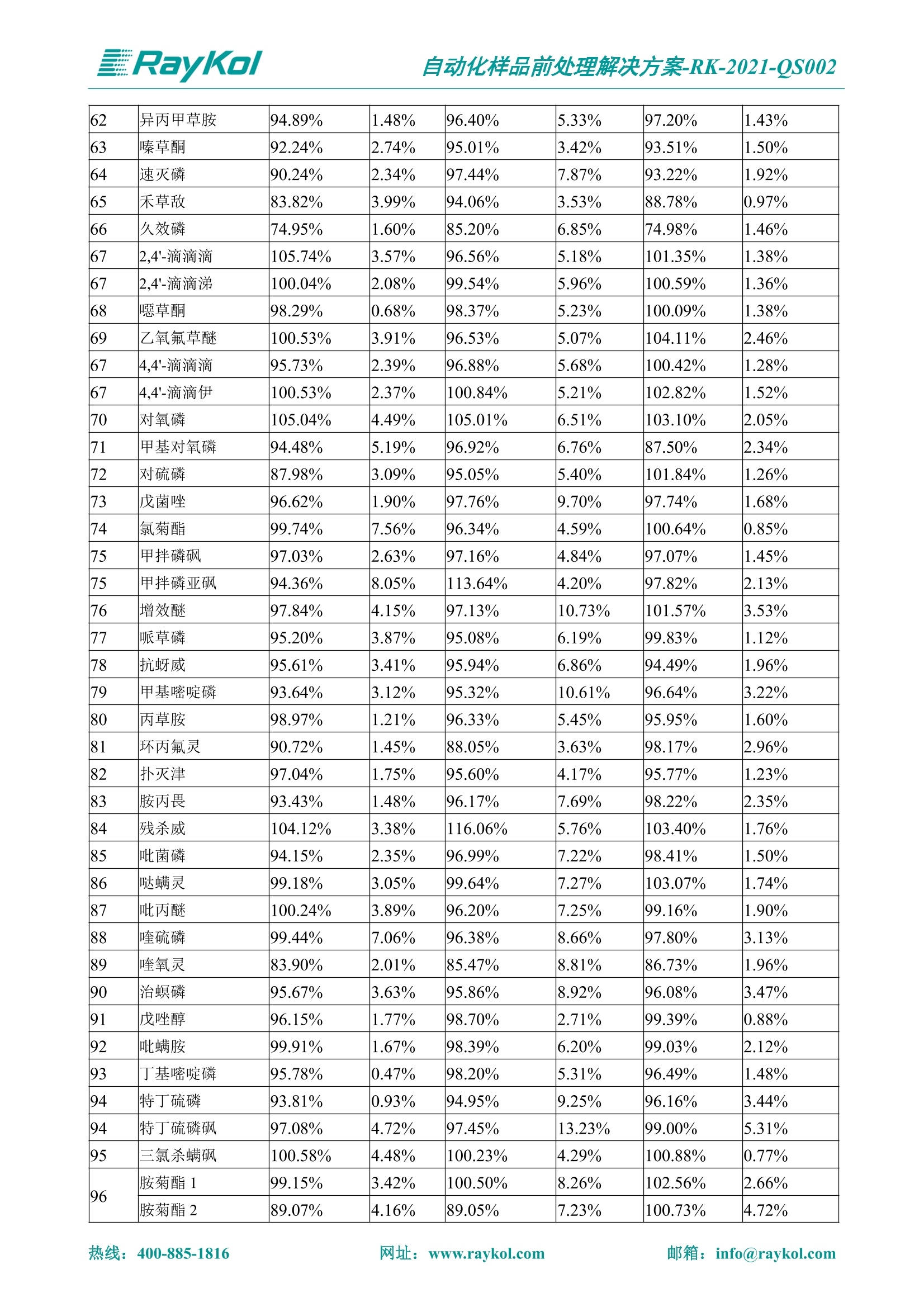
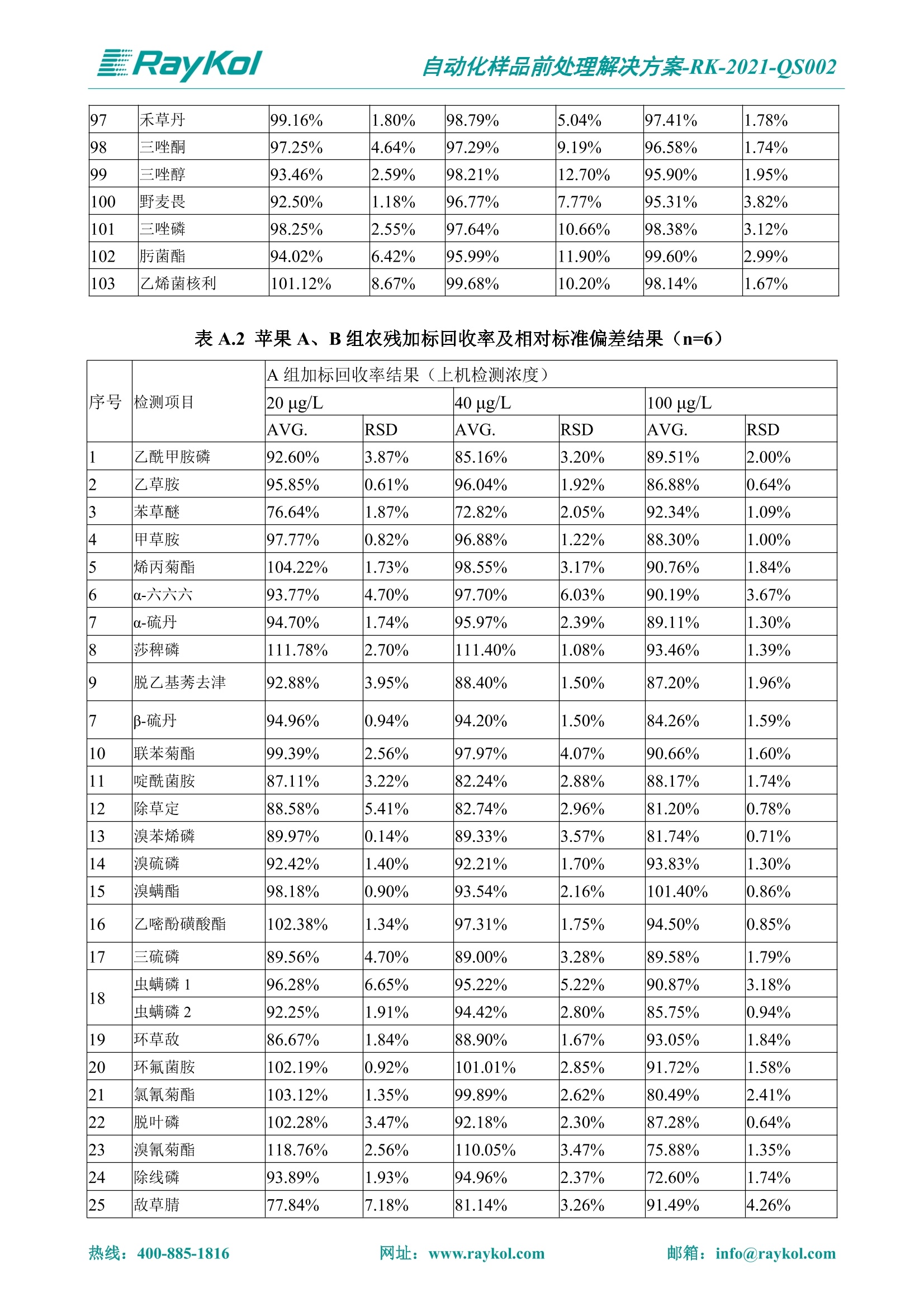
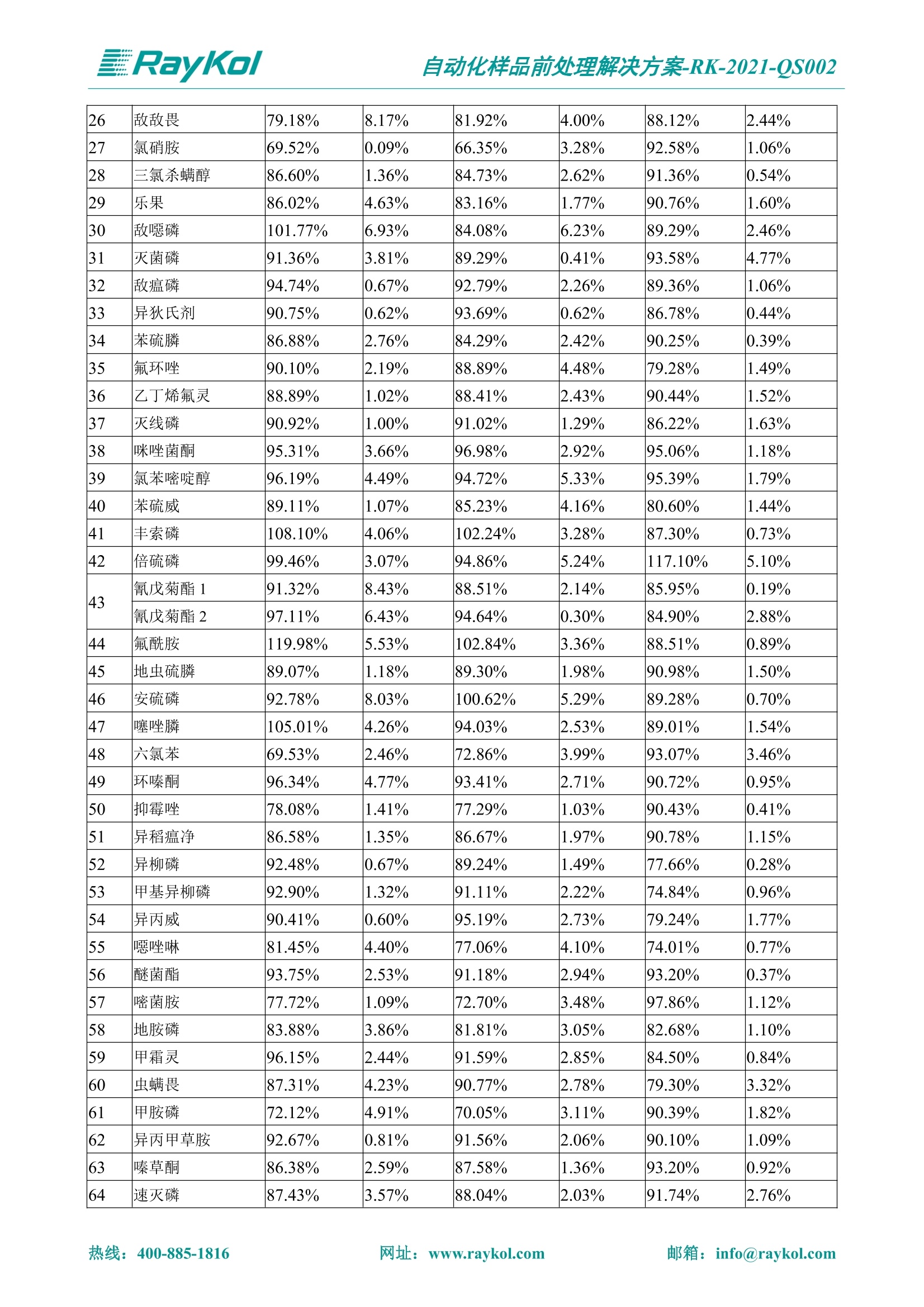
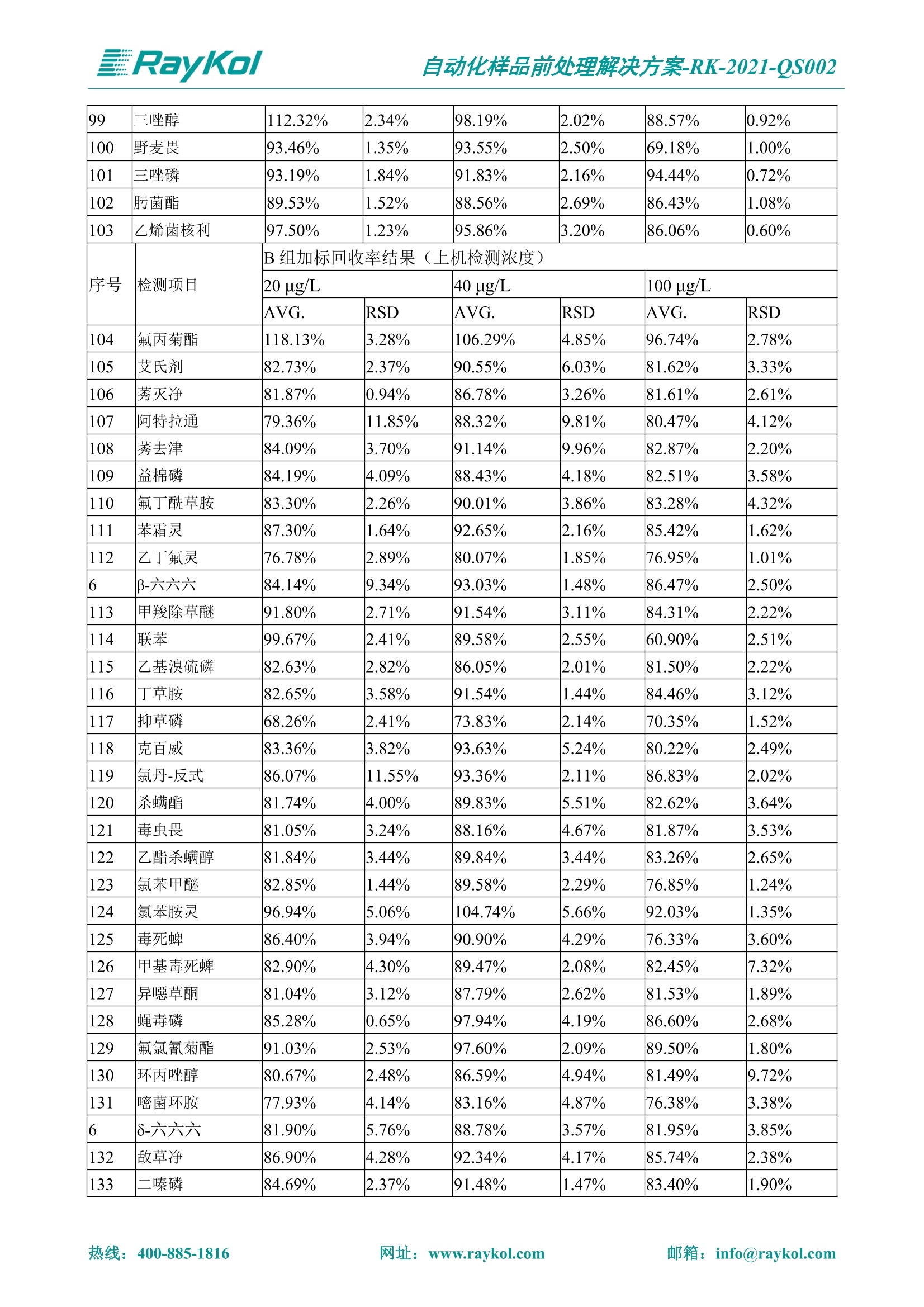
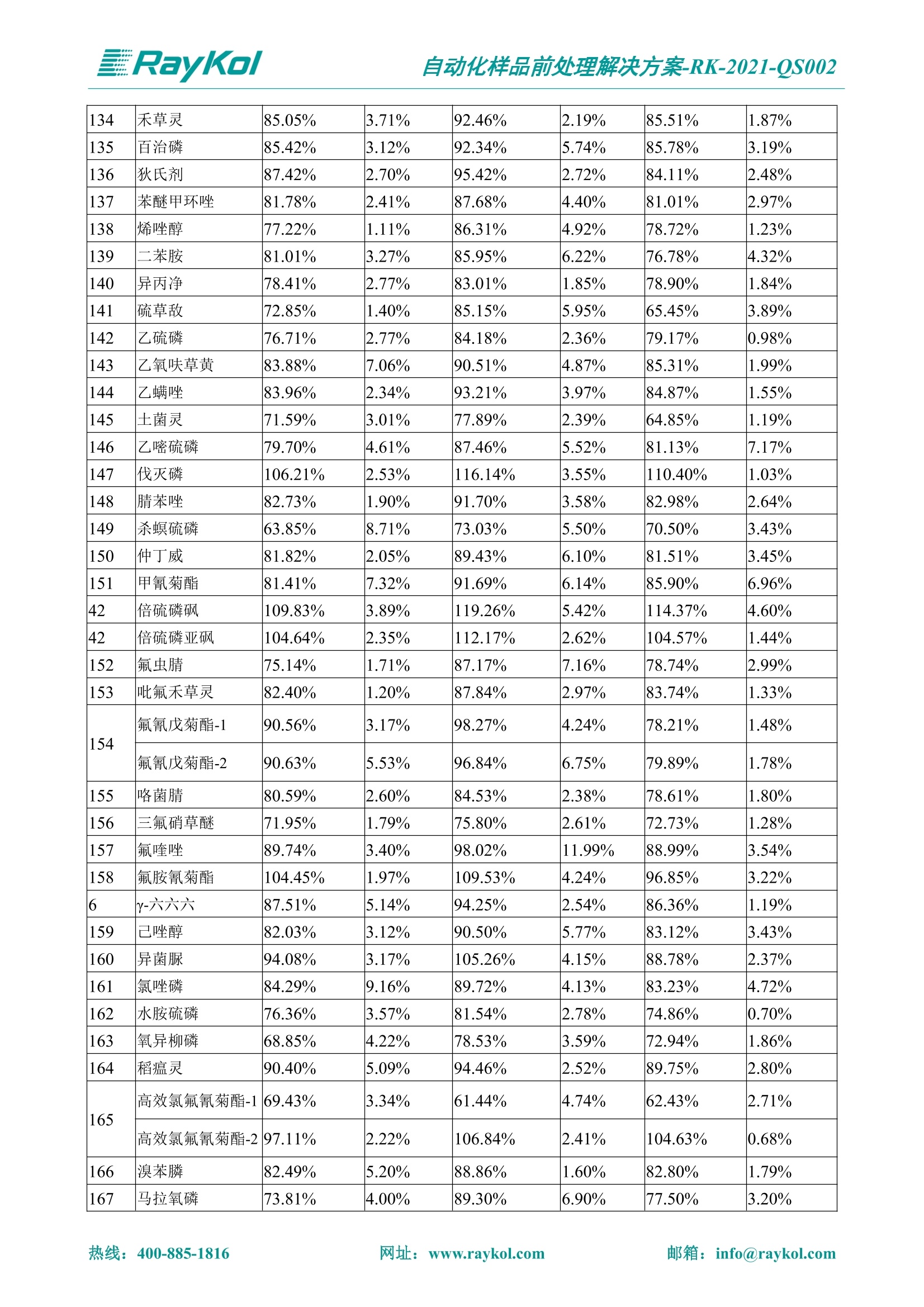
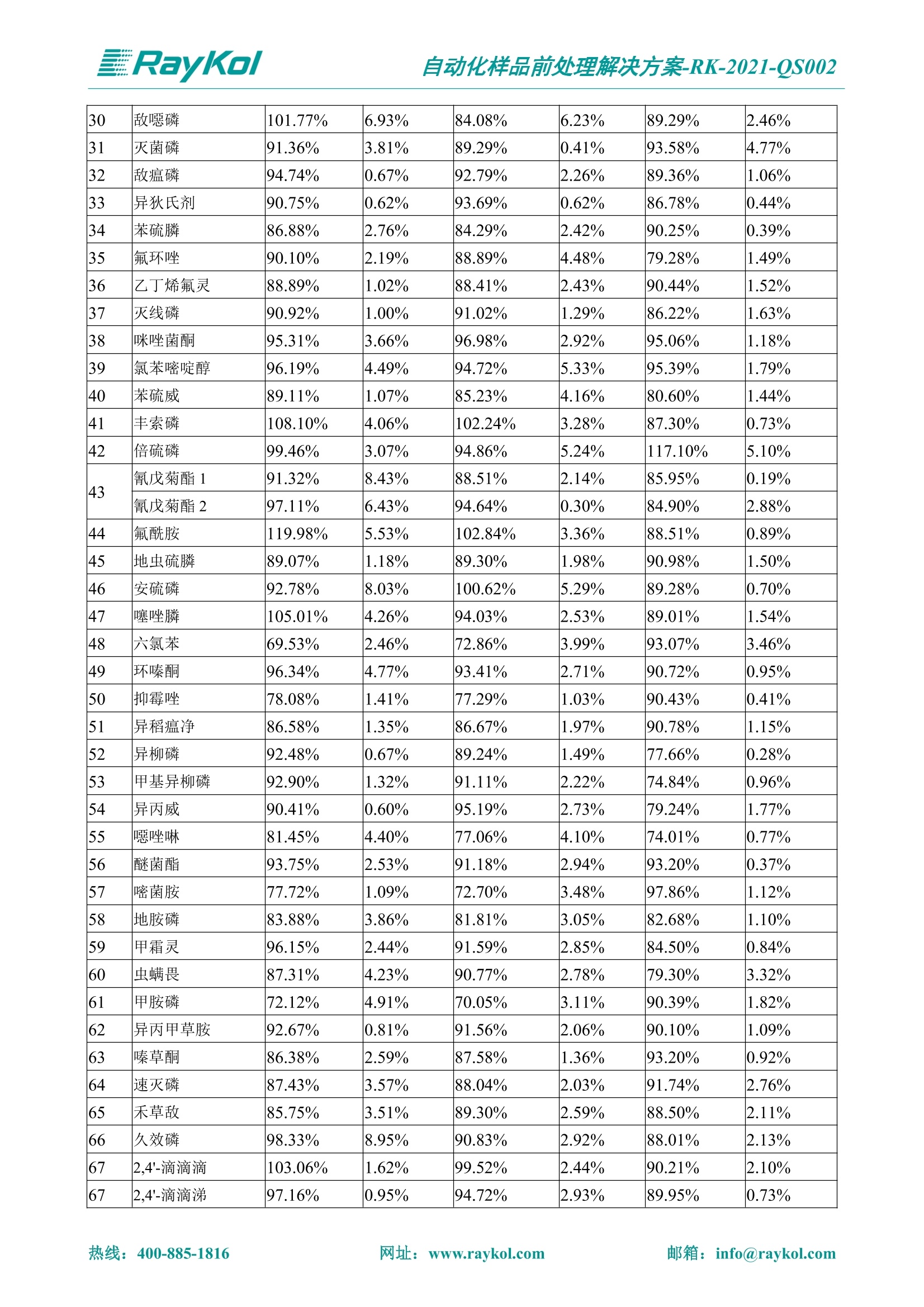
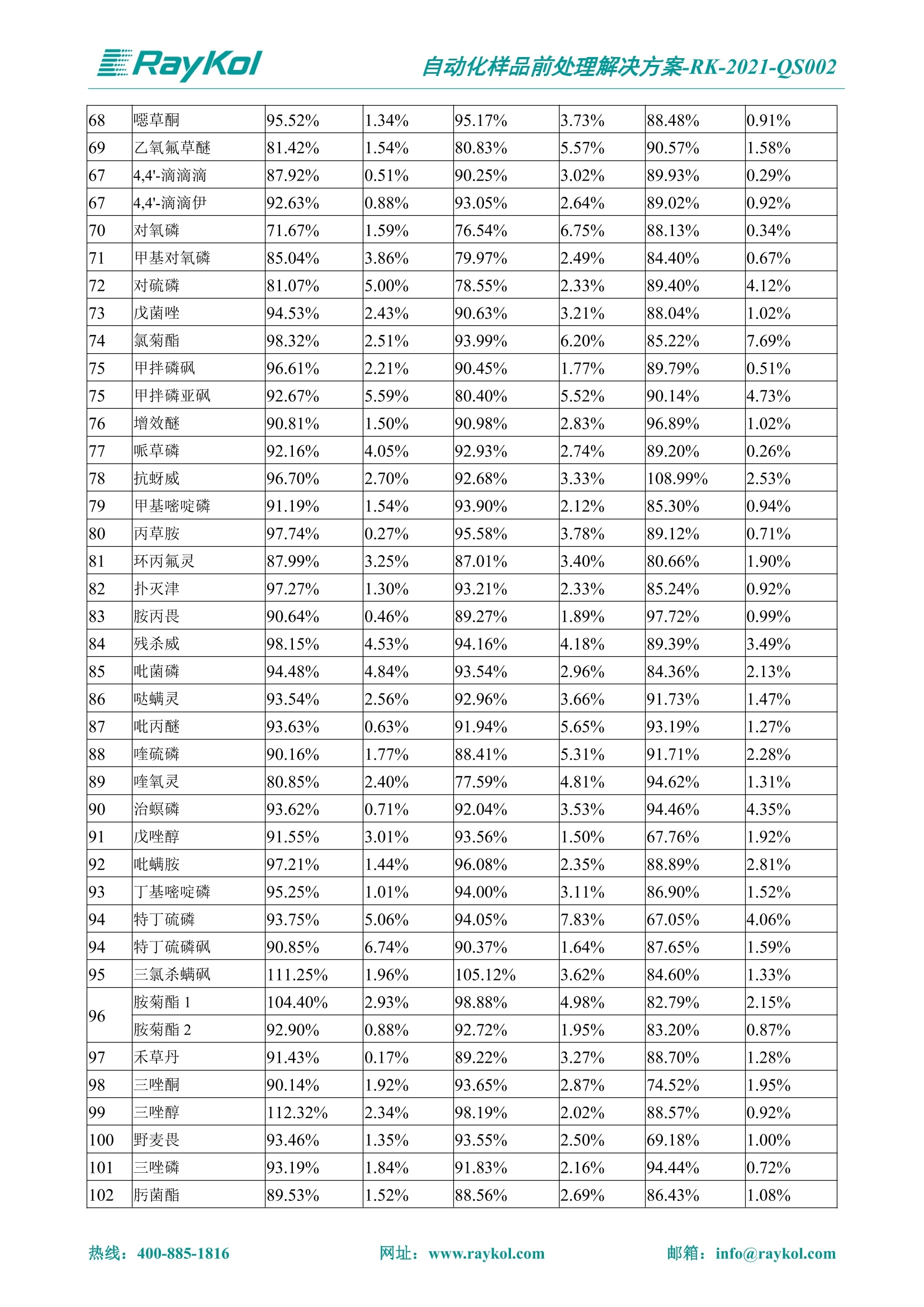
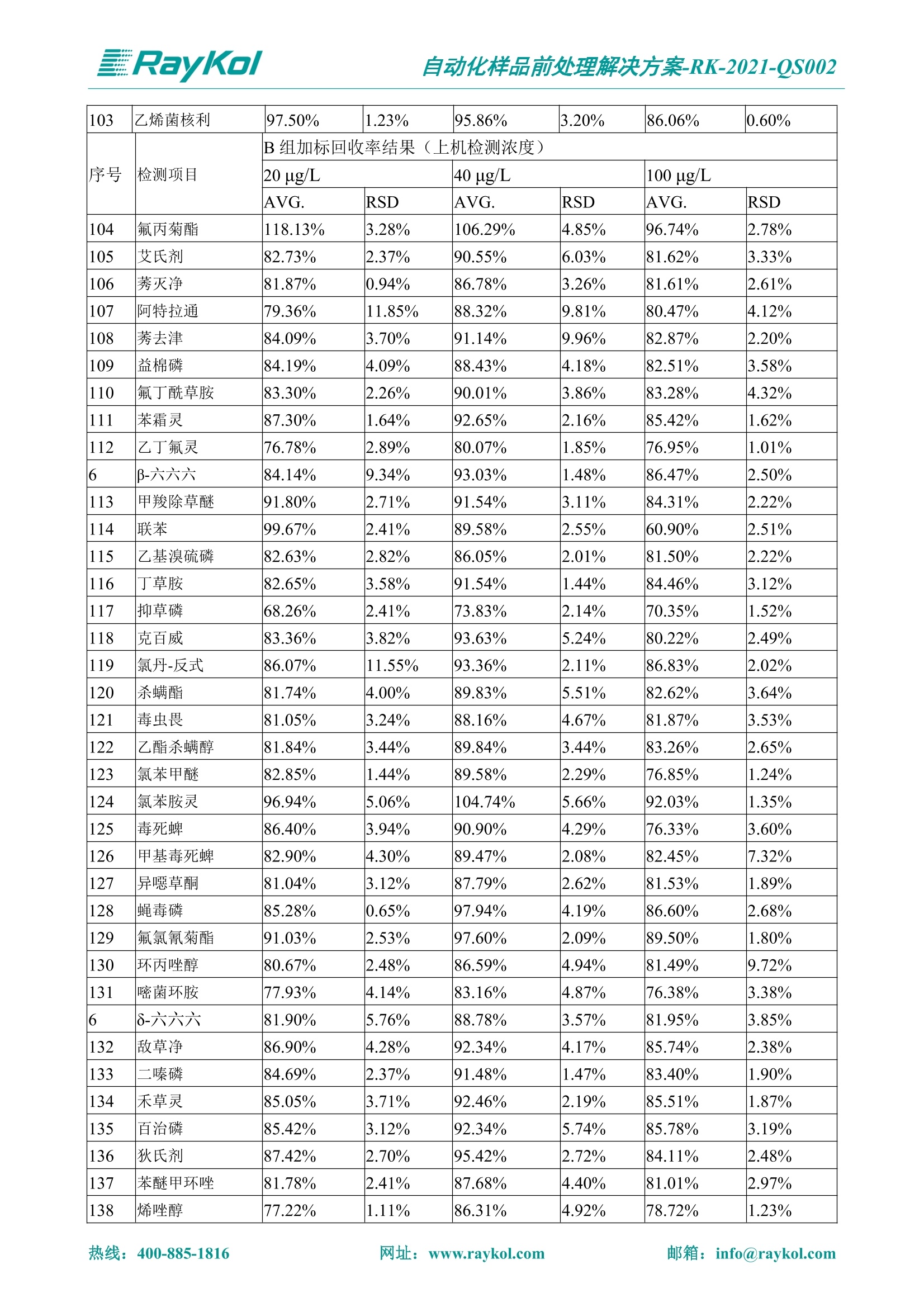
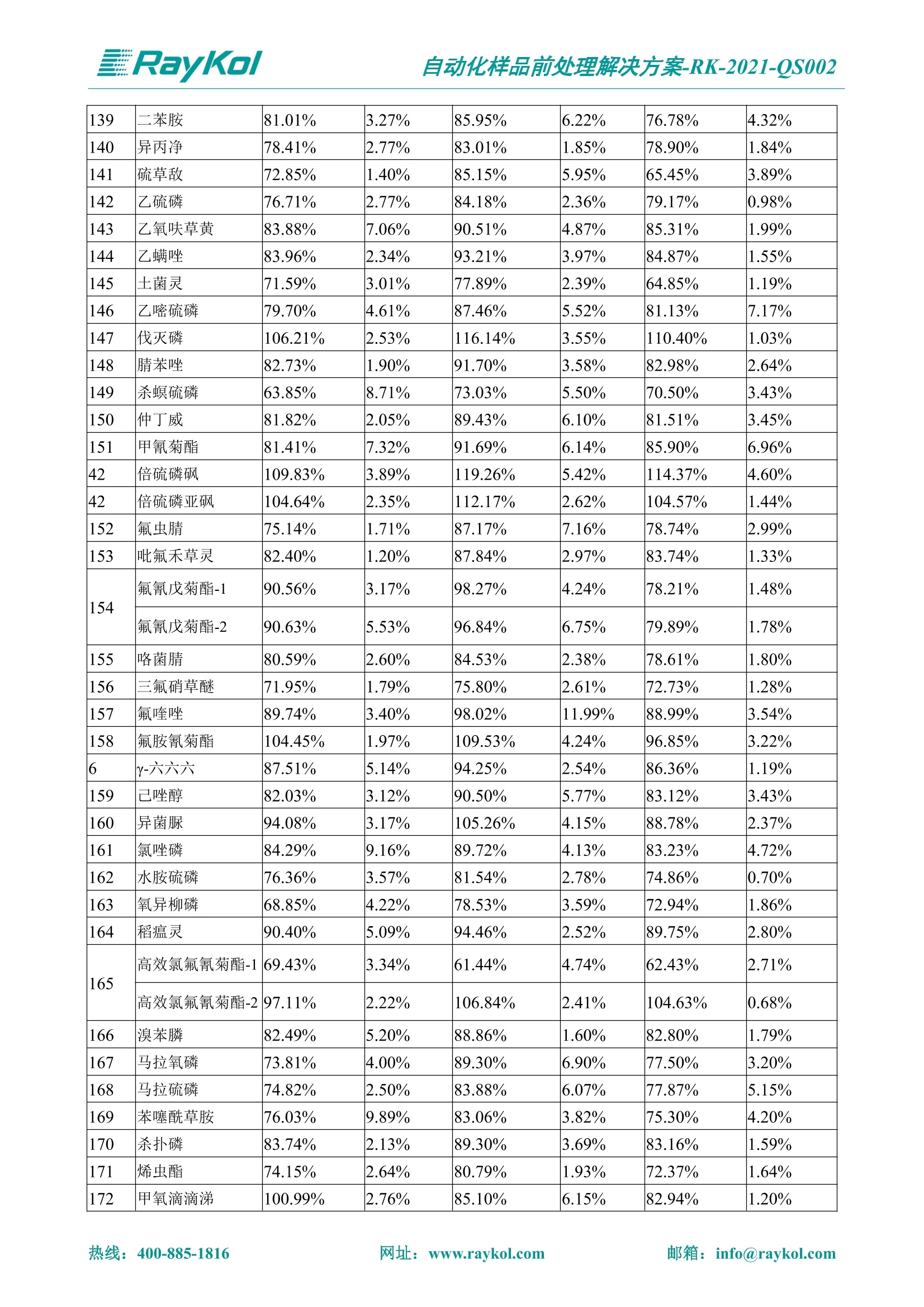
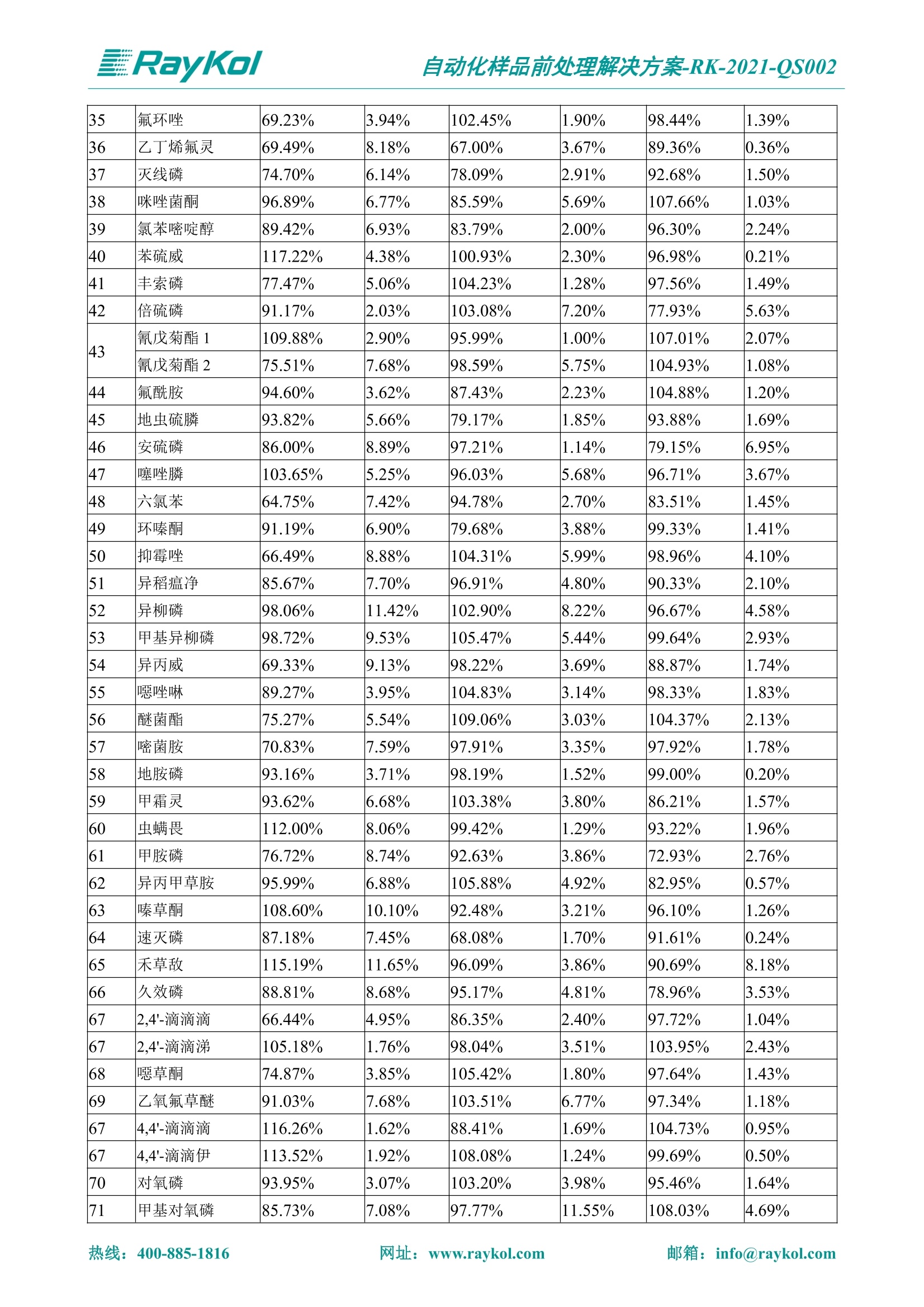
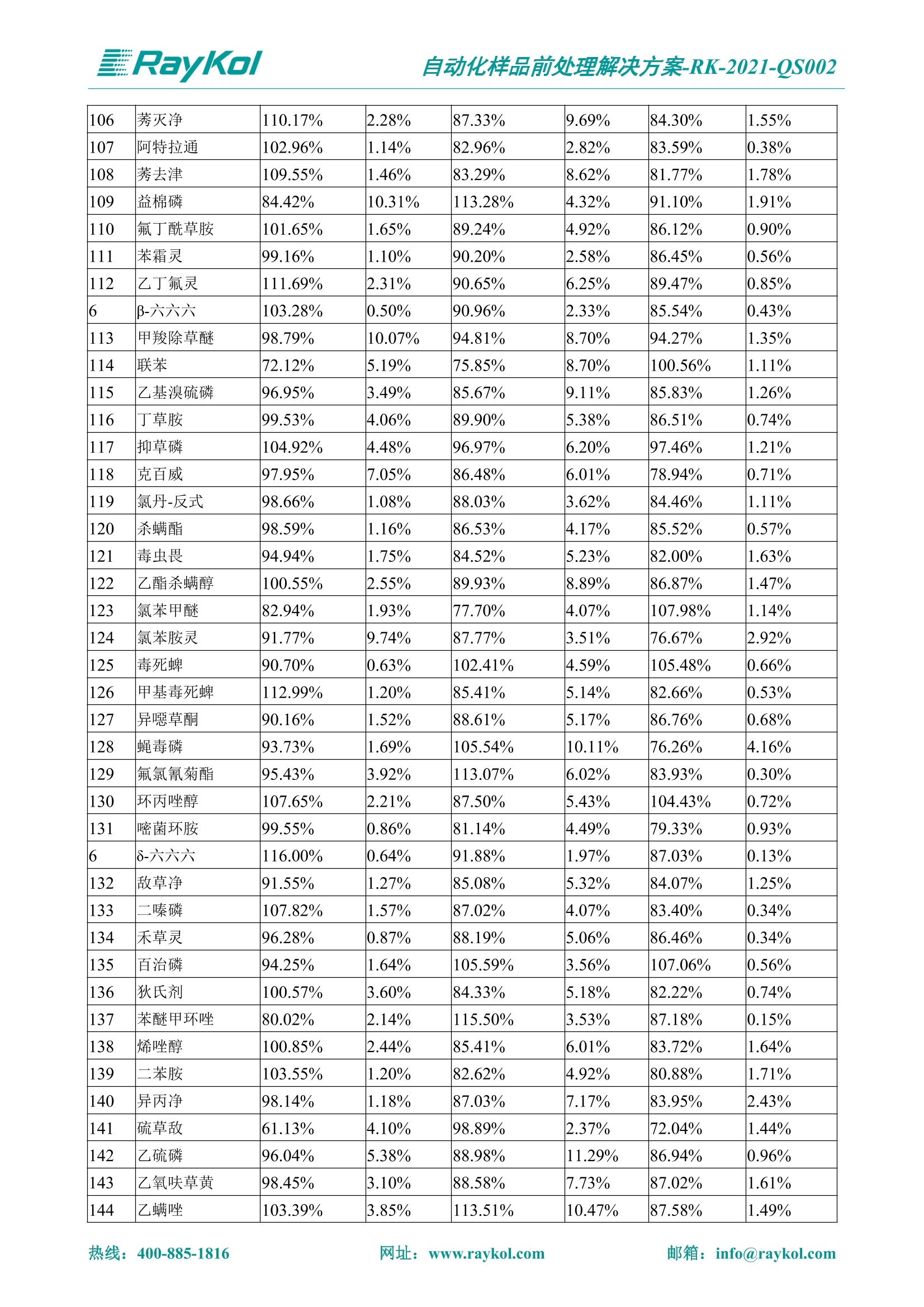
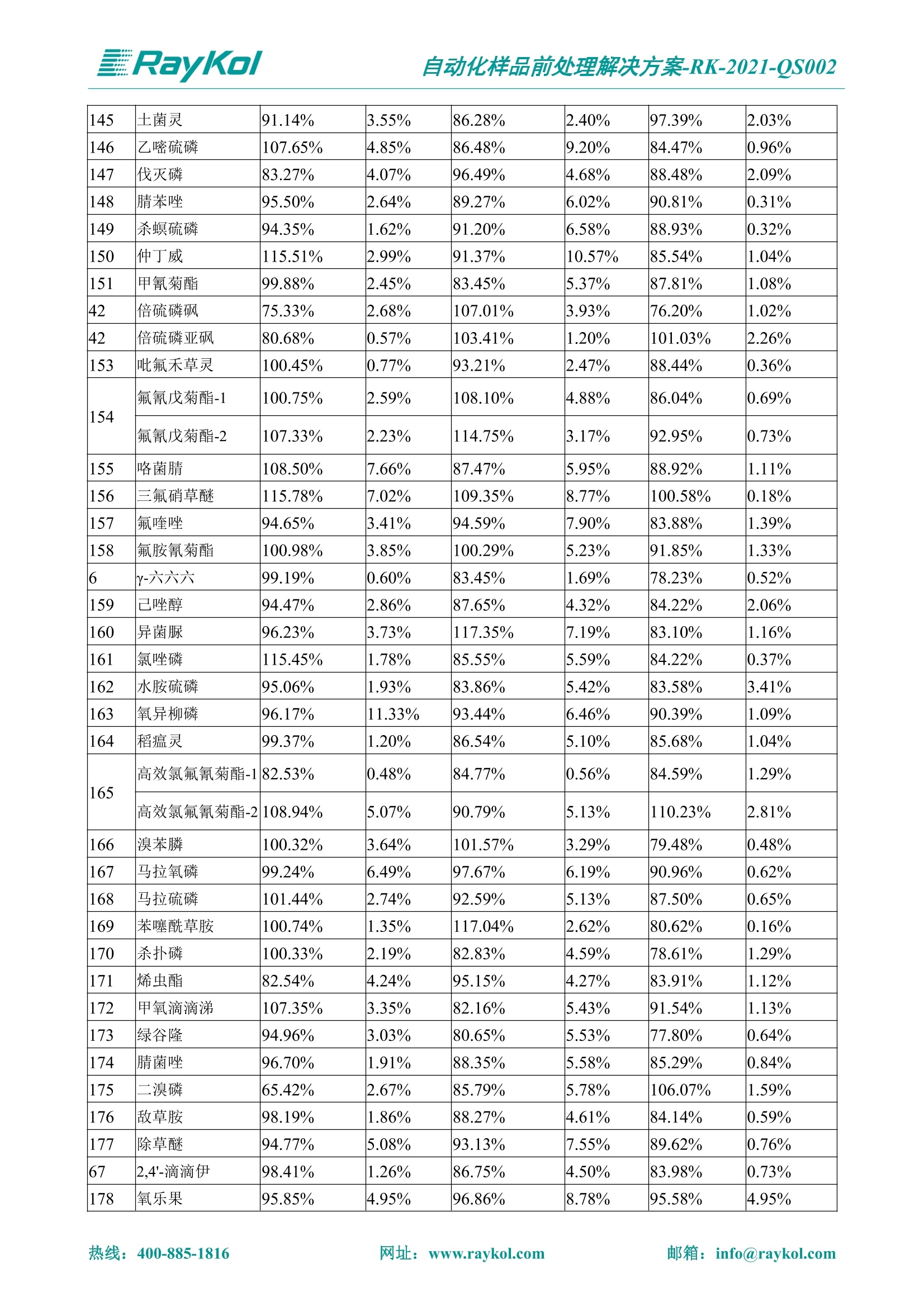
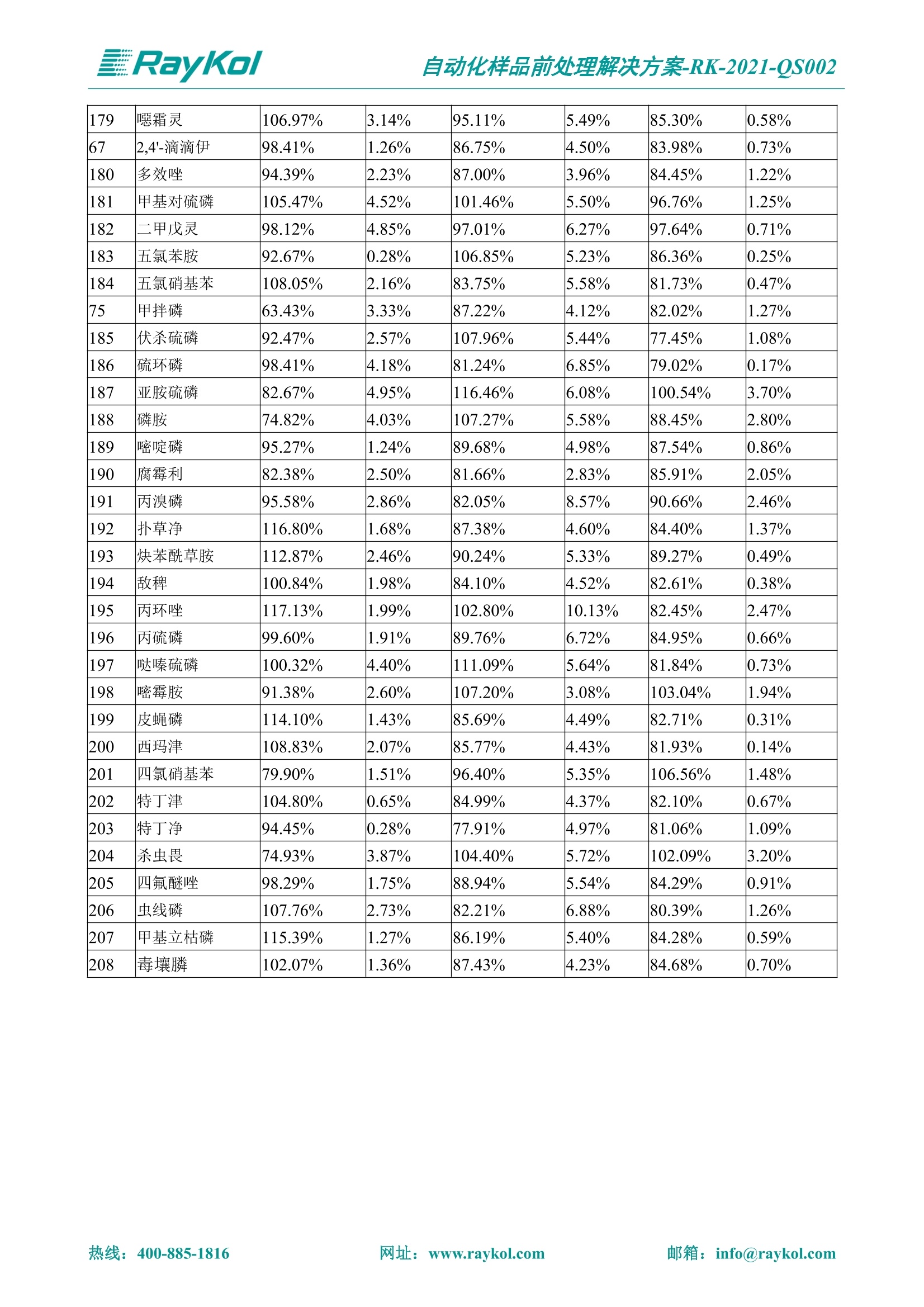
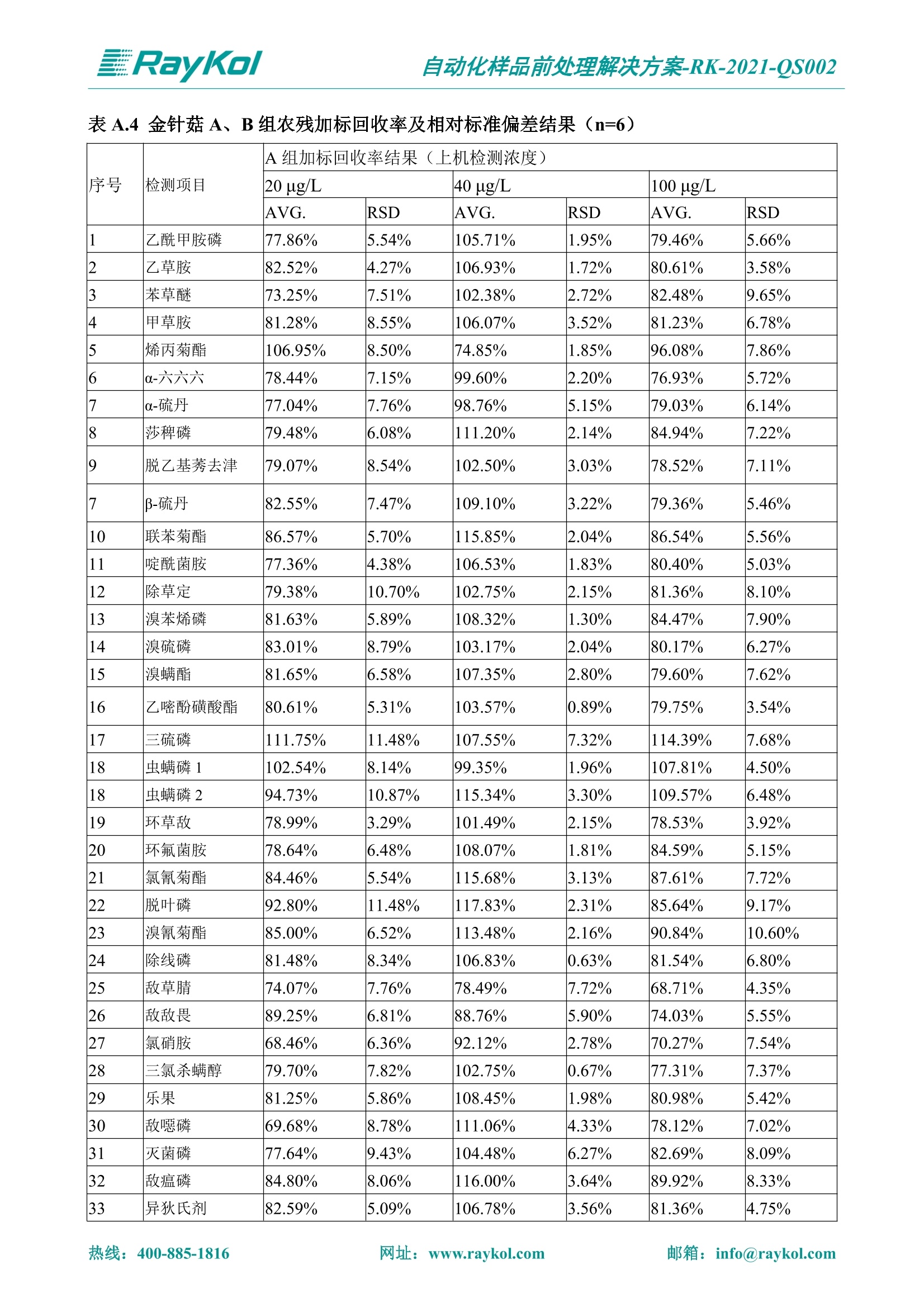
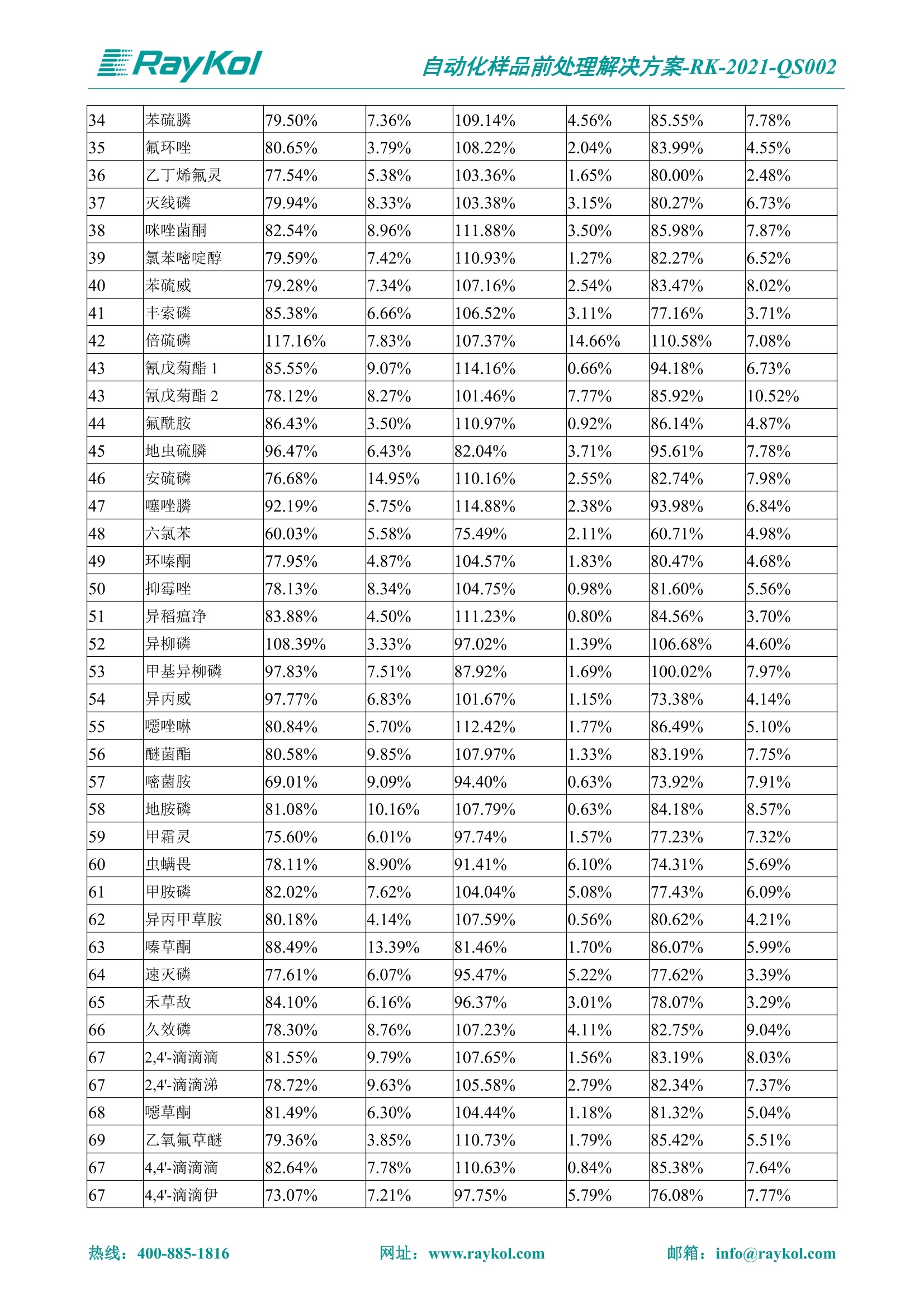
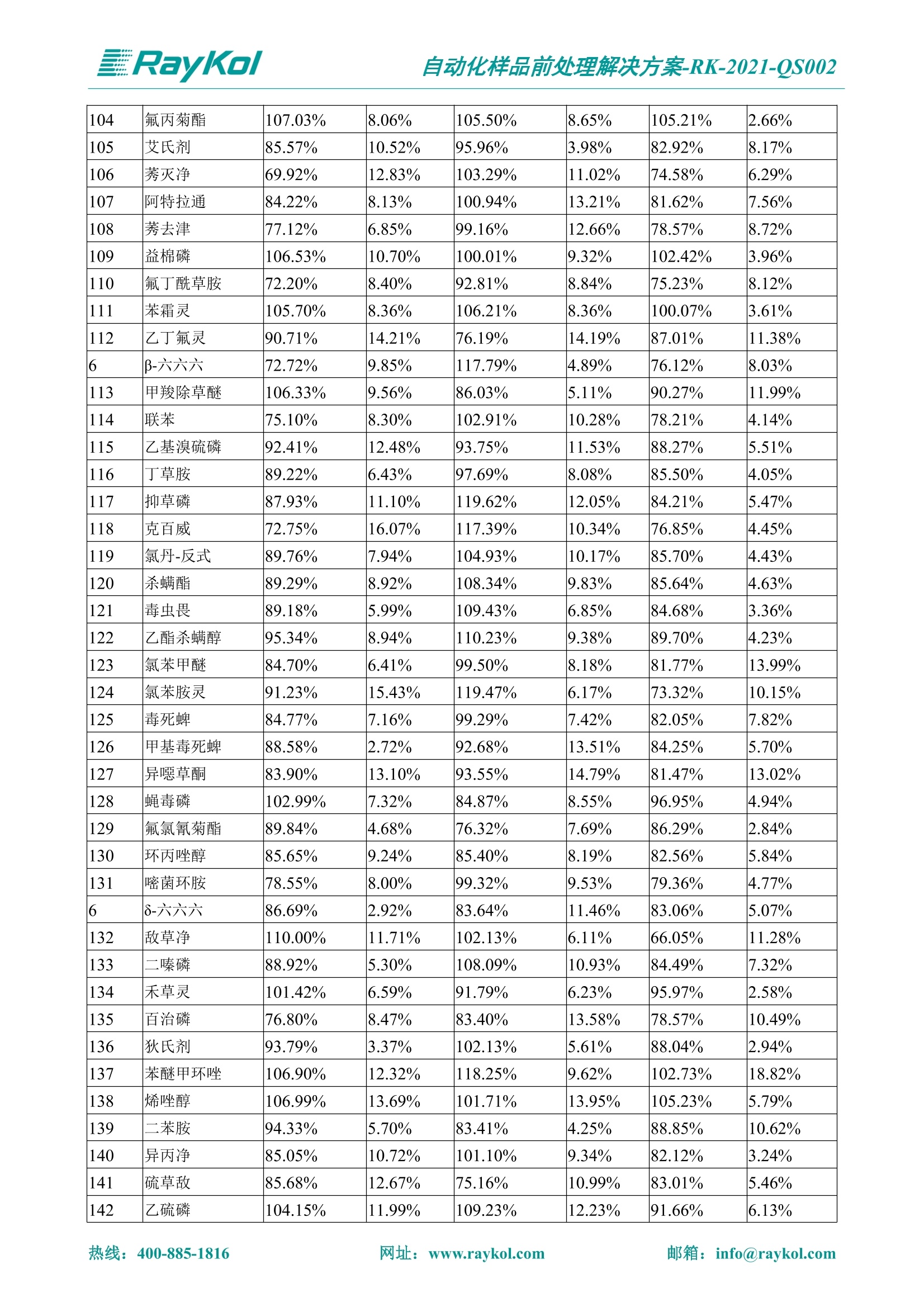
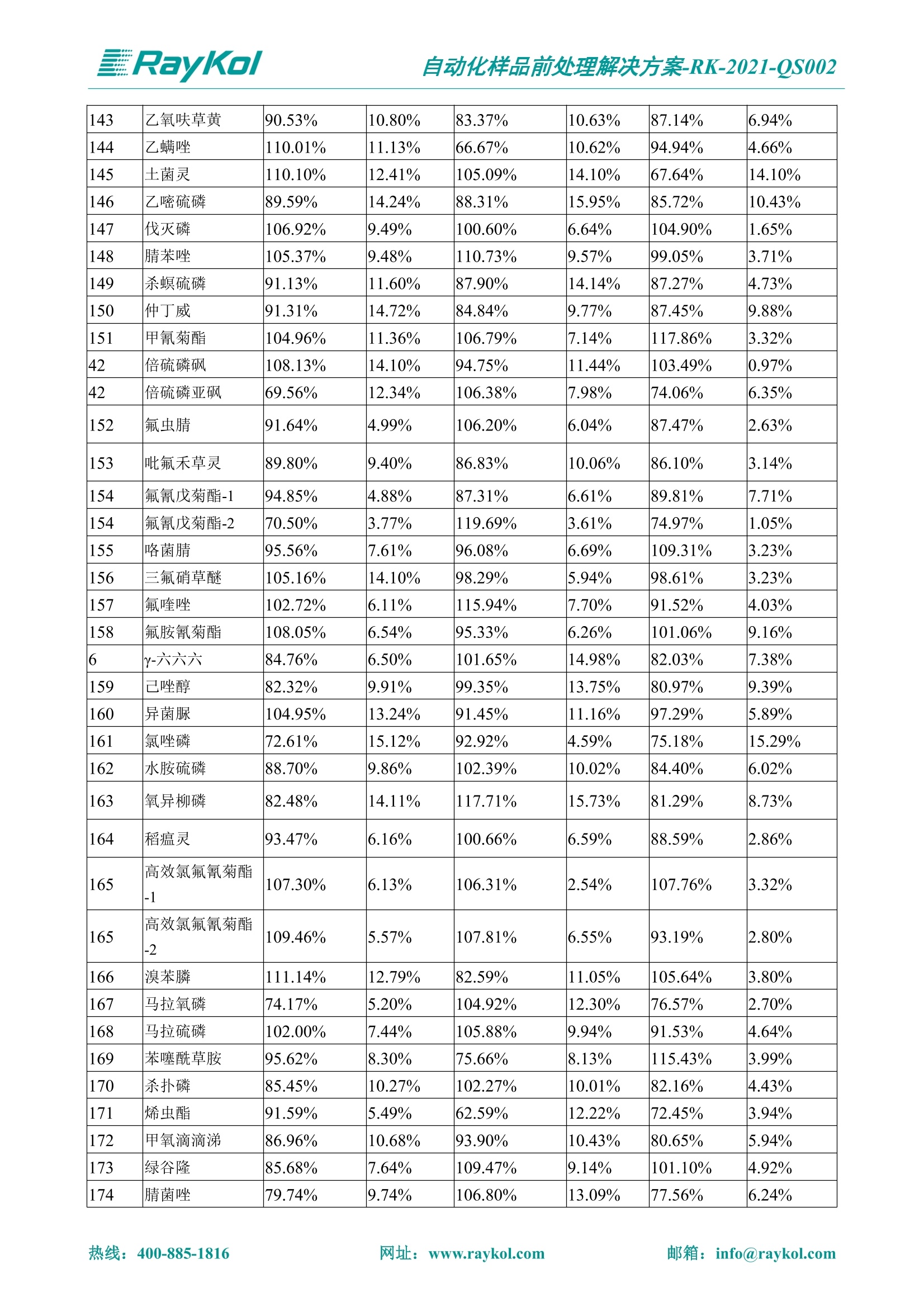
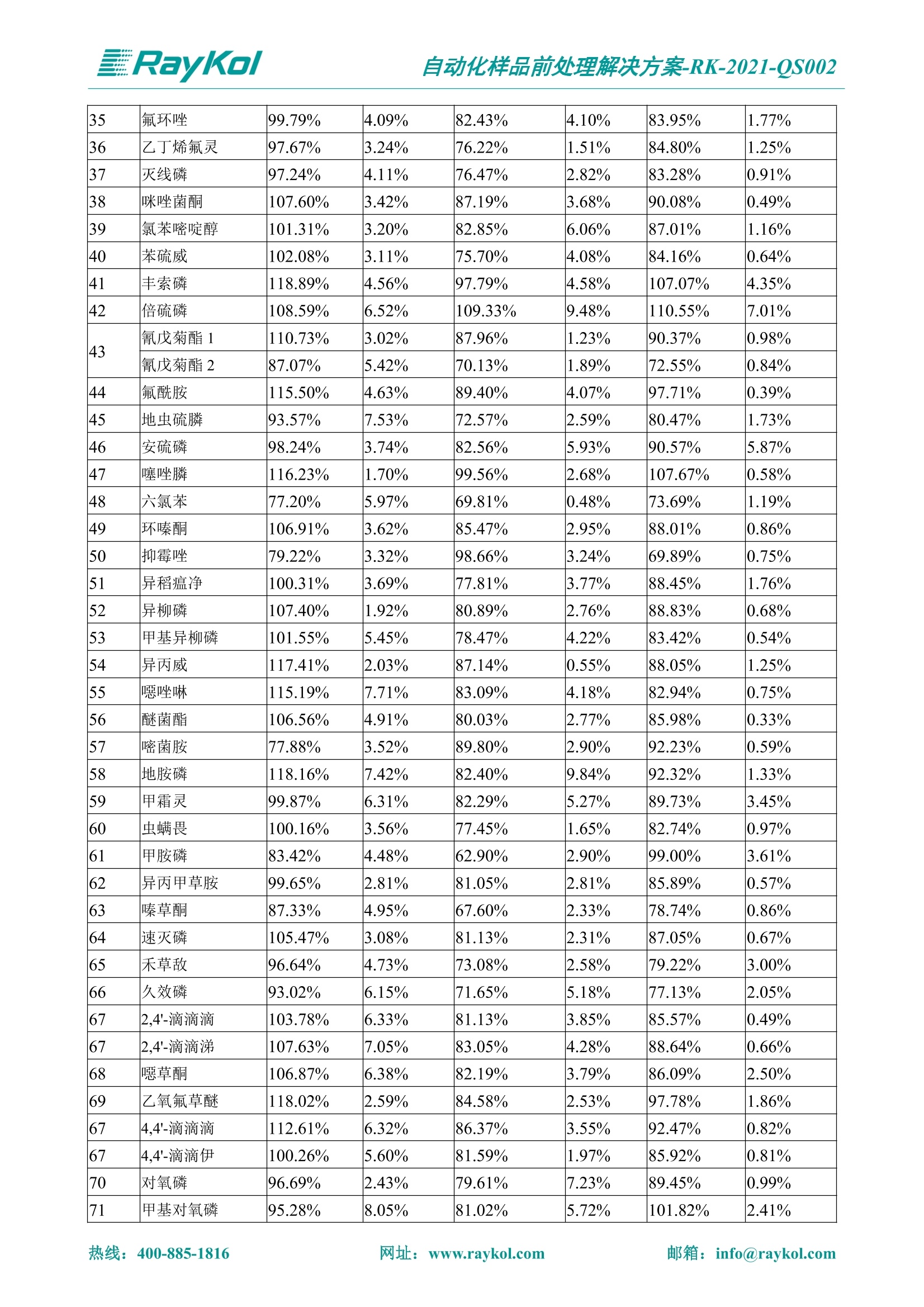
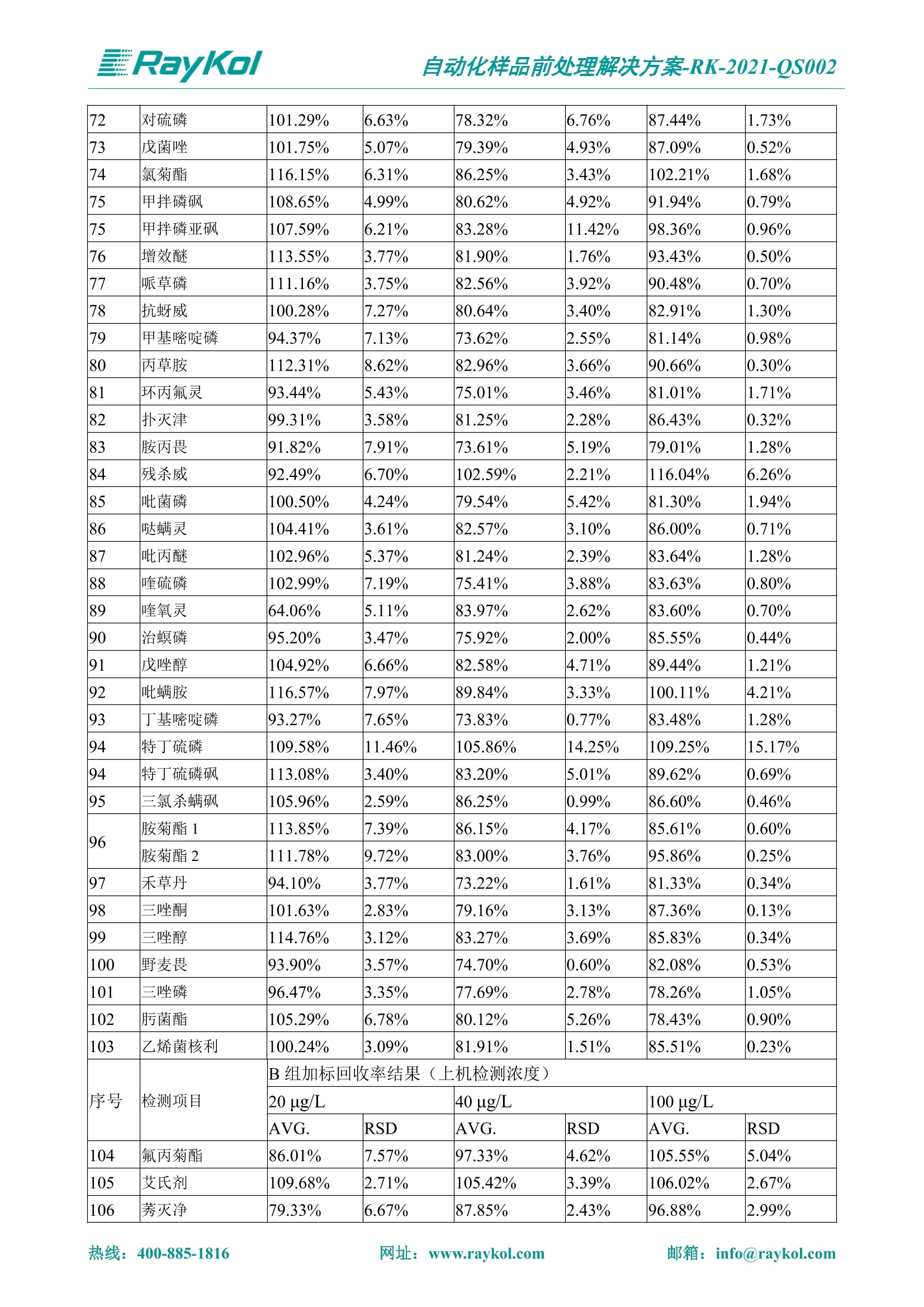
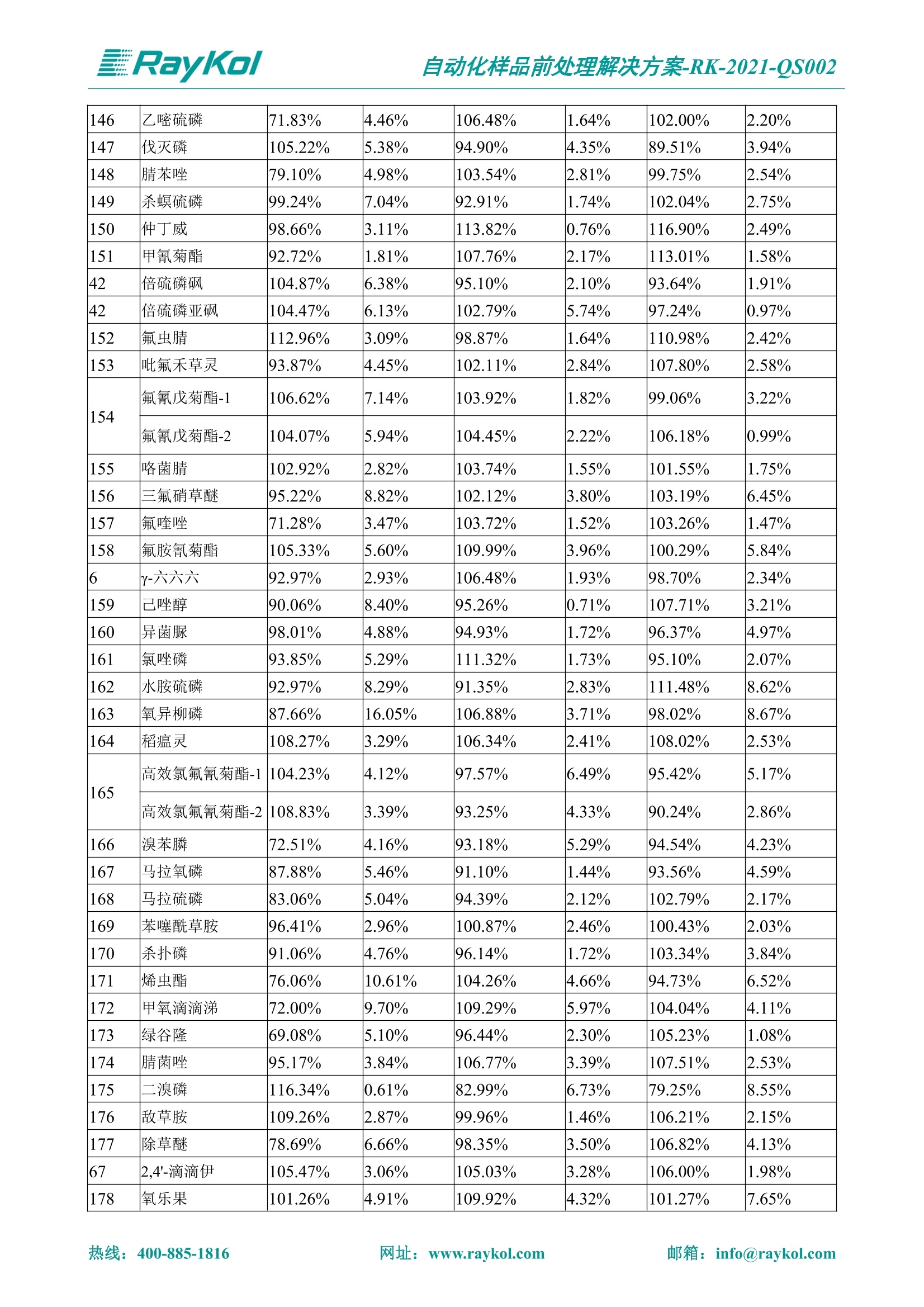
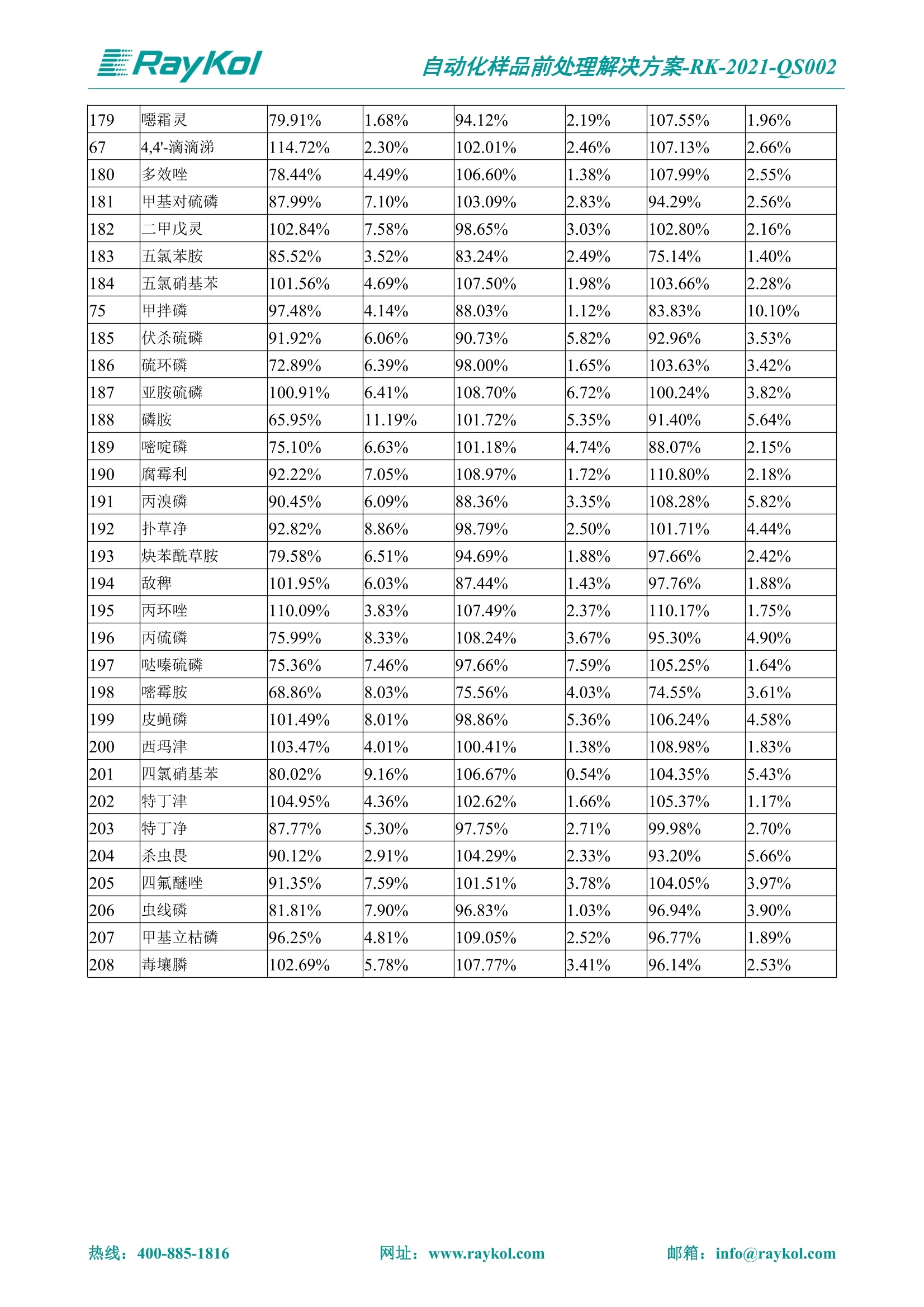
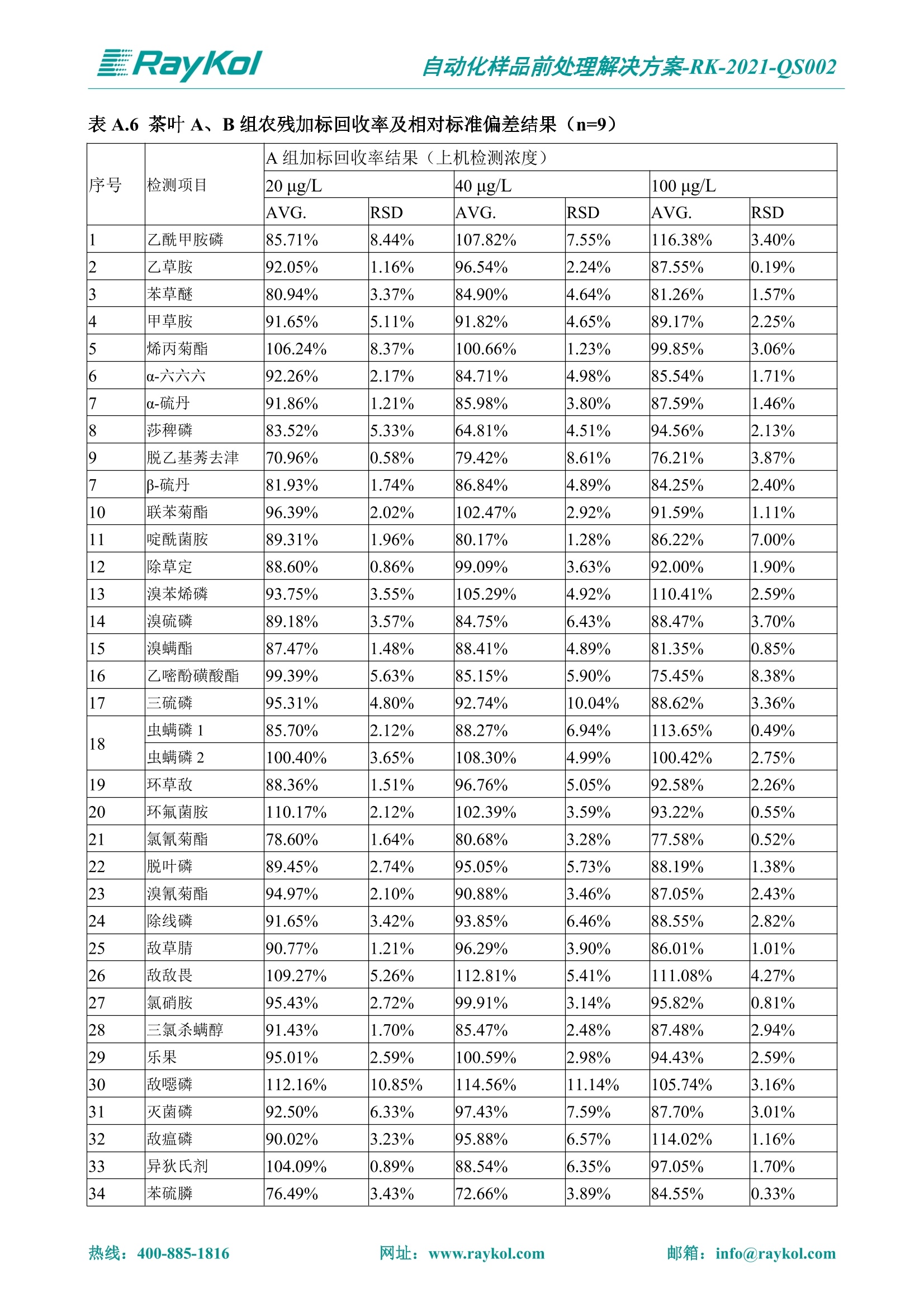
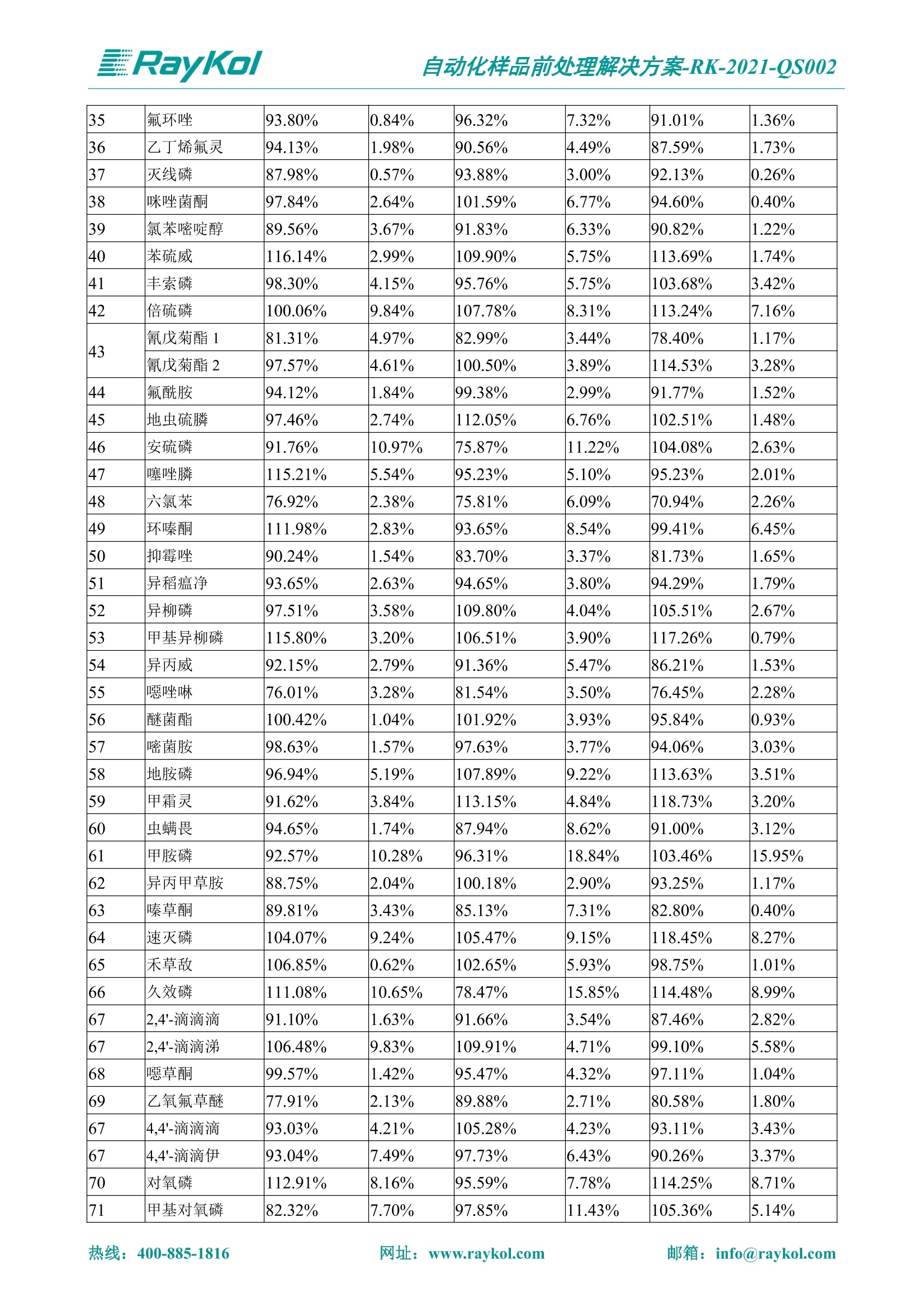
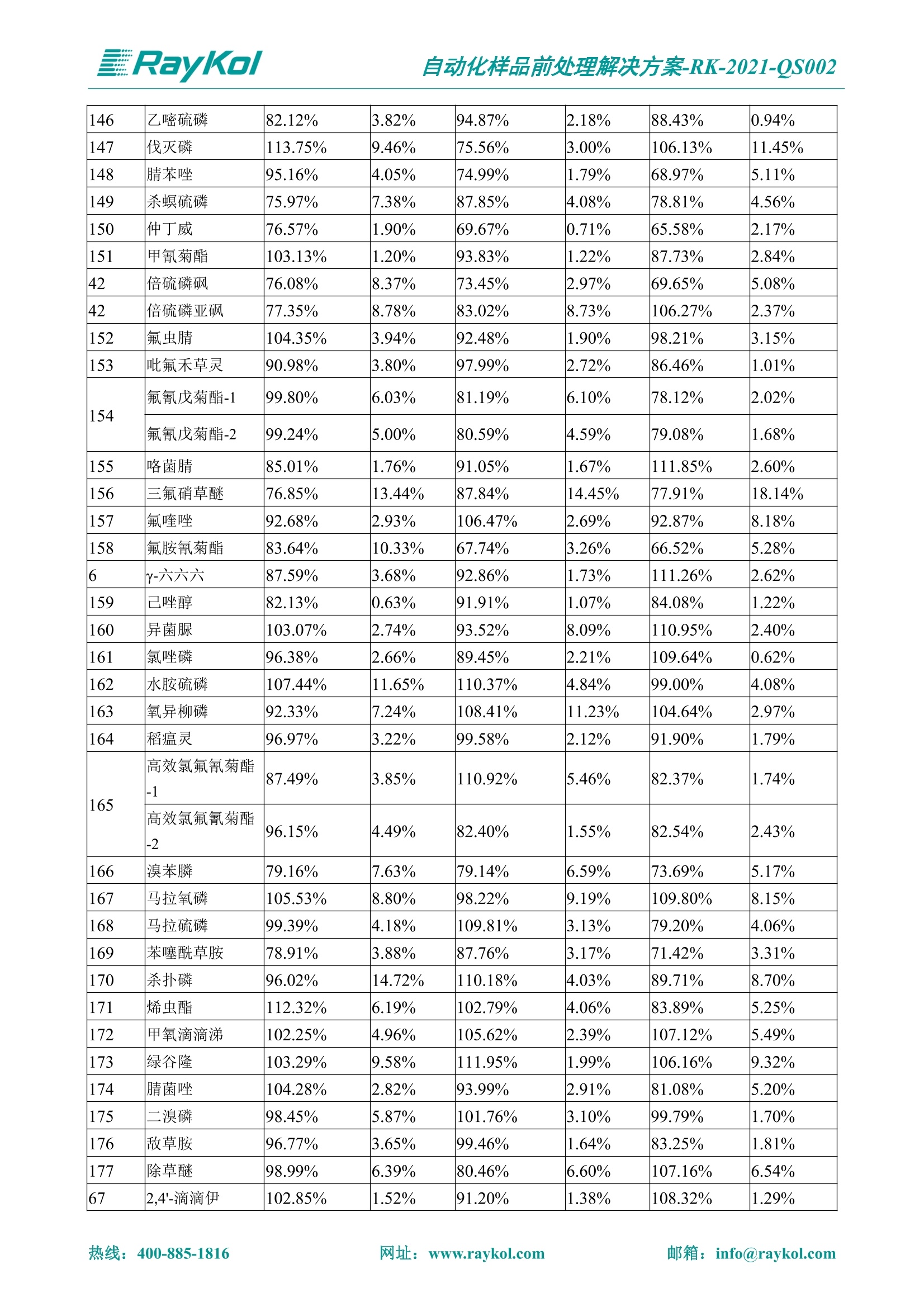
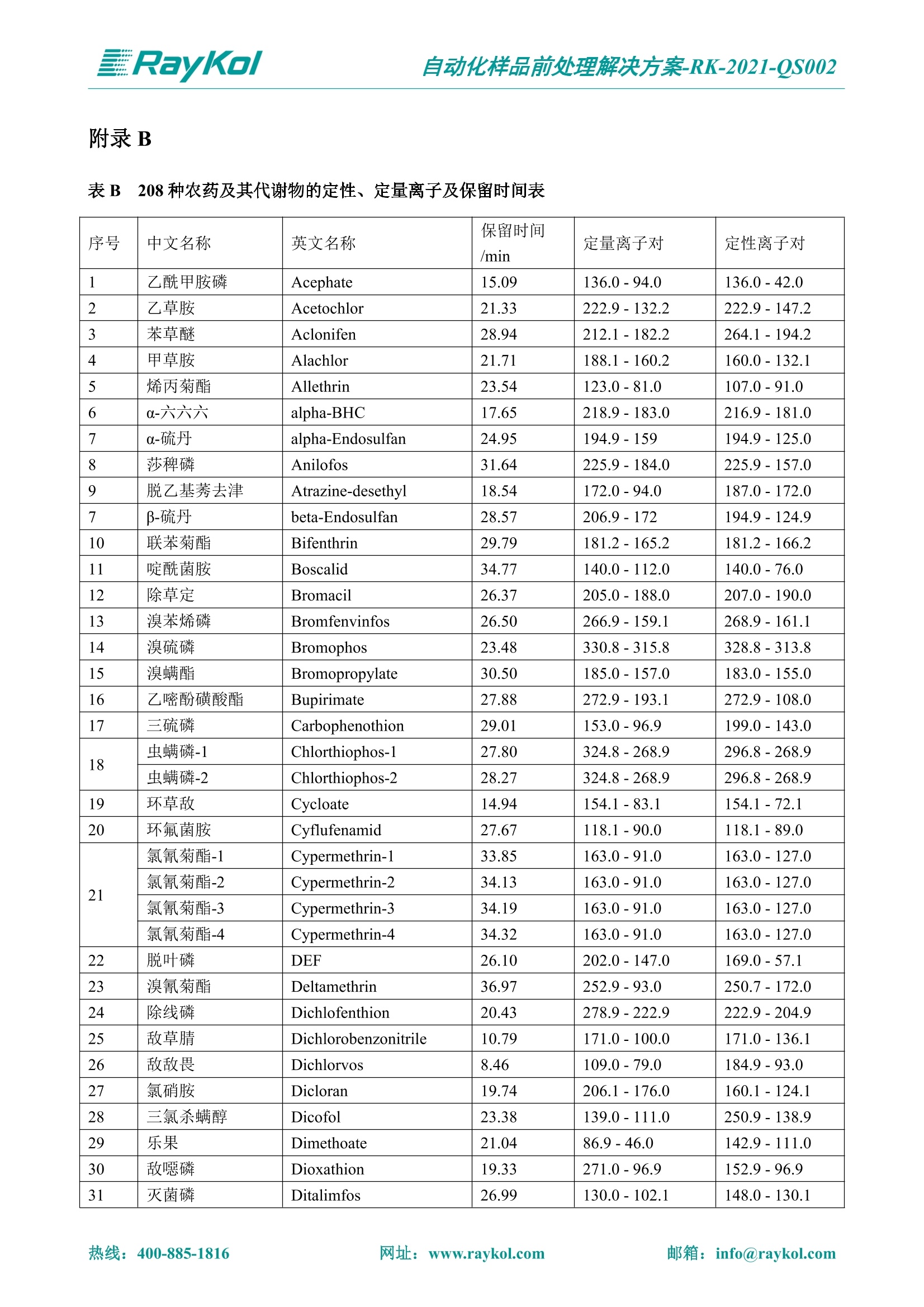
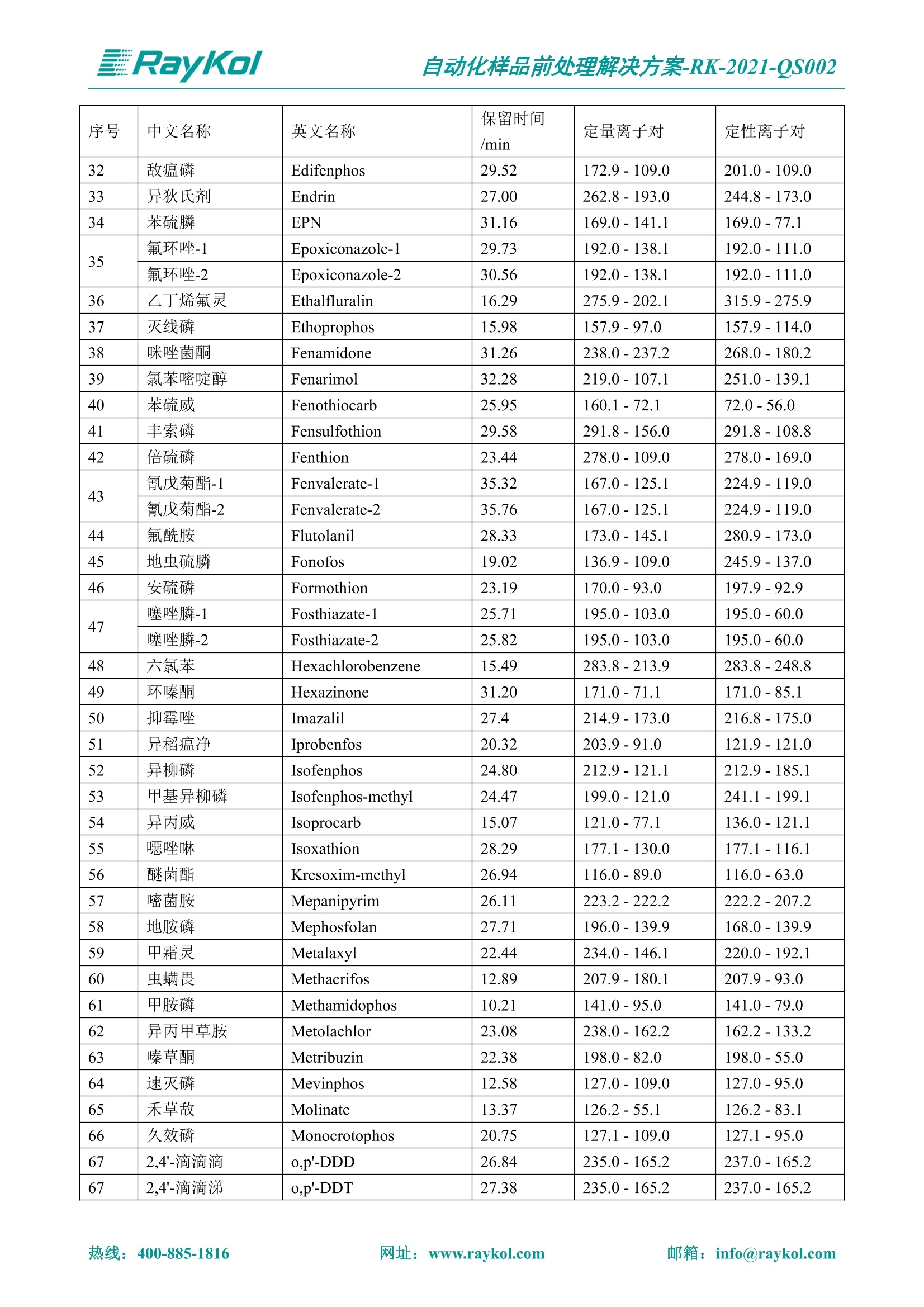
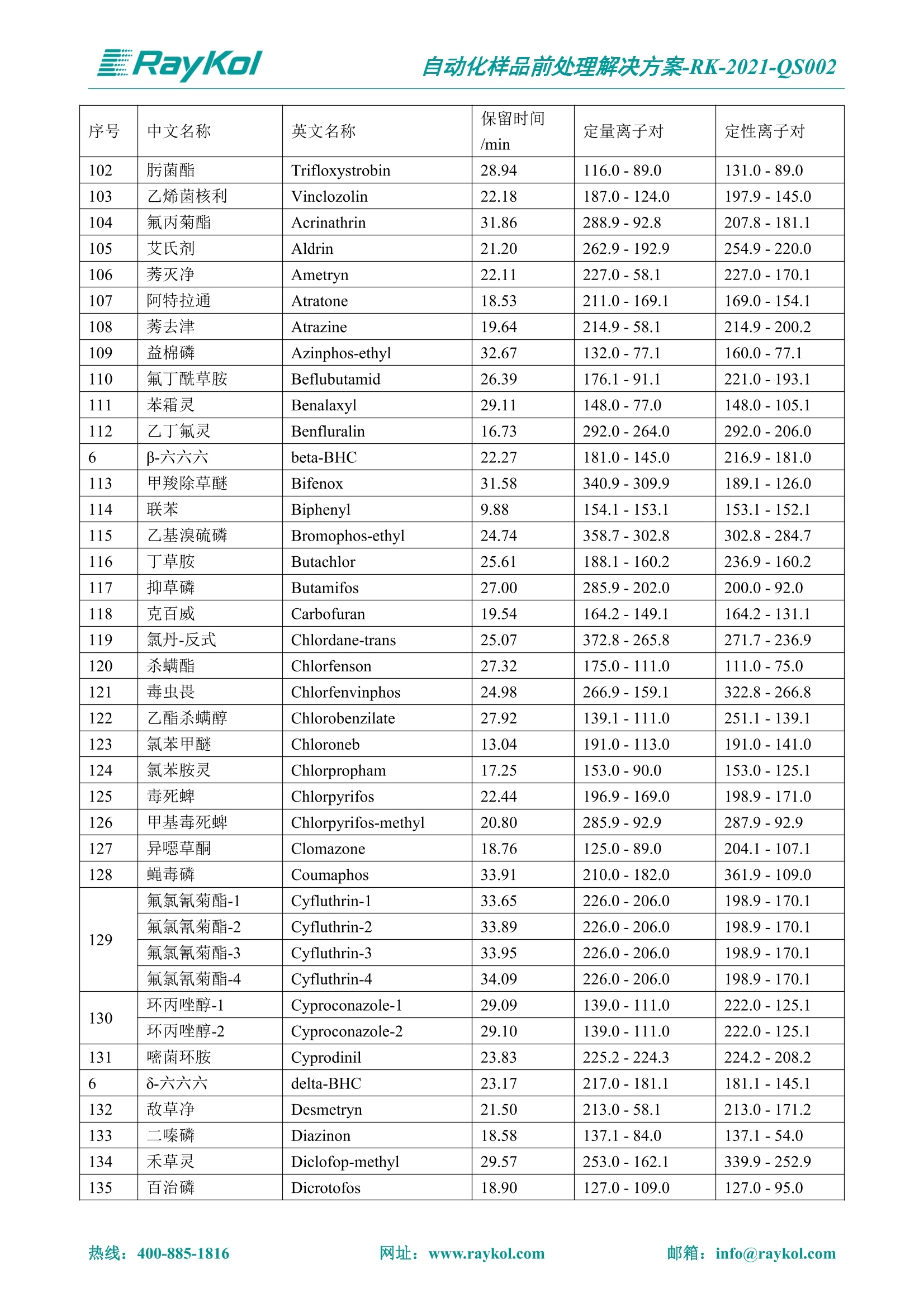
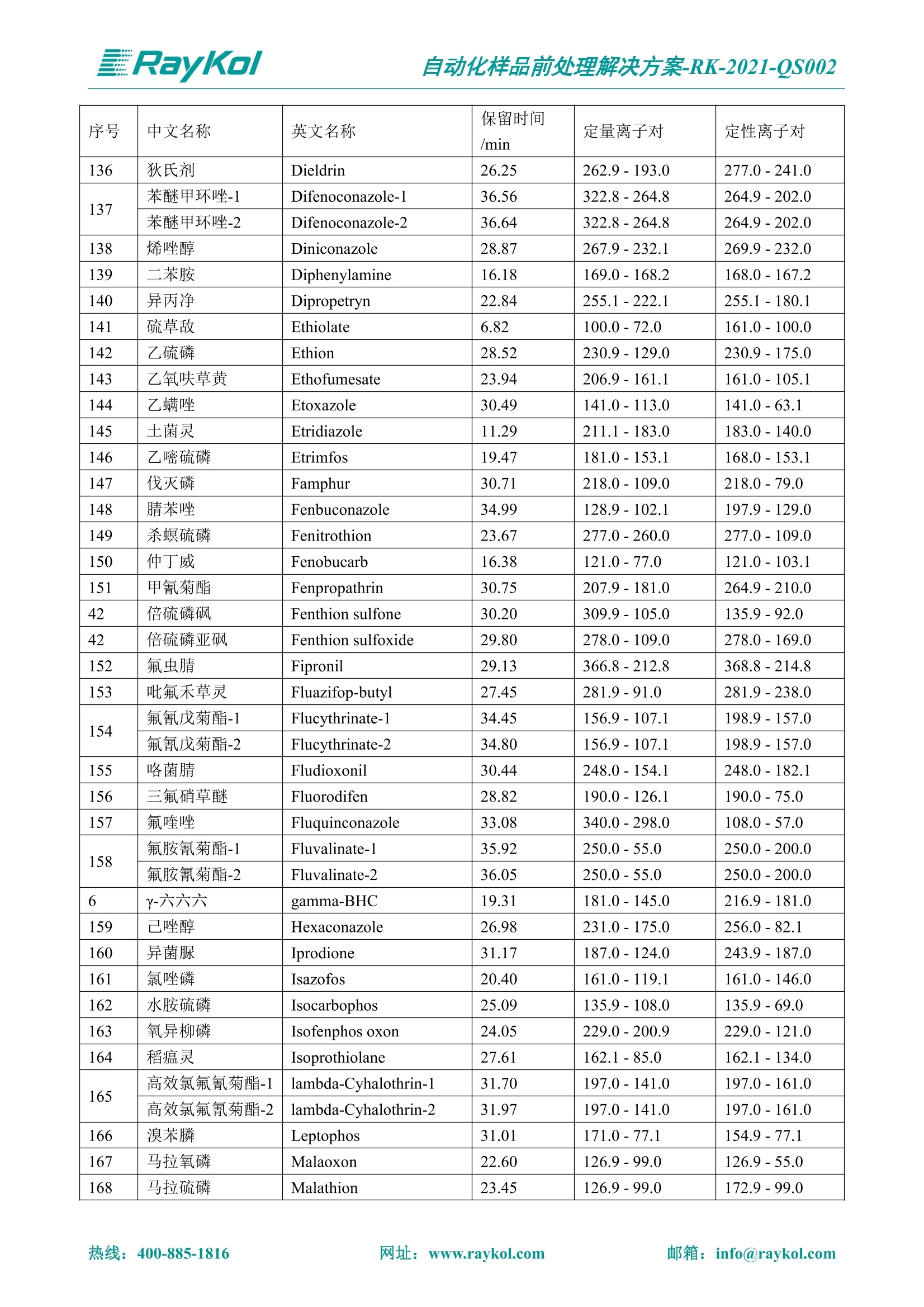
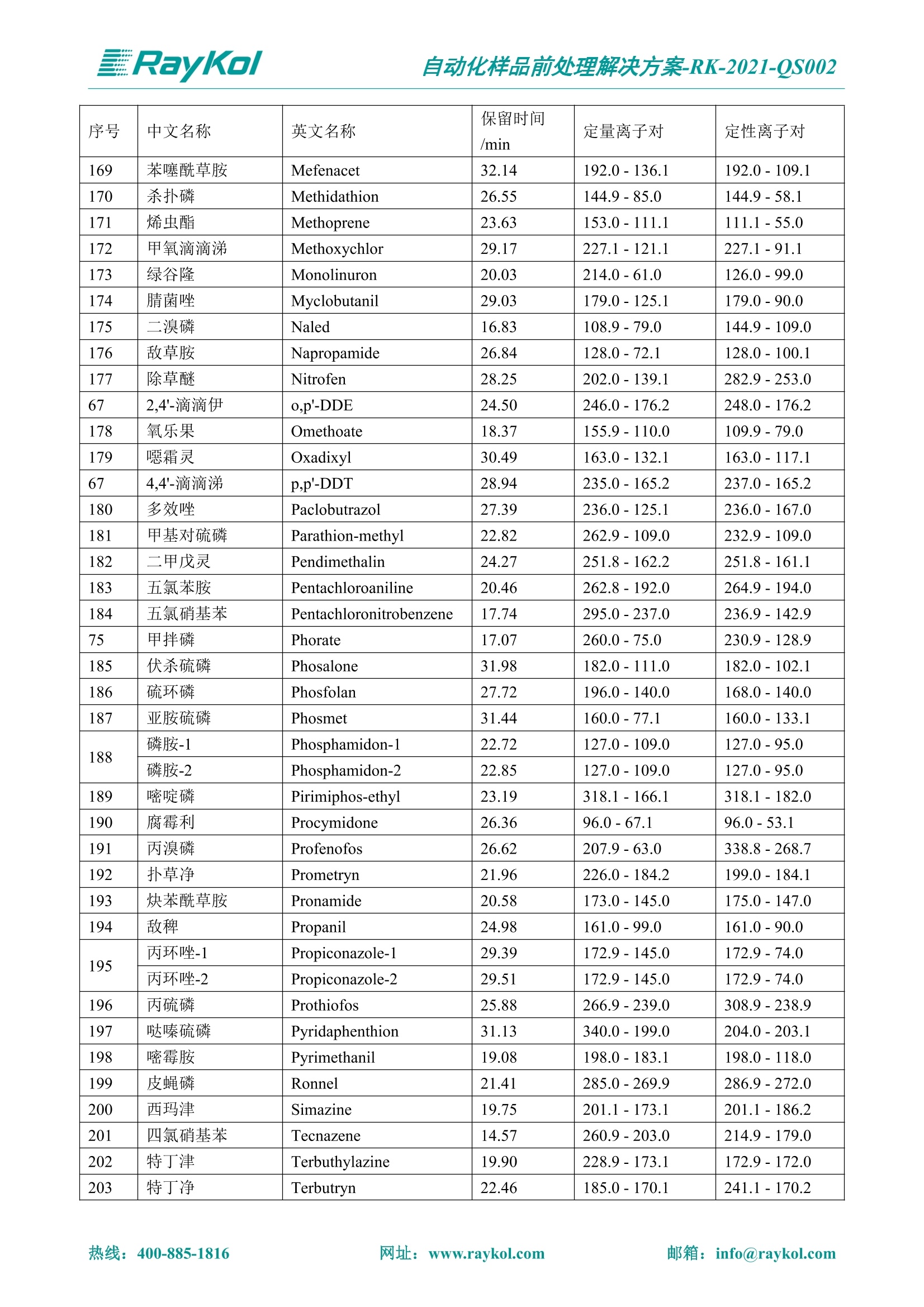
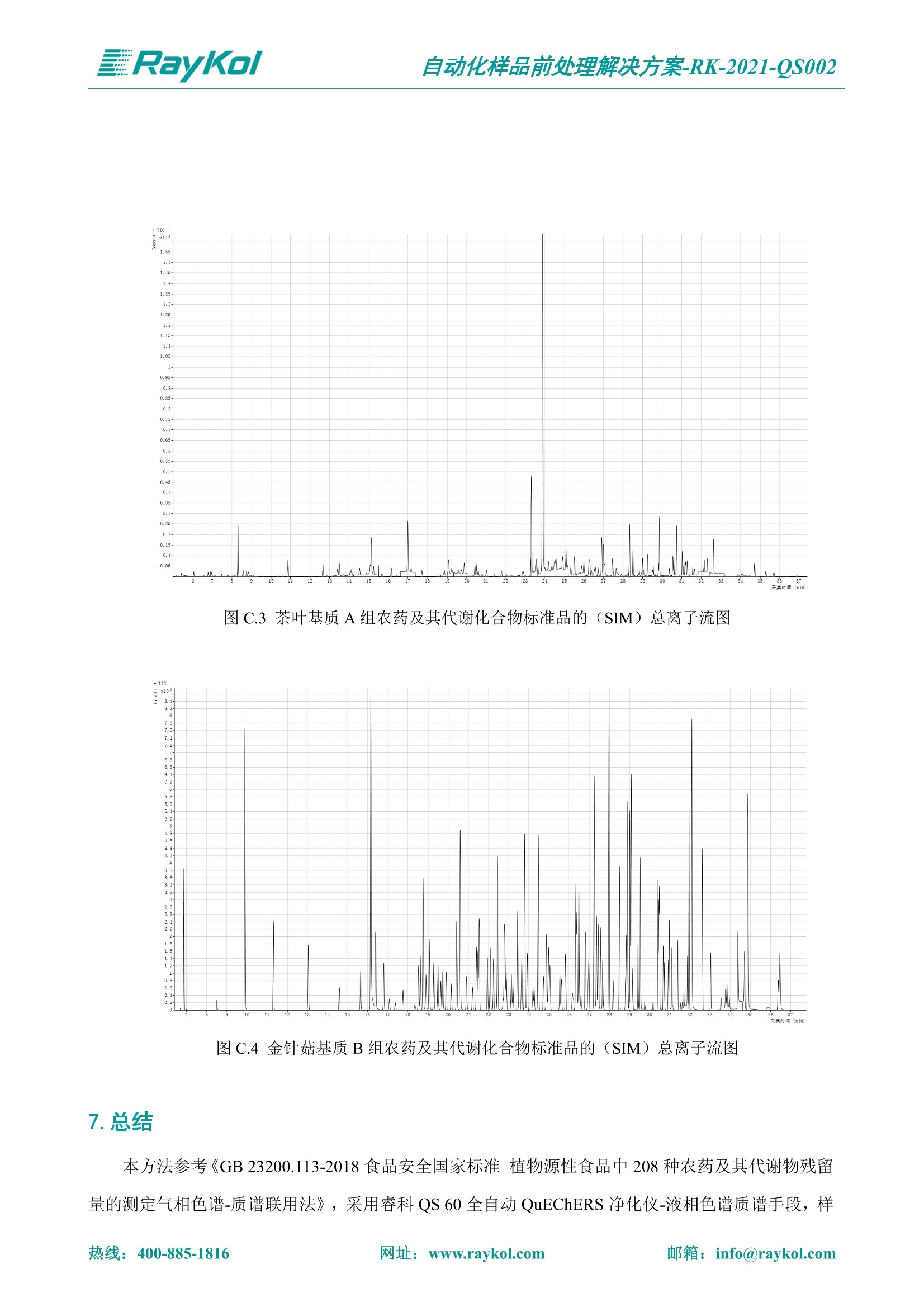
自动化样品前处理解决方案-RK-2021-QS002 Knowledge Optimized Laboratory 解决方案 植物源性食品中多种农药残留量的测定 全自动QuEChERS净化仪; GC-MS/MS;农残 使用乙腈(或酸化乙腈)提取白菜、苹果、菠菜、金针菇、大米和茶叶等基质,经盐析、离心后取上清液,再应用睿科全自动QuEChERS净化仪系统,经由m-PFC(多壁碳纳米管)柱净化,萃取多种农药及其代谢物,洗脱液直接由GC-MS/MS分析检测。 本应用文章参考《GB 23200.113-2018食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》,采用m-PFC(多壁碳纳米管)柱进行萃取和净化,气相色谱-质谱联用技术检测分析,建立了多种植物源性食品基质中对多农残快速且高准确度的前处理和检测分析方法。 1.仪器、试剂以及耗材 仪器 RayKol QS 60 全自动 QuEChERS 净化仪 RayKol Auto Prep 200全自动液体样品处理工作站 RayKol Auto EVA 80高通量全自动平行浓缩仪 GC-MS, Agilent 8890-7000D气相色谱-质谱联用仪 耗材 m-PFC PP净柱柱(多壁碳纳米管):180mg/3mLm-PFC CP 净化柱(多壁碳纳米管):180mg/3mLm-PFC HP净化柱(多壁碳纳米管):180mg/3mL Agilent CP9151 VF-1701MS (30 m x 250 um x 0.25 um) 试剂 乙腈 (HPLC级) 冰醋酸(AR级) 109种A组农药混合标准溶液,113种B组农药基质混合标准工作溶液 2.标准曲线配制 使用 Auto Prep 200 液体样品处理工作站进行农药混合标准工作溶液的配制。将购买的A组农药混标 i(50ug/mL) 通过工作站的有机配液模块进行配制:将昆合标准储备液直接稀释到1 ng/mL中间使用液,再进行质量浓度为0.0 ug/L, 10.0 ug/L, 20.0 ug/L, 50.0ig/L, 100.0ig/L、200.0ng/L的系列基质混合标准工作溶液的配制。具体配制方法如图-1所示。B组农药混标配制方法同上。 序号 命令 源液位 源液浓度 源液体积(mL 目标位 目标浓度 目标体积(mL 溶剂 洗针溶剂 1 直接稀释 D41 50.00| 1.00| D31I 1.00 1.00 2 直接稀释 D31 1.00| 1.00| D21 0.01 1.00| 基质空白液基质空白 3 直接稀释 D31 1.00| 1.00| D22I 0.02 1.00| 基质空白液基质空白 4 直接稀释 D31 1.00| 1.00 D23 0.05| 1.00| 基质空白液基质空白汇 5 直接稀释 D31 1.00 1.00| D24 0.10 1.00| 基质空白液基质空白汁 6 直接稀释 D31 1.00I 1.00| D25 0.20| 1.00| 基质空白液基质空白 7 方法结束 图-1 Auto Prep 200 的农药基质混合标准工作溶液配制方法 3.品制备 3.1白菜、苹果、菠菜、金针菇基质 3.11提取 称取10g试样(精确至0.01g)于50mL塑料离心管中,准确加入10 mL乙腈、4g无水硫酸镁、1g氯化钠、1g柠檬酸钠、0.5g柠檬酸氢二钠及1颗陶瓷均质子,盖上离心管盖,用V12振荡器以 550rpm的速度剧烈震荡 1min,,以4200r/min离心 5min, 取上清液备用。 3.12净化 准确移取1 mL 上清液于 QS 60 的样品盘位中,将PP型号的m-PFC 柱安装在QS 60的柱架上(对于颜色较深的菠菜试样,其所使用的净化柱型号为CP),运行仪器方法(图-2),净化后的样液即可供气质联用仪检测。 3.21提取 称取5g试样(精确至0.01g)于50mL塑料离心管中,加10 mL水涡旋混匀,静置30min。准确加入15 mL乙腈:醋酸溶液(99:1)、6g无水硫酸镁、1.5g醋酸钠及1颗陶瓷均质子,盖上离心管盖,用V12 振荡器以 550rpm 的速度剧烈震荡1min, 以4200r/min 离心 5min, 取上清液备用。 3.22净化 准确移取1mL上清液于 QS 60的样品盘位中,将HF型号的m-PFC 柱安装在 QS 60的柱架上,运行仪器方法(图-2),净化后的样液即可供气质联用仪检测。 3.31提取 称取5g试样(精确至0.01g)于50 mL塑料离心管中,加10 mL水涡旋混匀,静置30min。准确加入15mL乙腈:醋酸溶液(99:1)、6g无水硫酸镁、1.5g醋酸钠及1颗陶瓷均匀子,盖上离心管盖,剧烈震荡1 min 后 4200 r/min 离心5 min, 取上层清液备用。 3.32净化 准确移取1mL上清液于 QS 60 的样品盘位中,将 CP型号的m-PFC柱安装在 QS 60的柱架上,运行仪器方法(图-2),净化后的样液即可供气质联用仪检测。 图-2 QS 60 净化方法 4.气质联用检测条件 样口温度280℃,不分流进样,隔垫吹扫流量为 3mL/min, 进样量1.0 pL;载气为高纯氦气,恒流模式,流速为1.0 mL/min;色谱柱升温程序:初始温度40℃,保持 1 min; 以40℃/min速度升温至120℃;以5℃/min 升温至240℃,以12℃/min升温至300℃,保持6 min。 电子轰击源(EI) 70eV,离子源温度280℃,接口(传输线)温度280℃,溶剂延迟5min; 多反应监测模式检测,208种农其及其代谢物的保留时间、定量离子对、定性离子对以及碰撞电压见附录B。 5.样品测试 5.1基质标准工作曲线 选择定量离子的峰面积作为纵坐标,浓度作为横坐标,做相关曲线,曲线为线性回归,各点权重相等,拟合出工作曲线,线性相关系数 r>0.995;此曲线两周需要重新配置一次。 5.2:基质加标回收实验 选取白菜、苹果、菠菜、金针菇、大米和茶叶六种代表性基质样品,添加高浓度样品、中浓度样品、低浓度样品用 m-PFC 净化柱法进行标回收实验。详细的实验数据见下列附录A各表所示。 6.结果与讨论 6.1加标回收实验结果 选取白菜、苹果、菠菜、金针菇、大米和茶叶六种代表性基质样品作为方法验证的基质 样品,选择高浓度(100 ng/L)、中浓度(40 ug/L)、低浓度(20ug/L)三种浓度,用m-PFC 净化柱法进行试验。对白菜、苹果和金针菇这类含水量大、色素低、含糖量高的简单基质样品,使用 m-PFC 净化柱的方法,加标试验回收率在60.03%~119.98%之间, RSD 在0.04%~18.82%;对于菠菜和茶叶这类含大量色素及干扰物质的复杂基质样品,使用 m-PFC 净化柱的方法,加标试验回收率在61.13%~118.17%之间, RSD 在 0.13%~18.84%;对于大米这类富含淀粉且水分较低的干性基质样品,使用 m-PFC 净化柱的方法,加标试验回收率在62.90%~118.93%之间, RSD 在0.13%~16.05%; 具体的加标回收率及相对标准偏差结果见下表。 表A.1[白菜A、B组农残加标回收率及相对标准偏差结果(n=6) 序号 检测项目 A组加标回收率结果(上机检测浓度) 20 ug/L 40 ug/L 100 ug/L AVG. RSD AVG. RSD AVG. RSD 1 乙酰甲胺磷 84.71% 5.63% 97.71% 3.68% 84.53% 0.57% 2 乙草胺 96.40% 2.37% 94.33% 8.66% 96.01% 3.24% 3 苯草醚 85.53% 2.34% 92.01% 7.33% 98.08% 0.91% 4 甲草胺 94.83% 0.42% 96.68% 8.70% 95.47% 2.44% 5 烯丙菊酯 98.41% 3.27% 70.92% 2.31% 85.17% 1.37% 6 0-六六六 104.89% 7.17% 101.93% 8.14% 102.80% 3.11% 7 α-硫丹 96.65% 3.23% 97.11% 4.91% 99.08% 1.62% 8 莎稗磷 94.69% 0.86% 92.11% 14.62% 87.55% 2.44% 9 脱乙基莠去津 93.96% 8.59% 93.68% 8.73% 91.19% 1.87% 7 β-硫丹 95.58% 1.14% 98.69% 6.11% 96.09% 2.08% 10 联苯菊酯 103.36% 2.87% 102.03% 8.81% 104.91% 2.19% 11 啶酰菌胺 92.65% 3.10% 94.08% 4.89% 94.23% 1.00% 12 除草定 101.08% 6.69% 106.32% 6.35% 104.54% 3.36% 13 溴苯烯磷 98.33% 0.79% 99.73% 3.01% 100.56% 0.99% 14 溴硫磷 95.03% 0.43% 95.83% 3.34% 97.47% 0.91% 15 溴螨酯 97.73% 5.42% 98.91% 11.12% 101.01% 3.30% 16 乙嘧酚磺酸酯 100.81% 2.67% 98.68% 11.27% 102.38% 3.39% 17 三硫磷 97.92% 2.22% 98.47% 6.78% 100.62% 1.49% 18 虫螨磷-1 95.27% 1.51% 99.09% 7.01% 100.76% 2.91% 虫螨磷-2 97.66% 2.30% 93.79% 6.73% 98.23% 2.71% 19 环草敌 86.45% 2.15% 92.17% 3.95% 89.74% 1.60% 20 环氟菌胺 104.13% 2.78% 98.58% 5.82% 101.73% 1.53% 21 氯氰菊酯 103.41% 0.82% 103.58% 7.74% 105.87% 2.03% 97 禾草丹 99.16% 1.80% 98.79% 5.04% 97.41% 1.78% 98 三唑酮 97.25% 4.64% 97.29% 9.19% 96.58% 1.74% 99 三唑醇 93.46% 2.59% 98.21% 12.70% 95.90% 1.95% 100 野麦畏 92.50% 1.18% 96.77% 7.77% 95.31% 3.82% 101 三唑磷 98.25% 2.55% 97.64% 10.66% 98.38% 3.12% 102 肟菌酯 94.02% 6.42% 95.99% 11.90% 99.60% 2.99% 103 乙烯菌核利 101.12% 8.67% 99.68% 10.20% 98.14% 1.67% 表A.2 苹果A、B组农残加标回收率及相对标准偏差结果(n=6) 序号 检测项目 A组加标回收率结果(上机检测浓度) 20 ug/L 40 ug/L 100 ug/L AVG. RSD AVG. RSD AVG. RSD 1 乙酰甲胺磷 92.60% 3.87% 85.16% 3.20% 89.51% 2.00% 2 乙草胺 95.85% 0.61% 96.04% 1.92% 86.88% 0.64% 3 苯草醚 76.64% 1.87% 72.82% 2.05% 92.34% 1.09% 4 甲草胺 97.77% 0.82% 96.88% 1.22% 88.30% 1.00% 5 烯丙菊酯 104.22% 1.73% 98.55% 3.17% 90.76% 1.84% 6 α-六六六 93.77% 4.70% 97.70% 6.03% 90.19% 3.67% 7 α-硫丹 94.70% 1.74% 95.97% 2.39% 89.11% 1.30% 8 莎稗磷 111.78% 2.70% 111.40% 1.08% 93.46% 1.39% 9 脱乙基莠去津 92.88% 3.95% 88.40% 1.50% 87.20% 1.96% 7 β-硫丹 94.96% 0.94% 94.20% 1.50% 84.26% 1.59% 10 联苯菊酯 99.39% 2.56% 97.97% 4.07% 90.66% 1.60% 11 啶酰菌胺 87.11% 3.22% 82.24% 2.88% 88.17% 1.74% 12 除草定 88.58% 5.41% 82.74% 2.96% 81.20% 0.78% 13 溴苯烯磷 89.97% 0.14% 89.33% 3.57% 81.74% 0.71% 14 溴硫磷 92.42% 1.40% 92.21% 1.70% 93.83% 1.30% 15 溴螨酯 98.18% 0.90% 93.54% 2.16% 101.40% 0.86% 16 乙嘧酚磺酸酯 102.38% 1.34% 97.31% 1.75% 94.50% 0.85% 17 三硫磷 89.56% 4.70% 89.00% 3.28% 89.58% 1.79% 18 虫螨磷1 96.28% 6.65% 95.22% 5.22% 90.87% 3.18% 虫螨磷2 92.25% 1.91% 94.42% 2.80% 85.75% 0.94% 19 环草敌 86.67% 1.84% 88.90% 1.67% 93.05% 1.84% 20 环氟菌胺 102.19% 0.92% 101.01% 2.85% 91.72% 1.58% 21 氯氰菊酯 103.12% 1.35% 99.89% 2.62% 80.49% 2.41% 22 脱叶磷 102.28% 3.47% 92.18% 2.30% 87.28% 0.64% 23 溴氰菊酯 118.76% 2.56% 110.05% 3.47% 75.88% 1.35% 24 除线磷 93.89% 1.93% 94.96% 2.37% 72.60% 1.74% 25 敌草腈 77.84% 7.18% 81.14% 3.26% 91.49% 4.26% 206 虫线磷 77.75% 1.51% 83.91% 3.96% 74.35% 2.36% 207 甲基立枯磷 81.95% 3.33% 89.62% 8.18% 82.70% 9.10% 208 毒壤膦 80.21% 3.04% 86.36% 2.49% 80.25% 1.91% 表A.2苹果A、B组农残加标回收率及相对标准偏差结果(n=6) 表A.3 菠菜A、B组农残加标回收率及相对标准偏差结果(n=6) 表A.4金针菇A、B组农残加标回收率及相对标准偏差结果(n=6) 表A.5大米A、B组农残加标回收率及相对标准偏差结果(n=6) 表A.6 茶叶A、B组农残加标回收率及相对标准偏差结果(n=9) 附录B 表B208种农药及其代谢物的定性、定量离子及保留时间表 序号 中文名称 英文名称 保留时间/min 定量离子对 定性离子对 204 杀虫畏 Tetrachlorvinphose 26.18 328.9-109.0 330.9-109.0 205 四氟醚唑 Tetraconazole 25.54 336.0-217.9 336.0-203.8 206 虫线磷 Thionazin 15.55 143.0-79.0 175.0-79.0 207 甲基立枯磷 Tolclofos-methyl 21.55 265.0-250.0 265.0-93.0 208 毒壤膦 Trichloronat 22.78 296.8-268.9 298.8-270.9 附录C 208种农药及其代谢物总离子流图 采集时间(min 图C.1A组农药及其代谢化合物标准品的(SIM)总离子流图 图 C.2B组农药及其代谢化合物标准品的(SIM)总离子流图 图C.3茶叶基质A组农药及其代谢化合物标准品的(SIM)总离子流图 图 C.4金针菇基质B组农药及其代谢化合物标准品的(SIM)总离子流图 7.总结 本方法参考《GB 23200.113-2018食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》,采用睿科 QS 60全自动 QuEChERS 净化仪-液相色谱质谱手段,样 品经乙腈提取、盐析萃取和 m-PFC 净化后直接上机分析检测,应注意的是前处理过程中需要准确添加乙腈的提取体积,否则会造成回收率结果不佳。在 m-PFC 净化柱洗脱过程中控制液体过柱流速在1滴/min为宜,流速过快易造成杂质没有被吸附于小柱上而被收集。 基质会对化合物进行增强或者抑制,因此需要使用对应的基质混合标准工作溶液进行定量;在多基质样品加标回收实验中,选取有代表性的基质进行实验。 在使用新的衬管时,如出现响应变低甚至骤降的情况,可先将混合标液的进行多次检测,使石英棉达到饱和后再进行样品的测定。对于较复杂的基质,如菠菜、茶叶等可能出现保留时间延迟的情况,可在下一个扫描时间段里加上保留时间延迟的目标物再进行分析检测,或使用动态 MRM 的模式进行检测分析。 全自动 QuEChERS 净化仪 净化 全自动平行浓缩仪浓缩 全自动液体样品处理工作站标曲配制 Raykol 睿科集团股份有限公司 RayKol Group Corp.,Ltd. 网址: www.raykol.com 电话:400-885-1816 邮箱: info@raykol.com 本文中的信息、说明和技术指标如有变更,恕不另行通知◎睿科集团股份有限公司 2021年9月版 热线:箱: info@raykol.com网址:www.raykol.com 热线:箱: info@raykol.com网址:www.raykol.com 使用乙腈(或酸化乙腈)提取白菜、苹果、菠菜、金针菇、大米和茶叶等基质,经盐析、离心后取上清液,再应用睿科全自动QuEChERS净化仪系统,经由m-PFC(多壁碳纳米管)柱净化,萃取多种农药及其代谢物,洗脱液直接由GC-MS/MS分析检测。本应用文章参考《GB 23200.113-2018食品安全国家标准 植物源性食品中208种农药及其代谢物残留量的测定 气相色谱-质谱联用法》,采用m-PFC(多壁碳纳米管)柱进行萃取和净化,气相色谱-质谱联用技术检测分析,建立了多种植物源性食品基质中对多农残快速且高准确度的前处理和检测分析方法。关键字:关键字:全自动QuEChERS净化仪;GC-MS/MS;农残
确定





















还剩51页未读,是否继续阅读?
睿科集团股份有限公司为您提供《植物源性食品中多种农药残留量检测方案(其它萃取设备)》,该方案主要用于蔬菜中农药残留检测,参考标准--,《植物源性食品中多种农药残留量检测方案(其它萃取设备)》用到的仪器有睿科 Auto Prep 200全自动液体样品处理工作站
推荐专场
相关方案
更多
该厂商其他方案
更多















