方案详情
文
本文建立了HPLC-UV-CAD 方法,对注射用头孢吡肟的仿制药物从杂质谱和辅料等方面进行了一致性评价初探。在UV 检测基础上,采用通用型的电雾式检测器(CAD),结合混合基质柱Trinity-P1,通过调整有机相、盐浓度等,建立了辅料精氨酸的测定方法,并可同时对药物主成分和成盐离子完成测定。通过辅料、主成分、成盐离子比例,以及杂
质谱综合评价仿制药一致性。
方案详情

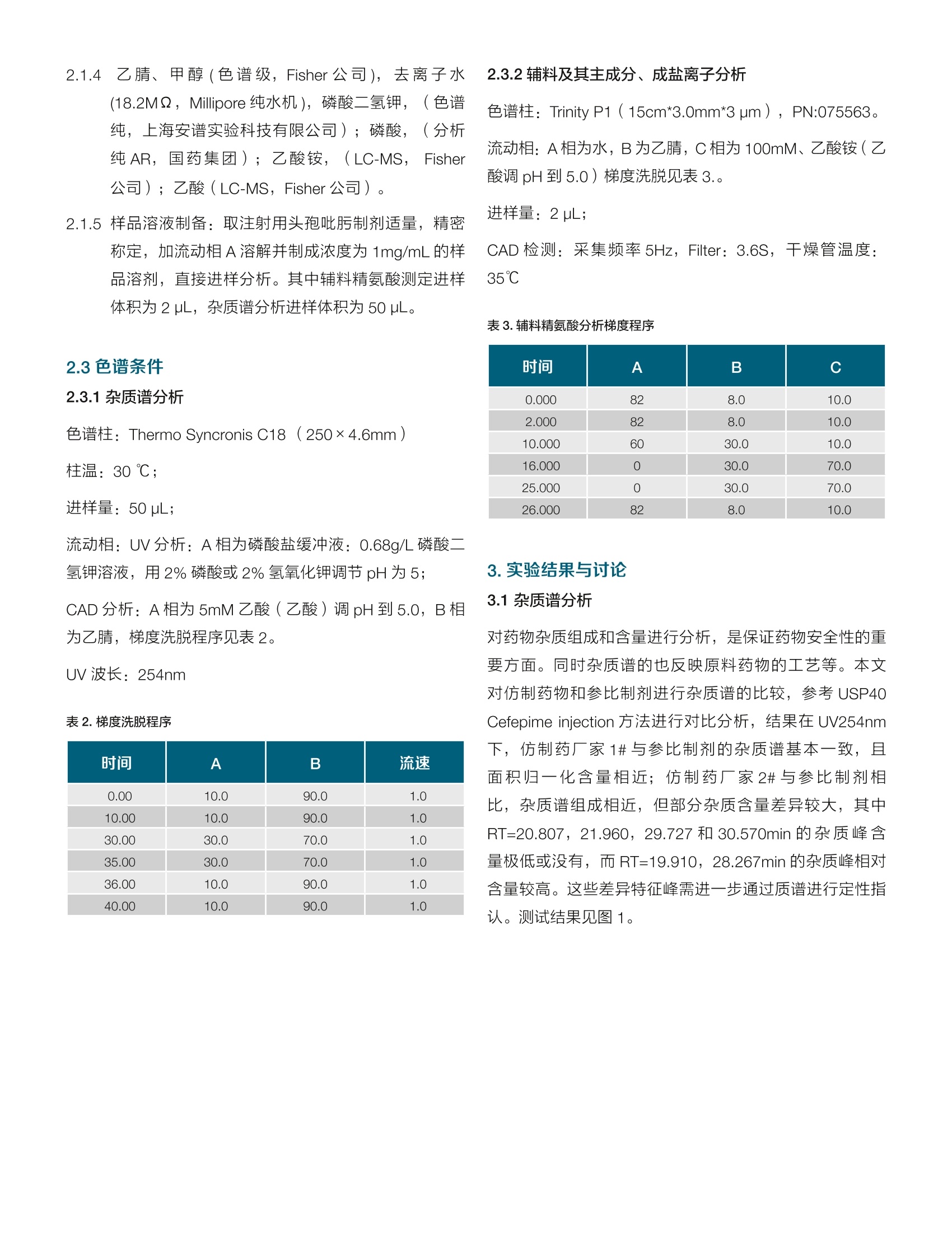
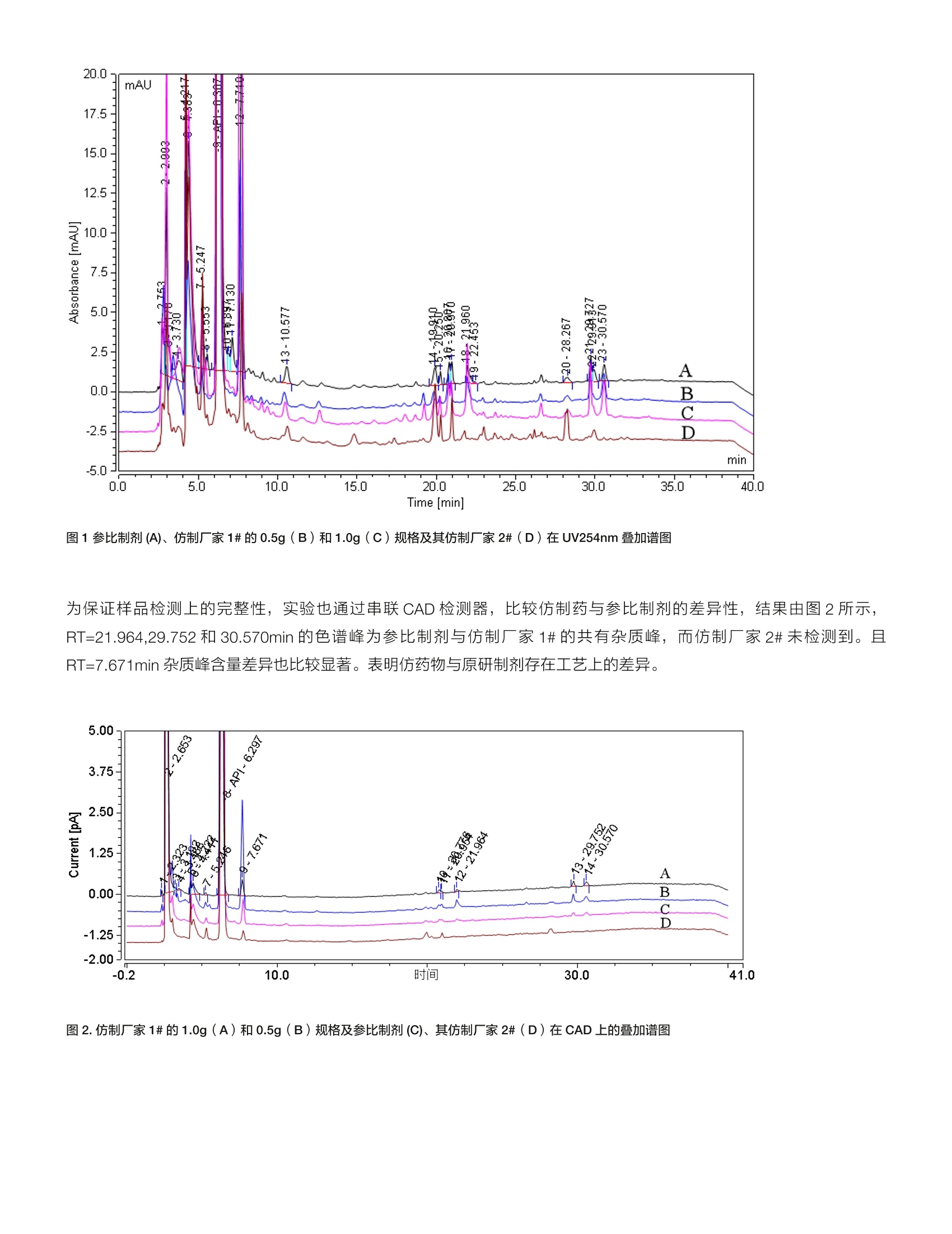
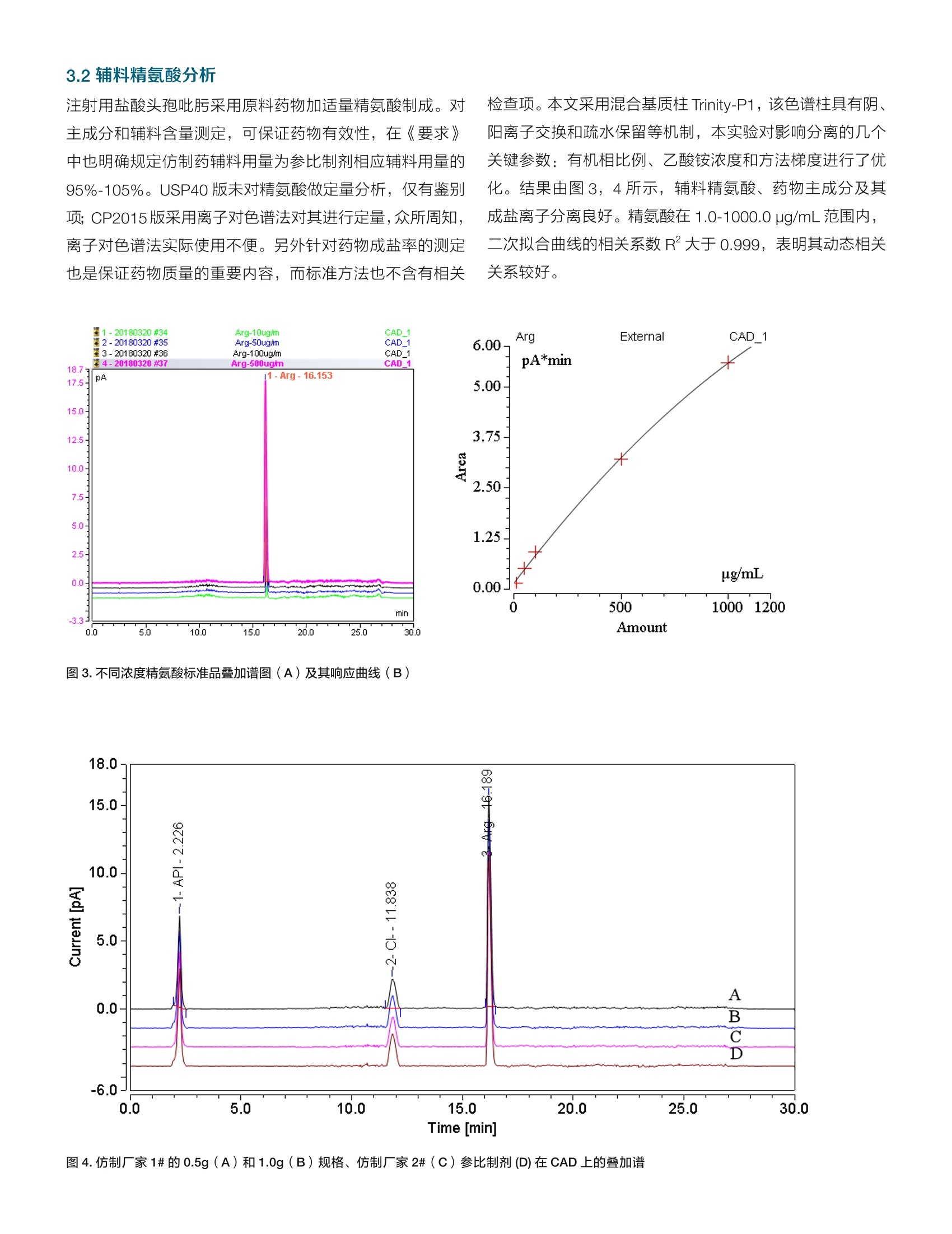
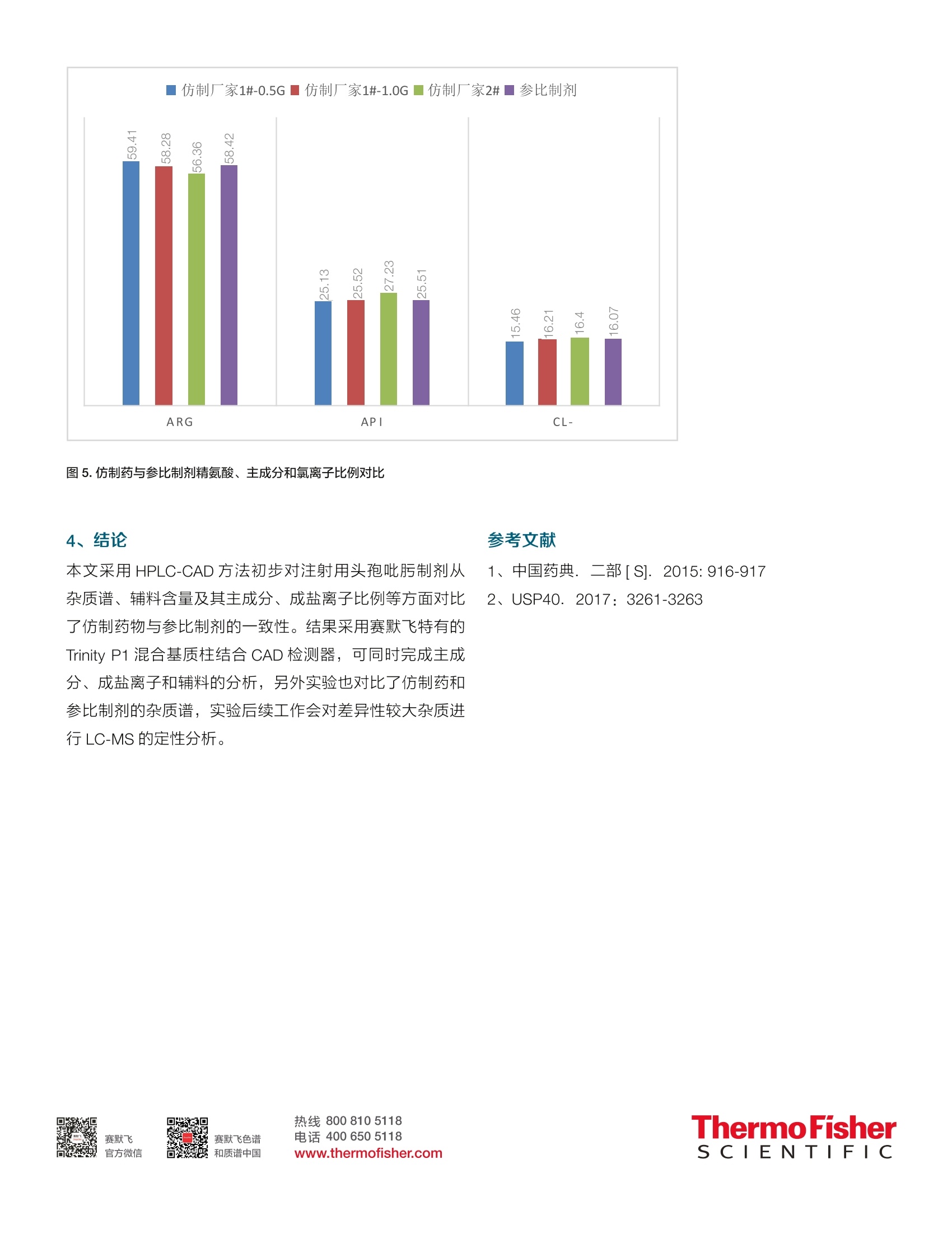
thermoscientific 3.2辅料精氨酸分析热线8008105118电话4006505118www.thermofisher.com HPLC-UV-CAD 在注射用头孢吡肟一致性评价中的应用 张艳海3金燕 赛默飞世尔科技(中国)有限公司色谱质谱部 本文建立了HPLC-UV-CAD 方法,对注射用头孢吡肟的仿制药物从杂质谱和辅料等方面进行了一致性评价初探。在UV 检测基础上,采用通用型的电雾式检测器(CAD),结合混合基质柱 Trinity-P1,通过调整有机相、盐浓度等,建立了辅料精氨酸的测定方法,并可同时对药物主成分和成盐离子完成测定。通过辅料、主成分、成盐离子比例,以及杂质谱综合评价仿制药一致性。 关键词 电喷雾检测器,注射剂,一致性评价,辅料,成盐离子 1.引言 注射剂是指药物制成的供注入体内的无菌溶液(包括乳浊液和混悬液)以及供临用前配成溶液或混悬液的无菌粉末或浓溶液。由于其给药途径的特殊性,使其用药安全风险要高于其他普通口服制剂,据统计,国内注射剂的使用率远高于其他发达国家,高达65%,临床风险较高。继2013年2月CFDA 发布《关于开展仿制药质量一致性评价工作的通知》之后, CDE 在2017年12月发布了《关于开展仿制药质量一致性评价工作的通知》和《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》(以下简称《要求》),以推进注射剂一致性评价工作。 本文按照《要求》,采用高效液相色谱-电雾式检测器(HPLC-CAD)法,从辅料精氨酸的含量、主成分及其成盐离子比例,以及杂质谱对比分析,对注射用头孢吡污进行了分析,初步评价了仿制药物与原研药物的一致性。 2.实验部分 2.1仪器与试剂 ( 2.1.1 1 T hermo UltiMate3000 高效液相色谱仪 ChromeleonM Chromatography Data System,变色龙色谱软件, 版本7.2 SR6 ) ( 2.1. 2 Corona CAD VEO 电雾式检测器, ) ( 2.1.3注用用头孢吡肟: 参比制剂, Hopira,批号:144H004;仿制厂家1#,规格:0.5g和1g,批号分 别为:012270702,010270701;仿制厂家2#,规格: 1.0g,批号: 6 F03898 ) 2.1.4 乙腈、甲醇(色谱级, Fisher 公司),去离子水(18.2M,Millipore纯水机),磷酸二氢钾, (色谱纯,上海安谱实验科技有限公司);磷酸, (分析纯AR,国药集团);乙酸铵, (LC-MS, Fisher公司);乙酸(LC-MS, Fisher 公司)。 2.1.5样品溶液制备:取注射用头孢吡肟制剂适量,精密称定,加流动相A溶解并制成浓度为 1mg/mL的样品溶剂,直接进样分析。其中辅料精氨酸测定进样体积为2uL,杂质谱分析进样体积为 50 uL。 2.3色谱条件 2.3.1杂质谱分析 色谱柱: Thermo Syncronis C18 (250×4.6mm) 柱温:30℃; 进样量:50uL; 流动相:UV分析:A相为磷酸盐缓冲液:0.68g/L磷酸二氢钾溶液,用2%磷酸或2%氢氧化钾调节 pH 为5; CAD分析:A相为5mM乙酸(乙酸)调 pH到5.0,B相为乙腈,梯度洗脱程序见表2。 UV 波长:254nm 表2.梯度洗脱程序 时间 A B 流速 0.00 10.0 90.0 1.0 10.00 10.0 90.0 1.0 30.00 30.0 70.0 1.0 35.00 30.0 70.0 1.0 36.00 10.0 90.0 1.0 40.00 10.0 90.0 1.0 2.3.2辅料及其主成分、成盐离子分析 色谱柱: Trinity P1(15cm*3.0mm*3um), PN:075563。 流动相:A相为水,B为乙腈,C相为100mM、乙酸铵(乙酸调 pH到5.0)梯度洗脱见表3.。 进样量:2pL; CAD检测:采集频率5Hz, Filter: 3.6S,干燥管温度:35℃ 表3.辅料精氨酸分析梯度程序 时间 A B C 0.000 82 8.0 10.0 2.000 82 8.0 10.0 10.000 60 30.0 10.0 16.000 30.0 70.0 25.000 30.0 70.0 26.000 82 8.0 10.0 3.实验结果与讨论 3.1杂质谱分析 对药物杂质组成和含量进行分析,是保证药物安全性的重要方面。同时杂质谱的也反映原料药物的工艺等。本文对仿制药物和参比制剂进行杂质谱的比较,参考 USP40Cefepime injection 方法进行对比分析,结果在UV254nm下,仿制药厂家1#与参比制剂的杂质谱基本一致,且面积归一化含量相近;仿制药厂家2#与参比制剂相比,杂质谱组成相近,但部分杂质含量差异较大,其中RT=20.807, 21.960,29.727 和 30.570min 的杂质峰含量极低或没有,而RT=19.910,28.267min 的杂质峰相对含量较高。这些差异特征峰需进一步通过质谱进行定性指认。测试结果见图1。 图1参比制剂(A)、仿制厂家1#的0.5g(B)和1.0g(C)规格及其仿制厂家2#(D) 在 UV254nm 叠加谱图 为保证样品检测上的完整性,实验也通过串联 CAD 检测器,比较仿制药与参比制剂的差异性,结果由图2所示,RT=21.964,29.752和30.570min 的色谱峰为参比制剂与仿制厂家1#的共有杂质峰,而仿制厂家2#未检测到。且RT=7.671min 杂质峰含量差异也比较显著。表明仿药物与原研制剂存在工艺上的差异。 图2.仿制厂家1#的1.0g(A)和0.5g(B)规格及参比制剂(C)、其仿制厂家2#(D) 在 CAD 上的叠加谱图 注射用盐酸头孢吡肟采用原料药物加适量精氨酸制成。对主成分和辅料含量测定,可保证药物有效性,在《要求》中也明确规定仿制药辅料用量为参比制剂相应辅料用量的95%-105%。USP40 版未对精氨酸做定量分析,仅有鉴别项; CP2015版采用离子对色谱法对其进行定量,众所周知,离子对色谱法实际使用不便。另外针对药物成盐率的测定也是保证药物质量的重要内容,而标准方法也不含有相关 检查项。本文采用混合基质柱 Trinity-P1, 该色谱柱具有阴、阳离子交换和疏水保留等机制,本实验对影响分离的几个关键参数:有机相比例、乙酸铵浓度和方法梯度进行了优化。结果由图3,4所示,辅料精氨酸、药物主成分及其成盐离子分离良好。精氨酸在1.0-1000.0 pg/mL范围内,二次拟合曲线的相关系数 R²大于0.999,表明其动态相关关系较好。 图3.不同浓度精氨酸标准品叠加谱图(A)及其响应曲线(B) 图4.仿制厂家1#的0.5g(A)和1.0g(B)规格、仿制厂家2#(C)参比制剂(D) 在 CAD上的叠加谱 ( 参考文献 ) ( 1、 、中国药典. . . 二部[S].2 0 15:916-917 2、 U SP40. 2 017:3261-3263 ) 对药物杂质组成和含量进行分析,是保证药物安全性的重要方面。同时杂质谱的也反映原料药物的工艺等。本文对仿制药物和参比制剂进行杂质谱的比较,参考USP40Cefepime injection 方法进行对比分析,结果在UV254nm下,仿制药厂家1# 与参比制剂的杂质谱基本一致,且面积归一化含量相近; 仿制药厂家2# 与参比制剂相比,杂质谱组成相近,但部分杂质含量差异较大,其中RT=20.807,21.960,29.727 和30.570min 的杂质峰含量极低或没有,而RT=19.910,28.267min 的杂质峰相对含量较高。这些差异特征峰需进一步通过质谱进行定性指认。本文采用HPLC-CAD 方法初步对注射用头孢吡肟制剂从杂质谱、辅料含量及其主成分、成盐离子比例等方面对比了仿制药物与参比制剂的一致性。结果采用赛默飞特有的Trinity P1 混合基质柱结合CAD 检测器,可同时完成主成分、成盐离子和辅料的分析,另外实验也对比了仿制药和参比制剂的杂质谱,实验后续工作会对差异性较大杂质进行LC-MS 的定性分析。
确定

还剩3页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《注射用头孢吡肟中含量检测方案(液相色谱仪)》,该方案主要用于化药制剂中含量测定检测,参考标准--,《注射用头孢吡肟中含量检测方案(液相色谱仪)》用到的仪器有赛默飞钛系统高效液相-Ultimate Ti、赛默飞Corona CAD电喷雾检测器、Chromeleon® 变色龙7色谱数据系统
推荐专场
相关方案
更多
该厂商其他方案
更多