方案详情
文
我们按照2020版 《中国药典》和EP方法,对盐酸利多卡因注射剂及其杂质2,6-二甲基苯胺、2,6-二甲基氯代乙酰苯胺进行分析,希望能够解决主成分与杂质分离效果差和拖尾的问题。
方案详情

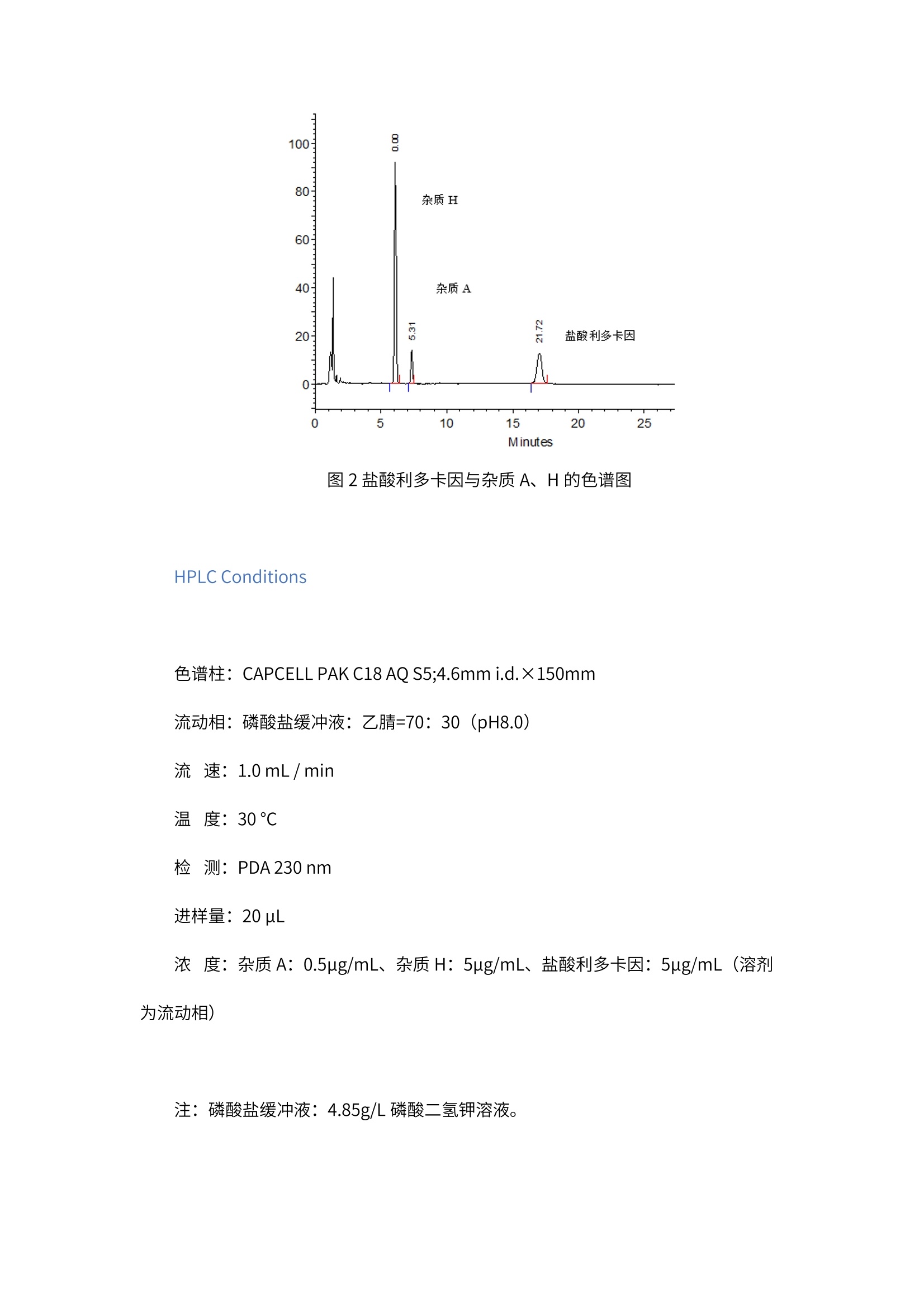
2020版 《中国药典》盐酸利多卡因注射剂有关物质的分析 盐酸利多卡因是局麻醉、抗心律失常药物,属于酰胺类化合物,这类物质在 C18色谱柱分析过程中容易出现拖尾的问题。 我们按照2020版 《中国药典》和EP方法,对盐酸利多卡因注射剂及其杂质2,6-二甲基苯胺、2,6-二甲基氯代乙酰苯胺进行分析,希望能够解决主成分与杂质分离效果差和拖尾的问题。 常规硅胶系色谱柱,由于受到硅胶基材表面残留硅醇基和金属杂质的影响,在分析碱性化合物时普遍易出现色谱峰拖尾的现象。 CAPCELL PAK 色谱柱凭借填料表面致密的聚合物包被来抑制硅胶基材的影响,因此能得到对称性良好的色谱峰。 我们使用经过包膜处理的 CAPCELL PAK C18 AQ S5 柱,很好地解决了盐酸利多卡因拖尾的问题;同时主峰与杂质的分离也满足要求。 2020版《中国药典》方法 系统适用性要求:盐酸利多卡因与杂质2,6-二甲基苯分离度满足要求,理论塔板数不低于2000。 按照2020 版 《中国药典》的要求,选择经过包膜处理的 CAPCELL PAK C18 AQ S5 柱,盐酸利多卡因峰形良好;同时2,6-二甲基苯胺与利多卡因分离度16.49,满足基线分离要求。 图1盐酸利多卡因与2,6-二甲基苯胺的色谱图 HPLC Conditions 色谱柱: CAPCELL PAK C18 AQ S5;4.6mmi.d.×250mm 流动相:磷酸盐缓冲液:乙腈=50: 50 (pH8.0) 流速:1.0mL/min 温度:30℃ 检测: PDA230 nm 进井量: 20uL 浓度:盐酸利多卡因样品2mg/mL、系统适用性溶液: 50 ug/mL(溶剂为流动相) 注:磷酸盐缓冲液:1mol/L磷酸二氢钠溶液1.3mL, 0.5mol/L 磷酸二氢钠32.5mL,用水稀释至1000mL,摇匀。 EP 9.0方法 推荐色谱柱: CAPCELL PAK C18 AQ S5 目前,EP没有盐酸利多卡因注射剂的相关规定,因此我们参考了EP 中盐酸利多卡因的检测方法。 系统适用性要求:主峰(盐酸利多卡因)保留时间约为17min, 杂质A(2,6-二甲基苯胺)与主峰的相对保留时间约为0.4,杂质H(2,6-二甲基氯代乙酰苯胺)与主峰的相对保留时间约为0.37,杂质A与杂质H的分离度不小于1.5。 按照 EP 9.0的检测方法,对杂质A、H以及盐酸利多卡因混合标准品进行分析,结果如图2所示,杂质H保留时间6.098min, 杂质A保留时间 7.357min, 杂质A、H分离度为5.31,满足二者分离度大于1.5的标准要求。 图2盐酸利多卡因与杂质A、H的色谱图 HPLC Conditions 色谱柱: CAPCELL PAK C18 AQ S5;4.6mmi.d.×150mm 流动相:磷酸盐缓冲液:乙腈=70:30 (pH8.0) 流速:1.0mL/min 温度:30℃ 检测:PDA230nm 进样量:20uL 浓度:杂质A: 0.5ug/mL、杂质H: 5ug/mL、盐酸利多卡因: 5ug/mL(溶剂为流动相) 注:磷酸盐缓冲液: 4.85g/L磷酸二氢钾溶液。 2020版《中国药典》方法 推荐色谱柱: CAPCELL PAK C18 AQ S5 系统适用性要求:盐酸利多卡因与杂质2,6-二甲基苯分离度满足要求,理论塔板数不低于2000。 按照2020版 《中国药典》的要求,选择经过包膜处理的CAPCELL PAK C18 AQ S5 柱,盐酸利多卡因峰形良好;同时2,6-二甲基苯胺与利多卡因分离度16.49,满足基线分离要求。 图1 盐酸利多卡因与2,6-二甲基苯胺的色谱图 HPLC Conditions 色谱柱:CAPCELL PAK C18 AQ S5;4.6mm i.d.×250mm流动相:磷酸盐缓冲液:乙腈=50:50(pH8.0)流 速:1.0 mL / min温 度:30 °C检 测:PDA 230 nm进样量:20 µL浓 度:盐酸利多卡因样品2mg/mL、系统适用性溶液:50 µg/mL(溶剂为流动相) 注:磷酸盐缓冲液:1mol/L磷酸二氢钠溶液1.3mL,0.5mol/L磷酸二氢钠32.5 mL,用水稀释至1000 mL,摇匀。 EP 9.0方法 推荐色谱柱:CAPCELL PAK C18 AQ S5 目前,EP没有盐酸利多卡因注射剂的相关规定,因此我们参考了EP中盐酸利多卡因的检测方法。 系统适用性要求:主峰(盐酸利多卡因)保留时间约为17min,杂质A(2,6-二甲基苯胺)与主峰的相对保留时间约为0.4,杂质H(2,6-二甲基氯代乙酰苯胺)与主峰的相对保留时间约为0.37,杂质A与杂质H的分离度不小于1.5。 按照EP 9.0的检测方法,对杂质A、H以及盐酸利多卡因混合标准品进行分析,结果如图2所示,杂质H保留时间6.098min,杂质A保留时间7.357min,杂质A、H分离度为5.31,满足二者分离度大于1.5的标准要求。图2 盐酸利多卡因与杂质A、H的色谱图 HPLC Conditions 色谱柱:CAPCELL PAK C18 AQ S5;4.6mm i.d.×150mm流动相:磷酸盐缓冲液:乙腈=70:30(pH8.0)流 速:1.0 mL / min温 度:30 °C检 测:PDA 230 nm进样量:20 µL浓 度:杂质A:0.5µg/mL、杂质H:5µg/mL、盐酸利多卡因:5µg/mL(溶剂为流动相) 注:磷酸盐缓冲液:4.85g/L磷酸二氢钾溶液。
确定



还剩2页未读,是否继续阅读?
三耀精细化工品销售(北京)有限公司为您提供《盐酸利多卡因注射剂中杂质检测方案 》,该方案主要用于化药制剂中特殊物质和基团检测,参考标准--,《盐酸利多卡因注射剂中杂质检测方案 》用到的仪器有CAPCELL PAK AQ C18(ODS)柱
相关方案
更多
该厂商其他方案
更多










