方案详情
文
稻米作为世界上最主要的粮食作物,具有适应性强、产量高、经济效益高的特点。其品质不仅受自身遗传因子的影响,还与环境因素有关。由于我国稻米种植区域广,品种多,一些不法商贩在利益的驱动下,将普通大米伪装成优质大米出售,以次充好,严重损害了消费者权益。因此为了规范市场秩序,保护消费者权益,亟需研究开发一种能够对稻米品种及产地进行高效、可靠鉴别的溯源方法。
方案详情

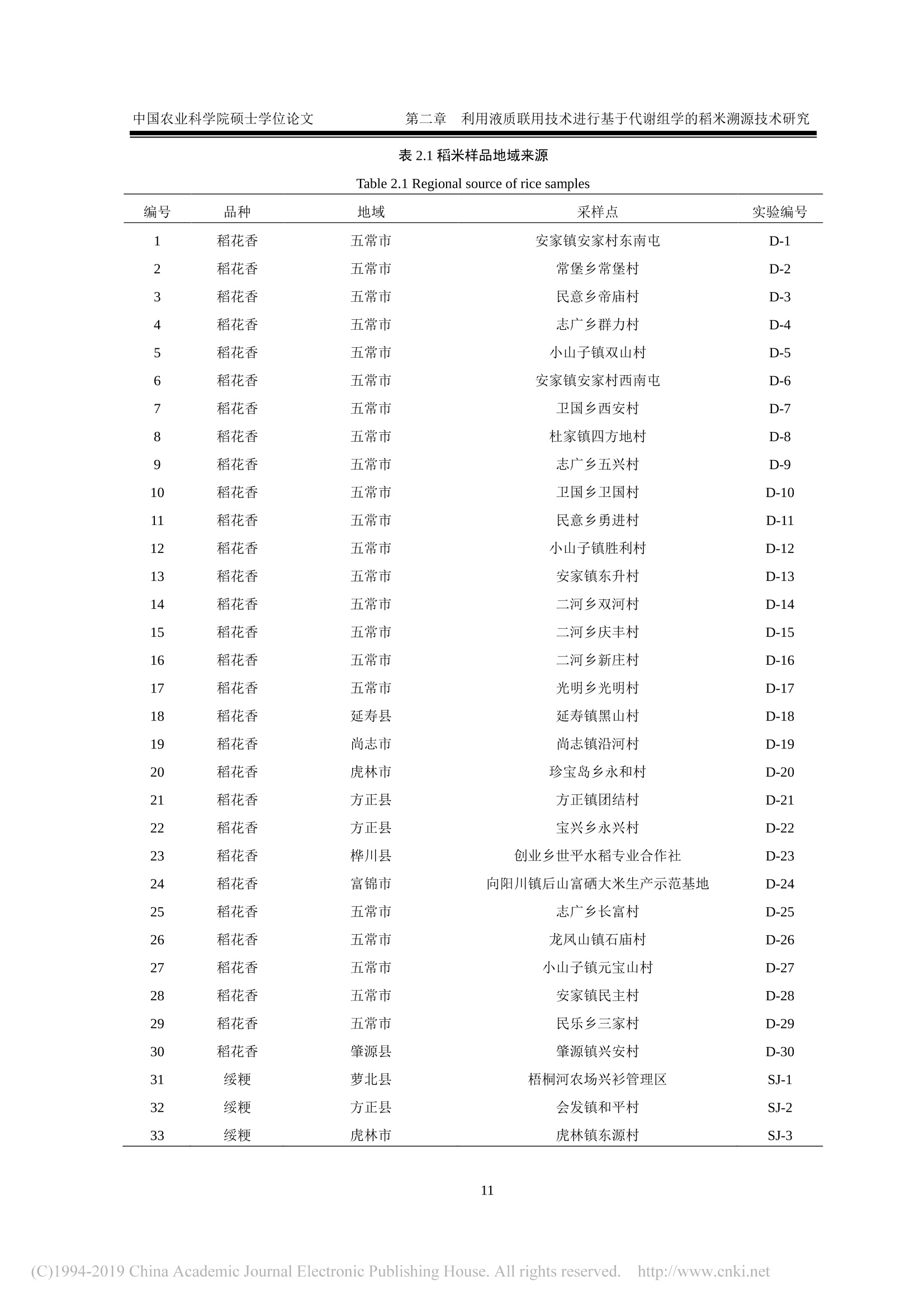
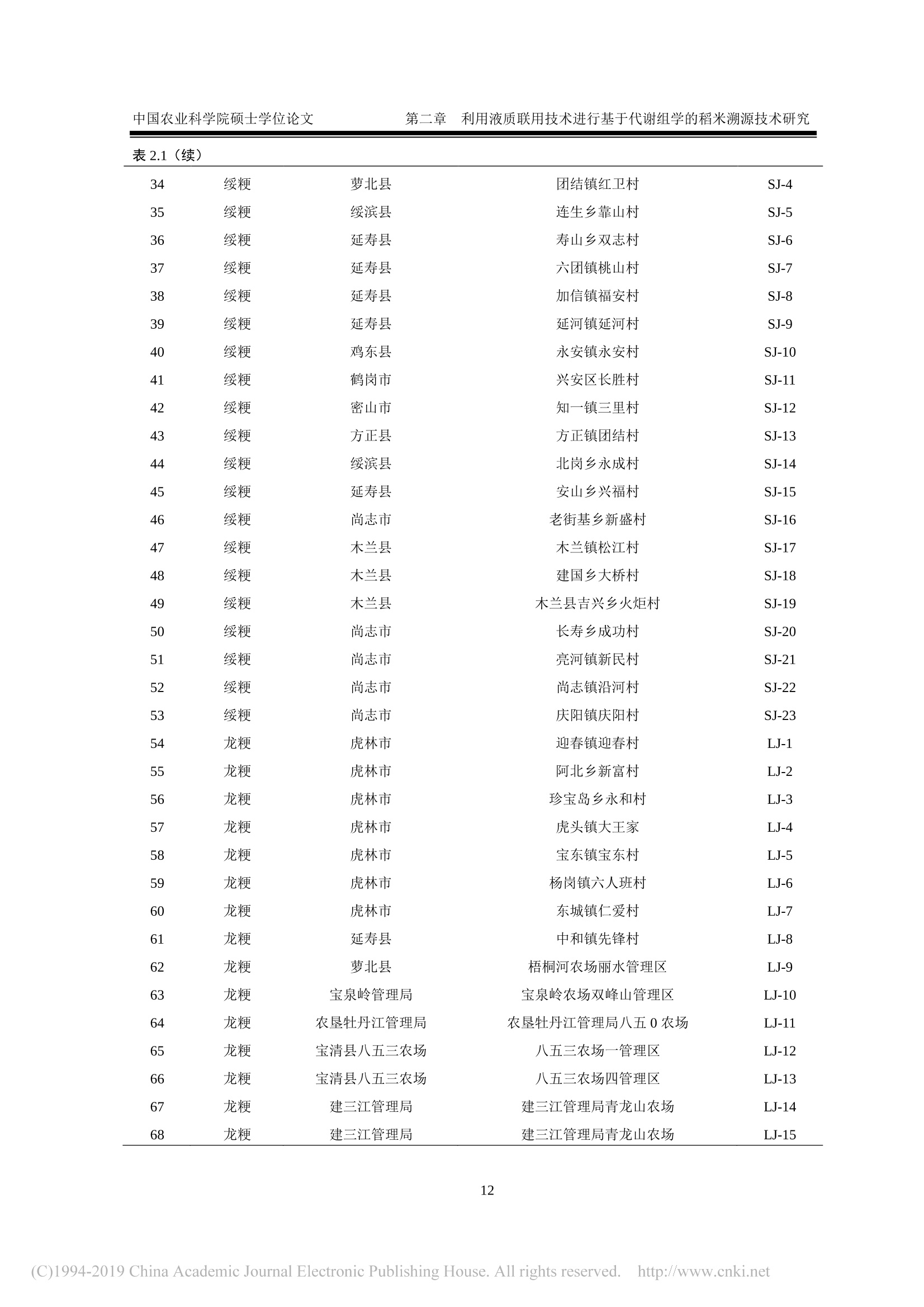
密级:论文编号: 中国农业科学院硕士学位论文第一章 引言 中国农业科学院学位论文 我国东北稻米产品溯源技术研究 The Traceability Technologies on Products of Rice inNortheast China 硕士研究生:王济世 指导教师:刘潇威研究员 申请学位类别:农业推广硕士 专业领域名称:农业资源利用 培养单位:农业部环境保护科研监测所研究生院 2018年5月 独创性声明 本人声明所呈交的论文是我个人在导师指导下进行的研究工作及取得的研究成果。尽我所知,除了文中特别加以标注和致谢的地方外,论文中不包含其他人已经发表或撰写过的研究成果,也不包含为获得中国农业科学院或其它教育机构的学位或证书而使用过的材料。与我一同工作的同志对本研究所做的任何贡献均已在论文中作了明确的说明并表示了谢意。 研究生签名::世 时间: >年月 关于论文使用授权的声明 本人完全了解中国农业科学院有关保留、使用学位论文的规定,即:中国农业科学院有权保留送交论文的复印件和磁盘,允许论文被查阅和借阅,可以采用影印、缩印或扫描等复制手段保存、汇编学位论文。同意中国农业科学院可以用不同方式在不同媒体上发表、传播学位论文的全部或部分内容。 研究生签名:4 时间: 18年月日 导师签名: 时间: 08年月日 中国农业科学院 硕士学位论文评阅人、答辩委员会签名表 论文题目 我国东北稻米产品溯源技术研究 论文作者 王济世 专业 农业资源利用 研究方向 不区分研究方向 指导教师 刘潇威 培养单位(研究所) 农业部环境保护科研监测所 姓名 职称 硕(博)导师 单 位 专 业 签名 评阅人 硕导口博导口 硕导口博导口 答辩主席 刘惠芬 教授 硕导口博导 天津农学院 环境科学 答辩委员 郭永泽 研究员 硕导口博导 天津农业科学院 农药学 陈长喜 教授 硕导口博导口 天津农学院 软件工程 史国良 副教授 硕导口博导口 南开大学 环境工程 史良 李岳 副教授 硕导博导口 南开大学 软件工程 硕导口博导口 硕导口博导口 硕导口博导口 会议记录(秘书) 知 论文答辩时间地点 农业部环境保护科研监测所二楼会议室2018年5月22日 密级: 论文编号: 中国农业科学院学位论文 我国东北稻米产品溯源技术研究 The Traceability Technologies on Products of Rice inNortheast China 硕士研究生:王济世 指导 教师::刘潇威研究员 申请学位类别:农业推广硕士 专业领域名称::农业资源利用 培养 单位:农业部环境保护科研监测所研究生院 2018年5月 Secrecy: No. Chinese Academy ofAgricultural SciencesDissertation The Traceability Technologies on Products of Rice inNortheast China M.S. Candidate: Jishi Wang Supervisor: Prof. Xiaowei Liu Degree: Master of Agricultural Extension Specialty: Agricultural Resources Utilization May 2018 商要 稻米作为世界上最主要的粮食作物,具有适应性强、产量高、经济效益高的特点。其品质不仅受自身遗传因子的影响,还与环境因素有关。由于我国稻米种植区域广,品种多,,一些不法商贩在利益的驱动下,将普通大米伪装成优质大米出售,以次充好,严重损害了消费者权益。因此为了规范市场秩序,保护消费者权益,亟需研究开发一种能够对稻米品种及产地进行高效、可靠鉴别的溯源方法。 本文基于非靶向代谢组学和脂质组学,建立了液相色谱-四极杆串联飞行时间质谱联用仪(UPLC/Q-TOF-MS)和气相色谱-四极杆串联飞行时间质谱联用仪(GC/Q-TOF-MS)对稻米溯源的研究方法,对不同品种、不同产地的稻米进行了溯源研究,同时还对气相色谱离子迁移谱联用技术在稻米溯源上的应用进行了探索,筛选出了部分特征代谢物,为稻米产品溯源提供了技术支撑。 1.本研究借助UPLC/Q-TOF-MS, 开展基于代谢组学和脂质组学的稻米产品溯源技术研究。采用液液萃取的提取方式对稻米样品进行前处理,对不同比例的水、甲醇、甲基叔丁基醚提取溶剂进行考察,对流动相洗脱梯度等条件进行优化,确定出最优的稻米内源代谢物筛查方法。 2.本研究借助 GC/Q-TOF-MS 开展基于代谢轮廓的稻米溯源技术研究,对衍生方法、温度、时间进行了优化。选取甲氧基胺盐酸盐吡啶溶液为肟化试剂,温度设为40℃,时长100 min; 硅烷化试剂为含有1%三甲基氯硅烷的N-甲基-N-三甲基硅基三氟乙酰胺溶液,温度设为40℃,时间定为 35 min。最终筛选出与标准谱库匹配度得分高于90的8种内源代谢物。 3.本研究借助气相色谱离子迁移谱联用技术对稻米中挥发性有机化合物进行了检测,确证出该方法具有较高可靠性,可用于不同品种、不同产地的稻米鉴别。 三种技术方法各有优点,为全面筛查稻米中的内源代谢物提供了强有力技术支撑。 ( 关键词:稻米,代谢组 学 , UPLC/Q-TOF-MS, GC/Q-TOF-MS, ) , 气相色谱离子迁移谱联用 ) Abstract As the most important crop in the world, rice has the characteristics of strong adaptability, high yield,and high economic benefits. Its quality is not only affected by its own genetic factors, but also related toenvironmental factors. Due to the wide area and variety of rice cultivation in China, some unscrupuloustraders, driven by interests, disguised ordinary rice as premium rice for sale and shoddy, which seriouslydamaged consumer’s rights and interests. Therefore, in order to regulate the market order and protectthe rights and interests of consumers, it is necessary to develop a traceability method that can effectivelyand reliably identify rice varieties and origins. In this paper, The method for the traceability of rice using the combined instruments liquidchromatography-quadrupolettime-of-flight mass spectrometry(UPLC/Q-TOF-MS) and gaschromatography-quadrupole-time-of-flight mass spectrometry (GC/Q-TOF-MS) was established forconducting a traceability study of different varieties or different origins of rice, based on non-targetedmetabolomics and lipidomics. At the same time, the application of gas chromatography with ionmobility spectrometry in rice tracing was explored. Some characteristic metabolites were screened outto provide technical support for traceability of rice production areas. 1. In this study, a method based on metabolomics and lipidomics for the traceability of rice originswas developed using the combined instruments liquid chromatography-quadrupole time-of-flight massspectrometry (UPLC/Q-TOF-MS). The liquid-liquid extraction method was used to pretreat the ricesamples, and different proportions of water, methanol, and methyl tert-butyl ether extraction solventswere investigated. The mobile phase elution gradient and other conditions were optimized to determinethe optimal screening method of rice endogenous metabolites. 2. In this study, gas chromatography-quadrupole-time-of-flight mass spectrometry (GC/Q-TOF-MS)was used to study rice tracing technology based on metabolic profiles, and the derivatization method,temperature, and time were optimized. The methoxylamine hydrochloride pyridine solution wasselected as the deuteration reagent, and the temperature was set to 40℃ for a period of 100 min. Thesilylating agent was a solution of N-methyl-N-( trimethylsilyl) trifluoroacetamide containing 1%trimethylchlorosilane. The temperature was set to 40°C. and the time was set to 35 min. Eightendogenous metabolites with a score of more than 90 from a accurate mass metabolite spectral librarywere finally identified. 3. In this study, the volatile organic compounds in rice were detected by gas chromatography ionmobility spectrometry. It was confirmed that the method has high reliability and can be used to identifyrice in different varieties and origins. The three technical methods have their own advantages and provide powerful technical support forthe comprehensive screening of endogenous metabolites in rice. Keywords:: Rice, Metabolomics, UPLC/Q-TOF-MS, GC/Q-TOF-MS, Gas chromatography ionmobility spectrometry 目 录 第--章 引 言 1.1代谢组学 1.1.1植物代谢组学.. 2 1.1.2脂质组学.. 3 1.2稻米研究进展.. 3 1.3代谢组学分析方法研究进展... 4 1.3.1代谢组学样品前处理... 4 1.3.2代谢组学分析技术. 5 1.3.3代谢组学数据处理与分析... 6 1.3.4可能特征化合物的结构鉴定.. 7 1.4气相色谱离子迁移谱联用技术... 7 1.5研究目的、内容和技术路线 7 1.5.1研究目的... 7 1.5.2研究内容.. 8 1.5.3技术路线.. 9 第二章利用液质联用技术进行基于代谢组学的稻米溯源技术研究.... ..10 2.1材料与方法... ...10 2.1.1仪器 .110 2.1.2试剂.. .10 2.1.3样品.. .10 2.2实验方法 .113 2.2.1样品前处理.。.. ..:113 2.2.2色谱条件... ..14 2.2.3质谱条件.. 15 2.2.4数据处理... ...15 2.3结果与讨论... .15 2.3.1提取溶剂的优化.. .115 2.3.2提取方法的优化.. ..16 2.3.3仪器条件的优化.. .16 2.3.4方法验证.. .17 2.3.5数据分析.... ..18 2.3.6次年样品对溯源方法的验证.. .23 2.4小结.. .224 第三章利用气质联用技术进行基于代谢组学的稻米溯源技术研究.. ..225 3.1材料与方法... 225 3.1.1仪器... .225 3.1.2试剂.. 25 3.1.3样品.. .25 3.2实验方法.. .226 3.2.1样品前处理.. 226 3.2.2色谱条件... 26 3.2.3质谱条件.. 26 3.3结果与讨论... .26 3.3.1衍生条件优化.. .226 3.3.2方法验证... 28 3.3.3数据分析... 29 3.3.4次年样品对溯源方法的验证.. .332 3.4小结... 332 第四章利用气相色谱离子迁移谱联用技术进行溯源技术研究. 34 4.1材料和方法... 34 .4.1.1仪器.... ..34 4.1.2样品.. .34 .4.2实验方法.. .34 4.2.1样品前处理.. 334 4.2.2分析条件.. .334 4.2.3仪器工作原理及流程... 335 4.3数据分析.. 35 4.3.1不同产地稻花香的指纹图谱.. .335 4.3.2不同产地稻花香的相似度... ..36 4.3.3不同产地稻花香的主成分分析。 337 4. 3.4不同品种稻米样品主成分分析.. .338 4.4样品中挥发性成分定性分析... .339 4.5小结.. .40 第五章结论与展望... 41 5.1结论.. 41 5.2展望.. . 441 参考文献. .43 致谢.. .449 作者简历... .550 图目录 图1.1技术路线.. 9 图2.1不同提取方法回收率.. .16 图2.2代谢正离子模式下代表性总离子流色谱图. .17 图2.3脂质正离子模式下代表性总离子流色谱普.. .17 图2.4代谢组学正离子模式下不同品种稻米的 PCA 得分图... ..19 图2.5脂质组学正离子模式下不同品种稻米的 PCA 得分图... .19 图2.6绥粳稻米的PCA 得分图... .220 图2.7代谢组学正离子模式下不同品种稻米的 PCA得得图.. 220 图2.8脂质组学正离子模式下不同品种稻米的PCA 得分图... 21 图2.9不同品种稻米的t检验得分图.. 22 .图2.10 CSID8704116 二级裂解质谱图.. .223 图2.11三个不同品种稻米的 PCA得得图... 23 图3.1不同衍生方法对3种稻米样品代谢物种类的影响.. .27 图3.2衍生化温度、时间对代谢物的影响... .228 图3.3 NIST14 和Fiehn 谱库检索示意图.... 29 图3.4三个不同品种稻米的 PCA 得分图... 330 图3.5四个主成分的贡献率图... 330 图3.6D-葡糖酸的叠加提取离子色谱图(左)、组分和谱库谱图的镜像图(右)31 图3.7D-葡糖酸在不同品种稻米中的丰度.. .332 图3.8三个不同品种稻米的 PCA 2D得分图.. .332 图4.1不同产地样品中挥发性有机物的 Gallery Plot 图.. 336 图4.2不同产地稻米的 PCA 得分图.. 38 图4.3不同品种样品的 PCA 得分图.. .338 表目录 表2.1稻米样品地域来源.. .11 表2.2流动相梯度洗脱参数... .114 表2.3流动相梯度洗脱参数... .14 表2.4不同体积提取溶剂试验设计.. .15 表2.5流动相选择.... .17 表2.69种代谢物在低、中、高添加浓度时的回收率和 RSD. .18 表2.7不同产地稻米潜在标志物的鉴定.. .222 表3.110种代谢物的保留时间、回收率、RSD 和相关系数R2.. .28 表3.2潜在特征内源代谢物信息.. 31 表4.1分析条件... 335 表4.2不同样品间的相似度(%). 337 表4.3D-2样品中挥发性有机化合物初步定性结果.. .339 VIII 英文缩略表 英文缩写 英文全称 中文名称 GC-MS/M S Gas chromatography- Tandem mass spectrometry 气质联用 LC-MS/MS Liquid chromatography-Tandem mass spectrometry 液质联用 APCI Atmospheric pressure chemical ionization 大气压化学电离 ESI Electrospray ionization 电喷雾电离 APPI Atmospheric pressure photoionization 大气压光致电离 Q-TOF/MS Quadrupole- time of fight mass spectrometer 四极杆-飞行时间质谱 PCA Principal components analysis 主成分分析 HCA Hierarchical cluster analysis 聚类分析 PLS-DA Partical least squares-discriminant analysis 偏最小二乘法判别分析法 OPLS-DA Orthogonal partical least squares-discriminant analysis 正交偏最小二乘法判别分析 IMS Ion mobility spectrometry 离子迁移谱 QC Quality control 质量控制样品 MPP Mass Profiler Professional 代谢组学分析软件 MSTFA N-methyl-N-(trimethylsilyl) trifluoroacetamide N-甲基-N-三甲基硅基三氟 乙酰胺 TMCS Trimethylchlorosilane 三甲基氯硅烷 GC-IMS Gas chromatography ion mobility spectrometry 气相色谱离子迁移谱联用技 术 第一章引 言 近年来,农产品质量安全问题受到越来越多的关注。随着现代农业的发展,生产方式的改变,社会的聚焦点已从农产品的产量转移到了质量上。食品质量是否有保障,口碑是否好,已成为影响人们消费行为的主要因素。根据欧洲相关机构的权威调查报告显示,有超过半数消费者将产地作为他们是否购买食品的主要依据(Franke et al., 2005)。强制性国家标准《原产地域产品通用要求》(GB17924-1999)的颁布,标志着我国在原产地域产品保护方面进入了标准化、制度化阶段(赵晓峰,2011)。 因水质、局部气候、土壤、昼夜温差等因素引起的地域差异,积累形成了具有典型地域特色的地理标志产品(余磊,2014),如贵州茅台、绍兴黄酒、金华火腿、常山胡柚、库尔勒香梨、兰州百合、信阳毛尖等(杨爱葵,2017)。被冠以地理标志的产品,凭借其营养价值和食品风味的优势,在市场上一般会获得较高认可度。与普通产品相比,为人所熟知的地理标志产品在销量和价格方面一般具有绝对优势,能够带动区域经济的发展。尽管我国对地理标志产品的审核越来越严格,但目前我国产品市场准入制度和溯源体系仍不完善,监管手段仍较为单一,过多的依赖产品特色标识包装来进行辨别,,「而在那些与原产地密切相关的指纹性质量特征、气候、环境等的科学印记的研究方面存在很大不足(冯雪,2016)。在利益的驱使下,,一一些诚信水平较低的产品经营者利用市场监管的短板,将假冒伪劣产品以次充好,打上地方特色标识后投入入场,严重损害了消费者的权益,降低了地理标志产品的可信度。为了维护市场秩序,更有效地打击假冒产品,真正做到产品顺向可跟踪,逆向可溯源,发展能够快速对产品进行真伪鉴别的产地溯源技术十分必要。 农产品产地溯源技术是建立于农产品生产、加工、储运、销售和消费过程的信息记录和信息追溯体系,即从“农田到餐桌”的过程跟踪或从“餐桌到农田”的源头追溯技术(张晓焱等,2010)。溯源技术作为保障农产品质量安全追溯制度有效实施的重要手段,当发生市场场纷或产品质量问题时,能够有效的完成问题产品的追溯和召回。目前食品的产地溯源及确证研究主要利用于矿物元素指纹、有机成分指纹、电子鼻、近红外光谱指纹等技术进行(马奕颜等,2012)。近几年,基于代谢组学的分析方法和手段,凭借高通量、高灵敏度和高精确度的分析优点,其应用领域越来越广,除在医学领域应用广泛外,同时也为产品产地溯源的研究开辟了新的途径。 1.1代谢组学 近年来,随着分析化学、生物化学及生物信息学等技术的不断进步,在基因组学、转录组学、蛋白质组学和系统生物学的研究中可以同时完成上千种化合物的测定,从而极大地促进了这些前沿领域学科的快速发展。作为一门新发展的技术和系统生物学的重要组成部分,代谢组学(Metabolomics) 已成为基因组学、转录组学和蛋白质组学之后的新研究热点(Nicholson et al.1999; Nicholson et al., 2002)。它主要通过定性、定量分析生物体受到外界刺激或扰动后(如将某个特定的基因变异或环境变化后)代谢产物的差异及代谢途径的变化规律来达到研究目的。 代谢组学研究对象是一些像氨基酸、糖醇类化合物、小分子多肽、脂类等相对分子质量小于1000的小分子代谢物。这些代谢物与生物体的糖代谢、脂代谢、氨基酸循环等生命活动密切相关。 当生物体受到气候、水源、光照等变化的外部刺激,这些小分子代谢物作为机体生长、发育、生物信号传递的重要物质基础会做出相应的代谢应答变化(彭超等,2008; Fiehn et al., 2001)。鉴于生物体内代谢物的复杂性和多样性,在研究过程中,研究人员根据研究对象的不同,代谢物结构特点等对其开展分类研究,进而产生了一系列代谢组学分支,主要有以植物体中代谢物为研究对象的植物代谢组学(Fiehn,2002),以脂类代谢物为研究对象的脂质组学(Lipidomics) (German, 2007)。 Fiehn 等根据研究对象和目的的不同,将代谢组学分析划为4个层次(Taylor et al., 2002;许国旺等,2003):1)代谢物靶标分析(Metabolite target analysis):“靶标”,顾名思义就是通过一定的预处理技术以除去基质干扰物,有针对性的对生物体中某个或某几个特定组分进行分析;2)代谢轮廓分析(Metabolic profiling analysis):利用待测化合物的特有化学性质,在样品预处理和检测过程中,采用特定技术实现对少数预设代谢物的定量分析,如氨基酸等某一类结构、性质相似的化合物或某一代谢途径的所有中间产物或多条代谢途径下的标志性代谢物组分;3)代谢组学(Metabolomics):采用具有高灵敏性、高选择性、高通量的样品预处理和检测技术,对特定的生物样品中所有的代谢物组分在一定的限定条件下进行定性和定量分析。因为代谢组学涉及的数据量非常大,分析过程中要求基质干扰要小,而且需要采用一定的化学计量学技术对数据进行解析。4)代谢指纹分析(Metabolic fingerprinting analysis): 目标不是为了分离鉴定具体的单一组分,而是针对样品进行快速分类(如表型的快速鉴定)(刘祥东等,2006;夏建飞等,2009)。从严格意义上讲,作为一种整体性的分析方法,代谢组学研究目标是针对生物体内所有代谢物的筛查以及开展定性、定量分析。 根据研究方法的不同,可将代谢组学分为两大类型::非靶向代谢组学(Non-targetedmetabolomics):在一定的生化和环境条件下,对生物样本中所有小分子内源代谢物进行全面的筛查,主要流程为对一组或多组样品进行差异表达分析,寻找丰度改变有统计学意义的生物感兴趣代谢物,然后通过一定的手段鉴定这些代谢物的化学结构,最后对所发现的代谢物与生物过程或生物状态之间的关联进行解释。靶向代谢组学 (Targeted metabolomics):为了提高代谢物检测的灵敏度和准确性,在预先设定条件下,根据已知信息对一部分特定的内源性代谢物进行选择性测定(Griffiths et al., 2010)。 1.1.1植物代谢组学 植物代谢组学主要将处于不同生长阶段或受到某些外界刺激前后植物体内所有小分子代谢物的变化作为研究对象,并对其进行定性、定量分析(李万春,2012)。植物中小分子代谢物即包括那些维持生命活动,与生长发育息息相关的初生代谢物,也包括起到抗病和抗逆的作用的次生代谢物(张凤霞等,2013)。植物代谢组学着眼于整体,多层次、多结构的分析了解植物代谢物的成分、结构、合成途径等相关基因功能,为更好的进行植物研究奠定了基础(赵洪芝,2012)。近几年植物代谢组学已成功应用于拟南芥(Gu et al., 2011)等模式植物和生地黄(Zhou et al., 2016)等非模式植物的研究。另外,作为潜在特征标志物鉴定的技术以及研究植物代谢规律的有效工具,植物代谢组学在农产品产地溯源方面的研究取得了突破性进展。 1.1.2脂质组学 脂质组学(Lipidomics) 是以生物体内所有脂质分子为研究对象。它以生物体内脂分子的特性及其在蛋白质表达和基因调控中的作用为研究重点(Lagarde et al., 2003)。脂质是脂肪和类脂的总称,作为能源储存物质和生物膜骨架,对维持机体正常生命活动至关重要。在过去人们只对脂质的物理性质如难溶于水易溶于脂溶性有机溶剂有所了解,而对其分子结构特点知之甚少。近几年, Fahy 等人依据脂质化合物的来源重新对脂质进行了定义,称其为“疏水性或两性小分子化合物”,并进一步对其高度复杂的分子结构进行了规范定义(Fahy et al., 2009; Fahy et al.,2005)。 生物体中的脂质分子一般可分为:1)非极性的脂质,包括一些胆固醇、胆固醇酯和甘油三酯;2)极性的脂质,包括磷酯类、鞘脂类和一些糖脂类;3)脂质代谢物, 一般指脂质合成或水解过程中产生的物质,包括具有生理活性、信号传递作用的物质(王涛,2010)。这些物质组成及含量在不同种类的生物体甚至是同一个体不同组织间都存在较大差异,其功能也不尽相同。在人类医学方面,由于脂质是能量储存物质和细胞膜的重要组成,而且还参与了细胞的许多重要功能,因此可以通过检测分析脂质的代谢是否正常来诊断一些疾病,如糖尿病等(Watson,2006)。另外,脂质同时参与植物的生长发育过程,如种子的萌发、内部信息传导、以及叶片光合作用等(Wang,2004; Wang et al., 2006)。当生物体处于不同生长发育阶段,体内激素水平发生变化,受到病虫害侵袭以及环境胁迫时,脂质组成和含量水平会发生相应的应激变化(Wang, 2004; Welti et al., 2004)。研究人员越来越多的关注脂质的作用机制及其代谢变化,但是由于脂质本身的复杂性以及检测技术的不成熟,使得脂质研究进展受到一定限制。随着脂质组学的提出以及质谱等分析技术的完善,研究人员对脂质组学的研究不断深入,研究方法不断创新,进而揭示了更加全面地脂质代谢物结构信息,更好地诠释了脂质与蛋白质表达以及基因调控的关系。目前,脂质组学的研究与应用不仅仅局限于动物领域,在植物方面也得到了突破性的进展。 1.2稻米研究进展 稻米作为世界上最主要的粮食作物之一(Slavin, 2004),具有适应性强、产量高、经济效益高的特点。在我国,稻米生产量和需求量位居世界前列,其品质的好坏直接关系到国家粮食安全。大米中具有丰富的营养物质,其蛋白品质较高,含有优质的赖氨酸,且具有低过敏性。主要成分为蛋白质(米谷蛋白、米胶蛋白等)、氨基酸(苏氨酸、赖氨酸等)、脂肪(亚油酸等)、碳水化合物(直链淀粉等)、矿物质 (Cu、Zn、Mg、Fe等)、脂溶性维生素(维生素A)、水溶性维生素(维生素B)以及肌醇、阿魏酸、咖啡酸、没食子酸、生物碱等生物活性物质。大米蛋白可用于开发生物活性材料,另外,由于其低还原性,被广泛应用于开发婴幼儿食品。随着经济发展,人民生活水平不断提升,老百姓对食品的要求已从“量”跨越到“质”,即越来越注重“舌尖上的安全”。由于人们对大米的营养价值和风味要求越来越高,所以在购买大米时,人们更加青睐于那些品质优、口感好的品种。稻米品质不仅受自身遗传因素的影响,还与环境因素有关,且栽培具有明显的区域性。目前,我国已将五常米、方正米、盘锦米等列为地理标志保护产品,但由于我国稻米种植区域广,品种多,再加上防伪技术存在一定短板,导致了市场监管难度大的问题。一些不法商测抓住这些漏洞,在利益的驱动下,将普通大米伪装成优质大米出售,严重损害了消 费者的合法权益。因此,为了纠正大米市场混乱的现象,规范市场秩序,保护消费者权益,亟需研究开发一种能够对稻米品种及产地进行高效、可靠鉴别的溯源方法。目前,各国学者综合相关知识,借助各种技术手段,对稻米产地鉴别技术的不断探索,以期开发一种高效溯源方法,为维护市场秩序提供科学技术支持。 近年来,国内外主要通过检测分析矿物质元素、稳定性同位素、脂肪酸、蛋白质以及 DNA指纹进行稻米产地溯源研究(冯雪,2016)。处于不同产地环境的作物,其体内矿物元素的组成和含量具有一定的指纹性差别,所以矿物元素指纹分析技术被用于产品产地鉴别中,如 Kelly 等采用电感耦合等离子质谱法对稻米中的矿物元素进行了测定(Kelly et al., 2005)。生物体内的稳定性同位素如13c/2c、H/'H等在气候、环境、品种等因素的影响下会发生分馏作用,从而导致不同来源的生物体内同位素的丰度具有一定差异(郭波莉等,2007)。 Kawasaki 等(Kawasaki et al., 2002)针对日本、中国、澳大利亚、美国和越南5个国家大米样品中的同位素B/B和8Sr /86Sr值采用电感耦合等离子体质谱进行了分析,发现不同产地的B/B和Sr/86Sr 值具有显著的差异。另外,回瑞华等(回瑞华等,2008)借助气相色谱-质谱对不同产地稻米油脂中脂肪酸进行了分析; Kim等采用近红外光谱结合偏最小二乘模式识别法对不同产地的品种进行了鉴别(Kim et al., 2003);还有人借助生物法对稻米中的遗传物质进行分析以达到鉴别目的。虽然每种方法都具有一定的优势,但到目前为止仍没有一种完全独立的方法可以达到农产品产地溯源的目的(郭波莉,2007)。在实际应用中,可以考虑探索一种将这些技术相结合的综合方法,进而快速、准确地完成产品产地溯源,推进构建和完善溯源体系的进程。 1.3代谢组学分析方法研究进展 代谢组学研究流程一般包括样品前处理、代谢物成分分析、数据处理与分析、潜在生物标志物的定性及结构鉴定。由于样品中的代谢物成分复杂,种类繁多,根据不同的研究对象和研究目的,往往采用不同的样品前处理技术和分析方法。代谢组学的研究分析多采用色谱、质谱、紫外吸收光谱、核磁共振、红外吸收光谱等技术手段(蔡爽等,2007)。虽然每种方法都有其独特的优势,但根据现在的认识水平,目前为止还没有一种可以覆盖所有代谢物的单一的分离提取及分析技术。因此为了获取更多的代谢物信息,实际分析过程中往往将多方法、多技术联合应用。 1.3.1代谢组学样品前处理 代谢组学研究中,样品--般需要经过一定的前处理如溶剂提取,化合物分离等技术后,再进行高通量、高灵敏度的检测分析。非靶向代谢组学研究中应尽量减少样品前处理步骤,以减少代谢物的变化和损失,确保代谢物的完整性,获得尽可能多的代谢物分析数据。而靶向分析过程中,常加入内标,并根据目标物结构,有针对性的对提取方法进行优化,最大程度的去除干扰物,选择性富集目标化合物,检测准确度较高。样品前处理流程一般包括样品的快速转移、淬灭、代谢物定量提取以及选择合适的前处理条件等(Dettmer et al., 2006)。前处理过程中常以水或甲醇、氯仿、甲基叔丁基醚等有机溶剂做提取溶剂,采用液液萃取、固相萃取、沉淀蛋白等方法(王中华,2015)实现对代谢物的提取。 液液萃取方法是基于相似相溶原理,以水互不相溶的有机溶剂对样品中的代谢物进行提取的方法。该方法对低分子量的非极性代谢物有较好的提取效果,但处理过程比较复杂。采用合适的溶剂,如一定比例的水、甲醇和甲基叔丁基醚对大米样品进行提取,上层有机相为极性小的脂类代谢物,下层水相多为极性大的代谢物,分别用于脂质组学和代谢组学的研究(Chang et al., 2014)。固相萃取方法是根据目标物在固相填料上吸附能力的差异,实现目标物与干扰物分离的方法(王中华,2015)。该方法操作简单,可同时完成样品的富集与净化,大大提高检测灵敏度,重现性好,相对于液液萃取,萃取速度快、消耗溶剂少,但样品处理成本较高。在靶向和非靶向代谢组学分析中该方法得到广泛应用(Griffiths et al., 2010; Michopoulos et al., 2009)。沉淀蛋白方法采用甲醇等水不溶性有机溶剂,使蛋白质变性凝结沉淀,离心除去蛋白质等生物大分子(Boernsen et al.,2005;Want et al., 2006)。该方法对极性较大的代谢物提取效果较好,但会产生较强的基质效应,残留的无机盐等杂质可能会污染仪器。 一些含有氨基、羧基、羟基等极性基团的低丰度代谢物由于不易挥发、易分解且难离子化而不利于仪器的检测分析。为了提高离子化效率,使目标物具有更高的挥发性、更低的极性和更好的热稳定性,以便于色谱分离,增加可检测的特征碎片离子,在样品前处理过程中,需采用适当的衍生化试剂对样品进行衍生化(Busch,2010; Fuzfai et al., 2008)。 1.3.2代谢组学分析技术 代谢组学研究顺利开展需要有高通量、高灵敏的仪器做技术支撑。生物体中代谢物种类繁多、物理化学性质差异较大且含量较低,要实现代谢物定性定量的全面分析,对分析技术提出了很高的要求。质谱(MS)凭借广泛的动态范围,具有可重现的定量分析的优点已被广泛应用于代谢组学的研究。但由于样品成分的复杂性,在分析之前一般需要进行分离,之后利用分离的保留时间等化学信息对代谢物进行追踪和鉴定。常用的分离技术是气相色谱和液相色谱。近几年,随着串联质谱技术的发展,色谱-质谱联用以及四极杆-飞行时间(Fardet et al., 2008)、线性离子阱等串联质谱日趋成熟,质谱技术高灵敏度、高针对性、可检测分子量范围广的特点在代谢组学研究中得到了很好的应用,为实现代谢物的高通量分析,确定分子式结构,完成标志物的鉴定提供了可能。 气相色谱串联质谱(GC-MS/MS) 和液相色谱串联质谱(LC-MS/MS)技术将色谱强分离性能和质谱高灵敏度、可鉴定分子结构的特点结合在一起,在代谢组学研究中得到了很好的应用。GC-MS/MS 的电离源多采用硬电离,电离得到的离子碎片一致性较好,但样品需进行衍生化前处理,适用于易挥发、热稳定性强、极性弱的代谢物(如酯类、硅烷化衍生物代谢谢等)的分析。而 LC-MS/MS 解决了不易挥发、极性强、热稳定性差化合物不易检测的难题,且无需衍生化处理,多用于复杂样本的分析。但由于质谱离子化的限制,导致 LC-MS/MS 在非靶向代谢组学分析中对代谢物的覆盖范围具有一定的局限性,另外方法稳定性较 GC-MS/MS 稍弱(韩莉妲,2009;Nordstrom et al.,2008)。 目前,大气压化学电离(APCI)、电喷雾电离(ESI)和大气压光致电离(APPI) 是 LC-MS/MS在代谢组学研究中应用最广泛的质谱离子源。APCI 基质效应弱,适用于中等或弱极性化合物。 其作用机理为样品先形成雾,接着电晕放电针对其放电,在高压电弧中样品被电离,然后去溶剂化形成离子进入检测器进行检测。ESI 源无需将样品衍生化,离子化效率高,灵敏度高,稳定性强,在代谢组学研究中常用于难挥发、热不稳定的高极性代谢物的电离(Zhou et al., 2012)。其作用机理是样品先带电再喷雾,带电液滴去溶剂化的同时形成样品离子,之后进入检测器进行检测。APPI 在电离过程中离子抑制作用和基质干扰小,对弱极性或非极性化合物离子化效率高。作用机理是经液相色谱分离的待测物随流动相在进入紫外光区前完全蒸发,并与可电离的添加剂在离子源内发生反应进而离子化(王中华,2015)。 近几年,四极杆-飞行时间质谱 (Quadrupole- time of fight mass spectrometer, Q-TOF/MS) 凭借检测速度快、灵敏度高、检测模式多样化、可检测的分子量范围大等高通量检测特点已成功应用于代谢组学的研究。Q-TOF/MS 是由四极杆与飞行时间质谱组成的空间串联高分辨率质谱,最常用离子源为 ESI 和APCI, 扫描方式有产物离子扫描,前体离子扫描和中性丢失扫描(林泽彬等,2012)。它以离子漂移管作为质量分析器,经离子源产生的离子进入收集器后速度变为零,之后在-个脉冲电场作用下进入无场漂移管并以恒定速度飞向离子接收器。离子质量不同到达接收器时间也不同,根据这一原理,使不同质量的离子达到分离的目的。另外, Q-TOF/MS 可通过母离子的裂解获取更多化合物结构信息,得到代谢物的精确质量,进行未知化合物的鉴定。 1.3.3代谢组学数据处理与分析 代谢物经仪器检测后,需要将获取的检测信号经过一定的数据处理方式转化为可被识别的代谢物信息,进而提取出有价值的信息,完成最终的定性定量分析。代谢组学数据处理与分析的整个流程包括获取原始数据,对数据进行预处理,进行模式识别,建立模型并验证以及开展变量筛选等。 代谢组学的检测数据经过基线校正 (Baseline correction), 滤噪 (Filtering and denoising),信号提取 (Signal extraction), 归一化 (Normalization)和标度化 (Scaling)完成数据预处理,进而消除或减小因实验操作不当或仪器分析带来的误差,提高实验结果的准确性。针对预处理后得到的大量多维数据,需要采取一些合理的化学计量学方法进行降维处理,通常包括无监督模式识别法(Unsupervised method)和有监督模式识别法 (Supervised method) (Eriksson et al., 2004; Tryggjet al., 2007)。无监督方法不需要任何样本的背景类别信息,直接根据原始谱图信息或预处理后的数据完成样本的归类,并经可视化技术直观的表达出来,主要分为主成分分析 (Principalcomponents analysis,PCA), 聚类分析(Hierarchical cluster analysis, HCA) (Geng et al., 2013)。当实验组内的显著差异小于组间时,无监督模式识别法可很好的实现分组,进而筛选出与原始信息相关的特征化合物。有监督模式识别法是根据已知的样本信息对未知数据进行强制分组,更大程度的提取不同组分间的差异变量,主要包括偏最小二乘法判别分析法( Partical leastsquares-discriminant analysis, PLS-DA) (Szymanska et al., 2012)和正交偏最小二乘法判别分析(Orthogonal partical least squares-discriminant analysis, OPLS-DA) (Wiklund et al., 2012)。代谢组学研究中常先进行主成分分析,找出离群点,然后再通过有监督方式建立模型并验证,最终筛选出差异明显的特征化合物。 1.3.4可能特征化合物的结构鉴定 代谢组学研究中,对筛选出的差异明显的特征化合物进行结构鉴定。通过确定正离子检测模式下的可能特征物的[M+H],[M+Na]*, [M+NH4]*,或负离子检测模式下[M-H],[M+HCOO]等准分子离子,推断化合物可能电离途径,进而推断出化合物的分子量和分子式,之后根据高分辨 MS/MS 数据与已有的数据谱库进行检索和匹配,判断代谢物的裂解特征是否正确,最终确证出潜在特征物的结构。 1.4气相色谱离子迁移普联用技术 随着科技的不断进步,除质谱色谱传统方法外,农产品产地溯源技术不断创新,并朝着灵敏、高效、准确和节约成本的方向发展。离子迁移谱(Ion mobility spectrometry, IMS) 早期被应用于环境监测、工业生产等方面(Asbury et al., 2000), 近年来被越来越多的应用到食品分析中,如食用油的品质鉴定、掺假鉴别(陈轲等,2015;帅茜,2015)。 离子迁移谱是一种依据离子形状、质量比等存在差异导致在迁移管中漂移时间不同,来完成样品分离及检测的技术。IMS 技术原理与电化学分析有些类似,后者分析原理是通过液相分子、离子的迁移反应以及得失电子生成电信号,而离子迁移谱则是样品先通过与载气碰撞,形成的离子在电场中又与缓冲气体进行碰撞而实现离子的分离和检测(成舒乔等,2012)。IMS 相对质质来说,装置较为简单,主要有进样部分(气路系统、样品导入系统)、迁移管、分析和生成谱图的检测器三部分组成。其中迁移管是离子迁移谱的关键部位,主要分为电离反应区、离子漂移区和离子检测器(徐淑武等,2003)。离子源是迁移管的核心部件,选择多种离子源对样品进行离子化可以具有较好的选择性和线性范围。最后迁移管将获得的电子信号放大后进入信号处理系统生成可被解读的谱图。 IMS 相对质谱来说,突出优势在于对样品的检测无需严格的真空条件,常压下即可完成,因此对一些挥发性物质如毒品(Verkouteren et al., 2011)的检测效果较好。随着离子迁移谱技术研究地深入, IMS 与色谱、质谱等分离技术联用越来越成熟,大大拓宽了其应用领域。本研究基于气相色谱与离子迁移谱联用技术,借助 FlavourSpec@食品风味分析与质量控制系统对不同品种稻米成分差异进行了分析,以期为稻米产品溯源提供新的思路和技术手段。 1.5研究目的、内容和技术路线 1.5.1研究目的 本研究通过对黑龙江同一地区不同品种,同一品种不同地区的代表性大米进行共性及差异性分析,借助液相色谱-四极杆串联飞行时间质谱联用仪(UPLC/Q-TOF-MS)和气相色谱-四极杆串联飞行时间质谱联用仪 (GC/Q-TOF-MS),开展非靶向代谢组学和脂质组学研究。通过大米代谢物在正离子化模式下的离子化特点,并结合主成分分析等多元统计分析方法,建立稻米非靶向代谢组学和脂质组学产地溯源分析方法,筛选并鉴定出对样本分组贡献大的差异代谢物,以达到对稻米进行产产溯源的目的。此外本研究还采用了FlavourSpec@食品风味分析与质量控制系统,通 过对稻米中挥发性代谢物进行检测,以实现不同品种稻米的差异分析,为快速进行产地稻米溯源提供技术支撑。 1.5.2研究内容 1、采用液液萃取的提取方式对稻米样品进行前处理,对不同比例的水、甲醇、甲基叔丁基醚提取溶剂进行考察,对流动相洗脱梯度等条件进行优化,利用 UPLC/Q-TOF-MS, 开展基于代谢组学和脂质组学的稻米产品溯源技术方法 2、对经前处理得到的提取液进行衍生化,利用GC/Q-TOF-MS 进行稻米代谢轮廓的研究。 3、利用 FlavourSpecQ食品风味分析与质量控制系统,对稻米中挥发性代谢物进行检测,,以探索建立不同品种稻米差异分析的快速检测方法。 4、分析来自黑龙江不同地区的稻花香、绥粳、垦稻、龙粳四个品种稻米代谢组分,通过 PCA等化学计量学手段对检测数据进行处理,筛选并确证出特征化合物,为产地溯源和品种鉴别提供技术支持。 1.5.3技术路线 本文技术路线: 图1.1技术路线 Figure 1.1 Technology roadmap 第二章 利用液质联用技术进行基于代谢组学的稻米溯源技术研究 由于稻米中的化学成分结构多样,极性差异大,十分复杂,进行代谢组学研究具有一定的难度。随着质谱技术的不断成熟,质谱联用技术在代谢组学研究中的应用越来越广。LC-MS/MS 凭借前处理简单、可检测代谢物浓度范围宽、灵敏度高的优点,适用于小分子氨基酸、有机酸的检测鉴定,现已成为代谢组学研究的重要工具(冯雪,2016)。UPLC/Q-TOF-MS 具有将代谢物快速分离、 准确定性定量的特点,可以获得更多的代谢物结构信息,在复杂样本的代谢物检测和特征物鉴定方面已取得一定的进展和成果(芮雯等,2012)。 本章节对稻米提取溶剂、提取方法、仪器采集方法、洗脱梯度等进行了优化,以建立一种尽可能多的检测稻米中代谢物的检测方法,并进行方法验证。之后对化合物的分子量进行确证,通过现有的谱库进行比对,匹配可能的结构信息,完成潜在标志物的鉴定。 2.1材料与方法 2.1.1仪器 ExionLCM AD 超高效液相色谱系统 (AB SCIEX, 美国),包括二元泵、自动进样器和柱温箱, SCIEX Triple TOFM 6600高分辨质谱仪,配有 APCI、ESI离子源以及 Analyst 1.7.1数据采集软件。 台式高速冷冻离心机 (Sigma, 德国), N-EVAP 氮吹仪 (Organomation, 美国),旋涡混合器(Thermo,美国),最小量程为10 mg 的电子天平(赛多利斯,中国),Milli-Q 净水系统(Milli-PORE公司,德国), Transferpette s 移液器 (BRAND, 德国), 1.5mL离心管(Axygen, 美国)。 2.1.2试剂 色谱纯甲醇、乙腈、异丙醇、甲基叔丁基醚(MTBE) 购自 Fisher 公司、9种用于方法学考察的代谢物标准品,代谢类4种:L-色氨酸-d5、d3-苹果酸、d3-己基-肉碱、d3-癸酰基-肉碱;脂质类5种: dLPC(16:0)、dLPE(18:0)、dPC(16:0/16:1)、dDAG(16:0/16:0)、PC (17:0/17:0), 购自美国 Sigma-aldrich 公司,用甲醇作为溶剂配成 10 mgkg的混标,-20℃储存,待用。 2.1.3样品 实验所用稻米样品来自黑龙江省农科院,采集时间为2016年10月,稻米品种为稻花香、绥粳、垦稻、龙粳。具体稻米采样布控点及具体信息见表2.1。每个采样点具有一定的代表性,样品采集时从每个采样点采集 5 kg 稻米,经晾晒、脱壳后,用四分法取200g做分析样,磨粉,在室温下风干,置于-80℃贮藏,备用。 表2.1稻米样品地域来源 Table 2.1 Regional source of rice samples 表2.1(续) 表2.1(续) 69 龙粳 建三江管理局 建三江管理局勤得利农场 LJ-16 70 龙粳 建三江管理局 建三江管理局胜利农场 LJ-17 71 龙粳 建三江管理局 建三江管理局胜利农场 LJ-18 72 龙粳 建三江管理局 建三江管理局八五九农场 LJ-19 73 龙粳 建三江管理局 建三江管理局八五九农场 LJ-20 74 龙粳 建三江管理局 建三江管理局七星农场 LJ-21 75 龙粳 建三江管理局 建三江管理局七星农场 LJ-22 76 龙粳 虎林县 杨岗镇云认班村 LJ-23 77 龙粳 虎林县 虎头镇虎头村 LJ-24 78 龙粳 绥滨县 北岗乡永乐村 LJ-25 79 龙粳 绥滨县 忠仁镇国家级绿色食品原料基地 LJ-26 80 龙粳 桦川县 新城镇协胜农副产品专业合作社 LJ-27 81 龙粳 富锦市 上街基镇宋店水稻生产示范基地 LJ-28 82 龙粳 同江市 同江镇新光村水稻生产基地 LJ-29 83 垦稻 尚志市 河东乡莲荷村 K-1 84 垦稻 尚志市 鱼池乡鱼池村 K-2 85 垦稻 尚志市 石河子镇宝山村 K-3 86 垦稻 尚志市 黑龙宫镇龙宫村 K-4 87 垦稻 尚志市 马延乡荣安村 K-5 88 垦稻 延寿县 延河镇新发村 K-6 89 垦稻 延寿县 青山乡北顺村 K-7 90 垦稻 延寿县 玉河乡长胜村 K-8 91 垦稻 延寿县 安山乡华炉村 K-9 92 垦稻 延寿县 寿山乡三星村 K-10 93 垦稻 延寿县 六团镇团结村 K-11 94 垦稻 延寿县 加信镇同德村 K-12 2.2实验方法 2.2.1样品前处理 称取大米样品 20 mg于1.5 mL离心管中,用移液器加入200 uL甲醇,涡旋 30 s, 加入540pLMTBE 涡旋 3 min, 再加入360pL水,涡旋30s, 室温下静置10 min, 然后在4℃,15000 r/min条件下离心10 min。离心结束后,提取液分为有机相和水相,最下层为样品残渣。 分层提取液上层为有机相,全部取出,置于 N-EVAP 氮吹仪上,在30℃下吹干,用1mL 乙腈/异丙醇/水(比例为65/30/5)的混合溶液复溶,涡旋30 s, 在室温、15000 r/min 条件下离心 10 min, 将上清液移至样品瓶,待 UPLC/Q-TOF-MS检测,进行脂质组学研究。上机时将所有样品序号打乱,随机排列,以避免仪器误差对结果造成影响。 下层提取液为极性相(水、甲醇),全部取出,氮气吹干,用100 uL 20%甲醇溶液复溶,涡旋 30 s, 在室温,15000 r/min条件下离心10 min, 将上清液移至样品瓶,待 UPLC/Q-TOF-MS检测,进行代谢组学研究。j。上机时将所有样品序号打乱,随机排列,以避免仪器误差对结果造成影响。 质量控制样品(Quality control, QC):从每个样品中取出相同量的稻米粉末,充分混匀,作为质量控制样品,其处理方式同上。上机时将质量控制样品均匀的分布在分析序列中,以监控控品数据采集过程,校正仪器误差,验证实验数据的准确性(Plumb,2006)。 2.2.2色谱条件 代谢组学:色谱柱为 Agilent SB-Aq 柱,规格1.8 um, 2.1×100mm, 流动相A相为1%甲酸水,B相为纯乙腈,进样量5 uL, 洗脱梯度见表2.2。 表2.2流动相梯度洗脱参数 Table 2.2 The gradient elution procedure of mobile phase 时间 流速 Flow rate 流动相B/% mL/min 流动相A/% Time/min initial 0.3 95 5 1.00 0.3 95 5 4.00 0.3 80 20 13.00 0.3 60 40 14.00 0.3 20 80 15.00 0.3 0 100 15.10 0.3 95 5 脂质组学:色谱柱Waters T3柱,规格1.8 um, 2.1×100mm, 流动相A相为混合溶剂乙腈:水=3:2,B相为混合溶剂异丙醇:乙腈=9:1, A、B相各加10mM醋酸铵,进样量5pL,洗脱梯度见表2.3。 表2.3流动相梯度洗脱参数 Table 2.3 The gradient elution procedure of mobile phase 时间 流速 Flow rate 流动相B/% mL/min 流动相A/% Time/min initial 0.26 70 30 1.50 0.26 46 54 4.00 0.26 45 55 14.00 0.26 20 80 17.00 0.26 15 85 表2.3(续) 17.50 0.26 0 100 21.50 0.26 0 100 2.2.3质谱条件 TOF 质量扫描范围: m/z 100-1000Da,使用数据关联采集模式,开启动态背景扣除,气帘气30 psi, Gasl 为 50 psi, Gas2 为50 psi, 温度550℃。正离子扫描模式: ESI 源喷雾电压 5000V,解簇电压80V。载气为氮气,碰撞气为氩气。 2.2.4数据处理 稻米样品经UPLC/Q-TOF-MS分析后得到原始数据,利用 Analyst1.7.1 软件(AB Sciex 公司,美国)得到原始图谱信息。在 Markerview 1.3.1软件进行保留时间校准,峰识别,滤噪处理以剔除缺失值,峰匹配,完成数据预处理得到保留时间、峰面积等数据信息。 仪器检测参数、峰匹配参数、滤噪处理参数根据仪器说明书上的参考值优化设置。将采集的原始数据在 Marker View软件中打开,样品按照品种分组后进行主成分分析,然后进行T检验分析,不同组之间进行比较,按照P值由小到大进行排序,以 P<0.05为差异具有统计学意义,P值越小,差异越大,将不具有统计学意义的化合物剔除,将筛选出的差异较大的潜在标志物利用 Peakview 软件中的 Master View 做进一步分析,查看经初筛后代谢物离子碎片的峰形以及碎片的一级、二级图,将响应好,一级二级碎片离子峰匹配好的代谢物采用 Chemspider 进行谱库比对。 2.3结果与讨论 2.3.1提取溶剂的优化 植物代谢组学主要以氨基酸、有机酸、糖类、脂类等小分子代谢物为研究对象,由于各个代谢物的极性、分子结构等理化性质存在差异,为了尽可能多的提取稻米中的代谢成分,结合已有的文献资料,实验选择了甲醇、水、甲基叔丁基醚三种溶剂的混合和溶液做提取溶剂。实验过程中对不同体积的甲醇、水、甲基叔丁基醚进行了优化比较,根据D-最优化设计方法,通过 Modde11.5软件对三种提取溶剂进行优化设计,实验方案如表2.4所示,每个比例组合做3个平行实验,以检测到的平均代谢物个数作为判定标准,选择最优的提取溶剂配比,结果如表2-4所示。 表2.4不同体积提取溶剂试验设计 Table 2.4 Experimental design of different volume of extraction reagent 实验编号 甲醇/uL MTBE/uL 水/pL 离子碎片谈/个 1 200 720 180 1588 2 200 675 225 1513 3 200 600 300 1650 4 200 540 360 1682 表2.4(续) 5 200 450 450 1587 6 200 360 540 1541 7 200 300 600 1456 通过比较发现,第4组得到的离子碎片数最多,另外随着甲基叔丁基基的体积减小,分层后有机相较少,为后期转移造成一定难度,最终选择200 uL甲醇, 540 uL甲基叔丁基醚和 360 pL水为最优提取体系。 2.3.2提取方法的优化 为了进一步考察提取方法的提取效率,研究过程中,对本实验采用的方法与文献中已报道的提取方法进行了比较。以20mg 质量控制样品为测试样,加入 100 pL 1mg/mL d3-苹果酸、dDAG(16:0/16:0)混合标准溶液做添加回收实验,每个方法做三个平行: A:为本实验提取方法。 B:先加入甲醇,涡旋,再加入2倍体积的氯仿,涡旋,最后加入水(Hu et al., 2008)。其他步骤同方法一。 C:加入甲醇/甲基叔丁基醚/水 1:3:1的提取溶剂,振荡30 min, 之后进行 10 min 冷冻超声处理,,再加入甲醇/水 1:3提取液(Giavalisco et al., 2011)。其他步骤同方法一 结果如图2.1,图中 MET 表示各个方法代谢组学正离子模式下的回收率, LIPID 表示各个方法脂质组学正离子模式下的回收率。从图中可以看出方法一代谢回收率略高于方法三,明显高于方法二,脂质回收率相差不大,方法三略低。综合来说,本实验方法具有较好的提取效果。 LIPID 图2.1不同提取方法回收率 Figure 2.1 The recovery of different extraction methods 2.3.3仪器条件的优化 为了校正色谱峰,使色谱信息更完整,获得较好的检测结果,实验过程中对流动相进行了优化,优化方案见表2.5。 表2.5流动相选择 Table 2.5 The choice of mobile phases 脂质组学 A相 B相 60%乙腈 异丙醇/乙腈9:1 60%乙腈+10mM醋酸钠 异丙醇/乙腈 9:1+10mM 醋酸钠 水 乙腈 代谢组学 水+0.1%甲酸 乙腈 水 甲醇 水+0.1%甲酸 甲醇 通过比较仪器色谱图,,1可以发现,脂质组学A、B两相中各加入10mM醋酸钠时代谢物离子化和分离效果较好,代谢组学A 相为水+0.1%甲酸,B相为乙腈时峰形好,响应较高,说明加入微量甲酸有助于提高离子化效率。图2.2和图2.3分别为代谢组学正离子模式下的总离子色谱图和脂质组学正离子模式下的总离子色谱图。 图2.2代谢正离子模式下代表性总离子流色谱图 Figure 2.2 Representative total ion chromatogram in metabolomics positive mode 图2.3脂质正离子模式下代表性总离子流色谱图 Figure 2.3 Representative total ion chromatogram in lipidomic positive mode 2.3.4方法验证 为了验证方法有效性,采用9种代谢物标准品做低、中、高三个水平的添加回收实验,向质控样品中分别加入10、50、100 pL 的10 mg/L混合标准溶液,每个添加水平做三个重复,计算平均回收率,结果如表2.6。 表2.69种代谢物在低、中、高添加浓度时的回收率和 RSD Table 2.6 Recovery of 9 metabolites at low, medium and high concentration 代谢物 低浓度回收率(%) 中浓度回收率(%) 高浓度回收率(%) L-色氨酸-d5 78.51 75.27 80.16 d3-苹果酸 87.12 84.07 81.36 d3-己基-肉碱 78.12 72.43 76.38 d3-癸酰基-肉碱 80.94 74.18 83.41 dLPC(16:0) 87.13 82.07 84.62 dLPE(18:0) 80.43 87.11 79.91 dPC(16:0/16:1) 76.84 89.13 82.56 dDAG(16:0/16:0) 85.13 91.07 84.71 PC (17:0/17:0) 89.94 102.81 97.15 结果表明9种内标代谢物的添加回收率在 70.0%~110.0%,表明该方法具有较好的提取效率,满足实验要求。 2.3.5数据分析 2.3.5.1不同品种稻米主成分分析 主成分分析实际上是一种降维的统计学方法。作为一种简化数据集的技术,通过线性变换将数据变换到一个新的坐标系统中,使得任何数据投影的第一大方差在第一个坐标(称为第一主成分)上,第二大方差在第二个坐标(第二主成分)上,依次类推。主成分分析通过减少数据集的维数,保持数据集的对方差贡献最大的特征。 为从检测到的海量原始数据中提取有效信息,观察各品种数据的聚类情况,将经过预处理的数据进行无监督的 PCA 分析。图2.4、图2.5分别为早期采用部分实验样品(D-1~D-18, SJ-1~SJ-12,KD-1~KD-12,LJ-1~LJ-8)开展实验得到的代谢组学正离子模式和脂质组学正离子模式下不同品种稻米的 PCA 得分图。从图中可以清楚地发现,同一品种稻米成簇分布,表明同一品种稻米代谢物成分类似,组内均一性好;不同品种稻米相距较远,说明不同品种稻米的内源代谢物存在较大差异。 ▲ daohuaxiang 图 2.4代谢组学正离子模式下不同品种稻米的 PCA得分图 Figure 2.4 Score plot of rice from 4 different breed in metabolomics positive modeScores for D1 (33.5%) versus D2 (33.5%), Log| Pareto (DA)▲ daohuaxiang longjing suijing 图2.5脂质组学正离子模式下不同品种稻米的 PCA 得分图 Figure 2.5 Score plot of rice from 4 different breed in lipidomic positive mode 实验过程对绥粳稻米进行产地鉴别,观察到不同地区同一样品间存在的差异,结果如图 2.6所示,可以发现 SJ-1、SJ-4、SJ-5、SJ-11和 SJ-14相距较近,查看样品信息,发现这5个样品来自鹤岗市, SJ-3、SJ-10和 SJ-12来自鸡西市,其它样品来自哈尔滨市。这三个地区的绥粳稻米被很好地区分开,说明同一品种不同地区之间存在一定差异,进一步说明该方法能够用于稻米产品溯源的研究。 图2.6绥粳稻米的 PCA 得分图 Figure 2.6 Score plot of rice from Sui jing rice 为了进一步验证方法的有效性,后期改变试验样品量(D-1~D-30, KD-1~KD-12, LJ-1~LJ-29),采用同样方法进行检测。对数据进行 PCA 分析,图2.7,图2.8分别为得到的代谢组学正离子模式和脂质组学正离子模式下不同品种稻米的 PCA 得分图。从图中可以看出三个品种被很好地区分开,进一步说明三个品种代谢物差异明显。 图 2.7代谢组学正离子模式下不同品种稻米的 PCA 得分图 Figure 2.7 Score plot of rice from 4 different breed in metabolomics positive mode 图2.8脂质组学正离子模式下不同品种稻米的PCA得分图 Figure 2.8 Score plot ofrice from 4 different breed in lipidomic positive mode 另外,为找到品种间差异性特征化合物,对实验数据进行 t检验。以 P<0.05为差异具有统计学意义,将不具有统计学意义的化合物剔除。以P值进行排序后,将明显具有差异性的化合物挑出,依据保留时间,质核比返回 Peak view 查看碎片离子一级和二级谱图,以便后期进一步定性。如图2.9为 peak name 304.3/10.1(2771)特征内源代谢物在三个品种中的丰度。从图中可以看出,该化合物在垦稻中含量最丰富,龙粳中含量次之,稻花香中含量最少。因此可以利用该化合物的差异去区分三个品种的稻米。 l DHX KD LJ Sample (by index) 图2.9不同品种稻米的t检验得分图 Figure 2.9 The t-test score plot of different rice varieties 2.3.5.2差异化合物的鉴定 将经t检验初筛的潜在标志物利用 Peak view 软件中的 Master View 做进一步分析,查看经初筛后代谢物离子碎片的峰形以及碎片的一级、二级图,将响应好,一级二级匹配好的代谢物尝试用 Chemspider 进行谱库比对,推测化合物可能对应的分子式,详细信息见表2.7, 以 Chemspiderd中 CSID 号为 3687646的特征化合物为例,其一级、二级质谱图见图2.10所示。由于缺乏一定相关经验,未对化合物结构做深入研究。 表2.7不同产地稻米潜在标志物的鉴定 Table 2.7 Identification of potential biomarkers in different breed of rice 序号 CSID 保留时间/min 实际质核比 理论质核比 分子式 1 2257014 4.55 338.3174 338.3176 C17H14N404 2 57514551 9.01 405.6123 405.6127 C22H47NO5 3 3687646 7.52 289.4541 289.4513 C16H35NO3 4 8704116 1.60 481.1814 481.1839 C22H28N2010 5 2257014 4.54 338.3175 338.3164 C16H18O; 6 8469199 10.32 389.6129 389.6157 C22H47NO4 7 32701296 12.64 401.6666 401.6635 C24H5jNO: 8 57514551 9.04 405.6123 405.6147 C22H47NO5 9 456973 1.46 261.4008 261.3967 C14H3NO 10 95755 1.38 305.4534 305.4532 C16H35NO4 11 4510369 3.48 312.4893 312.4870 C19H3603 12 56394 4.28 340.5405 340.5412 C21H4003 13 2517805 3.01 389.6129 389.6178 C22H47NO4 14 1125104 1.43 375.5054 375.5017 C21H33N303 图2.10 CSID8704116二级裂解质谱图 Figure 2.10 Secondary pyrolysis mass spectra of CSID8704116 2.3.6次年样品对源源方法的验证 为考察筛选出的特征性内源代谢物及溯源模型有效性,选取第二年采自相同地区,四个品种稻米各5个对建立的方法模型进行验证。结果如图2.11所示,三个品种稻米能够被明显区分和识别,所检测到的特征代谢物与之前筛出的基本相同,进一步说明所建立的方法与模型的可行性。 图2.11三个不同品种稻米的 PCA 得分图 Figure 2.11 Score plot of rice from 3 different breed origins 2.4小结 ,本章对提取方法,提取溶剂比例以及仪器条件进行了优化,建立了基于代谢组学和脂质组学的溯源分析方法。通过9种代谢物标准溶液进行了方法学考察,结果表明,本实验方法的可行性。实验过程中将经过前处理的样品借助UPLC/Q-TOF-MS 进行代谢正离子扫描和脂质代谢正离子扫描,能够获得较多的碎片离子峰。对采集到的数据借助 Markerview 1.3.1软件进行主成分分析结果显示同一品种不同产地以及不同品种的稻米能够被很好地区分开,经t检验后,筛选出P值小于0.05,具有统计学意义的潜在标志物利用 Peak view 软件中的 Master View 做进一步分析,最终筛选出14个一级二级谱图匹配好, 与 Chemspider 谱库匹配度在90以上的特征内源代谢物。由于实验过程中对代谢组学的研究还处于初级阶段,未对筛选出的特征化合物的归属以及形成机理做深入研究,后期会加强这方面的学习。 第三章利用气质联用技术进行基于代谢组学的稻米溯源技术研究 稻米中代谢物组分十分复杂,单一的检测分析方法仅能获得有限的代谢组信息,采用多技术联用的手段进行全面系统研究的研究十分必要(赵洁妤,2016)。 LC-MS 虽然灵敏度高、检测范围宽,但一些化合物容易受仪器状态、压力、流动相的限制的影响而导致保留时间发生偏移或者响应过低无法被检测,像一些酯类、烷基化衍生物等都不适合用 LC-MS 检测。 GC-MS 凭借分别率高、重现性好等特点对一些极性较低、热不稳定、衍生化后挥发性增强的代谢物具有较好的检测效果(陈冬梅等,2015)。随着气相色谱质谱联用技术的不断发展, GC-MS 已广泛应用于多个领域(Yoshida et al.,2012; Hernandez et al., 2012)。当GC-MS与 TOF MS串联使用时,能够对目标离子进行一级和多级质谱的高分辨质量测定,实现对复杂样品中未知化合物的结构解析(范若静等,2012)。 Agilent 7200 GC-QTOF 是具有高分辨、准确质量和高灵敏度的全扫描质谱, EI/CI 能快速完成切换,方便确定分子离子。其自带的 Masshunter 为 DRS软件,可解析复杂色谱中的可能组成,同时可进行数据库检索;利用MPP 软件可建立预测模型,进行标志化合物的鉴定。本章节利用GC/Q-TOF MS 仪器技术对不同品种稻米中代谢物开展代谢组学研究,以建立有效分析方法。后期对检测数据进行主成分分析,筛选特征化合物,,1以期为不同稻米品种的鉴别提供技术支撑。 3.1材料与方法 3.1.1仪器 Agilent 7890B 气相色谱系统与 Agilent 7200 Q-TOF-MS,台式高速冷冻离心机(Sigma,德国),N-EVAP 氮吹仪 (Organomation, 美国),旋涡混合器 (Thermo,美国),最小量程为10 mg的电子天平(赛多利斯,中国), Milli-Q净水系统(Milli-PORE公司, 德国), Transferpette"s 移液器 (BRAND, 德国), 1.5mL离心管 (Axygen, 美国)。 3.1.2试剂 甲苯(色谱纯, Fisher), 纯度99%的甲氧基胺盐酸盐、吡啶溶液购自百灵威科技有限公司,N-甲基-N-三甲基硅基三氟乙酰胺(MSTFA)、三甲基氯硅烷(TMCS) 购自 Sigma-Aldrich 公司,色谱纯甲醇、乙腈、异丙醇、甲基叔丁基醚(MTBE)购自 Fisher 公司。苏氨酸、苹果酸、亮氨酸、芥子酸、丝氨酸、角鲨烯、葡萄糖、柠檬酸、甘露糖、尿嘧啶购自美国 Sigma-Aldrich 公司。 3.1.3样品 实验用稻米样品来源与制备同2.1.3. 3.2实验方法 3.2.1样品前处理 称取大米样品 20 mg于1.5mL离心管中,使用移液器加入200 pL甲醇,涡旋 30 s,加入540uLMTBE 涡旋 3 min, 再加入360 uL水,涡旋 30 s, 室温下静置10 min, 然后在4℃,15000 r/min条件下离心10 min。离心结束后,提取液分层为有机相和水相,最下层为样品残渣。吸取 100 uL下层液体,加入10 pL 浓度为 0.4 mg/mL 的核糖醇水溶液做为内标。用氮气吹干,加入100 pL甲苯以去除可能残留的水分,涡匀,氮气吹干后加入10 pL 浓度为 40 mg/uL 的甲氧基胺盐酸盐(溶剂为无水吡啶),置于40℃下100 min, 再加入90 pL的 MSTFA (内含1%TMCS), 涡旋30s,用封口膜密封后置于40℃下 35 min, 之后15000 r/min 条件下离心 5 min, 取上清液至进样瓶内插管内,待测。 3.2.2色谱条件 毛细管色谱柱为 DB-5 MS (Agilent, 30 mx0.25 mmx0.25 um),1以氦气作为载气,流速设为1 mL/min,恒流,进样口温度为280℃,采用不分流进样模式,进样量为1pL,仪器升温程序:起始温度60℃,保持1 min, 然后以10℃/min, 升温至325℃,保持10 min, 总运行时间37.5min, 仪器传输线温度设为280℃。 3.2.3质谱条件 以全扫描的方式检测,采用重现性较好的EI 源电离模式,离子源温度280℃,四极杆温度150℃, 溶剂延迟时间设为 3min,质量数范围50m/z 至800m/z,谱图采集速率为 5Hz,l以棒状图和轮廓图两种模式采集。 3.3结果与讨论 3.3.1衍生条件优化 衍生化是利用 GC-MS 进行代谢组学研究必不可少的环节,主要分为酯化、醚化、硅烷化等。像一些亲水性或含有羟基、羧基、氨基等基团的化合物在检测时需进行衍生化使其挥发性加强,极性减弱(Petrovic et al., 2012; Yang et al.,2011),如一些含有活泼氢的糖、氨基酸、有机酸、脂肪酸等的代谢物,经过衍生化后能够被 GC-MS 成功检测(Kusano et al., 2011)。衍生化的原理是硅烷化试剂中的三甲基硅烷基团将羟基、羧基中的活泼氢取代。为使代谢物提取效率最优化,实验过程中对衍生化方法,衍生温度、时间进行了比较。 3.3.1.1衍生化方法选择 衍生方法有一步衍生法和两步衍生法,两步衍生法是先进行肟化,再进行硅烷化,而一步衍生化仅进行硅烷化。其中两步衍生法的使用在文献中报道较多(王鹏飞等, 2012; Hong et al., 2012),常用的硅烷化试剂为 MSTFA, TMCS 对硅烷化效果有促进作用(De et al.,2014)。两步衍生法可削 弱糖类异构体的影响(Boldizsa et al., 2008),但步骤较复杂。为了获得最优的衍生化结果,尽可能多的检测稻米中内源代谢物,研究中选取了稻花香(DHX)、垦稻(KD)、龙粳(LJ)三个品种,以观察到的代谢物个数为观察指标,对两种方法进行了比较。 a、一步衍生法:样品不使用甲氧基酸盐肟化,直接衍生化处理; b、两步衍生法:样品先进行肟化,再用MSTFA (内含1%TMCS) 试剂硅烷化处理。 c、两步衍生法:样品先进行肟化,再用 MSTFA 试剂硅烷化处理。 不同处理得到的代谢物数量如图3.1所示。从图中可以发现不进行肟化处理检测到的内源代谢物数量最少,以含有1% TMCS 的 MSTFA 硅烷化试剂处理后检测到的代谢物数量最多。说明两步衍生法要优于一步衍生法,且添加微量 TMCS 可促进 MSTFA 的衍生效果,所以本实验采用b衍生方法。 a b c 不同品种稻米 图3.1不同衍生方法对3种稻米样品代谢物种类的影响 Figure 3.1 Effect of different derivatization method on metabolites for 3 rice samples 3.3.1.2衍生温度、时间优化 温度优化:查阅相关文献(Szopa et al., 2001; Chen et al., 2013)发现肟化温度常设为37℃,实验过程中考察温度段25-55℃,期间保持硅烷化温度和衍生化时间不变,以检测到的代谢物数量和总相对峰面积(代谢物与内标物峰面积比值)为观察指标。结果如图3.2A 所示,可以发现在考察温度范围内,当温度为40℃时,代谢物数量和总相对峰面积达到最大,所以肟化温度设为40℃。 硅烷化温度考察范围为25-55℃,期间保持肟化温度和衍生化时间不变,结果如图3.2B所示,当温度在40-45℃时,代谢物数量和总相对峰面积都相对较高,且变化不大,所以选择40℃为最优硅烷化温度。 衍生时间优化:为使衍生效果和衍生效率都达到最优化,实验过程中分别考察了肟化和硅烷化阶段的衍生时间对代谢物数量和总相对峰面积的影响,考察时间范围都为30-120 min。从图3.2C可以看出,当肟化时间为 100 min, 衍生效果最好;从图3.2D可以看出,在测试时间段,代谢物数量变化不大,为使衍生效率最高,将硅烷化时间定为 35 min。 图3.2衍生化温度、时间对代谢物的影响 Figure 3.2 Effect of derivatization temperature and time on metabolites 3.3.2方法验证 为了进一步验证样品处理方法的有效性,实验过程中选取苏氨酸、苹果酸、亮氨酸、芥子酸、丝氨酸、角鲨烯、葡萄糖、柠檬酸、甘露糖、尿嘧啶10种标准品,以质控样品为基质,对线性、重现性、回收率进行了方法学考察。 线性考察:为了更好地观察内源代谢物的浓度和响应间的关系,对10种标准品在 0.01-0.5mg/mL 线性区间内绘制标准曲线,其相关系数R²见表 3.1。 回收率和重现性:平行称取6个稻米样品做添加回收实验,其中5个重复,一个基质标准。按照上述方法进行处理和检测。10种标准物质的回收率和 RSD 见表 3.1。 表3.110种代谢物的保留时间、回收率、RSD 和相关系数R Table 3.1 Retention time, recoveries, RSD and R’of 10 metabolites 保留时间(min) 化合物 回收率(%) 相对标准偏差(%) 相关系数R² 7.81 苏氨酸 81.4 4.3 0.994 9.43 苹果酸 79.1 2.7 0.997 4.55 亮氨酸 70.7 7.1 0.991 表3.1(续) 30.21 芥子酸 75.3 4.2 0.993 5.63 丝氨酸 70.1 6.8 0.995 36.1 角鲨烯 81.3 3.4 0.997 17.44 葡萄糖 74.9 6.9 0.991 16.62 柠檬酸 71.2 7.1 0.993 18.23 甘露糖 73.8 9.7 0.990 7.15 尿嘧啶 78.0 4.6 0.996 3.3.3数据分析 数据处理使用安捷伦 Unknown analysis 分析软件(B.08)进行查找化合物,然后通过 Nist14和 Fiehn 化合物谱库自动完成谱库检索。使用 Unknown 分析软件的输出工具,创建 CEF 文件,并导入到安捷伦 Mass Profiler Professional(MPP)(14.5)软件进行深度的统计分析。 深度统计分析时,使用未知物分析软件中的 Suremass 功能进行化合物查找,质量提取窗口设为100 ppm, 保留时间窗口大小因子为100。通过与 NIST14 和 Fiehn 谱库检索进行化合物初步鉴定(如图3.3所示)。其中A:样品信息列表,包括样品名称、 Suremass 之后得到的组分数和匹配的化合物个数等;B:组分信息列表,包括组分化合物名称,保留时间和匹配因子等;C:总离子流图和 Suremass 查找到的化合物的色谱图; D:提取离子(EIC 图); E: Suremass 后化合物质谱图;F:分子结构图;G:标准质谱图。 图 3.3NIST14 和 Fiehn 谱库检索示意图 Figure 3.3 The sketch map of library searching from NIST14 and Fiehn 对3个品种的37个稻米样品的检测数据使用 Mass Hunter Unknown Analysis 软件查找化合物后,借助 MPP手段完成数据的峰匹配,并依据代谢物的保留时间、精确质量数完成峰对齐、数 据归一化以及过滤和校正缺省值。。一般将P<0.05,倍率变化≥2(含量在不同组别之间变化大于2倍)作为不同品种稻米间存在显著差异的判别标准,最后筛选出在化学组成上对对品区分贡献较大的19种特征内源代谢物。对这些特征标记物进行主成分分析并绘制3D图(图3.4),如图所示,37个稻米样品明显分为3类,有力地说明不同品种之间稻米代谢物的组成成分存在很大差异。造成不同品种间内源代谢物显著差异的原因很多,,主要为生长环境的不同和品种间基因的差异。 图3.4三个不同品种稻米的 PCA 得分图 Figure 3.4 Score plot of rice from 4 different breed origins 分析过程中,主成分PC1,PC2, PC3, PC4 的贡献率分别为51.02%,17.36%,7.58%,5.08%,累计贡献率超过 80%。图3.5为四个主成分的贡献率图。 图3.5四个主成分的贡献率图 Figure 3.5 Contribution rate figure of four principal component 通过查阅相关资料(Fiehn,2003),对筛选出的19种特征物进一步确证是否为稻米的内源代谢物,防止溶剂等造成干扰,最终将与标准谱库匹配度大于90的8个内源代谢物挑选出来做为潜在特征目标物。最终筛选出来的8个潜在特征内源代谢物具体信息见表3.2。 表3.2潜在特征内源代谢物信息 Table 3.2 The information of potential characteristics of endogenous metabolites 编号 化合物名称 保留时间 匹配度得分 1 左旋谷氨酸 13.36 90.1 2 柠檬酸 16.61 94.8 3 4-氨基丁酸 13.35 95.1 4 肌醇 19.36 96.3 5 D-甘露醇 17.95 96.7 6 D-葡糖酸 18.48 98.4 7 角鲨烯 28.26 91.3 8 赖氨酸 13.68 93.7 其中肌醇、赖氨酸、角鲨烯已被前人应用于鉴定不同产地稻米。可以发现D-葡糖酸的匹配度最好,得分为98.4。 现以D-葡糖酸为例,对其进行分析。图3.6给出了 D-葡糖酸的叠加提取离子色谱图与通过谱库匹配的镜像图,从图中可以清楚地发现,D-葡糖酸的二级谱图中特征离子碎片与标准谱库中的总体吻合,响应也大体相同。 Component RT: 18.4829 图3.6D-葡糖酸的叠加提取离子色谱图(左)、组分和谱库谱图的镜像图(右) Figure 3.6 Superimposed extract ion chromatograms of D-Gluconic acid (left), mirror image of components andspectral library spectra (right) 为了更清晰的表征其在样品中的含量差异,现以峰面积为变量绘图(见图3.7),可以发现D-葡糖酸在垦稻(KD)中含量最高,龙粳(LJ)稻米中含量次之,而稻花香(DHX)品种中含量明显低于其他两个品种。因此D-葡糖酸可作为区分三个稻米品种的指标应用于稻米溯源中。 图3.7D-葡糖酸在不同品种稻米中的丰度 Figure 3.7 The abundance of D-Gluconic acid in different variety of rice 3.3.4次年样品对溯源方法的验证 为考察筛选出的特征性内源代谢物及溯源模型有效性,选取第二年采自相同地区,三个品种稻米各6个对建立的方法模型进行验证。结果如图3.8所示,三个品种稻米能够被明显区分和识别,左旋谷氨酸、柠檬酸等8个特征代谢物同样筛出,进一步说明所建立的方法可行性。 图3.8三个不同品种稻米的 PCA 2D 得分图 Figure 3.8 Score plot of rice from 4 different breed origins 3.4小结 本章节利用 GC/Q-TOF MS仪器技术对不同品种稻米中代谢物开展代谢组学研究。通过对衍生化方法、衍生温度、时间进行了优化,最终确定样品衍生化方法为两步衍生法,先进行肟化, 试剂为甲氧基胺盐酸盐吡啶溶液,温度设为40℃,时长100 min, 然后再进行硅烷化,硅烷化试剂为含有1%三甲基氯硅烷的N-甲基-N-三甲基硅基三氟乙酰胺溶液,温度设为40℃,时间定为35 min, 此时具有最佳的提取效果。同时,借助十种标准品对建立的方法进行了方法学考察,该方法的线性,回收率、重现性良好。后期对检测数据进行主成分分析,筛选出与标准谱库匹配度得分高于90的8种内源代谢物,分别为左旋谷氨酸、柠檬酸、4-氨基丁酸、肌醇、D-甘露醇、D-葡糖酸、角鲨烯、和赖氨酸。研究表明这八种潜在特征内源代谢物对区分稻花香、龙粳和垦稻三个品种贡献较大。 实验只进行了初步研究,由于样品数量和采样区域的限制,未对筛选出的特征内源代谢物进行深一层次的考证,其代表性有待进一步验证。今后应加强多地区多品种的分析,以期筛选出更多化合物,为稻米溯源提供技术支撑。 第四章利用气相色谱离子迁移谱联用技术进行溯源技术研究 气相色谱技术做为一种分离效率高、分析速度快的分离分析方法,在工业、农业、化工等领域的科学研究中得到了广泛应用(李红等,2011;Rahim et al., 2011)。气相色谱功能的好坏很大程度上取决于检测器的性能。检测器可以将载气带入的组分变化转变为电信号,常用的检测器有氢火焰检测器、电子捕获检测器等(关亚风等,2011)。随着离子迁移谱的不断发展,其快速高效、前处理简单、选择性好的特点充分显现出来,将 IMS 做为气相色谱的检测器可以将两者快速分离和高灵敏的特点结合起来,具有很大的应用前景(Kanu et al.,2008)。 在农产品溯源及品质鉴定等方面,快速高效、操作简单、化学试剂用量少的技术受到越来越多地青睐。电子鼻作为一种新兴技术,具有操作简单、检测快速等优点,已成功应用于茶叶品质鉴定等领域(于慧春等,2008),但存在精确度低、结果重现性差等缺点。气相色谱离子迁移谱联用技术 (GC-IMS)的发展为快速准确地实现产品溯源和品质鉴定提供了新的思路。 本实验借助 FlavourSpec@食品风味分析与质量控制系统对稻花香稻米进行了成分分析,并对稻花香与绥粳、垦稻、龙粳间的差异进行了考察。 4.1材料和方法 4.1.1仪器 FlavourSpecR风味谱仪 (G.A.S.mbH, 多特蒙德,德国), CTC 自动顶空进样器。 4.1.2样品 实验用稻米样品来源与制备同2.1.3. 4.2实验方法 4.2.1样品前处理 样品前处理简单,无需化学试剂提取。将稻米样品称取 5g 置于 20mL 顶空瓶中,65℃下孵化10 min, 经顶空进样借助气相离子迁移谱仪 FlavourSpec⑧进行测试。 4.2.2分析条件 食品风味分析与质量控制系统操作简单,无需高真空条件,检测速度快。具体检测条件见表4.1。 表 4.1分析条件 Table 4.1 Analysis condition FlavourSpecR 分析时间 15min 色谱柱类型 FS-SE-54-CB-0.5 15m ID: 0.53mm 柱温 40℃ 载气流量 2ml/min-100ml/min 漂移气流量 150ml/min 载气/漂移气 N2 IMS温度 45℃ 进样针温度 85℃ 进样体积 500 uL 孵化时间 10 min 孵化温度 65℃ 4.2.3仪器工作原理及充程 样品跟随载气进入气相色谱柱,经初分离后进入 IMS 电离室,在离子源的作用下,载气分子和样品分子发生一系列的电离反应和离子-分子反应,形成各种产物离子。之后在迁移管电场作用下,这些离子通过周期性开启的离子门进入漂移区。在与逆流的中性漂移气体分子不断碰撞的过程中,依据不同离子在电场中各自迁移速率的差异,从而使不同的离子得到分离,达到二次分离的目的,最后在检测器中被检测形成电信号,达到鉴定目的。 4.3 数据分析 迁移管末端的法拉第盘将采集到的离子信号转变成电流,被放大后进入信号处理系统对信号进行处理。G.A.S 系统自带的数据分析软件可以生成挥发性有机物的差异图谱,其中软件内置的2014NIST数据库和 IMS 数据库可对代谢物进行定性分析。 4.3.1不同产地稻花香的指纹图谱 为了更加方便地对比不同样品间品发性有机物的差异,数据分析过程中利用 G.A.S.公司开发的 LAV 软件的 GalleryPlot 插件,选取谱图中所有的待分析峰,自动生成指纹图谱,结果如图4.1。 图4.1不同产地样品中挥发性有机物的 Gallery Plot图 Figure 4.1 The Gallery Plot of volatile organic compound of rice from different geographical origins 图4.1中每一行表示不同产地稻花香样品(每个样品两个平行),每一列为同一保留时间及漂移时间下的有机物(不同样品中相同的物质)的信号峰。从指纹图中可以看出每种样品完整的挥发性有机物信息以及样品之间的差异性。 D1-D17 均来自五常市,挥发性有机物成分相似, D18来自延寿县与前17个样品差异较大。一些挥发性成分只存在于五常市稻花香,见区域A;一些挥发性成分在五常市稻花香中含量高于延寿县稻花香,见区域B;;一些挥发性成分只存在于延寿县稻花香,见区域C。 4.3.2不同产地稻花香的相似度 通过 GS-IMS 自带软件对样品的相似度进行分析,具体结果见表4.2。其中白色区域为延寿县稻花香 D18与五常市17个村镇样品对比,相似度均小于60%,延寿县稻花香可以清晰地被区分出来;绿色区域为五常市稻花香 D1-D2, D14-D17 与其他五常市稻花香样品对比,相似度均高于80%,粉色区域为 D3-D13 几个样品之间的对比,相似度均高于90%,说明这几种样品间差异很小,不易区分。 表4.2不同样品间的相似度(%) Table 4.2 The similarity of rice from different geographical origins(%) 样 4.3.3不同产地稻花香的主成分分析 为了更清晰的观察不同产地稻花香大米之间存在的差异性,数据处理过程中同时进行了内源代谢物的主成分分析,对样品进行统计学上的分类,结果如图4.2所示。 ■D2MD3 ■D4■D5 ■D6 ■D8 MD9■D10■D11 ■D12 ■D13 ■D14 ■D15LD16■D18 图4.2不同产地稻米的 PCA 得分图 Figure 4.2 Score plot of rice from different geographical origins D1、D7、D17三个样品因平行性不是很好,在主成分分析时被剔除。根据PCA 得分图我们不难发现,延寿县稻花香与其他稻米样品距离最远,说明延寿县稻花香所含内源代谢物与五常市稻花香差异较大。样品 D2-D16 为五常市不同乡镇的稻米,在图中距离较近且程交错分布,说明它们在挥发性有机物组成和配比上非常相似。 4.3.4不同品种稻米样品主成分分析 为了研究不同品种稻米间的差异,实验过程中同时对稻花香、绥粳、垦稻和龙粳四个品种进行了主成分分析,结果如图4.3所示。从图中发现稻花香(红色点)和龙粳(蓝色点)两个品种分布比较集中,说明它们各自品种间差异较小。垦稻和绥粳两种样品比较分散,且混合在一起,互相之间区分度不高,分析原因可能是由于这两个稻米品种挥发性有机物质含量较少,而GC-IMS主要是通过样品加热过程中产生的挥发性物质进行鉴别。从图中不难发现,所有其他样品与稻花香之间区分度很高,因此可以通过该方法鉴定未知样品是否为稻花香。 图4.3不同品种样品的 PCA 得分图 Figure 4.3 Score plot of different rice varieties 4.4样品中挥发性成分定性分析 实验过程中结合软件内置的 NIST 气相保留指数数据库及 IMS 数据库对样品中的挥发性成分进行了二维初步定性,以稻花香D-2样品为例,可疑挥发性成分定性结果见表4.3。由于谱库丰度等的局限性,实验未对定性结果做更深入的探究。 表4.3D-2样品中发发性有机化合物初步定性结果 Table 4.3 Preliminary qualitative results of volatile organic compounds in D-2sample 编号 挥发性有机物 CAS号 分子式 分子 保留时间 (sec) 2-Pinene C80568 C10H16 136.2 358.15 2 Dimethyl disulfide C624920 C2H6S2 94.2 233.303 3 Linalool C78706 C10H180 154.3 594.711 4 2-Octanone C111137 C8H16O 128.2 445.363 5 benzaldehyde C100527 C7H6O 106.1 401.631 6 2-Hexen-1-ol C2305217 C6H12O 100.2 322.012 7 1-Pentanol C71410 C5H12O 88.1 249.826 8 methylpyrazine C109080 C5H6N2 94.1 261.039 9 2,3-pentanedione C600146 C5H8O2 100.1 200.25 10 2-Pentanone C107879 C5H100 86.1 194.342 11 1-Butanol C71363 C4H10O 74.1 185.902 12 1-Hexanol C111273 C6H14O 102.2 340.057 13 1-Octen-3-o1 C3391864 C8H16O 128.2 431.7 14 2-Heptanone C110430 C7H14O 114.2 351.753 15 Limonene C138863 C10H16 136.2 476.051 16 2,5-Dimethylpyrazine C123320 C6H8N2 108.1 380.655 17 ethyl isovalerate C108645 C7H14O2 130.2 316.577 18 Isopentanol C123513 C5H12O 88.1 246.315 19 2,3-Butandione C431038 C4H602 86.1 170.789 20 Cyclohexanone C108941 C6H100 98.1 340.107 21 ethyl butyrate C105544 C6H12O2 116.2 254.492 22 dimethyl sulfide C75183 C2H6S 62.1 135.73 23 3-(methylthio) propanal C3268493 C4H8OS 104.2 372.4 24 3-Methylbutanal C590863 C5H100 86.1 196.766 25 2-ethyl-hexanol C104767 C8H18O 130.2 431.124 26 3-methylbutanoic acid C503742 C5H1002 102.1 331.434 27 (Z)-3-hexen-1-ol C928961 C6H12O 100.2 322.93 28 Acetophenone C98862 C8H8O 120.2 492.222 表4.3(续) 29 3-Methylbutyl acetate C123922 C7H14O2 130.2 320.712 30 Pentanal C110623 C5H100 86.1 220.815 31 Ethyl Acetate C141786 C4H8O2 88.1 164.661 32 1,8-Cineole (eucalyptol) C470826 C10H18O 154.3 511.684 4.5小结 本节借助 FlavourSpec"食品风味分析与质量控制系统对稻花香稻米进行了挥发性成分分析并对稻花香与绥粳、垦稻、龙龙间的差异进行了考察。利用仪器自带软件中的LAV软件中的Galleryplot 插件对样品进行了分析,发现延寿县稻花香品种内源代谢成分与五常市稻花香存在较大差别。除此之外,从主成分分析结果发现,稻花香与其他品种成分上存在较较差异,能够被很好地区分开。同时,结合软件内置的 NIST 气相保留指数数据库及 IMS 数据库对样品中的挥发性成分进行了二维定性。 经过初步研究可以发现气相色谱离子迁移谱联用对稻米中挥发性成分检测灵敏度高,且无需溶剂提取等前处理,操作简单,可用于不同品种、不同产地的稻米鉴别。但是由于该技术是针对挥发性化学成分进行检测,所以对一些挥发性化合物含量少的样品的检测具有一定的局限性。另外,由于实验样品数量和品种局限性以及谱库丰度的限制,结果的代表性和部分挥发性化合物定性的可靠性有待进一步验证。 第五章结论与展望 5.1结论 本文以东北稻米稻花香、绥粳、垦稻、龙粳为研究对象,采用代谢组学的方法,借助先进仪器手段对稻米中内源性代谢物进行非靶向筛查和分析。对不同提取方法、提取溶剂、衍生化条件等进行了优化,并开展了方法学考察。通过主成分分析等多元统计分析方法,建立稻米非靶向代谢组学和脂质组学产地溯源分析方法,筛选并鉴定出对样本分组贡献大的差异代谢物。此外本研究还探索了气相色谱离子迁移谱联用技术的适用性,通过对稻米中挥发性代谢物进行检测,以实现不同地区或不同品种稻米的差异分析,为快速进行稻米产品溯源提供技术支撑。综合全文,具体结论如下: 1.对提取方法,提取溶剂比例以及仪器条件进行了优化,应用 UPLC/Q-TOF MS 建立了基于代谢组学和脂质组学的溯源分析方法。通过主成分分析、t检验等手段最终筛选出14个一级二级谱图匹配好且与 Chemspider 谱库匹配度在90以上的特征内源代谢物。 2.通过衍生化,建立了基于 GC/Q-TOF MS 仪器技术代谢组学研究方法。筛选出与标准谱库匹配度得分高于90的8种内源代谢物,分别为左旋谷氨酸、柠檬酸、4-氨基丁酸、肌醇、D-甘露醇、D-葡糖酸、角鲨烯、和赖氨酸。研究表明这八种潜在特征内源代谢物对区分稻花香、龙粳和垦稻三个品种贡献较大。 3.借助气相色谱离子迁移谱联用技术对稻米中挥发性成分进行分析,初步筛选定性出32种挥发性特征化合物。验证出该技术检测灵敏度高,且无需溶剂提取等前处理,操作简单,可用于不同品种、不同产地的稻米鉴别。 综合比较,本实验采用的三种技术手段各有优缺点。UPLC/Q-TOF MS 灵敏度高,动态范围宽,可检测浓度差异大的代谢物,对一些小分子的氨基酸,有机酸等具有较好的检测效果,但是目前标准数据库还不完善,在未知代谢物的准确定性方面尚存在不足。而 GC/Q-TOF MS 与UPLC/Q-TOF MS 比较,其稳定性要高,重现性要好,标准的内源性、外源性代谢物数据库已相当全面,便于未知代谢物的鉴定,适用于酯类、硅烷化衍生物等挥发性物质的筛查,但是前处理需要衍生化,步骤较为繁琐,化学试剂用量大。以上两种技术适用于大量化合物的筛查,可获得内源代谢物的准确分子式,但是检测分析时间较长,仪器条件要求高。GC-IMS 作为一种新型快速筛查技术,操作简单,无需前处理,无需溶剂提提,仪器对高真空度要求低,可用于产品鉴定,具有广阔的应用前景,但是由于零溶剂萃取, GC-IMS 更适合一些挥发性物质的分析,对那些难挥发性物质的检测能力较弱,稳定性较差。 5.2展望 基于代谢组学的稻米产品溯源方法具有重要意义,通过 UPLC/Q-TOF MS 和 GC/Q-TOF MS技术研究内源代谢物来进行溯源与鉴别,具有很高的可靠性和真实性,有助于溯源方法的建立,从而规范稻米市场,真正做到产品链的顺向可追踪和逆向可溯源。另外,气相色谱离子迁移谱联 用技术以前处理简单、无需有机溶剂提取等优势在挥发性代谢物检测方法具有广泛的应用前景。后期应加强对引起稻米内源代谢物差异性的内源及外源因素的研究,加深对内源化合物代谢途径的认识,进而定性出更多特征性代谢物,为稻米产品溯源方法的建立提供技术支撑。 ( 参考文献 ) ( 1 . 蔡爽,孙博,李发美.代谢组学及其在药学中的应用[J].沈阳药科大学学报,2007, 24(7):445-450 ) ( 2. 陈冬梅,李忠,张志兴等.基于 GC-MS分析的水稻代谢组学研究策略[J].中国稻米,2015, .21(6):1-6. ) ( 3. 陈轲,颜毅坚,马军等.离子迁移谱法对地沟油的检测研究[].中国油脂,2015, 40(12):66-69. ) ( 4. 成舒乔,陈民辉,曹玲等.离子迁移谱及其应用进展[J].药物分析杂志,2012(5):912-918. ) ( 5. 范若静,张芳,郭寅龙.气相色谱-四极杆飞行时间串联质谱在加拿大一枝黄花挥发性成分检测中的应用[].分析测试学报,2012,31(9):1051-1057. ) ( 6. 冯雪.方正稻米产地溯源技术研究[D]. 河南农业大学,2016. ) ( 7. 关亚风,吴大朋,段春春.色谱仪器微型化和检测器技术的研究进展[].色谱,2011, 29(3):193-198. ) ( 8. 郭波莉,魏益民,潘家荣.同位素指纹分析技术在食品产地溯源中的应用进展[J].农业工程 学报,2007,23(3):284-289. ) ( 9. 郭波莉.牛肉产地同位素与矿物元素指纹溯源技术研究[D].中国农业科学院,2007. ) ( 韩莉.基于GC/MS 技术的脂肪酸代谢轮廓谱方法和应用研究[D].华东理工大学,2009. ) ( 回瑞华,侯冬岩,李铁纯等.不同产地稻米油脂中脂肪酸的气相色谱-质谱分析[J].质谱学报, 2008,29(6):349-352. ) ( 12. 李红,田福林,任雪冬等.气相色谱-串联质谱法测定土壤中的邻苯二甲酸酯[J].色谱,2011, 29(6):563-566. ) ( 13. 李万春.气质联用在不同茶叶品质鉴定中的应用[D]. 南京理工大学,2012. ) ( 14. 林泽彬,乐健,洪战英.液相色谱-四极杆-飞行时间质谱联用技术及其在中药代谢(组学)研究中的应用[J].中国药学杂志,2012(6):401-405. ) ( 15. 刘祥东,罗国安,王义明.代谢物组学应用的领域之二--植物代谢物组学[J].中成药,2006, 28(10):1515-1517. ) ( 16. 马奕颜,郭波莉,魏益民.植源性食品原产地溯源技术研究进展[C].中国食品科学技术学会年 会.2012. ) ( 17.彭超,黄和,肖爱华等.代谢组学分析技术平台及方法研究进展[J].食品科技,2008, 33(9):220-223. ) ( 18. 芮雯,冯毅凡,石忠峰等.不同产地黄芪药材的UPLC/Q-TOF-MS指纹图谱研究[J].药物分析 杂志.2012(04):607-611. ) ( . 帅茜.基于离子迁移谱的食用油快速掺伪鉴别技术研究[D].中国农业科学院,2015. ) ( 王鹏飞,王倩倩,李先恩等. GC-MS 技术在延胡索块茎代谢产物研究中的应用[J].植物学报. 2012(02):149-154. ) ( 21. . 王涛,梅旭荣,钟秀丽等.脂质组学研究方法及其应用[J].植物学报,2010,45(2):249-257. ) 22.王中华.基于代谢组学的2型糖尿病和环境污染物暴露生物标志物研究[D].北京协和医学院,2015. ( 23. 夏建飞,梁琼麟,胡坪等.代谢组学研究策略与方法的新进展[J].分析化学, 2009, 37(1):136-143. ) ( 24. 熊中强,王利兵,李宁涛等.气相色谱法测定高分子食品包装材料中抗氧化剂的残留量[J]. 色谱,2011, 29(3):273-276. ) ( 徐淑武,郑 健 ,毕志毅等.离子迁移谱检测技术及其应用[J].物理,2003,32(8):539-542. ) ( 许国旺,杨 军 .代谢组学及其研究进展[].色谱,2003,21(4):316-320. ) ( 杨爱葵.农产品地理标志部际联合认定与保护机制研究[].行政与法,2017(6):37-43. ) ( 于慧春,王俊.电子鼻技术在茶叶品质检测中的应用研究[J].传感技术学报,2008, 21(5):748-752. ) ( 29. 1 余磊.擦亮地理标志产品的“金字招牌”[].中国质量技术监督.2014(05):70-70. ) ( 30. 张凤霞,王国栋.植物代谢组学应用研究--现状与展望[J].中国农业科技导报,2013, 15(2):28-32. ) ( 31. 张晓焱,苏学素,焦必宁等.农产品产地溯源技术研究进展[J].食品科学,2010, 31(3):271-278. ) ( 32. 赵洪芝.拟南芥植物代谢组学及及银花代谢产物抗炎活性研究[D].南开大学,2012. ) ( 33.赵洁妤.基于 CE-MS 的代谢组学分析新方法及其在烟叶研究中的应用[D].大连理工大学, 2016. ) ( 34. 赵晓峰.原产地域产品的元素标识研究[D]. 广州大学,2011. ) ( 35. . A 1 sbury GR, Wu C, Si e ms WF, et al. S ep aration and identification of some chemical warfaredegradation p roducts u sing electrospray h igh resolution i on m obility spectrometry with m a ssselected detection[J]. Analytica Chimica Acta, 2000, 404(2):273-283. ) ( 36.] B oernsen KO, Gatzek S, Imb e rt G. Controlled protein precipitation in combination with chip-basednanospray i nfusion m ass s pectrometry. An approach f o r m e tabolomics pr o filing o f p l asma[J].Analytical Chemistry,2005, 7 7(22):7255-7264. ) ( 37.1 B oldizsa I, Fizfai Z, Molna-Perl I. C h aracteristic frag m entation patte r ns of tr i methylsilyl and trimethylsilyl-oxime derivatives of plant disaccharides as obtained b y gas chromatography coupledto ion-trap mass spectrometry[J]. Journa l of Chromatography A, 2011, 1218(43):7864-7868. ) ( 38. B usch KL. D e rivatization i n Mass Spectrometry[J]. Spectroscopy-Springfield then Eugene t henDuluth-,2010,25(11):18-22. ) ( 39. C hang YW, Zh a ng L, L u X,et al. A simultaneous ex t raction m e thod for metabolome and lipidomeand its application in cry1Ac, and sck-transgenic rice leaf treated with insecticid e based on LC- M Sanalysis[J]. Metabolomics,2014,10(6):1197-1209. ) 40.(Chen W, Gong L, Guo ZL, et al. A novel integrated method for large-scale detection, identification,and quantification of widely targeted metabolites: application in the study of rice metabolomics[J].Molecular Plant. 2013,6(6):1769-1780. 41. De B, Nag G. Metabolic diversity in the grains of Indian varieties of rice[J]. Comptes RendusBiologies. 2014,337(4):283-293. 42. Dettmer K, Aronov PA, Hammock BD. Mass spectrometry-based metabolomics[M]. MassSpectrometry Reviews. 2007, 26(1):51-78. 43. .1 Eriksson L, Antti H, Gottfries J, et al. Using chemometrics for navigating in the large data sets ofgenomics, proteomics, and metabonomics (gpm)[J]. Analytical and Bioanalytical Chemistry, 2004,380(3):419-429. ( 44. Fahy E, Subramaniam S, Bro w n HA, e t al. A co mp rehensive classification system for lip i ds[ J ].European Journal of Lipid Science a nd T echnology, 2005, 1 0 7(5):337-364. ) ( 45..I Fahy E, Subramaniam S , Murphy RC, et al. Update of the LIPID MAPS c o mprehensive: classification system for lipids[J]. Journal of Lipid Research, 2009, 50 (Supplement):S9-S14. ) ( 46. 1 Fardet A, L lorach R, M a rtin JF, e t al. A liquid chromatography-quadrupole time-of-flight(LC-QTOF)-based me t abolomic approach rev e als ne w met a bolic effects of catechin i n rats f edhigh-fat diets[J]. Journal of Proteome Research, 2008,7(6):2388-2398. ) ( 47. 1 F iehn O. Combining genomics, metabolome analysis, a nd biochemical modelling to understandmetabolic n etworks[J]. C o mparative and Functional Genomics, 2001,2(3):155-168. ) ( 48. Fiehn O . Metabolic n e tworks of Cucurbita maxima phloem[J]. Phytochemistry. 200 3 , 62(6 ) :875-886. ) ( 49. F iehn O. Metabolomics--the li n k between genotypes and phenotypes[J]. Plant Molecular Biology.2002,48(2):155-171. ) ( 50.1Franke BM, G r emaud G, Hadorn R, et al. Geographic origin of meat-elements of an analytical approach t o its authentication[J ] . Europea n Food Research and Technology. 2005,221(3-4) 493-503. ) ( 51. 1 F uzfai Z, Boldizsar I, M o lnar-Perl I. Characteristic fragmentation patterns of t h e trimethylsilyl andtrimethylsilyl-oxime derivatives of various saccharides as obtained b y gas chromatography coupledto ion-trap mass spectrometry[J]. Journal of Chromatography A, 2008,1177(1): 183- 1 89. ) ( 52.( G eng LL, S u n HY, Ya n Y, et al. Discrimination of raw and vinegar-processed G enkwa Flos usingmetabolomics coupled wi t h mu l tivariate data analysis: A discrimination study with metabolomicscoupled with PCA[J]. Fitoterapia, 2013,84(1):286-294. ) ( 53. German JB, Gillies LA, Smilowitz JT, et al. Lipi d omics and l i pid p rofiling in me t ab o lomics[J]Current Opinion i n Lipidology,2007,18(1):66-71. ) ( 54. .( G iavalisco P , Li Y , M atthes A , e t a l . Elemental f ormula a n notation of p o lar a n d l i pophilic metabolites using l ’c, 1 5N and 34s isotope labelling, i n combination with h i gh-resolution mass spectrometry[J]. Plant Journal, 2011, 68(2):364-376. ) ( 55. .( Griffiths WJ, Koal T , W ang YQ, et al . Targeted metabolomics for bi o marker discovery[J].Angewandte Chemie In t ernational Edition, 2010, 49(32):5426-5445. ) 56. Gu Q, David F, Lynen F, et al. Evaluation of automated sample preparation, retention time locked gas chromatography-mass spectrometry and data analysis methods for the metabolomic study ofArabidopsis species[J]. Journal of Chromatography A, 2011, 1218(21):3247-3254. 57. Hernandez F, Sancho JV, Ibarez M, et al. Current use of high-resolution mass spectrometry in theenvironmental sciences [J]. Analytical and Bioanalytical Chemistry, 2012,403(5):1251-1264. 58.HIong ZY, Lin ZB, Liu Y, et al. Innovative microwave-assisted oximation and silylation proceduresfor metabolomic analysis of plasma samples using gas chromatography-mass spectrometry[].Journal of Chromatography A. 2012, 1254: 14-22. 59. Hu CX, Van DJ, Van d HR, et al. RPLC-ion-trap-FTMS method for lipid profiling of plasma:method validation and application to p53 mutant mouse model[J]. Journal of Proteome Research.2008,7(11):4982-4991. 60. Kanu AB, Hill HH. Ion mobility spectrometry detection for gas chromatography[J]. Journal ofChromatography A,2008,1177(1):12-27. 61. Kawasaki A, Oda H, Hirata T. Determination of strontium isotope ratio of brown rice forestimating its provenance[J]. Soil Science and Plant Nutrition, 2002, 48(5):635-640. ( 62. K elly S , H eaton K , H o ogewerff J. Tracing the g e ographical o r igin of food: the a pplication ofmulti-element a nd m u lti-isotope a nalysis[J]. Trends in F ood Science and Tec h nology, 2005,16(12):555-567. ) ( 63. . Kim SS, Rhyu MR , Kim JM, et al . Authentication of r i ce usin g near-infrared reflectancespectroscopy[J]. Cereal Chemistry, 2003,80(3):346-349. ) ( 64. Kusano M , F u kushima A, Redestig H , e t al. M etabolomic approaches t oward u nderstandingnitrogen metabolism in plants[J]. Journal of Experimental B o tany, 2011, 62(4):1439-1453. ) ( 65. L agarde M , Geloen A, Record M, et a l . L ip i domics is e m erging[J]. Bio c himica Et B i op h ysicaActa-molecular and Cell B iology of Lipids, 2003,1 6 34(3):61-61. ) ( 66. .1 M ichopoulos F, Lai L , Gika H , e t al. UPLC-MS-based a n alysis of h uman p l asma f for metabonomics u s ing solvent precipitation or solid phase e xtraction[J]. Journal of ProteomeResearch, 2009,8(4):2 1 14-2121. ) ( 67. 1 N icholson JK, Connelly J,L i ndon JC, et al. M etabonomics: a platform f o r studying drug toxicity and gene function[J]. Nature Reviews Drug Discovery, 2002, 1 (2):153-161. ) ( 68. . Nicholson JK, L indon JC, Holmes E . 'Metabonomics': understanding the metabolic responses ofliving systems to pathophysiological stimuli via multivariate s tatistica l analysi s of biologica l NMRspectroscopic data[J]. Xenobiotica,1999,29(11):1181-1189 ) ( 69. N ordstrcm A, Want E, Northen T, et al. Multiple ionization mass spectrometry strategy u s ed toreveal the complexity of metabolomics[J]. Analytical Chemistry, 2008,80(2):421-429. ) 70.1Petrovic M,Kezic N, Bolaněa V. Optimization of the GC method for routine analysis of the fattyacid profile in several food samples[J]. Food Chemistry,2010,122(1):285-291. ( 71.] P lumb R. A p r agmatic a n d r e adily i mplemented quality control strategy f o r HPLC-MS and GC-MS-based metabonomic analysis[J]. Analyst, 2006, 131(10):1075-1078. ) 72.R]ahim AA, Saad B, Osman H, et al. Simultaneous determination of diethylene glycol, diethyleneglycol monoethyl ether, coumarin and caffeine in food items by gas chromatography[]. FoodChemistry, 2011, 126(3):1412-1416. Slavin J. Whole grains and human health[J]. Nutrition Research Reviews, 2004,17(1):99-110. Szopa J, Wilczynski G, Fiehn O, et al. Identification and quantification of catecholamines in potatoplants (Solarium tuberosum) by GC-MS[J]. Phytochemistry.2001,58(2):315-320. 75.Szymanska E, Saccenti E, Smilde AK, et al. Double-check: validation of diagnostic statistics forPLS-DA models in metabolomics studies[J]. Metabolomics Official Journal of the MetabolomicSociety, 2012,8(1):3-16. ( 76. Taylor J, King RD, Altmann T, e t al. Application of metabolomics to plant genotype discriminationusing statistics and machine learning[J]. Bioinformatics, 2002, 18 (suppl 2):S241-S248. ) ( 77. T rygg J, H olmes E , Lundstedt T . C h emometrics in Me t abonomics[J]. Journal of ProteomeResearch, 2007,6(2):469-479. ) ( 78.Verkouteren JR, S t aymates JL . Re l iability of ion mobility spectrometry for qualitative analysis ofcomplex, multicomponent L 1 illicitdcrug samples[J]. Forensic S cience I n ternational, 2011,206(1-3):190-196. ) ( 79.Wang X. Lipid signaling[J]. Current Opinion in Plant Biology, 2004,7(3):329-336. ) ( 80.Wang X M , Devaiah SP, Zhang WH, et al. Sig n aling functions of phosphatidic acid[J]. Progress inLipid Research, 2006, 45(3):250-278. ) ( 81 . Want E J ,O' M aille G, Smi t h CA, et al. Solvent-dependent metabolite distri b ution, clust e ring, andprotein extraction for serum profiling w ith mass spectrometry[J]. Analytical Ch e mistry, 20 0 6,78(3):743-752. ) ( 82.Watson A D . Lipidomics: a global appr o ach to li p id analysis in biological systems[J]. Journ a l ofLipid Research, 2006,47(10):2101-2111. ) ( 83.Welti R , W ang XM. Lipi d species profi l ing: a high-throughput appro a ch to identi f y lipidcompositional c hanges and d e termine t h e f u nction o f g e nes involved in lipid metabolism andsignaling[J]. Current Opinion in Plant B iology,2004,7(3):337-344. ) ( 84. Wiklund S, Johansson E, S j ostrom L, et al. Visualization of GC/TOF-MS-based metabolomics datafor identification of biochemically interesting compounds using OPLS class models[J]. Analytical Chemistry, 2008,80(1):115-122. ) ( 85. Y ang Z Y , Hollebone BP, Wan g Z, et al. Dete r mination of po l ar impurities in bi o di e sels usingsolid-phase extraction and gas chromatography-mass sp e ctrometry[J]. J o urnal o f SeparationScience, 2011,34(4):409-421. ) ( 86.Yoshida M, Hatano N, Nishiumi S, et al. Diagnosis of gastroenterological diseases b y metabolomeanalysis using gas chromatography-mass s p ectrometry[]. J o urnal o f G a stroenterology, 2 012,47(1):9-20. ) 87. Zhou B, Xiao J F, Tuli L, et al. LC-MS-based metabolomics[J]. Molecular Biosystems, 2012, 8(2):470-481. 88.Zhou L, Xu JD, Zhou SS, et al. Integrating targeted glycomics and untargeted metabolomics toinvestigate the processing chemistry of herbal medicines, a case study on Rehmanniae Radix[J].Journal of Chromatography A, 2016,1472:74-87. 致谢 时光如梭,三年的硕士生活即将结束。回望来时路,三年时光里自己收获了很多,在这青葱年华里,为青春谱写了一篇无悔的长歌。此时此刻,唯有言不出的别离,道不尽的感恩。 首先,我要感谢我的恩师刘潇威研究员在这三年里的悉心关怀与耐心指导。恩师在课程学习、课题研究、实验设计、论文写作等方面给予了全面的指导。研究过程中的每一次进步与导师的谆谆教诲是分不开的。生活中,恩师始终那么和蔼可亲、平易近人,关心学生,每一次轻松的言谈都能使我有不一样的收获。最好的教导无疑于言传身教,恩师严谨的工作态度、渊博的学识、宽广的胸怀、几十年如一日的敬业精神潜移默化的影响着我,将使我受益终生。我庆幸能够遇到这么好的老师。“引其流者怀其源,学其成时念吾师”,在此谨向恩师三年来的辛勤培育致以最真诚的敬意与最衷心的感谢! 其次,我还要感谢贺泽英老师在课题研究、实验设计、论文写作等方面给予的悉心指导。科研过程中,贺泽英老师耐心地为我答疑解惑,使我的科研能力得到了不断地提高,从而使论文工作能够顺利开展及完成。在此我要向贺泽英老师在实验中给予的指导与帮助表示衷心的感谢! 同时我还要感谢农业部环境保护科研监测所农产品质量安全危害因子风险评估团队的徐亚平老师、王璐老师、张艳伟老师、耿岳老师、彭祎老师、王跃华老师、王娴老师、赵玉杰老师、张铁亮老师、戴礼洪老师、李军幸老师、穆莉老师、姜红新老师、魏和莉老师以及邓凯、王策、史小萌、谷静、何沛桥、李宛津等科研工作人员,他们对工作认真的态度,超强的团队协作精神值得我去学习,在此对他们在工作、生活中给予的帮助表示衷心的感谢! 感谢师兄郑波、于泳、孟明辉、刘伟鹏,师姐冯雪、宋志廷、田娜娜,同窗谭冬飞、刘佳凤,师弟姜林杰、郭新蕾、王祖光、张瑶、郭琪琪,师妹王琦、鄂鄂在学习和生活中的陪伴与帮助,大家在一起的欢声笑语为研究生生活增添了色彩! 感谢任超琪同学,谢谢你这三年的陪伴与理解,希望在以后的日子里,我们一起继续努力。愿有岁月可回首,且以深情共白头! 最后,我要感谢我的家人,是父母无私的爱与支持,让我无畏艰辛,奋勇向前。在此我向父母表示最真诚的爱与最诚挚的感谢! 作者简历 王济世,男,汉族,1990年3月,山东菏泽人,中共预备党员,2015年7月毕业于滨州学院城市与环境系环境工程专业,本科学历。2015年9月进入中国农业科学院农业部环境保护科研监测所攻读农业资源利用专业,硕士研究生,导师刘潇威研究员,主要从事农业环境监测与评价及农产品质量安全评估。 科研经历 1. 参与了《食源性农产品中202种农药残留检测气相色谱串联质谱法》国家标准的制定相关工作。 2. 参与农业部农药检定所《植物源食品中农药多残留测定气相色谱-质谱法和液相色谱-质谱法》标准制定相关关作。 3. 参与2016年耕地重金属污染修复试点调查监测检测分析项目(湖南),负责多个实验室内部外部质量控制以及数据审核工作。 4. 参与2016-2018年度农业部农产品质量安全例行监测农药测定工作。 5. 参与2016年农业部农产品农药残留检测能力验证相关工作。 6. 参与“农药使用基线与环境效应关系研究”项目的相关工作。 7. 参加2017年第四届天津市质谱学术报告会,北京。 8. 参加第四届生态毒理学学术研讨会,杭州。 9. 参加2017年农产品质量安全风险筛查培训班学习。 二、发表文章情况 Jishi wang, Zeying He, Lu Wang, Yaping Xu, Yi Peng, Xiaowei Liu*. Automatic single-step quick,easy, cheap, effective, rugged and safe sample preparation devices for analysis of pesticide residues infoods.J. Chromatogr. A, 2017, 1521:10-18. 王济世,贺泽英,徐亚平,等.自动 QuEChERS 方法结合液相色谱串联质谱对玉米中133种农药的多残留分析[J].农业环境科学学报,2018,37(3):605-612. 所获荣誉 1. 2017年荣获硕士研究生国家奖学金。 2. 2017年荣获农业部环境保护科研监测所优秀学生干部荣誉。 3. 2017年荣获中国农业科学院研究生院优秀学生干部荣誉。 4. 2017年荣获农业部环境保护科研监测所优秀论文荣誉。 5. 2014年荣获国家励志奖学金。 6. 2013年荣获滨州学院校级优秀学生荣誉。 7. 2014年荣获滨州学院校一等奖学金。 8. 2013年荣获滨州学院优秀团员荣誉称号。 (C)China Academic Journal Electronic Publishing House. All rights reserved. http://www.enki.net 本文基于非靶向代谢组学和脂质组学,建立了液相色谱-四极杆串联飞行时间质谱联用仪(UPLC/Q-TOF-MS)和气相色谱-四极杆串联飞行时间质谱联用仪(GC/Q-TOF-MS)对稻米溯源的研究方法,对不同品种、不同产地的稻米进行了溯源研究,同时还对气相色谱离子迁移谱联用技术在稻米溯源上的应用进行了探索,筛选出了部分特征代谢物,为稻米产品溯源提供了技术支撑。1. 本研究借助UPLC/Q-TOF-MS,开展基于代谢组学和脂质组学的稻米产品溯源技术研究。采用液液萃取的提取方式对稻米样品进行前处理,对不同比例的水、甲醇、甲基叔丁基醚提取溶剂进行考察,对流动相洗脱梯度等条件进行优化,确定出最优的稻米内源代谢物筛查方法。2. 本研究借助GC/Q-TOF-MS 开展基于代谢轮廓的稻米溯源技术研究,对衍生方法、温度、时间进行了优化。选取甲氧基胺盐酸盐吡啶溶液为肟化试剂,温度设为40℃,时长100 min;硅烷化试剂为含有1%三甲基氯硅烷的N-甲基-N-三甲基硅基三氟乙酰胺溶液,温度设为40℃,时间定为35 min。最终筛选出与标准谱库匹配度得分高于90 的8 种内源代谢物。3.本研究借助气相色谱离子迁移谱联用技术对稻米中挥发性有机化合物进行了检测,确证出该方法具有较高可靠性,可用于不同品种、不同产地的稻米鉴别。三种技术方法各有优点,为全面筛查稻米中的内源代谢物提供了强有力技术支撑。关键词:稻米,代谢组学,UPLC/Q-TOF-MS,GC/Q-TOF-MS,气相色谱离子迁移谱联用
确定





















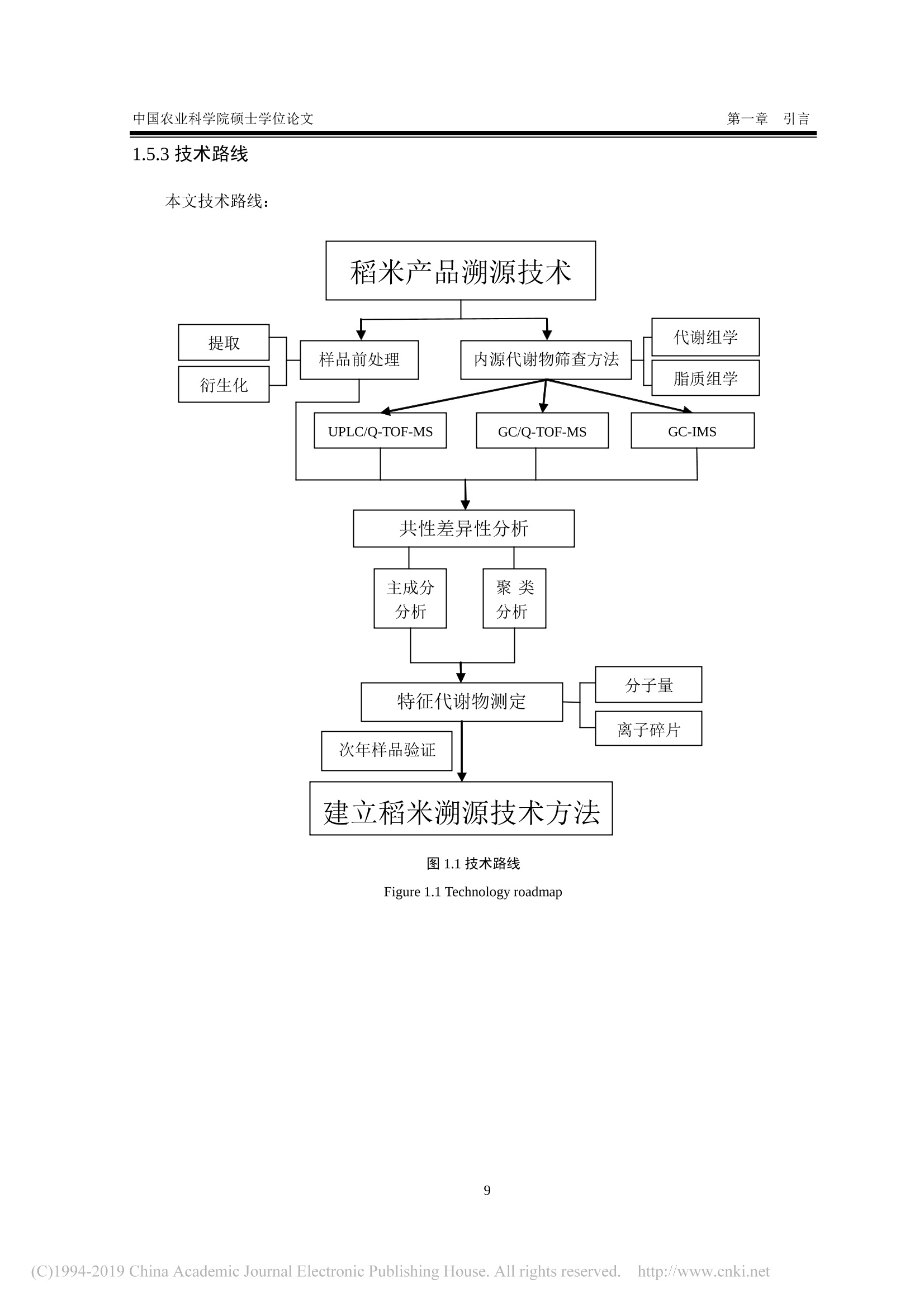




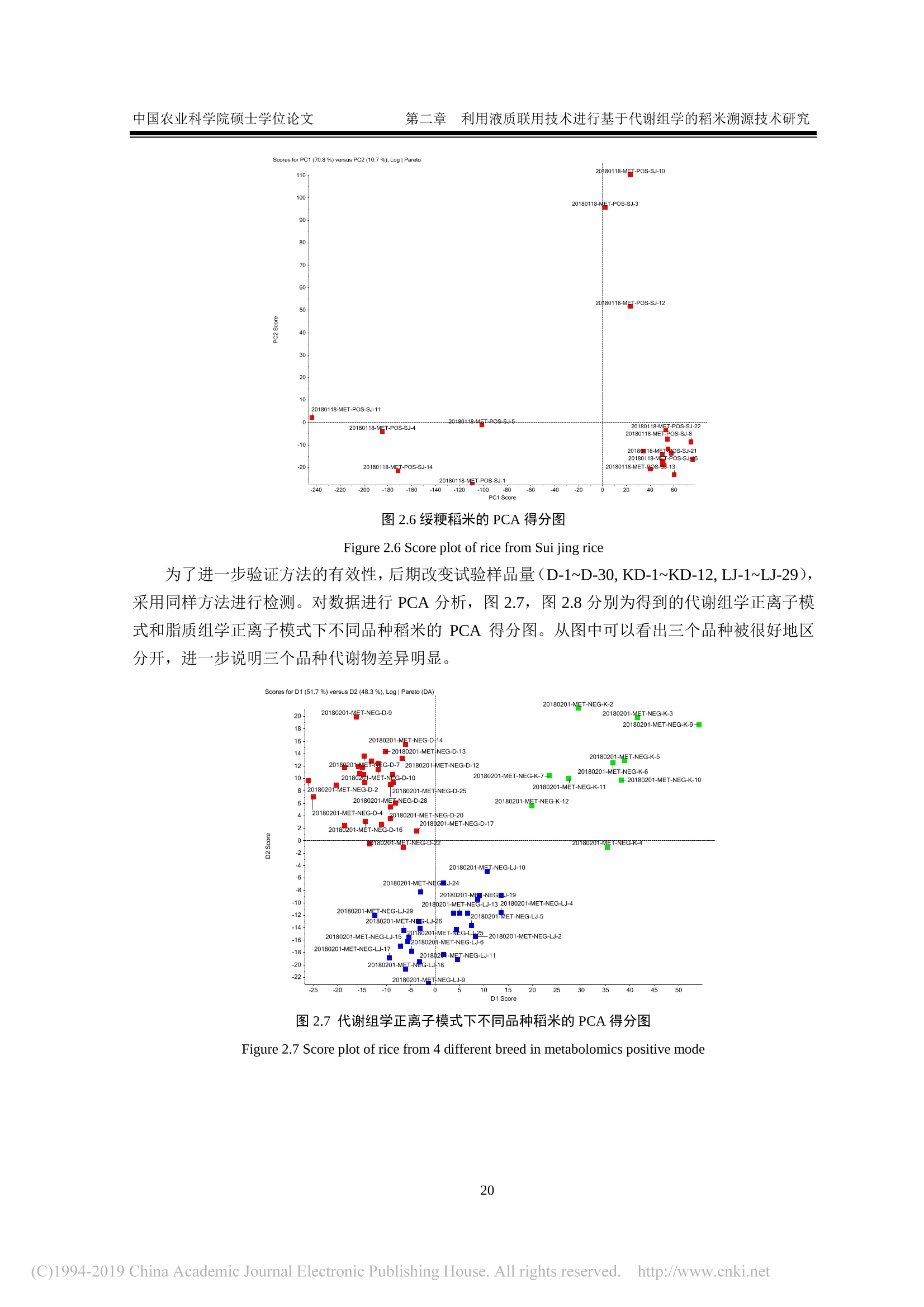
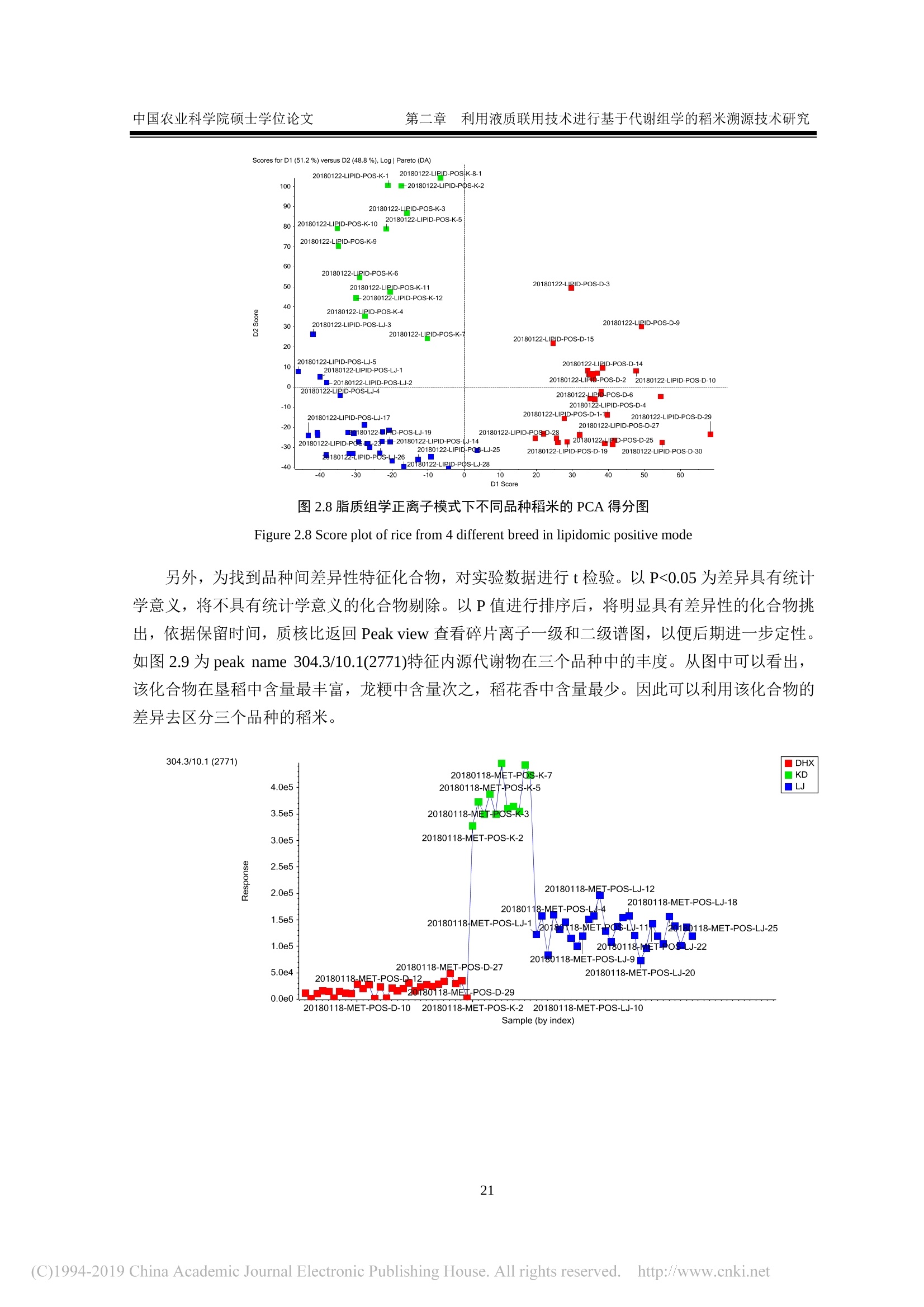
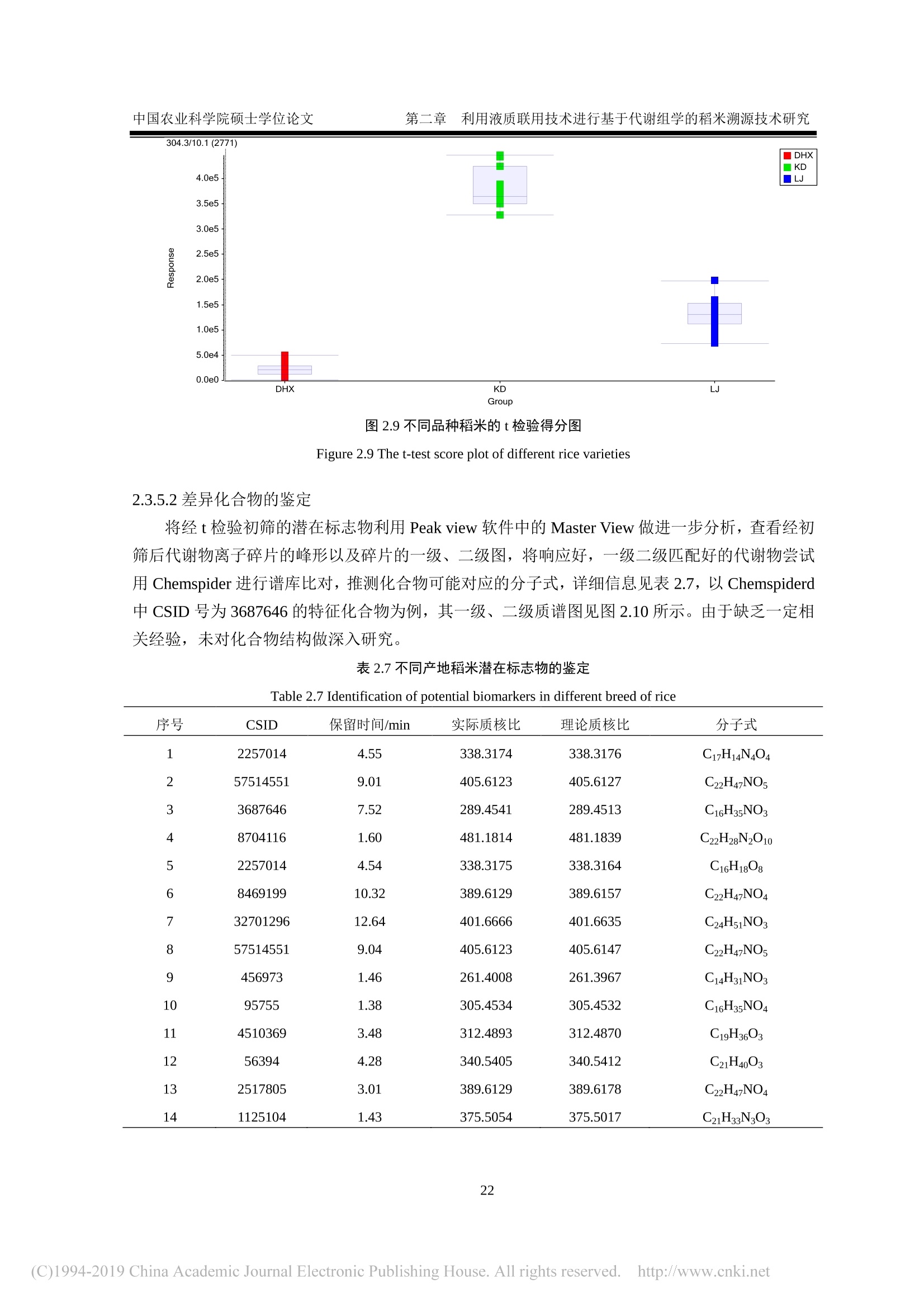




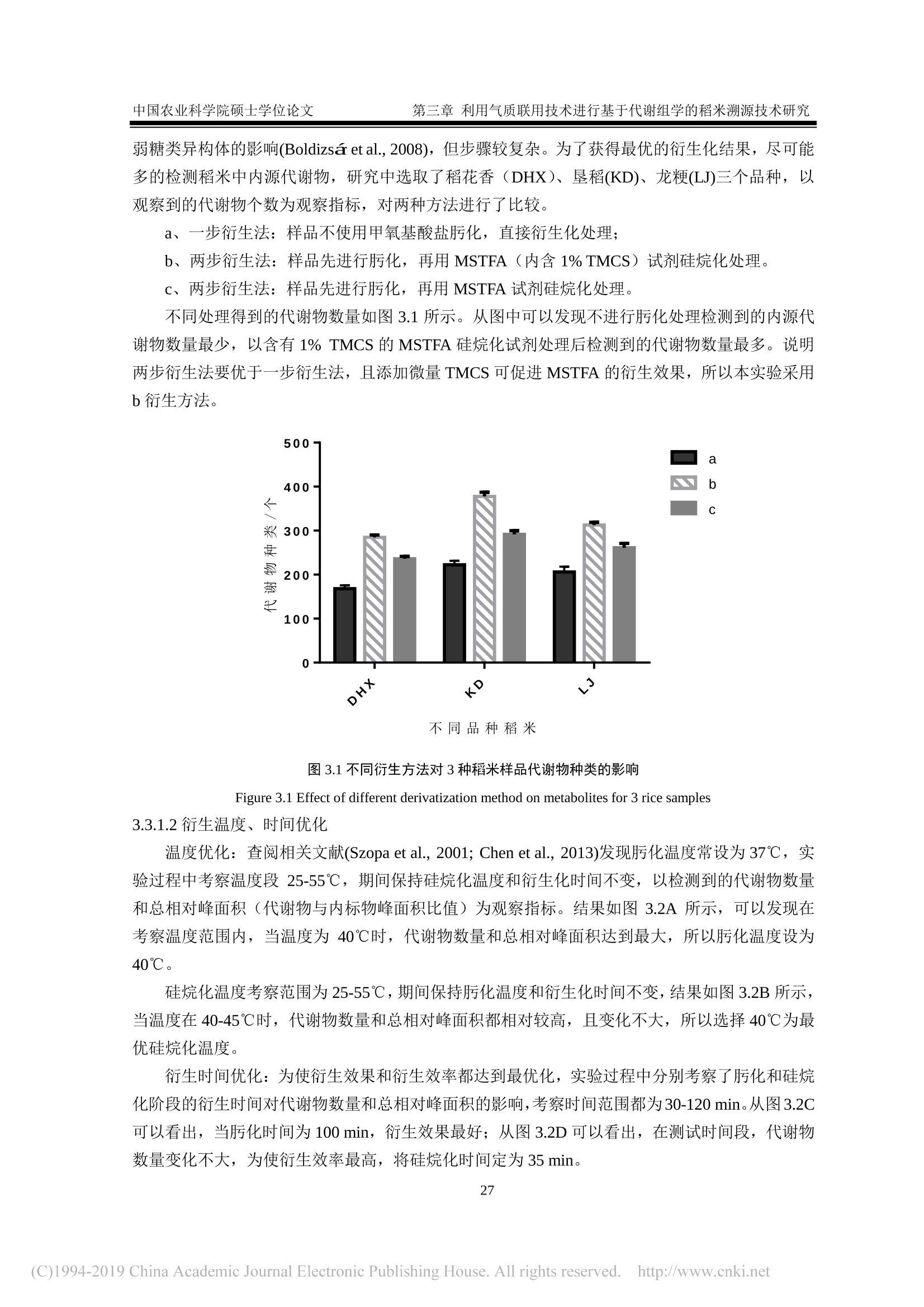
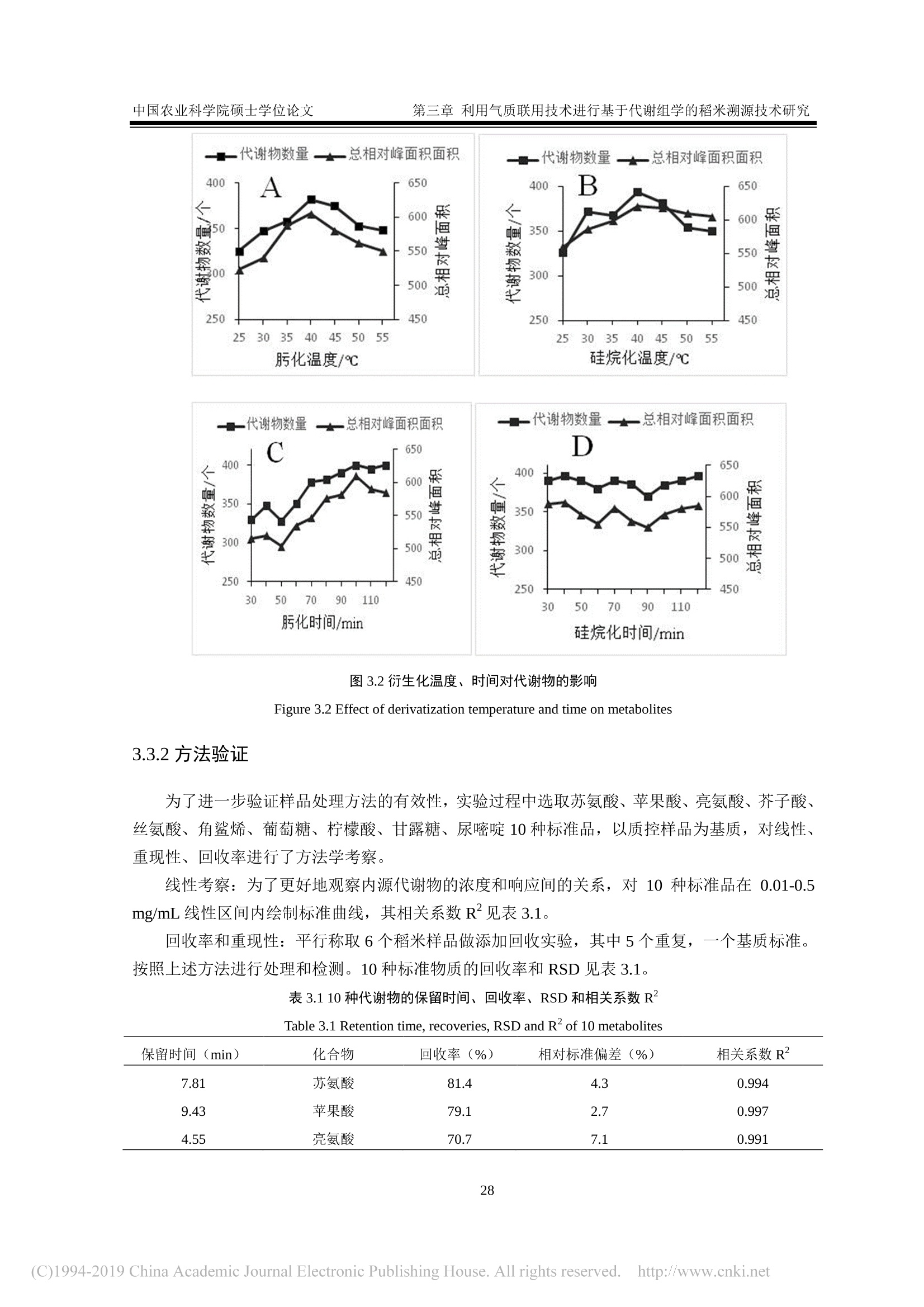

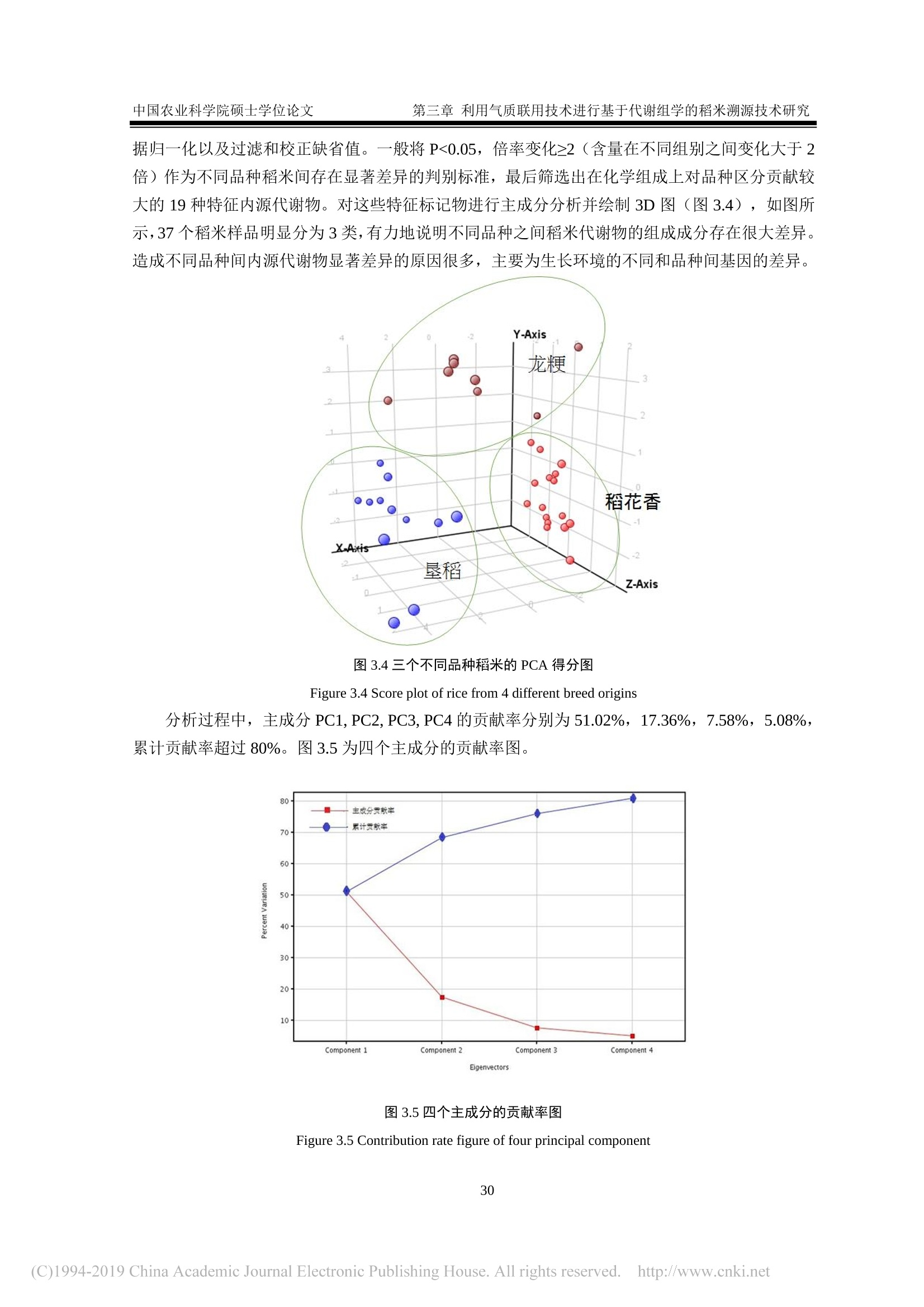

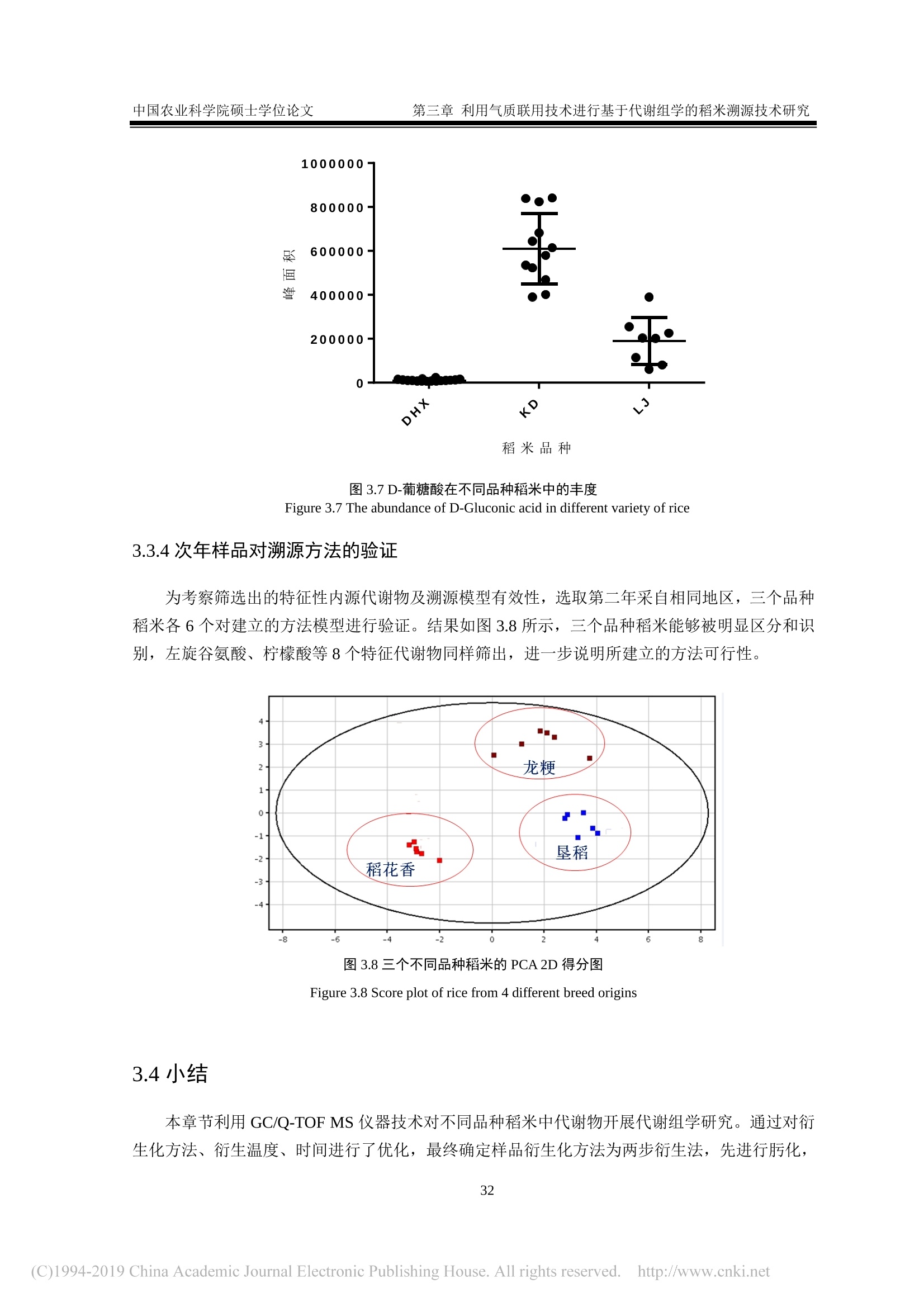




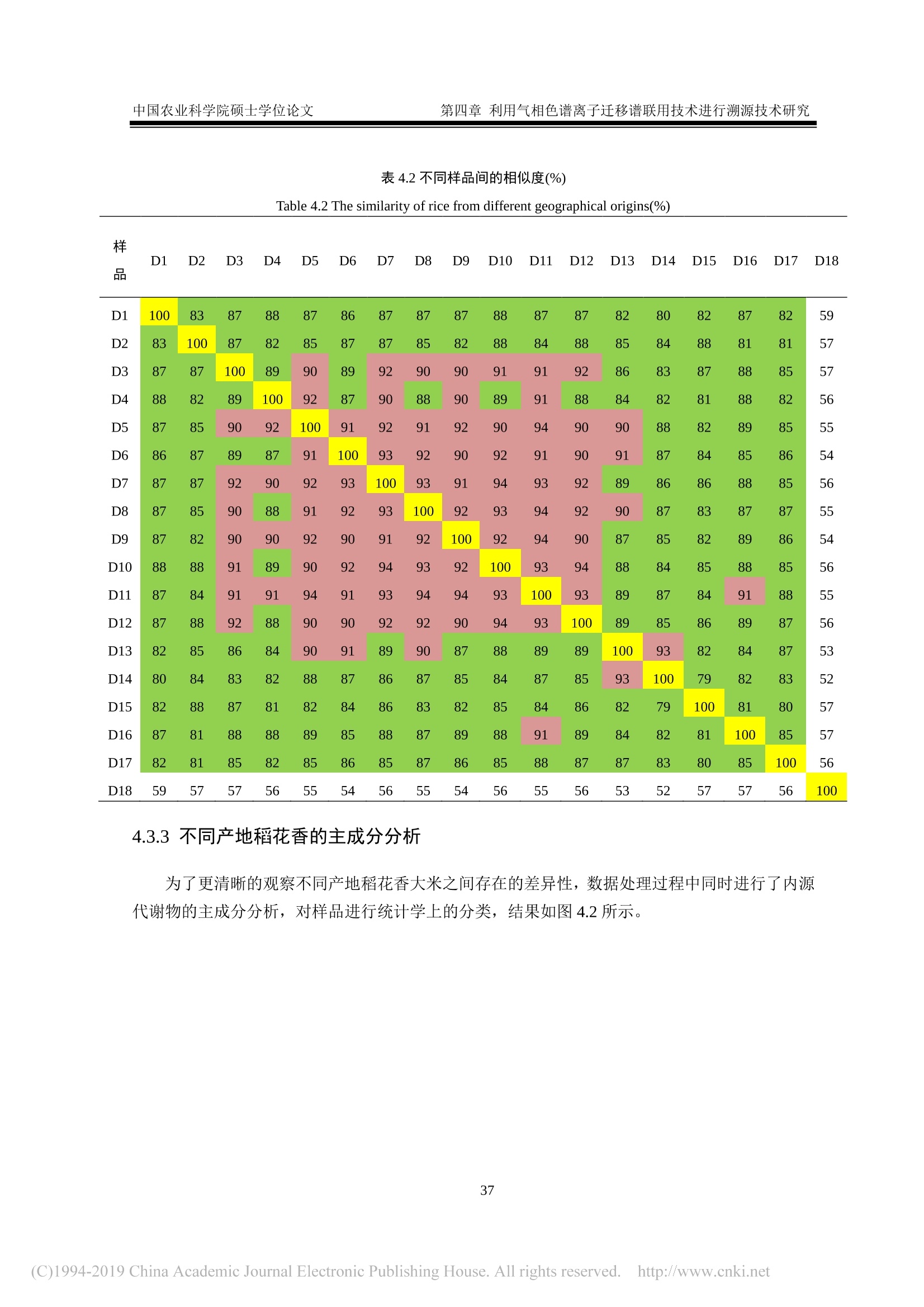
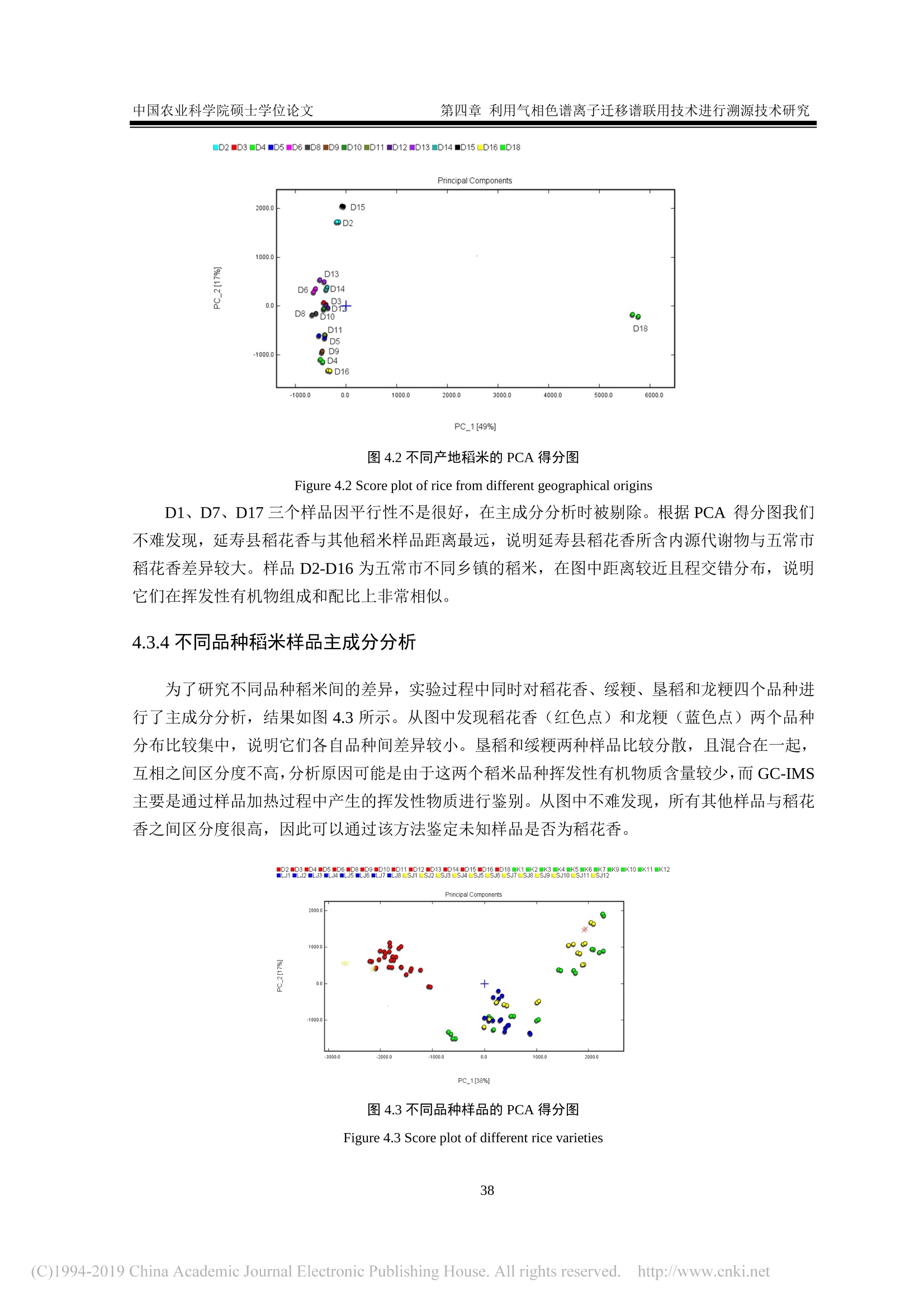
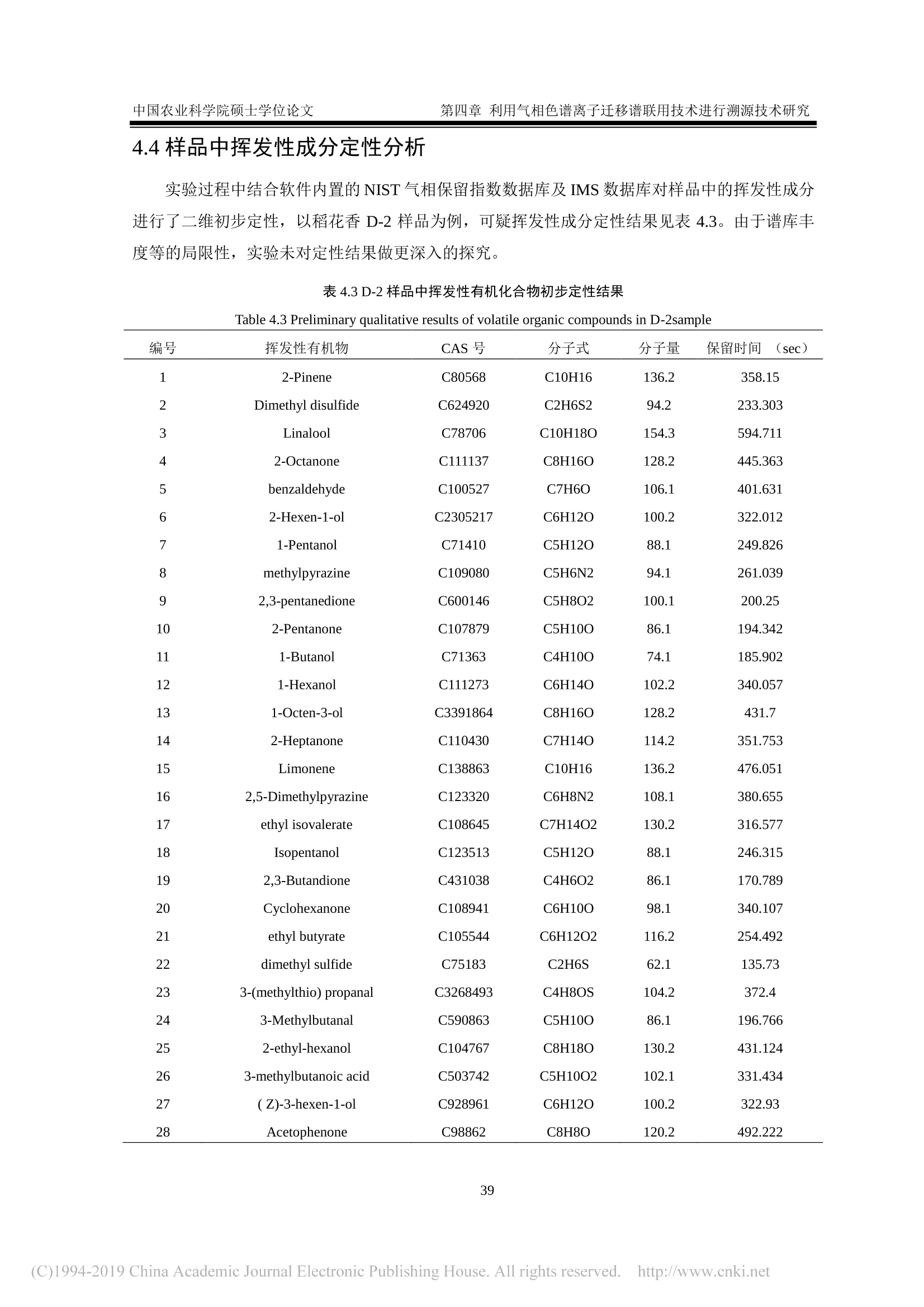











还剩62页未读,是否继续阅读?
G.A.S.为您提供《东北稻米中产品溯源技术研究检测方案(离子迁移谱仪)》,该方案主要用于大米中理化分析检测,参考标准--,《东北稻米中产品溯源技术研究检测方案(离子迁移谱仪)》用到的仪器有G.A.S.FlavourSpec®气相离子迁移谱联用仪
推荐专场
相关方案
更多
该厂商其他方案
更多















