方案详情
文
挂羊头,卖狗肉”是日常用的一个熟语。虽然随着时间的发
展,这句话已经难以反应最真实的情况,在世界上大部分地
方,狗已经不作为食用肉的来源,即使在极少数食狗肉的地
方,狗肉的价格也往往比羊肉还高,已经失去了造假的意义。
但是,这种商品标识与实际商品的组成不一致的情况,却是长
期存在的。 自从 2013 年欧盟“马肉风波”之后,中国肉类
掺假的现象也屡见报道,进一步加深了人们对肉类真实性的担
忧。这种非标明的添加,极大的扰乱的市场次序,影响相关宗
教人士、特殊风俗与部分肉类禁食人士的情感与健康,也带来
了潜在致病性和疾病控制的难题。目前最常用检测的方法有:
基于核酸的聚合酶链式反应技术(PCR),和基于抗体抗原结
合的酶联免疫法(ELISA)
方案详情

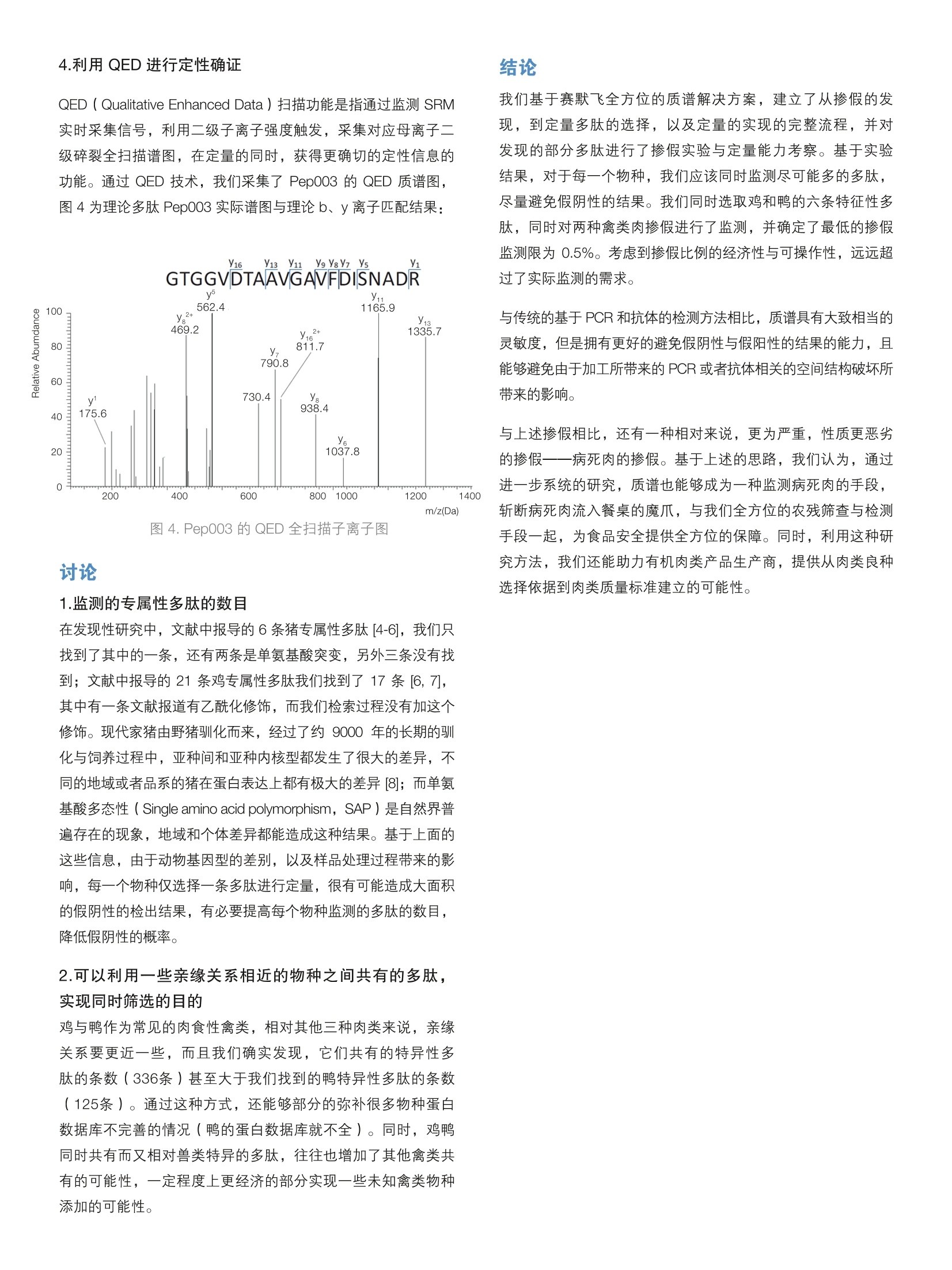
实验方法: 丁小军顾培明张伟周岳李静 赛默飞世尔科技(中国)有限公司 关键词:肉类掺假;定量分析 “挂羊头,卖狗肉”是日常用的一个熟语。虽然随着时间的发展,这句话已经难以反应最真实的情况,在世界上大部分地方,狗已经不作为食用肉的来源,即使在极少数食狗肉的地方,狗肉的价格也往往比羊肉还高,已经失去了造假的意义。但是,这种商品标识与实际商品的组成不一致的情况,却是长期存在的。 自从人:2013年欧盟“马肉风波”之后,中国肉类掺假的现象也屡见报道,进一步加深了人们对肉类真实性的担忧。这种非标明的添加,极大的扰乱的市场次序,影响相关宗教人士、特殊风俗与部分肉类禁食人士的情感与健康,也带来了潜在致病性和疾病控制的难题。目前最常用检测的方法有:基于核酸的聚合酶链式反应技术(PCR),和基于抗体抗原结合的酶联免疫法(ELISA)。前者受到 DNA 降解,复杂基质的干扰和样品提取与扩增方法的影响,干扰了定性和定量的准确性。后者往往受制于抗体的制备,加工过程中蛋白变性,复杂基质和近亲缘种属之间同源干扰导致的假阳性的影响[1,2]。 随着生物质谱技术的成熟,大规模的定性和定量研究蛋白表达谱的技术已经很成熟。因此,利用质谱技术寻找不同肉类样品特征性蛋白或者多肽,并进行定量,能够避免现在最常用的PCR 技术和 ELISA 所面临的上面的种种问题,其优点包括:不受食品加工的过程影响,因为氨基酸序列比核酸序列在加工过程中更容易保存;同时实现定性与定量,避免假阳性且定量结果更加准确可靠;能够同时监测多种添假[2]。 猪肉,禽肉,牛肉和羊肉是世界上消耗量最大的四种肉类[3]。大多数情况下,羊肉最贵,可能比最便宜的禽肉贵到5倍以上,在实际生活中,对不法商人具有最大的掺假诱惑力。我们基于超高分辨的Q Exactive 质谱平台,研究了五种常见肉类彼此之间的特征性专属多肽。选取其中找到的部分多肽,通过人为的将几种不同的肉类进行混合研究,模拟现实中掺假的情况,用TSQ Qpantiva 建立了基于 SRM (Selected Reaction Monitoring)的掺假比例定量方法。整个实验流程如下(图1): E D C 图1.基于 Thermo 质谱平台肉类真实性解决方案。 (A:样品裂解; B:肉类裂解样品还原烷化酶切;C:高分辨质谱平台采集每个物种数据; D: Proteome Discoverer 2.0, SEIVE 2.0 软件寻找物种特征性多肽, Pinpoint 软件批量自动生成定量离子对; E: TSQQuantiva 定量分析) 1.材料与样品制备 本实验所用肉类样品牛肉,猪肉,鸡肉和鸭肉购自于上海某大型超市,羊肉购自于上海某羊肉专卖店。五种肉类样品分别去皮与脂肪取纯肌肉样品约100 mg, 用 RIPA裂解液裂解后丙酮沉淀,尿素溶解后取部分测浓度,剩余样品还原烷化,酶切过夜,固相萃取除盐,离心浓缩后用 0.1%FA 溶解后备用。 2.掺假实验 将鸡与鸭的裂解液等比例混合,取羊1 pg总蛋白酶切产物六份,分别添加鸡和鸭的裂解酶切产物1 pg、100 ng、10 ng、5ng、1ng、0.1ng,模拟不同比例的掺假样品,每份样品进样三次。 3.色谱条件 液相 RSLC U3000 , 流速 0.2 mL/min,流动相A相为0.1%FA/H,O,流动相B相为0.1% FA/ACN。色谱柱 Accucore-150-C18, 100mm*2.1mm。梯度条件为: 表1.色谱梯度 Time (min) A相(%) B相(%) 0 100 0 0.2 90 10 16 60 40 17 20 80 17.5 20 80 18.5 100 0 20 100 0 4.质谱采集方法 质谱离子源参数设置为:喷雾电压3500V,鞘气38 Arb,辅气15 Arb, 反吹气为0Arb, 离子传输管温度275℃,离子源雾化温度为380℃。质谱采集参数为:采集周期为 0.3s, 碰撞气为 1.5mTorr, Q1 和Q3率辨率都为0.7,源内裂解能量为0。 1.种属特征性多肽的确认 种属特征性多肽寻找验证是肉类掺假实验的关键点,因此我们通过高分辨的 Q Exactive 质谱平台,研究了常见的五种肉类。选出每个物种专属性的多肽,去掉含有酶漏切位点的多肽,鉴定到各个物种相对于其他四种物种专属性的多肽条数为:鸡339条,鸭125条,猪426条,牛337条,羊152条。其中,鸡和鸭都为鸟纲家禽类,羊、牛、猪为哺乳纲真兽亚纲动物,前两者之间的进化亲缘关系更近,我们同时找到了鸡和鸭相对其他三种兽类专属性的多肽336条。Pep003为来源于鸡/鸭的特征性肽段,图2为利用 TSQ Quantiva 在不同掺假比例的样本中定量 Pep003的XIC ( eXtracted Ion Chromatogram ) 图: 图2.TSQ Quantiva 在不同掺假比例的样羊中定量 Pep003 的XIC 图 2.定量离子对的选择 依据丰度信息,我们选取了六条鸡与鸭的特征性多肽(不含漏切位点,不含甲硫氨酸,不含 NXS/T的糖基化基序),导入 Pinpoint 软件,利用 Pinpoint 软件自动导出离子对与碰撞能量信息,先采集一遍样品的信息,利用FPinpoint:软件生成schedule 信息,导入仪器自动生成最后的采集方法。方法中的离子对信息见下表: 通过将鸡肉与鸭肉按不同比例掺加到1 pg的羊肉中,利用SRM的方法,定量研究能够检测到的最低掺比比例,并利用 Xcalibur定量模块对上面的多肽分别进行定量,确定线性范围。其中Pep001 和 Pep003 都能够定量到5ng 的最低掺假,剩下的四条能够定量到10 ng 掺假。即分别能够检测到0.5%比例的掺假和1%比例掺假,实际标准曲线与线性范围如下: 4.利用QED 进行定性确证 QED ( Qualitative Enhanced Data)扫描功能是指通过监测 SRM实时采集信号,利用二级子离子强度触发,采集对应母离子二级碎裂全扫描谱图,在定量的同时,获得更确切的定性信息的功能。通过 QED 技术, 我们采集了 Pep003 的QED 质谱图,图4为理论多肽 Pep003 实际谱图与理论b、y离子匹配结果: 图 4. Pep003 的 QED 全扫描子离子图 1.监测的专属性多肽的数目 在发现性研究中,文献中报导的6条猪专属性多肽[4-6],我们只找到了其中的一条,还有两条是单氨基酸突变,另外三条没有找到;文献中报导的21条鸡专属性多肽我们找到了17条[6,7],其中有一条文献报道有乙酰化修饰,而我们检索过程没有加这个修饰。现代家猪由野猪驯化而来,经过了约9000年的长期的驯化与饲养过程中,亚种间和亚种内核型都发生了很大的差异,不同的地域或者品系的猪在蛋白表达上都有极大的差异[8];而单氨基酸多态性(Single amino acid polymorphism, SAP)是自然界普遍存在的现象,地域和个体差异都能造成这种结果。基于上面的这些信息,由于动物基因型的差别,以及样品处理过程带来的影响,每一个物种仅选择一条多肽进行定量,很有可能造成大面积的假阴性的检出结果,有必要提高每个物种监测的多肽的数目,降低假阴性的概率。 2.可以利用一些亲缘关系相近的物种之间共有的多肽,实现同时筛选的目的 鸡与鸭作为常见的肉食性禽类,相对其他三种肉类来说,亲缘关系要更近一些,而且我们确实发现,它们共有的特异性多肽的条数(336条)甚至大于我们找到的鸭特异性多肽的条数(125条)。通过这种方式,还能够部分的弥补很多物种蛋白数据库不完善的情况(鸭的蛋白数据库就不全)。同时,鸡鸭同时共有而又相对兽类特异的多肽,往往也增加了其他禽类共有的可能性,一定程度上更经济的部分实现一些未知禽类物种添加的可能性。 结论 我们基于赛默飞全方位的质谱解决方案,建立了从掺假的发现,到定量多肽的选择,以及定量的实现的完整流程,并对发现的部分多肽进行了掺假实验与定量能力考察。基于实验结果,对于每一个物种,我们应该同时监测尽可能多的多肽,尽量避免假阴性的结果。我们同时选取鸡和鸭的六条特征性多肽,同时对两种禽类肉掺假进行了监测,并确定了最低的掺假监测限为0.5%。考虑到掺假比例的经济性与可操作性,远远超过了实际监测的需求。 与传统的基于 PCR 和抗体的检测方法相比,质谱具有大致相当的灵敏度,但是拥有更好的避免假阴性与假阳性的结果的能力,且能够避免由于加工所带来的 PCR 或者抗体相关的空间结构破坏所带来的影响。 与上述掺假相比,还有一种相对来说,更为严重,性质更恶劣的掺假—病死肉的掺假。基于上述的思路,我们认为,通过进一步系统的研究,质谱也能够成为一种监测病死肉的手段,斩断病死肉流入餐桌的魔爪,与我们全方位的农残筛查与检测手段一起,为食品安全提供全方位的保障。同时,利用这种研究方法,我们还能助力有机肉类产品生产商,提供从肉类良种选择依据到肉类质量标准建立的可能性。 ( 1.Nakyinsige, K.,Y.B. Man, a n d A.Q. Sa z ili, Halal a uthenticity issues in meat and m eat products. Meat Sci,2012.91(3): p. 2 07-14. ) ( 2.Sentandreu, M.A. and E . Sentandreu, Peptide biomarkers as a w ay to determine meat authenticity. MeatSci, 2011.89(3): p . 280-5. ) ( 3.http://www.fao.org/ag/againfo/themes/en/meat/background.html. ) ( 4.von Bargen, C., et al . , New sensitive high-performance liquid chromatography-tande m massspectrometry method for the detection of horse and pork in h alal beef. J Agric Food Chem, 2 013. 61(49): p.11986-94. ) ( 5.von Bargen, C., J. Brockmeyer, and H.U. Humpf, Meat authentication: a new HPLC-MS/MS basedmethod for the fast and sensitive detection of horse an d pork in h ighly processed food. J Agric FoodChem,2014.62(39):p. 9428-35. ) ( 6.Montowska, M., e t al., Rapid detection of peptide markers for authentication purposes in raw andcooked m e at using ambient liquid extraction surface analysis mass spectrometry. Anal Chem,2014.86(20): p. 10257-65. ) ( 7.Sentandreu, M.A., e t al . , A proteomic-based approach for d etection o f chicken in meat mixes.J Proteome Res, 2 010.9(7): p . 3374-83. ) ( 8.Ramos-Onsins, S. E ., et al., Mining the pig g enome to investigate t h e domestication pr o cess. Heredity(Edinb), 2014. 1 13(6): p. 4 71-84. ) 学俱乐部 谱应用技术群 赛默飞世尔科技(中国)有限公司 上海(中国总部) 广州 沈阳 武汉 上海浦东新金桥路27号7号楼 广州东风中路410-412号 沈阳市沈河区惠工街10号 时代地产中心2405-2406,3001-3004 卓越大厦3109室 ( 武汉东湖高新技术开发区 高新大道858号A7楼 ) 北京 成都 香港 北京市安定门东大街28号 成都市武侯区临江西路1号 雍和大厦西楼7层 锦江国际大厦1406 ( 香港新界沙田,沙田乡事会路138号新 城 市中央广场 第 一座九楼911-915室 ) ThermoSCIENTIFIC SCIENTIFIC全国服务热线: 支持手机用户)A Thermo Fisher Scientific Brand “挂羊头,卖狗肉”是日常用的一个熟语。虽然随着时间的发 展,这句话已经难以反应最真实的情况,在世界上大部分地 方,狗已经不作为食用肉的来源,即使在极少数食狗肉的地 方,狗肉的价格也往往比羊肉还高,已经失去了造假的意义。 但是,这种商品标识与实际商品的组成不一致的情况,却是长 期存在的。 自从 2013 年欧盟“马肉风波”之后,中国肉类 掺假的现象也屡见报道,进一步加深了人们对肉类真实性的担 忧。这种非标明的添加,极大的扰乱的市场次序,影响相关宗 教人士、特殊风俗与部分肉类禁食人士的情感与健康,也带来 了潜在致病性和疾病控制的难题。目前最常用检测的方法有: 基于核酸的聚合酶链式反应技术(PCR),和基于抗体抗原结 合的酶联免疫法(ELISA)。前者受到 DNA 降解,复杂基质的 干扰和样品提取与扩增方法的影响,干扰了定性和定量的准确 性。后者往往受制于抗体的制备,加工过程中蛋白变性,复杂 基质和近亲缘种属之间同源干扰导致的假阳性的影响 [1, 2]。(A:样品裂解; B:肉类裂解样品还原烷化酶切;C:高分辨质谱平台采集每 个物种数据;D:Proteome Discoverer 2.0,SEIVE 2.0 软件寻找物种特征性多肽,Pinpoint 软件批量自动生成定量离子对;E:TSQ Quantiva 定量分析) 随着生物质谱技术的成熟,大规模的定性和定量研究蛋白表达 谱的技术已经很成熟。因此,利用质谱技术寻找不同肉类样 品特征性蛋白或者多肽,并进行定量,能够避免现在最常用的 PCR 技术和 ELISA 所面临的上面的种种问题,其优点包括:不 受食品加工的过程影响,因为氨基酸序列比核酸序列在加工过 程中更容易保存;同时实现定性与定量,避免假阳性且定量结 果更加准确可靠;能够同时监测多种添假 [2]。 猪肉,禽肉,牛肉和羊肉是世界上消耗量最大的四种肉类 [3]。 大多数情况下,羊肉最贵,可能比最便宜的禽肉贵到 5 倍以上, 在实际生活中,对不法商人具有最大的掺假诱惑力。我们基于 超高分辨的 Q Exactive 质谱平台,研究了五种常见肉类彼此之 间的特征性专属多肽。选取其中找到的部分多肽,通过人为的 将几种不同的肉类进行混合研究,模拟现实中掺假的情况,用 TSQ Qµantiva 建立了基于 SRM(Selected Reaction Monitoring) 的掺假比例定量方法。整个实验流程如下(图 1): AN_C_LCMSMS_7_201506Y表 1. 色谱梯度 实验方法: 1.材料与样品制备 本实验所用肉类样品牛肉,猪肉,鸡肉和鸭肉购自于上海某大 型超市,羊肉购自于上海某羊肉专卖店。五种肉类样品分别去 皮与脂肪取纯肌肉样品约 100 mg,用 RIPA 裂解液裂解后丙酮 沉淀,尿素溶解后取部分测浓度,剩余样品还原烷化,酶切过 夜,固相萃取除盐,离心浓缩后用 0.1%FA 溶解后备用。 2.掺假实验 将鸡与鸭的裂解液等比例混合,取羊 1 µg 总蛋白酶切产物六份, 分别添加鸡和鸭的裂解酶切产物 1 µg、100 ng、10 ng、5 ng、 1 ng、0.1 ng,模拟不同比例的掺假样品,每份样品进样三次。 3.色谱条件 液相 RSLC U3000 ,流速 0.2 mL/min,流动相 A 相为 0.1% FA/H2O,流动相 B 相为 0.1% FA/ACN。色谱柱 Accucore- 150-C18,100mm*2.1mm。梯度条件为: 实验结果 1.种属特征性多肽的确认 种属特征性多肽寻找验证是肉类掺假实验的关键点,因此我们 通过高分辨的 Q Exactive 质谱平台,研究了常见的五种肉类。 选出每个物种专属性的多肽,去掉含有酶漏切位点的多肽,鉴 定到各个物种相对于其他四种物种专属性的多肽条数为:鸡 339 条,鸭 125 条,猪 426 条,牛 337 条,羊 152 条。其 中,鸡和鸭都为鸟纲家禽类,羊、牛、猪为哺乳纲真兽亚纲动 物,前两者之间的进化亲缘关系更近,我们同时找到了鸡和鸭 相对其他三种兽类专属性的多肽 336 条。Pep003 为来源于鸡/ 鸭的特征性肽段,图 2 为利用 TSQ Quantiva 在不同掺假比例 的样本中定量 Pep003 的 XIC(eXtracted Ion Chromatogram) 图: 4.质谱采集方法 质谱离子源参数设置为:喷雾电压 3500 V,鞘气 38 Arb,辅气 15 Arb,反吹气为 0 Arb,离子传输管温度 275℃,离子源雾化 温度为 380℃。质谱采集参数为:采集周期为 0.3 s, 碰撞气 为 1.5mTorr, Q1 和 Q3 分辨率都为 0.7,源内裂解能量为 0。 Time (min) A相(%) B相(%) 0 100 0 0.2 90 10 16 60 40 17 20 80 17.5 20 80 18.5 100 0 20 100 0 Time(min) 40000 20000 0420 5000 0 200 0 100 0 10 020 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 10:33 10:37 10:36 10:38 10:39 10:40 1000ng 100ng 10ng 5ng 1ng 0.1ng blank 图 2. TSQ Quantiva 在不同掺假比例的样本中定量 Pep003 的 XIC 图 2.定量离子对的选择 依据丰度信息,我们选取了六条鸡与鸭的特征性多肽(不含 漏切位点,不含甲硫氨酸,不含 NXS/T 的糖基化基序),导 入 Pinpoint 软件,利用 Pinpoint 软件自动导出离子对与碰撞 能量信息,先采集一遍样品的信息,利用 Pinpoint 软件生成 schedule 信息,导入仪器自动生成最后的采集方法。方法中的 离子对信息见下表: Intensity表 2. 定量离子对和 Schedule 信息 Compoµnd Retention Time (min) RT Window (min) Polarity Precµrsor (m/z) Prodµct (m/z) Collision Energy (V) Pep001 8.68 2 Positive 764.9 817.9 29 Pep001 8.68 2 Positive 764.9 919.0 29 Pep001 8.68 2 Positive 764.9 990.1 29 Pep001 8.68 2 Positive 764.9 1089.2 28 Pep001 8.68 2 Positive 764.9 1188.4 27 Pep001 8.68 2 Positive 764.9 1301.5 26 Pep002 10.07 2 Positive 829.9 425.5 32 Pep002 10.07 2 Positive 829.9 912.9 32 Pep002 10.07 2 Positive 829.9 1012.1 31 Pep002 10.07 2 Positive 829.9 1198.3 30 Pep002 10.07 2 Positive 829.9 1297.4 29 Pep003 10.36 2 Positive 997.6 562.6 35 Pep003 10.36 2 Positive 997.6 675.7 35 Pep003 10.36 2 Positive 997.6 1165.2 35 Pep003 10.36 2 Positive 997.6 1264.4 35 Pep003 10.36 2 Positive 997.6 1335.4 34 Pep004 11.01 2 Positive 748.9 432.5 29 Pep004 11.01 2 Positive 748.9 595.7 29 Pep004 11.01 2 Positive 748.9 856.0 29 Pep004 11.01 2 Positive 748.9 1050.2 28 Pep005 13.55 2 Positive 1039.7 475.6 35 Pep005 13.55 2 Positive 1039.7 546.6 35 Pep005 13.55 2 Positive 1039.7 1140.3 35 Pep005 13.55 2 Positive 1039.7 1353.5 35 Pep006 16.92 2 Positive 973.2 404.5 35 Pep006 16.92 2 Positive 973.2 503.6 35 Pep006 16.92 2 Positive 973.2 881.1 35 Pep006 16.92 2 Positive 973.2 994.2 35 Pep006 16.92 2 Positive 973.2 1305.5 35 3.定量结果与定量下限 通过将鸡肉与鸭肉按不同比例掺加到 1 µg 的羊肉中,利用 SRM 的方法,定量研究能够检测到的最低掺比比例,并利用 Xcalibur 定量模块对上面的多肽分别进行定量,确定线性范围。其中 Pep001 和 Pep003 都能够定量到 5 ng 的最低掺假,剩下的四 条能够定量到 10 ng 掺假。即分别能够检测到 0.5% 比例的掺假 和 1% 比例掺假,实际标准曲线与线性范围如下: Pep001 Pep002 20000 15000 10000 5000 0 8000 6000 4000 2000 0 30000 20000 10000 0 50000 40000 30000 20000 10000 0 10000 8000 6000 4000 2000 0 3000 2500 2000 1500 1000 500 0 0 200 400 600 800 1000 0 20 40 60 80 100 0 200 400 600 800 1000 0 200 400 600 800 1000 0 200 400 600 800 1000 0 200 400 600 800 1000 线性范围:5ng-1000ng Y=-25.0053+52.7902*x Rˆ2=0.9963 W=1/X 线性范围:10ng-1000ng Y=231.214+35.25*X Rˆ2=0.9983 W=Equal 线性范围:10ng-1000ng Y=-36.2485+7.38705*X Rˆ2=0.9999 W:Equal Pep003 Pep004 线性范围:5ng-1000ng Y=-278.354+208.536*X Rˆ2=0.9992 W:Equal Pep005 Pep006 线性范围:10ng-1000ng Y=-11.0538+2.89643*X Rˆ2=0.9999 W:Equal 线性范围:10ng-1000ng Y=-16.9483+9.72766*X Rˆ2=1.0000 W:Equal 图 3. 定量标准曲线与线性范围 Area Area Area Area Area Area4.利用 QED 进行定性确证 QED(Qualitative Enhanced Data)扫描功能是指通过监测 SRM 实时采集信号,利用二级子离子强度触发,采集对应母离子二 级碎裂全扫描谱图,在定量的同时,获得更确切的定性信息的 功能。通过 QED 技术,我们采集了 Pep003 的 QED 质谱图, 图 4 为理论多肽 Pep003 实际谱图与理论 b、y 离子匹配结果: 图 4. Pep003 的 QED 全扫描子离子图 m/z(Da) 200 400 600 800 1000 1200 1400 100 80 60 40 20 0 y1 175.6 730.4 y7 790.8 y8 938.4 y6 1037.8 y11 1165.9 y13 y 1335.7 16 2+ 811.7 y5 562.4 y8 2+ 469.2 讨论 1.监测的专属性多肽的数目 在发现性研究中,文献中报导的 6 条猪专属性多肽 [4-6],我们只 找到了其中的一条,还有两条是单氨基酸突变,另外三条没有找 到;文献中报导的 21 条鸡专属性多肽我们找到了 17 条 [6, 7], 其中有一条文献报道有乙酰化修饰,而我们检索过程没有加这个 修饰。现代家猪由野猪驯化而来,经过了约 9000 年的长期的驯 化与饲养过程中,亚种间和亚种内核型都发生了很大的差异,不 同的地域或者品系的猪在蛋白表达上都有极大的差异 [8];而单氨 基酸多态性(Single amino acid polymorphism,SAP)是自然界普 遍存在的现象,地域和个体差异都能造成这种结果。基于上面的 这些信息,由于动物基因型的差别,以及样品处理过程带来的影 响,每一个物种仅选择一条多肽进行定量,很有可能造成大面积 的假阴性的检出结果,有必要提高每个物种监测的多肽的数目, 降低假阴性的概率。 2.可以利用一些亲缘关系相近的物种之间共有的多肽, 实现同时筛选的目的 鸡与鸭作为常见的肉食性禽类,相对其他三种肉类来说,亲缘 关系要更近一些,而且我们确实发现,它们共有的特异性多 肽的条数(336条)甚至大于我们找到的鸭特异性多肽的条数 (125条)。通过这种方式,还能够部分的弥补很多物种蛋白 数据库不完善的情况(鸭的蛋白数据库就不全)。同时,鸡鸭 同时共有而又相对兽类特异的多肽,往往也增加了其他禽类共 有的可能性,一定程度上更经济的部分实现一些未知禽类物种 添加的可能性。 结论 我们基于赛默飞全方位的质谱解决方案,建立了从掺假的发 现,到定量多肽的选择,以及定量的实现的完整流程,并对 发现的部分多肽进行了掺假实验与定量能力考察。基于实验 结果,对于每一个物种,我们应该同时监测尽可能多的多肽, 尽量避免假阴性的结果。我们同时选取鸡和鸭的六条特征性多 肽,同时对两种禽类肉掺假进行了监测,并确定了最低的掺假 监测限为 0.5%。考虑到掺假比例的经济性与可操作性,远远超 过了实际监测的需求。 与传统的基于 PCR 和抗体的检测方法相比,质谱具有大致相当的 灵敏度,但是拥有更好的避免假阴性与假阳性的结果的能力,且 能够避免由于加工所带来的 PCR 或者抗体相关的空间结构破坏所 带来的影响。 与上述掺假相比,还有一种相对来说,更为严重,性质更恶劣 的掺假——病死肉的掺假。基于上述的思路,我们认为,通过 进一步系统的研究,质谱也能够成为一种监测病死肉的手段, 斩断病死肉流入餐桌的魔爪,与我们全方位的农残筛查与检测 手段一起,为食品安全提供全方位的保障。同时,利用这种研 究方法,我们还能助力有机肉类产品生产商,提供从肉类良种 选择依据到肉类质量标准建立的可能性。
确定




还剩3页未读,是否继续阅读?
谱质分析检测技术(上海)有限公司为您提供《肉中定量肉类掺假比例检测方案(气相色谱仪)》,该方案主要用于畜禽肉及副产品中理化分析检测,参考标准--,《肉中定量肉类掺假比例检测方案(气相色谱仪)》用到的仪器有
相关方案
更多









