
使用Agilent?1200系列高分离度快速液相色谱系统,1.8-μm的RRHT色谱柱,并与Agilent?6330离子阱和Agilent?6210?ESI?TOF质谱联用来对药物的微量杂质进行检测和结构鉴定。采用1200系列RRLC系统,在1.8-μm色谱柱上实现了检测所有杂质需要的分离度。离子阱串联MS/MS和MSn ,可用于结构鉴定,ESI-TOF通过准确测定质量可用于初步分子式的确证。
方案详情

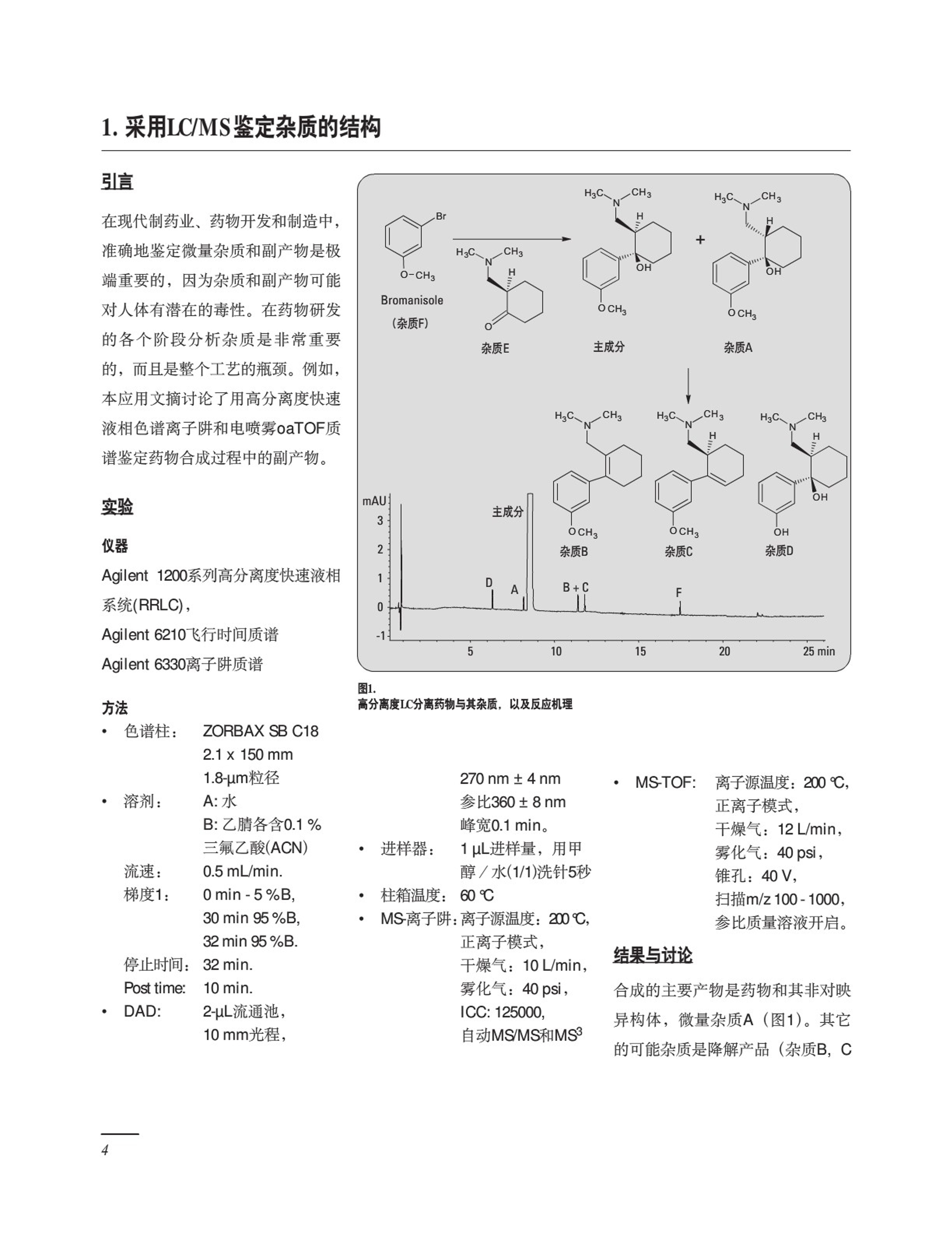
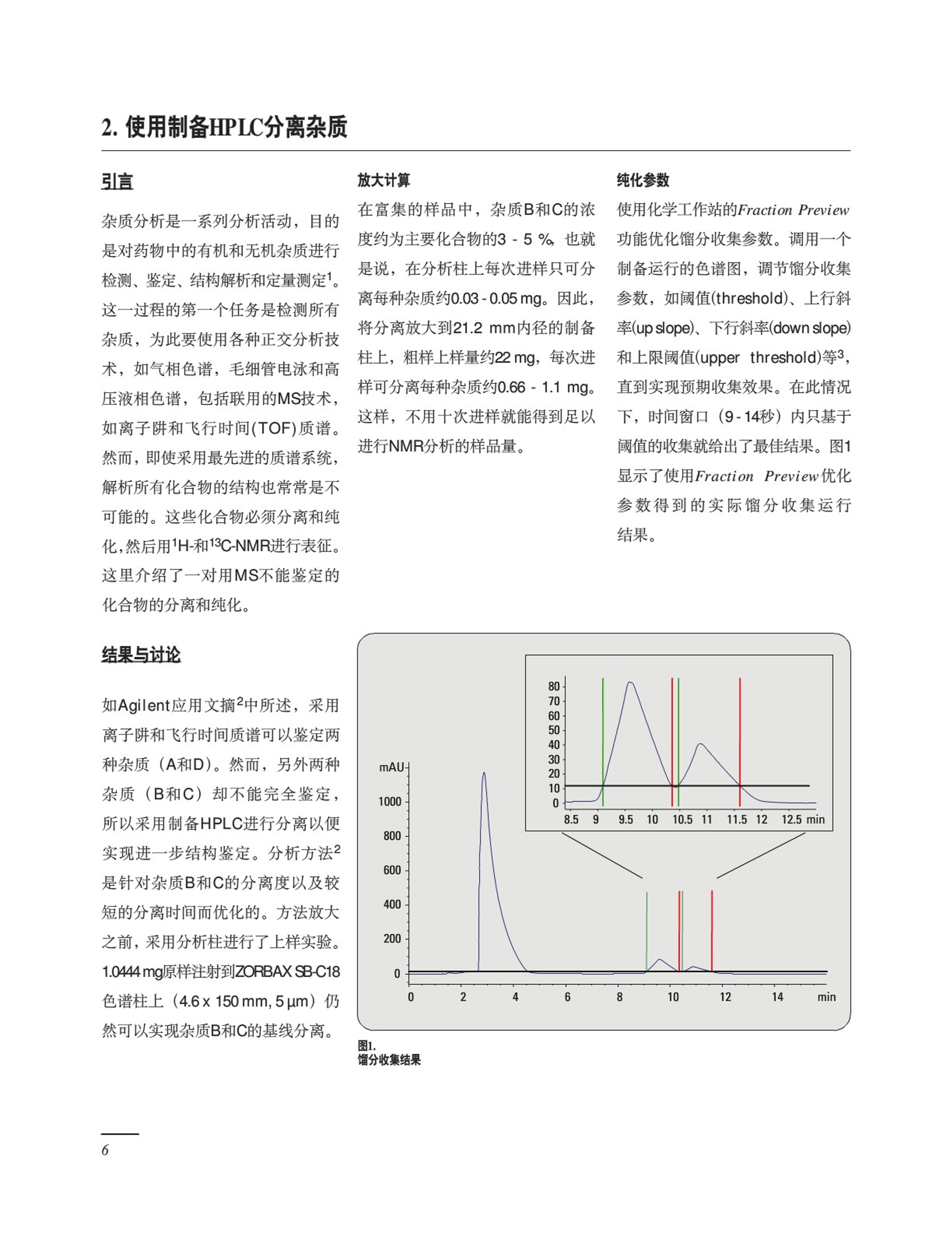
概述 采用Agilent 1200系列液相色谱系统进行药物杂质分析 应用汇编 在日常质量控制和质量保证工作中,药物中的杂质分析从初步筛选开始,以使用认证方法结束。在药物价值传递链上,药物杂质分析日益成为了一项具有挑战性的任务。本汇编就高分离度快速液相色谱(RRLC)与质谱联用如何用于药物中杂质分析和定性提供一个指南,以提高您的工作效率。综述了安捷伦最近的一些有关药物中杂质分析的应用文摘。这些文摘以详细摘要的形式介绍,若需深入阅读全文,您可以从下面的网站下载:www.agilent.com/chem/library。 药物中的杂质 ,1通常,从两个方面关注药物中的杂质: ( ·化学 方 面包括对 杂 质的种类和鉴 定 ,涉及到如何 生成 报告 、 如何设定 适 当的指标, 以 及描 述分 析步骤 。 ) ·更重要的是病人的安全方面,当新药上市时,这些病人将要使用最终产品。在这方面,比较研究和基因毒性测试变得越来越重要。 从法规机构如美国食品和药品管理局(FDA)和EMEA等的观点看,药物中的杂质分成以下几类: ·有机杂质(与工艺和药物相关)·无机杂质 ·残留溶剂 示例研究 本汇编中有5个应用文摘说明了在药物开发和商品化过程中典型分析方法开发和QA/QC实验室的分析流程,即,在药物活性成分中分析测定与生产有关的杂质。 在研究的初期,采用高分离度快速液相色谱,通过加快分析速度,并与飞行时间质谱联用,提供准确的质量信息,这就大大改进了分析过程。有机杂质来源有多种、浓度各不相同,它们最可能来源于药物活性物质的合成和储存过程,也可能来自最终药物产品的制造工艺和/或储存过程,可能来自于: ·起始原材料 ·副产物 ·中间体 ·降解产物 试剂和配体, 也有来自包装材料的。 根据FDA的指南“药物中的杂质”,含量低于0.1%的杂质一般不必进行鉴定。然而,对于那些可能有异常作用、0.1%以下浓度也可产生毒性或药理作用的潜在杂质就应当进行鉴定。在所有情况下,杂质都应该定性。 图1.分析方法开发和QA/QC实验室的通用工作流程 虽然现实中一般把0.05%到0.09%的分析结果取近似值(即0.1%),但本指南的目的,在确定是否对杂质进行鉴定时,这样的值不应当近似为0.1%。总之:为了减少潜在的副作用,需要对杂质进行灵敏的测定,而飞行时间(TOF)质谱能够提供高灵敏度测定和准确质量鉴定,是鉴定痕量杂质的首选方法。 副产物分析 本出版物介绍的分析步骤主要涉及原料、副产物和中间体的分析,以及如何在鉴定过程中及早有效地检测它们。关于包装材料和有机挥发 性杂质(OVI)分析的详细说明可参看附录。杂质分析遵循典型的方法开发流程,方法优化/转移以及最后在GMP条件(图1)下常规使用。 安捷伦科技长期以来致力于为制药行业的分析化学家提供合适的仪器,以持续提高分析速度,并实现更高灵敏度的药物分析。我们希望这个汇编是有用的,能够提供保证病人安全的方法。 引言 在现代制药业、药物开发和制造中,准确地鉴定微量杂质和副产物是极端重要的,因为杂质和副产物可能对人体有潜在的毒性。在药物研发的各个阶段分析杂质是非常重要的,而且是整个工艺的瓶颈。例如,本应用文摘讨论了用高分离度快速液相色谱离子阱和电喷雾oaTOF质谱鉴定药物合成过程中的副产物。 实验 仪器 Agilent 1200系列高分离度快速液相系统(RRLC), Agilent 6210飞行时间质谱 Agilent 6330离子阱质谱 方法 ·色谱柱: ZORBAX SB C18 32 min 95%B. 停止时间:J:32 min. Post time: 10 min. DAD: 2-uL流通池, 10 mm光程, 图1. 2.1x 150 mm MS-TOF: 1.8-pm粒径 270 nm±4nm 离子源温度:200℃, 溶剂: A:水 参比360±8nm 正离子模式, B:乙腈各含0.1% 峰宽0.1 min。 .干燥气:12L/min, 三氟乙酸(ACN) 进样器: 1uL进样量,用甲 雾化气:40psi, 流速: 0.5 mL/min. 醇/水(1/1)洗针5秒 锥孔:40V, 梯度1: 0 min-5%B. 柱箱温度: 60℃ 扫描m/z 100-1000 30 min 95%B. MS离子子:离子源温度:200℃, 参比质量溶液开启。 结果与讨论 合成的主要产物是药物和其非对映异构体,微量杂质A(图1)。其它的可能杂质是降解产品(杂质B,C 和D)以及合成的离析物(杂质E和F)。要在一个药物化合物中发现所有可能的杂质,很重要的一点是使用几种正交的分离技术,比如液相色谱、气相色谱或薄层色谱。仅用LC/UV分析,合成中使用的离析物与它们的保留时间对比证明杂质F是3-bromanisole(图1)。离析物杂质E用UV和ESI-MS都没有检测到。所以,又用GC-FLD分析了样品,可以检测到该化合物,并通过保留时间比较得到了证实(数据略)。为证实所有杂质的分子结构,进行了LC/MS-TOF分析,以测定准确的分子量并计算经验分子式。该实验可在低ppm下,以足够准确的质量确证所有建议的分子式。要获得有关杂质更详细的结构信息,就要进行离子阱质谱分析(图2)。非对映异构体杂质(A)在保留时间8.20min检测到,质量数为m/z264.1。这一化合物的分子离子在MS/MS碎裂时由于失去水而产生碎片离子m/z246.1;在三级质谱(MS3)解离时,离子m/z246.1由于失去甲氧基而产生主要离子m/z 215.1;失去甲基氨基产生离子m/z202.1,以及与苄基阳离子相关的碎片离子m/z 121.1。 杂质 分子式 理论质量 测得质量 质量 准确度 质量 准确度 mDa] Ippm A C6H2NO, 264.1964 264.1957 -0.7 2.5 B C16H2NO 246.1858 246.1850 -0.8 3.2 C CHNO 246.1858 246.1851 -0.7 2.9 D C5HNO, 250.1807 250.1804 -0.3 1.2 表1. LC/TOF分析测定杂质的准确质量,并通过计算相对质量误差证实经验分子式 图2. A)杂质A的离子阱MS,分子离子m/z264.1。B)杂质A的MS/MS碎片离子, m/2 246.1。 C) m/z 246.1离子的MS解离 结论 我们论述了使用Agilent 1200系列高分离度快速液相色谱系统, 1.8-um的RRHT色谱柱, 并与Agilent 6330离子阱和Agilent 6210 ESI TOF质谱联用来对药物的微量杂质进行检测 和结构鉴定。采用1200系列RRLC系统,在1.8-um色谱柱上实现了检测所有杂质需要的分离度。离子阱串联MS/MS和MS,可用于结构鉴定, ESI-TOF通过准确测定质量可用于初步分子式的确证。 ( 在下面的网站上浏览应用文摘“使用1200系 列 LC 系 统分析杂质一第一部分采用LC/MS鉴定杂质结构”(出版号5989-5617EN ) : www . agilent.com/c h em/library ) 引言 杂质分析是一系列分析活动,目的是对药物中的有机和无机杂质进行检测、鉴定、结构解析和定量测测1。这一过程的第一个任务是检测所有杂质,为此要使用各种正交分析技术,如气相色谱,毛细管电泳和高压液相色谱,包括联用的MS技术,如离子阱和飞行时间(TOF)质谱。然而,即使采用最先进的质谱系统,解析所有化合物的结构也常常是不可能的。这些化合物必须分离和纯化,然后用1H-和13C-NMR进行表征。这里介绍了一对用MS不能鉴定的化合物的分离和纯化。 结果与讨论 如Agilent应用文摘2中所述,采用离子阱和飞行时间质谱可以鉴定两种杂质(A和D)。然而,另外两种杂质(B和C)却不能完全鉴定,所以采用制备HPLC进行分离以便实现进一步结构鉴定。分析方法2是针对杂质B和C的分离度以及较短的分离时间而优化的。方法放大之前,采用分析柱进行了上样实验。1.0444 mg原样注射到ZORBAX SB-C18色谱柱上(4.6x150mm,5pm)仍然可以实现杂质B和C的基线分离。 放大计算 在富集的样品中,杂质B和C的浓度约为主要化合物的3-5%,也就是说,在分析柱上每次进样只可分离每种杂质约0.03-0.05mg。因此,将分离放大到21.2 mm内径的制备柱上,粗样上样量约22mg,每次进样可分离每种杂质约0.66-1.1 mg。这样,不用十次进样就能得到足以进行NMR分析的样品量。 纯化参数 使用化学工作站的Fraction Preview功能优化馏分收集参数。调用一个制备运行的色谱图,调节馏分收集参数,如阈值(threshold)、上行斜率(upslope)、下行斜率(down slope)和上限阈值(upper threshold)等3,直到实现预期收集效果。在此情况下,时间窗口(9-14秒)内只基于阈值的收集就给出了最佳结果。图1显示了使用Fraction Preview优化参数得到的实际馏分收集运行结果。 图1. 将十次连续纯化运行收集的杂质合并,杂质C(纯度98.7%)和杂质B(纯度98.2%)的量就足以用NMR进行结构分析(图2)。 结论 从Agilent 1200系列RRLC系统上开发的高分离度分析方法开始,说明了两种杂质的分离和纯化。方法转移到从Agilent 1200系列LC系统和从Agilent 1200系列制备系统是非常方便的,因为从Agilent的固定相既有用于分析柱的亚2微米的填料,也有用于制备柱的标准5-um填料。所以,方法优化和上样实验之后的制备放大可以直接完成,而不必在制备柱上进一步优化方法。化学工作站的功能,如Fraction Preview和馏分自动收集很容易在短的时间内实现最佳纯化。收集馏分的高纯度和回收率使得杂质结构鉴定成了一件很容易的工作。 3.Udo Huber“Sophisticated Peak-based Fraction Collection -Working with Up and DownSlope", Agilent TechnologiesApplication Note, publicationnum ber 5989-0511EN,2004. ( 在下面的网站上浏览应用文摘“使用1200系 列 LC 系 统分析杂质一第二部分采用制备HPLC分离纯化杂质”(出版物编号5989-5618EN) : www . a g ilent.com/chem/library ) 引言 “开发和认证新的分析方法成本高且费时”1所以,任何可减少单次分析运行时间的措施对整个分析过程都是有利的,但绝不能损失分离度、灵敏度、特别是可靠性。Agilent提供亚2微米填料粒径度的色谱柱,以及1000倍以上使用寿命的高质量,这使得方法开发过程大为加快。开始时,常常要确定较宽的分离条件范围,如固定相、流动相参数(%B, 缓冲液, pH, 溶剂)和操作参数如梯度陡度、温度等等,以确定最佳初始条件,然后进行微调。本应用文摘讨论了使用Agilent 1200高分离度快速液相色谱(RRLC)系统和各种Agilent ZORBAX RRHT色谱柱来确定每次分析不超过4 min的分离条件,以及分离位置异构体化合物和非对映异构体的分离效率。 实验 所有实验均在Agilent 1200系列RRLC系统上完成,配置有SL型二元泵,温控高效SL型自动进样器, SL型柱恒温箱和SL型二极管阵列检测器。在条件筛选过程中,测试了16种不同的条件。下列Agilent ZORBAX色谱柱用作固定相: StableBond CN,StableBond C18, Extend C18, Eclipse XDB C8和 Eclipse XDB C18。流 动相是HPLC级水和甲醇或乙腈,以及不同的添加剂。酸度条件为:0.2%TFA (强溶剂为0.16%, pH 1.92,弱酸条件是磷酸缓冲液,pH=6.02,最终的碱性条件是:02%氨(pH=11.0)。色谱柱、流动相和pH的所有可能组合中,只试验了合理的组合。初始筛选采用3.0 mm ID x 50 mm的色谱柱、低延迟体积的泵配置和5(L/6mm流通池的DAD。选择一支4.6-mm ID的色谱柱进行方法微调,使用标准延迟体积的泵配置和13(L/10mm的检测器流通也。所有筛 选试验采用梯度为5-95%B,温度40℃。更详细的情况请参阅第10页的参考文献2。 结果与讨论 本方法开发的目的是提供一个快速而耐用的方法,用于药物生产过程中杂质的定量,药物为碱性盐,pKa 9.4,易溶于水。从前面的实验我们知道,采用其它技术如GC或TLC, 而不是HPLC,就可以很容易地检测到反应试剂。故将关注点放在非对映异构体A和区域去羟基化产物B和C、以及去甲基化产物D的分离上(见图2的分子结构)。 图1. 在初期条件筛选过程中,使用富集了杂质的样品,对于不同的固定相和流动相组合采用了5-95%B的宽范围梯度。正如所料,改变流动相和/或固定相,选择性就发生变化,对色谱分离结果有显著的影响。选择了错误的条件可能导致错误的结论:样品是很简单的混合物。其它条件显示有4个峰,最后的条件5个化合物都检测到了。图1给出了显示选择性变化作用的实例。在选择微调的最佳初始条件进行微调时,只考虑分离度小于2的难分离物质对不超过1对的条件。最后,选择了StableBond C18色谱柱进行进一步优化。微调首先将条件转移到一支4.6mm ID的色谱柱上,这样的柱内径是制造业QA/QC环境优选的。然后,将梯度范围变窄,还研究了温度对微调方法的影响。最终方法对所有混合物可以得到大于3的分离度(图2)。表1列出了分离含有低浓度(主成分的0.05%)杂质的样 图2.将最终方法条件用于含低浓度杂质(主成分的0.05%)的样品分析 品的某些特征值。如参考文献3和4程序以及在制药QA/QC条件下应用所述,开发的方法能满足标准认证 的所有要求。 化合物 时间[min] 分离度 峰面积[mAU·s] 峰高[mAU] 峰宽[s] 面积百分比[%] 含量[ng] 杂质D 0.853 0.25 0.180 1.30 0.050% 1.76 杂质A 1.349 15.96 0.23 0.150 1.38 0.046% 1.62 主成分 1.489 3.21 497.10 222.200 2.11 99.791% 3492.69 杂质C 2.393 19.83 0.33 0.220 1.36 0.066% 2.32 杂质B 2.516 3.58 0.23 0.170 1.27 0.046% 1.62 表1. 使用Agilent 1200系列RRLC系统和亚2微米粒径填料的色谱柱进行条件筛选和微调可以减少活性药物组分中难分离的非对映异构体和位置异构体杂质的方法开发时间。由于需要很短的筛选运行周期(4.5min),一天之内可以试验很多组条件(包括重复和空白运行)。其它的微调再用半天时间,所以,一天半之后就可提供一个方法用于后续的方法认证,由于采用最终方法每次单个运行的时间只有4 min,因此也会明显减少方法认证的时间。 ( 参考文献 ) 1. ( Michael W. Dong,“Modern HPLCfor Practicing Scientists", Wiley Interscience , ISBN0-471-72789-X, 2006. ) ( 2.Michael Frank" l mpurity Profilingwith the Agilent 1200 Ser i esLC/MS System - Part 3: RapidCondition Scouting for Method Development",A g ilent ApplicationNote, publication number 5989-5619EN,2006. ) 3. Angelika Gratzfeld-Huesgen “Impurity Profiling with theAgilent 1200 Series LC System,Part 4:Method Validation of a FastLC Method" Agilent ApplicationNote, publication num ber 5989-5620 EN. 2006. 4. Angelika Gratzfeld-Huesgen “Impurity Profiling with the Agilent 1200 Series LC System Part 5:QA/QC Application Example with Complete Sequencing"Agilent Application Note, publication num ber 5989-5621EN,2006. 认证程序 在预认证实验之后,设置了表1所列的认证协议。测试并给出了专属性3。没有采取进一步的样品制备步骤。称取样品化合物并溶于水。设定了组成的限量并与实测值比较以确定通过或失败(表2)。杂质的分析结果列于表3。 图1. 一个主主分及其4个杂质的分析。主成分1.15 mg/mL, 杂质为主成分的0.072% 认证协议: 1..3主成分的峰面积和保留时间精度 6个浓度,每个浓度运行6次 2.主成分的准确度 6个浓度, 每个浓度运行6次 3.主成分的线性 6个浓度, 每个浓度运行6次 4.主成分的记忆效应 储备液3次进样 5.主成分的范围 6.杂质的峰面积和保留时间精度 7个浓度,每个浓度运行6次 7.杂质的准确度 7个浓度, 每个浓度运行6次 8.杂质的线性 7个浓度,每个浓度运行6次 9.杂质的范围 10.检测限和定量限 11.主成分和杂质的可靠性 不同的柱温,流速,进样量, TFA浓度, 梯度步长,波长,用户和仪器,没有做耐用性测试 表1. 认证测试程序 测试参数 标准指标 测得值 通过/失败 1 峰面积和保 峰面积<2% rsd 峰面积<0.5% rsd 通过 留时间精度 RT<0.1 % rsd RT <0.1 % rsd 2 准确度 ±2% ±1.5% 通过 3 线性 >0.99990 >0.99999 通过 响应因子 响应因子 5%范围内 5%范围内 4 记忆效应 ~0.01% ~0.01% 通过 5 范围 2到0.08 mg/mL 2.3到0.073 mg/mL 通过 11i 耐用性 <2%rsd, 峰面积 <2%rsd, 峰面积 通过 表2. 主成分的测试结果 测试参数 标准指标 测得值 通过/失败 6 峰面积和保 峰面积<5%rsd 峰面积<3% rsd 通过 留时间精度 浓度0.05% 浓度0.05% RT <0.5 % rsd RT <0.15 %rsd 准确度 +5%或浓度0.05% ±3% 通过 线性 >0.9990 >0.9998 响应因子 响应因子 通过 5%量程内 5%量程内 9 范围 0.03到0.3 pg/mL 0.0287到0.306 ug/mL 通过 10 检测限和定量限 LOD 0.01 %level LOD 0.007 %level 通过 11耐用性 LOO 0.03 %level <10 %rsd对于峰面积 LOQ 0.027 %level <10 %对于峰面积 通过 0.07 %level 0.07 % leve 表3. 杂质的测试结果 为分析主成分和4种杂质开发了快速LC方法。该方法的认证是成功的,满足了涉及精度、线性、准确度和稳定可靠性的所有要求。这说明快速LC方法可以用于QA/QC实验室,且符合USP/ICH推荐的要求。快速LC方法提供了同样的数据质量,而且又有较高的样品通量。 ( 参 考文献 ) ( 1. International Conference on Harmonization (ICH) Q2B. Validation of Analytical Procedures: Methodology; Nov. 1996, published in the " FederalRegister", V ol 62, N o. 9 6, pages 27463-27467,May 19, 1 997. ) 2. Internet Resources:http://fda.gov/cder/guidance/index.htm and http://www.labcompli-ance.com (Dr. Huber’s website) ( 3.Michael F rank,“ I m p urity P r ofilingwith t he Agilent 1200 LC System-Part 3: Rapid Condition Scoutingfor Method D evelopment”, A g ilent A pplication N ote, publicationnum ber 5989 - 5619EN,2006. ) 4. Reviewer Guidance, Validation ofChromatographic Methods, Centerfor Drug Evaluation and Research,Food and Drug Administration,1994. 5.Guideline for Submitting Samplesand Analytical Data for MethodsValidation, Food and DrugAdministration,1987. 引言 样品 目的 进样次数 空白溶液 验证基线稳定性 2到3次 (纯样品溶剂) 并鉴定溶剂纯度 验证灵敏度和分离度 对照样品 1 校准混合物l 验证响应的稳定性 3 校准混合物2 验证响应的稳定性并 3 系统适用性样品 校正校准混合物l 验证峰面积和保留时间 6 样品 分离度、峰宽, k和信噪比的精度 杂质和主成分的定量 并测定峰面积和保留时间 的精度 3 性能测试 要确定一个样品是通过还是失败需要多次测试。必须使用校准混合物和对照样品,以及含有用来稀释样品的溶剂的空白样品。表1概要列出了测定样品分析的精度、灵敏度、分离度和其他性能参数的要求。基于该表定义的要求,在安捷伦化学工作站软件中设置了一个分析序列 测试的参数和极限值设置: 峰面积的精度必须<2%rsd ·保留时间的精度必须<0.5%rsd ·所有峰的分离度必须>2 ·最大的半峰宽必须<0.08 min·k'必须550 系统适用性样品的测试结果列于作为一个例子,我们介绍系统适用 表2。满足了所有的极限指标。以性测试规程。要测试系统是否满足 同样的方法,评价了校准标样和对方法要求,制备了主成分和杂质A、照样品的参数指标。所有测试都满B、C、D的溶液,浓度为4-10pg/mL。足了极限指标,被分析样品也通过每天第一次进样之前都要分析这个了极限指标,3个样品的杂质含量溶液。 均没有超过0.5%的允许极限值。 化合物 含量 RSD RSD 分离度 峰宽 k' S/N (保留时间) (峰面积) 4.9 pg/mL 0.142 0.155 9.48 0.018 min 11.43 75.3 4.5 pg/mL 0.062 0.483 3.88 0.019 min 21.95 79.3 5.1 pg/mL 0.069 0.399 6.76 0.019 min 20.88 109.7 4.4 ug/mL 0.246 0.201 0.019 min 6.61 79.8 成分 9.99 ug/mL 0.107 0.160 6.13 0.018 min 13.09 109.7 结论 分析QA/QC部门面临着分析样品数量的逐渐增多以及对数据质量和可靠性越来越高的要求。一般来说,为保证定性和定量数据的正确性,一个样品需要运行10-15次。本文完整地认证的快速LC方法有助于显著提高样品分析通量,而不损失数据的质量。所用序列包含47次分析运行,包括30 min的系统适用性测试,共用3.9小时。若使用一个样品分析周期为20min左右的方法,大致需要15.7小时。这说明快速LC方法明显提高了样品通量。 溶剂的节省也非常明显。采用20 min的样品分析周期,47次运行,流速为2.2 mL/min, 需要溶剂2068mL。而采用本文的快速LC方法, 5 min的样品分析周期,47次运行只需要517mL溶剂。 每次分析的成本因而也大大下降为 大约原来的1/5~1/4。见表3的举例。 方法的重新认证可能需要2周时间, 花费4000美元。在我们的例子中, 在约500次分析运行之后,将方法升 级为快速方法在成本上经济实惠。 样品分析周期 20 min样品分析周期 5 min 样分分析周期 运行数/年* 26208 104832 每次分析大致成本 $I1.35 $2.85 每1000次分析大致成本** SII,350 $2,850 每1000次分析节约成本 一 $8,500 表3. 使用快速LC方法增加的样品通量和节约的分析成本*24小时/天,7天/周,52周/年 **溶剂和处理费=31美元/L,人工费/小时=$30 ( 参考文献 ) ( 1 . Michael Frank " I mpurity Profiling with the Agilent 1200 Series LC System P art 3: Rapid ConditionScouting fo r Method Development" , A gilent Application N ote, publica-tion number 5989-5619EN,2006. ) 2... Angelika Gratzfeld-Huesgen “Impurity Profiling with theAgilent 1200 Series LC SystemPart 4: Method Validation of a FastLC Method",Agilent ApplicationNote, publication number 5989-5620EN, 2006. ( 在下面的网站上浏览应用文摘“使用120 0 系列LC系统分析杂质一第五部分QA/QC应用举例 : 使用快速LC方法进行高通量样品分析” (出版物编号5989-56 2 1EN) : ww w . a gilent.com/che m /library ) 杂质分析 行业指南 “Impurity profiling with theAgilent 1200 Series LC system -厂口Part 1: Structure Elucidation ofImpurities with LC/MS",AgilentApplication Note, publicationnum ber 5989-5617EN,2006. “Impurity profiling with theAgilent 1200 Series LC System -Part 2: Isolation of Impurities withPreparative HPLC", AgilentApplication Note, publicationnumber 5989-5618EN,2006. “Impurity profiling with theAgilent 1200 Series LC system-Part 3: Rapid Condition Scoutingfor Method Development”,AgilentApplication Note, publicationnumber 5989-5619EN, 2006. “Impurity profiling with theAgilent 1200 Series LC System,Part 4:Method Validation of Ultra-fast Method" Agilent ApplicationNote, publication number 5989-5620EN,2006. “Impurity Profiling with theAgilent 1200 Series LC SystemPart 5: V.QA/QC ApplicationExample with CompleteSequencing”Agilent ApplicationNote, publication number 5989-5621EN,2006. “Guidance for IndustryNDAs: Impurities in DrugSubstances,"U.S. Departm ent ofHealth and Human Services Foodand Drug Administration Centerfor Drug Evaluation and Research(CDER) CMC, February 2000. “Guidance for IndustryQ3B(R2) Impurities in New DrugProducts,”U.S. Departm ent ofHealth and Human Services Foodand Drug Administration Centerfor Drug Evaluation andResearch (CDER) Center forBiologics Evaluation andResearch (CBER) ICHRevision 2, July 2006 残留溶剂 “The Determination of ResidualSolvents in Pharmaceuticals Usinathe Agilent G1888 NetworkHeadspace Sampler”, AgilentApplication Note, publicationnum ber 5989-1263EN, 2004. “The Determination of ResidualSolvents in PharmaceuticalsUsing the Agilent G1888Headspace/6890N GC/5975 InertMSD System”, Agilent ApplicationNote, publication number 5989-3196EN,2005. “The Determination ofExtractables and Leachables inPharmaceutical PackagingMaterials Using Headspace GC/MS",Agilent Application Note, publi-cation number 5989-5494EN,2006. “Evaluation of conventional ICP-MS and ORS-ICP-MS for Analysisof Traditional Chinese Medicines”.Agilent Application Note, publi-cation num ber 5989-2570EN.2005. “Determination of Toxic Elementsin Traditional Chinese MedicineUsing Inductively Coupled PlasmaMass Spectrometry", AgilentApplication Note, publicationnumber, 2006. “Routine Pharmaceutical Analysis:The Indispensable Solutions Guideto Proven Applications and BestPractices”CD, Agilent publica-tion num ber 5989-5366EN,2006. w w w.agilent.com/chem/1200rr @安捷伦科技公司版权所有,2006 2006年11月1日出版 出版号5989-5841CHCN Agilent Technologies 使用Agilent 1200系列高分离度快速液相色谱系统,1.8-μm的RRHT色谱柱,并与Agilent 6330离子阱和Agilent 6210 ESI TOF质谱联用来对药物的微量杂质进行检测和结构鉴定。采用1200系列RRLC系统,在1.8-μm色谱柱上实现了检测所有杂质需要的分离度。离子阱串联MS/MS和MSn ,可用于结构鉴定,ESI-TOF通过准确测定质量可用于初步分子式的确证。
确定













还剩14页未读,是否继续阅读?
北京京科瑞达科技有限公司为您提供《药物中杂质检测方案(液相色谱仪)》,该方案主要用于化药制剂中含量测定检测,参考标准--,《药物中杂质检测方案(液相色谱仪)》用到的仪器有Agilent1200液相色谱仪
推荐专场
相关方案
更多
该厂商其他方案
更多















