
方案详情
文
利用细胞的特性(尺寸、密度等)可以用各种方法分离和纯化细胞。本文将介绍如何使用不同的离心方法进行细胞分离。
方案详情

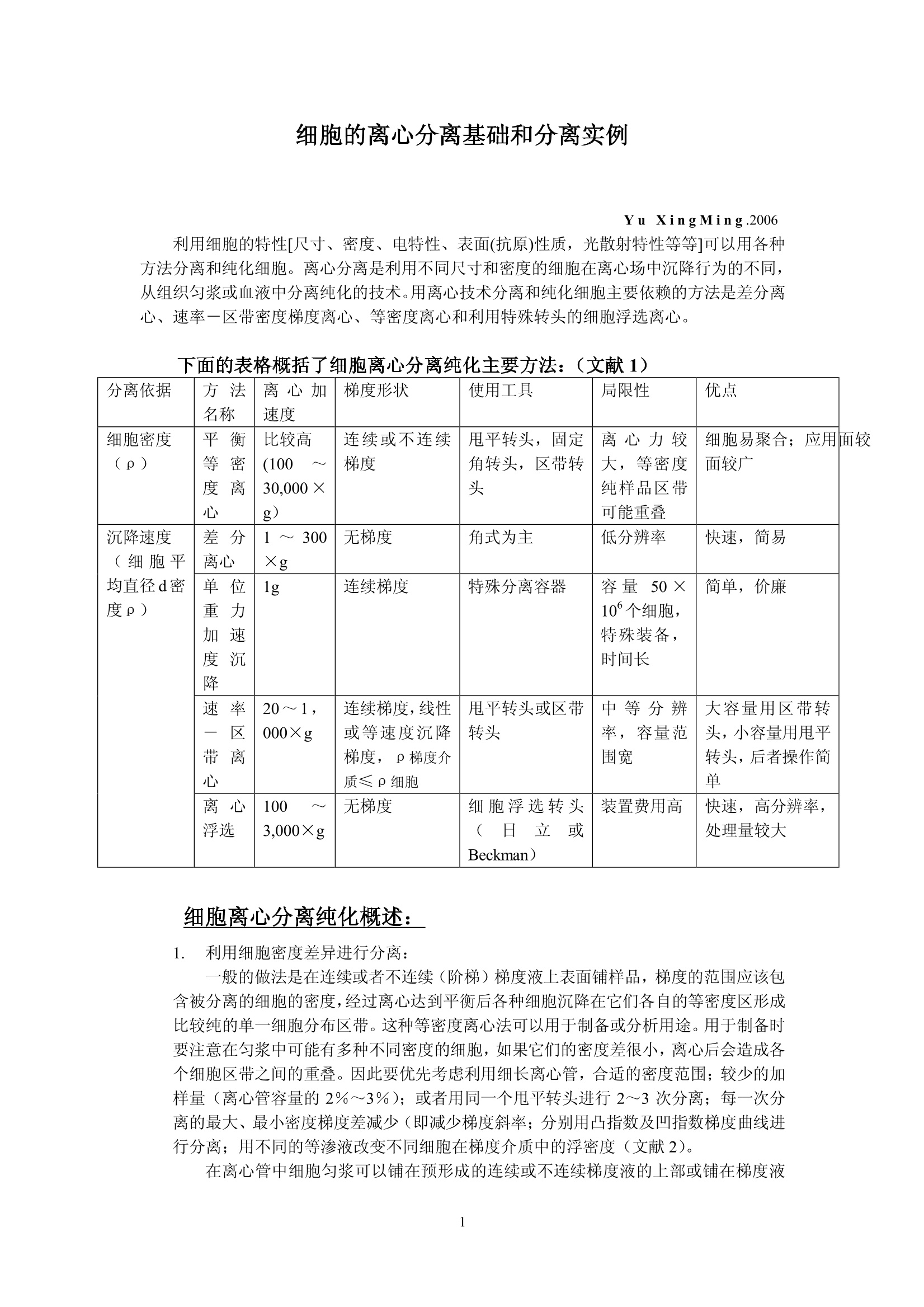
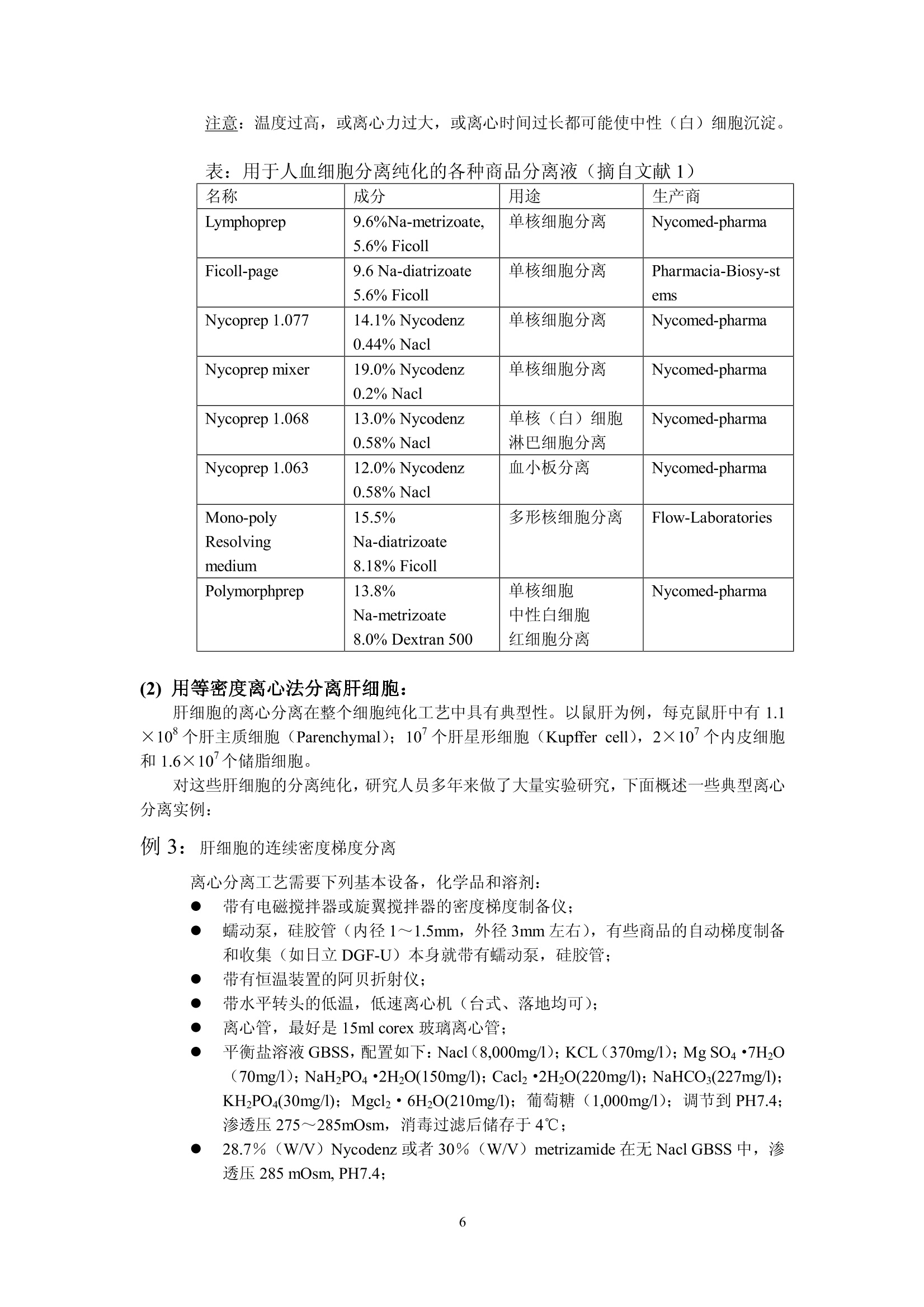
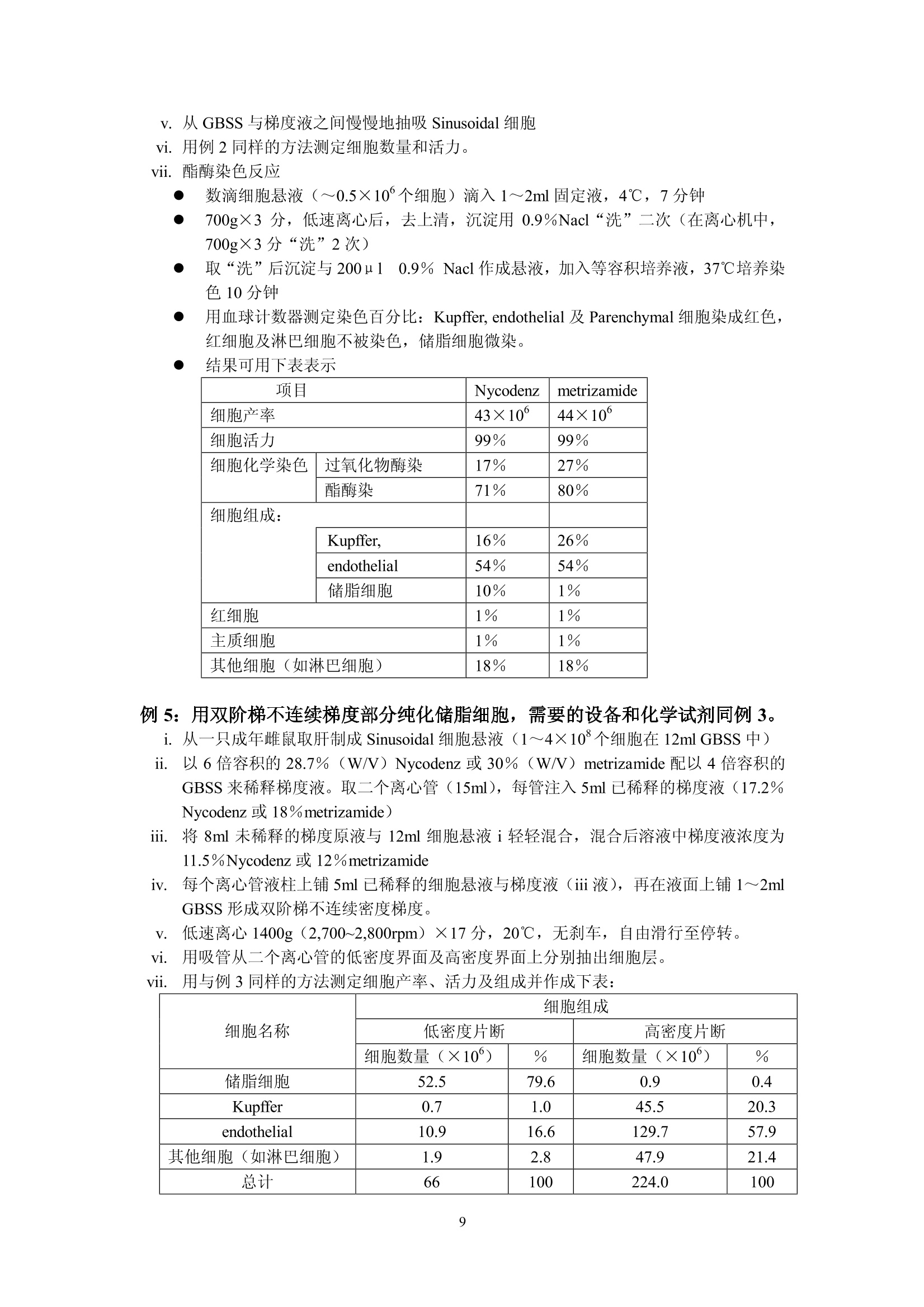
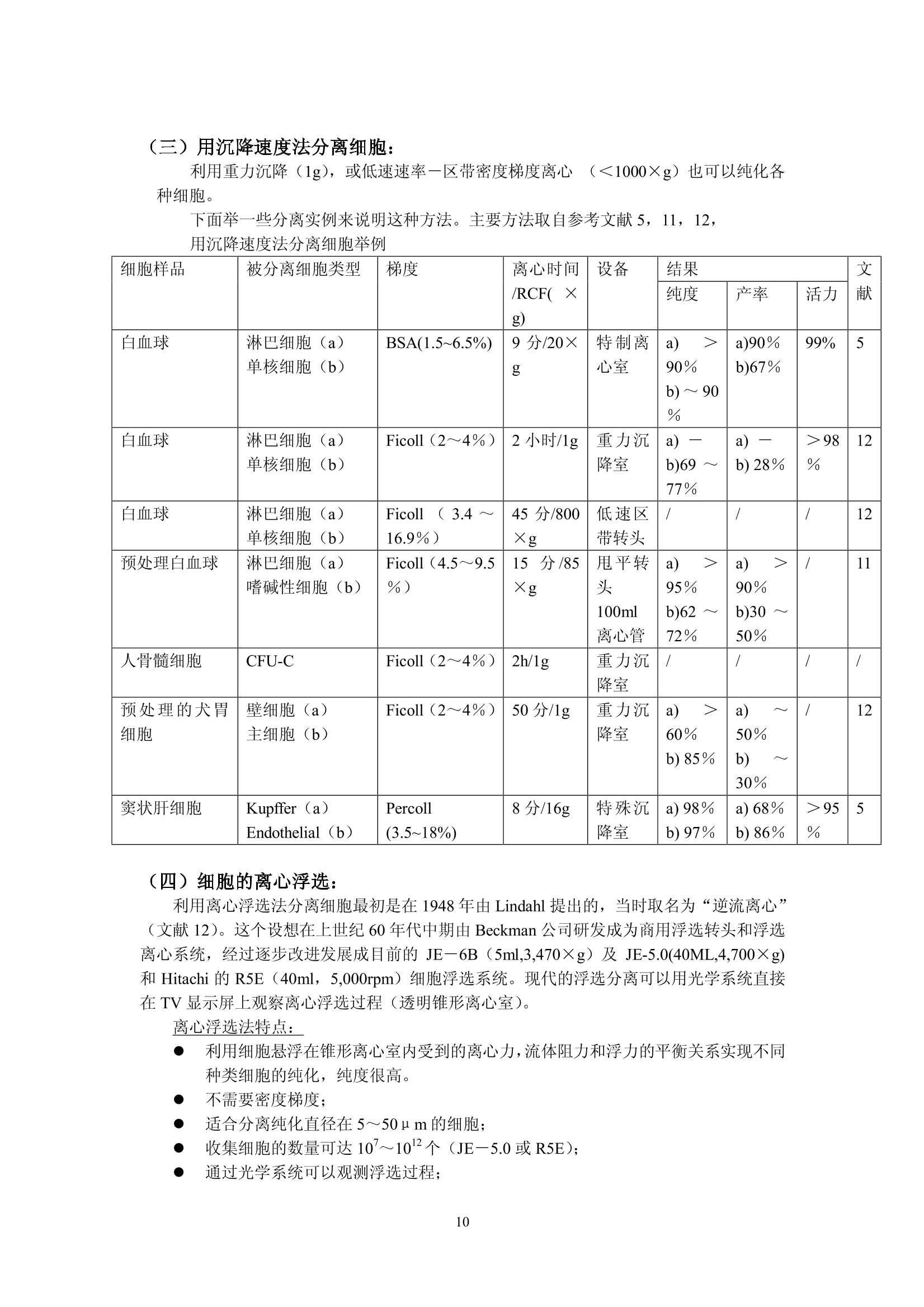
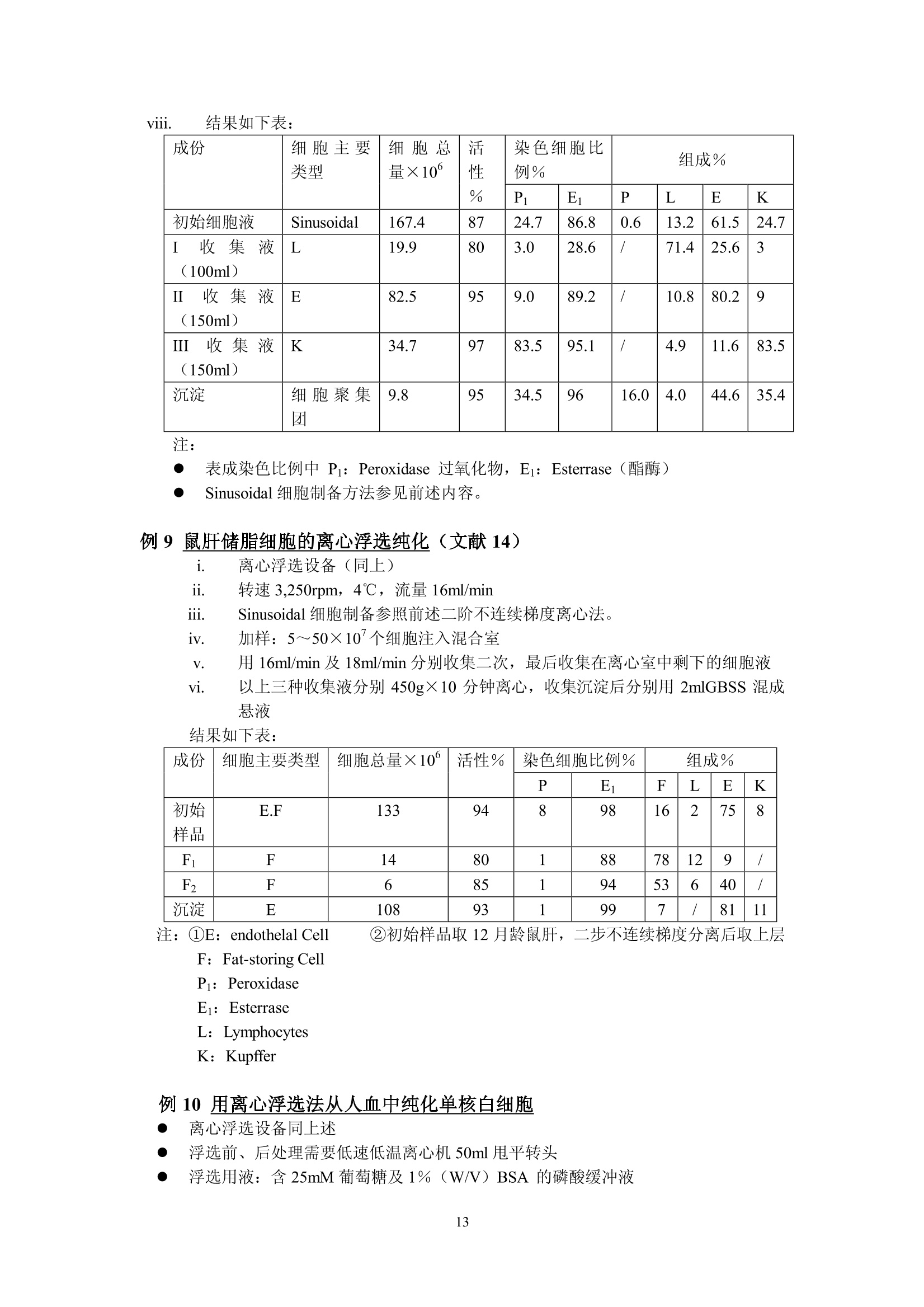
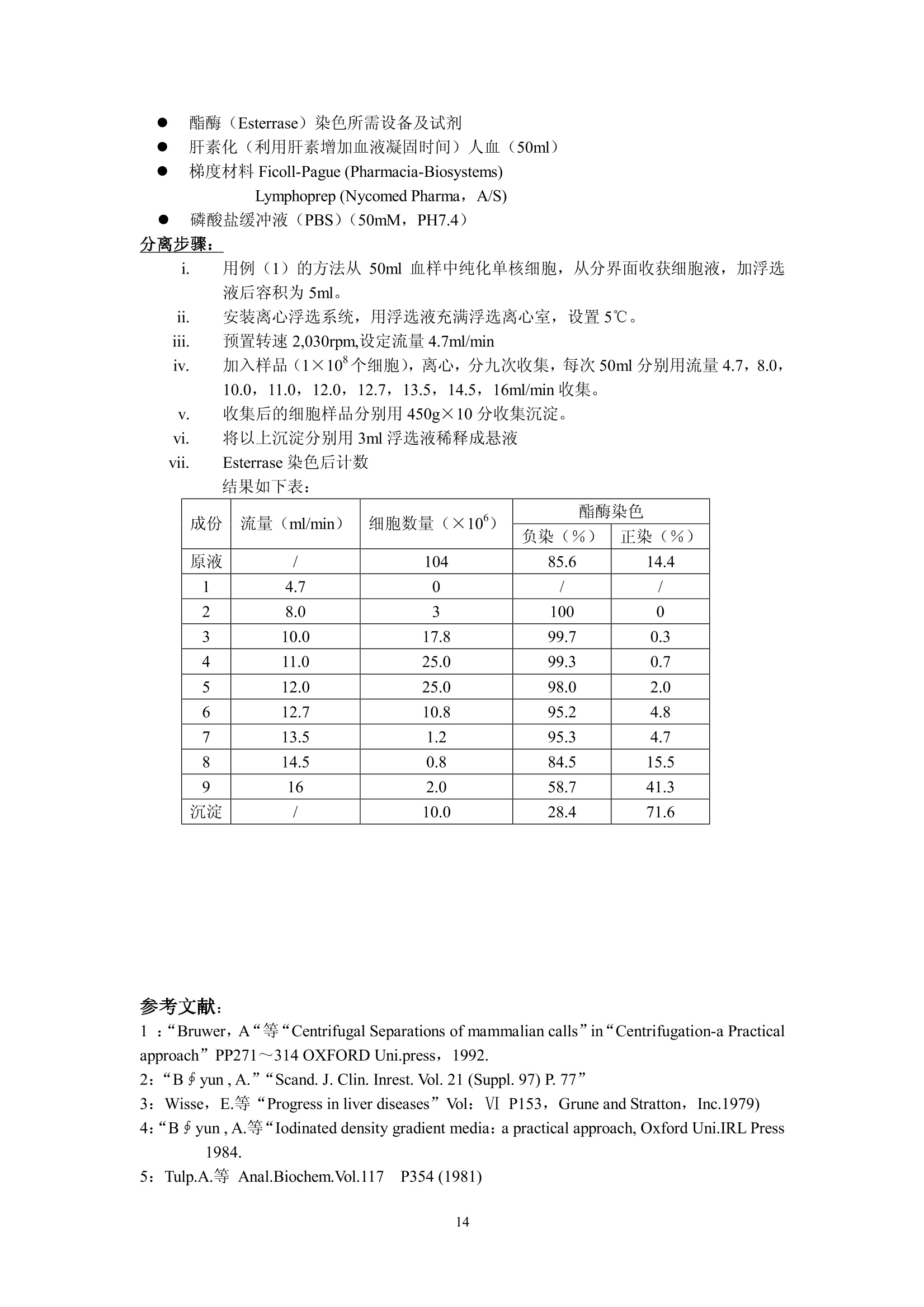
细胞的离心分离基础和分离实例 Yu XingMing.2006 利用细胞的特性[尺寸、密度、电特性、表面(抗原)性质,光散射特性等等]可以用各种方法分离和纯化细胞。离心分离是利用不同尺寸和密度的细胞在离心场中沉降行为的不同,从组织匀浆或血液中分离纯化的技术。用离心技术分离和纯化细胞主要依赖的方法是差分离心、速率一区带密度梯度离心、等密度离心和利用特殊转头的细胞浮选离心。 下面的表格概括了细胞离心分离纯化主要方法:(文献1) 分离依据 方法名称 离心加速度 梯度形状 使用工具 局限性 优点 细胞密度(p) 平衡等密度离心 比较高(10030,000×g) 连续或不连续梯度 甩平转头,固定角转头,区带转头 离心力较大,等密度纯样品区带可能重叠 细胞易聚合;应用面较广 沉降速度(细胞平均直径d密度p) 差分离心 1~300×g 无梯度 角式为主 低分辨率 快速,简易 单位重力加速度沉降 1g 连续梯度 特殊分离容器 容量50×10°个细胞,特殊装备,时间长 简单,价廉 速率一区带离心 20~1,000×g 连续梯度,线性或等速度沉降梯度,p梯度介质≤p细胞 甩平转头或区带转头 中等分辨率,容量范围宽 大容量用区带转头,小容量用甩平转头,后者操作简单 离心浮选 1003,000×g 无梯度 细胞浮选转头(日立或Beckman) 装置费用高 快速,高分辨率,处理量较大 面较 细胞离心分离纯化概述: 1. 利用细胞密度差异进行分离: -般的做法是在连续或者不连续(阶梯)梯度夜上表面铺样品,梯度的范围应该包含被分离的细胞的密度,经过离心达到平衡后各种细胞沉降在它们各自的等密度区形成比较纯的单一细胞分布区带。这种等密度离心法可以用于制备或分析用途。用于制备时要注意在匀浆中可能有多种不同密度的细胞,如果它们的密度差很小,离心后会造成各个细胞区带之间的重叠。因此要优先考虑利用细长离心管,合适的密度范围;较少的加样量(离心管容量的2%~3%);或者用同一个甩平转头进行2~3次分离;每一次分离的最大最小密度梯度差减少(即减少梯度斜率;分别用凸指数及凹指数梯度曲线进行分离;用不同的等渗液改变不同细胞在梯度介质中的浮密度(文献2)。 在离心管中细胞匀浆可以铺在预形成的连续或不连续梯度液的上部或铺在梯度液 的中间某一位置,后者可以在离心过程中让部分密度较小的细胞上浮,让一些密度较大的细胞沉降,减少了沉降距离,从而缩短了离心时间。 不连续的阶梯梯度常用于血细胞包离或肝细胞分离,作血细胞分离时梯度材料可选择Ficoll-metizoate,肝细胞分离可选择 Nycodenz 或 metrizamide (文献3)。 2. 根据不同细胞的沉降速度差异进行分离: 由于细胞在梯度介质中的沉降速度和细胞直径的平方成正比,和细胞与介质密度差一次方成正比(参考讲座文献2“实验离心技术的基本计算”)所以影响沉降速度的首要参数是细胞尺寸,其次才是密度。 公式中 d为细胞直径(cm)o为细胞密度(克/cm) n为介质粘性系数p为梯度介质密度(克/cm) ω为转头旋转角速度r为细胞所在位置与旋转中心的距离(cm) 1. 差分离心: 在不存在密度梯度条件下分离细胞是这种方法的主要特点,差分离心可以是利用地球重力(1g),也可以是利用低速离心分离组织匀浆。在重力或离心力作用下一些比较大的细胞沉降速度较快,当它们已变成沉淀时,大部分比较小的的细胞由于沉降速度慢而仍留在上清液中。很明显在大的细胞变成沉淀时一部分接近离心管底的较小细胞在离心力也已变成沉淀,第一次离心可以使最大颗粒细胞全部沉淀但沉淀中少量的较小细胞降低了分辨率和纯度。我们可以用第一次离心同样转速和时间将第一次沉淀稀释后再离心(每次都要用同样的缓冲液稀释)(这叫在离心机中“洗”,重复数次可以得到较纯的大颗粒沉淀。各次上清液合并以更高转速离心,重复以上过程数次,就可以得到各种较纯的不同大小的颗粒的沉淀。如果利用某些特殊梯度材料(如 dextran , percoll,Nycodenz , metrizamide 等)作为支持液来做血细胞或其他生物体细胞分离,可以用较小的离心次数得到较好的结果。(文献4)。 ii. 依赖重力加速度沉降: 不用离心机,将细胞悬液铺在预形成密度梯度上表面,在重力作用下细胞沉降。—般设计的密度梯度采用较小的密度变化范围,其最大密度小于密度最大的细胞密度。不同密度的细胞以很慢的速度按不同层次沉降。在最大密度细胞达到底部之前进行分部收集。(收集的方法参照“离心技术讲座”文章3a) iii. 利用速率一区带密度梯度离心法分离细胞: 在本质上与重力沉降是一样的,但是利用离心场来减少分离的时间。小容量样品用甩平转头,大容量样品用区带转头,对于较少数量的细胞(10~10°),并且不同细胞的沉降速度有较大差异,用甩平转头离心分离可以得到很满意的结果。对于较大数量的细胞(>10°)可以考虑利用区带转头。区带转头操作是离心技术中比较复什的分离工艺,需要较熟练的操作人员,细心的工作才能得到成功。由于在区带转头中离心分离不存在用离心管分离时产生的壁部效应 (Wall effect)参考加离心技术讲座文献3),可以一次离心收获大量比较纯的细胞。 曾有人在甩平转头的吊桶中加特殊的适配器(套管)来分离纯化少量的细胞(>5×10),提高了分离的纯度(文献5)。 如果不同细胞间尺寸差别不大,在离心场中沉降速度差别不大;或者需要制备大量的细胞用这个方法就不太合适。 iv. 离心浮选 利用一个特别的锥形转头,锥头方向与离心力方向相同,样品从锥头进入,利用离心力在圆锥形离心管中对细胞产生的逆流效应,可以有效地分离各种细胞(如各种培养细胞,酵母细胞,各种血细胞,受精卵等等)离心浮选转头一般配备在低速或高速低温离心机中(如 Hitachi 的 R5E 离心浮选装置, Beckman 的 JE-6B 离心浮选系统)由于样品是从圆锥头部压入,每种细胞都受到离心力和由于锥度形成的流速梯度产生的反向力,不同形状、尺寸、不同密度的细胞在锥形离心室中不同位置达到力的平衡从而形成不同种类细胞的区带,按顺序从锥室大头排出。 这个方法的特点是 不需要制备密度梯度; 可以分离107~10°个细胞; 最使用于分离平均尺寸为 2 u m~50um的细胞; 由于锥形离心管用透明材料制成,在离心室门盖上可以安装透明窗用于观察分离情况并可以装置摄像机通过屏幕观察分离过程; ● 加样泵有较大的流量1~120毫升/分,可以在很短时间内用较低的转速(最高不超过 5,000rpm)成功分离各种细胞; 不损伤细胞; 很高的分辨率; ● 设备投资很高,操作者需培训积累操作经验。因此应用受到很大限制。 3. 用于细胞分离的密度梯度 在讲座3中已较详尽地叙述了密度梯度材料,梯度形状,梯度离心等问题,对于细胞离心分离,对密度梯度材料还有一些特别重要的提示: 对细胞无毒性; 可以配制等渗液; 不会渗入细胞内部; 离心后作分部收集,易从收集集中除去分离介质(如透析); . 较低的粘性系数。 用于细胞分离最好的梯度材料是: Percoll, Nycodenz, Ficoll, metrizamide 和小牛血清白蛋白。它们的性质已在讲座文献的(3),(3)a,(18)中已说明。 细胞分离常用的梯度可以是线性的,非线性的(凸指数或凹指数)连续的或不连续的,梯度制备方法参考讲座文献3(a)。 需要指出的是细胞离心配置的梯度液必须是等渗的,沿整个离心管长度方向渗透压变化要小于10%,也就是说细胞在沉降过程中收缩和膨胀都非常小,它们的基本性状和离心分离前基本一致。梯度材料研制和生产厂对于配制各种等渗液都提供了详细资料。(讲座文献18) 4. 细胞离心分离过程中常常遇到的一些问题 i. 细胞聚集: 细胞聚集后在离心过程中的沉降行为与单个细胞完全不同,因此出现细胞聚集会影响分离纯度。避免的方法是添加一些防止粘结的成分如小牛血清白蛋白,脱氧核糖核酸酶(DNase,防止胶结)、蛋白酶 (protease)、EDTA等;(参考文献6) 关于离心分离温度,有些论文设在4℃离心分离细胞效果很好,也有人认为初步分离时温度应保持在20℃以上。(文献7) ii. 在梯度液中细胞过载: 在密度梯度离心中,每种细胞的数量都不能超过对应于它的密度的梯度液的容量,也就是每种细胞在梯度液中所占有的梯度层的厚度是受限制的,过分厚的纯样品区带会与别的细胞的纯样品区带相重叠;这是问题的一方面。另一方面,虽然垂直管转头在高速离心时,它的离心管纵切面可以容纳更多的样品分子(与甩平转头的离心管横剖面相比较),但在离心完成、梯度从垂直方向转换到水平方向后,每个纯样品所占据的离心管中心轴上的宽度很大。如果初始样品中所含的细胞品种很多,纯化后也会造成纯样品带的重叠。关于这个问题没有精确的数学计算,全靠用户在实验中逐渐积累经验。这涉及待分离样品中细胞的浓度,和梯度离心时的加样量(2%~5%离心管容量)以及梯度的形状(梯度曲线的斜率,连续梯度或者阶梯梯度)等等。 iii. 壁部效应: 在角式转头中沿离心力方向沉降的细胞接近离心管壁部时,与在离心力分力作用下沿管壁下滑的细胞碰撞,造成在角式转头离心管近外壁部形成了一个“壁部效应区”,这个壁部效应区从离心管上部到下部逐渐加宽。由于壁部效应,可能会造成部分细胞的聚集而影响分离纯度,也可能有一小部分细胞由于碰撞而受损。这种影响在用固定角式转头作等密度离心时尤为显著。所以细胞离心分离除浮选转头外一般小容量选择甩平转头,大容量选择区带转头。 iv. 旋涡效应: 在加速或减速过程中在离心管中产生的小旋涡会影响梯度的完整,在减速过程中还会影响已被分离的纯样品带的宽度,转速 500rpm~1000rpm之间往往在复合向心力、也就是 Coriolis 力的作用下在离心管中会产生涡旋,涡旋在下列情况下可以减少: ● 增加回转半径; ● 慢加速和慢减速(根据不同转头,不同容量,不同离心方法可以多档控制的加、减速速率); ● 缩小离心管直径(610mm以下,这在大多数情况下不现实); 使用一些抗旋涡的缓冲液(文献5); 应用有较陡斜率的密度梯度。 V. 液滴效应: 在预形成密度梯度液上表面加待分离的细胞样品,如果不马上离心,就会有很少的液滴滴入梯度层。这个现象在加样后几分钟内会发生,其结果是在样品与梯度液的界面上出现层间扩散(文献8)而影响分离效果,减少这种影响的方法是 ● 降低样品浓度; ● 提高梯度液的初始斜率; 在铺完样品后立即放入转头并开始离心分离。 vi. 离心力的选择: 离心力选择不当会影响细胞活力改变、细胞的内部构造、影响细胞的裂介和复制。 这种影响常出现在: ● 长时间的离心分离过程; ● 转头的快加速; ● 过大的离心力产生了较大的流体静压; ● 应用较高转速的等密度离心法。 如果我们选用较低的转速,粘度较小的梯度材料(本讲座文献18);利用细胞浮选 转头等都可以减少这种影响。 vii. ;渗透效应: 很多细胞特别是哺乳动物细胞没有坚固的细胞壁,周围的介质很容易渗透到细胞内部或者细胞内液体反向渗透到周围介质中而引起细胞的膨胀和收缩,从而改变离心过程中细胞的沉降(或上浮)特性。因此配制等渗的梯度液是必要的(讲座文献18) (二)实用细胞离心分离方法举例 (1) 血细胞纯化: 血细胞由多种类型的但细胞悬液组成,每种细胞都有它们自身的特性和功能并广泛被用于医学临床和诊断。多年来研究人员对血细胞分离纯化作了大量工作,实验室研究和血液成分分离都已广泛使用各种离心设备,如用于医学临床分析、诊断的全自动血细胞洗涤离心机(Hitachi MC-450,24管,Sorvall CW-2,12管),用于大量血液(标准200ml,300ml,400ml,500ml三联或四联血袋)成分分离用的大容量低速、低温离心机(参考技术讲座文献1)等等。o下面我们将以实验室研究为主线,举例说明各种血细胞分离纯化方法。 由 Bf yum 研发并在多年来被普遍应用的血细胞纯化方法是用梯度材料 Na-metrizaate与 Ficoll的混合液作密度梯度离心,把血球中的红血球,多形核细胞、淋巴细胞、单核细胞、血小板分离纯化。这种溶液有不同的商品名称如 Lymphoprep(Nycomed Pharma 公司)、Ficollpague (pharmacia-Biosystems公司)等,都可以作这一用途。(文献9) 下面的例子是在室温下用低速离心机作血细细胞离的实验。 例1.人血中单核(白)细胞的纯化 i. 用抗凝血剂处理血样,常用抗凝剂为0.32%柠檬酸钠。 ii. 用等容积的生理盐水稀释血样。 iii. 在10ml~15ml离心管中先注入3ml metrizoate-Ficoll 分离液,在其上铺6ml已稀释血样。 iv. 用甩平转头 600g(1,800~3,000ropm, 台式机)×20分,20℃。(不要在4-5℃低温离心,否则分离效果将很差。 V. 离心后用巴氏移液吸管从血浆与分离液界面中间吸出血细胞层,其中含有单核(白)细胞和部分血小板。 vi. 加入几毫升生理盐水,降低收集的血细胞浓度。 vii. 同一离心转头,同一离心管 250g (1200rpm 左右)×5分钟20℃。可以用同一工艺在离心机中洗几次。 viii. 收集沉淀在生理盐水中保存。 例2. 从人血中分离红细胞,单核(白)细胞,中性(白)细胞 新鲜人血(3~5)ml用抗凝剂处理。 ii. 15ml离心管中先注入5ml 分离液 Polymorphprep(Nycomed Pharma A/S 公司产品),然后铺上用抗血凝剂处理过的人全血5ml。 m台式低速离心机,甩平转头, 450g(1500~1600rpm) ×35分钟,18℃~23℃。 分离结果:离心管上部近40%液柱为血浆,接下来一薄层为单核细胞再下面间隔了少量分离液后又是一薄层中性(白)细胞,再往下近30%液柱为分离液,红细胞在底部(沉淀)。 注意:温度过高,或离心力过大,或离心时间过长都可能使中性(白)细胞沉淀。 表:用于人血细胞分离纯化的各种商品分离液(摘自文献1) 名称 成分 用途 生产商 Lymphoprep 9.6%Na-metrizoate,5.6% Ficoll 单核细胞分离 Nycomed-pharma Ficoll-page 9.6 Na-diatrizoate5.6% Ficoll 单核细胞分离 Pharmacia-Biosy-stems Nycoprep 1.077 14.1% Nycodenz0.44%Nacl 单核细胞分离 Nycomed-pharma Nycoprep mixer 19.0% Nycodenz0.2%Nacl 单核细胞分离 Nycomed-pharma Nycoprep 1.068 13.0% Nycodenz0.58% Nacl 单核(白)细胞淋巴细胞分离 Nycomed-pharma Nycoprep 1.063 12.0% Nycodenz0.58% Nacl 血小板分离 Nycomed-pharma Mono-polyResolving medium 15.5% Na-diatrizoate8.18% Ficoll 多形核细胞分离 Flow-Laboratories Polymorphprep 13.8% Na-metrizoate 8.0% Dextran 500 单核细胞 中性白细胞 红细胞分离 Nycomed-pharma (2)用等密度离心法分离肝细胞: 肝细胞的离心分离在整个细胞纯化工艺中具有典型性。以鼠肝为例,每克鼠肝中有1.1×10°个肝主质细胞 (Parenchymal); 10个肝星形细胞(Kupffer cell), 2×10个内皮细胞和1.6×10个储脂细胞。 对这些肝细胞的分离纯化,研究人员多年来做了大量实验研究,下面概述一些典型离心分离实例: 例3: 肝细胞的连续密度梯度分离 离心分离工艺需要下列基本设备,化学品和溶剂: ● 带有电磁搅拌器或旋翼搅拌器的密度梯度制备仪; 蠕动泵,硅胶管(内径1~1.5mm,外径3mm左右),有些商品的自动梯度制备和收集(如日立DGF-U)本身就带有蠕动泵,硅胶管; 带有恒温装置的阿贝折射仪; 带水平转头的低温,低速离心机(台式、落地均可); 离心管,最好是15ml corex 玻璃离心管; 平衡盐溶液 GBSS, 配置如下: Nacl(8,000mg/l); KCL (370mg/l); Mg SO4·7H20(70mg/1);NaH2PO4·2H2O(150mg/l); Cacl22H2O(220mg/l); NaHCO3(227mg/l);KHzPO4(30mg/l); Mgcl2·6H2O(210mg/l);葡萄糖(1,000mg/l);调节到 PH7.4;渗透压275~285mOsm, 消毒过滤后储存于4℃; 28.7%(W/V) Nycodenz 或者 30% (W/V) metrizamide 在无 Nacl GBSS中,渗透压285 mOsm, PH7.4; 窦状肝细胞(制备方法参见文献1, P313或其他文献); 0.5%(W/V) 台酚蓝 (trypan blue) 在生理盐水中; 制备过氧化物酶染色需要的条件(参见文献10) 分离方法: i. 从一个鼠肝中制备(2~3)×10°个肝窦状细胞; ii. 细胞在 15ml GBSS 中洗三次; iii. 低速离心300g(1200~1300rpm)×5分钟,室温; iv. 沉淀用 6ml GBSS制成悬液; V.i制备梯度液和离心分离: ●将 30%(W/V) metrizamide 或 28.7%(W/V) Nycodenz (最好是 Nycodenz, 因为它可以高温灭菌)分别用 GBSS 稀释到20%和19.1%一溶液A 用溶液 A (metrizamide)(3.1倍体积)稀释 iv 细胞悬液,成为8%(W/V)metrizamide梯度液 或用溶液A((Nycodenz)(5.4倍体积)稀释 iv 悬液,成为 7.7%(W/V) Nycodenz梯度液 ● 制备 8%~20%metrizamide 或 7.7%~19.1%Nycodenz 连续线性梯度(用本讲座中所用各种方法或利用 Hitachi DGF-U) 用甩平转头,低温,低速离心机, 2,000g(约3,400~3,500rpm)×30分钟,4℃,慢加速,慢减速。为了避免细胞聚集,总离心时间不要超过45分钟。 Vi.结果分析 用 DGF-U, 上取法将每个离心管中溶液分部收集成25~30管(每管0.3~0.5ml) 用阿贝折射仪测定各管的折射率(RI)并换算成密度 Nycodenz:密度 (g/ml)=RI×3.242-3.323 metrizamide:密度 (g/ml)=RI×3.453一3.601 用 0.5% Trypan 蓝溶介在生理盐水中与分部收集的细胞液混合,被染色的细胞为无活力细胞。 测定细胞数量并计算有活力的细胞百分比 用过氧化物酶染色反应测定肝星形细胞、内皮细胞及其他细胞的分布情况。 ● 过氧化物染色反应: a:分别取每个分部收集液数滴(约5×10各各胞)滴入2ml细胞培养液 注意:30分钟内用完。 b:在培养箱中37℃培养30分钟(也可以用恒温水槽) c:培养后低速离心300g×3分钟,去上清沉淀用 200 u 1GBSS 稀释 d:用血细胞计数器测定染色细胞数量:红细胞被染后呈黑色,而肝星形细胞(Kupffer)呈深褐色,由于它们大小不同,颜色也可分辨,在计数器上很容易鉴别。内皮细胞和淋巴西哦保保持染色前原色。 e: :结果可以绘成下图 从图可以看出: Kupffer 细胞在第10管中占20%,只占总的 Kupffer 细胞的一小部分。在第12~14管中内皮细胞占 50%。 ● 从结果分析,用这种等密度离心法还不能完全纯化 Kupffer 及 endothelial 细胞,而只能用于一般实验需要。 density (g/ml) 例4:肝细胞的不连续密度梯度分离 这种方法适用于从肝窦状细胞 (Sinusoidal) 中除去红细胞和主质细胞(parenchymal),离心结果是让红细胞沉淀:内皮细胞 (Sinusoidal)浮上。 实验需要的基本设备和试剂: . 一台带甩平转头的低速、低温离心机; GBSS: 在无 Nacl 的 GBSS 中的28.7%Nycodenz或 30%metrizamide 15ml塑料离心管; 窦状(Sinusoidal)肝细胞; Trypan 蓝染色剂: ● 过氧化物酶染色剂,及染色需要的设备; 生理盐水(0.9%Nacl) ● 固定液:2.5%二醛在0.1M二甲基胂酸钠中(PH7.4)(二甲基胂酸钠有剧毒,可用0.1M磷酸盐代替) 培养液::((在通风柜或生物安全柜中配置) 9.5ml 1.0M Nacl: 11mg1乙乙酸萘脂在 0.5ml 乙基乙二醇一乙醚中(在氮气中保存); 0.5ml 1.0M Nacl; 0.25ml 4%品红在2.0M HCL中, 0.25ml4%硝酸钠在纯水中,共计0.5ml混合; 把以上混合液调节到PH7.4,纤维纸过滤后待用: 注意:30分钟内用完! 离心方法: i. 准备 10ml Sinusoidal 肝细胞在GBSS中悬液(1~4×10个细胞) ii. 在悬液中加 14ml 28.7%(W/V) Nycodenz 或 30%(W/V) metrizamide 轻轻混匀。 iii.将以上溶液分别注入二个离心管,并在每管液面上缓铺1~2ml GBSS iv.离心: 400g×15分,室温,不用刹车,自由滑行减速至停转。 v. 从 GBSS 与梯度液之间慢慢地抽吸 Sinusoidal细胞 vi. 用例2同样的方法测定细胞数量和活力。 vii.酯酶染色反应 数滴细胞悬液(~0.5×10°个细胞)滴入1~2ml固定液,4℃,7分钟 ● 700g×3分,低速离心后,去上清,沉淀用 0.9%Nacl“洗”二次(在离心机中,700g×3分“洗”2次) ● 取“洗”后沉淀与2001 0.9% Nacl作成悬液,加入等容积培养液,37℃培养染色10分钟 ● 用血球计数器测定染色百分比: Kupffer, endothelial 及 Parenchymal 细胞染成红色,红细胞及淋巴细胞不被染色,储脂细胞微染。 结果可用下表表示 项目 Nycodenz metrizamide 细胞产率 43×10° 44×10° 细胞活力 99% 99% 细胞化学染色 过氧化物酶染 17% 27% 酯酶染 71% 80% 细胞组成: Kupffer, 16% 26% endothelial 54% 54% 储脂细胞 10% 1% 红细胞 1% 1% 主质细胞 1% 1% 其他细胞(如淋巴细胞) 18% 18% 例5:用双阶梯不连续梯度部分纯化储脂细胞,需要的设备和化学试剂同例 3.i. 从一只成年雌鼠取肝制成 Sinusoidal 细胞悬液(1~4×10°个细胞在 12ml GBSS 中) ii. 以6倍容积的28.7%(W/V) Nycodenz 或 30% (W/V) metrizamide 配以4倍容积的GBSS 来稀释梯度液。取二个离心管(15ml),每管注入5ml已稀释的梯度液(17.2%Nycodenz 或 18%metrizamide) iii. 将8ml未稀释的梯度原液与 12ml细胞悬液i轻轻混合,混合后溶液中梯度液浓度为11.5%Nycodenz 或 12%metrizamide iv.年每个离心管液柱上铺5ml已稀释的细胞悬液与梯度液(iii液),再在液面上铺 1~2mlGBSS形成双阶梯不连续密度梯度。 V.低速离心1400g(2,700~2,800rpm)×17分,20℃,无刹车,自由滑行至停转。 vi. 用吸管从二个离心管的低密度界面及高密度界面上分别抽出细胞层。 vii. 用与例3同样的方法测定细胞产率、活力及组成并作成下表: 细胞名称 细胞组成 低密度片断 高密度片断 细胞数量(×10°) % 细胞数量(×10°) % 储脂细胞 52.5 79.6 0.9 0.4 Kupffer 0.7 1.0 45.5 20.3 endothelial 10.9 16.6 129.7 57.9 其他细胞(如淋巴细胞) 1.9 2.8 47.9 21.4 总计 66 100 224.0 100 (三)用沉降速度法分离细胞: 利用重力沉降(1g),或低速速率一区带密度梯度离心(<1000×g)也可以纯化各种细胞。 下面举一些分离实例来说明这种方法。主要方法取自参考文献5, 11,12, 用沉降速度法分离细胞举例 细胞样品 被分离细胞类型 梯度 离心时间/RCF((×g) 设备 结果 文献 纯度 产率 活力 白血球 淋巴细胞(a)单核细胞(b) BSA(1.5~6.5%) 9分/20×g 特制离心室 a) >90%b)~90% a)90%b)67% 99% 5 白血球 淋巴细胞(a)单核细胞(b) Ficoll(2~4%) 2小时/1g 重力沉降室 a)b)69)~77% )二b)28% ≥98% 12 白血球 淋巴细胞(a)单核细胞(b) Ficoll (3.4~16.9%) 45分/800×g 低速区带转头 / / / 12 预处理白血球 淋巴细胞(a)嗜碱性细胞(b) Ficoll(4.5~9.5%) 157分/85Xg 甩平转头100ml离心管 a) >95%b)62)72% a)90%b)30~50% 11 人骨髓细胞 CFU-C Ficoll(2~4%) 2h/1g 重力沉降室 / / / / 预处理的犬胃细胞 壁细胞(a)主细胞(b) Ficoll(2~4%) 50分/1g 重力沉降室 a) >60%b) 85% a50%b 30% / 12 窦状肝细胞 Kupffer (a)Endothelial(b) Percoll (3.5~18%) 8分/16g 特殊沉降室 a)98%b)97% a) 68%b)86% >95% 5 (四)细胞的离心浮选: 利用离心浮选法分离细胞最初是在 1948年由 Lindahl 提出的,当时取名为“逆流离心”(文献12)。这个设想在上世纪60年代中期由 Beckman 公司研发成为商用浮选转头和浮选离心系统,经过逐步改进发展成目前的 JE-6B (5ml,3,470×g) 及 JE-5.0(40ML,4,700×g)和 Hitachi 的 R5E (40ml, 5,000rpm)细胞浮选系统。现代的浮选分离可以用光学系统直接在TV显示屏上观察离心浮选过程(透明锥形离心室)。 离心浮选法特点: ● 利用细胞悬浮在锥形离心室内受到的离心力,流体阻力和浮力的平衡关系实现不同种类细胞的纯化,纯度很高。 ● 不需要密度梯度; ● 适合分离纯化直径在5~50pm的细胞; ● 收集细胞的数量可达10~10个(JE-5.0或 R5E); ● 通过光学系统可以观测浮选过程; 可以实现自动收集已纯化的细胞: R5E在心机门上有照相机L记浮 : 离心浮选宝可以高温消毒(121℃,20分) 离心浮选示意图(取白Hitachi 样本) 离心浮选系统组成: ● Hitachi 或 Beckman 高速冷冻离心机 离心浮选转头(日立R5E或贝克曼JE-5.0); 环氧树脂透明离心室; 带流量计、蠕动泵、及加样分配阀的加样系统; 浮选转头专用观察门盖; 光源组件(装在转头下方) TV显示系统 例6肝主质细胞倍体级分离(文献13) 所需设备同上述。 肝细胞浮选用介质:L-glutamine(131mg/l), L - aspartic acid(13.3mg/l),,L-threonine(23.8mg/l), L-serine(31.5mg/l), glycine(37.6mg/l), L-alanine(53.5mg/l), L-glutainic acid(132.4mg/l), KCL(223.7mg/l), NaHzPO4·H20 (96.6mg/l), MgClz·6HzO(101.7mg/l), NaHCO3(2.01g/l), glucose(3.60g/l), fructose(3.60g/l), Sucrose(67.4mg/l), 溶液调节到PH7.4, 渗透压:308mOsm,配置后储存在一20℃待用。 肝主质细胞悬液,从三月龄雌性 WAG/Rij 鼠取出; trypan 蓝染色剂。 结果:各种倍体细胞分布 二倍体(2n) 四倍体(4n) 八倍体(8n) 16倍体(16n) 单核 双核 单核 双核 单核 双核 / 9% 16% 53% 16% 4% 2% 例7鼠肝主质细胞的多倍体级浮选分离 ● 设备及样品:同司(5) 转速1350rpm(~210g) 温度4℃ 初始充样流速 12ml/min, 直至细胞充满离心室 分别用流速19,32,41(ml/min)收集 I,II,III 细胞,收集量分别为 100ml, 150ml 及 100ml已收集细胞储存于4℃ 停止输液后转头停转,从离心室收集沉淀并收集混合室样品 用低速低温离心机甩平转头分别将收集液离心沉淀,1000×g,10分钟,将沉淀与3ml浮选介质混合制成倍体细胞悬液,4℃保存。 ● 结果:细胞数量与活性分析 成分 流量ml/min 细胞数量×10° 活性(%) 组成 原液 137.8 84 2n, 4n, 8n, 16n及 少量细胞聚集团及细胞碎片 I 19 39.8 72 2n, 4n,少量细胞碎片 Ⅱ 32 54.7 85 4n(90%) 41 15.5 83 4n, 8n, 细胞聚集团 沉淀 17.1 82 同原液数据 混合室 5.2 85 同原液数据 总数 127.0(92%) 例8肝的Kupffer (星形细胞)及 endothelial(内皮)细胞纯化 ● 浮选设备:同上述例 浮选用介质: GBSS 各种染色介质(参考各节) 肝窦状细胞(Sinusoidal)悬液 ● 分离步骤 i. 用不连续 Nycodenz 梯度制备鼠肝 Sinusoidal 细胞悬液(参见本文前例) ii. 安装离心浮选系统(Hitachi 或 Beckman) iii. 标准离心室: 3,250rpm,4℃ iv. 初始流量 13.5ml/min 注入1~5×10个细胞悬液 V. 在流量分别为18, 32, 48ml/min 时分别收集100ml, 150ml, 150ml 收集液中含有白细胞(L)、星形细胞(K)、内皮细胞(E)及主质细胞(P),收集液保存在4℃。 离心后收集在浮选室中的细胞 各种收集液离心沉淀:450g×10分,沉淀分别混悬于 3mlGBSS 中 viii. 结果如下表: 成份 细胞主要类型 细胞总漫×10° 活性% 染色细胞比例% 组成% P E1 P L E K 初始细胞液 Sinusoidal 167.4 87 24.7 86.8 0.6 13.2 61.5 24.7 I收集液(100ml) L 19.9 80 3.0 28.6 / 71.4 25.6 3 Ⅱ 收集液(150ml) E 82.5 95 9.0 89.2 / 10.8 80.2 9 II收集液(150ml) K 34.7 97 83.5 95.1 / 4.9 11.6 83.5 沉淀 细胞聚集团 9.8 95 34.5 96 16.0 4.0 44.6 35.4 注: 表成染色比例中 Pi: Peroxidase过氧化物, E: Esterrase(酯酶) Sinusoidal 细胞制备方法参见前述内容。 例9鼠肝储脂细胞的离心浮选纯化(文献14) i. 离心浮选设备(同上) ii. 转速 3,250rpm, 4℃, 流量 16ml/min iii. Sinusoidal 细胞制备参照前述二阶不连续梯度离心法。 iv. 加样:5~50×10个细胞注入混合室 V. 用 16ml/min 及 18ml/min 分别收集二次,最后收集在离心室中剩下的细胞液 vi. 以上三种收集液分别 450g×10分钟离心,收集沉淀后分别用 2mlGBSS 混成悬液 结果如下表: 成份 细胞主要类型 细胞总量×10° 活性% 染色细胞比例% 组成% P E F L E K 初始样品 E.F 133 94 8 98 16 2 75 8 F F 14 80 1 88 78 12 9 / F2 F 6 85 1 94 53 6 40 / 沉淀 E 108 93 1 99 7 81 11 注:①E: endothelal Cell ②初始样品取12月龄鼠肝,,二二步步不连续梯度分离后取上层F: Fat-storing Cell Pi: PeroxidaseEj: Esterrase L: Lymphocytes K:Kupffer 例10用离心浮选法从人血中纯化单核白细胞 离心浮选设备同上述 ● 浮选前、后处理需要低速低温离心机50ml甩平转头 ● 浮选用液:含25mM葡萄糖及1% (W/V) BSA 的磷酸缓冲液 酯酶 (Esterrase) 染色所需设备及试剂 ● 肝素化(利用肝素增加血液凝固时间)人血(50ml) ● 梯度材料 Ficoll-Pague (Pharmacia-Biosystems) Lymphoprep (Nycomed Pharma, A/S) ● 磷酸盐盐冲液(PBS)(50mM, PH7.4) 分离步骤: 1. 用例(1)的方法从50ml 血样中纯化单核细胞,从分界面收获细胞液,加浮选液后容积为5ml。 ii. 安装离心浮选系统,用浮选液充满浮选离心室,设置5℃。 iii. 预置转速 2,030rpm,设定流量 4.7ml/min iv. 加入样品(1×10个细胞),离心,分九次收集,每次 50ml分别用流量4.7, 8.0,10.0,11.0,12.0,12.7,13.5,14.5, 16ml/min 收集。 V. 收集后的细胞样品分别用 450g×10分收集沉淀。 vi. 将以上沉淀分别用3ml浮选液稀释成悬液 vii. Esterrase 染色后计数 结果如下表: 成份 流量(ml/min) 细胞数量(×10) 酯酶染色 负染(%) 正染(%) 原液 / 104 85.6 14.4 1 4.7 0 / / 2 8.0 3 100 0 3 10.0 17.8 99.7 0.3 4 11.0 25.0 99.3 0.7 5 12.0 25.0 98.0 2.0 6 12.7 10.8 95.2 4.8 7 13.5 1.2 95.3 4.7 8 14.5 0.8 84.5 15.5 9 16 2.0 58.7 41.3 沉淀 / 10.0 28.4 71.6 ( 参考文献: ) ( 1 :“Bruwer, A“等“Centrifugal Separations of mammalian calls”in“Centrifugation-a Practicalapproach”PP271~314 OXFORD Uni.press, 1992. ) ( 2: “B6 yun, A."“ S c a nd. J. Clin. Inrest. Vol. 21 ( Suppl.97) P . 77” ) ( 3: Wisse, E.等“Pr o gress in liver diseases” Vol: V I P 153, G r une and Stratton, I nc.1979) ) ( 4:“B yun, A.等“Iodinated density gradient media: a practical approach, Oxford Uni.IRL Press 1984. ) ( 5: Tulp.A.等 Anal.Biochem.Vol.117 P354(1981) ) 6: Brouwer,A 等人“Sinusoidal liver cells” P509, Elsevier Biomedical press .Amsterdam, 1982 7: Pertoft, H 等“Cell Separation: methods and selected applications”Vol 1, P41 Academic press.New York 1982 8::Remenyik, C.J.等 Arch. Biochem. Biophys.Vol:201 P500 9: B9yun,A.“Scand .J.Clin.Invest.Vd:21,P77 10: Knook, D. L.等“Exp. Cell Res. Vol:99, P444 11: MacGlashan, D.W 等“Cell Separation: Methods and Selected application ”Vol:l:1P301Academic Press. New York 1982 12:Wells, J.R.同上书 P169 13: Bezooijen C.F.A 等“Pharmacological morphological and Phisiological Aspects of liver aging”Vol:1 P115(1984) 14: Knock, D,L 等“Exp。 Cell Res. Vol:139 P468 (1982) 如欲了解更多详细信息,请联系天美(中国)科学仪器有限公司市场部,或访问天美官方网站:www.techcomp.cn
确定









还剩13页未读,是否继续阅读?
天美仪拓实验室设备(上海)有限公司为您提供《细胞的离心分离基础和实例》,该方案主要用于其他中--检测,参考标准--,《细胞的离心分离基础和实例》用到的仪器有
相关方案
更多
该厂商其他方案
更多








