
方案详情
文
"文章介绍采用了离子色谱法和ICP-MS 联用的方法来测量保健品中的六价铬,结果:相比离子色谱法而言,提高了抗干扰和定性的能力。从试验结果来看,效果良好。"
方案详情

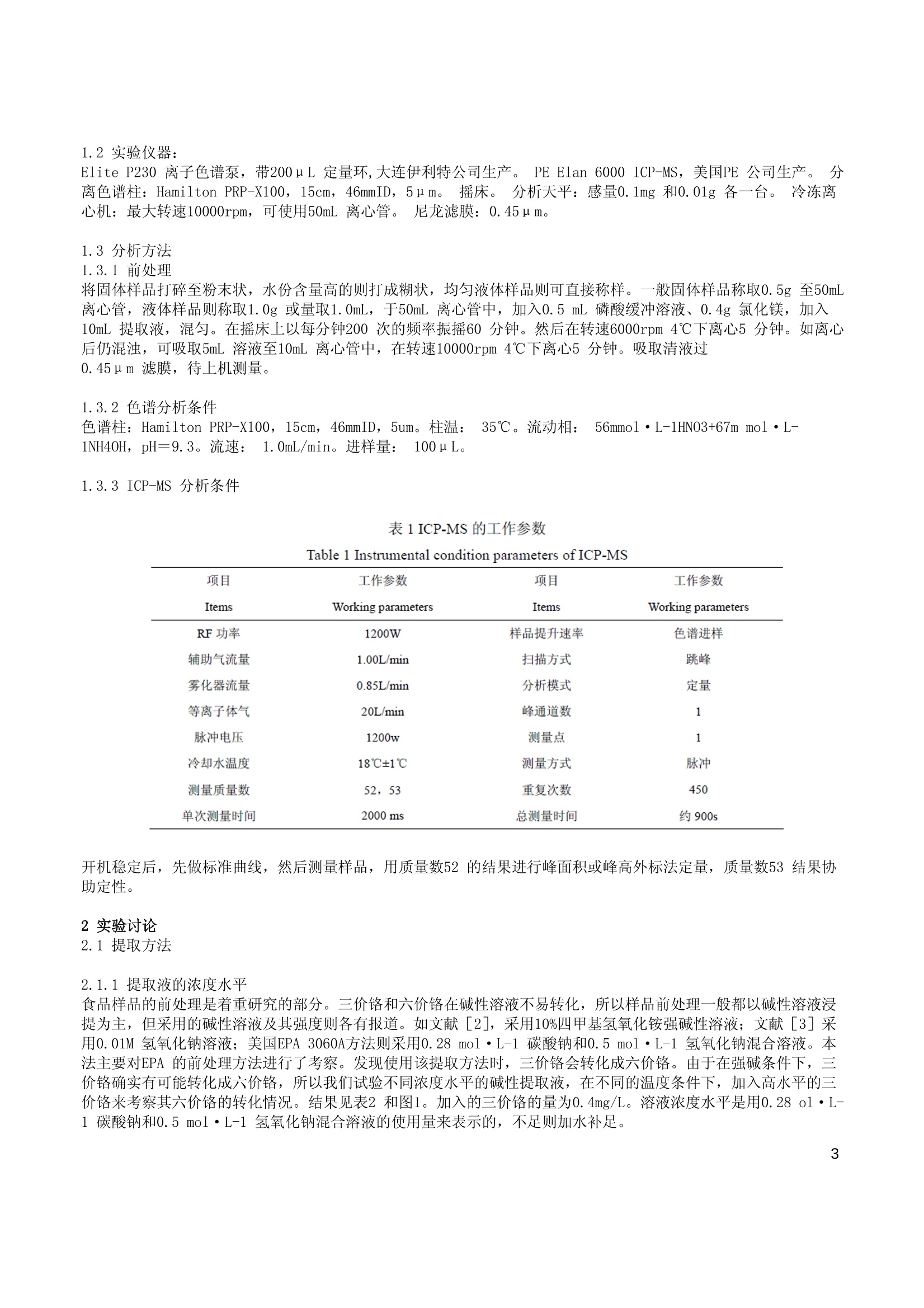
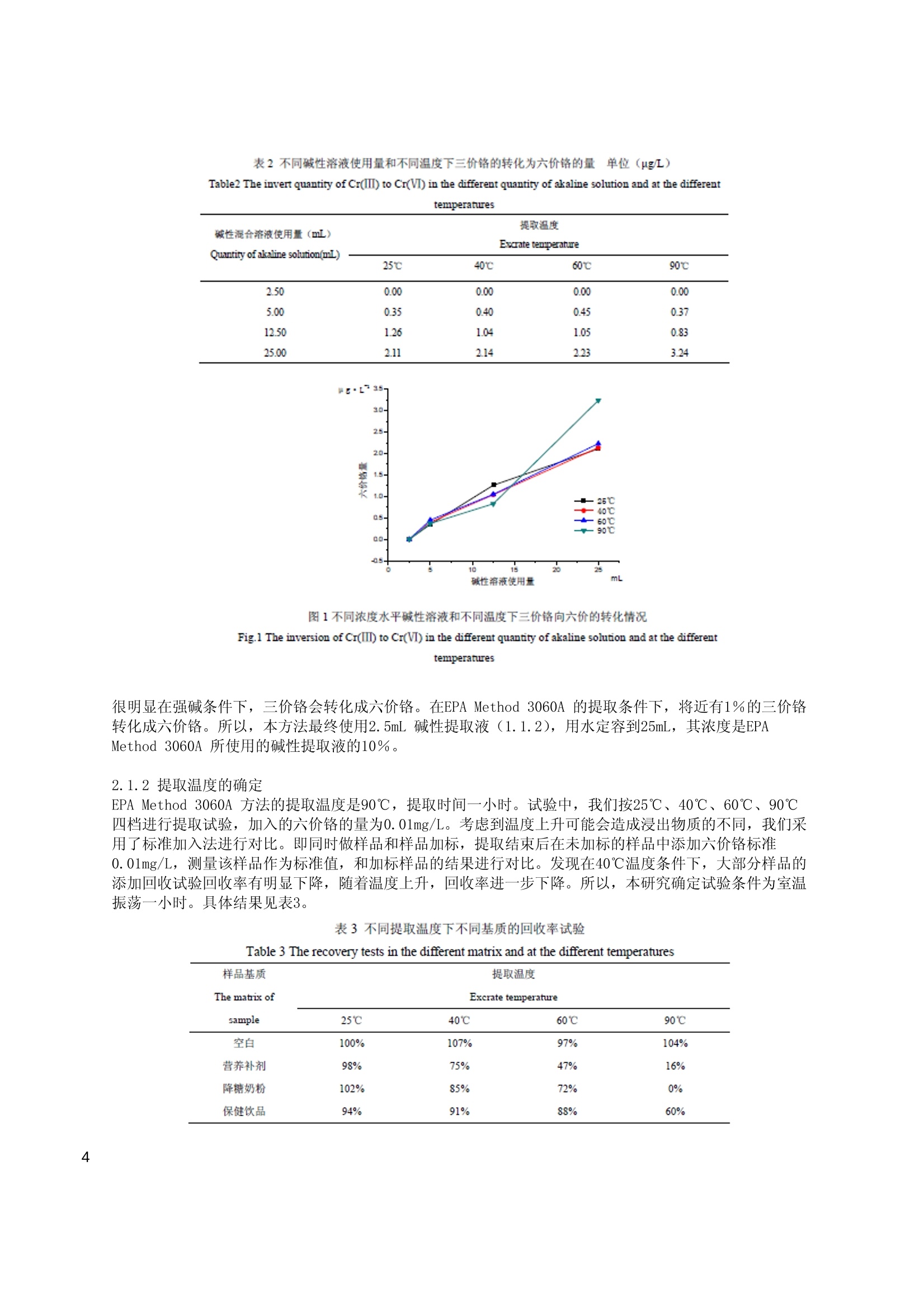
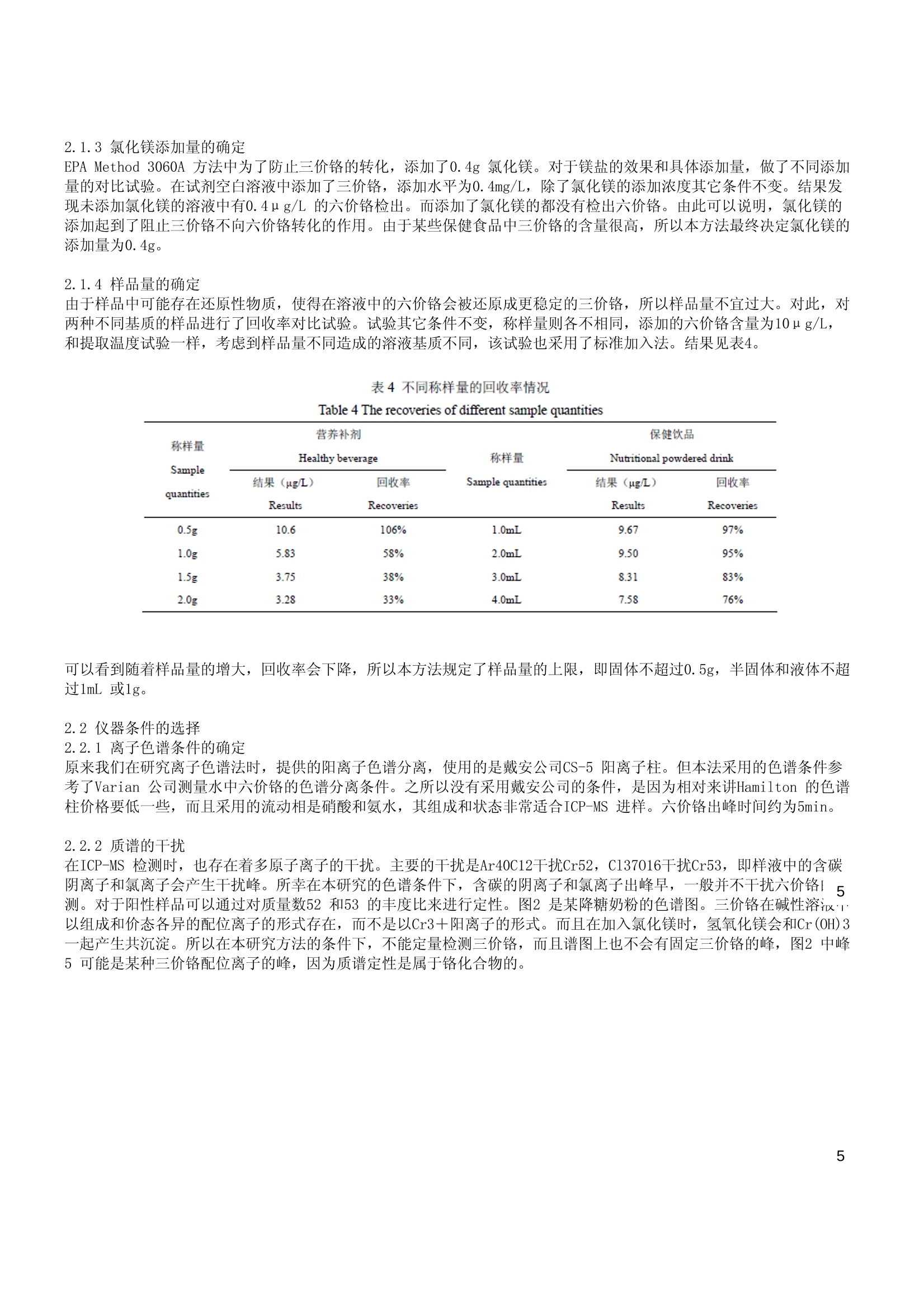
保健食品中的六价铬测定 摘要 采用碱性溶液稳定并提取保健品中的六价铬,在阴离子色谱柱上进行分离,用ICP-MS对六价铬进行检测。对保健奶粉、营养冲剂、保健饮品等样品进行了试验,线性相关系数大于0.999,精密度RSD<10%,回收率在80%-110%之间,测定低限为0.2u g/L。该方法简便快速,具有较强的定性能力。 铬是一种微量元素,常见的离子价态有:0、+2、+3和+6。Cr(Ⅱ)离子是强还原剂,相当不稳定,能迅速地氧化成三价铬,因此, Cr(Ⅱ)在生物体内极少可能存在。六价铬离子具有较高的正电荷和较小的半径,因此,不论在晶体中还是在溶液中都不存在简单的Cr(ⅥI)离子,而总是以酸根阴离子的形式存在。其中,六价铬主要是与氧结合成铬酸盐(Cr042-)或重铬酸盐 (Cr2072-),是一种很强的氧化剂。在酸性溶液中,这些离子很容易还原到Cr(II)。 三价铬是最稳定的氧化态,也是生物体内最常见的一种。但是, Cr(III) 在碱性溶液中却有较强的还原性,较易被氧化[1]。三价铬的毒性比较小,而且为人体所必需。其主要生理功能是作为葡萄糖耐量因子的组成成分;作为体内某些代谢酶类的活化剂;作为核酸的稳定剂,以及能促进胆固醇和脂肪酸的生成。而六价铬则毒性比较大,吸附在皮肤或摄入体内时可能引起病变甚至癌变。大量摄入可致死亡。 三价铬作为必需元素是人体葡萄糖耐量因子的组成部分,同时也产生其它生理作用。人体缺乏三价铬,可能导致一系列疾病。比较明显是缺铬导致的糖尿病。所以一些针对糖尿病人的保健品中就添加了三价铬。然而现在对于保健品中铬的测量是参照食品中总铬的测定方法GB/T 5009.123-2003《食品中铬的测定方法》,而没有保健品中六价铬的测定方法。对于这些添加三价铬的保健品,如果只测总量显然无法知道其中铬的具体价态以及可能造成的危害。经查阅资料,国内外现在对对品中六价价的测量有一些研究,如对动物性食品罐品[2]、饲料[3]、乳制品[4][5]等农畜产品中的六价铬测定进行了研究。其方法主要采用不改变价态的碱消解或水浸提,通过萃取或柱吸附的方法分离六价铬,然后用石墨炉原子吸收测定。这些方法的好处是能够利用石墨炉原子吸收灵敏度高的优点,缺点是操作需要分离,操作比较复杂。而对保健品则没有查到相关检测资料。 离子色谱是高效液相色谱的一个分支,主要用于阴、阳离子的分析。离子色谱选择性好、灵敏、快速、简便,可同时测定多组分。在测量环境样品中价态铬已经有了较广泛的应用[6]。笔者曾对离子色谱测量食品保健品中的六价铬进行了研究。采用了弱碱提取、离子色谱分离、柱后衍生分光光度定量的测量方法。[7]但在研究中发现对一些颜色较深的或者在色谱上有干扰峰出现的样品,离子色谱法定量六价铬就比较困难了。在已有的元素分析方法中, ICP-MS 是比较新的元素测量手段,具有极高的灵敏度和极强的选择性。同时由于ICP-MS 是采用蠕动泵进样,可以色谱进行联用。而色谱—ICP-MS联用可说是当今测量元素价态最有效的仪器方法。本研究即采用了离子色谱法和ICP-MS 联用的方法来测量保健品中的六价铬,相比离子色谱法而言,提高了抗干扰和定性的能力。从试验结果来看,效果良好。 1实验步骤 1.1试剂 实验所用水均为超纯水:电阻率为18.2MQ/cm。氯化镁,分析纯。65%HN03,优优纯。25%NH40H, 分析纯,均从国药集团购入。 1.1.1磷酸缓冲溶液(pH=7.0):将8.71g磷酸氢二钾和6.80g磷酸二氢钾溶解在水中,定容至100mL, 混匀。 1.1.2碱性提取液:0.5 mol·L-1Na0H 和0.28 mol·L-1Na2C03混合溶液。取分析纯NaOH20g和分析纯Na2C0330g 溶解在水中,最终用水定容至1000mL, 混匀待用。 1.1.3六价铬标准溶液:GBW (E)080257, 0.1000g/L。 1.1.4六价铬工作标准溶液:由六价铬标准储备溶液用水逐级稀释成50 ug/L 溶液,吸取0mL、0.2mL、0.5mL、1mL、2mL、5mL 该溶液于50mL 离心管中。分别加入0.5 mL 磷酸缓冲溶液、0.4g氯化镁,加入10mL 提取液,用水定容至25mL,混匀。在6000rpm 转速下离心5分钟,吸取清液过0.45um滤膜,即得到标准工作溶液系列。该标准系列的标准分别为:0、0.4、1、2、4、10ug/L。该标准系列应临用现配。 1.1.5流动相的配制:56m mol·L-1HN03+67m mol·L-1NH40H, pH 9.3。准确移取2mL65%HN03和2.5mL25%NH40H溶液于500mL烧杯中,加入水近400mL,混匀。使用NH40H 或HNO3溶液将pH 调至9.3。移入500mL容量瓶,然后用水定容。使用前,超声10分钟。 1.2实验仪器: Elite P230 离子色谱泵,带200uL定量环,大连伊利特公司生产。]PE Elan 6000 ICP-MS,美国PE公司生产。o分离色谱柱: Hamilton PRP-X100, 15cm, 46mmID, 5u m. 摇床。o分析天平:感量0.1mg 和0.01g各一台。冷冻离心机:最大转速10000rpm,可使用50mL 离心管。尼龙滤膜:0.45ume 1.3分析方法 1.3.1前处理 将固体样品打碎至粉末状,水份含量高的则打成糊状,均匀液体样品则可直接称样。,一般固体样品称取0.5g 至50mL离心管,液体样品则称取1.0g或量取1.0mL, 于50mL 离心管中,加入0.5mL 磷酸缓冲溶液、0.4g氯化镁,加入10mL 提取液,混匀。在摇床上以每分钟200次的频率振摇60分钟。然后在转速6000rpm 4℃下离心5分钟。如离心后仍混浊,可吸取5mL溶液至10mL 离心管中,在转速10000rpm 4℃下离心5分钟。吸取清液过 0.45um滤膜,待上机测量。 1.3.2色谱分析条件 色谱柱: Hamilton PRP-X100, 15cm, 46mmID, 5um。柱温: 35℃。流动相: 56mmol·L-1HN03+67m mol·L-1NH40H, pH=9.3。流速: 1.0mL/min。进样量: 100uL。 1.3.3 ICP-MS分析条件 表1ICP-MS的工作参数 Table 1 Instrumental condition parameters of ICP-MS 项目 工作参数 项目 工作参数 Items Working parameters Items Working parameters RF 功率 1200W 样品提升速率 色谱进样 辅助气流量 1.00L/min 扫描方式 跳峰 雾化器流量 0.85L/min 分析模式 定量 等离子体气 20L/min 峰通道数 1 脉冲电压 1200w 测量点 1 冷却水温度 18℃±1℃ 测量方式 脉冲 测量质量数 52,53 重复次数 450 单次测量时间 2000 ms 总测量时间 约900s 开机稳定后,先做标准曲线,然后测量样品,用质量数52的结果进行峰面积或峰高外标法定量,质量数53结果协助定性。 2实验讨论 2.1提取方法 2.1.1提取液的浓度水平 食品样品的前处理是着重研究的部分。三价铬和六价铬在碱性溶液不易转化,所以样品前处理一般都以碱性溶液浸提为主,但采用的碱性溶液及其强度则各有报道。如文献[2],采用10%四甲基氢氧化铵强碱性溶液;文献[3]采用0.01M氢氧化钠溶液;美国EPA 3060A方法则采用0.28 mol·L-1 碳酸钠和0.5 mol·L-1氢氧化钠混合溶液。本法主要对EPA 的前处理方法进行了考察。发现使用该提取方法时,三价铬会转化成六价铬。由于在强碱条件下,三价铬确实有可能转化成六价铬,所以我们试验不同浓度水平的碱性提取液,在不同的温度条件下,加入高水平的三价铬来考察其六价铬的转化情况。结果见表2和图1。加入的三价铬的量为0.4mg/L。溶液浓度水平是用0.28 ol·L- 1碳酸钠和0.5 mol·L-1氢氧化钠混合溶液的使用量来表示的,不足则加水补足。 表2 不同碱性溶液使用量和不同温度下三价铬的转化为六价格的量 单位 (pg/L) Table2 The invert quantity ofCr(III) to Cn(VI) in the different quantity of skaline solution and at the differenttemperarures 碱性混合洛液使用量 (mL) 提取温度 Excrate tenperature Quantity of akaline solution(mL) 25℃ 40℃ 60℃ 90℃ 250 0.00 0.00 0.00 0.00 5.00 0.35 0.40 045 0.37 12.50 1.26 1.04 1.05 0.83 25.00 2.11 214 223 3.24 图1不同浓度水平碱性溶液和不同温度下三价铬向六价的转化情况 Fig.1 The inversion of Cr(IIl) to Cr(VI) in the different quantity of akaline solution and at the differenttemperanures 很明显在强碱条件下,三价铬会转化成六价铬。在EPA Method 3060A 的提取条件下,将近有1%的三价铬转化成六价铬。所以,本方法最终使用2.5mL 碱性提取液(1.1.2),用水定容到25mL, 其浓度是EPAMethod 3060A 所使用的碱性提取液的10%。 2.1.2提取温度的确定 EPA Method 3060A 方法的提取温度是90℃,提取时间一小时。试验中,我们按25℃、40℃、60℃、90℃四档进行提取试验,加入的六价铬的量为0.01mg/L。考虑到温度上升可能会造成浸出物质的不同,我们采用了标准加入法进行对比。即同时做样品和样品加标,提取结束后在未加标的样品中添加六价铬标准0.01mg/L,测量该样品作为标准值,和加标样品的结果进行对比。发现在40℃温度条件下,大部分样品的添加回收试验回收率有明显下降,随着温度上升,回收率进一步下降。所以,本研究确定试验条件为室温振荡一小时。具体结果见见3。 表3不同提取温度下不同基质的回收率试验 Table 3 The recovery tests in the different matrix and at the different temperatures 样品基质 提取温度 The matrix of Excrate temperature sample 25℃ 40℃ 60℃ 90℃ 空白 100% 107% 97% 104% 营养补剂 98% 75% 47% 16% 降糖奶粉 102% 85% 72% 0% 保健饮品 94% 91% 88% 60% 2.1.3氯化镁添加量的确定 EPA Method 3060A 方法中为了防止三价铬的转化,添加了0.4g氯化镁。对于镁盐的效果和具体添加量,做了不同添加量的对比试验。在试剂空白溶液中添加了三价铬,添加水平为0.4mg/L, 除了氯化镁的添加浓度其它条件不变。结果发现未添加氯化镁的溶液中有0.4ug/L的六价铬检出。而添加了氯化镁的都没有检出六价铬。由此可以说明,氯化镁的添加起到了阻止三价铬不向六价铬转化的作用。由于某些保健食品中三价铬的含量很高,所以本方法最终决定氯化镁的添加量为0.4g。 2.1.4样品量的确定 由于样品中可能存在还原性物质,使得在溶液中的六价铬会被还原成更稳定的三价铬,所以样品量不宜过大。对此,对两种不同基质的样品进行了回收率对比试验。试验其它条件不变,称样量则各不相同,添加的六价铬含量为10ug/L,和提取温度试验一样,考虑到样品量不同造成的溶液基质不同,该试验也采用了标准加入法。结果见表4。 表4不同称样量的回收率情况 Table 4 The recoveries of different sample quantities 称样量 营养补剂 保健饮品 Healthy beverage 称样量 Nutritional powdered drink Sample 结果(pg/L) 回收率 Sample quantities 结果 (ug/L) 回收率 quantities Results Recoveries Results Recoveries 0.5g 10.6 106% 1.0mL 9.67 97% 1.0g 5.83 58% 2.0mL 9.50 95% 1.5g 3.75 38% 3.0mL 8.31 83% 2.0g 3.28 33% 4.0mL 7.58 76% 可以看到随着样品量的增大,回收率会下降,所以本方法规定了样品量的上限,即固体不超过0.5g,半固体和液体不超过1mL 或1g。 2.2仪器条件的选择 2. 2.1离子色谱条件的确定 原来我们在研究离子色谱法时,提供的阳离子色谱分离,使用的是戴安公司CS-5阳离子柱。但本法采用的色谱条件参考了Varian 公司测量水中六价铬的色谱分离条件。之所以没有采用戴安公司的条件,是因为相对来讲Hamilton 的色谱柱价格要低一些,而且采用的流动相是硝酸和氨水,其组成和状态非常适合ICP-MS 进样。六价铬出峰时间约为5min。 2.2.2质谱的干扰 在ICP-MS检测时,也存在着多原子离子的干扰。主要的干扰是Ar40C12干扰Cr52, C137016干扰Cr53,即样液中的含碳阴离子和氯离子会产生干扰峰。所幸在本研究的色谱条件下,含碳的阴离子和氯离子出峰早,,一般并不干扰六价铬15测。对于阳性样品可以通过对质量数52和53的丰度比来进行定性。图2是某降糖奶粉的色谱图。三价铬在碱性溶液以组成和价态各异的配位离子的形式存在,而不是以Cr3十阳离子的形式。而且在加入氯化镁时,氢氧化镁会和Cr(OH)3一起产生共沉淀。所以在本研究方法的条件下,不能定量检测三价铬,而且谱图上也不会有固定三价铬的峰,图2中峰5可能是某种三价铬配位离子的峰,因为质谱定性是属于铬化合物的。 ·--Cr52 图2某降糖奶粉的色谱图 Fig.2 The chromatograms of a sample of healthy milk powder 峰1、峰2可能是由于C造成的:峰3是C1的干扰:峰4是六价价的峰;峰5是未知峰。 2.3线性范围、检测限、回收率及精密度。 2.3.1线性和最低检出限实验 本方法标准曲线在0~10ug/L 范围内线性良好,相关系数>0.999。样品添加0.2ug/L Cr (VI)标准,连续测量11次,计算标准偏差,按3倍标准偏差计算得到方法的最低检测限,按10倍标准偏差计算得到方法的定量检测限。结果为最低检测限(LOD): 0.06ug/L,定量检测限(LOQ): 0.2ug/L。按固体样品0.5g 定容25ml计,样品中的定量探测限为10ug/kg,半固体和液体的定量探测限为5ug/kg。 2.3.2回收率和精密度试验 本研究对某降糖奶粉、某保健液和某营养冲剂三个样品进行了回收率和精密度试验。样品中六价均未检出。添加水平为0.2ug/L、1ug/L、5mg/L。试验平行数为6。结果见表5。 表5添加试验的精密度和回收率结果 Table 5 The precision and recovery results of fortified tests 添加水平 Fortified levels 降糖奶粉 保健液 营养冲剂 Healthy milk powder Nutritional powdered drink Healthy beverage 0.2ug/L 1pg/L 5ug/L 0.2ug/L lug/L 5ug/L 0.2ug/L lug/L Spg/L 0.175 0.876 4.96 0.185 0.987 4.59 0.197 1.01 5.39 0.201 0.843 4.78 0.203 0.856 4.84 0.193 0.834 5.29 3 0.209 0.902 4.75 0.176 0.912 4.89 0.182 0.901 5.33 4 0.188 0.938 4.59 0.196 0.882 4.80 0.175 0.863 5.21 5 0.197 0.812 4.88 0.198 0.963 4.84 0.204 0.903 5.08 6 0.187 0.941 4.69 0.187 0.92 4.95 0.178 0.914 5.29 平均值 0.19 0.89 4.78 0.19 0.92 4.81 0.19 0.90 5.26 平均回收率 0.96 0.89 0.95 0.95 0.92 0.96 0.94 0.90 1.05 变异系数 6.2% 5.8% 2.8% 5.2% 5.3% 2.6% 6.1% 6.6% 2.1% ( 参考文献 ) ( [1 ] 王夔主编.生命科学中的微量元素(第二版)[M].北京: 中 国国量出版社,1996: : 1 172 ) ( [2]吴永宁主编.现代食品安全科学[M].北京:化学工业出版社,2003:1 9 9 ) ( [3]生活饮用水卫生规范:生活饮用水水质卫生规范[S], , 卫 监发[2001]16 1 号.北京: 卫生部卫生法制与监督司编印, 2001.6: 3 -8. ) ( [4]杨惠芬等,食品卫生理化检验标准手册[M].北京:中国标准出版社,1997年:149. ) ( [5]宋全厚、胡正芝等,恒温平台石墨炉原子吸收光谱法分别测定食品中总铬和六价铬[J].食品与发酵工业,1990.4: 1. ) ( [6] S oares M E , B a stos M L , and Ferreira M A, D e termination of Total Chromium and Chr o mium(VI) in Animal Feeds by E lectrothermal A tomic A b sorption Spectrometry[J]. J. Anal. At. S p ectrom.,1994,9:269. ) ( [7] Lameiras J, Soares M E , Ba stos M L,and Ferreira M, Quantific a t ion of t ot a l chromium and h exavalentchromium in U H T milk b y ETAAS [J]. J. Analyst,1998,123 : 2091. ) ( [8] Soares M E , B astos M L,and Ferreira M A , S e lectiv e Determination of Chromium(VI) in Pow d ered Milk Infant Formulas by E lectrothermal Atomic A b sorption Spectrometry after Ion Exchange[J]. J. AOC.Int.,2000,83(1):220. ) ( [9] 周玉芝、邵光勺、牟世芬等,铬(Ⅲ)和 铬 (Ⅵ)的离子色谱分析[J].环境化学,1996 , 15(5):446 ) ( [10]杨振宇、郭德华,离子色谱法测定食品中的六价铬 [J].分析试验室,2005,24增刊:148 ) PerkinElmer, Inc. 大中华区总部地址:上海张江高科园区李冰路67弄4号邮编:201203电话:(021)38769510传真:(021)38791316 www.perkinelmer.com.cn ( C2 009 P e r k in E lm er, I nc. 保 留 所 有权利。Pe rkin E lm e r 徽标和外观设计是Per k in Elmer的 注 册商标。 文 中提 及的其它非Per kinElmer及 其 子公 司所有 的其它商 标 均为其 各 自所有者的财 产 。 ) PerkinElmer保留随时更改此文档的权利,恕不另行通知。对于编辑、图片或排版错误概不承担任何责任。 ICPMS_2010_016_CN
确定




还剩5页未读,是否继续阅读?
珀金埃尔默企业管理(上海)有限公司为您提供《保健食品中6价铬检测方案 》,该方案主要用于其他特殊膳食产品中重金属检测,参考标准--,《保健食品中6价铬检测方案 》用到的仪器有等离子质谱仪PerkinElmer
推荐专场
相关方案
更多
该厂商其他方案
更多















