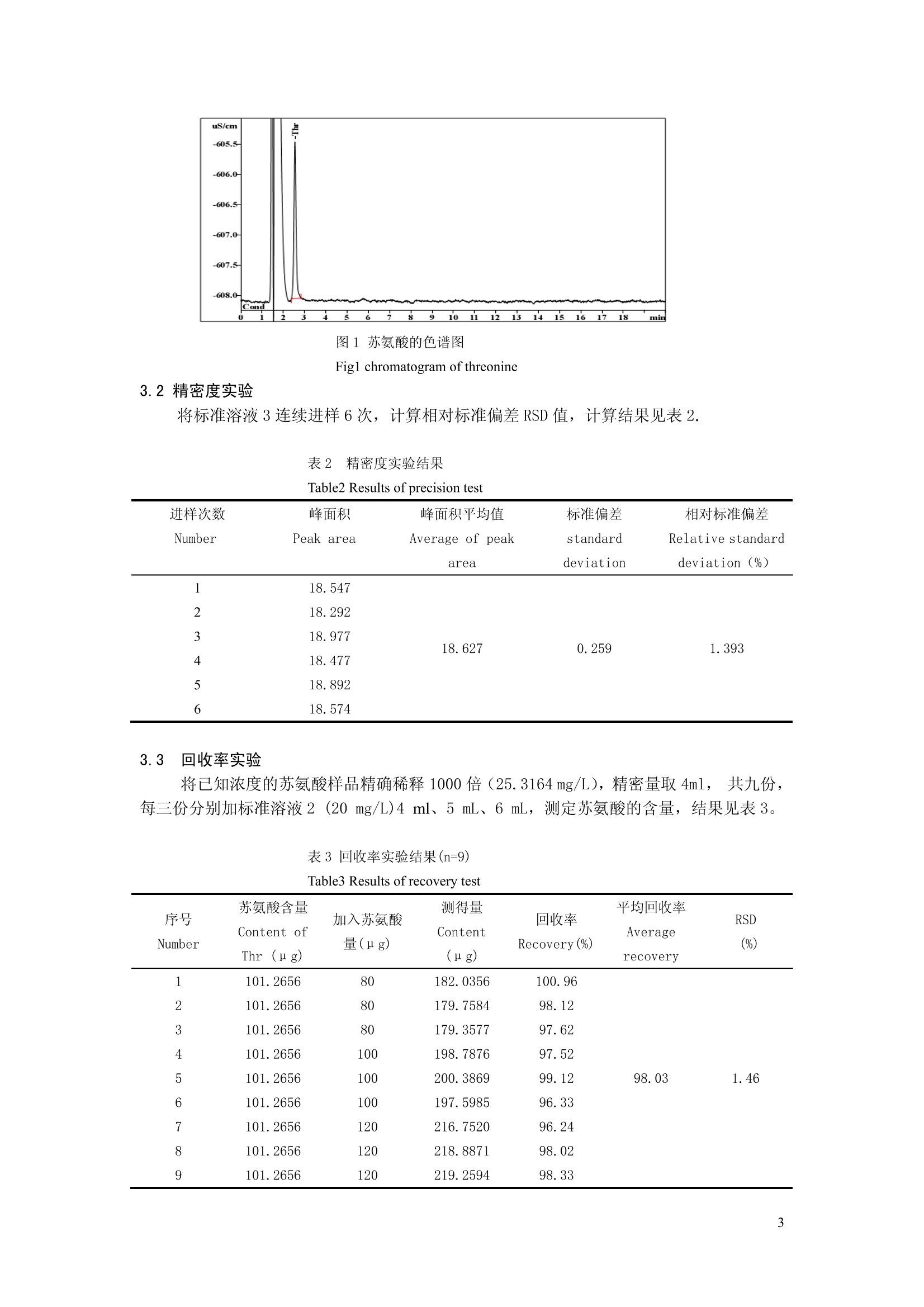
本文通过瑞士万通离子色谱仪,建立了离子色谱-电导检测器直接进样测定苏氨酸的方法。结果 最小检测限为1.8 mg/L;苏氨酸与其它阳离子同时测定时互不干扰;非离子态物质对苏氨酸的测定没有影响。离子色谱-电导检测器测定方法简单、准确,可用于苏氨酸的定量分析。
方案详情

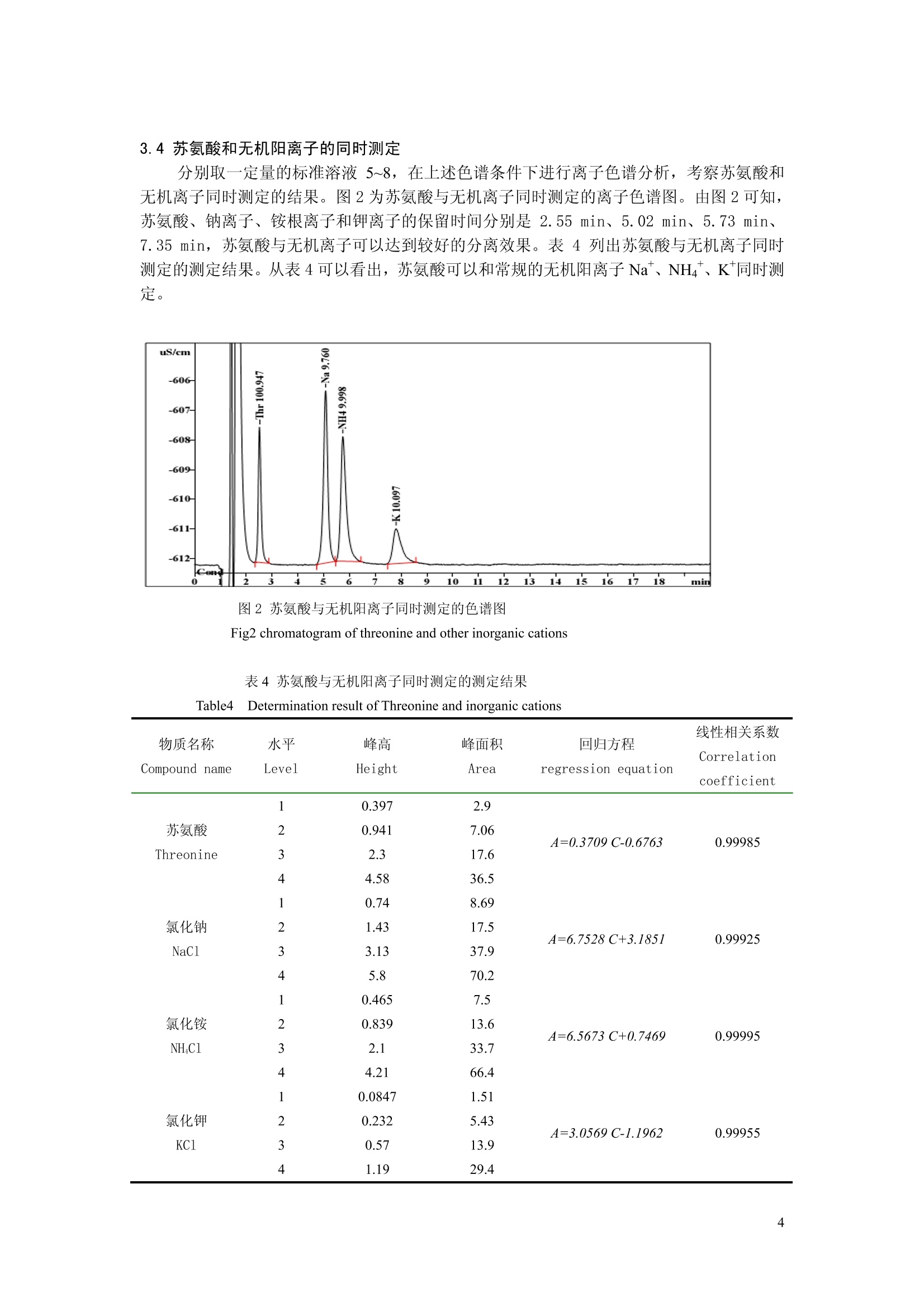
离子色谱-电导检测法测定苏氨酸 刘春梅12,丛威*2,张栩 (1.北京化工大学生命科学与技术学院,北京100029;2.中国科学院过程工程研究所生化工程国家重点实验室,北京100190) 摘要 建立了离子色谱-电导检测器直接进样测定苏氨酸的方法。淋洗液为4.0 mmol/L的酒石酸和1.0mmol/L 的2,6-吡啶二羧酸,流速为1.0 mL/min, 检测器为电导检测器。结果表明,苏氨酸在10~100 mg/L的线性范围内线性良好,回归方程为:A=0.3649 C-0.3315, R²=0.9998,精密度实验 RSD = 1.393%,最小检测限为 1.8mg/L;苏氨酸与其它阳离子同时测定时互不干扰;非离子态物质对苏氨酸的测定没有影响。离子色谱-电导检测器测定方法简单、准确,可用于苏氨酸的定量分析。 关键词 离子色谱,电导检测器,苏氨酸 Determination of Threonine by Ion Chromatographywith Conductivity Detector Liu Chun-Mei, Cong Wei, Zhang Xu' (1.College of Life Science and Technology, Beijing University of Chemical and Technology,Beijing 100029)2.State Key Lab of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing100190) Abstract A new method was established for determination of threonine( Thr). Ion chromatography withconductivity detector was adopted with tartaric acid ( 4.0mmol/L )and 2,6- Pyridinedicarboxylate (1.0 mmol/L) asthe eluent.the flow rate was 1.0 mL/min. The detection was performed by a conductivity detection mode. Theregression equation with Thr was A = 0.3649 C-0.3315.The calibnation curves were linear with a range of 10 ~100 mg/L, R’= 0.9998. Precision test RSD was 1.393%.The coinstantaneous determination of Thr and othercations were achieved; non-iron component has no influence with the detemination of threonine. This method issimple,accurate and suitable for the determination of Thr. Key words: Ion Chromatography(IC); Conductivity Detector ; Threonine( Thr) 15引言 苏氨酸是人与动物体内所内需的一种氨基酸,化学名为:L-a-氨基-β-羟基丁酸(L-a-Amino-B-hydroxybutyric acid);分子式: C4HgNO3, 分子量为119.12,其中氮含率为11.76%。分子中包含一个羧基和一个羟基,其离解常数分别为: pKcoom=2.15, pKNH2=9.12,等电点 pI=5.64。苏氨酸具有恢复体力,促进生长发育的效果,自身不能合成,必须从食物中摄取。在人和动物所需的8种限制性氨基酸中,苏氨酸是仅次于蛋氨酸、赖氨酸、色氨酸的第4种氨基酸。在大多数植物蛋白饲料中,苏氨酸是第2或第3限制性氨基酸,是重要的营养强化剂2。另外,对抗溃疡、防辐射、镇静等有较好效果。 目前苏氨酸的测定方法主要有高效液相色谱法[3.4]、氨基酸分析仪测定法I5.6]、离子色 ( 中科院重点方向性项目 (KSCX2-YW-G-020);国家重点基础研究计划(973)资助项目(2003CB716007) ) ( *通讯作者:丛 威 , Tel: 010-8 2 627060, E-ma i l: wei c ong@home.ipe.ac.cn ) ( 作者简介:刘春梅(1983-),女(汉族),山东济宁人,硕士研究生,在读,从事氨基酸生产的研究。 ) 谱-积分安培检测法、荷移分光光度法法]和凯氏定氮法。液相色谱法、离子色谱-积分安培检测法和氨基酸分析仪测定法是最可靠的方法,但是所用仪器价格昂贵,且样品前处理复杂,氨基酸衍生化时间长,不能满足大量样品分析的要求;荷移分光光度法不需要昂贵的仪器,但是其精密度相对较低;凯氏定氮法操作步骤复杂,试剂消耗多,测定周期长,不适用于中控分析。离子色谱-电导检测法操作简单,无需麻烦的预处理或者柱后处理,可以快速、高效的对多种离子进行检测和分离。实验利用离子色谱-电导检测法测定苏氨酸,实现了苏氨酸的快速测定,以及苏氨酸和其它无机离子的同时测定。 2实验部分 2.1仪器与试剂 761离子色谱仪(瑞士万通中国有限公司),包括串联双活塞泵,六通进样阀, C2-150阳离子交换柱、电导检测器;酒石酸(优级纯,中国,国药集团化学试剂有限公司),吡吡-2,6-二羧酸(优级纯, Alfa Aesar),苏氨酸、氯化钠、氯化铵、氯化钾、葡萄糖(均购于北京欣经科生物技术有限公司);色谱用超纯水。 2.2试验方法 2.2.1色谱条件 色谱柱:C2-150 离子交换柱;淋洗液:4.0 mmol/L酒石酸,11.0 mmol/L吡啶二羧酸;流速:1.0 ml/min;进样量:20pL;等度洗脱。 2.2.2标准溶液的制备 精密称取苏氨酸、氯化钠、氯化铵、氯化钾、葡萄糖,配制1 g/L的苏氨酸溶液、钠离子溶液、铵根离子溶液、钾离子、葡萄糖溶液,梯度稀释得到标准溶液,如表1所示。 表1标准溶液中的物质浓度 Table 1 concentration in standard solutions 序号 苏氨酸浓度 铵根离子浓度 钠离子浓度 钾离子浓度 葡萄糖浓度 Number CThr (mg/L) CNH4 +((mg/L) CNa (mg/L) Ck (mg/L) CG (mg/L) 1 10 0 0 0 0 2 20 0 0 0 0 50 0 0 0 0 4 100 0 0 0 0 5 10 0 6 20 2 2 0 7 50 5 5 5 0 8 100 10 10 10 0 50 0 0 0 50 3结果与讨论 3.1标准曲线的制备 分别取一定量的标准溶液1~4,在2.2色谱条件下进行离子色谱分析,以峰面积(A)对进样浓度(C,mg/L)做线性回归,得到线性方程和相关系数,线性方程为:A=0.3649C-0.3315,R=0.9998,线性范围在10 mg/L~100 mg/L。在选定的色谱条件下,以噪音的3倍峰高所对应的苏氨酸含量为最低检测限,计算出最小检测限为 1.8mg/L。 图1苏氨酸的色谱图 Figl chromatogram of threonine 3.2精密度实验 将标准溶液3连续进样6次,计算相对标准偏差 RSD 值,计算结果见表 2. 表2精密度实验结果 进样次数 峰面积 峰面积平均值 标准偏差 相对标准偏差 Number Peak area Average of peak standard Relative standard area deviation deviation(%) 1 18.547 2 18.292 3 4 18.977 18.477 18.627 0.259 1.393 5 18.892 6 18.574 3.3 回收率实验 将已知浓度的苏氨酸样品精确稀释1000倍(25.3164mg/L), 精密量取4ml,共九份,每三份分别加标准溶液2(20 mg/L)4 ml、5 mL、6mL,测定苏氨酸的含量,结果见表3. 表3回收率实验结果(n=9) Table3 Results of recovery test 序号 苏氨酸含量 加入苏氨酸 测得量 回收率 平均回收率 RSD Content of Content Average Number 量(ug) Recovery(%) (%) Thr (ng) (ug) recovery 1 101.2656 80 182.0356 100.96 2 101.2656 80 179.7584 98.12 3 101.2656 80 179.3577 97.62 4 101.2656 100 198.7876 97.52 5 101.2656 100 200.3869 99.12 98.03 1.46 6 101.2656 100 197.5985 96.33 7 101.2656 120 216.7520 96.24 8 101.2656 120 218.8871 98.02 9 101.2656 120 219.2594 98.33 3.4苏氨酸和无机阳离子的同时测定 分别取一定量的标准溶液5~8,在上述色谱条件下进行离子色谱分析,考察苏氨酸和无机离子同时测定的结果。图2为苏氨酸与无机离子同时测定的离子色谱图。由图2可知,苏氨酸、钠离子、铵根离子和钾离子的保留时间分别是 2.55 min、5.02 min、5.73 min、7.35 min, 苏氨酸与无机离子可以达到较好的分离效果。表4列出苏氨酸与无机离子同时测定的测定结果。从表4可以看出,苏氨酸可以和常规的无机阳离子 Na、NH4*、K*同时测定。 图2苏氨酸与无机阳离子同时测定的色谱图 Fig2 chromatogram of threonine and other inorganic cations 表4苏氨酸与无机阳离子同时测定的测定结果 Table4Determination result of Threonine and inorganic cations 物质名称 水平 峰高 峰面积 回归方程 线性相关系数 Correlation Compound name Level Height Area regression equation coefficient 0.397 2.9 A=0.3709 C-0.6763 0.99985 苏氨酸 0.941 7.06 Threonine 2.3 17.6 4 4.58 36.5 A=6.7528 C+3.1851 0.99925 0.74 8.69 氯化钠 1.43 17.5 NaCl 3.13 37.9 4 5.8 70.2 A=6.5673 C+0.7469 0.99995 0.465 7.5 氯化铵 0.839 13.6 NHC1 2.1 33.7 4 4.21 66.4 A=3.0569 C-1.1962 0.99955 0.0847 1.51 氯化钾 0.232 5.43 KC1 0.57 13.9 4 1.19 29.4 3.5 非离子态物质对苏氨酸测定的影响 分别取一定量的标准溶液3和标准溶液9,在上述色谱条件下进行离子色谱分析,考察葡萄糖对苏氨酸测定的影响,结果显示加葡萄糖和不加葡萄糖的标准溶液的测定值分别是49.961mg/L 和 49.501mg/L。表明非离子态物质对苏氨酸的测定没有影响。 4结论 实验介绍了测定苏氨酸的一种简洁、准确的方法。苏氨酸不必经过衍生化,直接上柱分析,简化了操作步骤,缩短了检测时间;实验使用C 2150 普通阳离子色谱分析柱、电导检测器,可以实现苏氨酸酸和无机离子的同时测定;测定不受葡萄糖等非离子型有机物的干扰。该方法在10~100 mg/L 范围内线性较好,回收率为98.03%,RSD= 1.46%。方法简便快速,结果可靠,耗时短,可满足大量样品分析的要求,提高了工作效率;同时实现了苏氨酸和其它无机离子的同时测定,并且测定不受非离子态物质的干扰,对其它氨基酸的测定也有一定的指导意义。 ( 参考文献: ) ( 常尊学,王玉林.紫外线诱变原生质体选育苏氨酸高产菌株[].微生物学通报,1991, 18(6):332~336 ) ( 江 冯志彬,徐庆阳,陈宁.代谢副产物对L一 苏 氨 酸 发酵的影响及应对措施[J].食品 发 酵与工业,2007, 33(6) : 32~35 ) ( 乔满辉,孙凤卿,康辉,等. HPLC法检测发酵液中苏氨酸含量[J].齐鲁药事 , 2007,26(7 ) :40 6 ~407 ) ( 刘保东, 王 维.葡萄酒中游离氨基酸的高效液相色谱法测定[].分析测试学报,1997, 16(6):5~7 ) ( 万丹晶,陈妙芬,翟咏虹.用 HPLC 法和氨基酸分析仪测定多维氨基酸片中18种氨基酸[]. 药 学服 务与研究,2006,6(3):212~214 ) ( 孙玮,袁发焕.血 清 游离羟氨酸的快速检测[J].分析测试学报,2002,21(3):80~82 ) ( 返 凌艳艳,朱岩,施青红,等.离子色谱--积分安培检测法测定气溶胶中的氨基酸[].分析化学,2004, 32(9),1267 ) ( 李省云,杨毅萍,王朝风.苏氨 酸 的荷移分光光度法测定[J].太原师范学院学报,2006,5(1):89~91 ) ( 吴飞燕,贾之慎,朱岩.离子色谱电导检测法测定酒中的有机酸和无机阴离子[J].浙江大学学报,2006, 33(3):312~315 )
确定



还剩3页未读,是否继续阅读?
瑞士万通中国有限公司为您提供《离子色谱电导检测法测定苏氨酸》,该方案主要用于其他中--检测,参考标准--,《离子色谱电导检测法测定苏氨酸》用到的仪器有瑞士万通Metrohm 燃烧炉-离子色谱联用系统
推荐专场
相关方案
更多