
方案详情
文
利用化学偶联法将末端修饰氨基的寡聚核苷酸固定在表面修饰有羧基化碳纳米管(CNTs-COOH)的金电极表面,制备新型核酸探针, 可以特异性结合目标单链寡聚核苷酸. 以阿霉素作为嵌合指示剂, 利用示差脉冲法测定杂交的结果. 经过实验条件的优化, 测定DNA 浓度在1.0×10-6~1.0×10-9 mol/L 呈良好的线性关系. 检测限为: 2.54×10-10mol/L. 碳纳米管特有的纳米结构对检测结果的放大作用, 提高了该传感器的检测限和灵敏度
方案详情

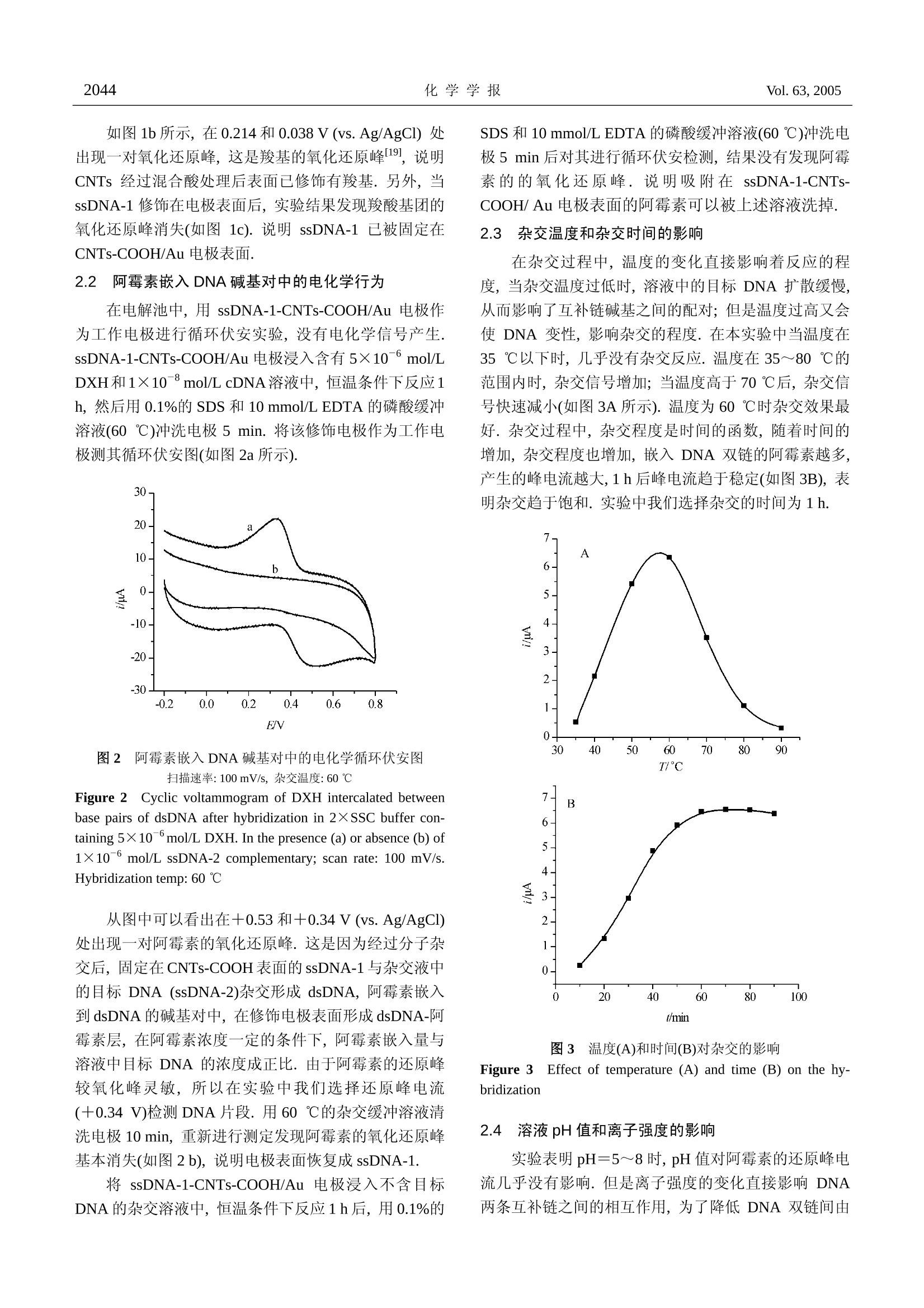
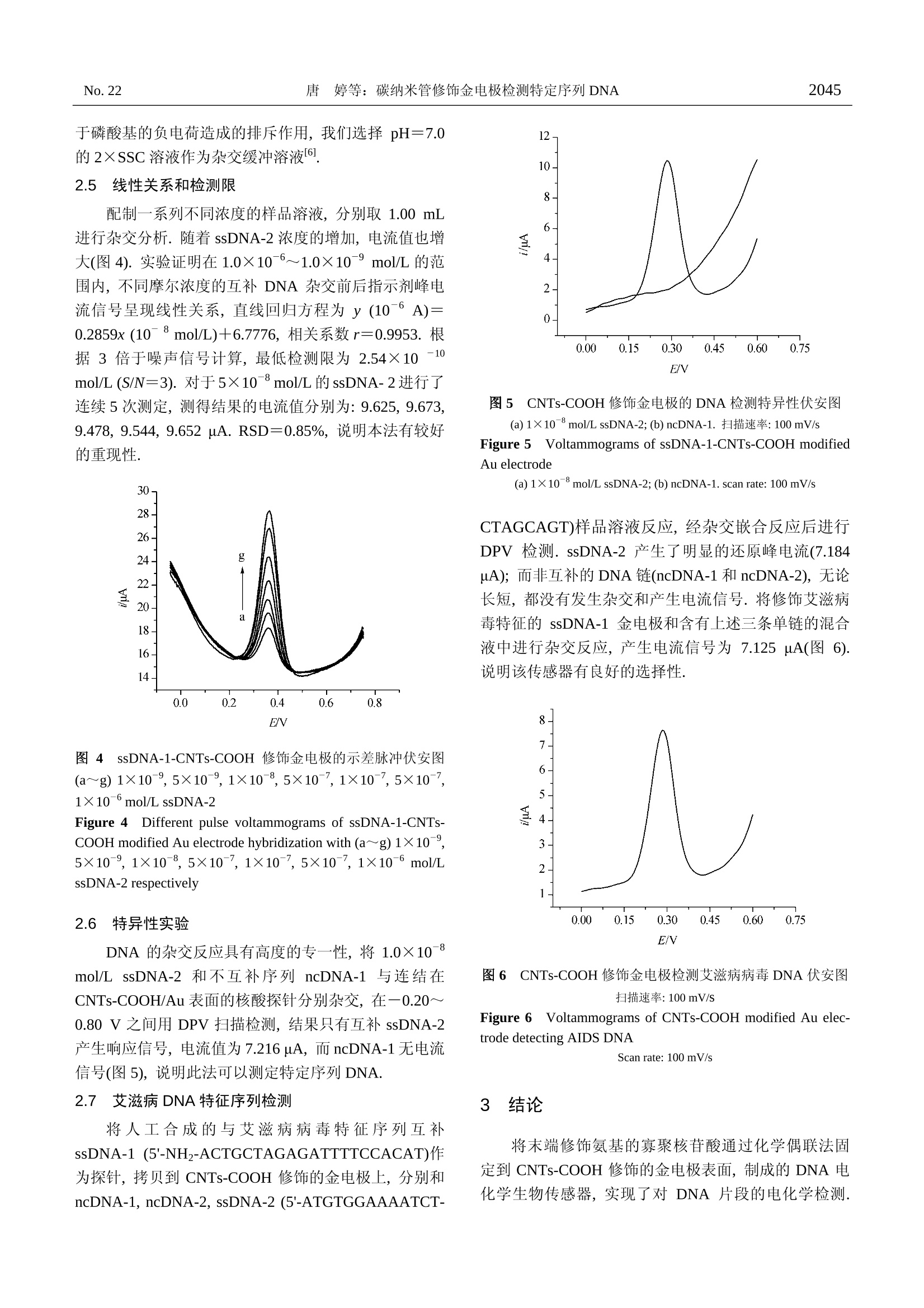
化学学报ACTA CHIMICA SINICA2005年第63卷第22期,2042~2046Vol. 63,2005No. 22,2042~2046 2043唐 婷等:碳纳米管修饰金电极检测特定序列 DNANo. 22 碳纳米管修饰金电电检测特定序列 DNA 唐 婷*,a,b 彭图治 时巧翠“ (“浙江大学化学系 西溪校区 杭州310028) (‘杭州师范学院医药卫生管理学院 杭州310036) 摘要 利用化学偶联法将末端修饰氨基的寡聚核苷酸固定在表面修饰有羧基化碳纳米管(CNTs-COOH)的金电极表面,制备新型核酸探针,可以特异性结合目标单链寡聚核苷酸.以阿霉素作为嵌合指示剂,利用示差脉冲法测定杂交的结果.经过实验条件的优化,测定 DNA 浓度在1.0×10-6~1.0×10°mol/L 呈良好的线性关系.检测限为:2.54×10-10mol/L.碳纳米管特有的纳米结构对检测结果的放大作用,提高了该传感器的检测限和灵敏度. 关键词 羧基化碳纳米管;DNA 杂交;阿霉素;示差脉冲伏安法 Sequence Determination of DNA Pieces Using Carbon NanotubeModified Gold Eectrodes TANG,Tin1gg*..b PENG.Tu-Zhi SHI, Qiao-Cui" (“ Department ofChemistry, Xixi Campus,Zhejiang University, Hangzhou 310028)(Medicine and Health Manage College of Hangzhou Teachers College, Hangzhou 310036) Abstract A novel electrochemical biosensor was reported for the detection of nucleic acid hybridizationand sequence-specific DNAs. A synthesized single stranded DNA (ssDNA-1) was covalently immobilizedon gold electrodes, which had been modified by carboxylic group-functionalized carbon nanotubes activatedusing N-ethyl-N'-(3-dimethylaminopropyl)carbodiimide(EDC) and N-hydroxysuccinimidobiotin (NHS).Differential pulse voltammetry was used to detect DNA with an electroactive indicator of adriamycin whichcould bind to double stranded DNA. The linear range for the determination of target DNA is from 1.0×10°to 1.0×10mol/L, and the detection limit is found to be 2.54×10-10 mol/L. Keywordscarboxylic carbon nanotube; DNA hybridization; adriamycin; differential pules voltammetry 作为生命遗传物质载体, DNA 的研究是生命科学研究中的重要方面.生物样品中特定 DNA 序列的测定在生物医学领域具有重要意义,其结果可用以对遗传性和传染性疾病进行鉴别和检测. DNA生物传感器是进行DNA 结构分析和检测的重要手段.电化学DNA传感器是近年来迅速发展的新型生物传感器[2~4].这类传感器具有选择性好、测试费用低及联机化的优点,又有电分析化学的不破坏测试体系、不受颜色影响和简便操作等特点.鞠秋先等1对电化学 DNA 传感器的原理及应用 ( *E-mail: tin a _ tangzhu@163.com ) ( R eceived March 23, 2 0 05; r e vised July 2, 2005; a ccepted August 2,2005. ) ( 国家自然科学基金(No.20275034)资助项目. ) 曾作出总结,并评述了发展趋势.电化学 DNA 传感器的灵敏度在很大程度上直接依赖于杂交指示剂对dsDNA 的选择性,所以选择合适的杂交指示剂对提高电化学 DNA 传感器的性能是至关重要的.电活性小分子阿霉素被发现是一种很好的 DNA 杂交指示剂16.7. 碳纳米管独特的结构和优异的性质受到研究人员的极大关注.要使碳纳米管得到应用必须对碳纳米管进行化学功能化,使其能够与其他分子或表面相连[8.9.用化学功能化的碳纳米管对电极表面进行修饰时,可将材 料本身的物化特性引入电极界面,同时也会拥有纳米材料的大比表面积、粒子表面带有较多的功能基团等特性,从而对某些物质的电化学行为产生特有的催化效应.当把羧基化的 CNTs 涂膜在玻碳电极上10,11],制成的修饰电极对多巴胺,抗坏血酸等生物分子的电化学氧化具有电催化作用.将 CNTs 修饰的电极制成生物传感器的研究发现, CNTs 可以促进酶与电极之间的电子转移112~151.CNTs 应用于 DNA 生物传感器的研究的报道较少[16,17]. 本文将羧基化的 CNTs 修饰到金电极表面,利用偶联试剂 EDC 和NHS 在 CNTs 表面固定寡聚核苷酸(其5'端修饰了氨基)作为探针,用于检测与其碱基序列互补的 DNA. 以阿霉素作为嵌合剂,实现了对特定序列DNA的检测.由于CNTs特有的纳米结构对检测结果的放大作用,提高了检测的选择性和灵敏度 实验部分 1.1 仪器与试剂 CHI660A 电化学工作站(美国 CHI 公司); CNTs-COOH 修饰的金电极为工作电极, Ag-AgCl 电极(1.0mol/LKCl)为参比电极,铂丝为对电极.单链DNA探针(ssDNA-1,5'-XATGGGTATTCAACATTTCCG, X=一NHz)、其互补目标 DNA(ssDNA-2,5'-CGGAAATGTTGAATACC)及两条不互补 DNA(ncDNA1, 5'-GACGTCAGC 和 ncDNA2, 5'-GGACGTTTAAGCTAGGCCAAATGCAGGTTTACGTA)(浙江大学生物研究所),偶联试剂盐酸1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)和N-羟基琥珀珀亚胺(NHS)为 Sigma 产品,阿霉素(DXH)为海正药业产品,碳纳米管 CNTs (浙江大学材料系)管内径4~8 nm,外径10~30 nm.0.1 mol/L 的2×SSC 缓冲溶液 (3.0 mol/L 氯化钠+0.3 mol/L 柠檬酸钠), 0.1 mol/L磷酸盐缓冲液(pH 7.0), TE 缓冲溶液(10mmol/L Tris-HC1+1 mmol/L EDTA) 0.1% 的SDS溶液.其它试剂均为分析纯.实验用水均为二次蒸馏水. 1.2 羧基化 CNTs(CNTs-COOH)的制备 取30mg 已经纯化过的 CNTs 加入30mL3:1的HzSO4 (98%) 和 HNO(16 mol/L)的混合物.超声4h,加水稀释后,过滤.用蒸馏水洗至中性,然后100℃下烘干[18],即得到实验需要的羧基化 CNTs (CNTs-COOH). 1.3 CNTs-COOH修饰电极的制备 将内径为2 mm 的金电极用1 um氧化铝粉抛光,在急速水流下冲洗除去抛光粉.依次在无水乙醇、丙酮、二次蒸馏水中超声5 min后,晾干.)取 1mg CNTs-COOH于2mL二次蒸馏水中超声5 min, 取 10 uLCNTs 的混合液滴于金电极表面,50℃下真空干燥. 1.4 CNTs-COOH-DNA 探针的制备 在CNTs-COOH/Au 电极表面滴加 10 pL 含有3 mg/mL EDC 和5 mg/mL 的 NHS 的 0.1 mol/L 的磷酸缓冲液,室温下晾干,以活化 CNTs 表面的羧基.然后将10 uL1×10mol/LssDNA-1的 TE 溶液滴在电极表面,抽真空干燥, ssDNA-1即被拷贝在CNTs-COOH/Au 电极表面.修饰好的电极置于4℃下保存. 1.5CNTs-COOH-DNA探针与目标单链 DNA的作用 在反应池中加入2mL 含有一定浓度的目标单链DNA 和5×10 mol/L 阿霉素的 2×SSC 缓冲溶液(pH=7.0),将 ssDNA-1修饰电极插入到上述溶液中,恒温条件下杂交1h,并均匀搅拌,然后用0.1%的 SDS 和10mmol/L EDTA 的磷酸缓冲溶液(60℃)冲洗电极5 min,重复3次,除去未杂交的目标单链 DNA. 1.6 电化学检测 将上述杂交好的电极作为工作电极, Ag/AgCl 电极为参比电极,铂丝为对电极,以 pH 7.0的磷酸盐缓冲溶液为测试底液,用示差脉冲伏安法(DPV)和循环伏安法(CV)检测,扫描范围:-0.20~0.80 V. 结果与讨论 2.1 CNTs-COOH 修饰电极的电化学行为 用 CNTs-COOH/Au 电极在0.1 mol/L 磷酸盐缓冲液.(pH7.0)的测试底液中进行循环伏安实验. 图1 电极在0.1 mol/L磷酸盐缓冲液(pH7.0)中的循环伏安图 ( (a) 未处理的金电极;(b) CNTs-COOH 修饰的金电极;(c) EDC/NHS 活化的 CNTs-COOH 修饰金电极(扫 描 速率:100mV/s) ) ( Figure 1 C yclic voltammograms for different el e ctrodes in 0.1mol/L phosphate b u ffer solution (pH 7.0). ) ( (a) bare gold e lectrode; (b) C NTs-COOH-modified gol d electrode; (c) CNTs-COOH-modified gold electrode treated with 1× 1 0mol/L ssDNA-1 with EDC/NHS activated (scan rate: 100 mV/s) ) 如图1b所示,在0.214和0.038 V (vs. Ag/AgCl)处出现见-对氧化还原峰,这是羧基的氧化还原峰119,说明CNTs 经过混合酸处理后表面已修饰有羧基.另外,当ssDNA-1修饰在电极表面后,实验结果发现羧酸基团的氧化还原峰消失(如图 1c). 说明 ssDNA-1 已被固定在CNTs-COOH/Au 电极表面. 2.2 阿霉素嵌入DNA碱基对中的电化学行为 在电解池中,用 ssDNA-1-CNTs-COOH/Au 电极作为工作电极进行循环伏安实验,没有电化学信号产生.ssDNA-1-CNTs-COOH/Au 电极浸入含有5×10mol/LDXH和1×10-mol/L cDNA溶液中,恒温条件下反应1h,然后用0.1%的 SDS 和 10 mmol/L EDTA 的磷酸缓冲溶液(60℃)冲洗电极 5 min. 将该修饰电极作为工作电极测其循环伏安图(如图2a所示). 图2 阿霉素嵌入 DNA 碱基对中的电化学循环伏安图扫描速率:100mV/s, 杂交温度:60℃ Figure 22Cyclic voltammogram of DXH intercalated betweenbase pairs of dsDNA after hybridization in 2×SSC buffer con-taining 5×10mol/L DXH. In the presence (a) or absence (b) of1×10 mol/LssDNA-2 complementary; scan rate: 100 mV/s.Hybridization temp:60℃ 从图中可以看出在+0.53和+0.34V(vs.Ag/AgCl)处出现一对阿霉素的氧化还原峰.这是因为经过分子杂交后,固定在 CNTs-COOH 表面的ssDNA-1与杂交液中的目标 DNA (ssDNA-2)杂交形成 dsDNA,阿霉素嵌入到dsDNA的碱基对中,在修饰电极表面形成 dsDNA-阿霉素层,在阿霉素浓度一定的条件下,阿霉素嵌入量与溶液中目标 DNA 的浓度成正比.由于阿霉素的还原峰较氧化峰灵敏,所以在实验中我们选择还原峰电流(+0.34V)检测 DNA片段.用60℃的杂交缓冲溶液清洗电极10 min, 重新进行测定发现阿霉素的氧化还原峰基本消失(如图2b),说明电极表面恢复成 ssDNA-1. 将 ssDNA-1-CNTs-COOH/Au 电极浸入不含目标DNA的杂交溶液中,恒温条件下反应1h后,用0.1%的 SDS 和10 mmol/L EDTA 的磷酸缓冲溶液(60℃)冲洗电极5 min 后对其进行循环伏安检测,结果没有发现阿霉素的的氧化还原峰.说明吸附在 ssDNA-1-CNTs-COOH/ Au 电极表面的阿霉素可以被上述溶液洗掉. 2.3 杂交温度和杂交时间的影响 在杂交过程中,温度的变化直接影响着反应的程度,当杂交温度过低时,溶液中的目标 DNA 扩散缓慢,从而影响了互补链碱基之间的配对;但是温度过高又会使 DNA 变性,影响杂交的程度.在本实验中当温度在35℃以下时,几乎没有杂交反应.温度在35~80℃的范围内时,杂交信号增加;当温度高于70℃后,杂交信号快速减小(如图3A 所示).温度为60℃时杂交效果最好.杂交过程中,杂交程度是时间的函数,随着时间的增加,杂交程度也增加,嵌入DNA 双链的阿霉素越多,产生的峰电流越大,1h后峰电流趋于稳定(如图3B),表明杂交趋于饱和.实验中我们选择杂交的时间为1h. 图3 温度(A)和时间(B)对杂交的影响 Figure 3 Effect of temperature (A) and time (B) on the hy-bridization 2.4 溶液 pH值和离子强度的影响 实验表明pH=5~8时, pH值对阿霉素的还原峰电流几乎没有影响.但是离子强度的变化直接影响 DNA两条互补链之间的相互作用,为了降低 DNA 双链间由 于磷酸基的负电荷造成的排斥作用,我们选择 pH=7.0的2×SSC 溶液作为杂交缓冲溶液. 2.5 线性关系和检测限 配制一系列不同浓度的样品溶液,分别取 1.00 mL进行杂交分析.随着 ssDNA-2浓度的增加,电流值也增大(图4).实验证明在1.0×10-6~1.0×10-° mol/L的范围内,不同摩尔浓度的互补 DNA 杂交前后指示剂峰电流信号呈现线性关系,直线回归方程为 y (10-6A)=0.2859x (108 mol/L)+6.7776,相关系数r=0.9953. 根据3倍于噪声信号计算,最低检测限为 2.54×10-10mol/L (S/N=3). 对于5×10-8mol/L 的ssDNA-2进行了连续5次测定,测得结果的电流值分别为:9.625,9.673,9.478,9.544, 9.652 uA. RSD=0.85%,说明本法有较好的重现性. 图4 ssDNA-1-CNTs-COOH 修饰金电极的示差脉冲伏安图(a~g) 1×10-9,5×109,1×10-8,5×10-7,1×10-7,5×10-7,1×10°mol/L ssDNA-2 Figure 4 Different pulse voltammograms of ssDNA-1-CNTs-COOH modified Au electrode hybridization with (a~g)1×10,5×10,1×10-8,5×10-7,1×10-7,5×10-7,1×10mol/LssDNA-2 respectively 2.6 特异性实验 DNA 的杂交反应具有高度的专一性,将1.0×10mol/L ssDNA-2和不互补序列 ncDNA-1与连结在CNTs-COOH/Au 表面的核酸探针分别杂交,在一0.20~0.80V之间用 DPV 扫描检测,结果只有互补 ssDNA-2产生响应信号,电流值为 7.216 uA, 而ncDNA-1无电流信号(图5),说明此法可以测定特定序列 DNA. 2.7 艾滋病 DNA 特征序列检测 将人工合成的与艾滋病病毒特征序列互补ssDNA-1(5'-NH2-ACTGCTAGAGATTTTCCACAT)作为探针,拷贝到 CNTs-COOH 修饰的金电极上,分别和ncDNA-1, ncDNA-2, ssDNA-2(5'-ATGTGGAAAATCT- 图5 CNTs-COOH 修饰金电极的 DNA 检测特异性伏安图(a)1×10-mol/L ssDNA-2;(b) ncDNA-1. 扫描速率:100 mV/s Figure 5 Voltammograms of ssDNA-1-CNTs-COOH modifiedAu electrode (a) 1×10mol/L ssDNA-2;(b)ncDNA-1. scan rate: 100 mV/s CTAGCAGT)样品溶液反应,经杂交嵌合反应后进行DPV 检测. ssDNA-2产生了明显的还原峰电流(7.184uA);而非互补的 DNA 链(ncDNA-1和ncDNA-2),无论长短,都没有发生杂交和产生电流信号.将修饰艾滋病毒特征的 ssDNA-1金电和和含有上述三条单链的混合液中进行杂交反应,产生电流信号为7.125pA(图6).说明该传感器有良好的选择性. 图6 CNTs-COOH 修饰金电极检测艾滋病病毒DNA 伏安图扫描速率:100 mV/s Figure 6 Voltammograms of CNTs-COOH modified Au elec-trode detecting AIDS DNAScan rate: 100 mV/s 3 结论 将末端修饰氨基的寡聚核苷酸通过化学偶联法固定到 CNTs-COOH 修饰的金电极表面,制成的 DNA 电化学生物传感器,实现了对 DNA 片段的电化学检测. 该DNA生物传感器因为羧基化 CNTs的引入,所以具有高的灵敏度和选择性.碳纳米管的特殊纳米结构使该DNA 生物传感器在集成和微型化方面具有广阔的发展前景. ( References ) ( 1 Pang, D.-W.; Yan, W. Chem.J. Chin. Univ. 2 001, 22, 389 (inChinese). ) ( (庞代文,颜蔚,高等学校化学学报,2001,22,389.) ) ( 2 Xu, C.; Cai, H.; He, P. G.; Fang, Y. Z. J. Anal . Chem. 2000, 367,593. ) ( 3 Peng, T .Z.; C heng, Q. Acta Chim. Sinica 2001, 59, 1125 (in Chinese). ) ( (彭图治,程琼,化学学报,2001,59,1125.) ) ( 4 Zhu, N. N.; Zhang, A . P.; H e, P . G.; Fang, Y . Z. A c ta Chim.Sinica 2003,61,1682 (in Chinese). (祝宁宁,张爱平,何品刚,方 禹 之,化学学报,2003,61, 1682.) ) ( 5 Lu, X. J .; Ju, H. X. Chin. J. Anal. Chem. 2003, 3 1 (1), 110 (in Chinese). ) ( (陆晓军,鞠先,分析化 学 ,2003,31(1),110.) ) ( 6 Fang, Y . Z .; L iu, S . H .; H e, P. G. C h em. J. Chin. Un i v. 1996,17, 1222 (in Chinese). (方禹之,刘盛辉,何品刚,高等学校化学学报,1996, 17, 1222.) ) ( 7 Hashimoto,K. ; Ito, K.; Ishimori,Y. A n al. Chim. Ac t a 1994, 286,219. ) ( 8 Li, X. H .; Niu, J. L.; Zhang, J.; L i , H . L.; Liu, Z. F. J. Phys. Chem. B 2003,107,2453. ) ( 9 Huang, T. S .; Tzeng, Y .; L iu, Y. K.; Chen, Y. C.; Walker, K. R.; Guntupalli, R.; Liu, C. Diamond Relat. Mater. 2004,13, 1 098. ) ( 10 Luo, H . X .; Shi, Z. J. ; Li, N. Q.; Gu, Z. N.; Zhuang,Q. K. Anal.Chem. 2001,73,915. ) ( 11 Wang, Z. H; Liu, J .; Yan, L. S. ; Wang, Y. M.; Luo, G. A. Chem. J. C hin. Univ. 2003, 24,236 (in Chinese). ) ( (王宗花,刘军,颜流水,王义明,罗国安,高等学校化学 学报,2003,24,236.) ) ( 12 Wang, S. G .; Zhang,Q . ; Wang, R.; Y o on, S. F.; Ahn, J;Yang, D . J . ; T ian, J. Z .; Li, J. Q.; Zhou, Q . Electrochem. Commun. 2003,5,800 ) ( 13 Yu, X .; C hattopadhyay, D.; G a leska, I.; Papadimitrakopou-los, F.; Rusling,J. F. Electroch e m. Commun.2003,5,408. ) ( Wang,J.;Musameh, M. Anal. Chem. 2003,75,2075. ) ( Sotiropoulou, S .; Chaniotakis, N. A. Anal. Bioanal. Chem. 2003,375,103. ) ( 16 Guo, M. L.; Chen, J. H.; Liu, D. Y. ; Nie, L.H.; Yao, S. Z.Bioelectrochemistry 2004, 62,29. ) ( 17 Wang, J.; Liu, G. D.; Jan, M. R.; Zhu, Q. Y. Electrochem. Commun.2003,5,1000. ) ( 18 Zhang,J.; Zou, H. L .; Qing, Q. J. Phys. Chem. B 2003,107,3712. ) ( 19 Luo, H .; S hi, Z. J .; Li, N. Q .; G u, Z. N . ; Zhuang, Q. K. Anal. Chem.2001,73,915. ) ( (A0503237 LU, Y .J.;LING, J.) )
确定



还剩3页未读,是否继续阅读?
武汉科思特仪器股份有限公司为您提供《碳纳米管修饰金电极检测特定序列DNA》,该方案主要用于其他中--检测,参考标准--,《碳纳米管修饰金电极检测特定序列DNA》用到的仪器有CS350M电化学工作站/电化学测试系统、CS310M电化学工作站/电化学测试系统、CS150M电化学工作站/测试系统、CS2350H双单元电化学工作站(双恒电位仪)
推荐专场
相关方案
更多
该厂商其他方案
更多


















