方案详情
文
制备1%琼脂糖凝胶(大胶用70ml,小胶用50ml):称取0.7 g(0.5 g)琼脂糖置于锥形瓶中,加入70 ml(50ml)1×TAE,瓶口倒扣小烧杯.微波炉加热煮沸3次至琼脂糖全部融化,摇匀,即成1.0%琼脂糖凝胶液。
方案详情

配制步骤如下: 1.制备1%琼脂糖凝胶(大胶用70ml,小胶用50ml):称取0.7 g(0.5 g)琼脂糖置于锥形瓶中,加入70 ml(50ml)1×TAE,瓶口倒扣小烧杯.微波炉加热煮沸3次至琼脂糖全部融化,摇匀,即成1.0%琼脂糖凝胶液。 2.胶板制备:取电泳槽内的有机玻璃内槽(制胶槽)洗干净,晾干,放入制胶玻璃板.取透明胶带将玻璃板与内槽两端边缘封好,形成模子.将内槽置于水平位置,并在固定位置放好梳子.将冷却到65℃左右的琼脂糖凝胶液混匀小心地倒入内槽玻璃板上,使胶液缓慢展开,直到整个玻璃板表面形成均匀胶层.室温下静置直至凝胶完全凝固,垂直轻拔梳子,取下胶带,将凝胶及内槽放入电泳槽中.添加1×TAE电泳缓冲液至没过胶板为止。 常见问题解决方法 1. DNA条带模糊,拖尾。 (1)DNA降解。避免核酸酶污染。 (2)DNA上样量过多。减少凝胶中DNA上样量。 (3)电泳缓冲液陈旧:电泳缓冲液多次使用后,离子强度降低,pH值上升,缓冲能力减弱,从而影响电泳效果。建议经常更换电泳缓冲液。 (4)电泳条件不合适。电泳时电压不应超过20 V/cm,温度<30℃,巨大DNA链,温度应<15℃,核查所用电泳缓冲液是否有足够的缓冲能力。 (5)DNA样含盐过高。泳前通过乙醇沉淀去除过多的盐。 (6)有蛋白污染。电泳前抽提去除蛋白。 (7)DNA变性。电泳前勿加热,用20 mM NaCl缓冲液稀释DNA。 2. DNA条带淡弱或无DNA带。 (1)DNA的上样量不够:增加DNA的上样量。 (2)DNA降解:避免DNA的核酸酶污染。 (3)DNA走出凝胶:缩短电泳时间,降低电压,增强凝胶浓度。 (4)分子大小相近的DNA带不易分辨。增加电泳时间,使用正确的凝胶浓度。 (5)DNA变性:电泳前请勿高温加热DNA链,用20 mM NaCl Buffer稀释DNA。 (6)DNA链巨大,常规凝胶电泳不合适。在脉冲凝胶电泳上分析。 3. DNAMARKER条带扭曲。 (1)配制凝胶的缓冲液和电泳缓冲液不是同时配制的。使用同时配制的缓冲液。电泳时缓冲液高过液面1~2 mm即可。 (2)电泳时电压过高。可以在电泳前15分钟用较低电压(3 V/cm),等条带出孔后,再调电压。 (3)尽量慢慢加样,等样品自然沉降后再加电压。
确定


还剩1页未读,是否继续阅读?
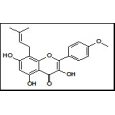
上海远慕生物科技有限公司为您提供《1%琼脂糖电泳制胶常见问题与解决办法》,该方案主要用于其他中琼脂糖凝胶制备检测,参考标准--,《1%琼脂糖电泳制胶常见问题与解决办法》用到的仪器有DEAE琼脂糖凝胶CL-6B500ml、琼脂糖(高分辨率)9012-36-6报价
相关方案
更多
该厂商其他方案
更多