生物检测技术的发展通常旨在提高检测的分辨率,或增加可以同时检测的生物特征数量。利用荧光素标记检测细胞特征的传统荧光流式是临床检测的常用技术,但由于荧光素数量限制,可同步检测的指标有限。流式质谱技术利用稳定的金属同位素标记抗体,可以在单细胞分辨率下同时检测超过40个生物学指标,显著增强了流式细胞术分析生理、病理过程中免疫系统的能力。本文在临床应用场景中比较了传统荧光流式和流式质谱两种技术手段对淋巴细胞的分群能力,旨在说明流式质谱技术具有优于荧光流式的技术特点,在未来能够广泛应用于临床样本检测。
方案详情

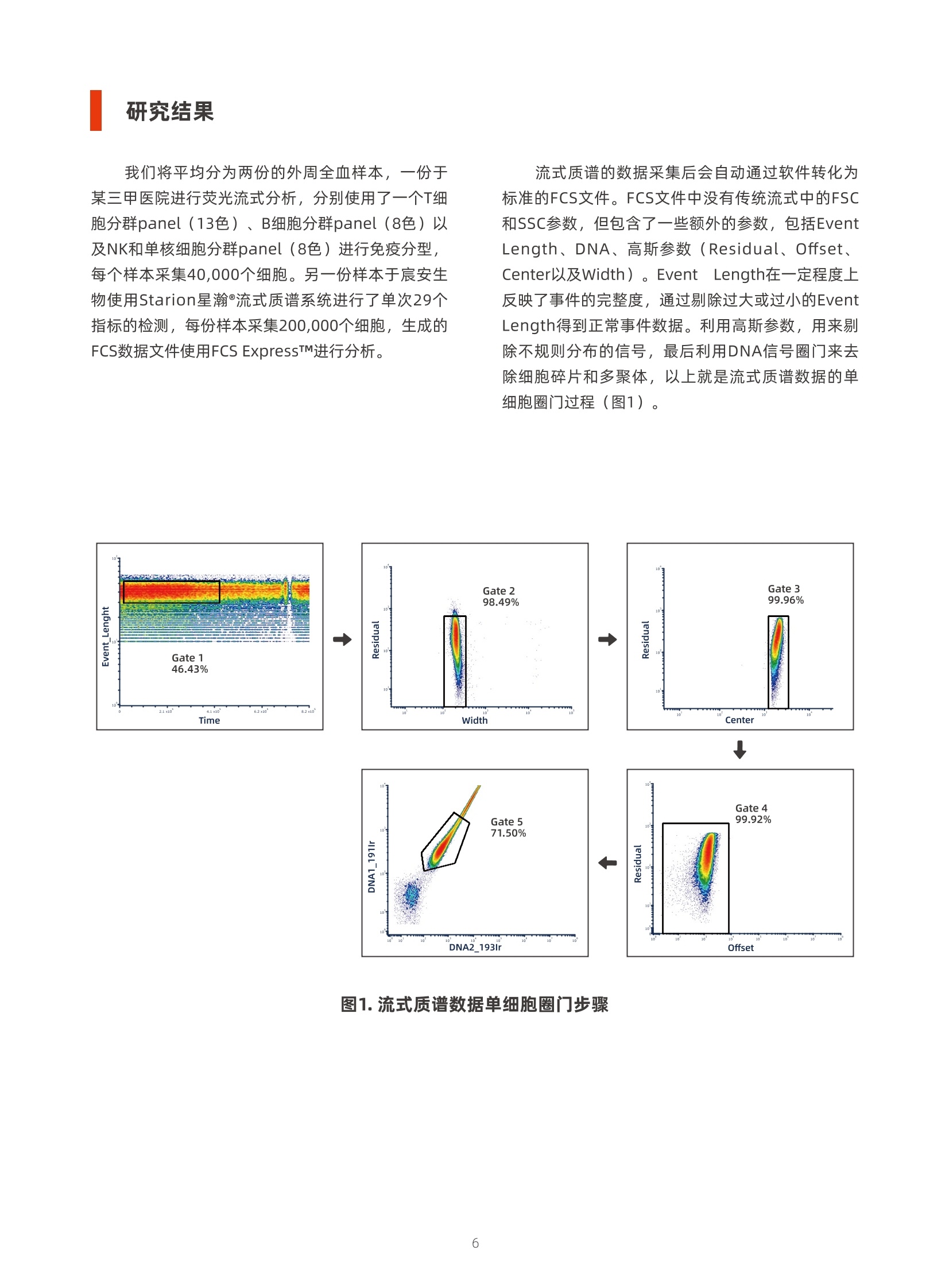
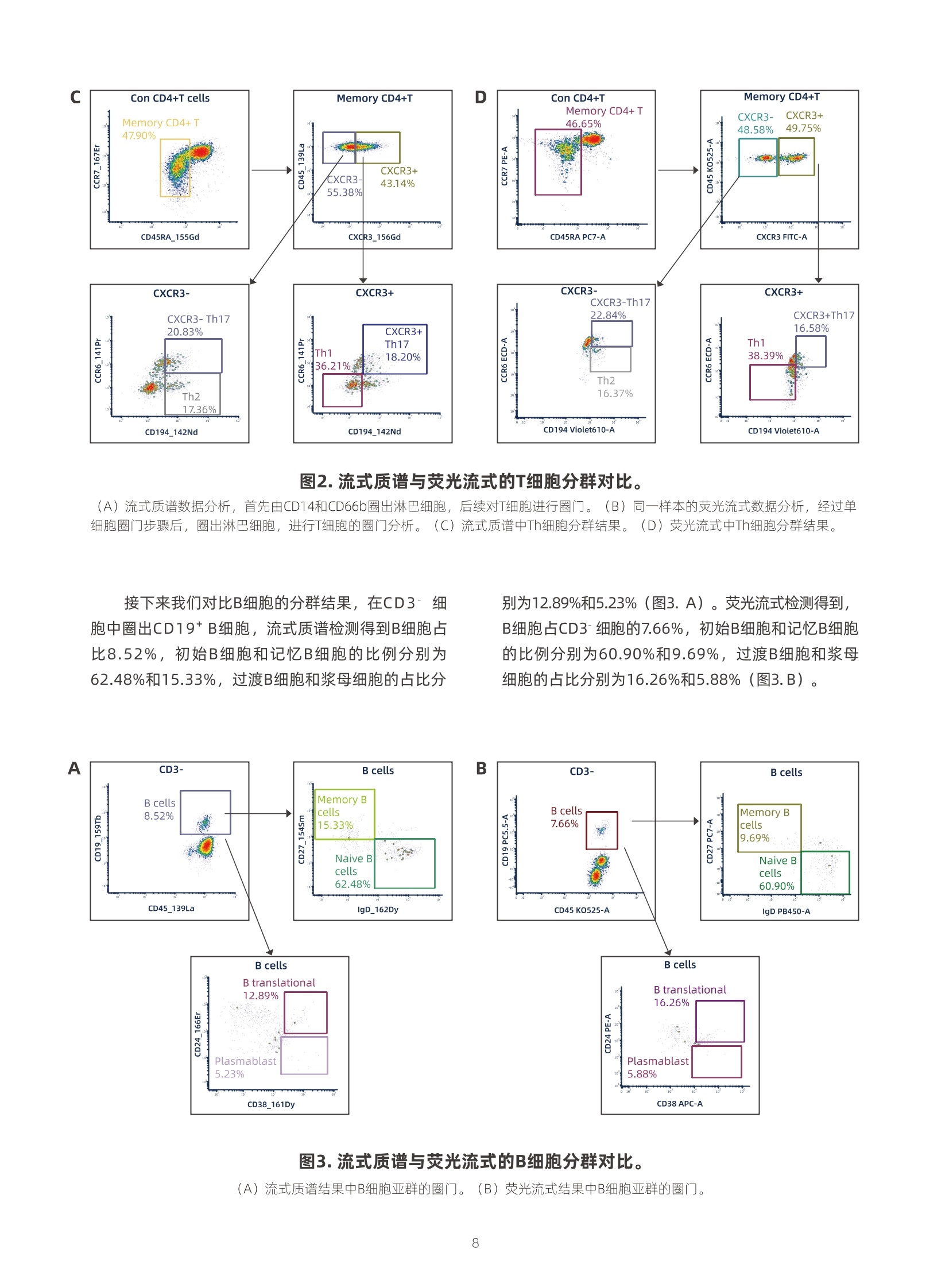
我们将平均分为两份的外周全血样本,一份于某三甲医院进行荧光流式分析,分别使用了一个T细胞分群panel(13色)、B细胞分群panel(8色)以及NK和单核细胞分群panel(8色)进行免疫分型,每个样本采集40,000个细胞。另一份样本于宸安生物使用Starion星瀚®流式质谱系统进行了单次29个指标的检测,每份样本采集200,000个细胞,生成的FCS数据文件使用FCS Express进行分析。 我们将这例样本的流式质谱和荧光流式分析结果进行对比,首先比较T细胞分群效果。流式质谱检测得到患者的外周血中CD4⁺ T细胞与CD8⁺ T细胞分别占总淋巴细胞的56.70%和12.26%,CD4/CD8的比值为4.62。Treg占CD4⁺ T细胞4.87%,CD4⁺ T细胞中初始T细胞、效应T细胞、中央记忆T细胞、效应记忆T细胞比例分别为24.58%、5.84%、9.12%、60.45%,活化的CD4⁺ T细胞比例为5.29%。对T细胞进行精细分群,CXCR3-的Th17和Th2占比分别为20.83%和17.36%,CXCR3⁺的Th17和Th1占比分别为18.20%和36.21%。而使用荧光流式检测得到该患者的外周血的淋巴细胞中CD4⁺ 和CD8⁺ T细胞占比为53.74%和13.09%,CD4/CD8的比值为4.10。 CD4⁺ T细胞中,Treg占比为2.89%,初始T细胞、效应T细胞、中央记忆T细胞、效应记忆T细胞比例分别为22.50%、6.29%、10.42%和60.66%,活化的CD4⁺ T细胞比例为6.46%。CXCR3- 的Th17和Th2占比分别为22.84%和16.37%,CXCR3⁺ 的Th17和Th1占比分别为16.58%和38.79%。从细胞的分群效果来看,流式质谱对CD4⁺ T细胞、CD8⁺ T细胞、Treg细胞以及Th1与Th17细胞的分群效果优于荧光流式。 接下来我们对比B细胞的分群结果,在CD3- 细胞中圈出CD19⁺ B细胞,流式质谱检测得到B细胞占比8.52%,初始B细胞和记忆B细胞的比例分别为62.48%和15.33%,过渡B细胞和浆母细胞的占比分别为12.89%和5.23%。荧光流式检测得到,B细胞占CD3- 细胞的7.66%,初始B细胞和记忆B细胞的比例分别为60.90%和9.69%,过渡B细胞和浆母细胞的占比分别为16.26%和5.88%。 对比NK细胞的分群结果,首先在淋巴细胞中圈出CD3- CD19- 细胞,接着利用CD16和CD56进行NK细胞圈门,人NK细胞主要可以分为两种类型:CD56bright (CD3-CD56++ CD16-/+)和CD56dim (CD3-CD56+/- CD16++)。流式质谱中,CD3- CD19-细胞占比21.16%,CD56bright和CD56dim NK细胞分别占比29.63%、62.33%。荧光流式中,CD3- CD19-细胞占比21.06%,CD56bright和CD56dim NK细胞分别占比29.85%、59.34%。4 流式质谱与荧光流式 对淋巴细胞分群能力的比较 摘要 生物检测技术的发展通常旨在提高检测的分辨率,或增加可以同时检 测的生物特征数量。利用荧光素标记检测细胞特征的传统荧光流式是临床 检测的常用技术,但由于荧光素数量限制,可同步检测的指标有限。流式 质谱技术利用稳定的金属同位素标记抗体,可以在单细胞分辨率下同时检 测超过40个生物学指标,显著增强了流式细胞术分析生理、病理过程中免 疫系统的能力。本文在临床应用场景中比较了传统荧光流式和流式质谱两 种技术手段对淋巴细胞的分群能力,旨在说明流式质谱技术具有优于荧光 流式的技术特点,在未来能够广泛应用于临床样本检测。 关键词 流式质谱 荧光流式 淋巴细胞分群 临床检测 了解生理、病理条件下组织器官的单细胞特征 有助于研究疾病发生中的细胞行为机制,更有助于 开发新的诊断和治疗方法¹。近年来得益于分子生物 学、微流体学和生物信息学等学科的发展,诞生了 一系列单细胞技术,科学家们也借此,对数千甚至 数百万个单细胞进行深入研究²。这些单细胞技术通 过深度揭示细胞间的异质性,能够为免疫学、发育 生物学等学科的研究提供高分辨率的数据,具有重 要的转化医学价值。其中,流式细胞术发展至今已 有半个多世纪的历史,它是单细胞领域的重要技术,是免疫学进步的主要驱动力,也是临床检测中常用 的重要技术。 在过去几十年间,荧光流式一直是流式细胞术 领域的主要技术手段,然而由于荧光基团的数量限 制和光谱重叠等问题,其在普通临床应用场景中单 次检测指标的数量通常为15个以内,而其检测极限 始终无法突破30个以上的指标,难以满足与日俱增 的临床和科研需求。流式质谱技术结合了流式技术 高效的单细胞研究能力和飞行时间质谱的全谱高分 辨率优势,采用金属同位素标签抗体对样本进行标 记,以离子质荷比信号强度作为检测指标。既克服 了荧光流式光谱信号重叠的问题,又突破了荧光检 测通道的限制,避免了复杂的实验设计,能够实现 更为全面的细胞特征分析。 流式质谱技术首创于2009年,该技术的成熟发 展不断推动了我们对生命科学的认知。流式质谱技 术帮助我们发现了许多新的细胞亚群,并深入剖析 其功能,以绘制特定组织的细胞图谱,探索特定细 胞亚群在疾病发生发展中的作用⁴。流式质谱相较于 荧光流式有显著的技术突破:流式质谱单次可检测 超过40个生物标志物的表达水平,极大拓展了检测 深度; 飞行时间质谱检测器的高分辨率,克服了荧光 信号峰的重叠问题。因此,一次流式质谱检测能实 现多次荧光流式检测的效果,在节省临床样本的同 时,更能将多维数据有机结合在一起,最大程度还 原样本真实特征。此外,流式质谱的操作以及数据 处理更为便捷,无需调整补偿等复杂操作,能有效 提高检测效率。 宸安生物在建立流式质谱系统的标准化操作方 面取得了很多成果,开发了17个marker的冻干微芯 抗体,能够实现染色过程中简单快捷地精准定量。通过使用编码试剂,可实现多个样本的同时检测,减少了批间差异。数据分析的自动化程度高,拥有 针对临床应用场景专门开发的分析软件,搭配成熟 分析模板,可以实现一键出报告。使用金属微球对 流式质谱仪器进行校准,金属校准微球具有良好的 均一度,可以对不同批次检测和不同仪器之间进行 校准,有利于开展大型多中心研究。流式质谱的标 准化建立使得其在多中心研究和临床检测中具有独 特优势,流式质谱技术已成为美国癌症免疫监测和 分析中心和癌症免疫数据共享(CIMAC-CIDC)项目 中检测免疫表型的主要工具,它也将会在建立科学 规范的、基于多中心研究的人免疫系统参考区间的 临床研究中发挥重要作用。 在这项研究中,宸安生物与某三甲医院进行合 作,通过采集分析相同的临床外周血样本,比较了 流式质谱技术和荧光流式技术对免疫细胞的检测能 力。其中,荧光流式使用三个抗体组合进行检测,流式质谱仅使用一个抗体组合完成检测。将其结果 进行对比,我们发现使用两种技术检测的结果接近,流式质谱技术对某些细胞亚群的分群效果更明显,提示了流式质谱技术在临床检测中的巨大应用潜力。 材料和方法 抗体 流式质谱 > 序号 抗原 克隆号 金属标签 货号 公司 1 CD14 MφP-9 175Lu H04842143 宸安生物 2 CD66b 6/40C 152Sm H24832109 宸安生物 3 CD45 HI30 139La H21231089 宸安生物 4 CD3 UCHT1 209Bi H16712189 宸安生物 5 CD4 SK3 145Nd H20631094 宸安生物 6 CD8 RPA-T8 168Er H25754133 宸安生物 7 CD25/IL-2RA BC96 169Tm H13553135 宸安生物 8 CD127 A019D5 149Sm H03612107 宸安生物 9 CD45RA HI100 155Gd H21411115 宸安生物 10 CD45RO UCHL1 165Ho H21612128 宸安生物 11 CXCR3(CD183) G025H7 156Gd H08912116 宸安生物 12 CXCR5 J252D4 172Yb H09131139 宸安生物 13 CCR4(CD194) L291H4 142Nd H09521095 宸安生物 14 CCR6 G034E3 141Pr H09711094 宸安生物 15 CCR7 G043H7 167Er H09813131 宸安生物 16 HLA-DR G46-6 173Yb H31111111 宸安生物 17 CD38 HIT2 161Dy H20443124 宸安生物 18 TCRγδ B1 164Dy H40762127 宸安生物 19 CTLA-4 14D3 170Er H05812099 宸安生物 20 PD-1 EH12.2H7 148Nd H15811096 宸安生物 21 CD19 HIB19 159Tb H09212120 宸安生物 22 CD20 2H7 171Yb H10612138 宸安生物 23 CD24 ML5 166Er H13111131 宸安生物 24 CD27 O323 154Sm H14923110 宸安生物 25 IgD IA6-2 162Dy H32011125 宸安生物 26 CD16 3G8 158Gd H06733118 宸安生物 27 CD56 NCAM16.2 160Gd H23414119 宸安生物 28 CD11c 3.9 147Sm H03124132 宸安生物 29 CD123(IL-3R) 6H6 143Nd H03311115 宸安生物 荧光流式- panel 1 序号 抗原 克隆号 荧光标签 货号 公司 1 CD45 J33 KO A96416 Beckman Coulter 2 CD3 UCHT1 A750 300470 Biolegend 3 CD8 RPA-T8 A700 301028 Biolegend 4 CD4 SK3 PC5.5 344608 Biolegend 5 CD127 A019D5 BV650 351326 Biolegend 6 HLA-DR LN3 eFluor 450 48-9956-42 eBioscience 7 CD25/IL-2RA 2A3 BV786 741035 BD Biosciences 8 CD45RA L48 PC7 337167 BD Biosciences 9 CD38 LS198-4-3 APC A60792 Beckman Coulter 10 CCR4(CD194) 1G1 BUV615 613000 BD Biosciences 11 CCR6 11A9 ECD NA NA 12 CCR7 G043H7 PE 353204 Biolegend 13 CXCR3(CD183) G025H7 FITC 353704 Biolegend 荧光流式- panel 2 序号 抗原 克隆号 荧光标签 货号 公司 1 CD45 J33 KO A96416 Beckman Coulter 2 CD3 UCHT1 A750 300470 Biolegend 3 CD19 J3-119 PC5.5 A66328 Beckman Coulter 4 CD20 2H7 A700 302322 Biolegend 5 CD27 M-T271 PC7 655157 BD Biosciences 6 IgD IA6-2 BV421 348226 Biolegend 7 CD24 ML5 PE 311106 Biolegend 8 CD38 LS198-4-3 APC A60792 Beckman Coulter 荧光流式- panel 3 序号 抗原 克隆号 荧光标签 货号 公司 1 CD45 J33 KO A96416 Beckman Coulter 2 CD14 MφP-9 APC-Cy7 557831 BD Biosciences 3 CD16 B73.1 APC 561304 BD Biosciences 4 CD11c B-ly6 PC7 652359 BD Biosciences 5 CD123(IL-3R) 7G3 PC5.5 558714 BD Biosciences 6 CD56 NCAM16.2 PE 340363 BD Biosciences 7 HLA-DR G46-6 BV421 562804 BD 8 CD3/CD19/CD20 UCHT1/HIB19/2H7 A700 NA NA 样本来源 由三甲医院检验科提供新鲜外周血样本,并平 均分为两份,其中一份在医院就地处理,另一份由冰 盒保存运输,在24小时内达到上海宸安生物实验室并 进行处理。 ●单细胞悬液制备 配制红细胞裂解液(现配现用) 10x红细胞裂解液(10X,eBioscience,00-4300-54)用超纯水稀释到1x红细胞裂解液。 红细胞裂解 取1 mL全血到15 mL离心管中,加入8 mL 1x红细胞裂 解液,轻轻颠倒混匀。计时,裂解时间为10-15分钟。 清洗 裂解结束,500 g离心10分钟,去上清,加入1 mL Cell Staining Buffer重悬细胞沉淀,再加入9 mL Cell StainingBuffer500g离心10分钟,去上清。重复上 述步骤再次清洗。 计数 加入1 mL Cell Staining Buffer重悬细胞沉淀。取10 µL 细胞悬液与10 µL台盼蓝充分混匀染色后于细胞计数仪 上进行细胞计数。根据计数结果,取出所需细胞数目 的细胞悬液。 ●流式质谱 染色 细胞悬液500g离心5分钟,去上清,按照1µg/样本 的用量加入金属标记的抗体,混匀后,室温孵育30分 钟。加入适量Cell Staining Buffer(或含1%BSA的PBS)重悬细胞,500 g离心细胞悬液5分钟,弃掉上清。 DNA嵌合试剂染色 样本中加入100µLDNA嵌合试剂(100µLCellFix Buffer+ 1 µL Ir-DNA嵌合试剂,涡旋充分混匀),吹 打混匀,室温孵育10分钟。 清洗 每管样本加入5 mL Cell Staining Buffer涡旋或颠倒混 匀,800 g离心5分钟,去上清。 上机 样本中加入5 mL Acquisition Solution重悬细胞沉淀,800 g离心10分钟,去上清。再加入1 mL Acquisition Solution重悬细胞沉淀,用40µm或70µm滤网的流 式管过滤细胞悬液,用Starion星瀚®(宸安生物)流 式质谱系统采集数据。 荧光流式 染色 细胞悬液500 g离心5分钟,去上清,按照说明书的推 荐用量加入荧光标记的抗体,混匀后置于室温,避 光孵育30分钟。 清洗 加入适量PBS重悬细胞,300 g离心细胞悬液5分钟,弃掉上清。 上机 加入2 mL PBS重悬细胞,用40 µm或70 µm滤网的流 式管过滤细胞悬液,用DxFLEX流式细胞仪(贝克曼 库尔特)进行检测和分析。 研究结果 我们将平均分为两份的外周全血样本,一份于 某三甲医院进行荧光流式分析,分别使用了一个T细 胞分群panel(13色)、B细胞分群panel(8色)以 及NK和单核细胞分群panel(8色)进行免疫分型,每个样本采集40,000个细胞。另一份样本于宸安生 物使用Starion星瀚®流式质谱系统进行了单次29个 指标的检测,每份样本采集200,000个细胞,生成的 FCS数据文件使用FCS Express™进行分析。 流式质谱的数据采集后会自动通过软件转化为 标准的FCS文件。FCS文件中没有传统流式中的FSC 和SSC参数,但包含了一些额外的参数,包括Event Length、DNA、高斯参数(Residual、Offset、Center以及Width)。Event Length在一定程度上 反映了事件的完整度,通过剔除过大或过小的Event Length得到正常事件数据。利用高斯参数,用来剔 除不规则分布的信号,最后利用DNA信号圈门来去 除细胞碎片和多聚体,以上就是流式质谱数据的单 细胞圈门过程(图1)。 图1.流式质谱数据单细胞圈门步骤 我们将这例样本的流式质谱和荧光流式分析结果 进行对比,首先比较T细胞分群效果。流式质谱检测 得到患者的外周血中CD4⁺ T细胞与CD8⁺ T细胞分别占 总淋巴细胞的56.70%和12.26%,CD4/CD8的比值为 4.62。Treg占CD4⁺ T细胞4.87%,CD4⁺ T细胞中初始 T细胞、效应T细胞、中央记忆T细胞、效应记忆T细胞 比例分别为24.58%、5.84%、9.12%、60.45%,活 化的CD4⁺ T细胞比例为5.29%(图2. A)。对T细胞进行 精细分群,CXCR3-的Th17和Th2占比分别为20.83%和17.36%,CXCR3⁺的Th17和Th1占比分别为 18.20%和36.21%(图2. C)。而使用荧光流式检测得 到该患者的外周血的淋巴细胞中CD4⁺和CD8⁺ T细胞 占比为53.74%和13.09%,CD4/CD8的比值为4.10。 CD4⁺T细胞中,Treg占比为2.89%,初始T细胞、效 应T细胞、中央记忆T细胞、效应记忆T细胞比例分别 为22.50%、6.29%、10.42%和60.66%,活化的CD4⁺T细胞比例为6.46%(图2. B)。CXCR3-的Th17和Th2占比分别为22.84%和16.37%,CXCR3⁺的Th17和Th1占比分别为16.58%和38.79%(图2. D)。从细胞的分 群效果来看,流式质谱对CD4⁺ T细胞、CD8⁺ T细胞、Treg细胞以及Th1与Th17细胞的分群效果优于荧光流 式。 图2.流式质谱与荧光流式的T细胞分群对比。 (A)流式质谱数据分析,首先由CD14和CD66b圈出淋巴细胞,后续对T细胞进行圈门。(B)同一样本的荧光流式数据分析,经过单 细胞圈门步骤后,圈出淋巴细胞,进行T细胞的圈门分析。(C)流式质谱中Th细胞分群结果。(D)荧光流式中Th细胞分群结果。 接下来我们对比B细胞的分群结果,在CD3-细 胞中圈出CD19⁺ B细胞,流式质谱检测得到B细胞占 比8.52%,初始B细胞和记忆B细胞的比例分别为 62.48%和15.33%,过渡B细胞和浆母细胞的占比分 别为12.89%和5.23%(图3. A)。荧光流式检测得到, B细胞占CD3-细胞的7.66%,初始B细胞和记忆B细胞 的比例分别为60.90%和9.69%,过渡B细胞和浆母 细胞的占比分别为16.26%和5.88%(图3. B)。 A 图3.流式质谱与荧光流式的B细胞分群对比。 对比NK细胞的分群结果,首先在淋巴细胞中圈 出CD3-CD19−细胞,接着利用CD16和CD56进行NK 细胞圈门,人NK细胞主要可以分为两种类型:CD56bright(CD3−CD56++CD16−/+)和CD56dim(CD3−CD56+/− CD16++)。流式质谱中,CD3- CD19−细胞占 比21.16%,CD56bright和CD56dim NK细胞分别占比 29.63%、62.33%(图4.A)。荧光流式中,CD3-CD19−细胞占比21.06%,CD56bright和CD56dimNK 细胞分别占比29.85%、59.34%(图4. B)。 图4.流式质谱与荧光流式的NK细胞分群对比。 (A)流式质谱结果中NK细胞亚群的圈门。(B)荧光流式结果中NK细胞亚群的圈门。 在本研究中我们将流式质谱技术与目前临床上 常用的荧光流式检测技术进行对比,比较了两种技 术手段下外周血淋巴细胞的分群结果。流式质谱对 单份样本进行了29个标志物的检测,对大部分淋巴细 胞亚群的分群结果与荧光流式检测结果十分接近,此外,细胞亚群的分群效果优于荧光流式,例如 Treg、CD4⁺T细胞与CD8⁺T细胞等。此结果可以说 明,流式质谱技术不仅与目前临床诊断所用的标准 方法相媲美,并且能够提供超过荧光流式检测范围 的额外有助于临床诊疗发现的高质量数据。 本研究中两次对比实验的变量无法进行精准控 制,这需要在今后的研究中避免。例如,两份样本 从全血到处理为单细胞悬液的时间不一致,由于取 材时间等问题,流式质谱所用样本处理时间滞后1-2天,由此可能会对细胞亚群的比例产生一定影响。此外,两次实验中所用抗体的克隆号未全部一致,可能会导致结果产生偏差。最后,手动圈门可能会 引入结果的主观偏差。 流式细胞术在临床样本检测中发挥着重要作用。在荧光流式应用场景中,当检测需求超过10个生物 标志物时,荧光素的选择要慎重考虑信号干扰和强 度差异。荧光流式技术目前能达到的上限是同时检 测30个标志物,但实际操作会非常困难。随着检测 需求的提高,荧光流式的技术瓶颈日益凸显。流式质 谱技术能够检测超过40个生物标志物,且不需要复 杂的调整补偿操作,在临床检测场景中具有巨大的 优势。 随着许多新的聚类、降维和其他高维数据分析 方法的发展,我们可以利用流式质谱的数据不断尝 试去发现、定义更多的免疫学概念。目前流式质谱 技术已经成为细胞生物学研究的关键工具,与其他 单细胞技术联合使用,能够为未来发现更多的生物 学新见解提供有力的数据支撑⁴。然而,当前国内临 床诊断中对于流式质谱技术的认知尚浅,仅有少数 一些医院引进流式质谱仪器,进行一些科研性探索 研究。如何推动流式质谱技术在临床中的广泛应用,更全面地建立流式质谱技术的标准化,是我们接下 来需要全力解决的一个挑战。 参考文献 1. Baskar R, Kimmey SC, Bendall SC. Revealing new biology from multiplexed, metal-isotope-tagged, single-cell readouts. Trends Cell Biol. 2022. 2. Gohil SH, Iorgulescu JB, Braun DA, Keskin DB, Livak KJ. Applying high-dimen sional single-cell technologies to the analysis of cancer immunotherapy. Nat Rev Clin Oncol. 2021; 18:244-56. 3. Cossarizza A, Chang HD, Radbruch A, Akdis M, Andrä I, Annunziato F, et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. Eur J Immunol. 2017; 47:1584-797. 4. Bendall SC, Nolan GP, Roederer M, Chattopadhyay PK. A deep profiler's guide to cytometry. Trends in Immunology. 2012; 33:323-32. POLARIS 晨 安安生 物 联系我们 售前咨询:inquiry@polarisbiology.com 订购咨询:order@polarisbiology.com 技术支持:techsupport@polarisbiology.com 了解更多信息 请关注宸安生物微信公众号 公司官网:www.polarisbiology.com 公司地址:上海市浦东新区祖冲之路1505弄138号6楼
确定








还剩8页未读,是否继续阅读?
上海宸安生物科技有限公司为您提供《流式质谱与荧光流式对淋巴细胞分群能力的比较》,该方案主要用于全血/血清/血浆中生化检验检测,参考标准--,《流式质谱与荧光流式对淋巴细胞分群能力的比较》用到的仪器有宸安生物Polaris Biology流式细胞仪Starion星瀚
推荐专场
相关方案
更多
















