方案详情
文
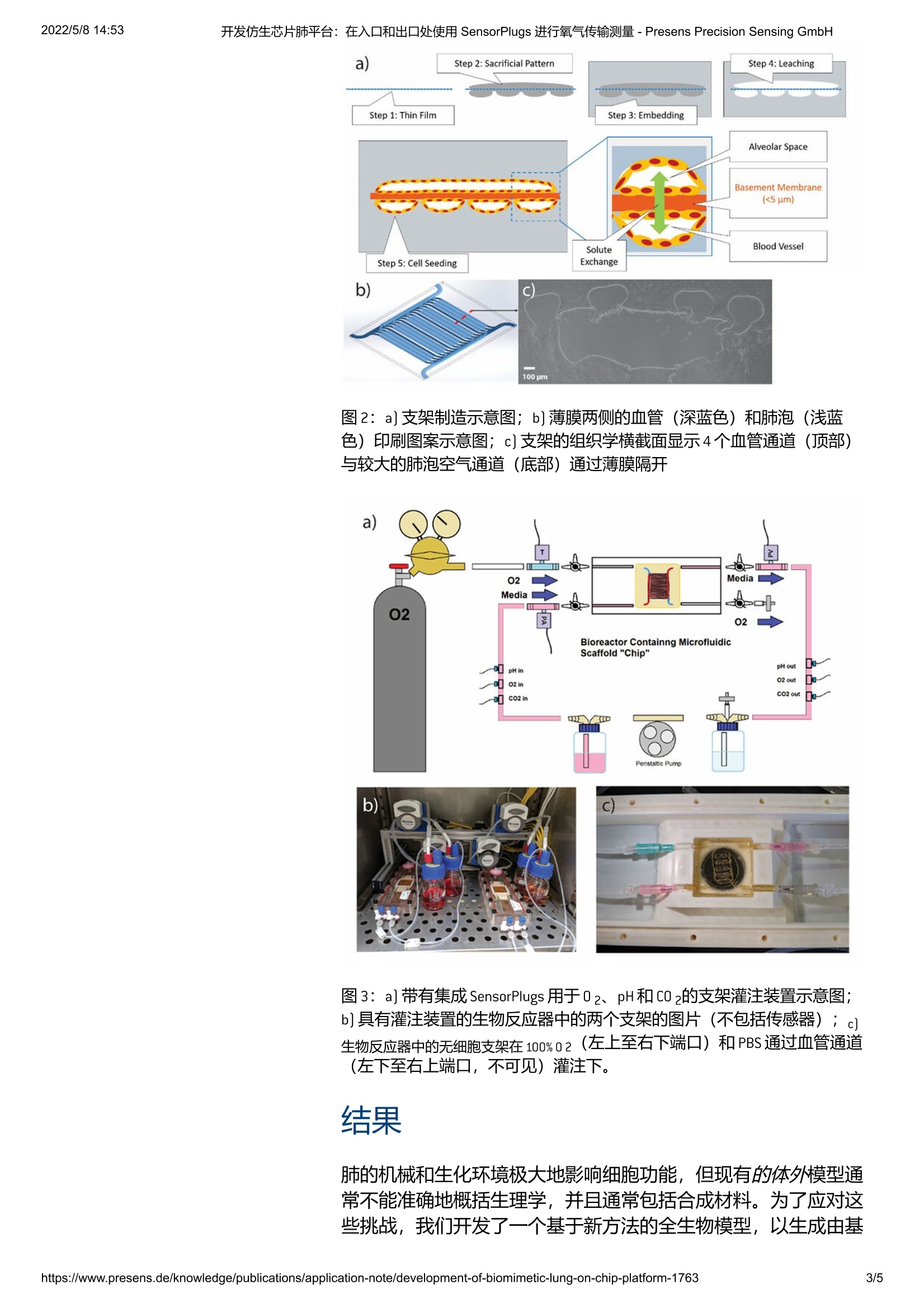
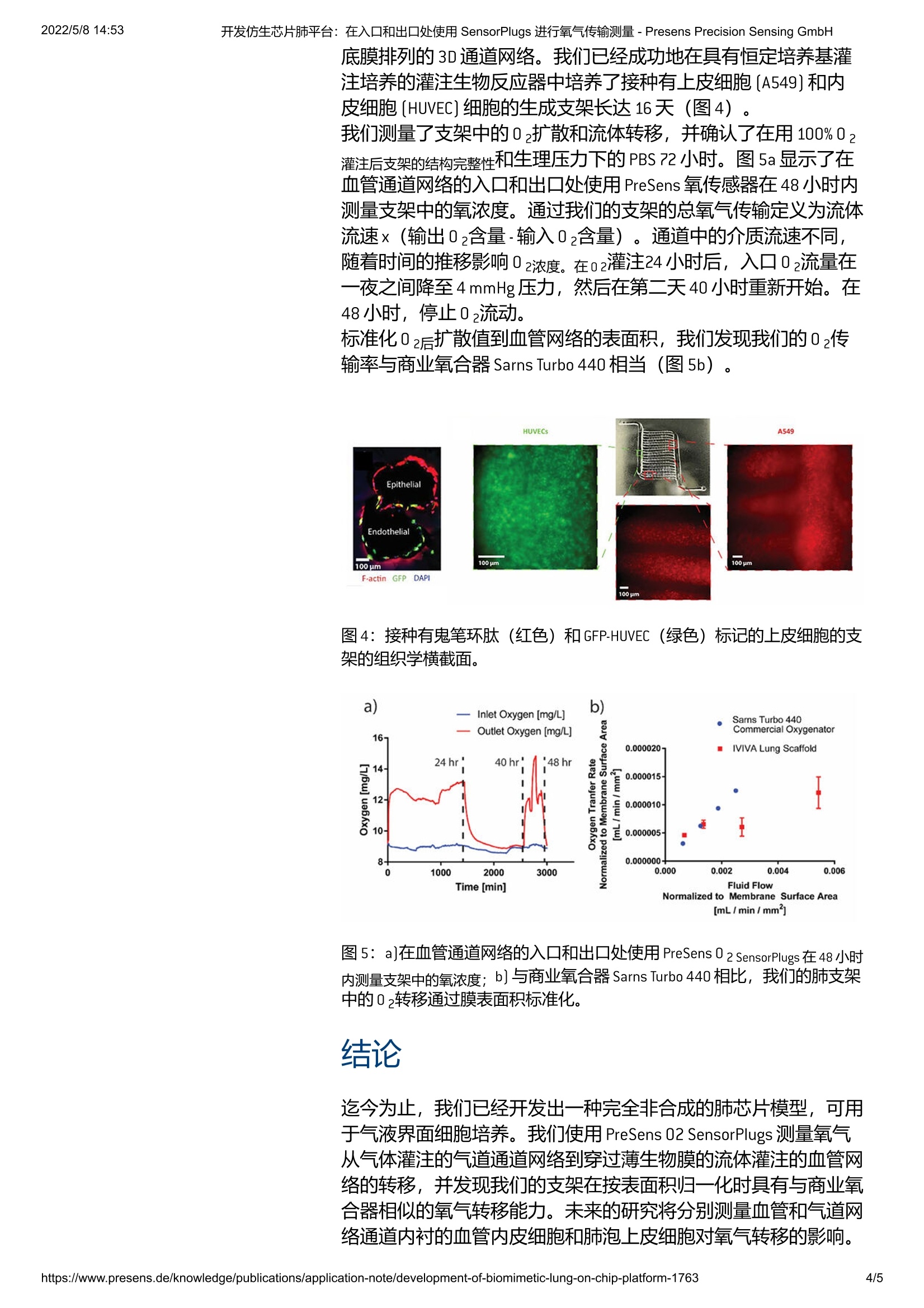
该项目的目标是为组织工程和专门用于疾病病理学研究提供仿生片上肺平台。我们首先在 3D 肺模型中建立了长期培养,并在我们的模型中测量了穿过多孔膜的氧气转移和流体过滤的基线值,这两者都已知会受到体内病毒感染的影响。为了测量氧气传输,我们使用 PreSens 的光学氧气传感器直接放置在支架入口和出口的流体灌注路径中。使用这种设置,我们已经证明,当通过气体交换表面积标准化时,我们的片上肺模型实现了与商业氧合器中看到的相似的氧气转移率。
方案详情

2022/5/8 14:53开发仿生芯片肺平台:在入口和出口处使用 SensorPlugs 进行氧气传输测量- Presens Precision Sensing GmbHCN 德 中国SrKELISIUN SENSING 开发仿生芯片肺平台:在入口和出口处使用 SensorPlugs 进行氧气传输测量-Presens Precision Sensing GmbH2022/5/8 14:53 后退 在入口和出口处使用 SensorPlug 进行氧气传输测量Dniel Cheng、Charles Klassen、Ha OttIVIVA Medical, 美国马萨诸塞州贝弗利 该项目的目标是为组织工程和专门用于疾病病理学研究提供仿生片上肺平台。我们首先在3D肺模型中建立了长期培养,并在我们的模型中测量了穿过多孔膜的氧气转移和流体过滤的基线值,这两者都已知会受到体内病毒感染的影响。为了测量氧气传输,我们使用 PreSens 的光学氧气传感器直接放置在支架入口和出口的流体灌注路径中。使用这种设置,我们已经证明,当通过气体交换表面积标准化时,我们的片上肺模型实现了与商业氧合器中看到的相似的氧气转移率。 当前的 COVID-19大流行凸显了对普遍可用、简单、负担得起、可扩展且与生理相关的平台的迫切需求,以研究病毒感染对人肺的影响。越来越多的证据表明,异常和适应不良的免疫反应,而不是病毒复制,会导致重症患者出现急性肺损伤。鉴于临床结果的异质性,一些患者可能会产生保护性免疫反应,而另一些则可能是有害的;因此,任何减轻免疫系统损伤作用的潜在疗法都需要个体化。为了了解和调节对 SARS-CoV-2的免疫反应, 迄今为止,还没有模型可以准确地概括远端肺组织的功能单元。现有的片上肺模型包含嵌入在聚二甲基硅氧烷 [PDMS]等非生物材料中的微流体通道网络,可能无法准确概括细胞-细胞外基质相互作用、生理流动曲线、间质液转移和氧气转移见于天然组织。此外,非生物材料容易形成血栓和结垢,因此可能无法有效研究需要数天或数周培养的延长孵育时间的病原体。在IVIVA,我们利用包括3D打印和薄膜制造在内的多种技术开发了一种全生物支架,该支架具有嵌入的血管和气道网络,由薄(约5pm)多孔明胶膜隔开。细胞可以接种在膜的相对两侧并保持在气-液界面培养中。在初步实验中,我们已经确认在我们 的3D支架中植入了各种细胞,并维持了超过21天的培养。我们 假设生理相关的生物支架将能够研究病毒感染对肺组织的直接影 响以及免疫后遗症,并能够评估治疗干预。 我们的第一个目标是开发我们的片上肺模型,并为无细胞模型中的氧气转移和液体过滤建立功能基线指标。接下来将在我们的支 架中重复这些测量,这些支架分别在血管和气道隔室中接种了内皮细胞和肺泡上皮细胞。通过首先建立脱细胞支架中氧转移的功能基线测量,我们可以测量细胞的影响并与已知的生理值进行比较。然后,我们将在系统中引入一种表征良好的扰动,即细菌脂多糖[LPS],并测量其对气体转移的影响,以验证我们的模型。 材料与方法 首先,我们生成了定义成分的基底膜,其厚度控制在大约。5 um(图1a, b)。通过使用F127 作为牺牲性致孔剂,我们创造了0.1-4 um的孔,类似于在人类支气管基底膜中观察到的孔(图1c, d)。 图1: a]显示膜厚度的光学轮廓测量。b]平均厚度测量值4.87 pm±0.71um, n=54]。 c] 显示多孔膜的 SEM 图像。d]膜中的孔径分布。 然后使用牺牲凝胶墨水 (Pluronic F127) 再次将通道3D打印在膜的两侧。使用3D打印的塑料模具将明胶浇注到这些膜上,然后使用微生物转浴氨酰胺酶将明胶交联,然后冲洗掉牺牲通道图案。在F127被抽空后,空心通道网络仍然存在,可以直接连接到流动,由蠕动泵驱动,并灌注流体或空气。中空通道也可以接种细胞,这些细胞将粘附在明胶通道壁上并形成细胞单层(图2a)。我们的通道几何结构设计为具有1000 um宽的肺泡空间,毗令较小的200pm血管通道(图2b)。肺泡表面积为232mm?血管表面积为184mm2,比率为1.26(图2c)。为了建立该项目的气液界面[ALI]培养,我们使用蠕动泵通过气道通道网络灌注空气,并使用 LabView中开发的定制软件控制流速。 PreSens 02SensorPlugs (连同 pH和 CO2SensorPlugs) 被放置在支架入口和出口处的流体通路中,连续的流体流动通过血管网络灌注。气管[T]气道入口、肺动脉 [PA]入口和肺静脉 [PV]出口也有在线压力传感器(图3a)。我们通过气道网络灌注100%02并测量了02一旦系统在给定的流体和气体流速下达到平衡,通过减去出口02浓度减去入口浓度,从穿过膜的空气通道到血管网络的传输速率 图2:a]支架制造示意图;b]薄膜两侧的血管(深蓝色)和肺泡(浅蓝色)印刷图案示意意; c]支架的组织学横截面显示4个血管通道(顶部)与较大的肺泡空气通道(底部)通过薄膜隔开 图3:a]带有集成SensorPlugs用于02、pH和CO2的支架灌注装置示意图; b]具有灌注装置的生物反应器中的两个支架的图片(不包括传感器); c)生物反应器中的无细胞支架在100%02(左上至右下端口)和PBS通过血管通道(左下至右上端口,不可见)灌注下。 结果 肺的机械和生化环境极大地影响细胞功能,但现有的体外模型通常不能准确地概括生理学,并且通常包括合成材料。为了应对这些挑战,我们开发了一个基于新方法的全生物模型,以生成由基 底膜排列的3D通首网络。我们已经成功地在具有恒定培养基灌注培养的灌注生物反应器中培养了接种有上皮细胞[A549]和内皮细胞 [HUVEC]细胞的生成支架长达16天(图4)。 我们测量了支架中的02扩散和流体转移,并确认了在用100%02灌注后支架的结构完整性和生理压力下的 PBS 72小时。图5a显示了在血管通道网络的入口和出口处使用 PreSens 氧传感器在48小时内测量支架中的氧浓度。通过我们的支架的总氧气传输定义为流体流速x(输出02含量-输入02含量)。通道中的介质流速不同,随着时间的推移影响02浓度。在02灌注24小时后,入口02流量在一夜之间降至4mmHg压力,然后在第二天40小时重新开始。在48小时,停止02流动。 标准化02后扩散值到血管网络的表面积,我们发现我们的02传输率与商业氧合器 Sarns Turbo 440相当(图5b)。 100 pm 图4:接种有鬼笔环肽(红色)和GFP-HUVEC(绿色)标记的上皮细胞的支架的组织学横截面。 图5:a]在血管通道网络的入口和出口处使用 PreSens 0 2 SensorPisloruPleugss 在仕48小时内测量支架中的氧浓度;b]与商业氧合器 Sarns Turbo 440 相比,我们的肺支架中的02转移通过膜表面积标准化。 结论 迄今为止,我们已经开发出一种完全非合成的肺芯片模型,可用于气液界面细胞培养。我们使用 PreSens 02 SensorPlugs测量氧气从气体灌注的气道通道网络到穿过薄生物膜的流体灌注的血管网络的转移,并发现我们的支架在按表面积归一化时具有与商业氧合器相似的氧气转移能力。未来的研究将分别测量血管和气道网络通道内衬的血管内皮细胞和肺泡上皮细胞对氧气转移的影响。 然后,我们将使用公认的细菌 LPS扰动来验证我们的系统,众所周知,细菌 LPS会对细胞存和和功能结果(例如气体交换和流体转移)产生不利影响。在验证了我们的平台之后,我们正在与马萨诸塞州总医院[MGH]和加州大学旧金山分校 [UCSF]的一个实验室合作,研究SARS-CoV-2病毒对远端肺组织的影响。我们将通过将一种假型病毒(一种涂有来自冠状病毒的“刺突”蛋白的病毒样颗粒)引入我们的肺模型来实现这一目标,并测量其对氧气转移等功能结果的影响。这将冠状病毒中的蛋白质导入我们的肺模型,并测量其对功能结果(例如氧气转移)的影响。这将冠状病毒中的蛋白质导入我们的肺模型,并测量其对功能结果(例如氧气转移)的影响。这体外测试平台将使直接观察能够更好地了解病毒对肺组织的影响,以及在临床研究之前测试对人体细胞的潜在治疗干预。 致谢 这项工作得到了 United Therapeutics 和 Mendez 国家移植研究所基金会的资助。 相关产品 https://www.presens.de/knowledge/publications/application-note/development-of-biomimetic-lung-on-chip-platform- 该开发仿生芯片肺平台:在入口和出口处使用Presens残氧仪 SensorPlugs 进行氧气传输测量项目的目标是为组织工程和专门用于疾病病理学研究提供仿生片上肺平台。我们首先在 3D 肺模型中建立了长期培养,并在我们的模型中测量了穿过多孔膜的氧气转移和流体过滤的基线值,这两者都已知会受到体内病毒感染的影响。为了测量氧气传输,我们使用 PreSens 的光学氧气传感器直接放置在支架入口和出口的流体灌注路径中。使用这种设置,我们已经证明,当通过气体交换表面积标准化时,我们的片上肺模型实现了与商业氧合器中看到的相似的氧气转移率。当前的 COVID-19 大流行凸显了对普遍可用、简单、负担得起、可扩展且与生理相关的平台的迫切需求,以研究病毒感染对人肺的影响。越来越多的证据表明,异常和适应不良的免疫反应,而不是病毒复制,会导致重症患者出现急性肺损伤。鉴于临床结果的异质性,一些患者可能会产生保护性免疫反应,而另一些则可能是有害的;因此,任何减轻免疫系统损伤作用的潜在疗法都需要个体化。为了了解和调节对 SARS-CoV-2 的免疫反应,迄今为止,还没有模型可以准确地概括远端肺组织的功能单元。现有的片上肺模型包含嵌入在聚二甲基硅氧烷 (PDMS) 等非生物材料中的微流体通道网络,可能无法准确概括细胞-细胞外基质相互作用、生理流动曲线、间质液转移和氧气转移见于天然组织。此外,非生物材料容易形成血栓和结垢,因此可能无法有效研究需要数天或数周培养的延长孵育时间的病原体。在 IVIVA,我们利用包括 3D 打印和薄膜制造在内的多种技术开发了一种全生物支架,该支架具有嵌入的血管和气道网络,由薄(约 5 µm)多孔明胶膜隔开。细胞可以接种在膜的相对两侧并保持在气-液界面培养中。在初步实验中,我们已经确认在我们的 3D 支架中植入了各种细胞,并维持了超过 21 天的培养。我们假设生理相关的生物支架将能够研究病毒感染对肺组织的直接影响以及免疫后遗症,并能够评估治疗干预。我们的第一个目标是开发我们的片上肺模型,并为无细胞模型中的氧气转移和液体过滤建立功能基线指标。接下来将在我们的支架中重复这些测量,这些支架分别在血管和气道隔室中接种了内皮细胞和肺泡上皮细胞。通过首先建立脱细胞支架中氧转移的功能基线测量,我们可以测量细胞的影响并与已知的生理值进行比较。然后,我们将在系统中引入一种表征良好的扰动,即细菌脂多糖 (LPS),并测量其对气体转移的影响,以验证我们的模型。材料与方法首先,我们生成了定义成分的基底膜,其厚度控制在大约。5 µm(图 1a,b)。通过使用 F127 作为牺牲性致孔剂,我们创造了 0.1 - 4 µm 的孔,类似于在人类支气管基底膜中观察到的孔(图 1c,d)。图 1:a) 显示膜厚度的光学轮廓测量。b) 平均厚度测量值 4.87 µm ± 0.71 µm,n = 54)。c) 显示多孔膜的 SEM 图像。d) 膜中的孔径分布。
确定



还剩3页未读,是否继续阅读?
上海奇宜仪器设备有限公司为您提供《仿生芯片肺平台中氧气传输测量检测方案(其它元素分析仪)》,该方案主要用于其他中其他检测,参考标准--,《仿生芯片肺平台中氧气传输测量检测方案(其它元素分析仪)》用到的仪器有德国Presens 残氧仪 OXY-1 SMA、新型“SensorPlugs 专为微流体和微流体应用而设计 、奇宜 读卡器 其他元素分析仪配件
推荐专场
相关方案
更多