方案详情
文
生物分析对于生物大分子药物的早期研发,临床前研究乃至临床研究阶段都具有非常重要的意义。为了提供药代动力学(pharmacokinetics,PK), 药效动力学(pharmacodynamics, PD)和毒动学(toxicokinetics, TK)所需的时间序列数据,我们对在生物基质中测定生物大分子药物浓度的准确性,灵敏度,选择性和通量均提出了非常高的要求。
方案详情

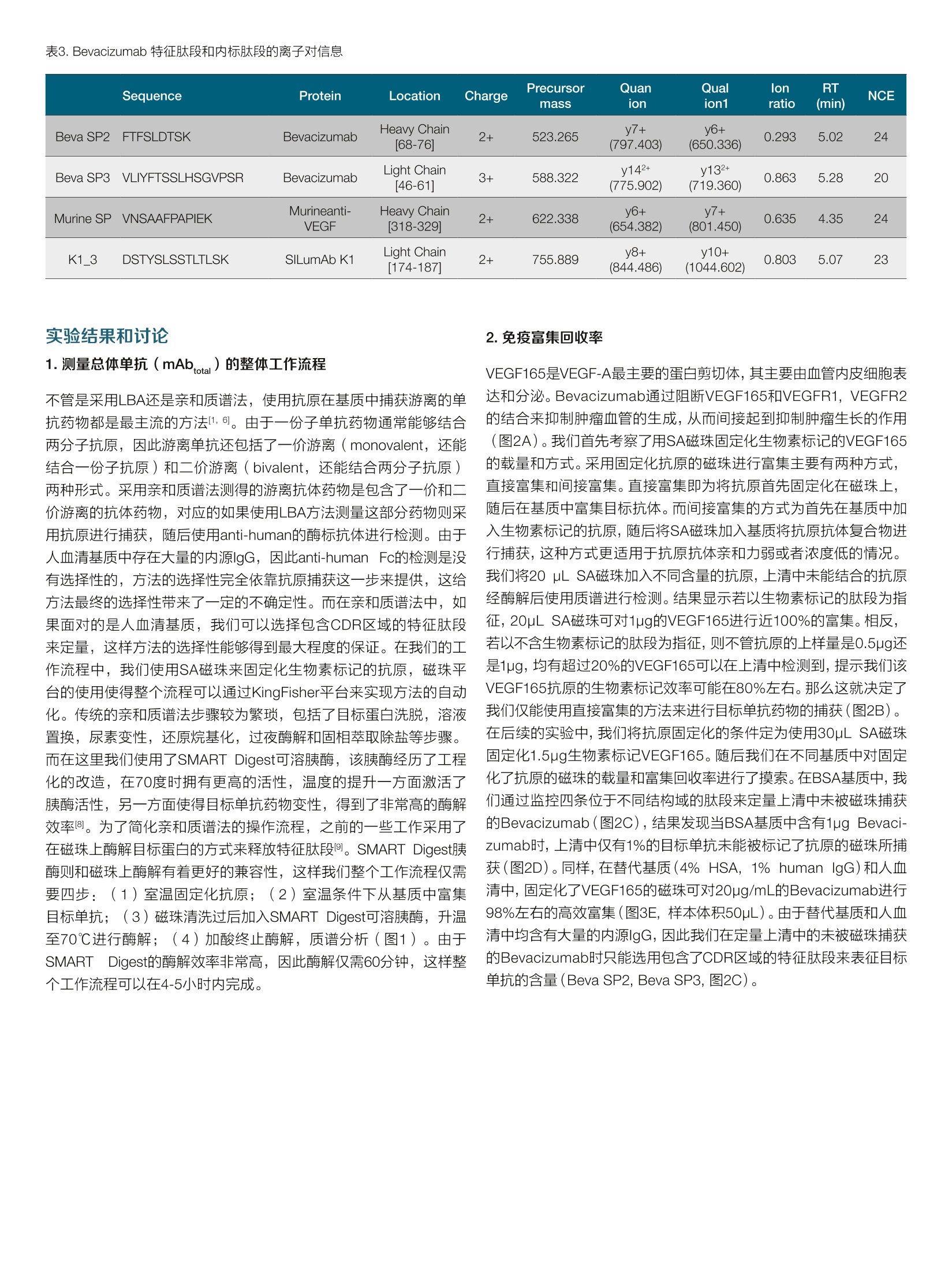
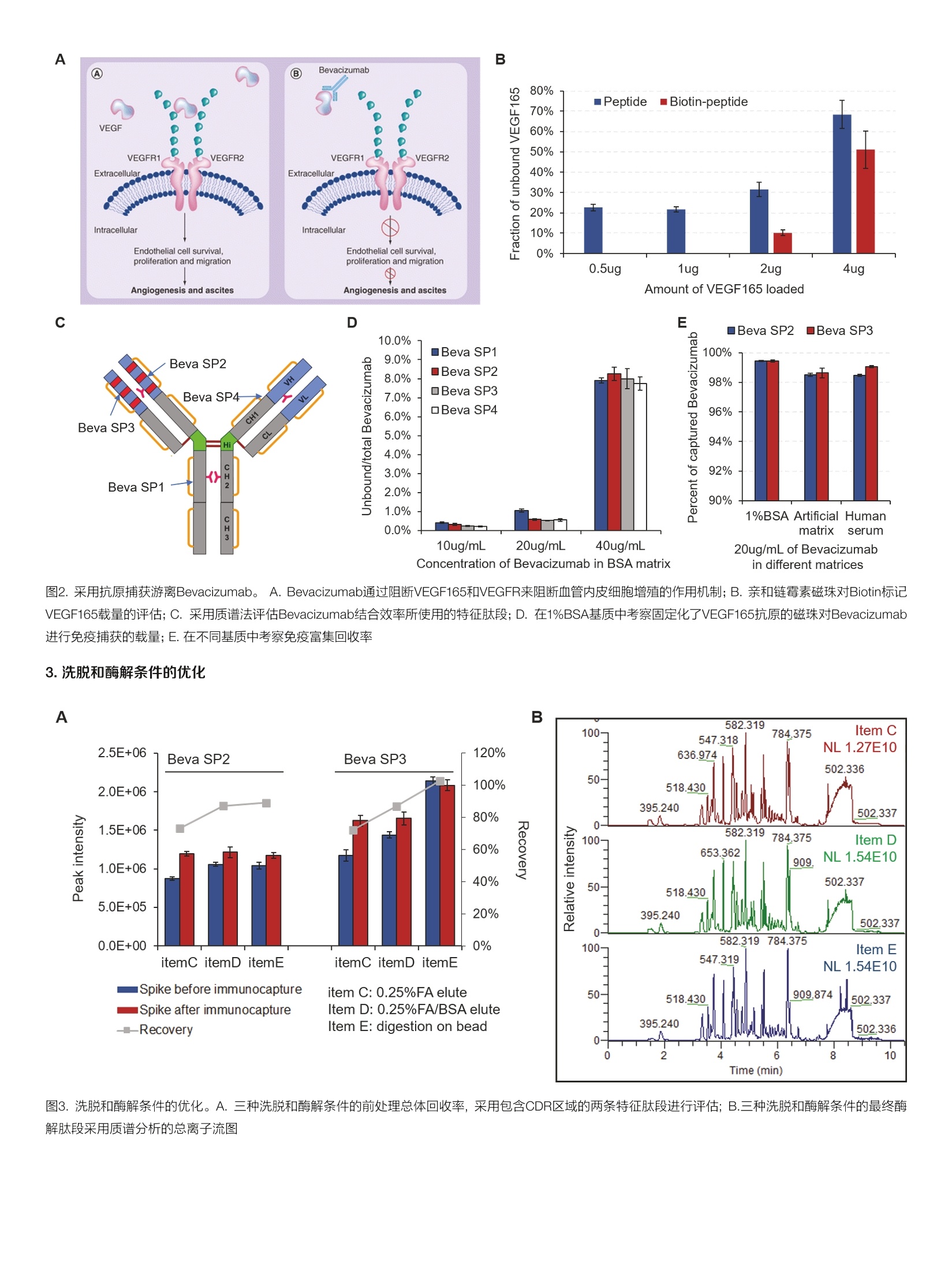
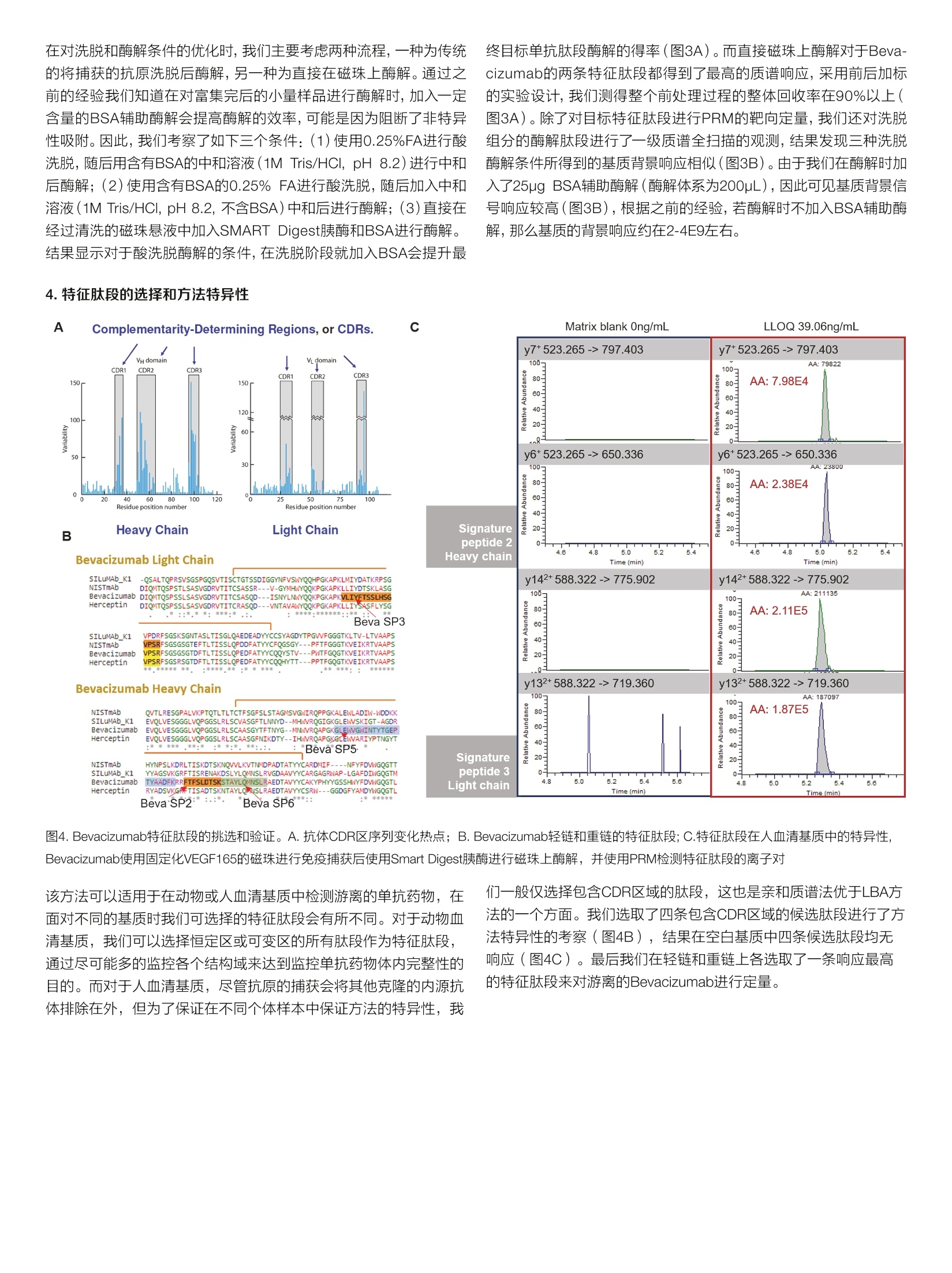
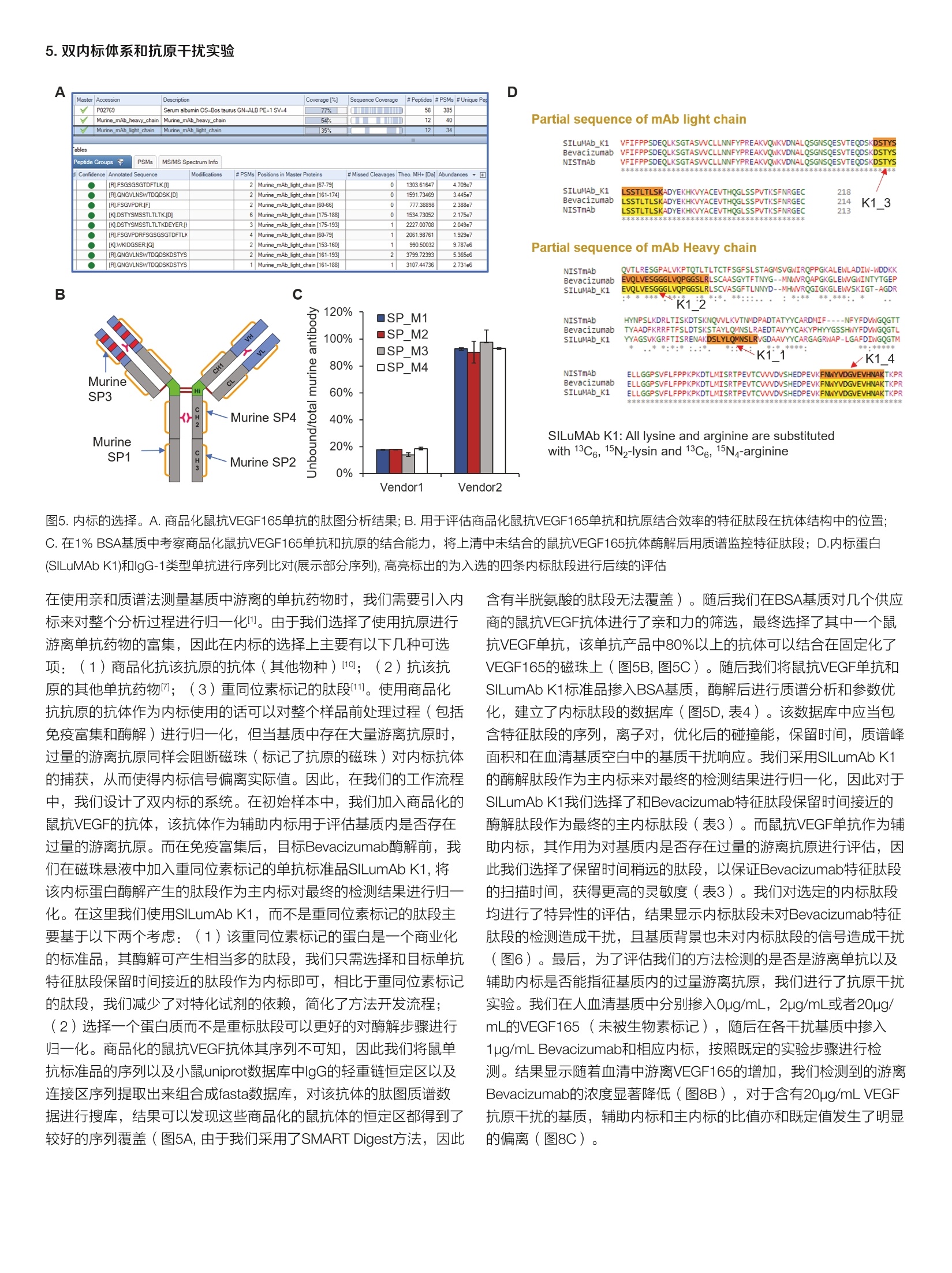
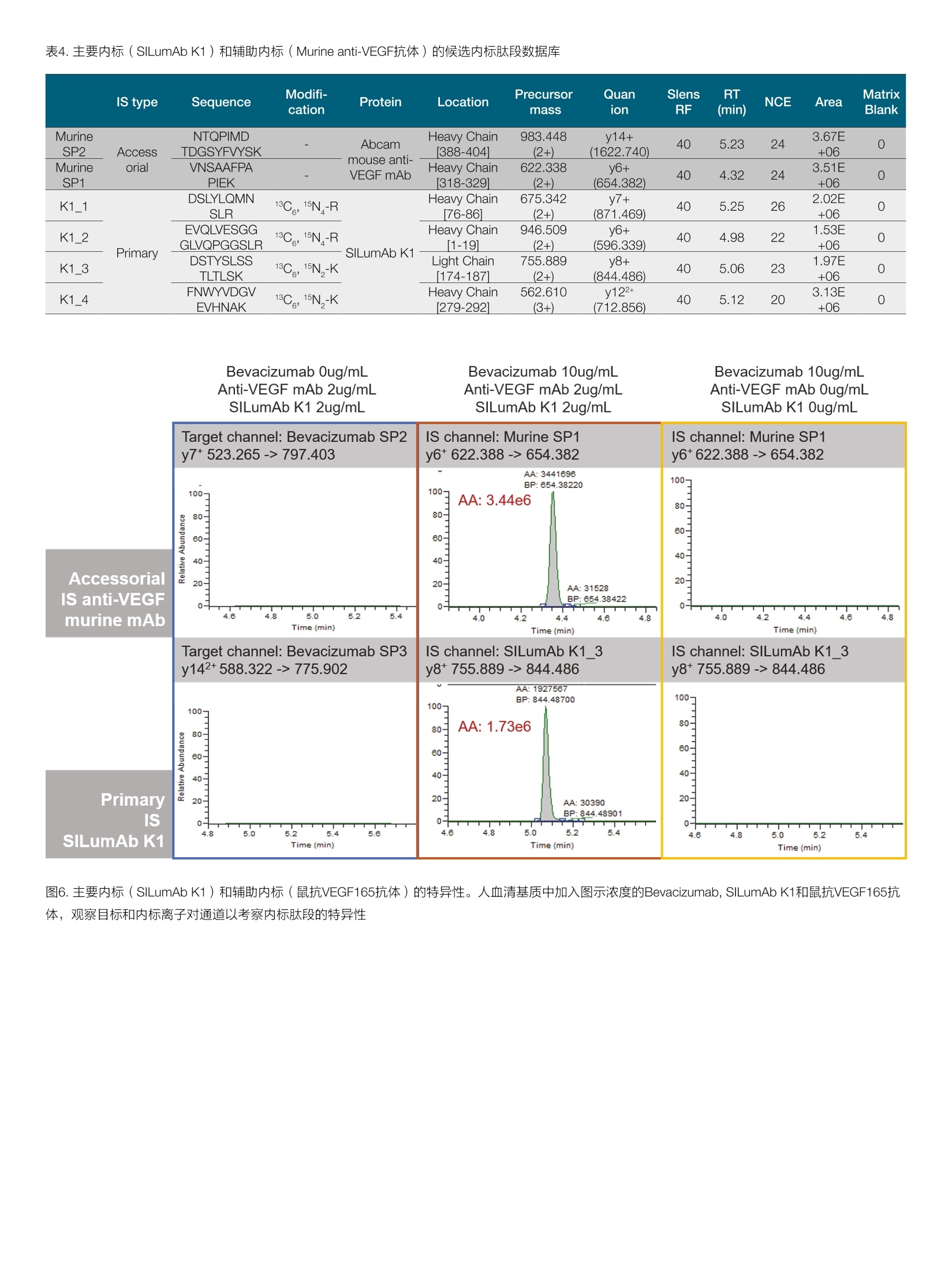
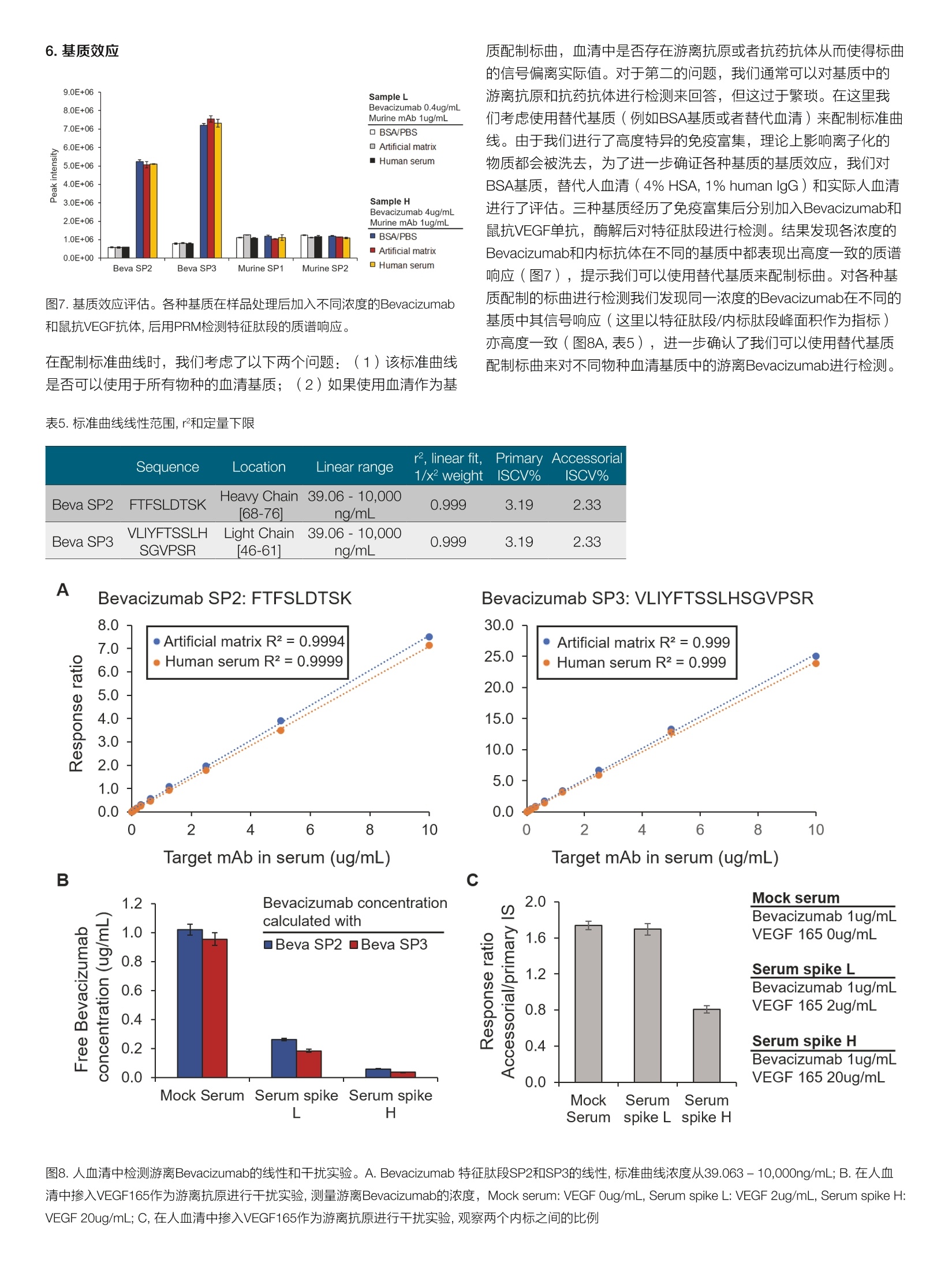
thermoscientific AB 唐家澍 赛默飞世尔科技(中国)有限公司 关键词 单抗药物生物分析,亲和质谱法,游离单抗药物, SMART Digest, Orbitrap 方法优势 。简单快速,整个前处理过程仅需4-5小时,并且可以实现无人值守的全程自动化和通量化 。固定的方法开发流程,对特化试剂依赖度低 。高灵敏度和高选择性,免疫质谱法兼具免疫法的灵敏度和质谱法的选择性 ·双内标系统有助于发现体内是否存在游离抗原 前言 生物分析对于生物大分子药物的早期研发,临床前研究乃至临床研究阶段都具有非常重要的意义。为了提供药代动力学(pharmaco-kinetics, PK),药效动力学(pharmacodynamics, PD) 和毒动学( toxicokinetics, TK)所需的时间序列数据,我们对在生物基质中测定生物大分子药物浓度的准确性,灵敏度,选择性和通量均提出了非常高的要求。基于免疫结合的方法(Ligand Binding Assay,LBA),例如酶联免疫吸附(ELISA)方法由于其出色的灵敏度和通量,,,一直是生物大分子药物生物分析的金标准方法。但其固有的一些不足也在后续的研究中一直困扰着单抗药物的生物分析: 。免疫法通常依赖于一对高质量抗体来识别蛋白药物的不同抗原表位。这些试剂其开发周期较长,在药物开发的早期通常难以获得。 ·免疫法的线性范围较窄,在一些情况下不能完全符合药代动力学实验的需求。 ·易受基质干扰影响,方法通常限定于特定的生物基质。 ·易受动物体内抗药物抗体的影响。 和LBA方法不同,质谱法是基于目标蛋白特征肽段的氨基酸独特序列信息来实现方法的选择性,从而降低了对关键试剂的依赖。目前大多数由质谱进行的生物分析方法都采用了自下而上的蛋白质组学策略(bottom-up strategy), 这种方法需要将蛋白质药物首先酶解成肽段,随后采用三重四级杆质谱进行选择反应监控 (SelectedReaction Monitoring, SRM) [2.3]或者高分辨质谱进行平行反应监控(Parallel Reaction Monitoring, PRM) [4,5]的方式来定量该蛋白药物的一条或者多条特征肽段。 单抗药物在生物体内存在着多种形式,单抗药物可以和游离抗原以及循环系统中的抗药抗体(Anti-Drug antibody, ADA)结合形成所谓的结合形式,没有完全被抗原或者抗药抗体封闭的单抗药物则称 为游离单抗药物(mAb)或者活性单抗药物(active mAb)。由于一份子单抗药物通常能够结合两分子抗原,因此游离单抗还包括了一价游离(monovalent,还能结合一份子抗原)和二价游离(bivalent, 还能结合两分子抗原)两种形式。在临床前研究阶段我们需要在动物模型体内研究单抗药物的PK行为以确定初次对人用药时 (first in human, FIH)的起始剂量。而在临床研究阶段,我们需要在人群中得到单抗药物的关键PK参数,以及建立PK/PD参数和药物安全性有效性的关联。在大多数情况下,游离单抗药物更直接和药效相关,因为其直接反应了体内抗体药物可以结合抗原的能力。使用LBA方法测量游离单抗一般有两种主要的方法: (1)采用抗原进行捕获,随后使用酶标抗原进行检测,这种方法特异的检测了二价的单抗药物;(2)采用抗原进行捕获,随后使用anti-human的酶标抗体进行检测,这种方法检测了包含一价和二价在内的所有游离单抗药物旧。在使用质谱法进行游离单抗分析时,我们一般也采用抗原捕获的方式12.71。在单抗药物早期研发进行质量分析时,一般需要进行体外的抗原抗体亲和力分析,因此在生物分析阶段该抗原并不难获得,除此之外使用质谱法进行游离单抗分析就不再需要其他特化试剂。 在我们这个案例中,我们以贝伐珠单抗(Bevacizumab)为例建立了在血清基质样本中分析游离单抗药物的工作流程。我们将生物素标记的VEGF165(贝伐珠单抗的目标抗原)固定化在亲和链霉素(Streptavidin, SA)的磁珠上,在血清基质中进行游离贝伐珠单抗的捕获,在酶解步骤我们使用了SMART Digest可溶性胰酶进行磁珠上的快速酶解,该方法通过加热来进行目标蛋白的变性,从而省略了繁琐的尿素变性,还原烷基化,以及后续的固相萃取操作,使 得整个前处理过程可以在4-5小时以内完成,且全程可进行自动化操作。在内标的选择上我们使用了双内标的方式,在免疫富集前加入商品化的鼠抗VEGF165的单克隆抗体,用于提示样本中是否存在游离抗原。而在免疫富集后,酶解时我们加入商品化的重同位素标记的单抗标准品SILumAb K1作为主内标来归一化蛋白酶解和质谱分析时的系统误差。通过这一案例我们建立了在血清基质中测量游离单抗药物的方法开发流程,该流程可用于临床前和临床阶段的研究,且尽可能的减少了对特化试剂的依赖。 样品前处理主要试剂耗材 DynabeadsTM MyOneTM Streptavidin T1 (P/N:65601) SMART Digest M Soluble Trypsin Kit (P/N: 60113-101) Biotinylated Human VEGF165, epitope tag free (Acro Biosystems,P/N: VE5-H8210) ( ActiveMax Human VEGF165 Protein, Tag Free (Acro Biosystems, P/N: VE5-H4210) ) Mouse monoclonal Anti-VEGF 165A antibody [6B7] (Abcam, P/N:ab69479) ( SILuTM Mab K1 - Stable I sotope Labeled Universal mAb Standard(SigmaAldrich, P/N: MSQC6) ) DynaMagTM-2 Magnet (P/N: 12321D) KingFisherTM Duo Prime (P/N: 5400110) 或者KingFisherTM Flex(P/N: 5400630) 磁珠纯化系统 Thermal Mixer多功能恒温震荡仪 (P/N: 13687722)HulaMixerTM Sample Mixer (P/N: 15920D) 标准曲线和内标工作液配置 将Bevacizumab制剂配制在1%BSA/PBS基质中,形成终浓度为1pg/uL的储备液,每个ep管分装100pL,在-80℃长期冻存。在每天实验前,将1ug/uL的Bevacizumab储备液用各种基质(1%BSA/PBS, 替代基质或者人血清)稀释至10pg/mL,随后通过梯度稀释配制出浓度为39.06,78.13,156.25,312.5,625,1250,2500,5000, 10000 ng/mL的标准曲线。Abcam mouse anti-VEGF antibody使用1% BSA/PBS稀释至终浓度为12pg/mL的工作液,分装后在-80℃长期冻存。稳定同位素标记的SILumAb K1内标蛋白按照供应商的说明使用0.1%FA/H2O溶解至0.2pg/uL,随后用0.25% BSA/TBS缓冲液稀释至终浓度为10 pg/mL的工作液,分装后在-80℃长期冻存。Biotinylated HumanVEGF165按照供应商的说明使用ddH2O温和溶解,随后使用BSA/PBS缓冲液稀释成终浓度为0.1pg/pL, BSA终浓度2ug/pL的储备液,分装后在-80℃长期冻存。 样品前处理步骤 ·抗原固定化:取适量的Biotinylated VEGF165抗原储备液,使用2倍体积的0.2% BSA/PBS稀释,成为抗原工作液。将抗原工作液以3:2(v/v)的比例加入加入到Dynabeads Streptavidin磁珠悬液中(下简称SA磁珠),在旋转混合仪上室温温和孵育45分钟,后使用适量0.1%BSA/PBS清洗三次。移去上清后加入0.1%BSA/PBS将固定化抗原的SA磁珠重悬于磁珠初始体积中。 ·目标单抗捕获:将固定化抗原的SA磁珠分装在2.0 mL ep管或者96孔板中,每个孔分装30pL SA磁珠。取60pL样品(或者标曲,质控品)加入10pL Abcam mouse anti-VEGF内标工作液,再加入530pLPBS进行稀释,温和混匀。将上述样品稀释液取500pL加入分装了SA磁珠的ep管中,在旋转混合仪上室温温和孵育90分钟。孵育完后使用500uL 0.1%BSA/TBS清洗3次,移除非特异性结合的蛋白。 。目标单抗酶解:用磁力架移去清洗缓冲液,在每个样品孔中加入185pL SMART Digest buffer, 再加入10uL SILumAb K1内标工作液和5pL SMART Digest可溶胰酶,70℃酶解60分钟。 ·酶解终止:酶解完成后冷却5分钟,将ep管置于磁力架上,移出195uL上清至新的ep管或者96孔板中。高速离心2分钟以去除可能残留的磁珠(96孔板可使用过滤板移除残留磁珠),取出180uL上清。在上清中加入20uL 10%FA/50%ACN以完全终止酶解。随后进样40uL样品用于LC-MS/MS检测。 ( Thermo ScientificTM VanquishTM Binary Flex UHPLC 包含以下组件·System Base Vanquish Flex (P/N VF-S01-A) ) ( ·Binary Pump F (P/NVF-P10-A-01) ) ( · Split Sampler F T (P/N VF-A10-A) ) ( ·Column Compartment H (P/N VH-C10-A) ) ( ·MS Connection Ki t Vanquish (P/N 6720.0405) ) ( ·Vanquish F Pumps 100pL Mixer Set (P/N 6044.5100) ) ( ·Vanquish Split Sampler H T Sample Loop, 100pL (P / N 68 5 0.191 3 ) ) 分离条件 流动相A:0.1%甲酸/水;流动相B:0.1%甲酸/乙腈 ( 色谱柱: T h ermo ScientificTM AcclaimTM Polar A dvantage, 2 .1mm *50mm (P/N: 072622) ) 柱温:50℃, still air 表1.液相色谱梯度 Time (min) Flow rate Flow path %A %B 0.0 0.5 mL/min To waste 95 5 1.4 0.5 mL/min Main path 95 5 1.7 0.5 mL/min Main path 95 5 6.5 0.5 mL/min Main path 65 35 7.0 0.5 mL/min Main path 10 90 8.9 0.5 mL/min Main path 10 90 9.0 0.5 mL/min Main path 95 5 10.5 0.5 mL/min Main path 95 5 质谱条件 仪器 Thermo ScientificTM Fusion Lumos三合一质谱仪 表2.质谱参数 源参数 质谱设置 极性 正离子模式 PRM scan 喷雾电压 3700V S-lens RF 40 鞘气压力 50 Arb 隔离窗口 1.4 Th 辅助器压力 15 Arb 二级分辨率 15,000 反吹气压力 0 Arb 碎裂模式 HCD 雾化温度 300℃ AGC target 1e5 离子传输管温度 320℃ MicroScan 1 Sequence Protein Location Charge Precursormass Quanion Qualion1 lonratio RT(min) NCE Beva SP2 FTFSLDTSK Bevacizumab Heavy Chain[68-76] 2+ 523.265 y7+(797.403) y6+(650.336) 0.293 5.02 24 Beva SP3 VLIYFTSSLHSGVPSR Bevacizumab Light Chain[46-611 3+ 588.322 y142+(775.902) y132+(719.360) 0.863 5.28 20 Murine SP VNSAAFPAPIEK Murineanti-VEGF Heavy Chain318-3291 2+ 622.338 y6+(654.382) y7+(801.450) 0.635 4.35 24 K1_3 DSTYSLSSTLTLSK SILumAb K1 Light Chain174-1871 2+ 755.889 y8+(844.486) y10+(1044.602) 0.803 5.07 23 1.测量总体单抗(mAb,otal)的整体工作流程 不管是采用LBA还是亲和质谱法,使用抗原在基质中捕获游离的单抗药物都是最主流的方法11.6。由于一份子单抗药物通常能够结合两分子抗原,因此游离单抗还包括了一价游离(monovalent, 还能结合一份子抗原)和二价游离(bivalent,还能结合两分子抗原)两种形式。采用亲和质谱法测得的游离抗体药物是包含了一价和二价游离的抗体药物,对应的如果使用LBA方法测量这部分药物则采用抗原进行捕获,随后使用anti-human的酶标抗体进行检测。由于人血清基质中存在大量的内源lgG, 因此anti-human Fc的检测是没有选择性的,方法的选择性完全依靠抗原捕获这一步来提供,这给方法最终的选择性带来了一定的不确定性。而在亲和质谱法中,如果面对的是人血清基质,我们可以选择包含CDR区域的特征肽段来定量,这样方法的选择性能够得到最大程度的保证。在我们的工作流程中,我们使用SA磁珠来固定化生物素标记的抗原,磁珠平台的使用使得整个流程可以通过KingFisher平台来实现方法的自动化。传统的亲和质谱法步骤较为繁琐,包括了目标蛋白洗脱,溶液置换,尿素变性,还原烷基化,过夜酶解和固相萃取除盐等步骤。而在这里我们使用了SMART Digest可溶胰酶,该胰酶经历了工程化的改造,在70度时拥有更高的活性,温度的提升一方面激活了胰酶活性,另一方面使得目标单抗药物变性,得到了非常高的酶解效率。为了简化亲和质谱法的操作流程,之前的一些工作采用了在磁珠上酶解目标蛋白的方式来释放特征肽段。SMART Digest胰酶则和磁珠上酶解有着更好的兼容性,这样我们整个工作流程仅需要四步: (1)室温固定化抗原; (2)室温条件下从基质中富集目标单抗; (3)磁珠清洗过后加入SMART Digest可溶胰酶,升温至70℃进行酶解; (4)加酸终止酶解,质谱分析(图1)。由于SMARTTDigest的酶解效率非常高,因此酶解仅需60分钟,这样整个工作流程可以在4-5小时内完成。 2.免疫富集回收率 VEGF165是VEGF-A最主要的蛋白剪切体,其主要由血管内皮细胞表达和分泌。Bevacizumab通过阻断VEGF165和VEGFR1, VEGFR2的结合来抑制肿瘤血管的生成,从而间接起到抑制肿瘤生长的作用(图2A)。我们首先考察了用SA磁珠固定化生物素标记的VEGF165的载量和方式。采用固定化抗原的磁珠进行富集主要有两种方式,直接富集和间接富集。直接富集即为将抗原首先固定化在磁珠上,随后在基质中富集目标抗体。而间接富集的方式为首先在基质中加入生物素标记的抗原,随后将SA磁珠加入基质将抗原抗体复合物进行捕获,这种方式更适用于抗原抗体亲和力弱或者浓度低的情况。我们将20 pL SA磁珠加入不同含量的抗原,上清中未能结合的抗原经酶解后使用质谱进行检测。结果显示若以生物素标记的肽段为指征, 20pL SA磁珠可对1pg的VEGF165进行近100%的富集。相反,若以不含生物素标记的肽段为指征,则不管抗原的上样量是0.5pg还是1pg,均有超过20%的VEGF165可以在上清中检测到,提示我们该VEGF165抗原的生物素标记效率可能在80%左右。那么这就决定了我们仅能使用直接富集的方法来进行目标单标药物的捕获(图2B)。在后续的实验中,我们将抗原固定化的条件定为使用30uL SA磁珠固定化1.5pg生物素示记VEGF165。随后我们在不同基质中对固定化了抗原的磁珠的载量和富集回收率进行了摸索。在BSA基质中,我们通过监控四条位于不同结构域的肽段来定量上清中未被磁珠捕获的Bevacizumab(图2C),结果发现当BSA基质中含有1ug Bevaci-zumab时,上清中仅有1%的目标单抗未能被标记了抗原的磁珠所捕获(图2D)。同样,在替代基质(4% HSA, 1% human lgG)和人血清中,固定化了VEGF165的磁珠可对20ug/mL的Bevacizumab进行98%左右的高效富集(图3E,样本体积50uL)。由于替代基质和人血清中均含有大量的内源IgG,因此我们在定量上清中的未被磁珠捕获的Bevacizumab时只能选用包含了CDR区域的特征肽段来表征目标单抗的含量(Beva SP2, Beva SP3, 图2C)。 图2.采用抗原捕获游离Bevacizumab。 A. Bevacizumab通过阻断VEGF165和VEGFR来阻断血管内皮细胞增殖的作用机制;B.亲和链霉素磁珠对Biotin标记VEGF165载量的评估;C. 采用质谱法评估Bevacizumab结合效率所使用的特征肽段; D. 在1%BSA基质中考察固定化了VEGF165抗原的磁珠对Bevacizumab进行免疫捕获的载量;E.在不同基质中考察免疫富集回收率 3.洗脱和酶解条件的优化 B 在对洗脱和酶解条件的优化时,我们主要考虑两种流程,一种为传统的将捕获的抗原洗脱后酶解,另一种为直接在磁珠上酶解。通过之前的经验我们知道在对富集完后的小量样品进行酶解时,加入一定含量的BSA辅助酶解会提高酶解的效率,可能是因为阻断了非特异性吸附。因此,我们考察了如下三个条件:(1)使用0.25%FA进行酸洗脱,随后用含有BSA的中和溶液(1M Tris/HCI, pH 8.2)进行中和后酶解;(2)使用含有BSA的0.25%FA进行酸洗脱,随后加入中和溶液(1M Tris/HCI, pH 8.2, 不含BSA)中和后进行酶解;(3)直接在经过清洗的磁珠悬液中加入SMART Digest胰酶和BSA进行酶解。结果显示对于酸洗脱酶解的条件,在洗脱阶段就加入BSA会提升最 4.特征肽段的选择和方法特异性 终目标单抗肽段酶解的得率(图3A)。而直接磁珠上酶解对于Beva-cizumab的两条特征肽段都得到了最高的质谱响应,采用前后加标的实验设计,我们测得整个前处理过程的整体回收率在90%以上(图3A)。除了对目标特征肽段进行PRM的靶向定量,我们还对洗脱组分的酶解肽段进行了一级质谱全扫描的观测,结果发现三种洗脱酶解条件所得到的基质背景响应相似(图3B)。由于我们在酶解时加入了25ug BSA辅助酶解(酶解体系为200pL),因此可见基质背景信号响应较高(图3B),根据之前的经验,若酶解时不加入BSA辅助酶解,那么基质的背景响应约在2-4E9左右。 图4. Bevacizumab特征肽段的挑选和验证。A.抗体CDR区序列变化热点; B. Bevacizumab轻链和重链的特征肽段;C.特征肽段在人血清基质中的特异性Bevacizumab使用固定化VEGF165的磁珠进行免疫捕获后使用Smart Digest胰酶进行磁珠上酶解,并使用PRM检测特征肽段的离子对 该方法可以适用于在动物或人血清基质中检测游离的单抗药物,在面对不同的基质时我们可选择的特征肽段会有所不同。对于动物血清基质,我们可以选择恒定区或可变区的所有肽段作为特征肽段,通过尽可能多的监控各个结构域来达到监控单抗药物体内完整性的目的。而对于人血清基质,尽管抗原的捕获会将其他克隆的内源抗体排除在外,但为了保证在不同个体样本中保证方法的特异性,我 们一般仅选先包含CDR区域的肽段,这也是亲和质谱法优于LBA方法的一个方面。我们选取了四条包含CDR区域的候选肽段进行了方法特异性的考察(图4B),结果在空白基质中四条候选肽段均无响应(图4C)。最后我们在轻链和重链上各选取了一条响应最高的特征肽段来对游离的Bevacizumab进行定量。 A Master Accession Description Coverage[%] Sequence Coverage P02769 Serum albumin OS=Bos taurus GN=ALB PE=1 SV=4 77% C山EEIID 58 385 Murine_mAb_heavy_chain Murine_mAb_heavy_chain 54% ID 12 40 Murine_mAb_light_chain 35% 12| 34 ables Peptide Groups PSMs MS/MS Spectrum Info Abundances-回 Modifications #PSMs Positions in Master Proteins [R].FSGSGSGTDFTLK.[ 2 Murine_mAb_light_chain [67-79] 0 1303.61647 4.709e7 [R].QNGVLNSWTDQDSK[D] 2 Murine_mAb_light_chain [161-174] 0 1591.73469 3.445e7 [R]FSGVPDR.[F] 2 Murine_mAb_light_chain [60-66] 0 777.38898 2.388e7 [K].DSTYSMSSTLTLTK.[D] 6 Murine_mAb_light_chain [175-188] 0 1534.73052 2.175e7 [KDSTYSMSSTLTLTKDEYERIF 3 Murine_mAblight_chain [175-193] 1 2227.00708 2.049e7 [R].FSGVPDRFSGSGSGTDFTLK 4 Murine_mAb_light_chain [60-79] 1 2061.98761 1.929e7 [K]WKIDGSER.[Q] 2 Murine_mAb_light_chain [153-160] 1 990.50032 9.787e6 [R].QNGVLNSWTDQDSKDSTYS 2 Murine_mAb_light_chain [161-193] 2 3799.72393 5.365e6 [R]QNGVLNSWTDQDSKDSTYS| 1 Murine_mAb_light_chain [161-188] 1 3107.44736 2.731e6 B C Vendor2 Partial sequence of mAb light chain SILuMAb_K1VFIFPPSDEQLKSGTASWCLLNNFYPREAKVQNKVDNALQSGNSQESVTEQDSKDSTYSBevacizumabbVFIFPPSDEOLKSGTASVCLLNNFYPREAKVONKVDNALQSGNSQESVTEODSKDSTYSNISTmAb VFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQNKVDNALQSGNSQESVTEQDSKDSTYS北 客业 F*沭北LSSTLTLSKADYEKHKVYACEVTHOGLSSPVTKSFNRGEC SILuMAb K1 218Bevacizumab LSSTLTLSKADYEKHKVYACEVTHOGLSSPVTKSFNRGEC 214K1_3NISTmAbLSSTLTLSKADYEKHKVYACEVTHOGLSSPVTKSFNRGEC 213 8*******书**************宗*: Partial sequence of mAb Heavy chain SILuMAb K1: All lysine and arginine are substitutedwith 13C6, 15N2-lysin and 13C6, 15N4-arginine 图5.内标的选择。A.商品化鼠抗VEGF165单抗的肽图分析结果;B.用于评估商品化鼠抗VEGF165单抗和抗原结合效率的特征肽段在抗体结构中的位置;C.在1%BSA基质中考察商品化鼠抗VEGF165单抗和抗原的结合能力,将上清中未结合的鼠抗VEGF165抗体酶解后用质谱监控特征肽段;D.内标蛋白(SILuMAbK1)和IgG-1类型单抗进行序列比对(展示部分序列),高亮标出的为入选的四条内标肽段进行后续的评估 在使用亲和质谱法测量基质中游离的单抗药物时,我们需要引入内标来对整个分析过程进行归一化。由于我们选择了使用抗原进行游离单抗药物的富集,因此在内标的选择上主要有以下几种可选项: (1)商品化抗该抗原的抗体(其他物种)[10]; (2)抗该抗原的其他单抗药物物; (3)重同位素标记的肽段I11。使用商品化抗抗原的抗体作为内标使用的话可以对整个样品前处理过程(包括免疫富集和酶解)进行归一化,但当基质中存在大量游离抗原时,过量的游离抗原同样会阻断磁珠(标记了抗原的磁珠)对内标抗体的捕获,从而使得内标信号偏离实际值。因此,在我们的工作流程中,我们设计了双内标的系统。在初始样本中,我们加入商品化的鼠抗VEGF的抗体,该抗体作为辅助内标用于评估基质内是否存在过量的游离抗原。而在免疫富集后,目标Bevacizumab酶解前,我们在磁珠悬液中加入重同位素标记的单抗标准品SILumAb K1,将该内标蛋白酶解产生的肽段作为主内标对最终的检测结果进行归一化。在这里我们使用SILumAb K1, 而不是重同位素标记的肽段主要基于以下两个考虑: (1)该重同位素标记的蛋白是一个商业化的标准品,其酶解可产生相当多的肽段,我们只需选择和目标单抗特征肽段保留时间接近的肽段作为内标即可,相比于重同位素标记的肽段,我们减少了对特化试剂的依赖,简化了方法开开流程;(2)选择一个蛋白质而不是重标肽段可以更好的对酶解步骤进行归一化。商品化的鼠抗VEGF抗体其序列不可知,因此我们将鼠单抗标准品的序列以及小鼠uniprot数据库中lgG的轻重链恒定区以及连接区序列提取出来组合成fasta数据库,对该抗体的肽图质谱数据进行搜库,结果可以发现这些商品化的鼠抗体的恒定区都得到了 较好的序列覆盖(图5A,由于我们采用了SMART Digest方法,因此 含有半胱氨酸的肽段无法覆盖)。随后我们在BSA基质对几个供应商的鼠抗VEGF抗体进行了亲和力的筛选,最终选择了其中一个鼠抗VEGF单抗,该单抗产品中80%以上的抗体可以结合在固定化了VEGF165的磁珠上(图5B,图5C)。随后我们将鼠抗VEGF单抗和SILumAb K1标准品掺入BSA基质,酶解后进行质谱分析和参数优化,建立了内标肽段的数据库(图5D,表4)。该数据库中应当包含特征肽段的序列,离子对,优化后的碰撞能,保留时间,质谱峰面积和在血清基质空白中的基质干扰响应。我们采用SILumAbK1的酶解肽段作为主内标来对最终的检测结果进行归一化,因此对于SILumAb K1我们选择了和Bevacizumab特征肽段保留时间接近的酶解肽段作为最终的主内标肽段(表3)。而鼠抗VEGF单抗作为辅助内标,其作用为对基质内是否存在过量的游离抗原进行评估,因此我们选择了保留时间稍远的肽段,以保证Bevacizumab特征肽段的扫描时间,获得更高的灵敏度(表3)。我们对选定的内标肽段均进行了特异性的评估,结果显示内标肽段未对Bevacizumab特征肽段的检测造成干扰,且基质背景也未对内标肽段的信号造成干扰(图6)。最后,为了评估我们的方法检测的是否是游离单抗以及辅助内标是否能指征基质内的过量游离抗原,我们进行了抗原干扰实验。我们在人血清基质中分别掺入Opg/mL, 2ug/mL或者20pg/mL的VEGF165(未被生物素标记),随后在各干扰基质中掺入1ug/mL Bevacizumab和相应内标,按照既定的实验步骤进行检测。结果显示随着血清中游离VEGF165的增加,我们检测到的游离Bevacizumab的浓度显著降低(图8B),对于含有20ug/mL VEGF抗原干扰的基质,辅助内标和主内标的比值亦和既定值发生了明显的偏离(图8C)。 表4.主要内标(SILumAb K1)和辅助内标(Murine anti-VEGF抗体)的候选内标肽段数据库 IS type Sequence Modifi- cation Protein Location Precursor mass Quan ion Slens RF RT (min) NCE Area Matrix Blank MurineSP2 Access NTQPIMDTDGSYFVYSK Abcam Heavy Chain388-4041 983.448(2+) y14+(1622.740) 40 5.23 24 3.67E+06 0 MurineSP1 orial VNSAAFPAPIEK mouse anti- VEGF mAb Heavy Chain318-3291 622.338(2+) y6+(654.382) 40 4.32 24 3.51E+06 0 K1_1 DSLYLQMN SLR 13C,15N-R Heavy Chain [76-86] 675.342 (2+) y7+ (871.469) 40 5.25 26 2.02E +06 0 EVQLVESGG Heavy Chain 946.509 y6+ 1.53E K1_2 Primary GLVQPGGSLR 1C,15N-R SILumAb K1 [1-19] (2+) (596.339) 40 4.98 22 +06 0 K1_3 DSTYSLSS TLTLSK 13C,15N,-K Light Chain 174-1871 755.889 (2+) y8+ (844.486) 40 5.06 23 1.97E +06 0 K1_4 FNWYVDGV EVHNAK 1C,15N,-K Heavy Chain 279-2921 562.610 (3+) y122+ (712.856) 40 5.12 20 3.13E +06 0 图6.主要内标(SILumAb K1)和辅助内标(鼠抗VEGF165抗体)的特异性。人血清基质中加入图示浓度的Bevacizumab, SILumAb K1和鼠抗VEGF165抗体,观察目标和内标离子对通道以考察内标肽段的特异性 图7.基质效应评估。各种基质在样品处理后加入不同浓度的Bevacizumab和鼠抗VEGF抗体,后用PRM检测特征肽段的质谱响应。 在配制标准曲线时,我们考虑了以下两个问题: (1)该标准曲线是否可以使用于所有物种的血清基质; (2)如果使用血清作为基 质配制标曲,血清中是否存在游离抗原或者抗药抗体从而使得标曲的信号偏离实际值。对于第二的问题,我们通常可以对基质中的游离抗原和抗药抗体进行检测来回答,但这过于繁琐。在这里我们考虑使用替代基质(例如BSA基质或者替代血清)来配制标准曲线。由于我们进行了高度特异的免疫富集,理论上影响离子化的物质都会被洗去,为了进一步确证各种基质的基质效应,我们对BSA基质,替代人血清(4% HSA, 1% human lgG)和实际人血清进行了评估。三种基质经历了免疫富集后分别加入Bevacizumab和鼠抗VEGF单抗,酶解后对特征肽段进行检测。结果发现各浓度的Bevacizumab和内标抗体在不同的基质中都表现出高度一致的质谱响应(图7),提示我们可以使用替代基质来配制标曲。对各种基质配制的标曲进行检测我们发现同一浓度的Bevacizumab在不同的基质中其信号响应(这里以特征肽段/内标肽段峰面积作为指标)亦高度一致(图8A,表5),进一步确认了我们可以使用替代基质配制标曲来对不同物种血清基质中的游离Bevacizumab进行检测。 Sequence Location Linear range r, linear fit,FPrimary 1/x² weightISCV% Accessorial ISCV% Beva SP2 FTFSLDTSK Heavy Chain 39.06-10,00068-76] ng/mL 0.999 3.19 2.33 Beva SP3 VLIYFTSSLHSGVPSR Light Chain46-611 In 39.06-10,000ng/mL 0.999 3.19 2.33 ABevacizumab SP2: FTFSLDTSK Bevacizumab SP3: VLIYFTSSLHSGVPSR Target mAb in serum (ug/mL) Target mAb in serum (ug/mL) C 图8.人血清中检测游离Bevacizumab的线性和干扰实验。A. Bevacizumab 特征肽段SP2和SP3的线性,标准曲线浓度从39.063- 10,000ng/mL; B. 在人血清中掺入VEGF165作为游离抗原进行干扰实验,测量游离Bevacizumab的浓度, Mock serum: VEGF Oug/mL, Serum spike L: VEGF 2ug/mL, Serum spike H:VEGF 20ug/mL; C, 在人血清中掺入VEGF165作为游离抗原进行干扰实验,观察两个内标之间的比例 在实验流程设计之初,我们一个很重要的考虑即为尽量减少方法对特化试剂的依赖,使得方法开发可以遵循固定的流程。如果不考虑使用辅助内标来评估基质中可能的过量游离抗原,那我们整个实验流程仅需要生物素标记的抗原这一个特化试剂。在单抗药物早期研 发进行质量分析时,一般需要进行体外的抗原抗体亲和力分析,因此在生物分析阶段该抗原并不难获得,而抗原的生物素标记亦是一个高度范式化的步骤,一般使用NHS-Biotin (P/N: 20217) 即可获得非常高效的标记。这样我们这个方法开发流程主要包括以下几个步: 图9.采用免疫质谱法检测血清中游离单抗药物的方法开发流程。 结论 这个工作中,我们建立了基于亲和质谱法测量血清基质中游离单抗药物的流程,并以贝伐珠单抗为例展示了方法的性能和结构化开发流程。我们的方法具有简单快速,可自动化,对特化试剂依赖程度低且方法开发流程化的优点。结合我们之前的工作I12-15],我们建立了单抗药物生物分析的完整解决方案体系。我们的方案体系对于早期研发过程中的候选抗体筛选,临床前研究中的PK、ADME以及生物转化研究,临床阶段的PK研究都提供了强有力的平台支撑,助力药企和CRO对抗体药物的成药性研究。 ( 1 . Jenkins, R., et al . , Recommendations for validation of LC-MS/MSbioanalytical methods for protein biotherapeutics. AAPS J , 2015.17(1): p. 1-16. ) ( 2. Heudi, O ., e t al., Towards absolute quantification of th e rapeuticmonoclonal antibody in serum by LC-MS/MS using isotope-labe-led antibody standard and protein cleavage isotope di l ution m a ssspectrometry. Anal Chem, 2008.80(11): p. 4 200-7. ) ( 3.Yuan, L . , et al., Simple and efficient digestion of a monoclonal an-tibody in serum u s ing pellet digestion: comparison with tra d itionaldigestion methods in L C-MS/MS bioanalysis. B i oanalysis, 2 012.4(24): p.2887-96. ) ( 4. Mekhssian, K . , J.N. Mess, an d F. Ga r ofolo, Application of high-resolution MS in the quantification of a therapeutic m onoclonalantibody in human plasma. Bi o analysis, 2014. 6(13): p. 1767-79. ) ( 5. Nguyen, T., et al., Investigating t h e utility of minimized sample pre-paration and h igh-resolution mass spectrometry f o r quantificationof monoclonal antibody drugs. J Pharm Biomed Anal, 2018. 159: p. 384 - 392. ) ( 6. Lee, J.W., et al., Bioanalytical approaches to quantify "total"and"free" therapeutic antibodies a n d their targets: technical challen-ges and PK/PD applications over the course of drug development. AAPS J, 2011.13(1):p.99-110. ) ( 7 . Yang, Y., e t a l., Development and validation of a targeted affinity-enrichment a nd LC-MS/MS proteomics approach for the thera-peutic m onitoring of adalimumab. C l in Chim Acta, 2018. 48 3 : p. 308-314. ) ( 8. Lanshoeft, C., O. Heudi, and S . Cianferani, SMART Digest com-pared with pellet digestion for analysis of human immunoglobulinG1 in rat serum by liquid chromatography tandem mass spectro-metry. Anal Biochem, 2016.501: p. 23-5. ) ( 9. L i , H., et al., Simultaneous analysis of multiple m onoclonal antibo-dy biotherapeutics by L C-MS/MS method in ra t plasma followingcassette-dosing. AAPS J, 2013 . 1 5 (2): p. 3 37-46. ) ( 10. Dubois, M ., et al., Immunopurification and m a ss spectrometricquantification of the active form of a chimeric therapeutic antibo-dy in human serum. Anal C h em, 20 0 8. 80(5): p. 1737-45. ) ( 11. Fernandez O c ana, M. , et al . , Clinical pharmacokinetic assess-ment o f an anti-MAdCAM monoclonal a n tibody therapeutic byLC-MS/MS. Anal Chem, 2012.84(14): p. 5959-67. ) ( 12. Jiashu Tang, X.Z., Yue Zhou, Min Du, A fas t and simple immuno-mass s p ectrometry m e thod for pr e clinical b ioanalysis for lgG1mAb. 2020: ThermoFisher Application Note 73684. ) ( 13. Kwasi Antwi, A . R., U r ban A. Ki e rnan, and Eric E. Nie d erkofler, Bioanalysis of Intact Therapeutic Monoclonal Antibodies fr o mNon-Human P r imates U s ing MSIA D.A.R.T.’ S Technology. 2017: APPNOTEMSIAPrimate0717. ) ( 14 . Tang, J., 基于沉淀酶解法的IgG-1类型单克隆抗体药物临床前生物分析的通用方法.2020: T hermoFisher Application Note 20059. ) ( 15. Tang, J., 基于亲和质谱法的通用方法测定临床样本中的总体单 克隆抗体药物.2021: ThermoFisher Application Note 21021. ) 生物分析对于生物大分子药物的早期研发,临床前研究乃至临床研究阶段都具有非常重要的意义。为了提供药代动力学(pharmacokinetics,PK), 药效动力学(pharmacodynamics, PD)和毒动学(toxicokinetics, TK)所需的时间序列数据,我们对在生物基质中测定生物大分子药物浓度的准确性,灵敏度,选择性和通量均提出了非常高的要求。
确定





还剩9页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《血清中游离贝伐珠单抗检测方案(液相色谱仪)》,该方案主要用于全血/血清/血浆中生化检验检测,参考标准--,《血清中游离贝伐珠单抗检测方案(液相色谱仪)》用到的仪器有Vanquish™ Duo UHPLC Systems
推荐专场
相关方案
更多
该厂商其他方案
更多
















