针对于水产品中大环内酯类药物的检测,GB 31660.1-2019采用液相色谱-质谱联用的方法对大环内酯进行了定性和定量的测定。试样中大环内酯类药物的残留经乙腈提取,正己烷除脂、中性氧化铝柱净化,液相色谱-串联质谱法测定,然后采用外标法定量。
本方法参考了上述国标的前处理过程,采用中性氧化铝固相萃取柱净化目标物,洗脱目标物后浓缩并复溶,经液相色谱-质谱/质谱联用检测水产品中9种大环内酯类药物的残留量。
方案详情

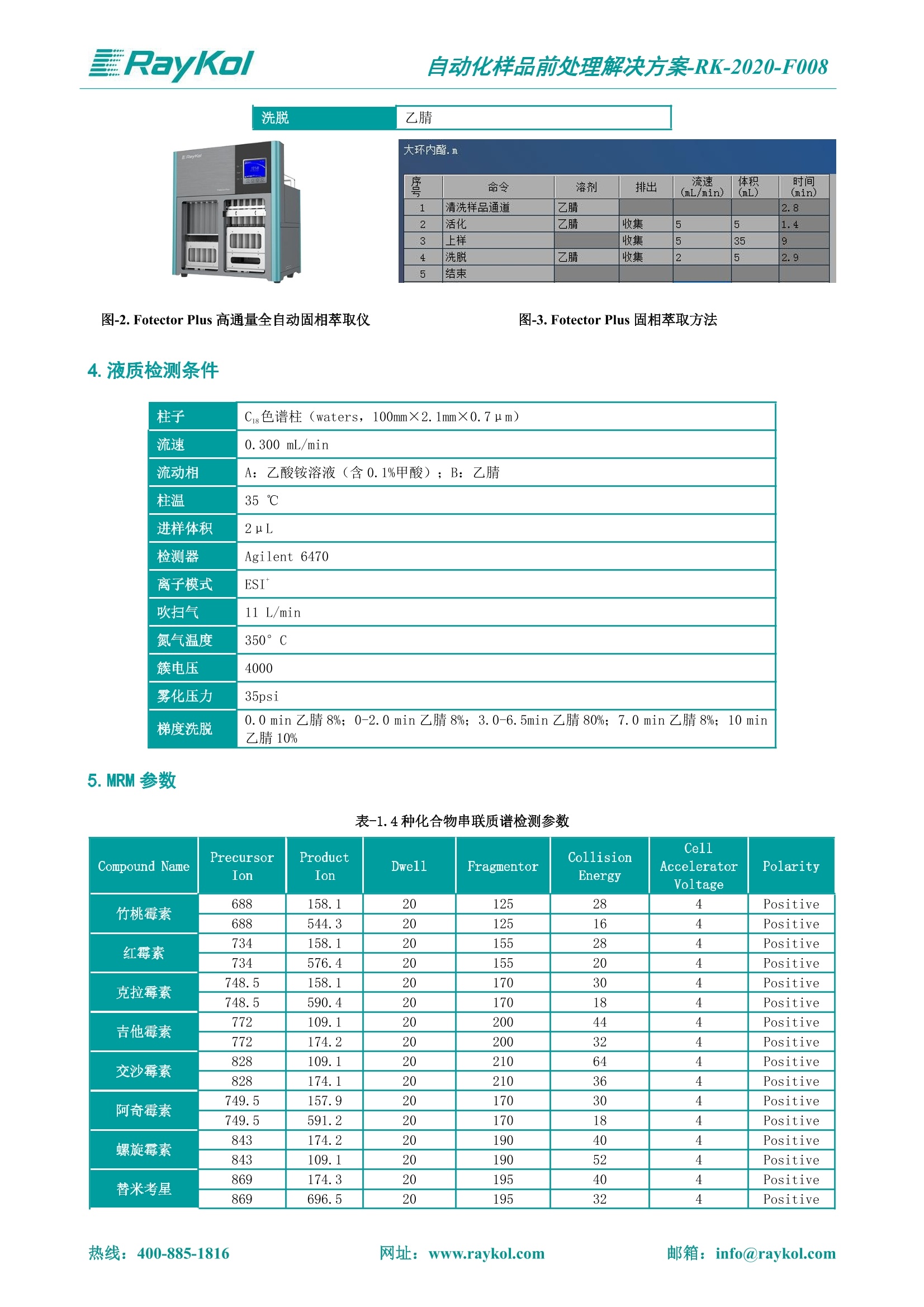
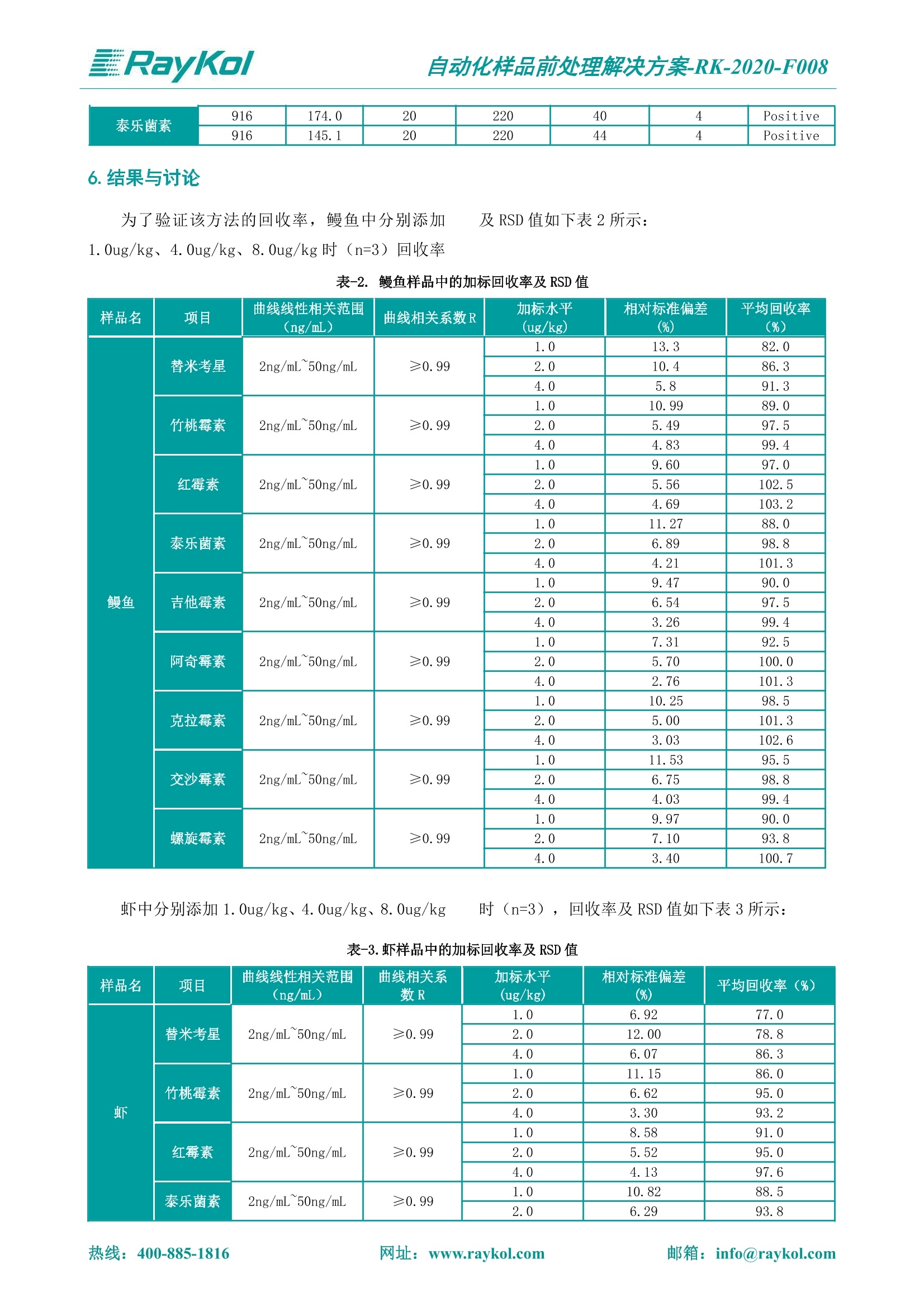
自动化样品前处理解决方案-RK-2020-F008 解决方案 水产品中大环内酯类药物残留量的测定 关键字 全自动固相萃取;高效液相色谱-串联质谱;大环内酯 介绍 对于大环内酯类药物的检测有多个国标。针对于水产品中大环内酯类药物的检测,GB 31660.1-2019采用液相色谱-质谱联用的方法对大环内酯进行了定性和定量的测定。试样中大环内酯类药物的残留经乙腈提取,正己烷除脂、中性氧化铝柱净化,液相色谱-串联质谱法测定,最后采用外标法定量。 图-1.阿奇霉素Azithromycin 图-2.克拉霉素Clarithromycin 图-3.吉他霉素Kitasamycin 图-4.交沙霉素Josamycin 图-5.红霉素Erythromycin 图-6.螺旋霉素Spiramycin 图-7.泰乐菌素Tylosin 图-8.竹桃霉素Oleandomycin 图-9.替米考星Tilmicosin 本方法参考了上述国标的前处理过程,采用中性氧化铝固相萃取柱净化目标物,洗脱目标物后浓缩并复溶,经液相色谱-质谱/质谱联用检测水产品中9种大环内酯类药物的残留量。 1.仪器和耗材才 Raykol Fotector Plus 高通量全自动固相萃取仪 mL, RC-204-16906) 甲醇(HPLC) Raykol Auto Prep 200 全自动液体样品处理工作站 乙腈(HPLC) 正己烷(HPLC) Raykol AH-30全自动均质器 乙腈饱和正己烷 Raykol AutoEVA-20Plus 全自动平行浓缩仪 0.05 mol/L 乙酸铵溶液:称取0.77g无水乙酸铵溶解于200 mL水中 高效液相色谱 (HPLC) Agilent 1290,质谱检测器(MS) Agilent 6470或相当 中性氧化铝固相萃取柱 (RayCure AL-N, 2g/6 定容液:将20mL乙腈与80 mL 乙酸铵溶液混合可得。 2.标准曲线配制 将0.1 Hg/mL 的混合标准储备液取出,于室温平衡后用 Auto Prep 200 全自动液体样品处理工作 站配成浓度为2.5、5.0、10.0、20.0、50.0 Hg/L的基质工作曲线。 3.品制备 鲜活水产品 称取5.0g已制备好的鳗鱼和虾样品于50 mL塑料离心管中,加入20 mL 乙腈,用 AH-30全自动均质器以10000 r/min 的速度匀浆耳取30s并洗涤刀头,4000 r/min离心5 min, 上清液转移至睿净化 先将中性氧化铝柱安装在睿科 Fotector Plus高通量全自动固相萃取仪中,用5mL乙腈进行活化,然后吸取备用液过柱,用乙腈5mL对柱子进行洗脱,收集洗脱液。在洗脱液中加入异丙醇4ml,使用睿科 AutoEVA-20Plus 全自动平行浓缩仪中固相萃取净化条件 科Fotector Plus 80 mL 玻璃试管中;残渣加入乙腈后再提取一次,合并上清液至80mL 玻璃试管中,摇匀备用。 40℃氮吹至干。后加入定容液2 mL 溶解残余物,再加乙腈饱和正己烷2mL, 转至5mL离心管中进行涡旋并离心,取下清液经滤膜过滤后供液相色谱-质谱/质谱测定。具体的固相萃取方法见图-3。 图-3. Fotector Plus 固相萃取方法 4.液质检测条件 柱子 Cg色谱柱 (waters, 100mm×2.1mm×0.7m) 流速 0.300 mL/min 流动相 A:乙酸铵溶液(含0.1%甲酸);B:乙腈 柱温 35℃ 进样体积 2uL 检测器 Agilent 6470 离子模式 ESI 吹扫气 11 L/min 氮气温度 350°C 簇电压 4000 雾化压力 35psi 梯度洗脱 0.0 min 乙腈 8%; 0-2.0 min 乙腈8%; 3.0-6.5min 乙腈80%; 7.0 min 乙腈 8%; 10 min 乙腈10% 5.MRM 参数 表-1.4种化合物串联质谱检测参数 Compound Name Precursor Ion Product Ion Dwell Fragmentor Collision Energy Cell Accelerator Voltage Polarity 竹桃霉素 688 158.1 20 125 28 4 Positive 688 544.3 20 125 16 4 Positive 红霉素 734 158.1 20 155 28 4 Positive 734 576.4 20 155 20 4 Positive 克拉霉素 748.5 158.1 20 170 30 4 Positive 748.5 590.4 20 170 18 4 Positive 吉他霉素 772 109.1 20 200 44 4 Positive 772 174.2 20 200 32 4 Positive 交沙霉素 828 109.1 20 210 64 4 Positive 828 174.1 20 210 36 4 Positive 阿奇霉素 749.5 157.9 20 170 30 4 Positive 749.5 591.2 20 170 18 4 Positive 螺旋霉素 843 174.2 20 190 40 4 Positive 843 109.1 20 190 52 4 Positive 替米考星 869 174.3 20 195 40 4 Positive 869 696.5 20 195 32 4 Positive 泰乐菌素 916 174.0 20 220 40 4 Positive 916 145.1 20 220 44 4 Positive 6.结果与讨论 为了验证该方法的回收率,鳗鱼中分别添加1.0ug/kg、4.0ug/kg、8.0ug/kg时 (n=3)回收率 及 RSD 值如下表2所示: 表-2.鳗鱼样品中的加标回收率及 RSD 值 样品名 项目 曲线线性相关范围(ng/mL) 曲线相关系数R 加标水平 (ug/kg) 相对标准偏差 (%) 平均回收率 (%) 鳗鱼 替米考星 2ng/mL 50ng/mL ≥0.99 1.0 13.3 82.0 2.0 10.4 86.3 4.0 5.8 91.3 竹桃霉素 2ng/mL~50ng/mL ≥0.99 1.0 10.99 89.0 2.0 5.49 97.5 4.0 4.83 99.4 红霉素 2ng/mL~50ng/mL ≥0.99 1.0 9.60 97.0 2.0 5.56 102.5 4.0 4.69 103.2 泰乐菌素 2ng/mL~50ng/mL ≥0.99 1.0 11.27 88.0 2.0 6.89 98.8 4.0 4.21 101.3 吉他霉素 2ng/mL~50ng/mL ≥0.99 1.0 9.47 90.0 2.0 6.54 97.5 4.0 3.26 99.4 阿奇霉素 2ng/mL~50ng/mL ≥0.99 1.0 7.31 92.5 2.0 5.70 100.0 4.0 2.76 101.3 克拉霉素 2ng/mL~50ng/mL ≥0.99 1.0 10.25 98.5 2.0 5.00 101.3 4.0 3.03 102.6 交沙霉素 2ng/mL~50ng/mL ≥0.99 1.0 11.53 95.5 2.0 6.75 98.8 4.0 4.03 99.4 螺旋霉素 2ng/mL~50ng/mL ≥0.99 1.0 9.97 90.0 2.0 7.10 93.8 4.0 3.40 100.7 虾中分别添加1. 0ug/kg、4.0ug/kg、8.0ug/kg 时(n=3),回收率及 RSD 值如下表3所示: 表-3.虾样品中的加标回收率及 RSD 值 样品名 项目 曲线线性相关范围(ng/mL) 曲线相关系 数R 加标水平 (ug/kg) 相对标准偏差 (%) 平均回收率(%) 虾 替米考星 2ng/mL 50ng/mL ≥0.99 1.0 6.92 77.0 2.0 12.00 78.8 4.0 6.07 86.3 竹桃霉素 2ng/mL~50ng/mL ≥0.99 1.0 11.15 86.0 2.0 6.62 95.0 4.0 3.30 93.2 红霉素 2ng/mL 50ng/mL ≥0.99 1.0 8.58 91.0 2.0 5.52 95.0 4.0 4.13 97.6 泰乐菌素 2ng/mL~50ng/mL ≥0.99 1.0 10.82 88.5 2.0 6.29 93.8 4.0 4.38 94.4 吉他霉素 2ng/mL 50ng/mL ≥0.99 1.0 11.78 87.5 2.0 5.08 92.5 4.0 3.32 93.2 阿奇霉素 2ng/mL~50ng/mL ≥0.99 1.0 9.43 97.5 2.0 4.68 97.5 4.0 3.54 98.8 克拉霉素 2ng/mL~50ng/mL ≥0.99 1.0 8.32 99.0 2.0 4.74 98.8 4.0 2.18 98.2 交沙霉素 2ng/mL~50ng/mL ≥0.99 1.0 9.50 89.5 2.0 5.41 92.5 4.0 4.13 91.9 螺旋霉素 2ng/mL~50ng/mL ≥0.99 1.0 7.21 100.0 2.0 7.64 98.8 4.0 9.03 101.3 由表2和表3可知,鳗鱼和虾样品整体的回收率在70-110%之间, RSD<15%。说明该方法能够很 7.总结 本文采用 AH-30 全自动均质器搭配 FotectorPlus 高通量全自动固相萃取仪,结合AutoEVA-20Plus 全自动平行浓缩仪及Auto Prep 200 全自动液体样品处理工作站优化建立水产品中大环内酯类药物残留量的测定前处理解决方案。 AH-30全自动均质器可取代手动均质的过程,快速完成样品均质; Fotector Plus 高通量全自动固相萃取仪采用全自动操作,可以排除人员操作带来的误差,从活化到上样、洗脱一步到位,六通道同时进行。睿科 AH-30全自动均质器,密封式设计防止有机溶剂挥发;每次均质完成后自动进行刀头 全自动液体样品处理工作站标液配制 全自动均质器均质 高通量全自动固相萃取仪净化 全自动平行浓缩仪浓缩 RayKol 睿科集团股份有限公司 RayKol Group Corp., Ltd. 网址: www.raykol.com 电话:400-885-1816 邮箱: info@raykol.com 本文中的信息、说明和技术指标如有变更,恕不另行通知 @睿科集团股份有限公司 2020年5月版 邮箱: info@raykol.com热线:址:www.raykol.com 邮箱: info@raykol.com网址:www.raykol.com热线: 针对于水产品中大环内酯类药物的检测,GB 31660.1-2019采用液相色谱-质谱联用的方法对大环内酯进行了定性和定量的测定。试样中大环内酯类药物的残留经乙腈提取,正己烷除脂、中性氧化铝柱净化,液相色谱-串联质谱法测定,然后采用外标法定量。本方法参考了上述国标的前处理过程,采用中性氧化铝固相萃取柱净化目标物,洗脱目标物后浓缩并复溶,经液相色谱-质谱/质谱联用检测水产品中9种大环内酯类药物的残留量。
确定



还剩4页未读,是否继续阅读?
睿科集团股份有限公司为您提供《水产品中大环内酯类药物残留量检测方案(固相萃取仪)》,该方案主要用于水产品中兽药残留检测,参考标准--,《水产品中大环内酯类药物残留量检测方案(固相萃取仪)》用到的仪器有睿科Fotector Plus高通量全自动固相萃取仪、睿科AH-40全自动均质器、睿科 Auto Prep 200全自动液体样品处理工作站
推荐专场
该厂商其他方案
更多
























