方案详情
文
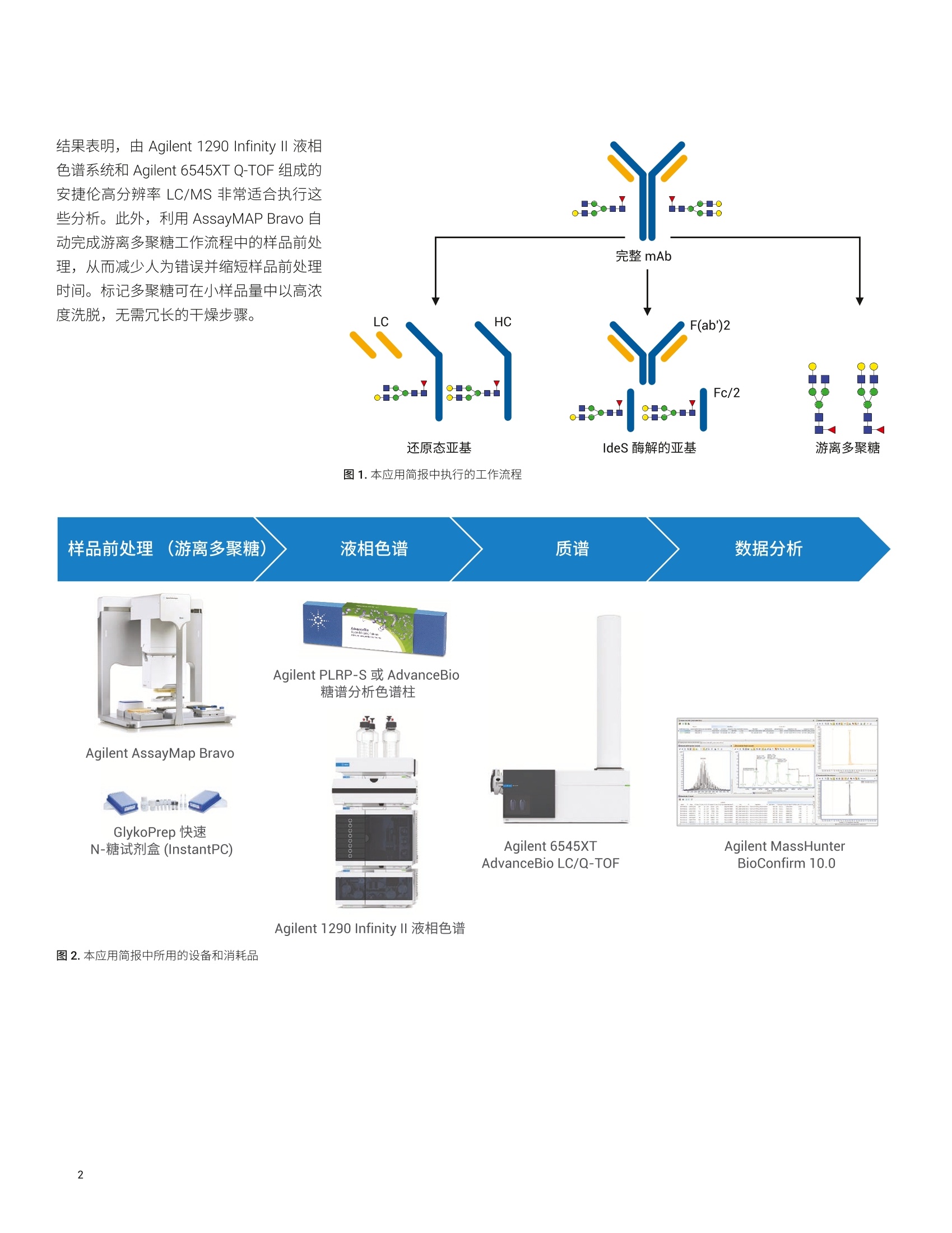
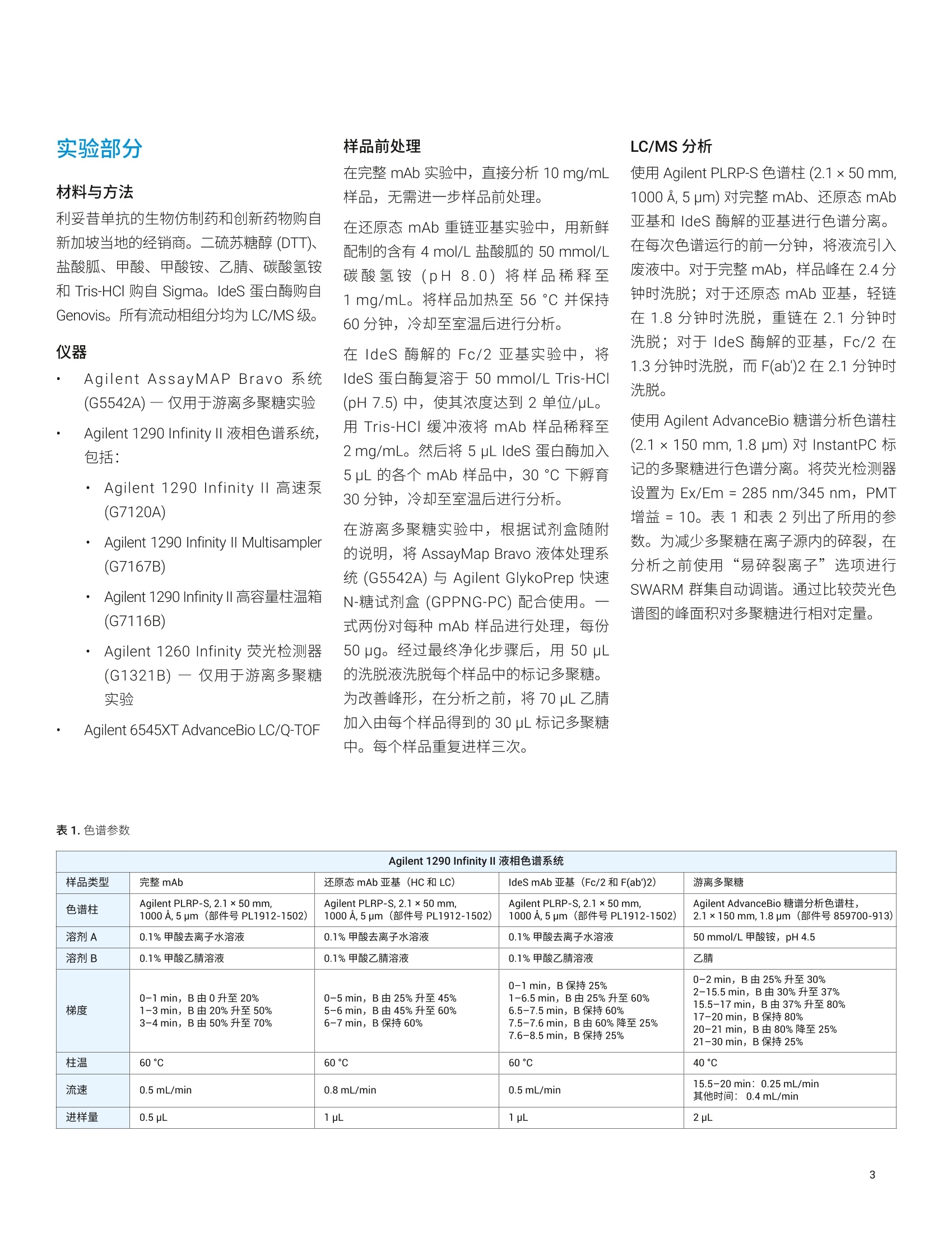
本应用分析了两种利妥昔单抗生物仿制药的完整质量数、亚基质量数和糖基化,并将它们与创新药物分子进行了比较。我们使用四种不同的工作流程进行分析:(i) 完整 mAb,(ii) 还原态亚基,(iii) IdeS 酶解的亚基,以及 (iv) 游离多聚糖。在这些工作流程中,样品前处理时间各不相同,有的无需样品前处理(完整 mAb),有的需要大约三个小时(游离多聚糖)。包含更多样品前处理步骤的工作流程的优势通常在于对低丰度多聚糖组分具有更高的灵敏度,从而提高了相应技术的分析能力。结果表明,由 Agilent 1290 Infinity II 液相色谱系统和 Agilent 6545XT Q-TOF 组成的安捷伦高分辨率 LC/MS 非常适合执行这些分析。此外,利用 AssayMAP Bravo 自动完成游离多聚糖工作流程中的样品前处理,从而减少人为错误并缩短样品前处理时间。标记多聚糖可在小样品量中以高浓度洗脱,无需冗长的干燥步骤。
方案详情

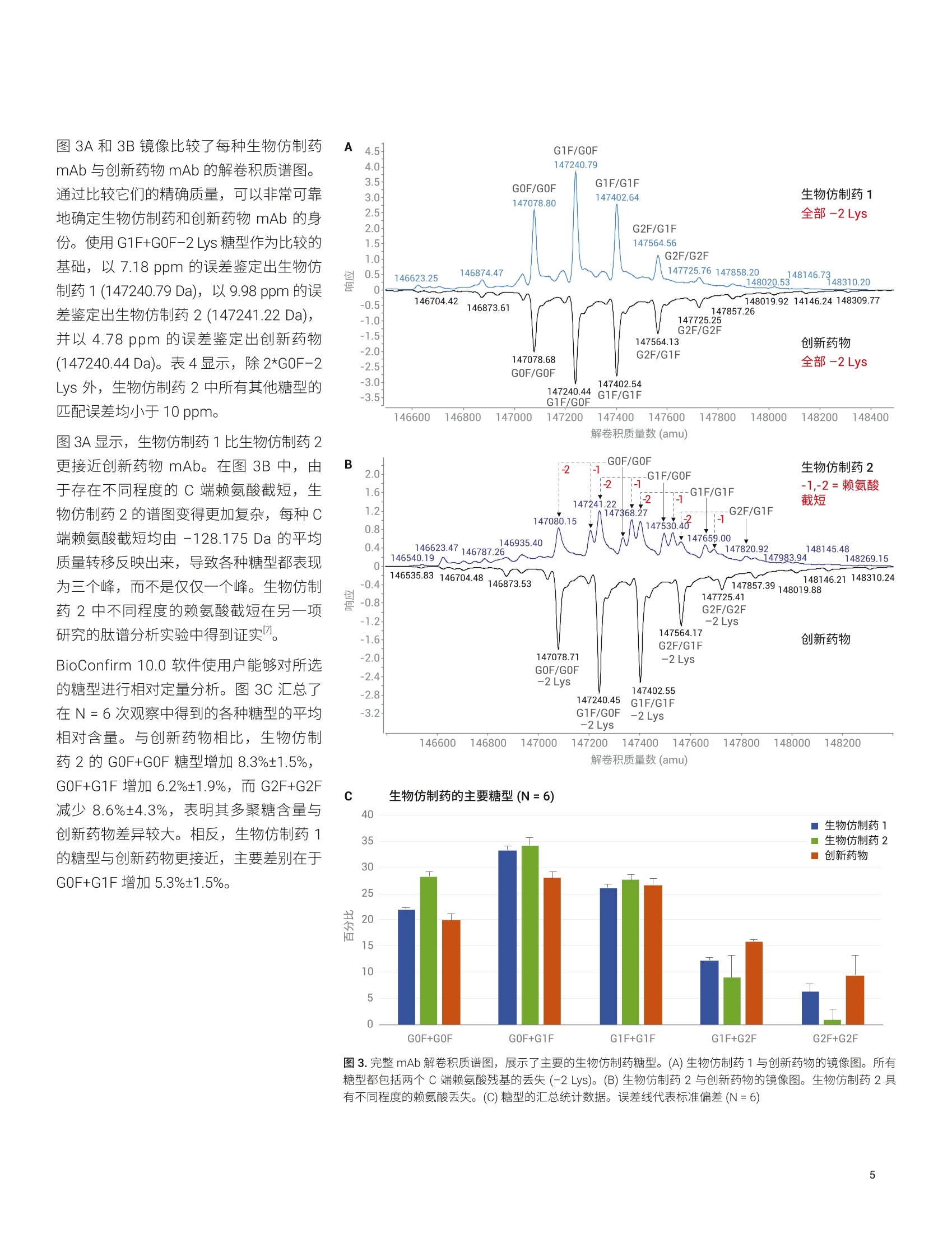
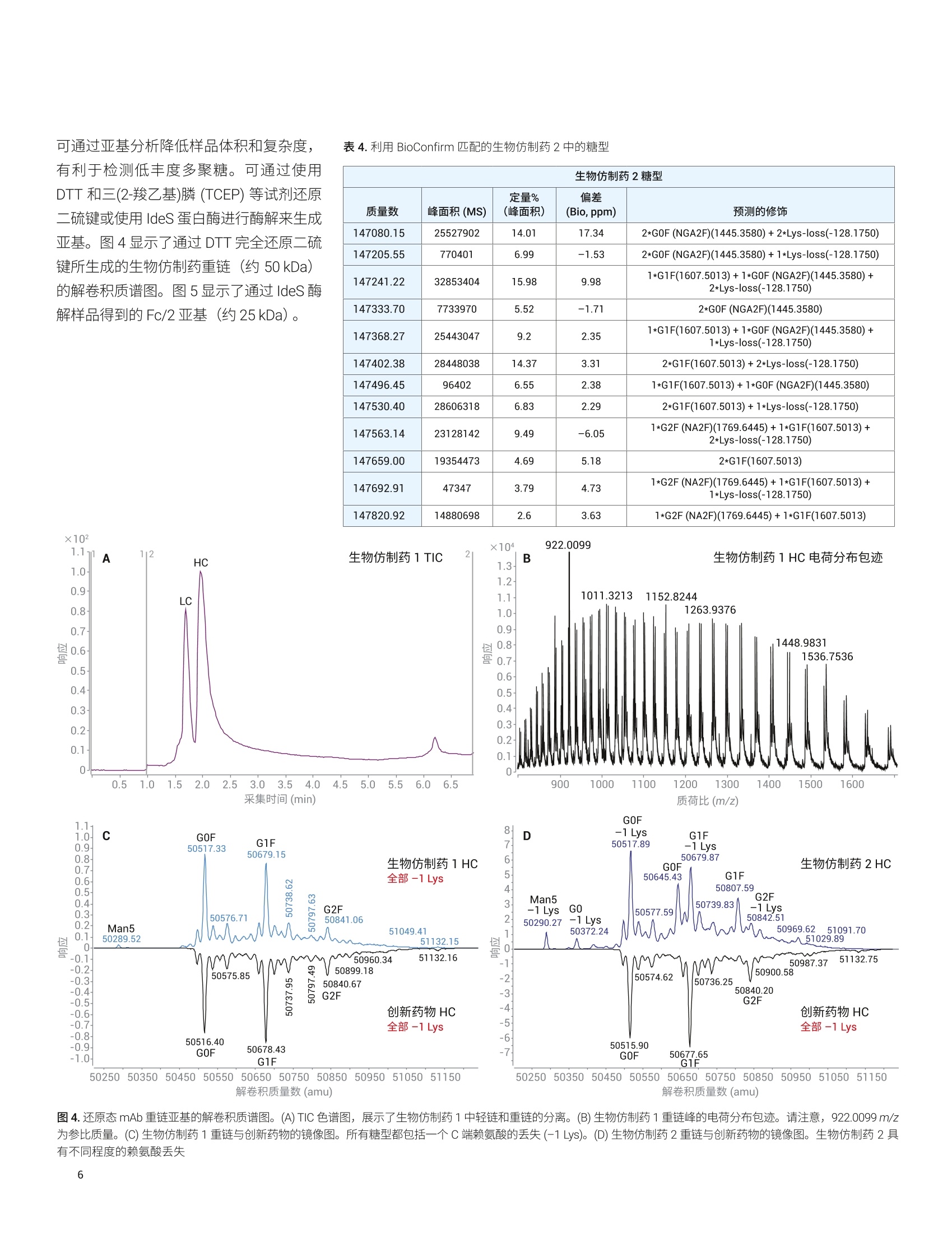
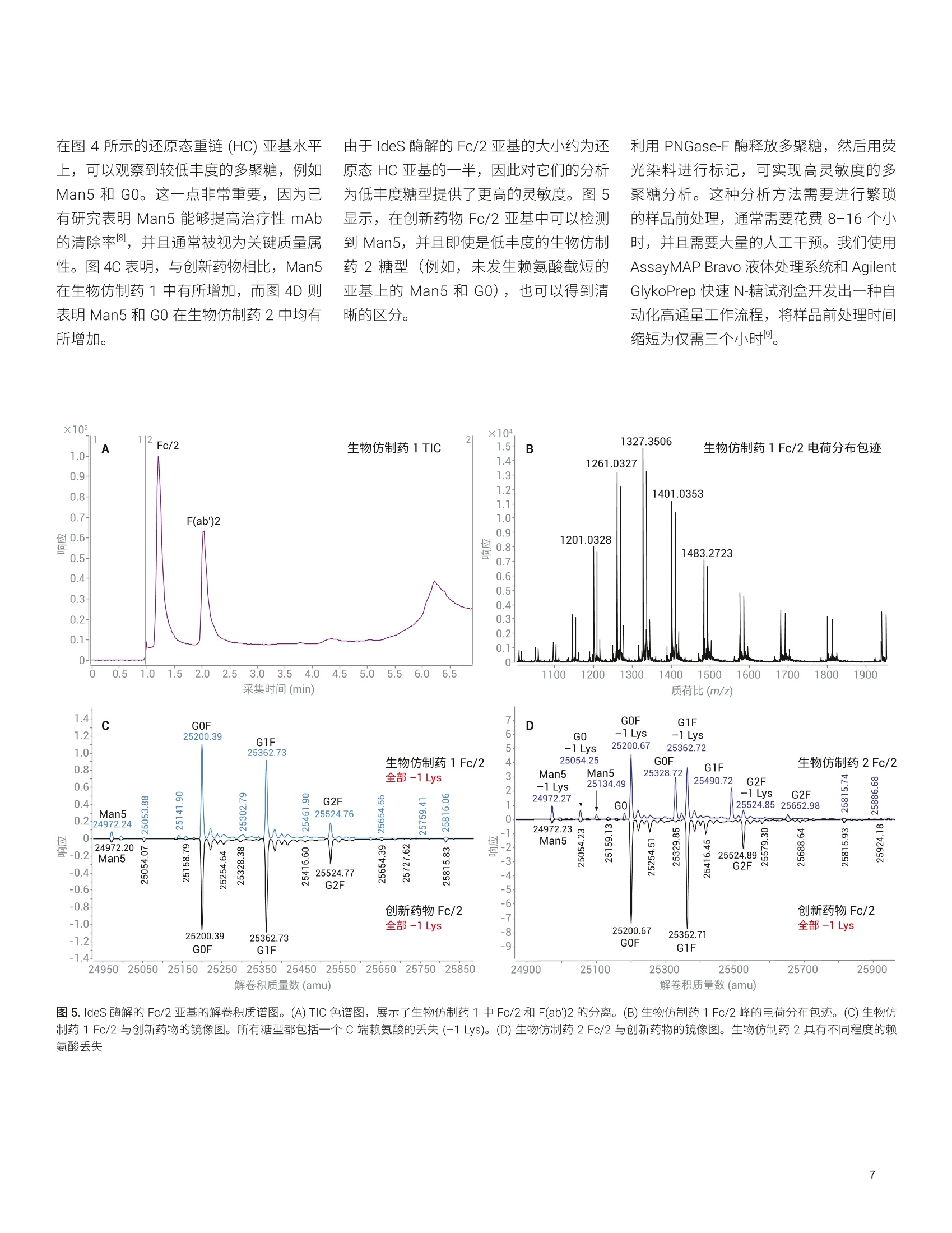
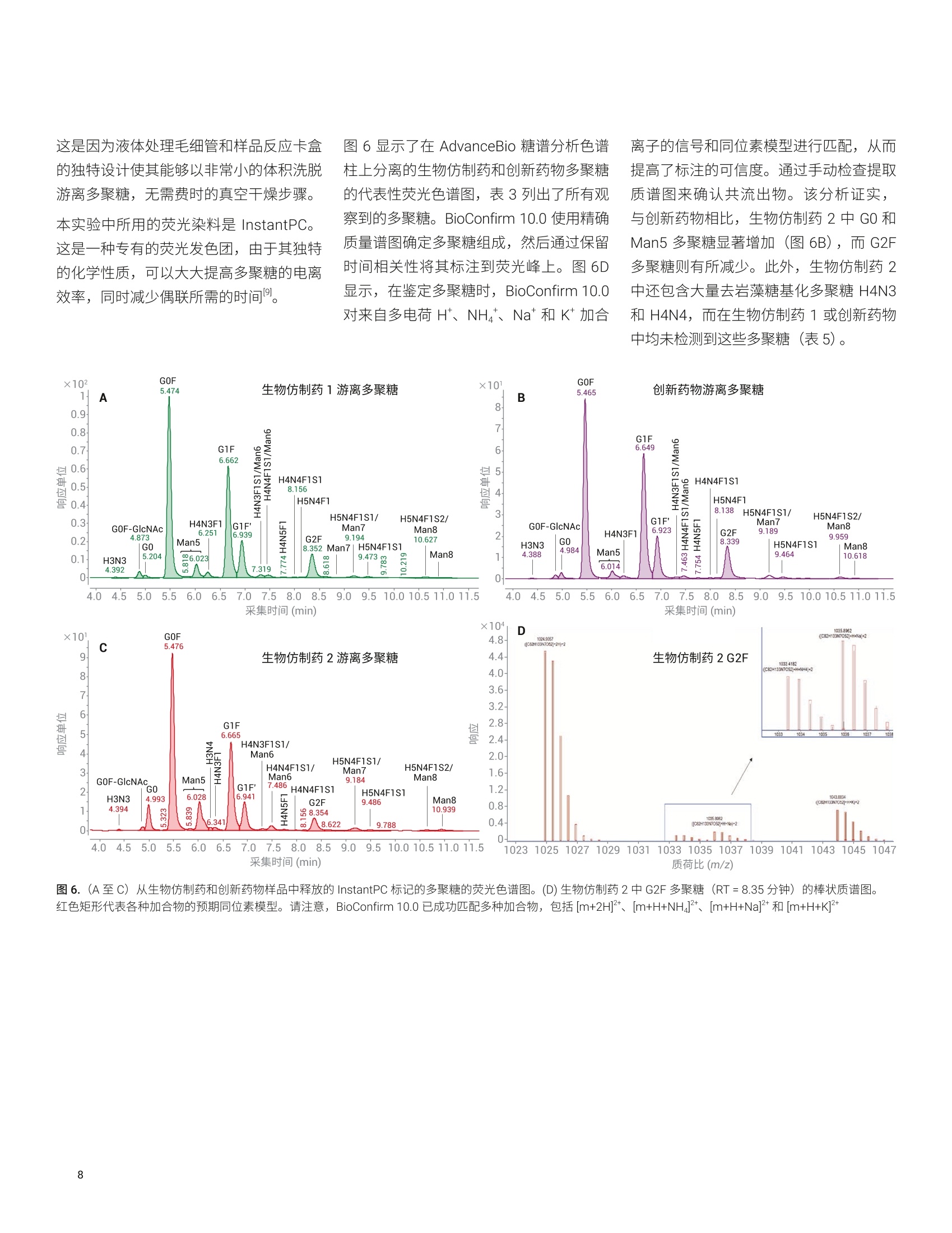
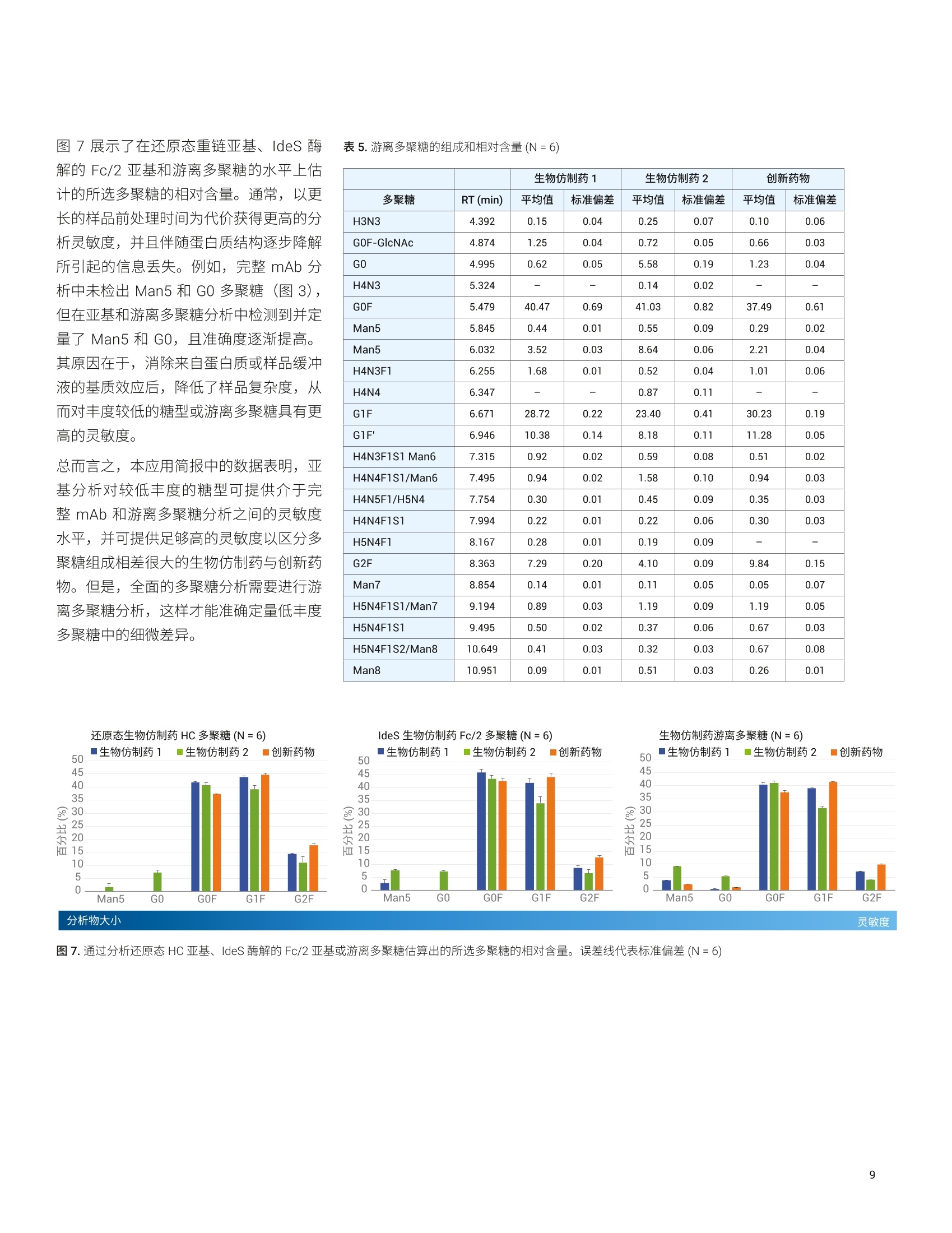
应用简报 Agilent制药与生物制药Trusted Answers 使用高分辨率 LC/MS对两种利妥昔单抗生物仿制药的完整质量数、亚基质量数和游离多聚糖进行比较研究 Brian Liau 安捷伦科技有限公司 近年来,由于多种高利润的原创生物制剂的专利保护期满,生物仿制药单克隆抗体(mAb)的开发和生产迅速增长。尽管不存在有关生物仿制药的全球监管标准,但是业界一致认为生物仿制药应当:(i)与原创生物制剂具有高度生物物理和生物化学相似性,并且 (ii) 在纯度、效价安安全性方面具有可比性"。美国 FDA 等监管机构指出,可以使用高质量分析数据来证明范围较窄的体内研究的合理性②,强调了全面的高分辨率分析表征的重要性。 与小分子药物不同, mAb 极其复杂,难以实施完整的分析表征。因此,生物制药公司将确定定组需要监测的关键质量属性(CQA), 选择 CQA的原则是它们对生生制剂的整体质量、安全性或有效性具有重大影响。由于同一工厂可能生产多种治疗药物,因此 mAb身份(鉴定)是一种 CQA, 其最有效的测定方法是完整蛋白质质谱法。此外,糖基化通常也被视为一种 CQA, 因为非人类多聚糖基序可能触发急性或慢性过敏反应3.4。另外,由于 mAb 由培养的细胞产生,而多聚糖对培养条件的变化非常敏感,因此它们是生产工艺发生非预期变化的有用的指标。 本应用简报分析了两种利妥昔单抗生物仿制药的完整质量数、亚基质量数和糖基化,并将它们与创新药物分子进行了比较。我们使用四种不同的工作流程进行分析:() 完整 mAb, (ii) 还原态亚基, (iii) ldeS 酶解的亚基,以及 (iv) 游离多聚糖。在这些工作流程中,样品前处理时间各不相同,有的无需样品前处理(完整mAb),有的需要大约三个小时(游离多聚糖)。包含更多样品前处理步骤的工作流程的优势通常在于对低丰度多聚糖组分具有更高的灵敏度,从而提高了相应技术的分析能力。 结果表明, 由 Agilent 1290 Infinity ll液相色谱系统和 Agilent 6545XT Q-TOF 组成的安捷伦高分辨率 LC/MS 非常适合执行这些分析。此外,利用 AssayMAP Bravo 自动完成游离多聚糖工作流程中的样品前处理,从而减少人为错误并缩短样品前处理时间。标记多聚糖可在小样品量中以高浓度洗脱,无需冗长的干燥步骤。 IdeS 酶解的亚基 游离多聚糖 图1.本应用简报中执行的工作流程 图2.本应用简报中所用的设备和消耗品 实验部分 材料与方法 利妥昔单抗的生物仿制药和创新药物购自新加坡当地的经销商。二硫充糖醇(DTT)、盐酸胍、甲酸、甲酸铵、乙腈、碳酸氢铵和 Tris-HCI 购自 Sigma。 IdeS 蛋白酶购自Genovis。所有流动相组分均为 LC/MS级。 ( 仪器 ) ( Agilent AssayMAP Brav o 系统(G5542 A )一仅用于游离多聚糖实验 ) ( Agilent 1290 Infinity II 液相色谱系统,包括: ) ( Agilent 1 290 Infinity ll 高速泵 (G7120A) ) Agilent 1290 Infinity II Multisampler(G7167B) ·AAgilent 1290 Infinity ll 高容量柱温箱(G7116B) ( ·A Agilent 1260 Infinity 荧光检测器(G1321 B )一仅用于游离多聚糖实验 ) Agilent 6545XT AdvanceBio LC/Q-TOF 样品前处理 在完整 mAb 实验中,直接分析 10 mg/mL样品,无需进一步样品前处理。 在还原态 mAb 重链亚基实验中,用新鲜配制的含有 4 mol/L 盐酸胍的 50 mmol/L碳酸氢铵(pH8.0)将样品稀释至1 mg/mL。将样品加热至56°℃并保持60分钟,冷却至室温后进行分析。 在 IdeS 酶解的 Fc/2亚基实验中,将IdeS 蛋白酶复溶于 50 mmol/L Tris-HCI(pH7.5)中,使其浓度达到2单位/pL。用 Tris-HCI 缓冲液将 mAb 样品稀释至2 mg/mL。然后将 5 pL IdeS 蛋白酶加入5 uL 的各个 mAb 样品中,30℃下孵育30分钟,冷却至室温后进行分析。在游离多聚糖实验中,根据试剂盒随附 的说明, 将 AssayMap Bravo 液体处理系统 (G5542A) 与 Agilent GlykoPrep 快速N-糖试剂盒 (GPPNG-PC) 配合使用。式两份对每种 mAb 样品进行处理,每份50 pg。经过最终净化步骤后,用50 pL的洗脱液洗脱每个样品中的标记多聚糖。为改善峰形,在分析之前,将70 pL乙腈加入由每个样品得到的 30 pL标记多聚糖中。每个样品重复进样三次。 LC/MS分析 使用 Agilent PLRP-S色谱柱(2.1×50mm,1000 A, 5 um) 对完整 mAb、还原态 mAb亚基和 ldeS 酶解的亚基进行色谱分离。在每次色谱运行的前一分钟,将液流引入废液中。对于完整 mAb,样品峰在2.4分钟时洗脱;对于还原态mAb 亚基,轻链在1.8分钟时洗脱,重链在2.1分钟时洗脱;对于 IdeS 酶解的亚基, Fc/2 在1.3分钟时洗脱,而F(ab')2 在2.1分钟时洗脱。 使用 Agilent AdvanceBio 糖谱分析色谱柱(2.1×150 mm, 1.8 um) 对 InstantPC 标记的多聚糖进行色谱分离。将荧光检测器设置为 Ex/Em =285 nm/345nm, PMT增益=10。表1和表2列出了所用的参数。为减少多聚糖在离子源内的碎裂,在分析之前使用“易碎裂离子”选项进行SWARM 群集自动调谐。通过比较荧光色谱图的峰面积对多聚糖进行相对定量。 Agilent 1290 Infinity lI液相色谱系统 样品类型 完整mAb 还原态mAb 亚基 (HC 和LC) IdeS mAb 亚基 (Fc/2 和F(ab')2) 游离多聚糖 色谱柱 Agilent PLRP-S, 2.1×50 mm,1000 A, 5 pm (部件号 PL1912-1502) Agilent PLRP-S, 2.1×50 mm,1000A,5 pm (部件号PL1912-1502) Agilent PLRP-S, 2.1×50 mm,1000 A, 5 pm (部件号PL1912-1502) Agilent AdvanceBio 糖谱分析色谱柱,2.1×150 mm,1.8 pm(部件号859700-913) 溶剂A 0.1%甲酸去离子水溶液 0.1%甲酸去离子水溶液 0.1%甲酸去离子水溶液 50 mmol/L甲酸铵, pH4.5 溶剂B 0.1%甲酸乙腈溶液 0.1%甲酸乙腈溶液 0.1%甲酸乙腈溶液 乙腈 梯度 0-1 min, B由0升至20%1-3min, B 由 20%升至50%3-4min, B由50%升至70% 0-5 min, B由25%升至45%5-6 min, B由45%升至60% 6-7 min, B 保持60% 0-1 min, B 保持 25% 1-6.5 min, B由25%升至60%6.5-7.5 min, B保持60%7.5-7.6 min, B由60%降至25%7.6-8.5 min, B保持25% 0-2 min, B由25%升至30% 2-15.5min, B由30%升至37%15.5-17 min, B由37%升至80% 17-20 min, B 保持 80%20-21 min, B由80%降至25% 21-30 min, B保持25% 柱温 60C 60°℃ 60°℃ 40°C 流速 0.5 mL/min 0.8 mL/min 0.5mL/min 15.5-20 min: 0.25 mL/min其他时间:0.4mL/min 进样量 0.5 pL 1pL 1pL 2pL Agilent 6545XT AdvanceBio LC/Q-TOF 系统 样品类型 完整 mAb 还原态 mAb 亚基 (HC 和LC) IdeS mAb 亚基 (Fc/2和F(ab')2) 游离多聚糖 离子源 安捷伦双喷射流离子源 干燥气温度 350°C 350°C 350°C 150°C 气体流速 12 L/min 12 L/min 12L/min 9 L/min 雾化器 60psig 35 psig 35 psig 35 psig 鞘气温度 400°℃ 350°C 350℃ 300°℃ 鞘气流速 11 L/min 11 L/min 11 L/min 10 L/min 毛细管电压 5.5 kV 4 kV 4 kV 3 kV 喷嘴电压 2 kV 2kV 2kV 500V 碎裂电压 380 V 180V 180V 120V 锥孔电压 140V 65V 65V 65V 质量数范围 100-10000 m/z 100-3200 m/z 800-5000m/z 300-1700m/z 采集速率 1质谱图/秒 1质谱图/秒 1质谱图/秒 2质谱图/秒 参比质量 922.0098 采集模式 正离子,扩展(10000 m/z)质量数范围 正离子,标准(3200 m/z)质量数范围, HiRes (4 Ghz) 正离子,扩展(10000m/Z)质量数范围 正离子,低质量数范围,HiRes (4 Ghz) 数据处理 所有数据分析均采用 Agilent MassHunterBioConfirm 10.0 软件。对于游离多聚糖,使用MassHunter 定性分析软件10.0版提取荧光色谱图,并使用安捷伦个人化合物数据库与谱库(PCDL)多聚糖数据库鉴定多聚糖组成。 在完整 mAb、还原态 mAb 亚基和 IdeS酶解的亚基分析中,采用了最大熵解卷积,质谱精度为1Da。 对于游离多聚糖,将匹配容差设置为10 ppm。允许的离子种类为 H*、Na*、K*、NH+和H,且电荷态范围为1-3。 在软件中选中 InstantPC 标签选项。 的每条重链上都包含一个糖基化位点,所得糖型代表两种多聚糖的不同组合。此外,根据细胞培养过程中羧肽酶D的活性量不同,重链C末端的赖氨酸残基可能发生不同程度的剪切。 表3.解卷积设置 Agilent MassHunter BioConfirm B10.0 设置 样品类型 完整 mAb 还原态mAb亚基 (HC 和LC) IdeS mAb 亚基 (Fc/2 和 F(ab')2) 解卷积 最大熵 解卷积m/z 范围 2000-6500 800-2600 1000-2600 解卷积质量数范围 140-160kDa 20-60kDa 21-28kDa 解卷积扣除基线 7.0 7.0 6.0 匹配容差 20 ppm 20 ppm 20 ppm mAb 与创新药物 mAb 的解卷积质谱图。通过比较它们的精确质量,可以非常可靠地确定生物仿制药和创新药物 mAb 的身份。使用 G1F+GOF-2 Lys 糖型作为比较的基础,以7.18 ppm 的误差鉴定出生物仿制药1(147240.79 Da), 以9.98 ppm的误差鉴定出生物仿制药2(147241.22 Da),并以4.78 ppm 的误差鉴定出创新药物(147240.44 Da)。表4显示,除2*G0F-2Lys外,生物仿制药2中所有其他糖型的匹配误差均小于 10 ppm. 图3A显示, 生物仿制药1比生物仿制药2更接近创新药物 mAb。 在图 3B 中, 由于存在不同程度的C端赖氨酸截短,生物仿制药2的谱图变得更加复杂,每种C端赖氨酸截短均由 -128.175 Da 的平均质量转移反映出来,导致各种糖型都表现为三个峰,而不是仅仅一个峰。生物仿制药2中不同程度的赖氨酸截短在另一项研究的肽谱分析实验中得到证实。 BioConfirm 10.0 软件使用户能够对所选的糖型进行相对定量分析。图3C汇总了在N=6次观察中得到的各种糖型的平均相对含量。与创新药物相比,生物仿制药2的 GOF+GOF 糖型增加8.3%±1.5%,G0F+G1F 增加 6.2%±1.9%,而G2F+G2F减少8.6%±4.3%,表明其多聚糖含量与创新药物差异较大。相反,生物仿制药1的糖型与创新药物更接近,主要差别在于GOF+G1F增加5.3%±1.5%。 C 生物仿制药的主要糖型(N=6) 40 图3.完整 mAb 解卷积质谱图,展示了主要的生物仿制药糖型。(A)生物仿制药1与创新药物的镜像图。所有糖型都包括两个C端赖氨酸残基的丢失(-2 Lys)。(B)生物仿制药2与创新药物的镜像图。生物仿制药2具有不同程度的赖氨酸丢失。(C)糖型的汇总统计数据。误差线代表标准偏差(N=6) 可通过亚基分析降低样品体积和复杂度,有利于检测低丰度多聚糖。可通过使用DTT 和三(2-羧乙基)膦 (TCEP) 等试剂还原二硫键建使用 IdeS 蛋白酶进行酶解来生成亚基。图4显示了通过 DTT完全还原二硫键所生成的生物仿制药重链(约50kDa)的解卷积质谱图。图5显示了通过 IdeS 酶解样品得到的Fc/2亚基(约25kDa)。 表4.利用BioConfirm 匹配的生物仿制药2中的糖型 ×102 生物仿制药2糖型 质量数 峰面积(MS) 定量% (峰面积) 偏差 (Bio,ppm) 预测的修饰 147080.15 25527902 14.01 17.34 2*G0F (NGA2F)(1445.3580)+2*Lys-loss(-128.1750) 147205.55 770401 6.99 -1.53 2*G0F (NGA2F)(1445.3580)+1*Lys-loss(-128.1750) 147241.22 32853404 15.98 9.98 1*G1F(1607.5013)+1*GOF (NGA2F)(1445.3580)+2*Lys-loss(-128.1750) 147333.70 7733970 5.52 -1.71 2*G0F (NGA2F)(1445.3580) 147368.27 25443047 9.2 2.35 1*G1F(1607.5013)+1*GOF (NGA2F)(1445.3580)+1*Lys-loss(-128.1750) 147402.38 28448038 14.37 3.31 2*G1F(1607.5013)+2*Lys-loss(-128.1750) 147496.45 96402 6.55 2.38 1*G1F(1607.5013)+1*GOF (NGA2F)(1445.3580) 147530.40 28606318 6.83 2.29 2*G1F(1607.5013)+1*Lys-loss(-128.1750) 147563.14 23128142 9.49 -6.05 1*G2F (NA2F)(1769.6445)+1*G1F(1607.5013)+2*Lys-loss(-128.1750) 147659.00 19354473 4.69 5.18 2*G1F(1607.5013) 147692.91 47347 3.79 4.73 1*G2F (NA2F)(1769.6445)+1*G1F(1607.5013)+1*Lys-loss(-128.1750) 147820.92 14880698 2.6 3.63 1*G2F (NA2F)(1769.6445)+1*G1F(1607.5013) 图4.还原态 mAb 重链亚基的解卷积质谱图。(A) TIC色谱图,展示了生物仿制药1中轻链和重链的分离。(B)生物仿制药1重链峰的电荷分布包迹。请注意,922.0099 m/z为参比质量。(C)生物仿制药1重链与创新药物的镜像图。所有糖型都包括一个C端赖氨酸的丢失(-1Lys)。 (D)生物仿制药2重链与创新药物的镜像图。生物仿制药2具有不同程度的赖氨酸丢失 在图4所示的还原态重链(HC) 亚基水平上,可以观察到较低丰度的多聚糖,例如Man5 和 GO。这一点非常重要,因为已有研究表明 Man5 能够提高治疗性 mAb的清除率8,并且通常被视为关键质量属性。图4C表明,与创新药物相比, Man5在生物仿制药1中有所增加,而图4D则表明 Man5 和 GO 在生物仿制药2中均有所增加。 由于 IdeS 酶解的 Fc/2 亚基的大小约为还原态 HC亚基的一半,因此对它们的分析为低丰度糖型提供了更高的灵敏度。图5显示,在创新药物 Fc/2亚基中可以检测到Man5,并且即使是低丰度的生物仿制药2糖型(例如,未发生赖氨酸截短的亚基上的 Man5 和 GO),也可以得到清晰的区分。 利用 PNGase-F 酶释放多聚糖,然后用荧光染料进行标记,可实现高灵敏度的多聚糖分析。这种分析方法需要进行繁琐的样品前处理,通常需要花费8-16个小时,并且需要大量的人工干预。我们使用AssayMAP Bravo 液体处理系统和 AgilentGlykoPrep 快速N-糖试剂盒开发出一种自动化高通量工作流程,将样品前处理时间缩短为仅需三个小时。 图5. IdeS 酶解的 Fc/2 亚基的解卷积质谱图。(A) TIC 色谱图,展示了生物仿制药1中 Fc/2 和F(ab)2 的分离。(B)生物仿制药1Fc/2峰的电荷分布包迹。(C)生物仿制药1Fc/2与创新药物的镜像图。所有糖型都包括一个C端赖氨酸的丢失(-1 Lys)。(D)生物仿制药2Fc/2 与创新药物的镜像图。生物仿制药2具有不同程度的赖氨酸丢失 这是因为液体处理毛细管和样品反应卡盒的独特设计使其能够以非常小的体积洗脱游离多聚糖,无需费时的真空干燥步骤。本实验中所用的荧光染料是 InstantPC。这是一种专有的荧光发色团,由于其独特的化学性质,可以大大提高多聚糖的电离效率,同时减少偶联所需的时间。 图6显示了在 AdvanceBio 糖谱分析色谱柱上分离的生物仿制药和创新药物多聚糖的代表性荧光色谱图,表3列出了所有观察到的多聚糖。 BioConfirm 10.0使用精确质量谱图确定多聚糖组成,然后通过保留时间相关性将其标注到荧光峰上。图6D显示,在鉴定多聚糖时, BioConfirm 10.0对来自多电荷H*、NH*、Na和K*加合 离子的信号和同位素模型进行匹配,从而提高了标注的可信度。通过手动检查提取质谱图来确认共流出物。该分析证实,与创新药物相比,生物仿制药2中GO和Man5 多聚糖显著增加(图6B), 而 G2F多聚糖则有所减少。此外,生物仿制药2中还包含大量去岩藻糖基化多聚糖 H4N3和H4N4,而在生物仿制药1或创新药物中均未检测到这些多聚糖(表5)。 图6.(A至C)从生物仿制药和创新药物样品中释放的 InstantPC 标记的多聚糖的荧光色谱图。(D)生物仿制药2中G2F多聚糖 (RT=8.35分钟)的棒状质谱图。 红色矩形代表各种加合物的预期同位素模型。请注意, BioConfirm 10.0 已成功匹配多种加合物,包括[m+2H]2+、[m+H+NH]2、[m+H+Na]2+和[m+H+K]² 图7展示了在还原态重链亚基、IdeS 酶解的Fc/2亚基和游离多聚糖的水平上估计的所选多聚糖的相对含量。通常,以更长的样品前处理时间为代价获得更高的分析灵敏度,并且伴随蛋白质结构逐步降解所引起的信息丢失。例如,完整 mAb 分析中未检出 Man5 和 GO多聚糖(图3),但在亚基和游离多聚糖分析中检测到并定量了 Man5和 GO, 且准确度逐渐提高。其原因在于,消除来自蛋白质或样品缓冲液的基质效应后,降低了样品复杂度,从而对丰度较低的糖型或游离多聚糖具有更高的灵敏度。 总而言之,本应用简报中的数据表明,亚基分析对较低丰度的糖型可提供介于完整 mAb 和游离多聚糖分析之间的灵敏度水平,并可提供足够高的灵敏度以区分多聚糖组成相差很大的生物仿制药与创新药物。但是,全面的多聚糖分析需要进行游离多聚糖分析,这样才能准确定量低丰度多聚糖中的细微差异。 生物仿制药1 生物仿制药2 创新药物 多聚糖 RT (min) 平均值 标准偏差 平均值 标准偏差 平均值 标准偏差 H3N3 4.392 0.15 0.04 0.25 0.07 0.10 0.06 GOF-GIcNAc 4.874 1.25 0.04 0.72 0.05 0.66 0.03 G0 4.995 0.62 0.05 5.58 0.19 1.23 0.04 H4N3 5.324 - 0.14 0.02 - - GOF 5.479 40.47 0.69 41.03 0.82 37.49 0.61 Man5 5.845 0.44 0.01 0.55 0.09 0.29 0.02 Man5 6.032 3.52 0.03 8.64 0.06 2.21 0.04 H4N3F1 6.255 1.68 0.01 0.52 0.04 1.01 0.06 H4N4 6.347 - 0.87 0.11 G1F 6.671 28.72 0.22 23.40 0.41 30.23 0.19 G1F' 6.946 10.38 0.14 8.18 0.11 11.28 0.05 H4N3F1S1 Man6 7.315 0.92 0.02 0.59 0.08 0.51 0.02 H4N4F1S1/Man6 7.495 0.94 0.02 1.58 0.10 0.94 0.03 H4N5F1/H5N4 7.754 0.30 0.01 0.45 0.09 0.35 0.03 H4N4F1S1 7.994 0.22 0.01 0.22 0.06 0.30 0.03 H5N4F1 8.167 0.28 0.01 0.19 0.09 - - G2F 8.363 7.29 0.20 4.10 0.09 9.84 0.15 Man7 8.854 0.14 0.01 0.11 0.05 0.05 0.07 H5N4F1S1/Man7 9.194 0.89 0.03 1.19 0.09 1.19 0.05 H5N4F1S1 9.495 0.50 0.02 0.37 0.06 0.67 0.03 H5N4F1S2/Man8 10.649 0.41 0.03 0.32 0.03 0.67 0.08 Man8 10.951 0.09 0.01 0.51 0.03 0.26 0.01 结论 本研究使用 Agilent 1290 Infinity II 液相色谱系统、高分辨率 Agilent 6545XT AdvanceBioLC/Q-TOF 和 Agilent MassHunterBioConfirm 10.0软件对两种生物仿制药和一种创新药物 mAb 进行了全面的分析。使用 Agilent AssayMap Bravo 液体处理技术实现了繁琐的样品前处理步骤的自动化并加快了处理速度,从而提高了分析效率和重现性。 我们考察了四种分析方法,这些方法能够满足生物药物生产中不同阶段的需求: 完整 mAb 方法可快速评估样品中存在的 mAb 的身份及其主要糖型,非常适合批次放行和在发现/开发过程中筛选 CHO细胞克隆。这种方法几乎无需样品前处理,并且可以获得独特的高阶信息,例如不同的糖基化或赖氨酸截短的重链配对而产生的糖型的相对含量 还原态 HC 和 IdeS 酶解的亚基方法提供了介于完整 mAb 方法和游离多聚糖方法之间的灵敏度,并且非常适合在生产中对生物反应器产物进行常规的在线监测10。更高的灵敏度水平使其能够对一些低丰度 CQA((例如Man5)进行检测和定量 www.agilent.com/chem 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 ( C安捷伦科技(中国)有限公司,2020 ) 游离多聚糖方法可提供最高水平的灵敏度,非常适合用于发现/开发中的治疗药物开发活动。由于该方法依赖于荧光色谱,因此是四种方法中最可靠的多聚糖相对定量方法。InstantPC 比传统标记(例如2-AB)亮得多,并且以1:1的化学计量比与多聚糖共价结合,从而能够检测和定量糖基化的细微差异 我们检测到了两种生物仿制药与创新药物之间糖基化模式(即GOF、G1F 和 G2F 的相对表达)的差异,并且四种方法得到的结果一致,展示了安捷伦 LC/MS 技术在生物仿制药开发应用中的稳定性和通用性。 ( 1. K irchhoff. C. F. et al. Biosimilars: K ey regulatory Considerationsand S imilarity Assessment Tools.Biotechnol. Bioeng. 2 017, 1 1 4, 2696 - 2705 ) 2. ( Scientific Considerations i n Demonstrating Biosimilarity to a Reference Product-Guidance for Industry, United States Food andDrug Administration 2015 ) ( 3. C hung, C. H. etal. Cetuximab-Induced Anaphylaxis and IgE Specificfor Galactose-alpha-1,3-Galactose. N .Engl.J.Med. 2008,358,1109-1117 ) ( 4. Tangvoranuntakul, P . e t al. Humanuptake a nd Incorporation of anImmunogenic Nonhuman Dietary Sialic Acid.PNAS 2003,100, 12045-12050 ) ( 5. 从样品前处理到数据分析的单克隆 抗体N-连接多聚糖全面分析方法,安捷伦科技公司,出版号5991- 8550ZHCN ) ( 6. Hu, Z. et al. Carboxypeptidase D isthe Only Enzyme Responsible forAntibody C -T e rminal Lysine Cleavagein Chinese Hamster Ovary (CHO)cells. Biotechnol. Bioeng. 2016, 113, 2100-2106 ) ( 7. 利妥昔单抗创新药物与生物仿制药的LC/MS/MS肽谱分析比较,安捷伦科技公司,出 版 号5994-1495ZHCN ) ( 8. Goetze, A. M. et al. High-Mannoseglycans o n t he Fc Region ofTherapeuti c I gG antibodies I ncrease Serum Clearance in Humans. Glycobiology 2011, 21,949-959. ) ( 9. Streamlined Workflows for N -GlycanAnalysis of Biotherapeutics UsingAgilent AdvanceBio G ly-XInstantPCand 2-AB Express Sample Preparationwith LC/FLD/MS (使用 Agilent AdvanceBio Gly-XInstantPC 和 2 - ABExpress 样品前处理与 LC/FLD/MS简化生物治疗药物的N-糖分析工作流程),安捷伦科技公司应用简报, 出版号 5994-1348EN, 2019 ) ( 10. L iu, P. et al. Subunit Mass Analysis f or Monitoring M ultiple Attributespf Monoclonal Antibodies. RapidCommun. M ass Spectrom.2019,33,31-40 ) 近年来,由于多种高利润的原创生物制剂的专利保护期满,生物仿制药单克隆抗体(mAb) 的开发和生产迅速增长。尽管不存在有关生物仿制药的全球监管标准,但是业界一致认为生物仿制药应当:(i) 与原创生物制剂具有高度生物物理和生物化学相似性,并且 (ii) 在纯度、效价和安全性方面具有可比性。美国 FDA 等监管机构指出,可以使用高质量分析数据来证明范围较窄的体内研究的合理性,强调了全面的高分辨率分析表征的重要性。与小分子药物不同,mAb 极其复杂,难以实施完整的分析表征。因此,生物制药公司将确定一组需要监测的关键质量属性 (CQA),选择 CQA 的原则是它们对生物制剂的整体质量、安全性或有效性具有重大影响。由于同一工厂可能生产多种治疗药物,因此 mAb 身份(鉴定)是一种 CQA,其最有效的测定方法是完整蛋白质质谱法。此外,糖基化通常也被视为一种 CQA,因为非人类多聚糖基序可能触发急性或慢性过敏反应。另外,由于 mAb 由培养的细胞产生,而多聚糖对培养条件的变化非常敏感,因此它们是生产工艺发生非预期变化的有用的指标。本应用分析了两种利妥昔单抗生物仿制药的完整质量数、亚基质量数和糖基化,并将它们与创新药物分子进行了比较。我们使用四种不同的工作流程进行分析:(i) 完整 mAb,(ii) 还原态亚基,(iii) IdeS 酶解的亚基,以及 (iv) 游离多聚糖。在这些工作流程中,样品前处理时间各不相同,有的无需样品前处理(完整 mAb),有的需要大约三个小时(游离多聚糖)。包含更多样品前处理步骤的工作流程的优势通常在于对低丰度多聚糖组分具有更高的灵敏度,从而提高了相应技术的分析能力。结果表明,由 Agilent 1290 Infinity II 液相色谱系统和 Agilent 6545XT Q-TOF 组成的安捷伦高分辨率 LC/MS 非常适合执行这些分析。此外,利用 AssayMAP Bravo 自动完成游离多聚糖工作流程中的样品前处理,从而减少人为错误并缩短样品前处理时间。标记多聚糖可在小样品量中以高浓度洗脱,无需冗长的干燥步骤。
确定


还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《两种利妥昔单抗生物仿制药中完整质量数、亚基质量数和游离多聚糖检测方案(液相色谱仪)》,该方案主要用于化药制剂中含量测定检测,参考标准--,《两种利妥昔单抗生物仿制药中完整质量数、亚基质量数和游离多聚糖检测方案(液相色谱仪)》用到的仪器有Agilent 1290 Infinity II 液相色谱系统、Agilent 6545XT Q-TOF 液质联用系统
推荐专场
相关方案
更多
该厂商其他方案
更多

















