
方案详情
文
有限稀释是一个普遍接受的建立单克隆性的方法,它基于
统计概率因此只有很少一部分( 10-30% )的微孔能被接
种单个细胞。流式细胞分选是另一种传统的克隆方法,它
可以高效地接种单个细胞至微孔内,但是液体剪切力会对
被分选细胞的活率造成不可忽视的影响1-2 。此外,仪器
维护和培训产生的高昂成本对一些资源有限的用户造成
障碍。因此,急需高性价比的细胞株开发流程和高效的克
隆方法。CloneSelect™ Single-Cell Printer™
f.sight™ ( f.sight )被开发用于满足这些需求, 它可以
柔和地接种单个细胞至微孔,同时记录整个细胞接种过
程,提供单克隆性的图像证据以及优异的接种后细胞生长
用于细胞株开发。
方案详情

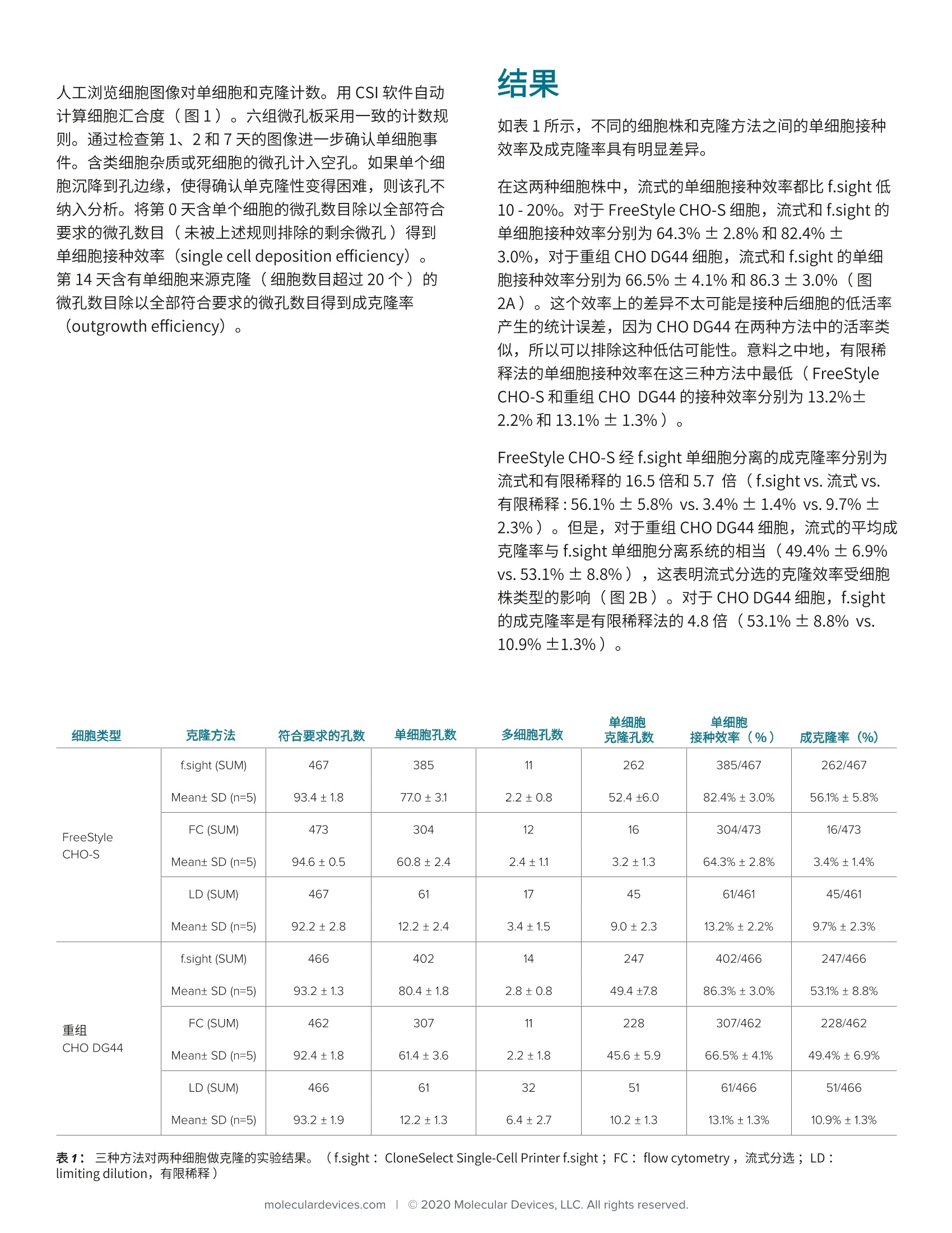
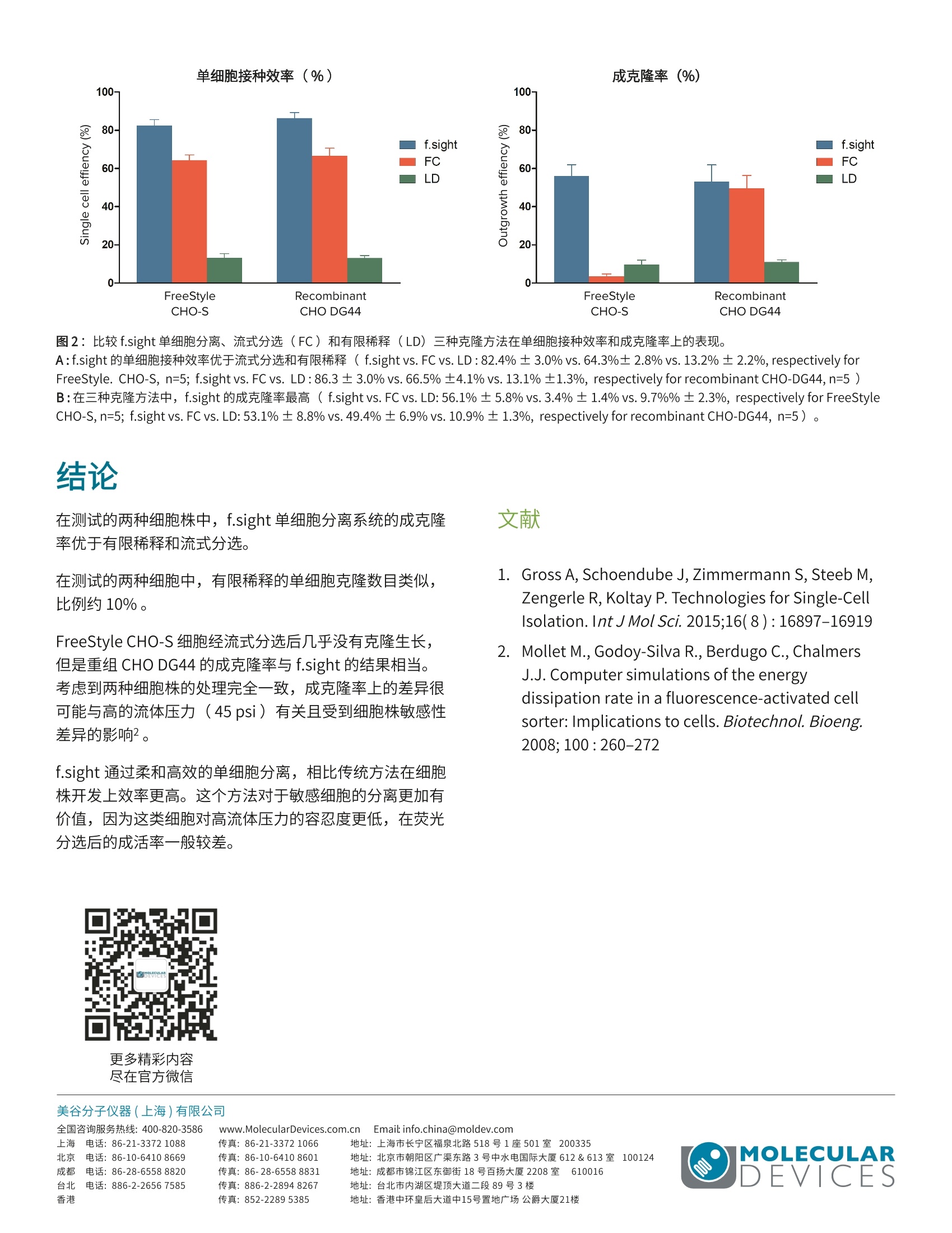
MOLECULARcytenaAPPLICATION NOTE 随着监管机构对细胞株开发的要求愈加严格,研究人员被要求开展单细胞克隆并提供细胞株源于单个细胞的证据(即单克隆性的证据)。 有限稀释是一个普遍接受的建立单克隆性的方法,,它基于统计概率因此只有很少一部分(10-30%)的微孔能被接种单个细胞。流式细胞分选是另一种传统的克隆方法,它可以高效地接种单个细胞至微孔内,但是液体剪切力会对被分选细胞的活率造成不可忽视的影响1.2。此外,仪器维护和培训产生的高昂成本对一些资源有限的用户造成障碍。因此,急需高性价比的细胞株开发流程和高效的克 隆方法。CloneSelectM Single-Cell Printer f.sight ((f.sight)被开发用于满足这些需求,它可以柔和地接种单个细胞至微孔,同时记录整个细胞接种过程,提供单克隆性的图像证据以及优异的接种后细胞生长用于细胞株开发。 在这个研究中,我们开展了六组实验,用无血清培养基和补充成分克隆两种 CHO细胞,比较了 f.sight 和另外两种克隆方法(有限稀释和流式分选)的表现。 ·提供细胞分离过程的实时图像,从而实现快速的质量控制和反馈调节。 ·两种独立设备采集单细胞图像确保高单克隆性概率。 ·利用高的分离效率,成克隆率比有限稀释提高5倍以上。 分选后的细胞活率提高至流式的15倍以上,可用于高敏感细胞株的分离。 材料和方法 实验采用了两种悬浮培养的 CHO细胞株:第一种为 FreeStyleTM CHO-S (Thermo Fisher, R80007),第二种为 分泌重组人 IgG的 CHO DG44细胞株(MolecularDevices)。两种细胞解冻后培养于XP CHO Growth A培养基 (Molecular Devices,K8860),传代至少4次后用于后续实验,培养基中含 4mM L-glutamine (FisherScientific, 25030081) 。 两种细胞株使用的克隆培养基的组分以及样品制备的流程完全一致。克隆培养基新鲜制备自 EX-CELL CHO 克隆培养基 (Sigma SAFC, C6366), 添加4mM L-GIn和2.5% ClonaCell-CHO ACF supplement (STEMCELL, 3820)。克隆前,细胞按0.35×106个/ml的密度接种至克隆培养基培养48小时后进入指数增长期。克隆当天,收集107个细胞,然后用1uM的Calcein-AM(Molecular Devices, R8343A)于37°C孵育15分钟。染色后用培养基洗涤细胞两次,重悬于培养基, 30um过滤器过滤,调节细胞密度至1×106个/ml, 最后样品一分为三分别用于如下的三种克隆方法。 图1:采用三种不同克隆方法制板,第14天用 CSI 对孔板白光成像,缩略图中的绿色伪彩即细胞团。 f.sight 单细胞分离 微孔板预先每孔加200uL 的克隆培养基。取60uL单细胞悬液(密度1×106个/ml)加到一次性无菌分离槽,然后将分离槽安装至 f.sight 单细胞分离系统上。设定细胞直径、圆度和荧光强度,按1个细胞/孔的密度接种细胞至5块标准96孔板 (Corning, 3300)。 流式分选 将染色的细胞和预加200pL/孔培养基的微孔板放入BD FACS Aria Fusion 流式细胞仪。低荧光或弱荧光的未染色细胞作为基线用于荧光细胞分选。喷嘴直径85um, 鞘液压力45 psi, 基于细胞荧光强度分选单细胞,按1个细胞/孔的密度接种5块96孔板。 有限稀释 取染色的细胞(1×106个/ml)稀释1000倍。然后取165pL稀释1000倍后的细胞样品,加到100mL的克隆培养基中。旋转混合细胞,按每孔200uL (对应0.33个细胞/ml)制备5块96孔板。 接种后的微孔板 200g离心3分钟使细胞沉降至孔板底部。利用CloneSelect Imager(CSI)细胞生长分析系统在第0、1、2、7和14天对孔板成像以监测细胞生长并确认单克隆性。 人工浏览细胞图像对单细胞和克隆计数。用 CSI软件自动计算细胞汇合度(图1)。六组微孔板采用一致的计数规则。通过检查第1、2和7天的图像进一步确认单细胞事件。含类细胞杂质或死细胞的微孔计入空孔。如果单个细胞沉降到孔边缘,使得确认单克隆性变得困难,则该孔不纳入分析。将第0天含单个细胞的微孔数目除以全部符合要求的微孔数目(未被上述规则排除的剩余微孔)得到单细胞接种效率 (single cell deposition efficiency) 。第14天含有单细胞来源克隆(细胞数目超过20个)的微孔数目除以全部符合要求的微孔数目得到成克隆率(outgrowth efficiency)。 如表1所示,不同的细胞株和克隆方法之间的单细胞接种效率及成克隆率具有明显差异。 在这两种细胞株中,流式的单细胞接种效率都比 f.sight 低10-20%。对于 FreeStyle CHO-S细胞, 流式和 f.sight 的单细胞接种效率分别为64.3%±2.8%和82.4%±3.0%, 对于重组 CHO DG44细胞,流式和 f.sight 的单细胞接种效率分别为 66.5%±4.1%和86.3±3.0%(图2A)。这个效率上的差异不太可能是接种后细胞的低活率产生的统计误差,因为 CHO DG44 在两种方法中的活率类似,所以可以排除这种低估可能性。意料之中地,有限稀释法的单细胞接种效率在这三种方法中最低 (FreeStyleCHO-S 和重组 CHO DG44 的接种效率分别为13.2%±2.2%和13.1%±1.3%)。 FreeStyle CHO-S 经 f.sight单细胞分离的成克隆率分别为流式和有限稀释的16.5倍和5.7倍 (f.sight vs.流式 vs.有限稀释:56.1%±5.8%vs. 3.4%±1.4% vs. 9.7%±2.3%)。但是,对于重组 CHO DG44细胞,流式的平均成克隆率与 f.sight 单细胞分离系统的相当(49.4%±6.9%vs. 53.1%±8.8%),这表明流式分选的克隆效率受细胞株类型的影响(图2B)。对于 CHO DG44 细胞, f.sight的成克隆率是有限稀释法的4.8倍(53.1%±8.8%vs.10.9%±1.3%)。 FreeStyleCHO-S f.sight (SUM) Mean± SD (n=5) 467 93.4±1.8 385 77.0±3.1 11 2.2±0.8 262 52.4±6.0 385/467 82.4%±3.0% 262/467 56.1%±5.8% FC (SUM) Mean± SD (n=5) 473 94.6±0.5 304 60.8±2.4 12 2.4±1.1 16 3.2±1.3 304/473 64.3%±2.8% 16/473 3.4%±1.4% LD (SUM) Mean± SD (n=5) 467 92.2±2.8 61 12.2±2.4 17 3.4±1.5 45 9.0±2.3 61/461 13.2%±2.2% 45/461 9.7%±2.3% 重组 CHO DG44 f.sight(SUM) Mean± SD(n=5) 466 93.2±1.3 402 80.4±1.8 14 2.8±0.8 247 49.4±7.8 402/466 86.3%±3.0% 247/466 53.1%±8.8% FC (SUM) Mean± SD (n=5) 462 92.4±1.8 307 61.4±3.6 11 2.2±1.8 228 45.6±5.9 307/462 66.5%±4.1% 228/462 49.4%±6.9% LD (SUM) Mean± SD (n=5) 466 93.2±1.9 61 12.2±1.3 32 6.4±2.7 51 10.2±1.3 61/466 13.1%±1.3% 51/466 10.9%±1.3% 表1:三种方法对两种细胞做克隆的实验结果。 (f.sight: CloneSelect Single-Cell Printer f.sight; FC: flow cytometry, 流式分选; LD: limiting dilution,有限稀释) 单细胞接种效率(%) 成克隆率(%) 图2:比较 f.sight单细胞分离、流式分选(FC)和有限稀释(LD)三种克隆方法在单细胞接种效率和成克隆率上的表现。 A:f.sight的单细胞接包效率优于流式分选和有限稀释 (f.sightvs. FC vs. LD:82.4%±3.0% vs. 64.3%± 2.8% vs. 13.2%±2.2%, respectively for FreeStyle. CHO-S, n=5; f.sight vs. FCvs. LD :86.3 ± 3.0% vs. 66.5%±4.1% vs. 13.1%±1.3%, respectively for recombinant CHO-DG44, n=5)B:在三种克隆方法中, f.sight的成克隆率最高(f.sight vs. FC vs. LD: 56.1%±5.8% vs. 3.4%±1.4% vs. 9.7%%±2.3%, respectively for FreeStyle CHO-S,n=5; f.sight vs. FC vs. LD: 53.1% ± 8.8% vs. 49.4%±6.9%vs. 10.9%±1.3%, respectively for recombinant CHO-DG44, n=5)。 在测试的两种细胞株中,f.sight单细胞分离系统的成克隆率优于有限稀释和流式分选。 在测试的两种细胞中,有限稀释的单细胞克隆数目类似,比例约10%。 FreeStyle CHO-S细胞经流式分选后几乎没有克隆生长,但是重组 CHO DG44 的成克隆率与 f.sight 的结果相当。考虑到两种细胞株的处理完全一致,成克隆率上的差异很可能与高的流体压力(45psi)有关且受到细胞株敏感性差异的影响2。 f.sight 通过柔和高效的单细胞分离,相比传统方法在细胞株开发上效率更高。这个方法对于敏感细胞的分离更加有价值,因为这类细胞对高流体压力的容忍度更低,在荧光分选后的成活率一般较差。 ( l. G ( ross A, Schoendube J,Zimmermann S, Steeb M, Zengerle R, Koltay P. Technologies for Single-Cell Isolation.IntJ Mol Sci. 2015;16(8):16897-16919 ) ( 2. M ollet M., Godoy-Silva R., Berdugo C.,Chalmers J.J . Computer simulations of the energydissipation r ate i n a fluorescence-activated c e ll sorter: Implications to cells. Biotechnol. Bioeng. 2008;100:260-272 ) 电话:86-21-33721088 传真:86-21-33721066 地址:上海市长宁区福泉北路518号1座501室200335 ( 北京 电 话:8 6 -10-64108669成都 电话:8 6 -28- 6 5588820 台北 电 话:8 8 6-2- 2 6567585 ) 传真:86-10-64108601 地址:北京市朝阳区广渠东路3号中水电国际大厦612&613室100124 传真:86-28-6558 8831 地址:成都市锦江区东御街18号百扬大厦2208室 610016 传真:886-2-28948267 地址:台北市内湖区堤顶大道二段89号3楼 ( 传真:8 5 2-2289 5385 地址:香港中环皇后大道中15号置地广场公爵大厦21楼 ) moleculardevices.com◎Molecular Devices, LLC. All rights reserved. 有限稀释是一个普遍接受的建立单克隆性的方法,它基于统计概率因此只有很少一部分( 10-30% )的微孔能被接种单个细胞。流式细胞分选是另一种传统的克隆方法,它可以高效地接种单个细胞至微孔内,但是液体剪切力会对被分选细胞的活率造成不可忽视的影响1-2 。此外,仪器维护和培训产生的高昂成本对一些资源有限的用户造成障碍。因此,急需高性价比的细胞株开发流程和高效的克隆方法。CloneSelect™ Single-Cell Printer™f.sight™ ( f.sight )被开发用于满足这些需求, 它可以柔和地接种单个细胞至微孔,同时记录整个细胞接种过程,提供单克隆性的图像证据以及优异的接种后细胞生长用于细胞株开发。
确定


还剩2页未读,是否继续阅读?
美谷分子仪器(上海)有限公司为您提供《单细胞中分离检测方案(单细胞分析仪)》,该方案主要用于其他中分离检测,参考标准--,《单细胞中分离检测方案(单细胞分析仪)》用到的仪器有
相关方案
更多
该厂商其他方案
更多








