文中使用筛选合适的DNA条形码序列,以建立基于DNA条形码技术的银柴胡及其混伪品鉴定方法。该研究团队共收集了60份银柴胡及其混伪品,进行DNA提取:取经鉴定的银柴胡及其混伪品基原植物样品30 mg, 干燥药材去除表皮取中间部分50 mg,加入GP1 缓冲液和钢珠2 枚, 经高通量组织研磨机(美国SPEX公司 Geno 2010)研磨4 或6 min 后, 采用DNA 提取试剂盒提取总DNA,详细操作参照试剂盒说明书。
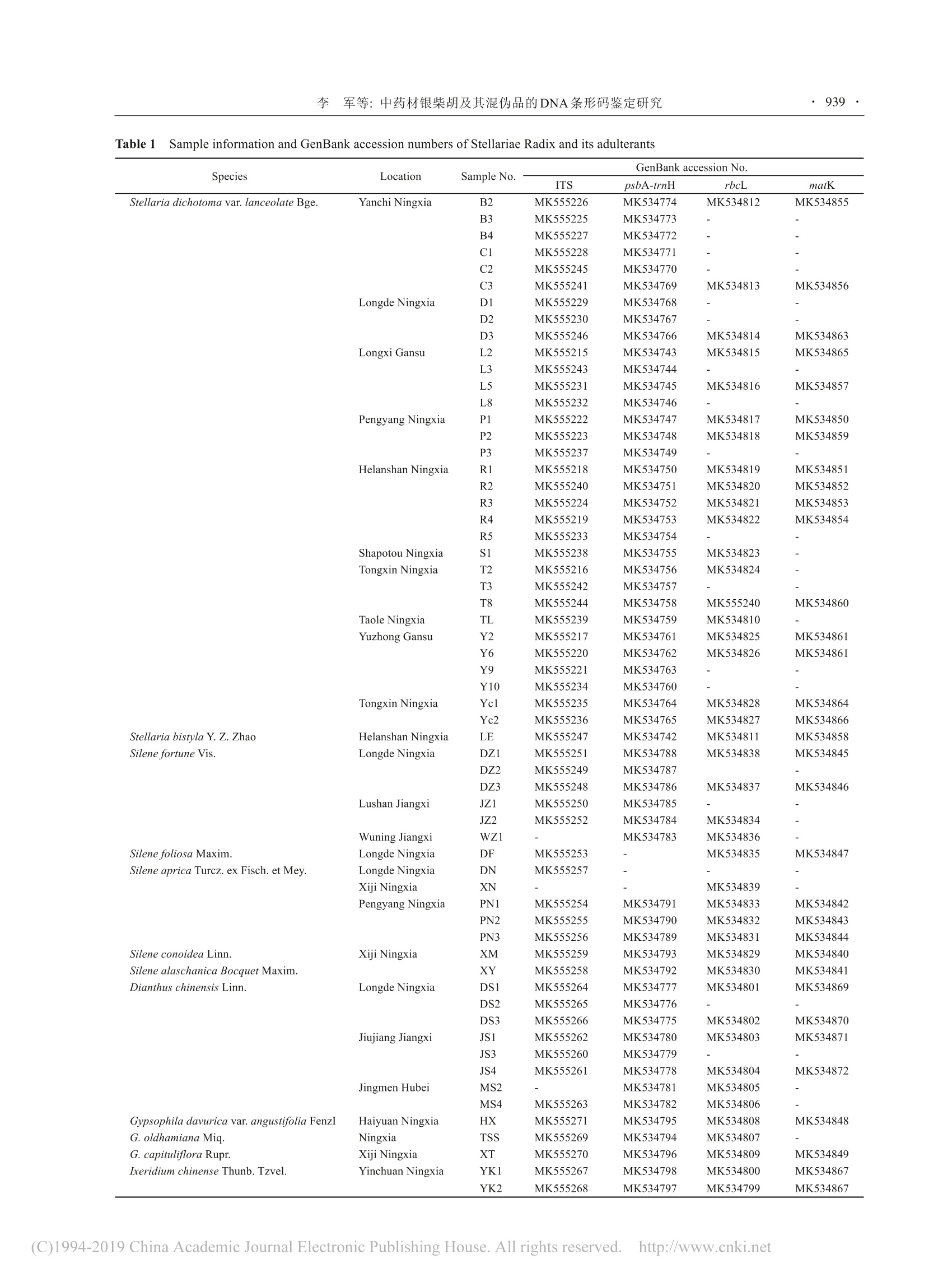
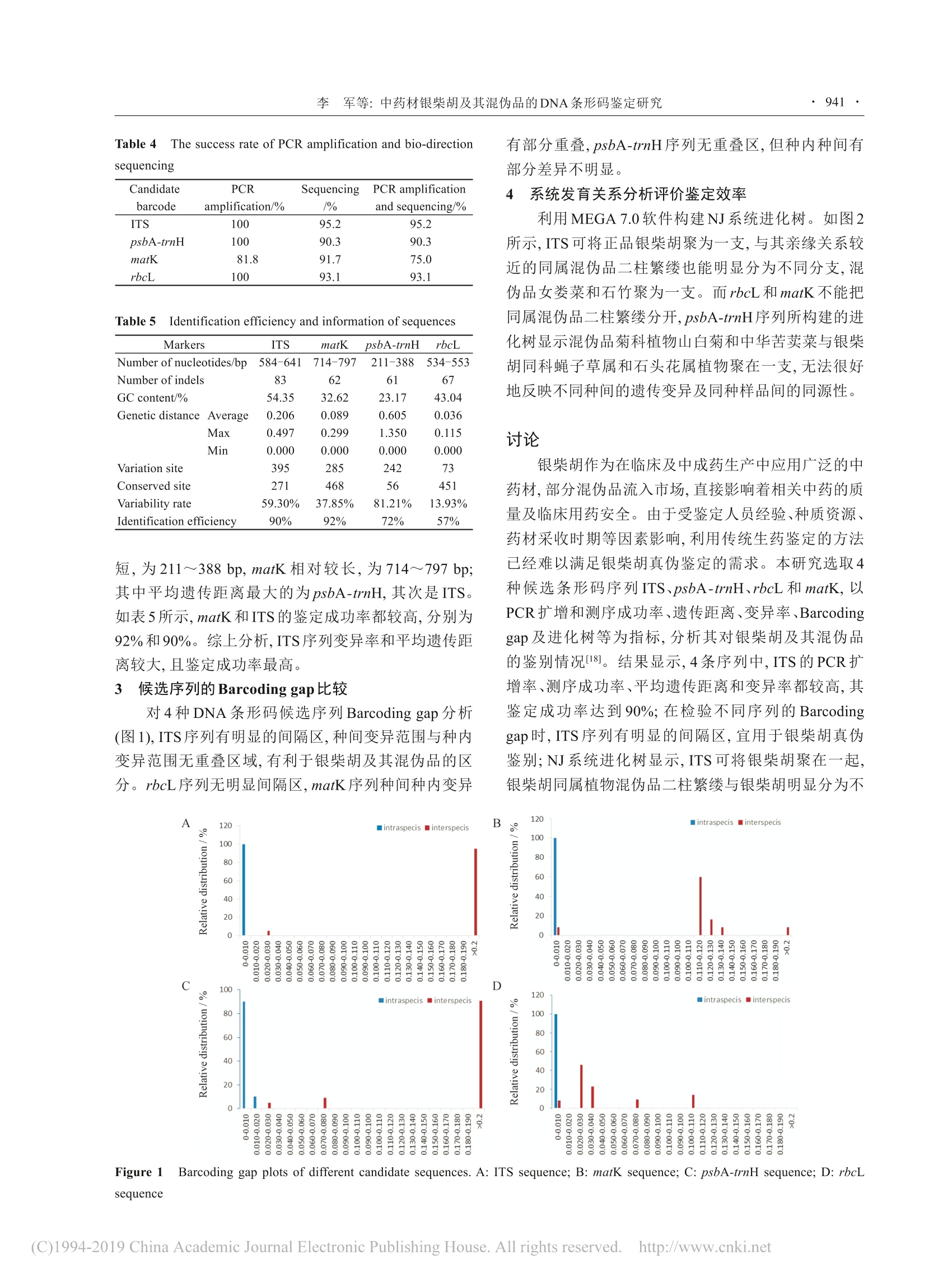
结果显示, ITS序列的PCR扩增及测序成功率最高,为95.2%, matK最低,为75%; 4种序列的长度范围为211~797 bp, ITS的GC含量在各序列中最高,为54.35%; matK和ITS的鉴定成功率较高,分别为92%和90%; Barcoding gap图显示ITS有明显的间隔区, rbc L、mat K和psb A-trn H序列间隔区不明显或种间种内变异有部分重叠; NJ系统进化树显示, ITS可将银柴胡聚为一支,同属混伪品二柱繁缕与银柴胡明显分为不同支, rbc L和mat K不能把混伪品二柱繁缕分开。因此, ITS序列可作为银柴胡及其混伪品鉴定的优选条形码序列,为银柴胡的真伪鉴定提供科学依据。
方案详情

·937·药学学报 Acta Pharmaceutica Sinica 2019, 54(5):937-943 ·938药学学报 Acta Pharmaceutica Sinica 2019, 54(5): 937 -943 中药材银柴胡及其混伪品的DNA条形码鉴定研究 李 军,张 燃l,于淑萍2,王晓敏,冷晓红',石林春“* (1. 宁夏职业技术学院,宁夏中药材开发与利用工程技术研究中心,宁夏银川750021; 2.承德医学院附属医院,河北承德067000; 3. 宁夏大学农学院,宁夏银川750021;44.中国医学科学院、北京协和医学院药用植物研究所,北京100193) 摘要:筛选合适的DNA 条形码序列,以建立基于DNA条形码技术的银柴胡及其混伪品鉴定方法。本文收集并提取60份银柴胡及其混伪品的DNA, 对4种DNA条形码序列 ITS、psbA-trnH、rbcL和 matK 进行 PCR扩增和测序,计算各序列PCR扩增和测序成功率;利用MEGA7.0分析序列特征、计算遗传距离,并构建 Neighbour-joining (NJ) 系统进化树;利用种间种内变异分析做 Barcoding gap 图;运用BLAST方法计算各序列鉴定成功率,通过以上指标综合评价不同序列的鉴别能力。结果显示, ITS序列的PCR扩增及测序成功率最高,为95.2%, matK 最低,为75%;4种序列的长度范围为211~797 bp, ITS 的GC含量在各序列中最高,为54.35%; matK 和 ITS的鉴定成功率较高,分别为92%和90%; Barcoding gap 图显示ITS有明显的间隔区, rbcL、matK 和psbA-trnH序列间隔区不明显或种间种内变异有部分重叠; NJ 系统进化树显示, ITS可将银柴胡聚为一支,同属混伪品二柱繁缕与银柴胡明显分为不同支, rbcL和 matK 不能把混伪品二柱繁缕分开。因此,ITS序列可作为银柴胡及其混伪品鉴定的优选条形码序列,为银柴胡的真伪鉴定提供科学依据。 关键词:银柴胡;混伪品;DNA 条形码; ITS;分子鉴定 中图分类号:R931 文献标识码:A 文章编号:0513-4870(2019)05-0937-07 Identification of Chinese medicinal materials Stellariae Radix andits adulterants using DNA barcoding LI Jun', ZHANG Ran', YU Shu-ping, WANG Xiao-min,LENG Xiao-hong, SHI Lin-chun" (1. College of Ningxia Vocational and Technical, Ningxia Research Center for the Development and Utilization ofChinese Herbal, Yinchuan 750021, China; 2.Affiliated Hospital of Chengde Medical College, Chengde 067000, China;3. School of Agriculture, Ningxia University, Yinchuan 750021, China;:4. Institute of Medicinal Plant Development,Chinese Academy ofMedical Sciences and Peking Union Medical College, Beijing 100193, China) Abstract: To accurately discriminate Stellariae Radix from its adulterants, four leading candidate DNAbarcoding markers were evaluated. Sixty samples including Stellariae Radix and its adulterants have been newlycollected and their total genomic DNA was extracted. Four DNA barcoding markers ITS, rbcL, psbA-trnH andmatK were amplified and sequenced. Their sequence characteristic analyses,Kimura-2-parameter (K2P) distancecalculation and Neighbor-joining (NJ) phylogenetic tree constructions were accomplished using the MEGA 7.0software. DNA Barcoding gaps of the four DNA barcoding markers were estimated by the distributions of inter-and intra-sequence specific variations. Species identification efficiency was calculated using the BLAST method.The results showed that ITS had the highest (95.2%) while matK demonstrated the lowest (75%) PCR and ( 收稿日 期: 2019-01-07; 修回日期:2019-02-26. ) ( 基金项目:2017年宁 夏 青年科技人才托 举工 程项目; 宁 夏 回 族自治区教育厅服务地方经济发展项目(NGY 2 016259);承德市科学技支局 项 目 (201601A049);四川省科技计划 项 目 重 点研发项目(20 1 9YFS0017). ) ( *通 讯 作者 T e l: 86-10-57833194,E- m ail: lcshi@implad.ac.cn ) ( DOI: 1 0.16438/j.0513-4870.2019-0012 ) sequencing efficiency. The length range of the four markers were in the ranger of 211-797 bp,and the G+C contentof ITS was highest (54.35%). The identification efficiency of matK and ITS was 92% and 90% respectively.Barcoding gap could be found in ITS sequences. The NJ phylogenetic tree constructed using ITS sequencesshowed that samples of Stellariae Radix were separately formed into one clade, and samples of adulterants likeStellaria bistyla were clearly belong to different branches from Stellariae Radix, whereas NJ trees constructedusing psbA-trnH, rbcL and matK could not differentiate Stellariae Radix from its adulterants. Therefore, ITSregions as DNA barcodes can stably and accurately distinguished Stellariae Radix from its adulterants, and providea new technique for modern identification of Stellariae Radix. Key words: Stellariae Radix; adulterants; DNA barcoding; ITS; molecular identification 银柴胡是石竹科繁缕属植物银柴胡 (Stellariadichotoma L. var. lanceolate)的干燥根,为2015年版《中华人民共和国药典》收载中药药,味甘、性寒,具有清虚热、除疳热的功效,用于阴虚发热、骨蒸劳热、小儿疳热等症!2。银柴胡在临床中主要用于感冒高热、过敏性疾病、抗肿瘤等方面的治疗。此外,银柴胡常与其他药材配伍,如在乌鸡白凤丸中与牡蛎、生地、天冬归类,同起到滋阴清热之功能,为乌鸡白凤丸中不可或缺的一味药材I3];与青蒿等药材配伍,具有良好的抗菌消炎作用4]。因此,银柴胡的临床应用非常广泛。 银柴胡主要分布在宁夏、内蒙古、陕西省毗邻的干旱少雨沙生草原区,极耐干旱。目前银柴胡的野生资源相对匮乏,商品药材绝大部分来源于人工种植,市场上出现了的混伪品,如有蝇子草、女娄菜、丝石竹、石竹等的干燥根[6.7],导致银柴胡临床用药的安全性和有效性得不到保证。银柴胡混伪品的混入不仅严重干扰了药材市场的正常运行,而且对以此为原料的中成药生产产生极大干扰。针对银柴胡的鉴别方法,国内学者开展了大量研究,主要集中在性状、显微、理化及光谱鉴定。但这些鉴定方法由于受鉴定人员经验、药材生长和采收加工的影响,难以快速准确的鉴定银柴胡及其混伪品。 DNA条条码 (DNA barcoding) 技术作为中药材物种鉴定研究中的新方法法,是利用标准的、有足够变异的、易扩增且相对较短的 DNA片段对物种进行快速、准确的鉴定[10,11]。具有鉴定结果准确、重复性良好、方法通用性强等优点。DNA条形码鉴定技术已经在中药材冬虫夏草、枸杞、羌活、党参、天南星、锁阳等药材及其混伪品的鉴定中取得了良好的效果[12],成为近年来中药鉴定研究的重点和亮点。同时国家药典委员会已将中药材DNA条形码分子鉴定指导原则收载于2015年版《中国药典》第四部凹。其在中药材鉴定、药品流通、监督等诸多方面也得到了很好的应用。而有关银柴胡DNA条形码真伪鉴定研究亟待开展,本文利用4条常用 DNA 候选条形码序列 ITS、rbcL、psbA- trnH和matK对银柴胡及其混伪品进行鉴定研究,分析比较不同候选序列对银柴胡的真伪鉴定能力,为银柴胡及其混伪品的分子鉴定提供优选序列,以期建立一种快速、准确高效的银柴胡真伪鉴定方法,为银柴胡药材的准确鉴定提供科学依据。 材料与方法 材料 本研究采集银柴胡及其混伪品的基原植物和药材样本共计60份,分别来自宁夏、甘肃、江西、湖北等多个省份。基原植物样品采集后立刻装入含硅胶的密封袋中,并勤换硅胶,直至样品干燥完全。所有银柴胡及其混伪品的基原植物经宁夏大学农学院李小伟副教授或宁夏药品检验研究院丁锐副主任药师鉴定,样品保存于宁夏中药材开发与利用工程技术研究中心储存室-70℃冰箱。所有药材样品均经原宁夏药品检验所韩义欣主任药师鉴定。样品采集信息见表1。本研究同时从 GenBanK数据库下载条形码序列,序列筛选参照陈士林等[I3]建立的筛选校对机制,即BLAST分析、系统树分析、Barcoding gap 检验,共整理银柴胡及其混伪品的114条有效条形码序列(表2)。 试剂 DL2000 Marker、RNase 酶、植物基因组DNA提取试剂盒(北京天根生化科技有限公司);psbA-trnH、ITS、matK、rbcL序列引物(上海生工生物工程有限公司);琼脂糖(西班牙, Biowest Agarose); 2×Taq plus Master Mix (南京诺唯赞生物科技有限公司);GelRed染料(美国 Biotium 公司)。 仪器 MyCycler PCR仪、Gel Doc XR+凝胶成像系统、Powerpac Basic 琼脂糖凝胶电泳仪(美国伯乐有限公司); MiniSpin plus 高速离心机(德国Eppendorf公司); Geno 2010 高通量组织研磨机(美国SPEXSamplePrep 公司); ND2000核酸蛋白检测仪(美国NanoDrop公司);自动高压灭菌锅(上海博讯仪器有限公司); Mini离心机(珠海黑马医学仪器有限公司);SZ-1涡旋混合器(常州国宇仪器制造有限公司);恒温水浴锅(北京长源实验设备厂)。 Table 1Sample information and GenBank accession numbers of Stellariae Radix and its adulterants Table 2Accession numbers downloaded from GenBank of different barcodes from various species Barcode Species Species accession No. ITS Stellaria dichotoma var. lanceolata Bge. KY445986,KY445976, KY018698,KY445992, KY445994, KY445987 Silene repens Patr. DQ908662,KJ918501 Aster ageratoides Turcz. HQ154047,KJ587591,KJ587594,KJ587591,KJ587594 A. ageratoides var. lasiocladus Turcz. JN543781 A. ageratoides var. micranthus Turcz. KY428861,KY807174-75,KY428862 Silene fortunei Vis. EF060226 Silene macrostyla Maxim. EF060227,KX757533-35 G. pacifica Kom. JX274528,KX183986 Ferula bungeana Kitag. KJ660769 matK Silene repens Patr. DQ908661,DQ908663 D. chinensis Linn. KU722868,JN589242 G. paniculata Linn. JN589231, MG603322, MG603324-45, KX183906 G. oldhamiana Miq. MF064036 rbcL Silene repens Patr. FJ589552 Aster ageratoides Turcz. GQ436475,MH116076,MH116077 G. oldhamiana Miq. MF065145 D. chinensis Linn. KU722896 G. paniculata Linn. MG247978,MG547346-48,MG547353-57,MG547359-60,DQ908663-70,DQ908672-73 psbA-trnH G. oldhamiana Miq. MF064598 A. ageratoides Turcz. GQ435121,MH117003,MH117002 DNA提取 取经鉴定的银柴胡及其混伪品基原植物样品30 mg, 干燥药材去除表皮取中间部分50 mg,加入 GP1 缓冲液和钢珠2枚,经高通量组织研磨机研磨4或6 min后,采用 DNA 提取试剂盒提取总 DNA,详细操作参照试剂盒说明书I4]。 PCR 扩增及测序 本研究选用国际通用序列ITS、rbcL、psbA-trnH及 matK 4条DNA条形码候选序列。4对引物序列及PCR反应条件如表3。PCR体系为25 uL,包含2xTaq Plus Master Mix 12.5 uL,正反向引物各1pL,DNA模板1 uL, ddH,O 9.5 uL2。 取4 uL PCR产物用1%的琼脂糖凝胶(含GelRed染料)电泳,在凝胶成像仪中观察并拍照保存。并将扩增成功的PCR产物直接送至中国农业科学院作物科学研究所进行双向测序。 序列分析及评价利用序列拼接软件 CodonCodeAligner V7.01对测序峰图文件进行校对拼接,去除低质量序列及引物区;ITS序列除去18S和28S序列,保留 ITS1、5.8S和ITS2[15];使用 MEGA 7.0对拼接后序列进行比对分析,比较不同序列的比对后长度、变异位点 和遗传距离,分析序列的碱基组成,对各个候选序列进行种间种内变异分析,做出Barcoding gap 图116],并对数据进行1000次自展,以K2P模型采用NJ法建立系统进化树,分析银柴胡及混伪品的亲缘关系。同时运用相似性搜索算法 (BLAST)计算各序列的鉴定成功率I17]。 结果与分析 11候选序列扩增及测序成功率 PCR扩增和测序成功率是 DNA条形码分子鉴定的两个重要指标。4条候选序列扩增及测序结果如表4,其中 ITS、psbA-trnH和 rbcL 扩增成功率达100%,matK 扩增成功率最小为84.1%。 ITS的测序成功率最高,为95.2%, psbA-trnH的测序成功率较低,为90.3%。综合扩增和测序成功率, ITS序列最高(95.2%), matK最低(75.0%). 21候选序列的特征分析及鉴定成功率 4条序列的特征参数如长度、GC含量、遗传距离、变异位点数、变异率及鉴定成功率等信息详见表5。各序列的长度范围为211~797 bp,其中psbA-trnH最 Gene Primer 5'-3' PCR conditions ITS 5F GGAAGTAAAAGTCGTAACAAGG 94℃ 5 min; 94℃ 1 min,50℃ 1 min, 4R TCCTCCGCTTATTGATATGC 72℃ 1 min 33 s; 30 cycles matK 3F-KIM CGTACAGTACTTTTGTGTTTACGAG 95℃1 min; 95 ℃ 30 s, 56℃ 1 min, 1R-KIM ACCCAGTCCATCTGGAAATCTTGGTTC 72℃1 min, 40 cycles; 72 ℃ 10 min rbcL RbcLa-F ATGTCACCACAAACAGAGACTAAAGC 95℃ 1 min;95℃ 30 s, 56℃1 min, RbcLa-R GTAAAATCAAGTCCACCRCG 72℃ 40 s, 35 cycles; 72 ℃ 10 min psbA-trnH fwd PA GTTATGCATGAACGTAATGCTC 95℃ 1 min; 95℃ 30s; 58℃1 min, Rev TH CGCGCATGGTGGATTCACAATCC 72 ℃ 30 s, 35 cycles; 72 ℃ 10 min Table 4 The success rate of PCR amplification and bio-directionsequencing Candidate PCR Sequencing PCR amplification barcode amplification/% and sequencing/% ITS 100 95.2 95.2 psbA-trnH 100 90.3 90.3 matK 81.8 91.7 75.0 rbcL 100 93.1 93.1 Table 5 Identification efficiency and information of sequences Markers ITS matK psbA-trnH rbcL Number of nucleotides/bp 584-641 714-797 211-388 534-553 Number of indels 83 62 61 67 GC content/% 54.35 32.62 23.17 43.04 Genetic distance Average 0.206 0.089 0.605 0.036 Max 0.497 0.299 1.350 0.115 Min 0.000 0.000 0.000 0.000 Variation site 395 285 242 Conserved site 271 468 56 Variability rate 59.30% 37.85% 81.21% 13.93% Identification efficiency 90% 92% 72% 57% 短,为211~388 bp, matK 相对较长,为714~797 bp;其中平均遗传距离最大的为psbA-trnH, 其次是ITS。如表5所示, matK 和 ITS的鉴定成功率都较高,分别为92%和90%。综上分析, ITS序列变异率和平均遗传距离较大,且鉴定成功率最高。 3 候选序列的Barcoding gap 比较 对4种DNA条形码候选序列 Barcoding gap分析(图1), ITS序列有明显的间隔区,种间变异范围与种内变异范围无重叠区域,有利于银柴胡及其混伪品的区分。rbcL序列无明显间隔区, matK序列种间种内变异 有部分重叠,psbA-trnH序列无重叠区,但种内种间有部分差异不明显。 4 系统发育关系分析评价鉴定效率 利用 MEGA 7.0软件构建NJ系统化化树。如图2所示, ITS可将正品银柴胡聚为一支,与其亲缘关系较近的同属混伪品二柱繁缕也能明显分为不同分支,混伪品女娄菜和石竹聚为一支。而 rbcL 和 matK 不能把同属混伪品二柱繁缕分开,psbA-trnH序列所构建的进化树显示混伪品菊科植物山白菊和中华苦荬菜与银柴胡同科蝇子草属和石头花属植物聚在一支,无法很好地反映不同种间的遗传变异及同种样品间的同源性。 讨论 银柴胡作为在临床及中成药生产中应用广泛的中药材,部分混伪品流入市场,直接影响着相关中药的质量及临床用药安全。由于受鉴定人员经验、种质资源、药材采收时期等因素影响,利用传统生药鉴定的方法已经难以满足银柴胡真伪鉴定的需求。本研究选取4种候选条形码序列 ITS、psbA-trnH、rbcL 和 matK, 以PCR扩增和测序成功率、遗传距离、变异率、Barcodinggap 及进化树等为指标,分析其对银柴胡及其混伪品的鉴别情况I18]。结果显示,4条序列中, ITS 的 PCR扩增率、测序成功率、平均遗传距离和变异率都较高,其鉴定成功率达到90%;在检验不同序列的 Barcodinggap时, ITS序明有明显的间隔区,宜用于银柴胡真伪鉴别; NJ系统进化树显示, ITS可将银柴胡聚在一起,银柴胡同属植物混伪品二柱繁缕与银柴胡明显分为不 Figure 1 Barccooddiing gap plots of different candidate sequences. A: ITS sequence; B: matK sequence; C: psbA-trnH sequence; D: rbcLsequence Figure 2 NJ trees based on four DNA barcoding sequences for Stellariae Radix and its adulterants. A: ITS; B: psbA-trnH; C: matK; D:rbcL. Bootstrap 1 000 repetitions, the value on the support only shows self-support support rate≥70% 同分支,可对银柴胡及其混伪品进行准确鉴定。另外,ITS是最常用的系统发育序列[19],本研究中基于 ITS序列构建的进化树将样品聚为三支,分别为石竹科、伞形科和菊科,将各科同属的样本聚为一支,并能将同属不同物种分为不同分支,因此 ITS 序列也具有银柴胡分子进化研究的潜力。2018年, Meng 等I20]基于 ITS序列的银柴胡种质资源遗传多样性研究,推测目前宁夏和甘肃陇西所有人工栽培的银柴胡种质资源来源相同,是同一野生种的后代。 实验过程中4条序列的PCR扩增率都较高,其中ITS、psbA-trnH和rbcL扩增成功率达100%,matK 由于序列较长,测序成功率略低。PCR扩增和测序未成功的样本均经多次重复试验。其中, ITS 的测序成功率最高,为95.2%[211。在序列分析中,鉴定成功率是考察 不同序列对同一物种鉴别能力的重要指标之一。BLAST方法是将样本的DNA序列与全体序列进行碱基比对,按碱基差异进行排名,具有运行速度快、精度高的特点122.23]。结果显示, matK 和 ITS的鉴定成功率都较高,分别为92%和90%。本实验采用通用的DNA条形码引物和PCR扩增条件,并进行多次扩增和测序的重复试验以保证数据的可靠性,采用了包括序列变异分析、遗传距离计算、Barcoding gap检验、物种鉴定效率比较等多种分析方法以保证结论的可靠性。 理想的DNA条形码序列,种内遗传距离应该明显小于种间遗传距离,且种内遗传距离和种间遗传距离存在明显差异,两者内可形成一个半段的间隔区,即“DNA barcoding gap”,可用来判断种内不同个体之间的变异程度。Zheng等[24]在百合属内不同物种分子 鉴定中,5条候选序列的 Barcoding gap 图表明, ITS序列种与种间变异明显分为两大部分,其分布较高的遗传变异可以明显区分, ITS序列可作为鉴别百合属的较理想条形码序列。 Yang 等I25]对山矾属植物的最适DNA 条形码片段筛选时,从 Barcoding gap 图可看出, ITS 序列种内和种间的遗传距离频率分布重叠区域较小,满足DNA 条形码候选序列要求。本实验中Barcoding gap 图显示, ITS序列有明显的间隔区,种间变异范围与种内变异范围无重叠区域,作为优选序列有利于银柴胡药材的真伪鉴别。 ITS序列在扩增效率、鉴定成功率、种内与种间变异、Barcoding gap、系统发育树等方面均较其他序列表现良好。因此, ITS序列是准确鉴别银柴胡及其混伪品的理想DNA条形码鉴定序列。银柴胡DNA条形码的研究将为银柴胡市售药材的判定及混伪品鉴别提供可靠的分子水平依据。其也可作为《中国药典中药材DNA条形码标准序列》中银柴胡DNA条形码鉴定的补充,为有效监管银柴胡药材流通领域的各个环节提供辅助手段,有利于推动中药材市场的标准化和规范化,对保障银柴胡药材的临床用药安全具有重要意义。 ( References ) ( [1] C hinese Pharmacopoeia Committee. Pharmacopoeia of t hePeople’s Republic of China . Part 1(中华人民共 和 国药典 ) [S]. Beijing: China Medical Science Press , 2015: 2 2-23. ) ( [2] AoL,LiJ,LiuYH. Chemical constituents from Stellaria dichotoma and t heir a nti- i nflammatory activities [ J]. Chin T r adit Pat M e d ( 中 成药),2018,40: 1106-1109. ) ( [3] Jiang L L, Li u C K . St u dy on the the r apeutic eff e ct and cli n ical application ofWuji Baifeng pills [J]. Cl i n J Chin Med (中医临床 研究),2012,23:31-33. ) ( [4] Gao X M. Ch i nese Pharmacy(中药学) [M]. B eijing: China Pre s s of Traditional Chinese Medicine, 2007. ) ( [5] Shang B Y . The qu a lity analysis of cultivated Lanceolate Dichoto- mous S tarwort Roo t in Ningxia [ J]. Ningxia Med J(宁夏医学杂 志),2012, 34:451-452. ) ( [6] C ai S Q, Li J. Species Systematization and Quality Evaluation o fC o mmonly Used Chinese Traditional Dru g s (常用中药材品 种 整理 和 质量研究) [M]. Beijing: Beijing Medical Unive r sity Press, 2005. ) ( [7] Yu K Q, Jiao LK, R e n S Y , et al. R esearch p rogress of Chinese traditional medicinal Stellar i ae Radix [J]. M od Chin M e d (中 国 现代中药),2015,17:1223-1229. ) ( [8] Chen F . T he i d entification between S tellariae Radix and i ts adulterant Silene jenisseensis [J]. Guide C h ina Med ( 中国医药指 南),2013,11:234-235. ) ( [9] Techen N, Parveen I, Pan Z,et a l. DNA barcoding of medicinal plant m aterial f or i dentification [J]. Curr Opin B iotechnol, 2014, ) ( 25:103-110. ) ( [ 1 0] H ebert P DN, R a tnasingham S, de Waard JR. Barcoding animal l ife: cytochrome coxidase subunit 1 divergences among closely related species [J]. Proc Biol Sci, 2003, 2 7 0: S96-S99. ) ( [1 1 ] L i D Z, Liu J Q, C hen ZD, e t al. Plant DNA barcoding in C h ina [J] . J Sys t Evolut , 20 1 1 , 4 9: 1 65. ) ( [ 12] Ch e n S L . DN A Barcoding Mole c ular Identification of Tr adi -tional Chi n ese Medicine (中药DNA条形码分子鉴定)[M].Beijing: People's Medical P u blishing House, 2012: 14. ) ( [13] Chen SL, So n g JY, Yao H, e t a l. St r ategy and ke y te c hnique ofidentification of Chinese herbal medicine using DNA barcoding [J]. Chin J Nat Med(中国天然药物),2009,7 : 322-327. ) ( [14] L i J, H ao CQ, Z h ang R, et a l . S creening of the total DN A e xtrac- tion m ethods f o r different m aterial of R adix S tellariae []. Jiangsu Agric Sci ( 江苏农业科学),2018,46: 43-46. ) ( [15] Zheng S H , We i WL , Ren WG, et al. M ol e cular identification ofthe species o f Pinellia and i ts adulterants by DNA ba r coding [J]. Chin Bull Bot(植物学报),2014, 49:710-719. ) ( [16W ]a ng J, Hou YF , Ba i Z, et al. S creening the universal sequenceof D NA ba r codes in cu r cuma kwa n gsiensis [J] . China J Tradit Chin Med Pharm ( 中 华 中医药杂志),2015,30:10 0 -103. ) ( [ 1 7] Feng S S , Z h eng SH , Li YK, et a l . Ide n tification of Radix et Rhizoma Clematidis a nd i ts adulterants using DNA barcoding[ J ]. Acta Pharm Sin (药学学报),2014,49:260-266. ) ( [18] L u JN, Cheng H, F an JJ, et a l. DN A mole c ular ident i fication of Chinese h erbal materials of Dysosma by I TS2 b arcode sequence [J]. Chi n Trad i t He r b Drugs (中草 药),2018,49:3907-3911. ) ( [19] W ang D Y , W a ng Q, Wang YL , et al . E v aluation of DNA barcodes i n C o donopsis (Campanul- aceae) and in s ome l a rgeangiosperm plant genera [J]. PL o S One, 2017,12 : e017 02 86. ) ( [20] M eng XS, Dai XH, Liu P,et al. Study on genetic div e rsity of IT S sequence in Stellaria dichotoma var. lacceolata []. J Chin Med Mater (中药材),2018,41:55-59. ) ( [21] Wang YD, Ha n XN,Zhao YD, et al. Ide n tification of commercial Bupleuri Radix a nd i t s adulterants based on I TS2 barcode [ J ]. Chin Tradit Herb Drugs ( 中 草药),2017,48:3 5 90-3596. ) ( [22] L u Q Z . Th e St u dy on DN A Molecular Iden t ification of 12 Kinds of C o mmon Medicinal Pteridophytes i n Lushan R e gion ( 1 2 种 庐山地区常见药用蕨类植物的DNA分子鉴定研究)[D]. Nanchang: Nanchang University, 2018. ) ( [23] Zhou M, Fan LL, Gao HX, et al . T h e DNA barcoding research of Hedyotis diffusa [ J ]. Lishi z hen Med Mater Med R e s (时珍国医 国药 ) ,2018,29:103-106. ) ( [24] Z heng S H , L i YK, Re n WG , et al. Molecular identification i n genus o f Lilium based on DNA b a rcoding [ ] . Acta P h arm Sin (药学 学 报),2014,49:1730-1738. ) ( [25] Y ang P, Z hou HY, Wu HE, et a l . S creening research on DNA barcoding s equences of m e dicinal p l ants o f Symplocos [J] . JChin Med Mater(中药材),2018,41:13 3 1-1334. ) (C)China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 25日零时起,湖北省除武汉市以外地区解除离鄂通道管控,国内“抗疫”成果显著。本以为国内的疫情得到有效控制,我们就可以松一口气了,但国外患者数不断创新高。截至3月24日,全球已突破40万例,海外新增较前日增长15.18%,国外疫情不断升级,再次让我们见识了“新冠”病毒的厉害。数据来自丁香园2020年东京奥运圣会被推迟,美股一周内4次熔断,全球30多个国家封城甚至封国,世界各国正在经受前所未有的考验。而中国国内新增“新冠”确诊病例连续多日0增长,援鄂医疗队撤离,疫情重灾区武汉不断传出好消息,被按下暂停键的湖北也正在重启。中国的“抗疫”成果得到了全球各界的认可,其中一个重要的亮点引起了社会各界的重视。 “社会各界认为,中医药发挥了重要作用,成为这次疫情防控的一大亮点。”中央指导组成员、卫生健康委党组成员、中医药局党组书记余艳红介绍,全国新冠肺炎确诊病例中,有74187人使用了中医药,占91.5%,其中湖北省有61449人使用了中医药,占90.6%。“集中隔离,普遍服中药,是阻止疫情蔓延的基础。”中国工程院院士、天津中医药大学校长张伯礼介绍,数据显示,2月初“四类人员”当中诊断确诊比例是超过80%,中旬就降到了30%,到2月底下降到了百分之十以内。可以说中医药在此次抗击“新冠“的战役中,起到了至关重要的作用,具体内容,请大家查看文章:论中医药在“新冠”防止中的作用及效果。 我们今天的主角“银柴胡”是中医药中清肺的常用中药材。银柴胡的功效是清虚热、除疳热,银柴胡的作用是治阴虚发热、骨蒸劳热、小儿疳积发热,银柴胡用药禁忌是外感风寒及血虚。(具体用药,请遵照医生遗嘱,使用专业医师开具的药方) 银柴胡 《本草求原》:清肺、胃、脾、肾热,兼能凉血。《纲目拾遗》:谓热在骨髓,非银柴胡莫疗,用以治虚劳肌热骨蒸,劳疟热从髓出及小儿五疳赢热,盖退热而不苦泄,理阴而不升腾,固虚热之良药。 银柴胡作为在临床及中成药生产中应用广泛的中药材, 部分混伪品流入市场, 直接影响着相关中药的质量及临床用药安全。由于受鉴定人员经验、种质资源、药材采收时期等因素影响, 利用传统生药鉴定的方法已经难以满足银柴胡真伪鉴定的需求。中文核心期刊《药学学报》2019年05期中,一篇来自宁夏中药材开发与利用工程技术研究中心李军等人:“中药材银柴胡及其混伪品的DNA条形码鉴定研究”的文中,选取4种候选条形码序列ITS、psbA-trnH、rbcL 和matK, 以PCR扩增和测序成功率、遗传距离、变异率、Barcoding gap 及进化树等为指标, 分析其对银柴胡及其混伪品的鉴别情况。文中使用筛选合适的DNA条形码序列,以建立基于DNA条形码技术的银柴胡及其混伪品鉴定方法。该研究团队共收集了60份银柴胡及其混伪品,进行DNA提取:取经鉴定的银柴胡及其混伪品基原植物样品30 mg, 干燥药材去除表皮取中间部分50 mg,加入GP1 缓冲液和钢珠2 枚, 经高通量组织研磨机(美国SPEX公司 Geno 2010)研磨4 或6 min 后, 采用DNA 提取试剂盒提取总DNA,详细操作参照试剂盒说明书。SPEX 高通量组织研磨仪,可一批次处理6块深孔板,共576个样品,可进行干磨、湿磨、低温研磨,可快速粉碎样品,并保障样品完整性,对研磨中药材非常有效,是中药材研究的利器。 而后对4种DNA条形码序列ITS、psb A-trn H、rbc L和mat K进行PCR扩增和测序,计算各序列PCR扩增和测序成功率;利用MEGA7.0分析序列特征、计算遗传距离,并构建Neighbour-joining (NJ)系统进化树;利用种间种内变异分析做Barcoding gap图;运用BLAST方法计算各序列鉴定成功率,通过以上指标综合评价不同序列的鉴别能力。 结果显示, ITS序列的PCR扩增及测序成功率最高,为95.2%, matK最低,为75%; 4种序列的长度范围为211~797 bp, ITS的GC含量在各序列中最高,为54.35%; matK和ITS的鉴定成功率较高,分别为92%和90%; Barcoding gap图显示ITS有明显的间隔区, rbc L、mat K和psb A-trn H序列间隔区不明显或种间种内变异有部分重叠; NJ系统进化树显示, ITS可将银柴胡聚为一支,同属混伪品二柱繁缕与银柴胡明显分为不同支, rbc L和mat K不能把混伪品二柱繁缕分开。因此, ITS序列可作为银柴胡及其混伪品鉴定的优选条形码序列,为银柴胡的真伪鉴定提供科学依据。 查看更多资料,请关注培安官方微信公众号、登录培安官网:www.pynnco.com。
确定





还剩5页未读,是否继续阅读?
产品配置单

培安有限公司为您提供《银柴胡中DNA提取前处理检测方案(组织研磨仪)》,该方案主要用于中药材和饮片中前处理检测,参考标准--,《银柴胡中DNA提取前处理检测方案(组织研磨仪)》用到的仪器有HG-600 Geno/Grinder (原SPEX 2010)高通量动植物组织研磨机
推荐专场
相关方案
更多
该厂商其他方案
更多














