方案详情
文
本文基于《GB/T 19648-2006 水果和蔬菜中500 种农药及相关化学品残留量的测定 气相色谱- 质谱法》,结合赛默飞特有的CSR 大体积进样技术和Time-SIM 功能建立了测定蔬菜中11 种常检农药多残留检测方法。采用乙腈提取,复合固相萃取小柱GCB/PSA 柱一次净化。实验结果表明:进样量为5μL 时,各组分在0.02 ~ 0.5μg/mL 浓度范围内,线性关系良好, 相关系数R2 范围为0.9953 ~ 0.9996,各组分测定低限可达0.005mg/kg,提高了仪器检测灵敏度; 添加量分别为0.05、0.1 和0.2μg/mL 时, 回收率在50.76 ~ 105.03% 之间,相对标准偏差RSD 在0.53 ~ 9.63%之间(n=4),重复性良好,基本满足分析检测的要求。
方案详情

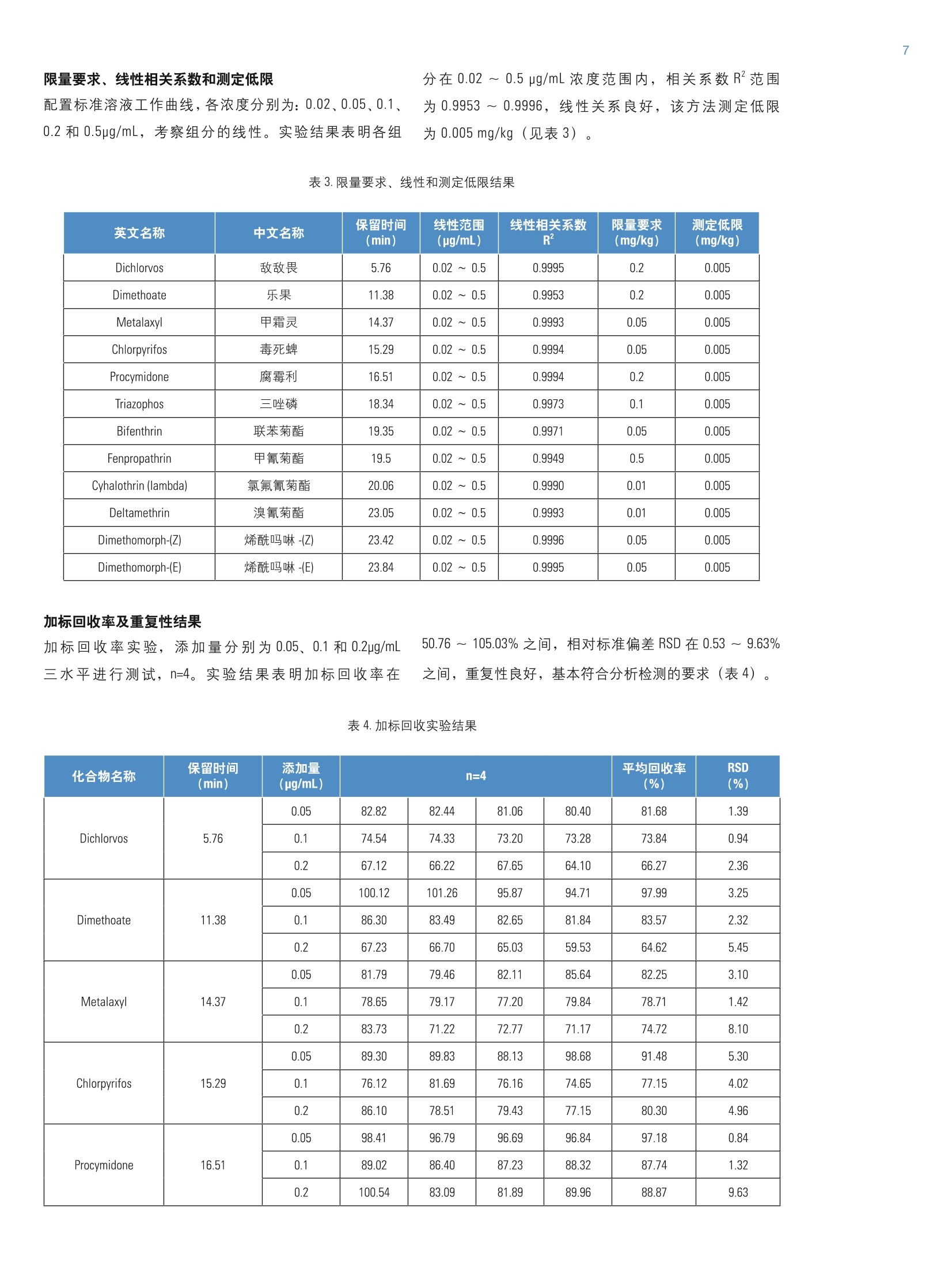
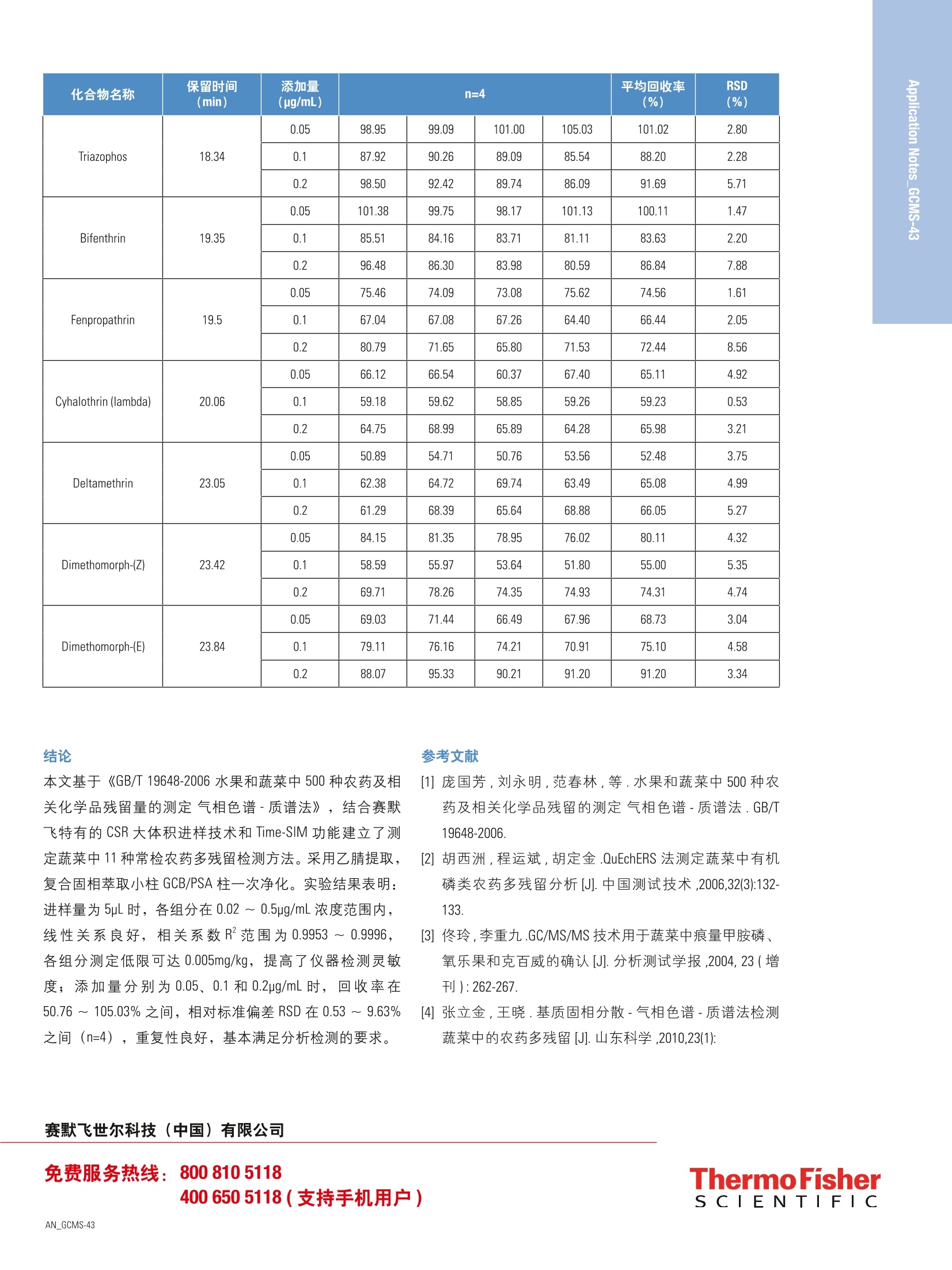
结果与讨论 2)特点二:分析高、低沸点化合物无歧视 本文基于《GB/T19648-2006 水果和蔬菜中500种农药及相关化学品残留量的测定气相色谱-质谱法》,建立了蔬菜中11种常检农药多残留的 GC-MS 检测方法,采用复合固相萃取小柱 GCB/PSA柱一次净化,并结合 CSR 大体积进样技术、Time-SIM功能,以及 TraceFinder 软件数据处理系统,可提高仪器检测灵敏度和分析效率。该方法线性良好、仪器检测灵敏度高、重复性好,基本满足分析检测的要求。 引言 随着科学进步和人类物质生活的不断提高,食品安全问题受到世界关注,各国对农药残留限量也要求越来越苛刻。绿叶蔬菜样品由于基质复杂,色素严重干扰检测,GB/T 19648-2006 采用两次净化步骤,前处理过程复杂。而本文建立的蔬菜中11种农药多残留的 GC-MS 检测方法,改进了净化技术,采用复合固相萃取小柱 GCB/PSA 柱-次净化,同样可以达到较好的净化效果,避免用串联柱净化时带来的麻烦,并结合CSR 大体积进样技术、Time-SIM 功能, 以及 TraceFinder 软件数据处理系统,提高了仪器检测灵敏度和分析效率。 仪器 Thermo Scientific'M ISO 单四极杆气质联用仪,包括:-TRACE 1310 气相色谱,配程序升温进样口- ISQ LT单四极杆质谱-AS1310自动进样器 Thermo Scientific"M TraceFinder 3.2.512.0数据处理系统 ( 耗材 ) Thermo ScientificM 毛细管色谱柱 TG-5sil MS (30 mx0.25mmx0.25 pm) (P/N 26096-1420) Thermo ScientificM CSR kit (P/N 19050725) TTHhermo ScientificM预柱(5mx0.32mm) (P/N 26080010) Thermo Scientific不分流衬管(P/N453A1925) Thermo ScientificM低流失进样口隔垫 (P/N 31303233) Thermo ScientificM气相色谱进样口石墨垫 (P/N 290VA191) Thermo ScientificM质谱端石墨垫 (P/N 29033496) Thermo ScientificM15mL塑料离心管 (P/N 339650) Thermo ScientificM2ml进样小瓶(P/N C4000-88W) Thermo ScientificM 2mL 进样小瓶样品架 (5×10, C4012-25) Thermo Scientific 10 ~100pL 移液器 (JH91538) Thermo Scientific 100 ~ 1000uL 移液器 (JH91348) Thermo ScientificM37610-33CN 涡旋混合器 (P/NC1861130737630) 1)乙腈:色谱纯; 3)无水硫酸钠:分析纯,用前在650℃灼烧4h,至于干燥器中,冷却后备用; 4)乙酸乙酯:色谱纯; 5)正己烷:色谱纯; 6)甲苯:分析纯; 7)洗脱液配制:乙乙-甲苯(3+1,体积比); 8)固相萃取柱: GCB/PSA柱(500mg/500mg, 6mL); 9)农药标准物质:敌敌畏、乐果、甲霜灵、毒死蜱、腐霉利、三唑磷、联苯菊酯、甲氰菊酯、氯氟氰菊酯、溴氰菊酯、烯酰吗啉购于农业部环境保护科研测所和德国 Dr.E公司; 10)青菜样品,试样制备参考 GB/T 19648-2006。 标准溶液的制备 准确称取上述标准品(精确至0.1mg),用正己烷(配制有机氯和菊酯类农药)或乙酸乙酯(配制有机磷农药)溶解并定容配制成一定浓度的储备液,于4℃冰箱中避光保存。 混合标准工作液的制备 取适量量准储备液用乙酸乙酯稀释至浓度为 10pg/mL的混合标准工作溶液待用。 标准工作曲线溶液的制备 取混合标准液用乙酸乙酯稀释至浓度为0.02、0.05、0.1、0.2、0.5pg/mL系列点, 供GC-MS分析。 (1)提取 20mL乙腈,再加人5g氯化钠,涡旋提取2min, 将离心管放入离心机,4200r/min 离心5min, 取上清液于鸡心瓶中,残渣再 20mL乙乙涡旋提取1min, 4200r/min 离心5min, 合并二次提取上清液,在40℃以下旋转蒸发浓缩至1~3mL,待净化。 (2)净化 活化柱:将 PSA/GCB 柱(500mg/500mg, 6 mL)置 SPE 装置上,在柱中加入约 2cm 高的无水硫酸钠,用10mL乙腈+甲苯(3+1)预洗柱,用洗耳球吹去柱中的气泡,弃去淋洗液,直至液面到达无水硫酸钠的顶部,关闭 SPE装置流速控制开关。 上柱净化:将活化后的 PSA/GCB 柱转移至25mL玻璃离心管上,将样品浓缩液转移至柱上,样品被全部吸附后,用2mL乙青+甲苯(3+1)洗涤鸡心瓶(涡旋),并将洗涤液移入柱中,重复操作三次以上,继续用乙腈+甲苯(3+1)洗涤柱,直至收集流出液共25mL, 将净化液在≤40℃下氮气吹干仪吹干,用乙酸乙酯定容至1ml,过滤膜,装入进样瓶供气相色谱质谱仪分析。 GC-MS仪器条件 (1)色谱条件 色谱柱: TG-5silMS (30 m x 0.25 mm×0.25 pm); 进样口温度:250℃;升温程序:初始温度为50℃,保持2min,以 50℃ /min 升至150℃, 再以5℃ /min 升至200℃,最后以16℃ /min 升至300℃,保持4min;载气:氦气(纯度≥99.999%);载气流速: 1.2mL/min; 进样量:5pL;进样方式:不分流进样。 (2)质谱条件 离子源:El源; 离子源温度:300℃;传输线温度:300℃;采集模式: Time-SIM 模式; SIM 参数信息见表1。 表1.SIM 参数信息 英文名称 中文名称 保留时间 (min) 定量离子(m/z) 定性离子1(m/z) 定性离子2(m/z) Dichlorvos 敌敌畏 5.76 109 185 187 Dimethoate 乐果 11.38 87 93 125 Metalaxyl 甲霜灵 14.37 249 206 45 Chlorpyrifos 毒死蜱 15.29 314 258 286 Procymidone 腐霉利 16.51 283 96 285 Triazophos 三唑磷 18.34 161 77 162 Bifenthrin 联苯菊酯 19.35 181 165 166 Fenpropathrin 甲氰菊酯 19.5 181 97 265 Cyhalothrin (lambda) 氯氟氰菊酯 20.06 181 197 208 Deltamethrin 溴氰菊酯 23.05 181 251 253 Dimethomorph-(Z) 烯酰吗啉-(Z) 23.42 301 303 387 Dimethomorph-(E) 烯酰吗啉-(E) 23.84 301 303 387 CSR 大体积进样原理介绍 溶剂浓缩大体积进样技术 (Concurrent Solvent Recondensation,简称CSR),即在进样口和分析柱间连接一段空的预柱,且衬管中装填玻璃棉,采用传统的分流不分流进样口,进样口处于恒定的较高温度,自动进样器插入汽化室5mm,保持针头部分温度较低,快速注入样品。样品以带状液体的状态离开注射器,被收集在衬管底部的少量玻璃棉上,开始缓慢汽化。由于衬管是一个密闭体系,蒸汽体积迅速膨胀,取代和压缩载气,使得衬管内压力迅速增大,而载气阻止了溶剂蒸汽从汽化室溢出,从而产生了“压力涌浪”效应,迫使溶剂蒸汽转移到低温的预柱上。溶剂蒸汽在柱头上冷凝形成液膜,进一步加速了蒸汽的转移,此时溶剂汽化和冷凝同时发生,使得进样体积不再受汽化体积的限制,从而实现大体积进样,预柱起承载样品的作用。图1为 CSR 基本原理图解,图2为 CSR 进样过程。 图1.CSR基本原理图解 图3.不同进样体积结果 图2. CSR 进样过程 CSR 大体积进样技术特点 PTV进样虽然进样体积可高达250pL,但是在溶剂蒸发的过程中会造成低沸点化合物的损失;而OCI进样虽然不会造成低沸点化合物损失,但由于样品溶液直接注入到色谱柱中,很容易造成色谱柱的污染,导致部分有机磷农药响应偏低、且影响分离。相比, CSR 技术更具有优越性,具备以下三个特点。 1)特点一:显著提高检测灵敏度 CSR 最大进样体积为50pL,能显著提高检测灵敏度。例如: CSR 大体积进样气相色谱质谱中的应用,如图3所示,进样量为1、2、3、4、5uL时所得的结果比较,从图中可以得出,随着进样体积的增加,响应值几乎呈线性倍数增加,充分表明增加进样量可以显著提高检测灵敏度。 如图4所示,以正己烷为溶剂,不同环数烷烃的大体积进样分析,进样体积35pL。从图中可以看出比正己烷溶剂多两个碳的化合物C8,并未随溶剂蒸发损失,且高沸点的 C40具有较好的响应及分析精密度,进一步证明了CSR 对低沸点和高沸点化合物均无歧视效应。 图4.低、高沸点化合物无歧视 3)特点三:简化前处理过程,避免低沸点化合物浓缩时有损失 如图5所示,在环境水体中 PAHs的分析,T,-一般需要浓缩1000倍,进样量为1pL,采用液液萃取和 SPE 小柱富集两种方式均消耗大量溶剂,且费时,在氮吹浓缩过程中容易造成低沸点 PAHs 的损失。因此可以采用类似液液微萃取的方式,只需1mL有机溶剂,20mL水样,无需氮吹浓缩,萃取后可直接进样分析,进样量为50pL,可达到相同效果, 甚至更好,既可以大大减少样品前处理过程,并避免低沸点化合物的损失。同样,在农残分析过程中,如敌百虫、敌敌畏、甲胺磷等低沸点农药在旋转蒸发和氮吹浓缩过程中也容易损失一部分,从而造成结果不准确,因此可以采用 CSR 技术来解决这一问题。 图5.简化前处理过程 Time-SIM 与普通 SIM的比较 Time-SIM 与普通SIM的比较:普通SIM需要人工切段分组,方法设置繁琐,不但浪费了采集时间,降低了色谱分辨和结果的精密度,而且色谱峰容易被切割;而 Time-SIM无需切段,自动按保留时间分组,并利用CDB 数据库使得方法设置更加方便快捷,同时有效利用采集时间,所得质谱图更多,大大提高了色谱分辨和结果的精密度,而且色谱峰不易被切割。从以下各图均能看出, Time-SIM要优于普通 SIM。 表2.Time-SIM 与普通 SIM 的比较 扫描模式 分组方式 采集时间 准确度 方法设置 其他 普通 SIM 切段分组 浪费采集时间 低 复杂 色谱峰容易被切割 Time-SIM 无需切段,自动按保留时间分组 有效利用采集 高 简单 色谱峰不易被切割 图6.分组方式比较 图7.采集效率比较 Time-SIM 方法建立介绍 建立主方法 (Marster Method)时,可以直接从数据库中选取要分析的目标化合物,相关化合物的所有信息即刻转入到方法中,无需手动输入化合物的任何信息,使用 方便,,.节约了大量的工作时间,也避免了手动输入引起的错误。建立的农药分析方法包包含了仪器采集方法和数据处理方法。 步骤如下:在TF3.2里选择Method View, 在 Filel 里选择新建 MarsterMethod,选择从 CDB 建立主方法,选择导入数据库里的数据,导入完成后要链接 Instrument Method,下面就要链接一个原始数据,关联完数据后,要在 Compunds 里面进行色谱峰积分设置,校正设置,内标外标,校正水平设置。如果在保留时间内没有目标峰,可能是因为通道不对,要在 Detection 里定性或定量色谱图信息里选择Signal,选择对应的通道。上述 Acquisition -Timed (Time-SIM)各项设置完成后就必须保存主方法,主方法建立完成。 图8.选择从CDB 建立主方法 NY-98-SDM (2)meth-Thermo Xcalbi l一X 图 10. Acquisition -Timed 参数设置 典型色谱图 图11.标准溶液色谱图 图12.空白色谱图 限量要求、线性相关系数和测定低限 配置标准溶液工作曲线,各浓度分别为:0.02、0.05、0.1、0.2和0.5pg/mL,考察组分的线性。实验结果表明各组 分在0.02~0.5 pg/mL浓度范围内,相关系数R范围为0.9953~0.9996,线性关系良好,该方法测定低限为 0.005 mg/kg (见表3)。 表3.限量要求、线性和测定低限结果 英文名称 中文名称 保留时间(min) 线性范围(pg/mL) 线性相关系数 R² 限量要求(mg/kg) 测定低限(mg/kg) Dichlorvos 敌敌畏 5.76 0.02~0.5 0.9995 0.2 0.005 Dimethoate 乐果 11.38 0.02~0.5 0.9953 0.2 0.005 Metalaxyl 甲霜灵 14.37 0.02~0.5 0.9993 0.05 0.005 Chlorpyrifos 毒死蜱 15.29 0.02~0.5 0.9994 0.05 0.005 Procymidone 腐霉利 16.51 0.02~0.5 0.9994 0.2 0.005 Triazophos 三唑磷 18.34 0.02~0.5 0.9973 0.1 0.005 Bifenthrin 联苯菊酯 19.35 0.02~0.5 0.9971 0.05 0.005 Fenpropathrin 甲氰菊酯 19.5 0.02~0.5 0.9949 0.5 0.005 Cyhalothrin (lambda) 氯氟氰菊酯 20.06 0.02~0.5 0.9990 0.01 0.005 Deltamethrin 溴氰菊酯 23.05 0.02~0.5 0.9993 0.01 0.005 Dimethomorph-(Z) 烯酰吗啉-(Z) 23.42 0.02~0.5 0.9996 0.05 0.005 Dimethomorph-(E) 烯酰吗啉-(E) 23.84 0.02~0.5 0.9995 0.05 0.005 加标回收率及重复性结果 加标回收率实验,添加量分别为0.05、0.1和0.2ug/mL 50.76~105.03%之间,相对标准偏差 RSD 在0.53~9.63%三水平进行测试, n=4。实验结果表明加标回收率在 之间,重复性良好,基本符合分析检测的要求(表4)。 表4.加标回收实验结果 化合物名称 保留时间 (min) 添加量(ug/mL) n=4 平均回收率 (%) RSD (%) Dichlorvos 5.76 0.05 82.82 82.44 81.06 80.40 81.68 1.39 0.1 74.54 74.33 73.20 73.28 73.84 0.94 0.2 67.12 66.22 67.65 64.10 66.27 2.36 Dimethoate 11.38 0.05 100.12 101.26 95.87 94.71 97.99 3.25 0.1 86.30 83.49 82.65 81.84 83.57 2.32 0.2 67.23 66.70 65.03 59.53 64.62 5.45 Metalaxyl 14.37 0.05 81.79 79.46 82.11 85.64 82.25 3.10 0.1 78.65 79.17 77.20 79.84 78.71 1.42 0.2 83.73 71.22 72.77 71.17 74.72 8.10 Chlorpyrifos 15.29 0.05 89.30 89.83 88.13 98.68 91.48 5.30 0.1 76.12 81.69 76.16 74.65 77.15 4.02 0.2 86.10 78.51 79.43 77.15 80.30 4.96 Procymidone 16.51 0.05 98.41 96.79 96.69 96.84 97.18 0.84 0.1 89.02 86.40 87.23 88.32 87.74 1.32 0.2 100.54 83.09 81.89 89.96 88.87 9.63 化合物名称 保留时间 (min) 添加量(ug/mL) n=4 平均回收率 (%) RSD (%) Triazophos 18.34 0.05 98.95 99.09 101.00 105.03 101.02 2.80 0.1 87.92 90.26 89.09 85.54 88.20 2.28 0.2 98.50 92.42 89.74 86.09 91.69 5.71 Bifenthrin 19.35 0.05 101.38 99.75 98.17 101.13 100.11 1.47 0.1 85.51 84.16 83.71 81.11 83.63 2.20 0.2 96.48 86.30 83.98 80.59 86.84 7.88 Fenpropathrin 19.5 0.05 75.46 74.09 73.08 75.62 74.56 1.61 0.1 67.04 67.08 67.26 64.40 66.44 2.05 0.2 80.79 71.65 65.80 71.53 72.44 8.56 Cyhalothrin (lambda) 20.06 0.05 66.12 66.54 60.37 67.40 65.11 4.92 0.1 59.18 59.62 58.85 59.26 59.23 0.53 0.2 64.75 68.99 65.89 64.28 65.98 3.21 Deltamethrin 23.05 0.05 50.89 54.71 50.76 53.56 52.48 3.75 0.1 62.38 64.72 69.74 63.49 65.08 4.99 0.2 61.29 68.39 65.64 68.88 66.05 5.27 Dimethomorph-(Z) 23.42 0.05 84.15 81.35 78.95 76.02 80.11 4.32 0.1 58.59 55.97 53.64 51.80 55.00 5.35 0.2 69.71 78.26 74.35 74.93 74.31 4.74 Dimethomorph-(E) 23.84 0.05 69.03 71.44 66.49 67.96 68.73 3.04 0.1 79.11 76.16 74.21 70.91 75.10 4.58 0.2 88.07 95.33 90.21 91.20 91.20 3.34 结论 本文基于 《GB/T 19648-2006 水果和蔬菜中500种农药及相关化学品残留量的测定气相色谱-质谱法》,结合赛默飞特有的CSR大体积进样技术和 Time-SIM 功能建立了测定蔬菜中11种常检农药多残留检测方法。采用乙腈提取,复合固相萃取小柱 GCB/PSA 柱一次净化。实验结果表明:进样量为5pL时,各组分在0.02~ 0.5pg/mL 浓度范围内,线性关系良好,相关系数R范围为0.9953~0.9996,各组分测定低限可达0.005mg/kg,提高了仪器检测灵敏度;添加量分别为0.05、0.1和 0.2ug/mL时,回收率在50.76~105.03%之间,相对标准偏差 RSD 在0.53~9.63%之间(n=4),重复性良好,基本满足分析检测的要求。 ( [1]庞国芳,刘永明,范春林,等.水果和蔬菜中500种农药及相关化学品残留的测定气相色谱-质谱法.GB/T 19648-2006. ) ( [2]胡西洲,程运斌,胡定金.QuEchERS 法测定蔬菜中有机 磷类农药多残留分析[J].中国测试技术,2006,32(3):132- 133. ) ( [3]佟玲,李重九.GC/MS/MS 技术用于蔬菜中痕量甲胺磷、 氧乐果和克百威的确认[J].分析测试学报,2004,23(增 刊) : 262-267. ) ( [4]张立金,王晓.基质固相分散-气相色谱-质谱法检测蔬菜中的农药多残留 [J].山东科学,2010,23(1): ) ThermoFisherS CIENTIFIC AN_GCMS- 随着科学进步和人类物质生活的不断提高,食品安全问题受到世界关注,各国对农药残留限量也要求越来越苛刻。绿叶蔬菜样品由于基质复杂,色素严重干扰检测,GB/T 19648-2006 采用两次净化步骤,前处理过程复杂。而本文建立的蔬菜中11 种农药多残留的GC-MS 检测方法,改进了净化技术,采用复合固相萃取小柱GCB/PSA 柱一次净化,同样可以达到较好的净化效果,避免用串联柱净化时带来的麻烦,并结合CSR 大体积进样技术、Time-SIM 功能,以及TraceFinder 软件数据处理系统,提高了仪器检测灵敏度和分析效率。
确定




还剩6页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《蔬菜中农药多残留检测方案(气相色谱仪)》,该方案主要用于蔬菜中农药残留检测,参考标准--,《蔬菜中农药多残留检测方案(气相色谱仪)》用到的仪器有赛默飞TRACE 1300系列 模块化气相色谱仪、赛默飞ISQ™ 7000单四极杆GC-MS、赛默飞TraceFinder软件
推荐专场
相关方案
更多
该厂商其他方案
更多