
方案详情
文
对样品结果的仔细解析可以有力地证明牡蛎受到墨西哥湾原油的脂肪烃污染和PAH污染。牡蛎样品分析得到的脂肪烃和PAH谱图与墨西哥湾原油分析得到的谱图相匹配,表4列举出墨西哥湾原油的组成成分,特征物正十六烷、正十七烷和异十八烷的含量相对较高,异十八烷/C-17含量比为0.7,植烷/C-18含量比为0.35。单个脂肪烃的任意组合的相对含量的测定值与墨西哥湾原油的组成相匹配。列举了直接测定墨西哥湾原油的结果,以及牡蛎样品净化后的测定结果。需要指出的是,油的组成会随着时间发生变化,因此被牡蛎吸收部分的色谱图与原油的色谱图是有区别的,其它原油样品的谱图也证明了这种区别。列举了原油中的PAHs的测定结果,特征性的Ant、Phe、Flu和Chr的浓度比B(a)P的浓度高100倍。为了对PAHs进行准确定性,方法提供了高质量数PAHs的半定量测定结果,作为判断牡蛎样品中PAHs的含量是否超过安全限值的有力依据。要得到准确可靠的结果,必须采取更加精细的净化步骤。
方案详情

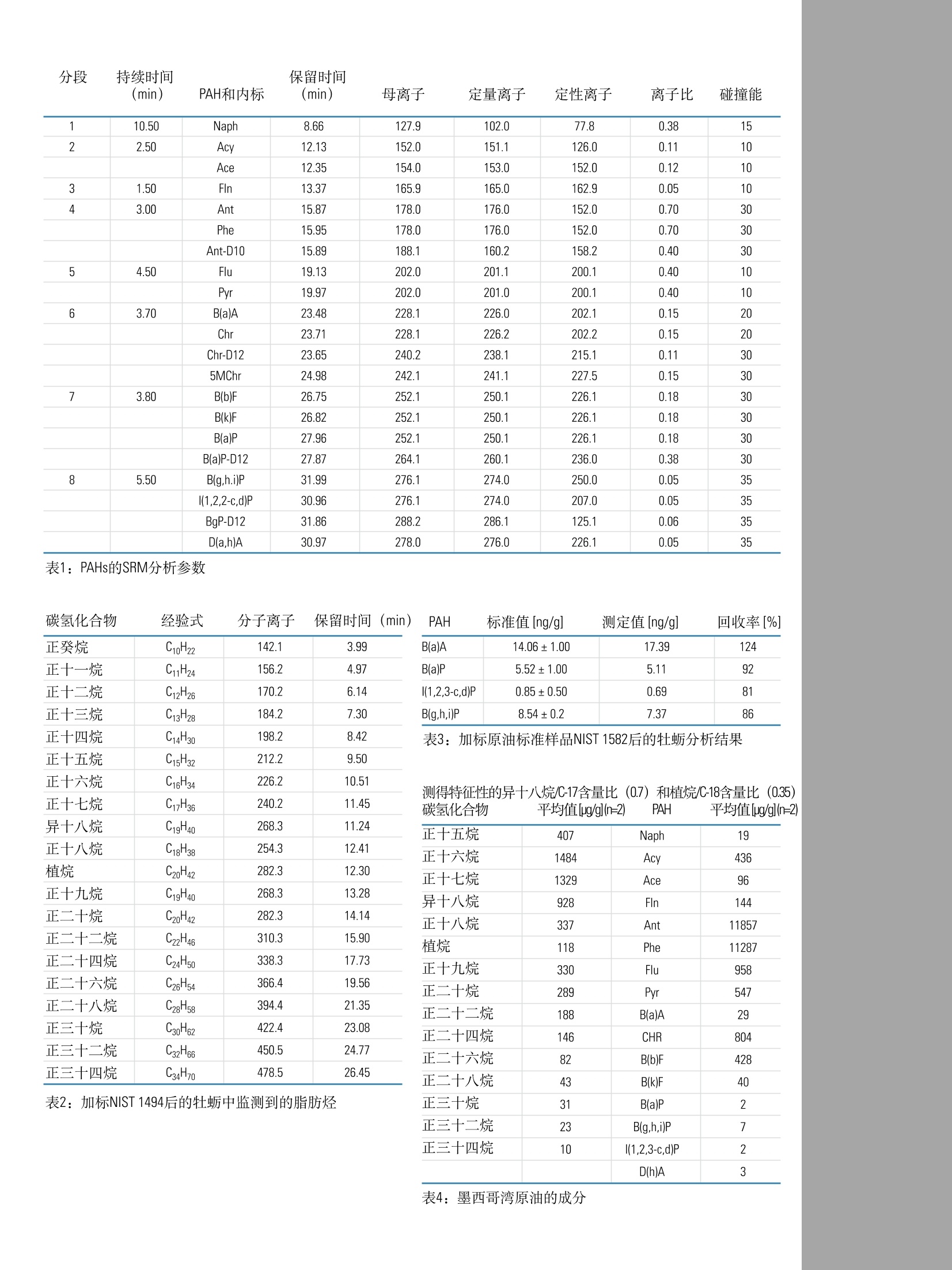
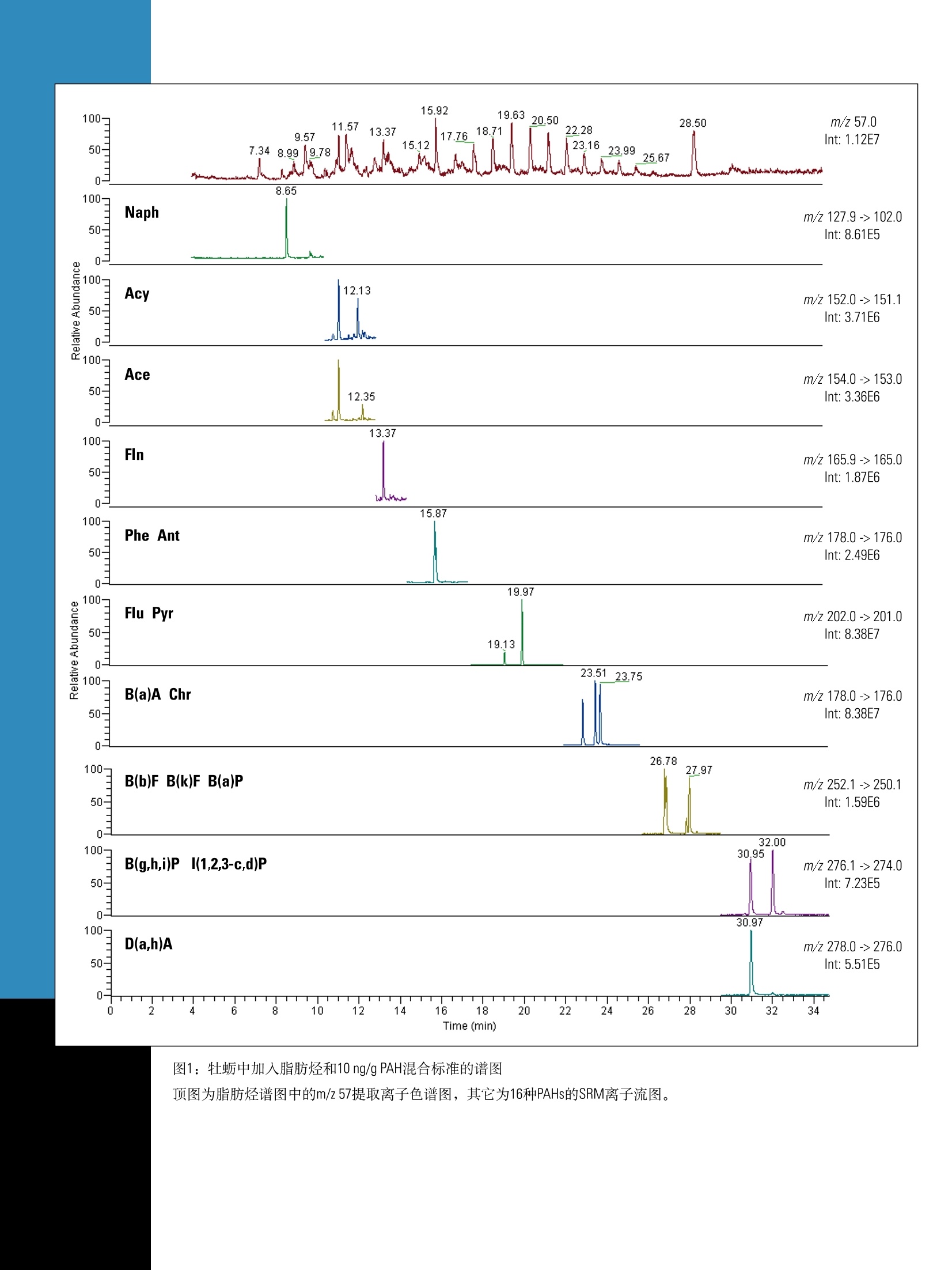
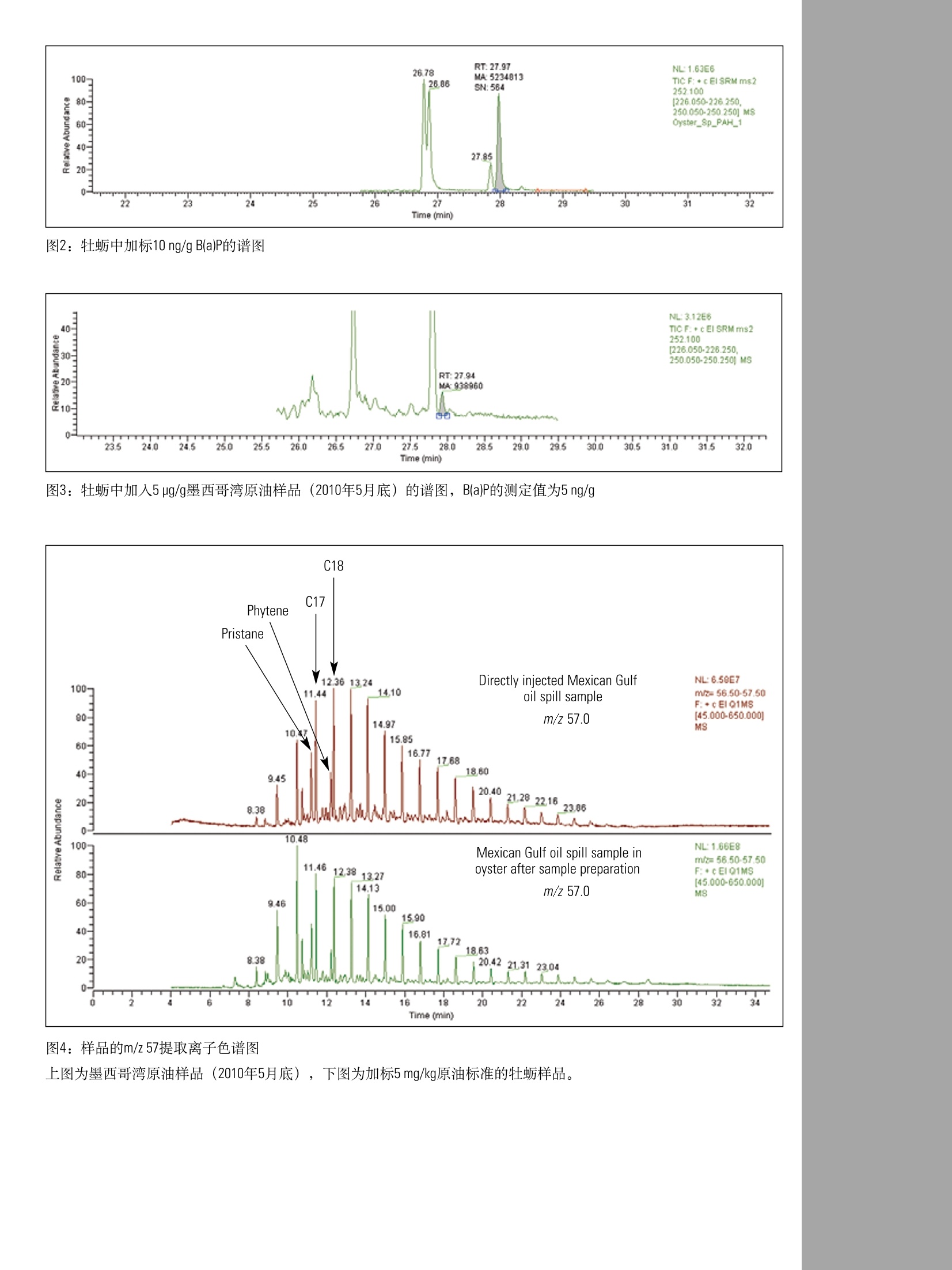
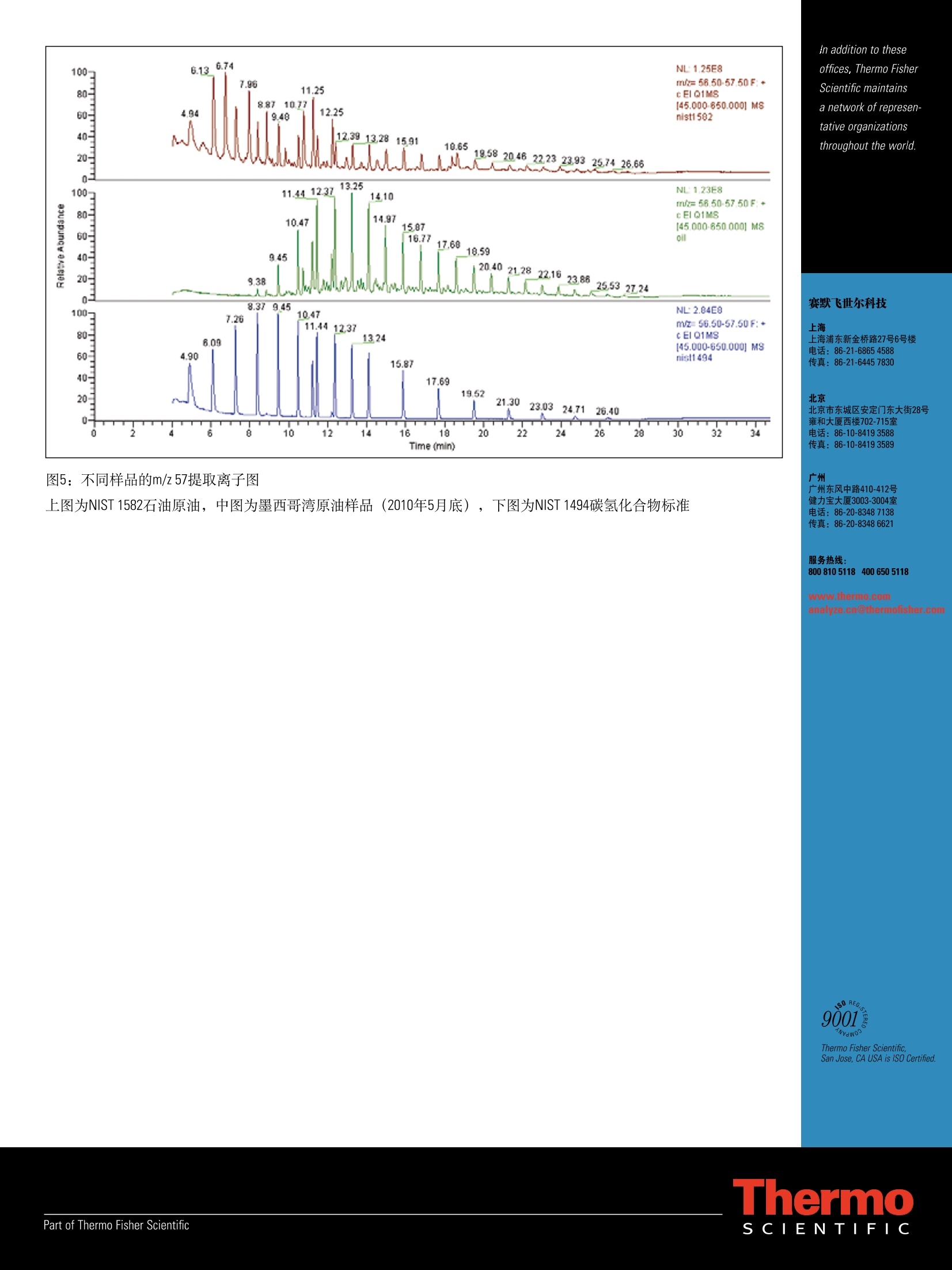
ApplicationNote:51980GC-MS/MS测定牡蛎中的多环芳烃(PAHs)和脂肪烃Part of Thermo Fisher Scientific 1方法示意图 Key Words ·TEQ Quantum XLS ·脂肪烃 1.准确称取样品,至于15mL玻璃管中并加入内标 ·海湾溢油 2.搅拌样品10s 3.平衡10min ·油污染 ·牡蛎提取物 溶剂提取 ·多环芳烃 4.用5mL正己烷超声萃取10min 4试剂 5.用巴氏吸管将萃取液移取至圆底烧瓶中 Fisher Scientific USA 6.重复步骤4和步骤5三次 7.将萃取液浓缩至约1mL 净化 8.用3mL正己烷活化固相萃取柱 4.1 丙酮 A9491 4.2 环己烷 C6201 4.3 正己烷 H3021 4.4 lypersep SI 固相萃取柱, 200mg/3mL 03251270 4.5 甲苯 AC176850010 9.上样 5校准标样 10.用5mL正己烷洗脱 5.1 PAHs 浓缩 芯-Ace (Sigma公司) 11.氮吹至干 二氢氢基-Acy(Sigma公司) 12.加入180uL环己烷和20uL进样/替代标样 蒽-Ant (Sigma公司) GC-MS/MS 2!应用领域 苯并(ghi)-B(g,h,i)P (Sigma公司) 2010年5月,墨西哥湾发生原油泄漏事故,用该方法检测牡蛎,可以判断牡蛎是否受到脂肪烃和PAH污染。该方法依据GC-MS/MS谱图可以判定污染来源。PAHs的半定量结果能够指示其含量是否超出了牡蛎的安全食用限值。 苯并[k]荧蒽-B(k)F (Sigma公司) 荧蒽-Flu (Sigma公司) 芴-FIn(Sigma公司) 3房原理 茚并(1,2,3-cd)芘-(1,2,3-c,d)P (Sigma公司) 用正己烷对牡蛎进行提取,然后使用硅胶固相萃取柱净化提取液。样品中加入适当的内标物,采用TSQ QuantumXLS三重四极杆GC-MS/MS仪进行测定。脂肪烃和PAHs对食品安全很重要,用该方法可以测定,并且能与2010年5月底溢出的墨西哥湾原油的测定结果相比较。 萘-Naph(Sigma公司) 芘-Pyr (Sigma公司) 5.2进样内标 5-甲基苯并[a]菲-5-MChr (Dr. Ehrenstorfer公司) 5.3内标 蒽-D10-Ant-D10 (Sigma) 苯并[a]芘-D12-B(a)P-D12 (Sigma) 苯并(ghi)-D12-B(g,h,i)P-D12 (LGC Standards) 屈-D12-Chr-D12 (Sigma) 5.4质控样 原油 (NIST标准物质,1582) 脂肪烃溶于2,2,4-三甲基戊烷 (NIST标准物质,1494) 6标样及试剂配制 6.1 PAH储备液2 pg/mL, 溶于甲苯。 6.2 PAH内标溶液:2pg/mL[苯并(ghi) -D12、蒽-D10、屈-D12],溶于甲苯;200 ug/mL苯并[a]芘-D12,溶于环己烷。 6.316种PAH的标准溶液混合物100 ng/mL, 溶于甲苯 6.4 PAHs内标标准溶液混合物200 ng/mL, 溶于甲苯6.5进样内标:5-甲基屈200ng/mL, 溶于甲苯 6.6加标 (NIST 1582)原油样品100 mg/mL,溶于环己烷 7仪器设备 Fisher Scientific USA 产品号 7.1离心机, HeraeusTM, MultifugeTM X3 75-004-500 7.2Thermo Scientific 16位真空固相萃取仪 03-251-252 7.3EVTM-130-32-16蒸发器 (Fisher Scientific Germany) 7.4Fisher 精密天平 7.5真空泵 05-402-100 7.6 旋转蒸发仪⑧R-210 7.7赛多利斯分析天平 01-910-3224 7.8Thermo sci. Barnstead EasypureM Ⅱ超纯水系统 7.9Elmsonic S40H 超声仪 7.10 ULTRA-TURRAXQ-胶溶工具 7.11 ULTRA-TURRAX-插入式接头 7.12 ULTRA-TURRAX 7.13漩涡振荡器 7.14漩涡标准盖 7.15气相色谱柱 TR-50MS 30m, 内径0.25mm, 膜厚0.25um 7.16 TSQ Quantum XLS 三重四极杆质谱仪 8.1 气相色谱样品瓶 03393F 8.2 Finnpipette移液器100-1000 pL 14386320 8.3Finnpipette移液器10-100uL 14356318 8.4 Finnpipette移液器 500-5000 uL 14386321 8.5 移液管架 14245160 8.6 钠钙玻璃材质的巴氏吸管150mm 136786A 8.7 移液器 03-692-350 8.8 移液吸头0.5-250pL,500个/盒 21377144 8.9 移液吸头1-5mL, 75个/盒 2137750 8.10移液吸头 100-1000pL, 200个/盒 2137746 8.11 18/10钢质抹刀 14356C 8.12尼龙抹刀 NC9319088 8.13 Hypersep SI 固相萃取柱, 03251270 200mg/3mL, 50 pc. 8.14管架 03840233 8.15 PTFE洗瓶 0340911A 玻璃器皿 3106395 8.16 50mL烧杯 FB10050 8.17 Fisherbrand试管 01918306 14-958D 8.1855mm漏斗 14353D 8.19玻璃管 14957E 8.20巴氏吸管 136786A 0905050 8.21 50mL圆底烧瓶, NS 29/32 9011835 (Fisher Scientific Germany) 1546060 8.22 10mL容量瓶 FB40110 1425980 8.233 25ml容量瓶 10200A 14259023 9.实验步骤 产品号 9.1样品制备 14505141 在分析前将玻璃器皿用丙酮清洗,以避免交叉污染。 取适量的牡蛎肉(如250g)用高速搅拌器(如ULTRA- TURRAX)搅拌均匀。 9.2提取 9.2.1准确称取均质样品(约2g)于玻璃管中。 9.2.2加入PAH内标50uL。 9.2.3混合物搅拌10s后,稳定10min。 9.2.4加入5mL的正己烷,超声10min。 9.2.5用巴氏吸管将上层萃取液移取至50mL的圆底烧瓶中。 9.2.6再重复萃取三次(重复步骤9.2.4和9.2.5)。 9.2.7在5℃的条件下,以4500rpm转速离心5min, 取上层清液。 9.2.8在真空条件下浓缩萃取液至1mL(真空度220mbar,温度50℃)。 9.3净化 9.3.1用3mL正己烷活化固相萃取柱。 9.3.2提取液通过固相萃取柱后,用5mL正己烷洗脱,洗脱液置于蒸发管中。 9.3.340℃下,氮吹至干。 9.3.4加入180pL环己烷和20pL进样内标。 9.4分析 9.4.1GC条件 采用Thermo Scientific TRACE GC UItraTM 系统 (Thermo FisherScientific, Waltham, MAUSA) 。GC条件如下: 色谱柱: Thermo TR-50MS 30m, 内径0.25mm,膜厚0.25pm毛细管柱 进样模式:不分流,5mm 进样衬管 进样口温度:270℃ 柱流量:1.2mL/min 分流管路::“On",流速:25mL/min 不分流时间:1min SSL 载气模式:恒定流速 初始值: On",1.2 mL/min 初始时间:1min 载气节省流速:1.5mL/min 载气节省时间: 3min 真空补偿:“On" 传输线温度:270℃ 柱温:60℃保持1min, 以12℃/min升至210℃, 再以8℃/min升至340℃,保持5min. 9.4.2质谱条件 采用TSQ Quantum XLS 三重四极杆质谱仪(Thermo FisherScientific, Waltham, MA USA)。当检测器设置为m/z<300,FC43(校准气)的三个离子(68,219和502)的高度至少为各自窗口高度的一半,502和503离子分辨率好,能够得到满意的调谐结果。 分析PAHs的质谱条件 离子化方式:El正离子电离模式 离子盒:密闭的E电离源 发射电流:50uA 离子源温度:250℃扫描方式:全扫描,m/z范围45-650,和选择反应监测 (SRM)扫描模式 扫描带宽:SRM扫描为0.15 全扫描的扫描时间为0.2s, SRM扫描为0.05s 峰宽:Q1,0.7Da; Q3, 0.7Da 半峰宽 碰撞气体(Ar)压力:0.5mTorr 通过设置质谱程序,可以在一个色谱运行中同时完成全扫描GC-MS测定烃类和MS/MS定量测定PAHs。质谱程序包括8个时间段,每个时间段包含两个扫描窗口。其中一个扫描窗口用于监测整个色谱运行中(即在所有的时间段内)出现的脂肪烃,另外一个扫描窗口采用SRM模式监测PAHs。 SRM扫描窗口#1的设置见表1。 扫描窗口#2的设置保持不变,具体为: 扫描方式:全扫描,45-650m/z 扫描时间: 0.2s 半峰宽:0.7 Da 碰撞气体压力:0.5 10 计算结果 10.1脂肪烃 从GC-MS扫描数据中,打印出m/z57的提取离子色谱图,并将图绘制在在类混合标准m/z57的提取离子色谱图的旁边。根据表2列出的保留时间,可以对牡蛎中所有的脂肪烃进行定性,如图1所示。通过计算峰面积百分比可以表征烃类污染的来源。 10.2 PAHs 如果检测到表1中列举的离子对(定量和定性离子),并与相应的标准物质具有相同的保留时间,则表明样品中含有与食品安全相关的16种PAHs中的一种或多种,如图1所示。仔细检查SRM色谱图,确认有无干扰。各定量离子的峰面积比例必须跟表1中标准物质的比例一致。如果通过保留时间和离子比例确定了样品中存在16种PAHs中的任何一种,则按照下式来进行定量计算。 采用内标法进行PAHs的定量校正。通过以下公式计算响应因子R。 响应因子计算公式 Rf-PAHs标准和内标物的响应因子 Ast-校正示准中PAHs的峰面积 A[IS]-校正标准中内标物的峰面积 CSt-校正标准中PAHs的浓度 C[IS]-校正标准中内标物的浓度 样品中萃取得到的PAH绝对量的计算公式 XPAH-样品萃取得到的PAH绝对量 APAH-样品中PAH的峰面积 A[IS]S-样品中内标物的峰面积 X[IS]-样品中内标物的绝对量 样品中PAH的浓度(ng/g)计算公式 C-样品中PAHs的浓度(ng/g) m-样品量(g) 对样品结果的仔细解析可以有力地证明牡蛎受到墨西哥湾原油的脂肪烃污染和PAH污染。牡蛎样品分析得到的脂肪烃和PAH谱图与墨西哥湾原油分析得到的谱图相匹配,表4列举出墨西哥湾原油的组成成分,特征物正十六烷、正十七烷和异十八烷的含量相对较高,异十八烷/C-17含量比为0.7,植烷/C-18含量比为0.35。单个脂肪烃的任意组合的相对含量的测定值与墨西哥湾原油的组成相匹配。表4列举了直接测定墨西哥湾原油的结果,以及牡蛎样品净化后的测定结果。需要指出的是,油的组成会随着时间发生变化,因此被牡蛎吸收部分的色谱图与原油的色谱图是有区别的,图5中其它原油样品的谱图也证明了这种区别。 表4列举了原油中的PAHs的测定结果,特征性的Ant、Phe、Flu和Chr的浓度比B(a)P的浓度高100倍。为了对PAHs进行准确定性,方法提供了高质量数PAHs的半定量测定结果,作为判断牡蛎样品中PAHs的含量是否超过安全限值的有力依据。要得到准确可靠的结果,必须采取更加精细的净化步骤。 12方法性能 通过对空白牡蛎进行单独加标实验,即首先加入脂肪烃混合标准物质NIST 1494 C10-C34碳氢化合物,然后加入16种PAHs标准品来考察方法性能。为了考察脂肪烃和PAHs混合加标时的方法性能,采用石油原油标准品NIST 1582进行加标试验。 12.1回收率 脂肪烃 结果显示该方法对低于正十五烷的脂肪烃回收率较低,主要是由于样品提取时发生损失。正十六烷(C-16)到正三十四烷(C-34)的平均回收率为52-108%。 PAHs 由于背景污染,而且很难得到真正的空白样品,低质量数的PAHs (Naph, Ace, Acy, Flu, Ant, Phe, FIn和Pyr)无法得到准确的回收率值,而被保留的高质量数PAHs[B(a)P, Chr, B(b)F, B(k)F,B(g,h,i)P和D(a,h)A]的回收率在65-126%范围内。 12.2定性确认 脂肪烃 对每个样品进行全扫描,将得到的谱图与标准谱图进行对照,依据保留时间进行定性,并从一定程度上检验干扰的存在。提取质荷比m/z57作为主要离子,另外,脂肪烃的某些特征离子(如m/z71)被选作辅助定性离子。 PAHs 选择SRM模式,对照每个PAHs标准,通过适当保留时间出现的离子对(定量和定性离子)对样品谱图进行成分确认。而且,样品中母离子与定量离子的峰面积之比应该与PAHs标准相吻合。 12.3检出限 脂肪烃 全扫描模式下,脂肪烃的检出限(LODs) 为0.2-1ng(柱上进样)。如果进样1pL经过处理的样品溶液,牡蛎中脂肪烃的LODs为20-100 ng/g (ppb) PAHs 由于背景污染,低质量数的PAHs (Naph,Ace, Acy, Flu, Ant,Phe, FIn和Pyr) 无法得到准确的LODs,而被保留的高质量数PAHs[B(a)P, Chr, B(b)F, B(k)F, B(g,h,i)P和D(a,h)A]的LODs为0.01-0.07ng(柱上进样)。如果将1pL经过处理的样品溶液进样到GC-MS/MS系统中,牡蛎中PAHs的LODs为1-7ng/g (ppb)。 12.4准确性 ( 将NIST原油标准样品加入到牡蛎中,经过后续的提取和净化步骤,计算PAHs的回收率,考察方法的准确性。由于 背景污染,低质量数的 P AHs (Naph, Ace , Acy, Flu, Ant, Phe, F I n和Pyr)无法得到准确的回收率值,而B(a)A, B(a)P, B(g, h ,i)P和Ⅰ(1,2,3-c,d)P的回收率分别为124,92,81和86%,结果如表3所 示。值得指出的是,该方法用作半定量筛选,可以得到令人满意的准确性。 ) 分段 持续时间 保留时间 1 10.50 Naph 8.66 127.9 102.0 77.8 0.38 15 2 2.50 Acy 12.13 152.0 151.1 126.0 0.11 10 Ace 12.35 154.0 153.0 152.0 0.12 10 3 1.50 FIn 13.37 165.9 165.0 162.9 0.05 10 4 3.00 Ant 15.87 178.0 176.0 152.0 0.70 30 Phe 15.95 178.0 176.0 152.0 0.70 30 Ant-D10 15.89 188.1 160.2 158.2 0.40 30 5 4.50 Flu 19.13 202.0 201.1 200.1 0.40 10 Pyr 19.97 202.0 201.0 200.1 0.40 10 6 3.70 B(a)A 23.48 228.1 226.0 202.1 0.15 20 Chr 23.71 228.1 226.2 202.2 0.15 20 Chr-D12 23.65 240.2 238.1 215.1 0.11 30 5MChr 24.98 242.1 241.1 227.5 0.15 30 7 3.80 B(b)F 26.75 252.1 250.1 226.1 0.18 30 B(k)F 26.82 252.1 250.1 226.1 0.18 30 B(a)P 27.96 252.1 250.1 226.1 0.18 30 B(a)P-D12 27.87 264.1 260.1 236.0 0.38 30 8 5.50 B(g,h.i)P 31.99 276.1 274.0 250.0 0.05 35 (1,2,2-c,d)P 30.96 276.1 274.0 207.0 0.05 35 BgP-D12 31.86 288.2 286.1 125.1 0.06 35 D(a,h)A 30.97 278.0 276.0 226.1 0.05 35 表1: PAHs的SRM分析参数 正癸烷 C10H22 142.1 3.99 正十一烷 CH24 156.2 4.97 正十二烷 C12H26 170.2 6.14 正十三烷 C13H28 184.2 7.30 正十四烷 C4H30 198.2 8.42 正十五烷 C15H32 212.2 9.50 正十六烷 C16H34 226.2 10.51 正十七烷 C17H36 240.2 11.45 异十八烷 C1gH40 268.3 11.24 正十八烷 C1838 254.3 12.41 植烷 C20H42 282.3 12.30 正十九烷 C19H40 268.3 13.28 正二十烷 C20H42 282.3 14.14 正二十二烷 C22H46 310.3 15.90 正二十四烷 C24H50 338.3 17.73 正二十六烷 正二十八烷 C26H54 C28H58 366.4 394.4 19.56 21.35 正三十烷 C3062 422.4 23.08 正三十二烷 C3266 450.5 24.77 正三十四烷 34H70 478.5 26.45 PAH 标准值[ng/g] 测定值[ng/g] 回收率[%] B(a)A 14.06±1.00 17.39 124 B(a)P 5.52±1.00 5.11 92 l(1,2,3-c,d)P 0.85±0.50 0.69 81 3(g,h,i)P 8.54±0.2 7.37 86 表3:加标原油标准样品NIST 1582后的牡蛎分析结果 测得特征性的异十八烷/C-17含量比(0.7)和植烷/C-18含量比(0.35)碳氢化合物 平均值[ug/g](n=2) PAH 平均值[ug/g](n=2) 表2:加标NIST 1494后的牡蛎中监测到的脂肪烃 正十五烷 407 Naph 19 1484 Acy 436 正十七烷 1329 Ace 96 异十八烷 928 Fln 144 正十八烷 337 Ant 11857 植烷 118 Phe 11287 正十九烷 330 Flu 958 正二十烷 289 Pyr 547 正二十二烷 188 B(a)A 29 正二十四烷 146 CHR 804 正二十六烷 82 B(b)F 428 正二十八烷 43 B(k)F 40 正三十烷 31 B(a)P 2 正三十二烷 23 B(g,h,i)P 7 正三十四烷 10 (1,2,3-c,d)P 2 D(h)A 3 图1:牡蛎中加入脂肪烃和10 ng/gPAH混合标准的谱图 顶图为脂肪烃谱图中的m/z57提取离子色谱图,其它为16种PAHs的SRM离子流图。 图2:牡蛎中加标10 ng/g B(a)P的谱图 图3:牡蛎中加入5 pg/g墨西哥湾原油样品(2010年5月底)的谱图, B(a)P的测定值为5 ng/g 图4:样品的m/z57提取离子色谱图 上图为墨西哥湾原油样品(2010年5月底),下图为加标5 mg/kg原油标准的牡蛎样品。 In addition to these offices, Thermo FisherScientific maintainsa network of represen-tative organizationsthroughout the world. 赛默飞世尔科技 上海 上海浦东新金桥路27号6号楼 电话:86-21-6865 4588 传真: 86-21-64457830 北京 北京市东城区安定门东大街28号 雍和大厦西楼702-715室 电话:86-10-84193588 传真: 86-10-84193589 图5:不同样品的m/z57提取离子图 广州 广州东风中路410-412号 上图为NIST 1582石油原油,中图为墨西哥湾原油样品(2010年5月底),下图为NIST1494碳氢化合物标准 健力宝大厦3003-3004室 电话:86-20-8348 7138 传真:86-20-83486621 服务热线: 8008105118400 650 5118 www.thermo.com analyze.cn@thermofisher.com 对样品结果的仔细解析可以有力地证明牡蛎受到墨西哥湾原油的脂肪烃污染和PAH污染。牡蛎样品分析得到的脂肪烃和PAH谱图与墨西哥湾原油分析得到的谱图相匹配,表4列举出墨西哥湾原油的组成成分,特征物正十六烷、正十七烷和异十八烷的含量相对较高,异十八烷/C-17含量比为0.7,植烷/C-18含量比为0.35。单个脂肪烃的任意组合的相对含量的测定值与墨西哥湾原油的组成相匹配。列举了直接测定墨西哥湾原油的结果,以及牡蛎样品净化后的测定结果。需要指出的是,油的组成会随着时间发生变化,因此被牡蛎吸收部分的色谱图与原油的色谱图是有区别的,其它原油样品的谱图也证明了这种区别。列举了原油中的PAHs的测定结果,特征性的Ant、Phe、Flu和Chr的浓度比B(a)P的浓度高100倍。为了对PAHs进行准确定性,方法提供了高质量数PAHs的半定量测定结果,作为判断牡蛎样品中PAHs的含量是否超过安全限值的有力依据。要得到准确可靠的结果,必须采取更加精细的净化步骤。
确定




还剩6页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《牡蛎中正十九烷检测方案(固相萃取仪)》,该方案主要用于水产品中正十九烷检测,参考标准--,《牡蛎中正十九烷检测方案(固相萃取仪)》用到的仪器有赛默飞AutoTrace 280全自动固相萃取仪、TSQ Quantum Ultra三重四极杆液质联用仪、赛默飞TSQ Duo 三重四极杆 GC-MS/MS
推荐专场
相关方案
更多
该厂商其他方案
更多























