
方案详情
文
由于杂质中某些污染物本身具有毒性,并且可能对药物稳定性和保 质期造成负面影响或可能引发不必要的副作用,需要关注药物成分 中是否存在杂质。因此,必须对原材料(包括水(用于药品生产)、 中间产物、活性药物成分 (API)、赋形剂(稳定剂、填料、粘合剂、 着色剂、香精、涂料))和最终剂型中的有机和无机(元素)杂质进 行监测和控制。此外,还必须监测由生产工艺引入的杂质,诸如生 产工艺设备中的催化剂残留和污染物,并且必须评估包装和容器封 闭系统 (CCS) 造成污染的可能性。使用 Agilent 7800 ICP-MS 以及配套开发并优化的方法进行分析,在处理有机溶剂时表现出极佳的性能,可得到准确、精密的结果,表明这是一种用于分析药物成分中元素杂质的可靠解决方案。
方案详情

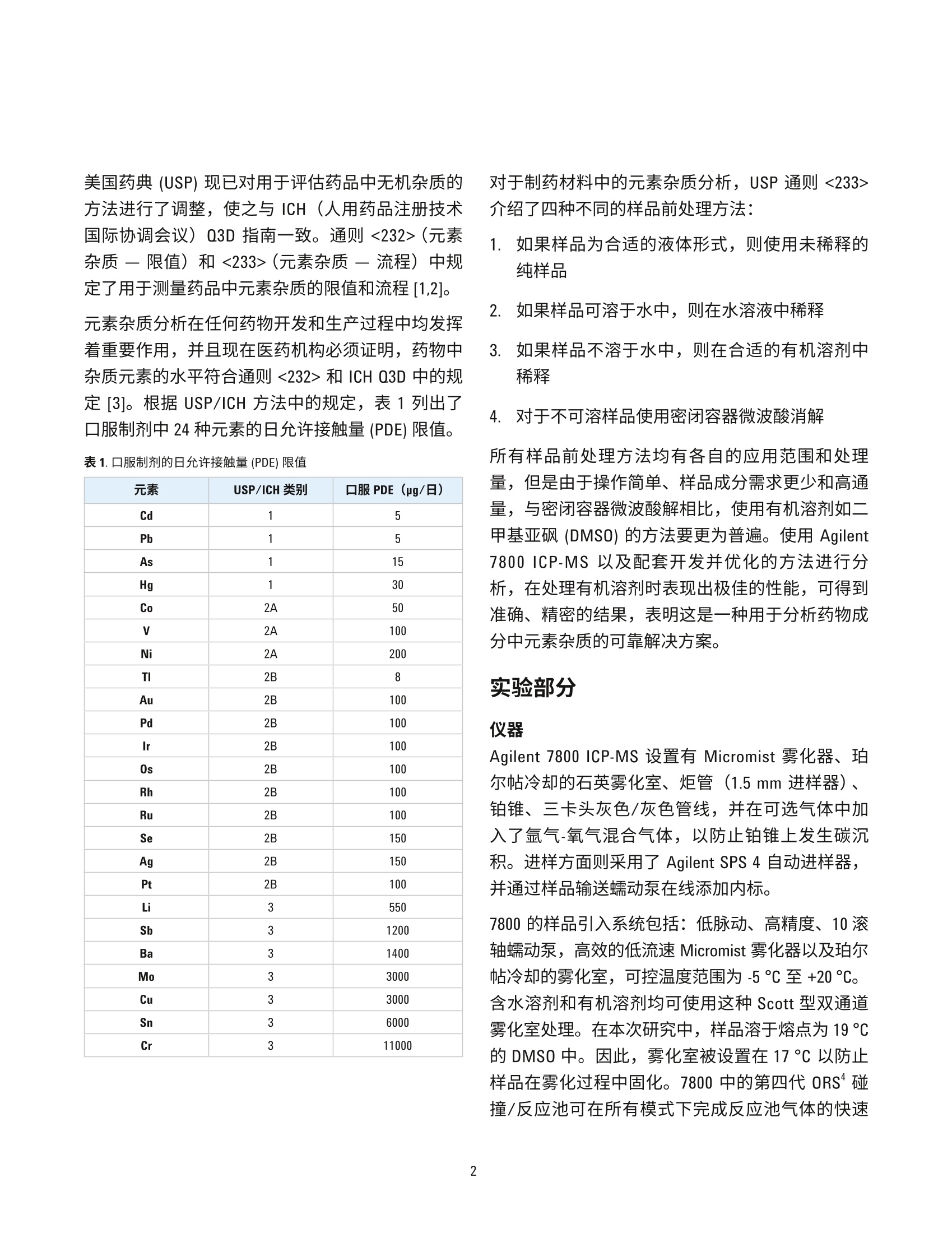
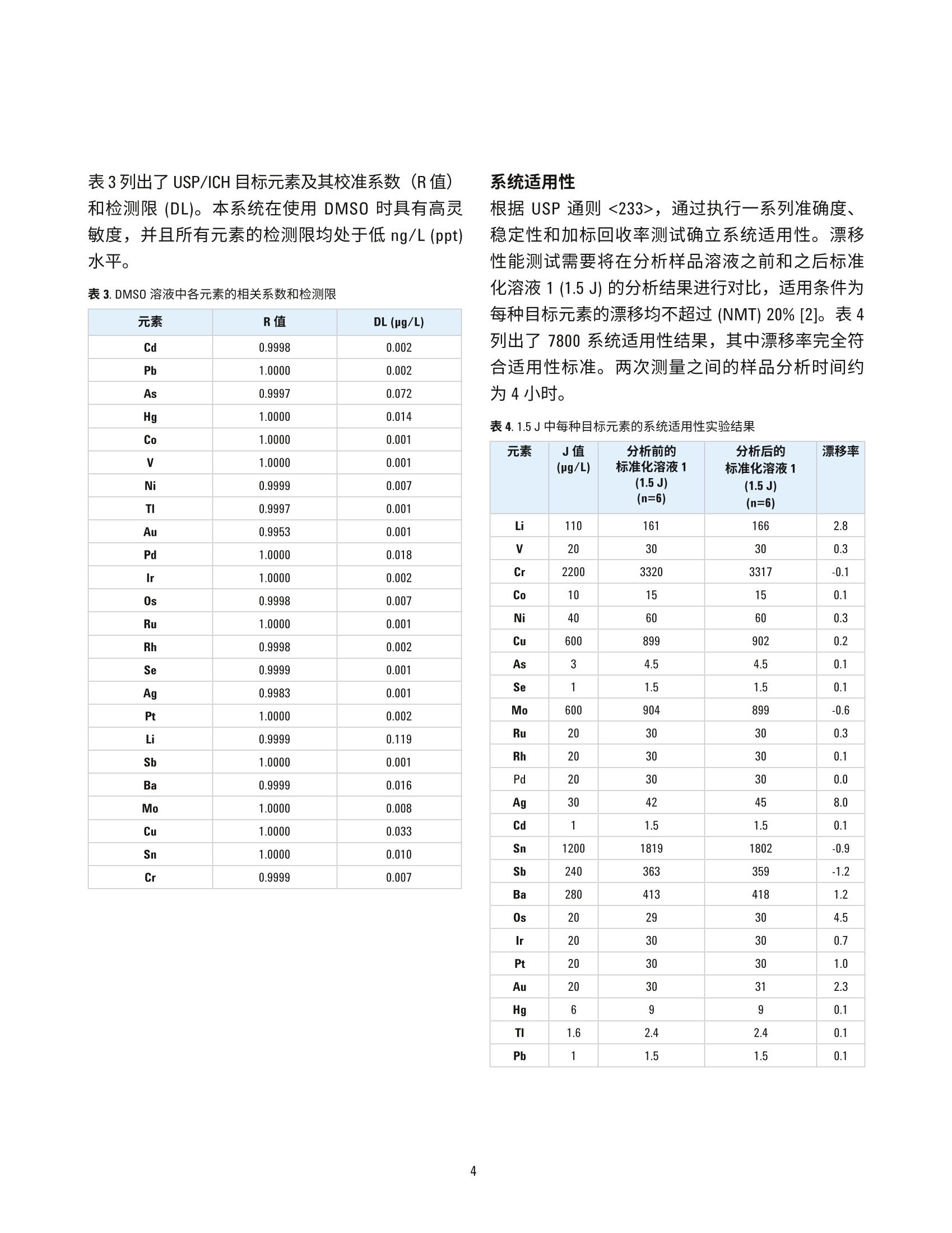
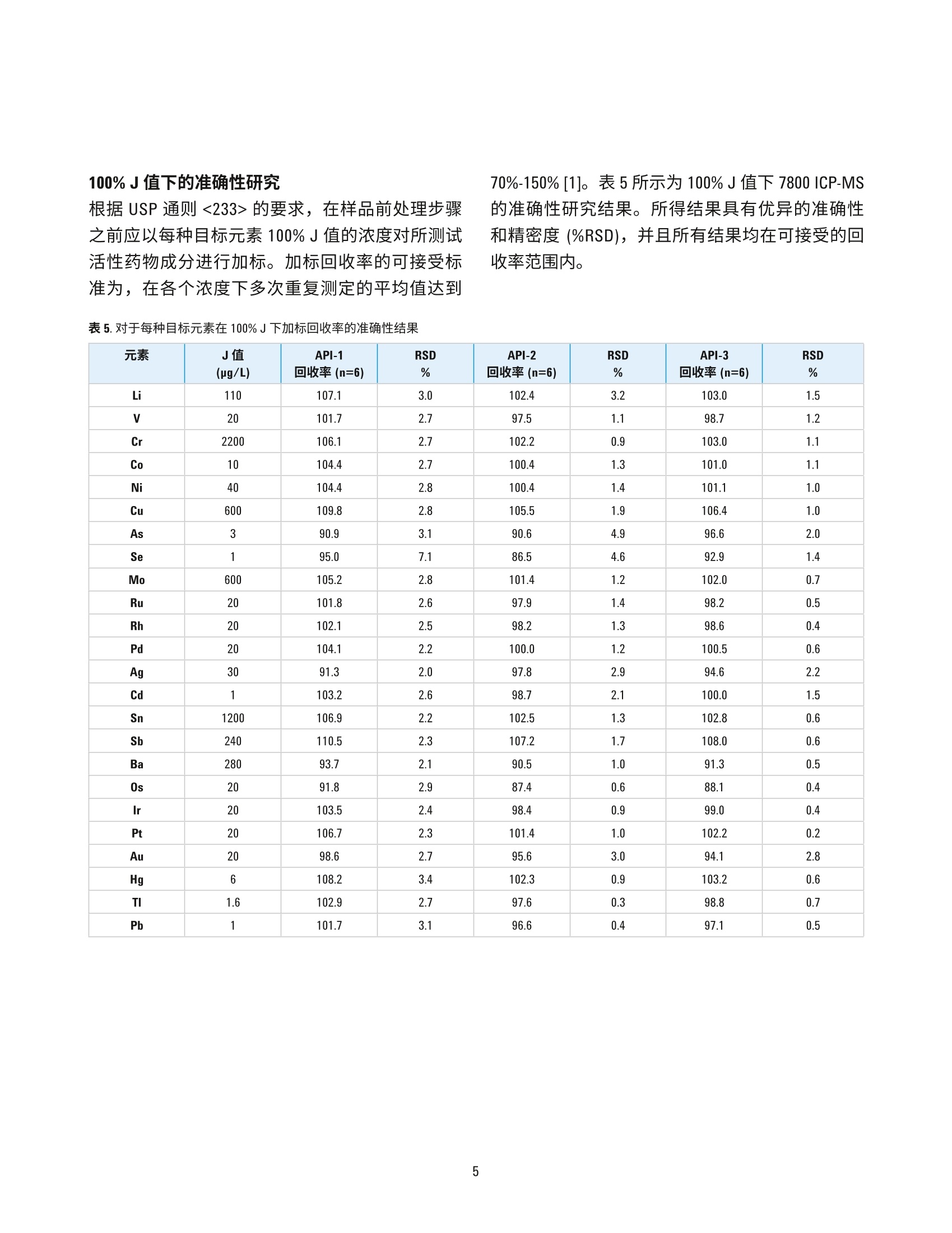
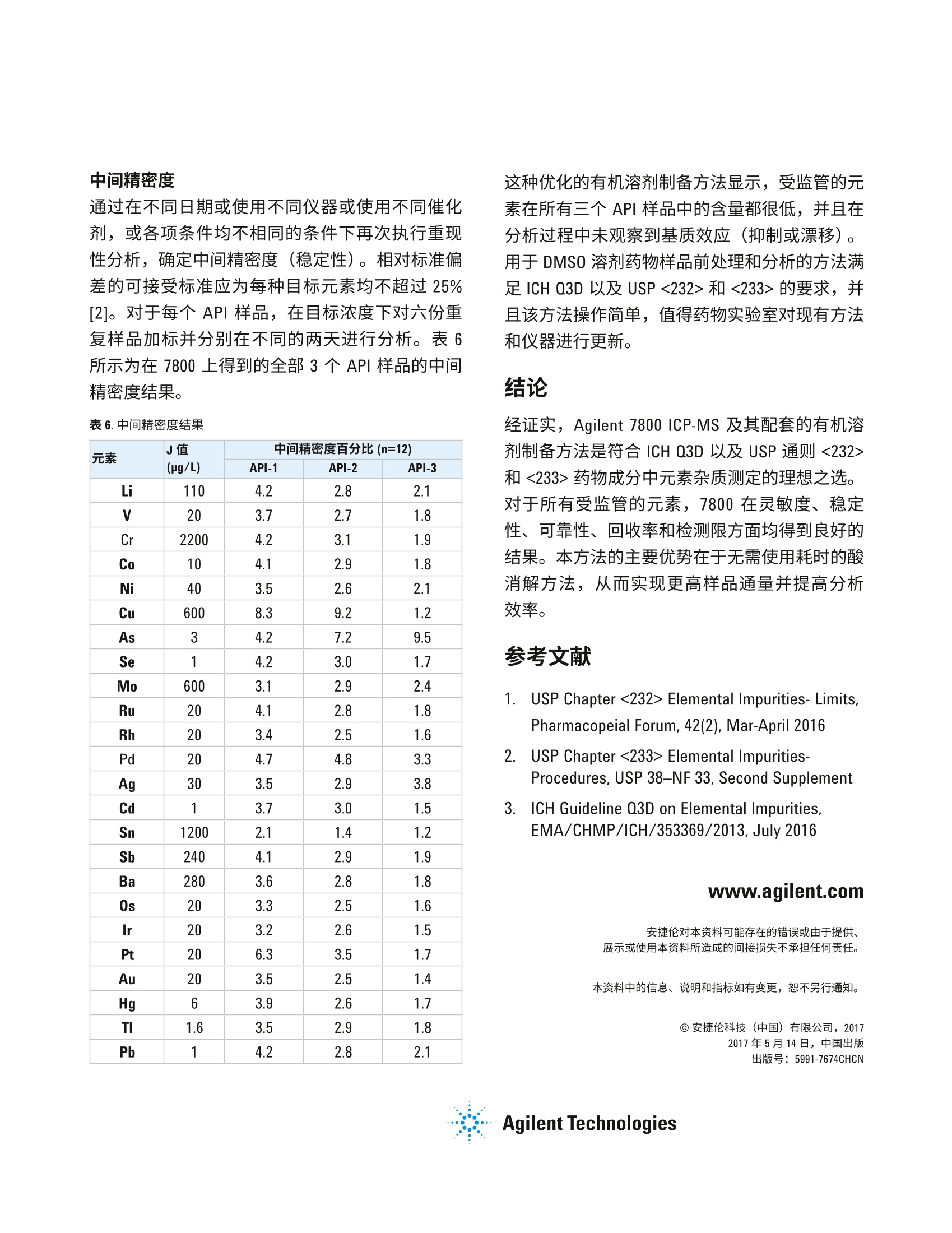
100%J值下的准确性研究 作者 Radhey S. Dhuria、 Vinay Jain、Gaurav Kapadnis 和 Samir Vyas 卓越研究中心 安捷伦科技公司 马尼萨尔,印度 使用 USP/ICH 方法和 ICP-MS测定药物成分中的元素杂质 前言 由于杂质中某些污染物本身具有毒性,并且可能对药物稳定性和保质期造成负面影响或可能引发不必要的副作用,需要关注药物成分中是否存在杂质。因此,必须对原材料(包括水(用于药品生产)、中间产物、活性药物成分(API)、赋形剂(稳定剂、填料、粘合剂、着色剂、香精、涂料))和最终剂型中的有机和无机(元素)杂质进行监测和控制。此外,还必须监测由生产工艺引入的杂质,诸如生产工艺设备中的催化剂残留和污染物,并且必须评估包装和容器封闭系统(CCS)造成污染的可能性。 美国药典 (USP)现已对用于评估药品中无机杂质的方法进行了调整,使之与 ICH(人用药品注册技术国际协调会议) Q3D 指南一致。通则<232>(元素杂质一限值)和<233>(元素杂质-流程)中规定了用于测量药品中元素杂质的限值和流程[1,2]。 元素杂质分析在任何药物开发和生产过程中均发挥着重要作用,并且现在医药机构必须证明,药物中杂质元素的水平符合通则<232> 和 ICH Q3D中的规定[3]。根据 USP/ICH 方法中的规定,表1列出了口服制剂中24种元素的日允许接触量 (PDE)限值。 表1.口服制剂的日允许接触量 (PDE) 限值 元素 USP/ICH类别 口服PDE (ug/日) Cd 1 5 Pb 1 5 As 1 15 Hg 1 30 Co 2A 50 V 2A 100 Ni 2A 200 TI 2B 8 Au 2B 100 Pd 2B 100 Ir 2B 100 Os 2B 100 Rh 2B 100 Ru 2B 100 Se 2B 150 Ag 2B 150 Pt 2B 100 Li 3 550 Sb 3 1200 Ba 3 1400 Mo 3 3000 Cu 3 3000 Sn 3 6000 Cr 3 11000 对于制药材沐中的元素杂质分析, USP 通则<233>介绍了四种不同的样品前处理方法: 1..如果样品为合适的液体形式,则使用未稀释的纯样品 2. 如果样品可溶于水中,则在水溶液中稀释 3.如果样品不溶于水中,则在合适的有机溶剂中稀释 4. 对于不可溶样品使用密闭容器微波酸消解 所有样品前处理方法均有各自的应用范围和处理量,但是由于操作简单、样品成分需求更少和高通量,与密闭容器微波酸解相比,使用有机溶剂如二甲基亚砜 (DMSO) 的方法要更为普遍。使用 Agilent7800 ICP-MS 以及配套开发并优化的方法进行分析,在处理有机溶剂时表现出极佳的性能,可得到准确、精密的结果,表明这是一种用于分析药物成分中元素杂质的可靠解决方案。 实验部分 ( 仪器 ) Agilent 7800 ICP-MS 设置有 Micromist 雾化器、珀尔帖冷却的石英英化室、管(1.5mm进样器)、铂锥、三卡头灰色/灰色管线,并在可选气体中加入了氩气-氧气混合气体,l以防止铂锥上发生碳沉积。进样方面则采用了 Agilent SPS 4 自动进样器,并通过样品输送蠕动泵在线添加内标。 7800的样品引入系统包括:低脉动、高精度、10滚轴蠕动泵,高效的低流速Micromist 雾化器以及珀尔帖冷却的雾化室,可控温度范围为-5℃至+20°℃。含水溶剂和有机溶剂均可使用这种 Scott 型双通道雾化室处理。在本次研究中,样品溶于熔点为19℃的 DMSO中。因此,雾化室被设置在17°C 以防止样品在雾化过程中固化。7800中的第四代 ORS 碰撞/反应池可在所有模式下完成反应池气体的快速 切换并有效地去除干扰,并且结合了久经考验的高性能双曲面四极杆,以及具有10个数量级线性动态范围的最新一代同步双模式离散打拿级检测器。 Agilent ICP-MS MassHunter 软件便于设置和操作,并且其中的预设方法为 USP/ICH通则提供了简单操作范例。仪器的操作条件见表2。 表 2.7800 ICP-MS操作条件 参数 设置 等离子体模式 通用 RF 功率(W) 1550 载气流速(L/min) 0.99 采样深度(mm) 8.0 S/C温度(℃) 17 反应池气体流速(mL/min) 4 动能歧视电压(V) 3 可选气体(%) 10 样品和标样前处理 用 DMSO(二甲基亚砜)稀释 NIST 可朔源标样,制备校准标样。每种活性药物成分(API)样品准确称量100mg, 放入装有5 mL DMSO 的 50 mL Falcon管中。然后对这些管进行 15 min 的超声处理,使样品完全溶解并用 DMSO 定容至50mL。制备样品以及未加标溶液。同时制备加标样品。在线添加内标。图1所示为用于样品前处理和分析的流程图。 结果与讨论 校准 所有药品的风险评估中均须包括1类(Cd、Pb、As 和 Hg) 和 2B类(Co、V和 Ni) USP/ICH 分析物评估。在 Agilent 7800 上测量的 DMSO 中 As、Hg、Cd 和 Pb 的校准曲线图参见图2。 图2. As、Hg、Cd 和 Pb的校准线性曲线图 表3列出了 USP/ICH目标元素及其校准系数(R值)和检测限 (DL)。本系统在使用 DMSO 时具有高灵敏度,并且所有元素的检测限均处于低 ng/L (ppt)水平。 表3. DMSO 溶液中各元素的相关系数和检测限 元素 R值 DL(pg/L) Cd 0.9998 0.002 Pb 1.0000 0.002 As 0.9997 0.072 Hg 1.0000 0.014 Co 1.0000 0.001 1.0000 0.001 Ni 0.9999 0.007 TI 0.9997 0.001 Au 0.9953 0.001 Pd 1.0000 0.018 Ir 1.0000 0.002 Os 0.9998 0.007 Ru 1.0000 0.001 Rh 0.9998 0.002 Se 0.9999 0.001 Ag 0.9983 0.001 Pt 1.0000 0.002 Li 0.9999 0.119 Sb 1.0000 0.001 Ba 0.9999 0.016 Mo 1.0000 0.008 Cu 1.0000 0.033 Sn 1.0000 0.010 Cr 0.9999 0.007 系统适用性 根据 USP 通则<233>,通过执行一系列准确度、稳定性和加标回收率测试确立系统适用性。漂移性能测试需要将在分析样品溶液之前和之后标准化溶液1(1.5J) 的分析结果进行对比,适用条件为每种目标元素的漂移均不超过 (NMT) 20%[2]。表4列出了7800系统适用性结果,其中漂移率完全符合适用性标准。两次测量之间的样品分析时间约为4小时。 表4.1.5J中每种目标元素的系统适用性实验结果 元素 J值(pg/L) 分析前的 标准化溶液1(1.5 J) (n=6) 分析后的 标准化溶液1(1.5J) (n=6) 漂移率 Li 110 161 166 2.8 V 20 30 30 0.3 Cr 2200 3320 3317 -0.1 Co 10 15 15 0.1 Ni 40 60 60 0.3 Cu 600 899 902 0.2 As 3 4.5 4.5 0.1 Se 1 1.5 1.5 0.1 Mo 600 904 899 -0.6 Ru 20 30 30 0.3 Rh 20 30 30 0.1 Pd 20 30 30 0.0 Ag 30 42 45 8.0 Cd 1 1.5 1.5 0.1 Sn 1200 1819 1802 -0.9 Sb 240 363 359 -1.2 Ba 280 413 418 1.2 0s 20 29 30 4.5 Ir 20 30 30 0.7 Pt 20 30 30 1.0 Au 20 30 31 2.3 Hg 6 9 9 0.1 TI 1.6 2.4 2.4 0.1 Pb 1 1.5 1.5 0.1 根据 USP 通则<233>的要求,在样品前处理步骤之前应以每种目标元素100%J值的浓度对所测试活性药物成分进行加标。加标回收率的可接受标准为,在各个浓度下多次重复测定的平均值达到 70%-150%[1]。表5所示为100%J值下7800 ICP-MS的准确性研究结果。所得结果具有优异的准确性和精密度 (%RSD),并且所有结果均在可接受的回收率范围内。 元素 J值 (pg/L) API-1 回收率(n=6) RSD API-2 回收率(n=6) RSD % API-3 回收率(n=6) RSD % % Li 110 107.1 3.0 102.4 3.2 103.0 1.5 V 20 101.7 2.7 97.5 1.1 98.7 1.2 Cr 2200 106.1 2.7 102.2 0.9 103.0 1.1 Co 10 104.4 2.7 100.4 1.3 101.0 1.1 Ni 40 104.4 2.8 100.4 1.4 101.1 1.0 Cu 600 109.8 2.8 105.5 1.9 106.4 1.0 As 3 90.9 3.1 90.6 4.9 96.6 2.0 Se 1 95.0 7.1 86.5 4.6 92.9 1.4 Mo 600 105.2 2.8 101.4 1.2 102.0 0.7 Ru 20 101.8 2.6 97.9 1.4 98.2 0.5 Rh 20 102.1 2.5 98.2 1.3 98.6 0.4 Pd 20 104.1 2.2 100.0 1.2 100.5 0.6 Ag 30 91.3 2.0 97.8 2.9 94.6 2.2 Cd 1 103.2 2.6 98.7 2.1 100.0 1.5 Sn 1200 106.9 2.2 102.5 1.3 102.8 0.6 Sb 240 110.5 2.3 107.2 1.7 108.0 0.6 Ba 280 93.7 2.1 90.5 1.0 91.3 0.5 0s 20 91.8 2.9 87.4 0.6 88.1 0.4 lr 20 103.5 2.4 98.4 0.9 99.0 0.4 Pt 20 106.7 2.3 101.4 1.0 102.2 0.2 Au 20 98.6 2.7 95.6 3.0 94.1 2.8 Hg 6 108.2 3.4 102.3 0.9 103.2 0.6 TI 1.6 102.9 2.7 97.6 0.3 98.8 0.7 Pb 1 101.7 3.1 96.6 0.4 97.1 0.5 中间精密度 通过在不同日期或使用不同仪器或使用不同催化剂,或各项条件均不相同的条件下再次执行重现性分析,确定中间精密度(稳定性)。相对标准偏差的可接受标准应为每种目标元素均不超过 25%[2]。对于每个API样品,在目标浓度下对六份重复样品加标并分别在不同的两天进行分析。表6所示为在7800上得到的全部3个API样品的中间精密度结果。 表6.中间精密度结果 元素 J值 中间精密度百分比(n=12) (pg/L) API-1 API-2 API-3 Li 110 4.2 2.8 2.1 V 20 3.7 2.7 1.8 Cr 2200 4.2 3.1 1.9 Co 10 4.1 2.9 1.8 Ni 40 3.5 2.6 2.1 Cu 600 8.3 9.2 1.2 As 3 4.2 7.2 9.5 Se 1 4.2 3.0 1.7 Mo 600 3.1 2.9 2.4 Ru 20 4.1 2.8 1.8 Rh 20 3.4 2.5 1.6 Pd 20 4.7 4.8 3.3 Ag 30 3.5 2.9 3.8 Cd 1 3.7 3.0 1.5 Sn 1200 2.1 1.4 1.2 Sb 240 4.1 2.9 1.9 Ba 280 3.6 2.8 1.8 0s 20 3.3 2.5 1.6 Ir 20 3.2 2.6 1.5 Pt 20 6.3 3.5 1.7 Au 20 3.5 2.5 1.4 Hg 6 3.9 2.6 1.7 TI 1.6 3.5 2.9 1.8 Pb 1 4.2 2.8 2.1 这种优化的有机溶剂制备方法显示,受监管的元素在所有三个 API 样中中的含量都很低,并且在分析过程中未观察到基质效应(抑制或漂移)。用于 DMSO 溶剂药物样品前处理和分析的方法满足ICH Q3D 以及 USP <232>和<233>的要求,并且该方法操作简单,值得药物实验室对现有方法和仪器进行更新。 结论 经证实, Agilent 7800 ICP-MS 及其配套的有机溶剂制备方法是符合 ICH Q3D 以及 USP 通则<232>和<233>药物成分中元素杂质测定的理想之选。对于所有受监管的元素,7800 在灵敏度、稳定性、可靠性、回收率和检测限方面均得到良好的结果。本方法的主要优势在于无需使用耗时的酸消解方法,从而实现更高样品通量并提高分析效率。 ( 参考文献 ) ( 1. USP Chapter <232> El e mental Impurities- Li m its,Pharmacopeial Forum, 42(2), M a r-April 2 0 16 ) ( .2. USP Chapter <233> Elemental Impurities-Procedures, USP 38-NF 33, Second Supplement ) ( 3. ICH Guideline Q3D on Elemental Impurities, EMA/CHMP/ICH/353369/2013, J u ly 2016 ) ( www.agilent.com ) 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 ( 本资料中的信息、说明和指标如有变更,恕不另行通知。 ) ( ◎安捷伦科技(中国)有限公司,2017 ) ( 2017年5月14日,中国出版 ) ( 出版号:59 9 1-7674CHCN ) Agilent Technologies 前言由于杂质中某些污染物本身具有毒性,并且可能对药物稳定性和保质期造成负面影响或可能引发不必要的副作用,需要关注药物成分中是否存在杂质。因此,必须对原材料(包括水(用于药品生产)、中间产物、活性药物成分 (API)、赋形剂(稳定剂、填料、粘合剂、着色剂、香精、涂料))和最终剂型中的有机和无机(元素)杂质进行监测和控制。此外,还必须监测由生产工艺引入的杂质,诸如生产工艺设备中的催化剂残留和污染物,并且必须评估包装和容器封闭系统 (CCS) 造成污染的可能性。美国药典 (USP) 现已对用于评估药品中无机杂质的方法进行了调整,使之与 ICH(人用药品注册技术国际协调会议)Q3D 指南一致。通则 <232>(元素杂质 — 限值)和 <233>(元素杂质 — 流程)中规定了用于测量药品中元素杂质的限值和流程。元素杂质分析在任何药物开发和生产过程中均发挥着重要作用,并且现在医药机构必须证明,药物中杂质元素的水平符合通则 <232> 和 ICH Q3D 中的规定。根据 USP/ICH 方法中的规定,表 1 列出了口服制剂中 24 种元素的日允许接触量 (PDE) 限值。对于制药材料中的元素杂质分析,USP 通则 <233> 介绍了四种不同的样品前处理方法:1. 如果样品为合适的液体形式,则使用未稀释的纯样品2. 如果样品可溶于水中,则在水溶液中稀释3. 如果样品不溶于水中,则在合适的有机溶剂中稀释4. 对于不可溶样品使用密闭容器微波酸消解所有样品前处理方法均有各自的应用范围和处理量,但是由于操作简单、样品成分需求更少和高通量,与密闭容器微波酸解相比,使用有机溶剂如二甲基亚砜 (DMSO) 的方法要更为普遍。使用 Agilent 7800 ICP-MS 以及配套开发并优化的方法进行分析,在处理有机溶剂时表现出极佳的性能,可得到准确、精密的结果,表明这是一种用于分析药物成分中元素杂质的可靠解决方案。结论经证实,Agilent 7800 ICP-MS 及其配套的有机溶剂制备方法是符合 ICH Q3D 以及 USP 通则 <232>和 <233> 药物成分中元素杂质测定的理想之选。对于所有受监管的元素,7800 在灵敏度、稳定性、可靠性、回收率和检测限方面均得到良好的结果。本方法的主要优势在于无需使用耗时的酸消解方法,从而实现更高样品通量并提高分析效率。
确定


还剩4页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《药物中元素杂质检测方案(等离子体质谱)》,该方案主要用于化药制剂中限度检查检测,参考标准--,《药物中元素杂质检测方案(等离子体质谱)》用到的仪器有
相关方案
更多
该厂商其他方案
更多








