方案详情
文
单克隆抗体 (mAb) 是制药行业中发展最快的一类药物。mAb 作为蛋白质药物,从初始表达到最终商业化经历了一个高度复杂的过程,需要在每个步骤中对其进行仔细表征。在用于 mAb 表征的众多分析方法中,肽谱分析是一项至关重要的技术,它能够实现 mAb 的一级结构确认,还可以对翻译后修饰 (PTM)(如脱酰氨基化、氧化和糖基化)进行鉴定和定量分析。使用 LC/MS/MS 方法进行的 mAb 肽谱分析包括将纯化的 mAb 酶裂解为肽段、串联质谱分析以及数据解析。样品前处理通常涉及多个步骤,包括变性、还原、烷基化和酶解。手动进行肽谱分析样品前处理的过程十分繁琐,且易于受到可扩展性和重现性不佳的影响。此应用简报展示了一个高通量工作流程,能够同步进行样品消解和样品净化,具有很高的重现性。
方案详情

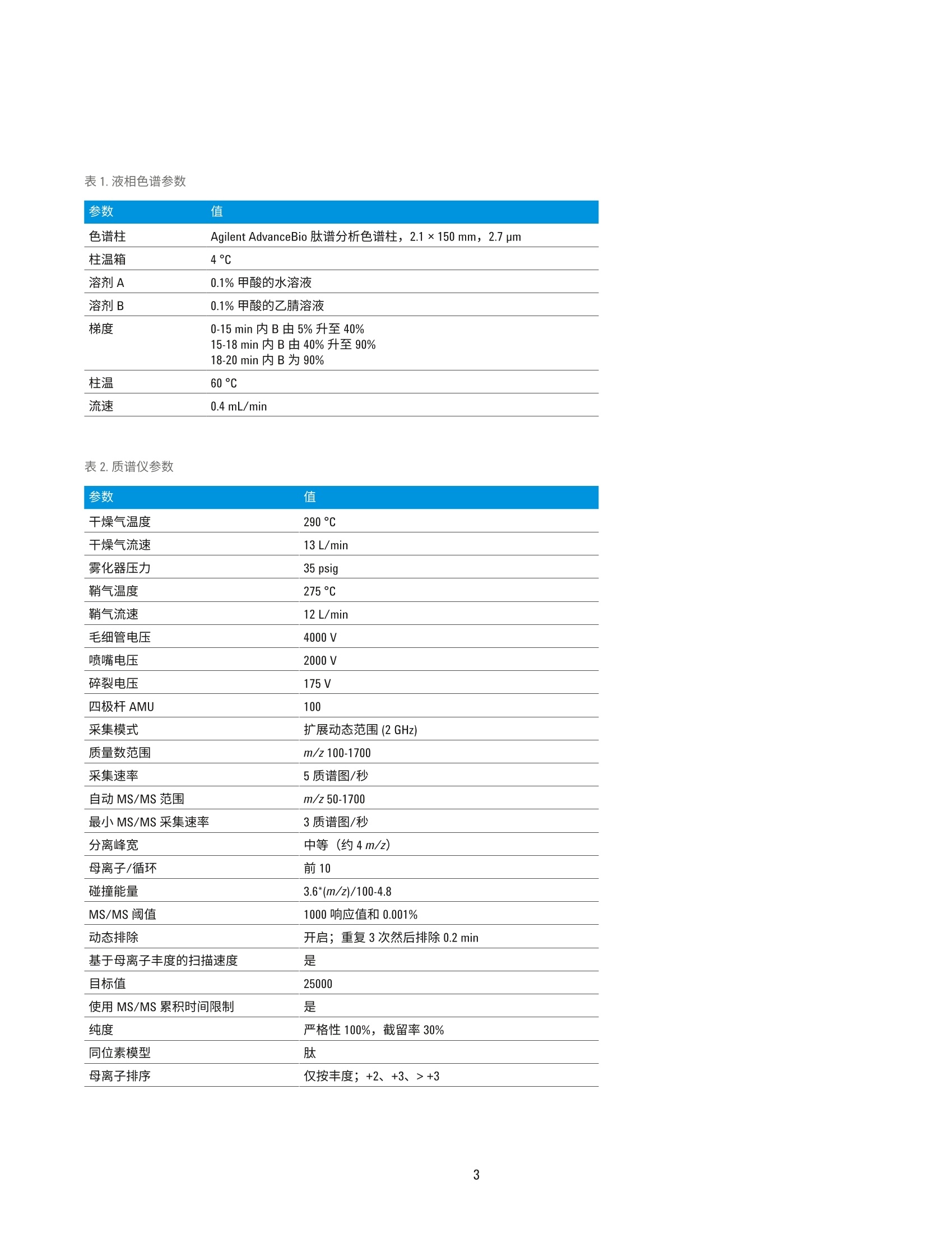
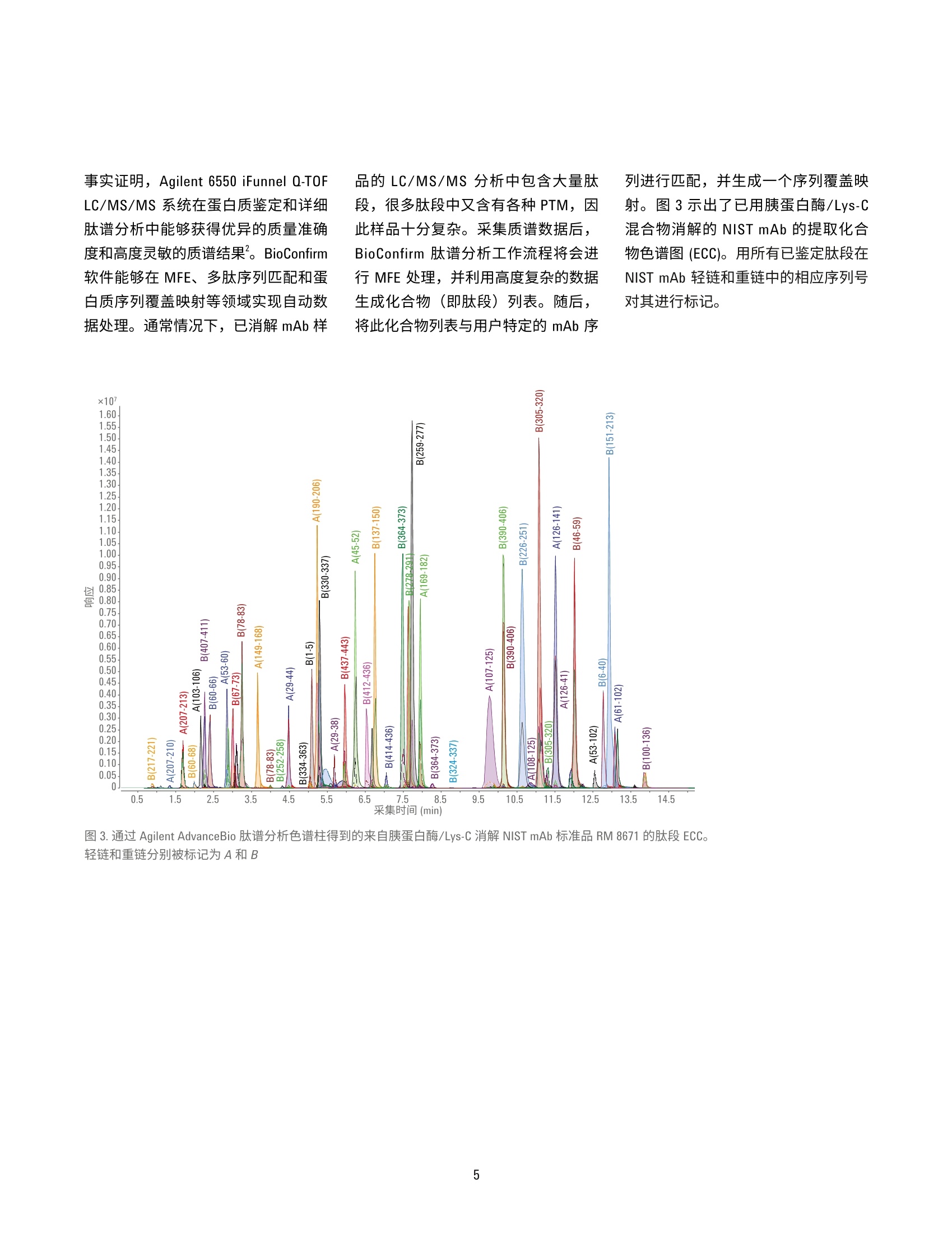
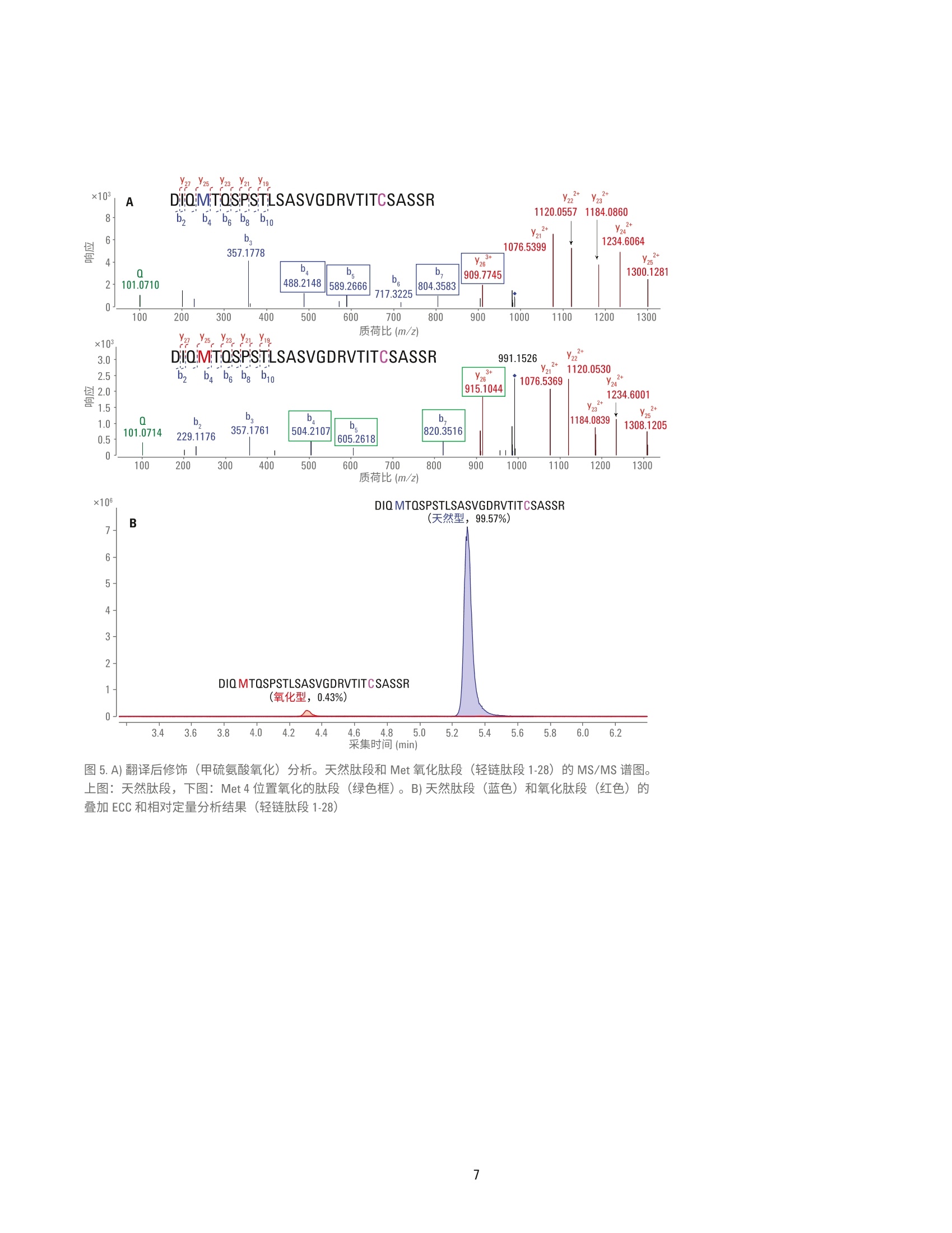
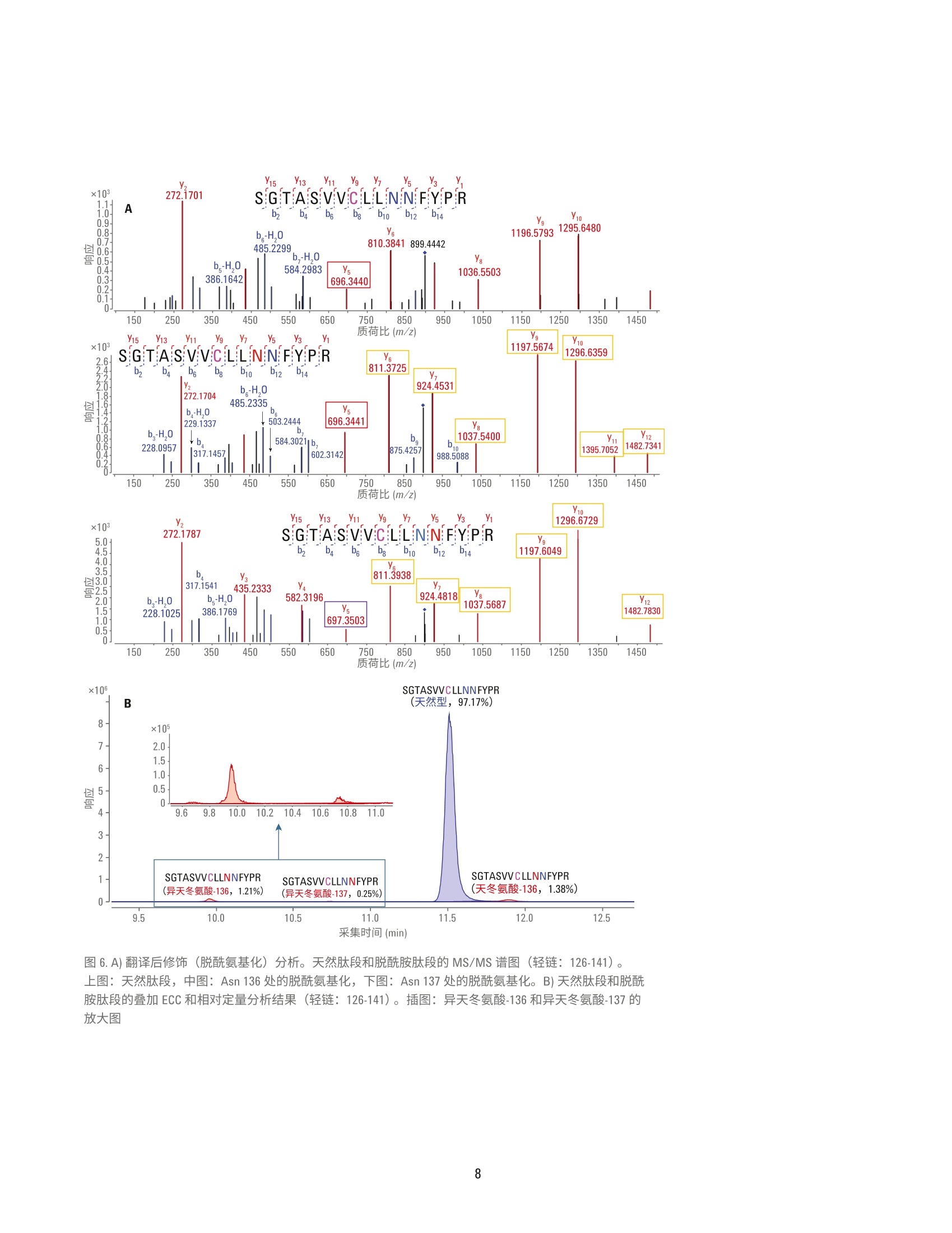
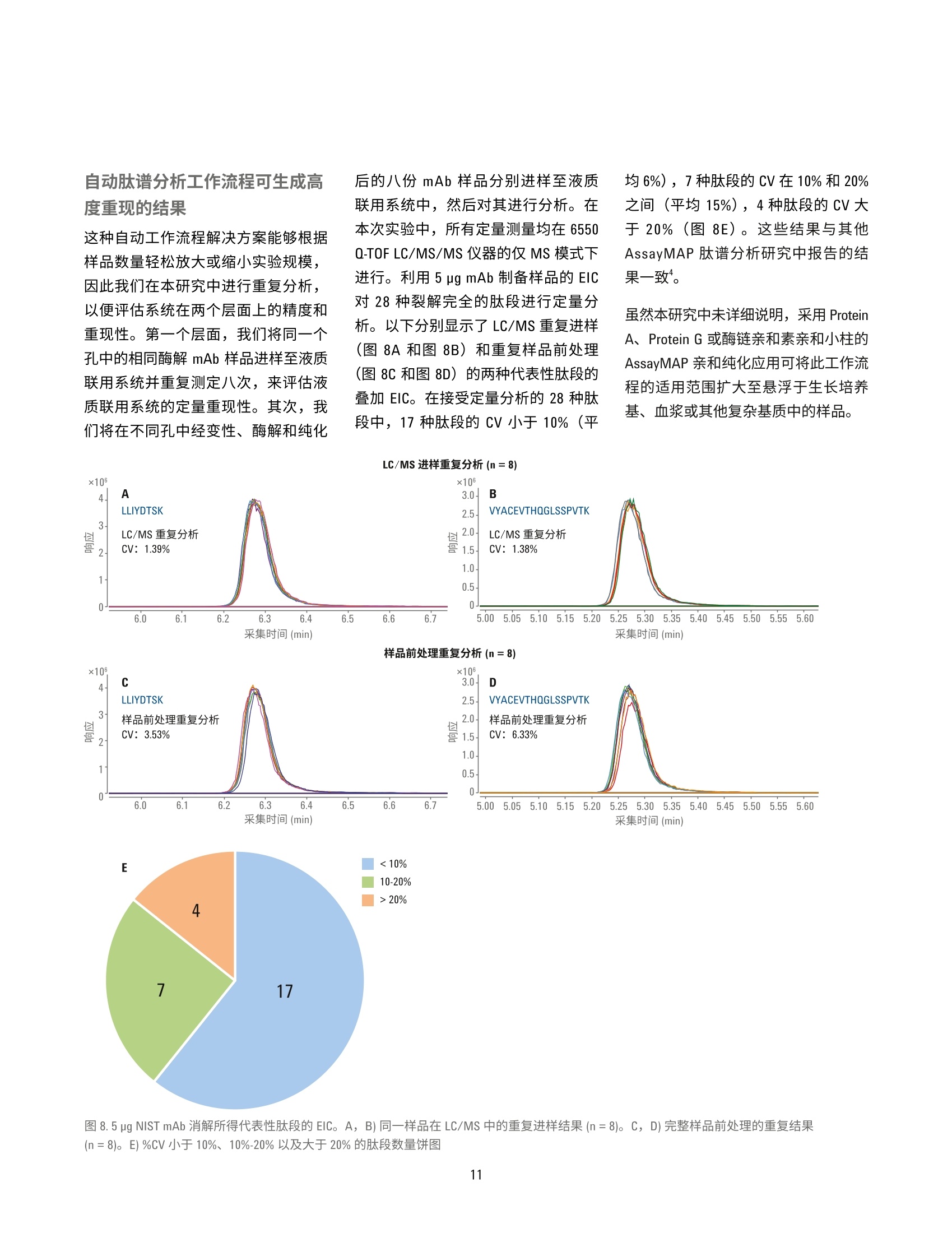
用于单克隆抗体肽谱分析的一体化工作流程 应用简报 生物治疗药物和生物仿制药 作者 前言 David L. Wong 安捷伦科技有限公司 Santa Clara, CA, USA Jing Chen 单克隆抗体(mAb) 是制药行业中发展最快的一类药物。mAb 作为蛋白质药物,从初始表达到最终商业化经历了一个高度复杂的过程,需要在每个步骤中对其进行仔细表征。在用于 mAb 表征的众多分析方法中,肽谱分析是一项至关重要的技术,它能够实现 mAb 的一级结构确认,还可以对翻译后修饰(PTM)(如脱酰氨基化、氧化和糖基化)进行鉴定和定量分析。 安捷伦科技有限公司 Madison, WI, USA 使用LC/MS/MS 方法进行的 mAb 肽谱分析包括将纯化的 mAb 酶裂解为肽段、串联质谱分析以及数据解析。样品前处理通常涉及多个步骤,包括变性、还原、烷基化和酶解。手动进行肽谱分析样品前处理的过程十分繁琐,且易于受到可扩展性和重现性不佳的影响。 此应用简报展示了一个高通量工作流程,能够同步进行样品消解和样品净化,具有很高的重现性。分析过程中使用 Agilent AssayMAP Bravo 液体处理自动化系统、Agilent 1290 Infinity ll液相色谱与 Agilent 6550 Q-TOF 质谱联用系统(用于灵敏而准确的谱图采集), 以及 Agilent MassHunter BioConfirm 软件(用于数据自动分析)。 实验部分 材料 单克隆抗体标准品 RM 8671购自美国国家标准技术研究院(NIST)。质谱级胰蛋白酶/Lys-C酶混合物购自 Promega.所有其他化学品均购自Sigma-Aldrich。 AssayMAP C18 小柱来自安捷伦科技公司。 样品前处理 NIST mAb 标准品 RM 8671 使用 AssayMAPBravo 平台进行变性、还原、烷基化、酶解及脱盐处理。将样品用去离子水稀释至10、5、1和0.5 pg/pL(每个浓度重复8次)后,从每每样品中取10pL转移到不透明的96孔U型底板上。由蛋白质样品前处理工作台软件协调进行样品前处理。溶液内酶解模块用于进行样品消解:向每份样品中加入30pL的变性剂和还原剂(8M胍,13.3 mMTCEP, pH 7.5)。将样品板密封,并在台板外于37C下温育1小时。 开封样品板后,使用溶液内消解应用将10pL烷基化试剂 (132mM碘乙酰胺)从带盖的不透明96孔U型底板转移至每份样品中。将样品混合。盖上样品板盖,在室温下避光温育30分钟。 然后将210 pL 稀释剂 (50 mM Tris, pH 7.5)加入到样品中,随后加入5pL用50mM乙酸稀释的各种浓度的胰蛋白酶/LysC混合物(酶:蛋白质=1:40)。 将样品密封,并在台板外于37°℃下温育2小时。再向样品中加入5pL胰蛋白酶/LysC混合物,然后将样品在台板外于37°C下继续温育14小时。第二天,使用 AssayMAP 试剂转移工具将 30 pL 10% TFA 转移到样品板中,使样品酸化。使用 C18小柱通过肽段纯化应用对样品进行脱盐处理。使用100 pL 60% ACN、0.1% TFA 灌注小柱,并用 50 pL 0.1% TFA使其达到平衡,以5 pL/min的流速向小柱中注入消解样品,再使用 50 uL的 0.1% TFA 对小柱进行清洗,然后使用15pL的60%ACN、0.1% TFA 以 3 pL/min 的流速洗脱至165 pL0.1%FA 中, 使 ACN 的浓度降低至5%。然后使用LC/MS 系统对 0.5 pg的每个样品进行分析。 LC/MS分析 仪器 液相色谱系统 Agilent 1290 Infinity ll液相色谱系统,包括: ( Agilent 1290 Infinity lI高速泵 G7120A ) ( Agilent 1 290 Infinity II Multisampler G7167B ) ( Agilent 1290 Infinity II柱温箱 G7116B ) 质谱系统 配有安捷伦双喷射流离子源的 Agilent6550 iFunnel Q-TOF 液质联用系统 使用 Agilent 1290 Infinity ⅡI 液相色普系统联用配备双喷射流 ESI 离子源的Agilent 6550 iFunnel Q-TOF 液质联用系统进行 LC/MS/MS 和 LC/MS 分析。使用 Agilent AdvanceBio 肽谱分析色谱柱(2.1×150 mm, 2.7 pm)实现液相色谱分离。表1和表2汇总了所采用的 LC/MS/MS 参数。LC/MS分析中采用了相同的液相色谱梯度和离子源参数。以每秒五张谱图的采集速率采集质谱数据。 数据分析 使用 Agilent MassHunter BioConfirm B.08软件处理LC/MS/MS中采集的原始数据。简言之,首先使用分子特征提取器(MFE)对原始数据进行处理。将发现肽段参数设为默认值,而将 m/z范围设为不受限,另外将峰值过滤器的峰高设为大于500响应值。在NISTmAb 序列中搜索结果,序列中包括烷基化(C)的固定修饰以及氧化(M)、脱酷氨基化(NQ)、焦谷氨酸化 (Q) 和糖基化(N)各种常见形式的可变修饰。质谱匹配的允许误差为 ±10 ppm,MS/MS 匹配的允许误差为 ±20 ppm。允许两处未发生酶裂解。鉴定的所有肽段中至少包括1张 MS/MS 谱图。 手动检查低 BioScores 肽段的有效性。 表1.液相色谱参数 参数 值 色谱柱 Agilent AdvanceBio 肽谱分析色谱柱,2.1×150mm, 2.7 pm 柱温箱 4°C 溶剂A 0.1%甲酸的水溶液 溶剂 B 0.1%甲酸的乙腈溶液 梯度 0-15 min 内 B 由5%升至40% 15-18 min 内 B由40%升至90% 18-20 min 内 B 为 90% 柱温 60°C 流速 0.4 mL/min 表2.质谱仪参数 参数 值 干燥气温度 290°C 干燥气流速 13 L/min 雾化器压力 35 psig 鞘气温度 275°C 鞘气流速 12 L/min 毛细管电压 4000V 喷嘴电压 2000 V 碎裂电压 175V 四极杆AMU 100 采集模式 扩展动态范围(2 GHz) 质量数范围 m/z 100-1700 采集速率 5质谱图/秒 自动MS/MS范围 m/z 50-1700 最小MS/MS采集速率 3质谱图/秒 分离峰宽 中等(约4m/z) 母离子/循环 前10 碰撞能量 3.6*(m/z)/100-4.8 MS/MS阈值 1000响应值和 0.001% 动态排除 开启;重复3次然后排除 0.2 min 基于母离子丰度的扫描速度 是 目标值 25000 使用 MS/MS 累积时间限制 是 纯度 严格性100%,截留率30% 同位素模型 肽 母离子排序 仅按丰度;+2、+3、>+3 结果与讨论 采用 Agilent AssayMAP Bravo 平台、Agilent 6550 Q-TOFLC/MS/MS系统和Agilent BioConfirm B.08 软件的一体化工作流程 虽然肽谱分析是生物药物 mAb 表征的常规方法,但其样品前处理过程复杂,且这对保证分析结果质量有至关重要的影响。分析差异可能来自于技术、技术人员或不同合作实验室之间 的细微差异。当需要比较不同月份或年份之间的不同批次药品时,这种差异更具挑战性。此外,手动进行样品前处理很难针对克隆选择等高通量应用进行放大。 Agilent AssayMAP Bravo 平台可以自动完成肽谱分析的样品前处理操作,加快了处理进程,提高了结果的重现性。 AssayMAP 软件中简单易用的应用专为应对各种类型蛋白质的样品前处理工作流程(包括溶液内消解和肽 段纯化)而设计。自动化系统按照软件的指示进行基本步骤的操作,例如LC/MS 分析所需的样品变性、还原、烷基化、酶解和纯化。这种开放式自动化解决方案专为蛋白质样品前处理而设计,这些机械步骤的自动化(图1和图2)使分析人员能够在样品接受前处理的同时分身执行其他任务。样品前处理方法还可在不同实验室的AssayMAP系统之间转移,可提高不同机构间的结果重现性。 图1.mAb 肽谱分析的一体化工作流程,依次为 Agilent AssayMAP Bravo 平台上的自动化样品前处理、Agilent 6550 Q-TOF LC/MS/MS 分析和 Agilent BioConfirm B.08软件 图 2. Agilent AssayMAP 肽段样品前处理工作流程用于肽谱分析和其他工作流程的消解、纯化与选择性分馏 事实证明, Agilent 6550 iFunnel Q-TOFLC/MS/MS 系统在蛋白质鉴定和详细肽谱分析中能够获得优异的质量准确度和高度灵敏的质谱结果。BioConfirm软件能够在 MFE、多肽序列匹配和蛋白质序列覆盖映射等领域实现自动数据处理。通常情况下,已消解mAb 样 品的 LC/MS/MS分析中包含大量肽段,很多肽段中又含有各种PTM, 因此样品十分复杂。采集质谱数据后,BioConfirm 肽谱分析工作流程将会进行MFE 处理,并利用高度复杂的数据生成化合物(即肽段)列表。随后,将此化合物列表与用户特定的 mAb 序 列进行匹配,并生成一个序列覆盖映射。图3示出了已用胰蛋白酶/Lys-C混合物消解的 NIST mAb 的提取化合物色谱图 (ECC)。用所有已鉴定肽段在NIST mAb 轻链和重链中的相应序列号对其进行标记。 图 3.通过 Agilent AdvanceBio 肽谱分析色谱柱得到的来自胰蛋白酶/Lys-C 消解 NIST mAb 标准品 RM 8671 的肽段 ECC。轻链和重链分别被标记为A和B 为得到高度可靠的肽段鉴定结果,所有已匹配肽段的质谱质量数误差应<10 ppm, 并至少有一张确证MS/MS谱图。图4显示了两个选定肽段碎片离子的 MS/MS 谱图。BioConfirm 评分算法考虑了以下因素: b碎片离子和y碎片离子的存在 亚胺离子 质量准确度 MS/MS 峰强度 其他参数 结合高质量 MS 和 MS/MS数据有助于提高肽段匹配的可靠性,并提供有关肽段修饰的大量信息(图5和图6)。 图4.消解 NIST mAb 所得肽段的代表性 MS/MS 谱图。A)轻链肽段。B)重链肽段 质荷比(m/z) 采集时间 (min) 图5.A)翻译后修饰(甲硫氨酸氧化)分析。天然肽段和 Met氧化肽段(轻链肽段1-28) 的 MS/MS 谱图。上图:天然肽段,下图: Met4位置氧化的肽段(绿色框)。B)天然肽段(蓝色)和氧化肽段(红色)的叠加 ECC和相对定量分析结果(轻链肽段1-28) 15 Y ×103 272.1701 1.1- SGTASVVCLLNNFYPR 1.0- A b2 b b10 b12 b4 Yio 081 b-H,0 1196.5793 3 1295.6480 0.7- 485.2299 810.3841 899.4442 0.6- 0.5- b.-H,0 0.4- b-H,0 584.2983 Ys 1036.5503 386.1642 696.3440 3210.1 0- 1:1il 11 250 350 450 550 650 750 850 950 1050 1150 1250 1350 1450 质荷比 (m/Z) 15Y13 Y Y10 ×10S.GTAs:v.VCLLNNFYPR 1197.5674 1296.6359 图6.A)翻译后修饰(脱酰氨基化)分析。天然肽段和脱酰胺肽段的 MS/MS 谱图(轻链:126-141)。上图:天然肽段,中图: Asn 136处的脱酰氨基化,下图: Asn 137 处的脱酰氨基化。B)天然肽段和脱酷胺肽段的叠加 ECC 和相对定量分析结果(轻链:126-141)。插图:异天冬氨酸-136和异天冬氨酸-137的放大图 本文还研究了 mAb 蛋白序列覆盖率与消解样品量之间的关系。表3总结了在不同样品浓度下制备的 NIST mAb消解物的蛋白质序列覆盖率。在分析的所有 NIST mAb 消解物(n=8)中,每个蛋白质浓度下的平均蛋白质序列覆盖率均高于95%。图7显示了由BioConfirm B.08 软件生成的典型肽谱分析结果,其中包含蛋白质序列覆盖率。 消解的 NIST mAb 消解物(重复次数) 样品(ug) 1 2 3 4 5 6 7 8 平均 100 96% 96% 96% 95% 96% 96% 95% 97% 96% 50 96% 96% 97% 96% 96% 97% 96% 96% 96% 10 97% 97% 97% 97% 97% 97% 98% 98% 97% 05 97% 93% 97% 97% 94% 94% 97% 94% 95% 图 7. Agilent MassHunter BioConfirm 软件中代表性肽谱分析结果和蛋白质序列覆盖率的屏幕截图 翻译后修饰分析 蛋白质的甲硫氨酸氧化和天冬酰胺的脱酰氨基化是具有生物学意义的两种最常见PTM。甲硫氨酸(Met)是一种极易被活性含氧物质氧化的含硫氨基酸。对 Met 氧化的表征在 mAb 型治疗药物的开发过程中通常十分关键。 在肽谱分析结果中,含Met 4 的 NISTmAb 轻链肽段1-28被鉴定为部分氧化。图5A显示了天然肽段(母离子位于 m/z 985.8097处,+3)与Met氧化肽段(母离子位于 m/z 991.1414处,+3)的 MS/MS 谱图对比结果。ba-bz碎片离子(绿色框)中的主要差异(+16 Da)能够清楚区分出天然肽段和修饰形式,并指出了修饰的具体位置。此外,质谱数据显示了每种肽段类型的相对数量,其中氧化形式和天然形式分别占肽段总量的约0.43%和99.57%(图5B)。 脱酰氨基化是另一种常见的 PTM。在这种情况下,自发的非酶反应通过移除酰胺基团并使用羧基将其替换来修饰天冬酰胺或谷氨酰胺。天冬酰胺通常转化为天冬氨酸 (Asp)或异天冬氨酸(Iso Asp)。脱酰胺率取决于一级结构、蛋白质结构以及 pH、温度和离子强度等溶液性质。 本分析采用 MS/MS 谱图在三个不同的保留时间处找到了三个脱酰胺形式的NIST mAb 轻链肽段 126-141。图 6A 显示了天然肽段和脱酰胺肽段的 MS/MS谱图,其中y系列碎片在较大质量数范围内是主要离子,而b系列碎片在较小质量数范围内是主要离子。y-Y12碎片离子(橙色框)均显示出一个0.98 Da 的特征质量数偏移,清楚地表明肽段的这个区域内存在脱酰氨基化现象。此外,由于ys离子(红色框)(中图)与天然形式(上图)保持相同,显然该肽段的脱酰氨基化发生在 Asn 136 而非 Asn 137 处。相比之 下,下图中的ys离子(紫色框)的质量数比天然序列高0.98 Da, 证实了这一肽段群中的的酰氨基化发生在 Asn137位置。 质谱数据的定量分析结果揭示了与该轻链126-141肽段脱氨氨基化动力学有关的大量信息。在样品中,未修饰形式的天然肽段占样品的97.17%,:三种脱酰胺异构体在样品中的比例各不相同:异天冬氨酸-136为1.21%、异天冬氨酸-137为0.25%, 而天冬氨酸-136则为1.38%。结果列于图6B中。值得注意的是,这种位置特异性 PTM 信息、每种修饰的相对定量结果对于治疗性药物(mAb) 的开发通常十分关键。而此工作流程使这些信息十分易于获得。肽谱分析工作流程十分复杂,需要进行大量样品处理步骤以生成精确还原、烷基化、消解和脱盐的样品用于 LC/MS 测量,因此这种类型的定量分析得益于通过 AssayMAP 液体处理系统轻松实现的高度重现的全自动样品处理流程。 自动肽谱分析工作流程可生成高度重现的结果 这种自动工作流程解决方案能够根据样品数量轻松放大或缩小实验规模,因此我们在本研究中进行重复分析,以便评估系统在两个层面上的精度和重现性。第一个层面,我们将同一个孔中的相同酶解 mAb 样品进样至液质联用系统并重复测定八次,来评估液质联用系统的定量重现性。其次,我们将在不同孔中经变性、酶解和纯化 后的八份mAb样品分别进样至液质联用系统中,然后对其进行分析。在本次实验中,所有定量测量均在6550Q-TOF LC/MS/MS 仪器的仅 MS模式下进行。利用 5 pg mAb 制备样品的 EIC对28种裂解完全的肽段进行定量分析。以下分别显示了 LC/MS重复进样(图8A和图8B)和重复样品前处理(图8C和图8D)的两种代表性肽段的叠加EIC。在接受定量分析的28种肽段中,17种肽段的 CV 小于10%(平 均6%),7种肽段的 CV 在10%和20%之间(平均15%),4种肽段的 CV大于20%;(图8E)。这些结果与其他AssayMAP 肽谱分析研究中报告的结果一致。 虽然本研究中未详细说明,采用 ProteinA、 ProteinG 或酶链亲和素亲和小柱的AssayMAP 亲和纯化应用可将此工作流程的适用范围扩大至悬浮于生长培养基、血浆或其他复杂基质中的样品。 图8.5 ug NIST mAb 消解所得代表性肽段的 EIC。A, B)同一样品在 LC/MS 中的重复进样结果(n=8)。C, D)完整样品前处理的重复结果(n=8)。 E) %CV 小于 10%、10%-20%以及大于20%的肽段数量饼图 结论 安捷伦肽谱分析工作流程解决方案集先进的液体处理自动化系统、高效色谱技术、精确质量数 Q-TOF LC/MS 系统与强大的软件于一体,自动处理并精简对mAb 生物制剂开发至关重要的复杂处理过程。此工作流程采用: Agilent AssayMAP Bravo 系统, 能够自动进行酶解和样品纯化,具有优异的重现性 Agilent AdvanceBio 肽谱分析色谱柱,可实现出色的液相色谱分离,快速分离有助于提高分析实验室的效率 高度准确且灵敏的 Agilent 6550Q-TOF LC/MS/MS 系统,能够生成无偏差的肽谱分析数据,可实现单克隆抗体蛋白质的全面序列覆盖 Agilent MassHunter BioConfirm 数据分析软件,可执行自动数据提取、序列匹配、PTM鉴定和序列覆盖率计算 ( 参考文献 ) ( 1. G reer, F. M. MS Analysis of BioPharmaceutical P roducts.Innovation in Pharmaceutical Technology 2001, 83-90 ) ( 2. H igh Resolution and Rapid PeptideMapping o f Monoclonal AntibodyUsing an Agilent 1290 Infinity UHPLCand an A gilent 6550 i Funnel Q-TOFLC/MS System 1 ( ( 利用 Agilent 1290Infinity UHPLC 和 Agilent 6550 i F unnel Q-TOF LC/MS系统对单克隆抗体 进行高分离度的快速肽谱分析), 安捷伦科技公司,出版号5991- 3600EN ) ( 3. Robinson, N. E. P rotein Deamidation. PNAS 2002,99(8),5283-5288 ) ( 4.自动化液质联用样品前处理: 通过 Agilent AssayMAP Bravo 平台 实现高通量溶液内酶解和肽段纯化,安捷伦科技公司,出版号 5991-2957CHCN ) Agilent Technologies 前言单克隆抗体 (mAb) 是制药行业中发展最快的一类药物。mAb 作为蛋白质药物,从初始表达到最终商业化经历了一个高度复杂的过程,需要在每个步骤中对其进行仔细表征。在用于 mAb 表征的众多分析方法中,肽谱分析是一项至关重要的技术,它能够实现 mAb 的一级结构确认,还可以对翻译后修饰 (PTM)(如脱酰氨基化、氧化和糖基化)进行鉴定和定量分析。使用 LC/MS/MS 方法进行的 mAb 肽谱分析包括将纯化的 mAb 酶裂解为肽段、串联质谱分析以及数据解析。样品前处理通常涉及多个步骤,包括变性、还原、烷基化和酶解。手动进行肽谱分析样品前处理的过程十分繁琐,且易于受到可扩展性和重现性不佳的影响。此应用简报展示了一个高通量工作流程,能够同步进行样品消解和样品净化,具有很高的重现性。分析过程中使用 Agilent AssayMAP Bravo 液体处理自动化系统、Agilent 1290 Infinity II 液相色谱与 Agilent 6550 Q-TOF 质谱联用系统(用于灵敏而准确的谱图采集),以及 Agilent MassHunter BioConfirm 软件(用于数据自动分析)。结论安捷伦肽谱分析工作流程解决方案集先进的液体处理自动化系统、高效色谱技术、精确质量数 Q-TOF LC/MS 系统与强大的软件于一体,自动处理并精简对 mAb 生物制剂开发至关重要的复杂处理过程。此工作流程采用:• Agilent AssayMAP Bravo 系统,能够自动进行酶解和样品纯化,具有优异的重现性;• Agilent AdvanceBio 肽谱分析色谱柱,可实现出色的液相色谱分离,快速分离有助于提高分析实验室的效率;• 高度准确且灵敏的 Agilent 6550 Q-TOF LC/MS/MS 系统,能够生成无偏差的肽谱分析数据,可实现单克隆抗体蛋白质的全面序列覆盖;• Agilent MassHunter BioConfirm 数据分析软件,可执行自动数据提取、序列匹配、PTM 鉴定和序列覆盖率计算。
确定







还剩10页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《单克隆抗体(mAb)中肽谱分析检测方案(液相色谱仪)》,该方案主要用于预防类生物药品中含量测定检测,参考标准--,《单克隆抗体(mAb)中肽谱分析检测方案(液相色谱仪)》用到的仪器有Agilent 1290 Infinity II 液相色谱系统、Agilent AssayMAP Bravo 蛋白质样品前处理平台
推荐专场
液体处理工作站(移液工作站)
更多
相关方案
更多
该厂商其他方案
更多

















