
方案详情
文
目前,对于沙丁胺醇的检测,主要有酶联免疫分析法、液/质联用分析法、气/质联用分析法,其中前者主要用作筛选方法,后两者主要用作确认方法。
方案详情

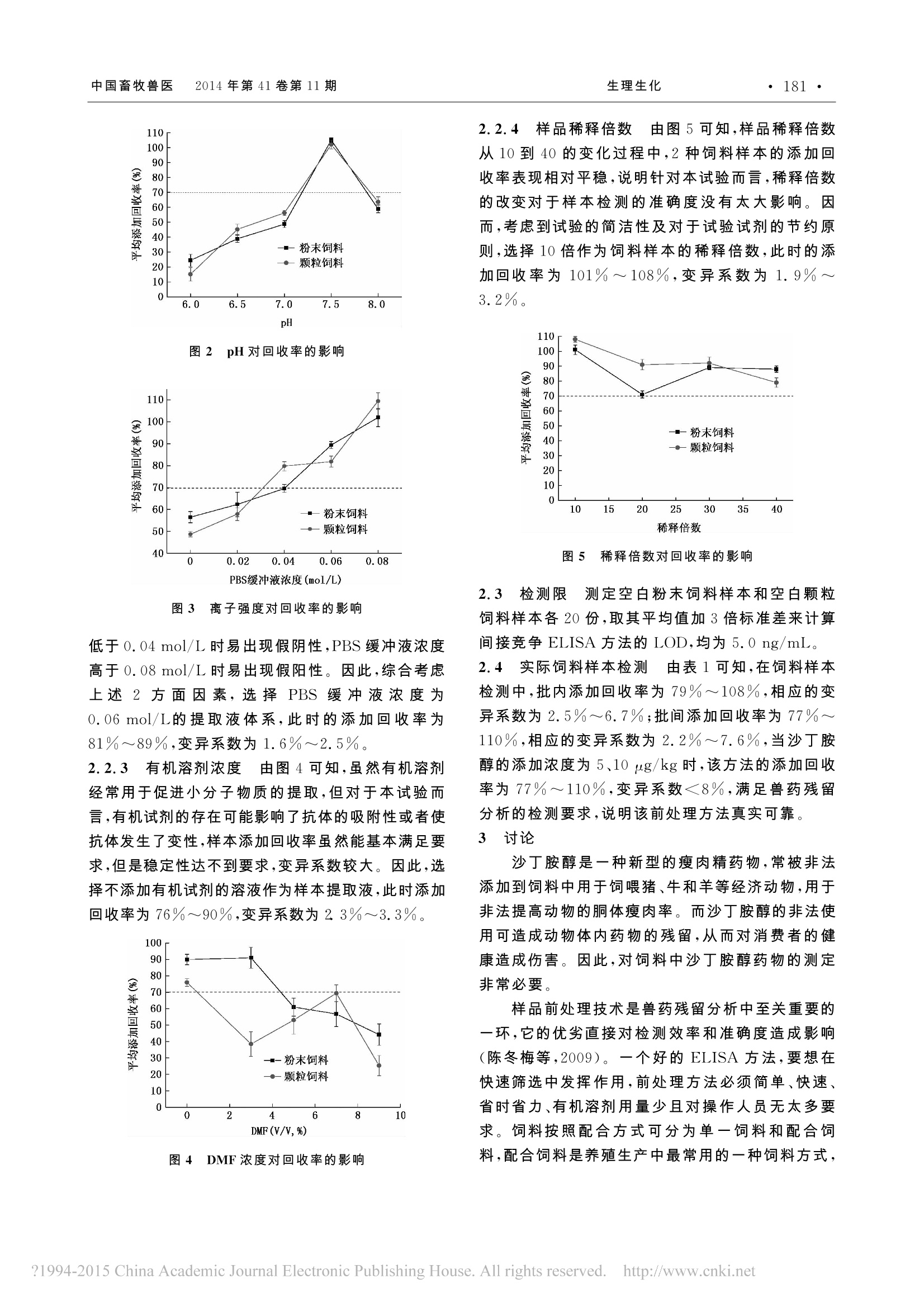
生理生化中国畜牧兽医 2014年第41卷第11 期·179· 中国畜牧兽医 2014年第41卷第11期生理生化·180· 饲料中沙丁胺醇酶联免疫前处理方法的探究 栗静雅1,王战辉1.2,王文珺3,江海洋1.2,沈建忠1.2 (1.中国农业大学动物医学院,北京 100193;2.国家兽药安全评价中心,北京 100193:3.北京维德维康生物技术有限公司,北京 100085) 摘要:为探讨酶联免疫法(ELISA)检测饲料中沙丁胺醇(salbutamol,SAL)的前处理方法,试验对提取液的 pH、离子强度、有机溶剂浓度及样品稀释倍数等条件进行了考察,选取最适宜的提取液条件对2种不同类型的饲料样本进行提取,用 ELISA测定样品中沙丁胺醇的残留量。结果表明,沙丁胺醇标准曲线的IC5o值为0.606 ng/mL,线性范围为0.221~1.658 ng/mL,R²=0.9998,提取液的pH为 7.5,PBS缓冲液最优浓度为0.06 mol/L,稀释倍数为10倍,2种不同类型的饲料样本的检测限(LOD)为 5.0 ng/mL。当沙丁胺醇的添加浓度为5、10 ug/kg时,该方法的添加回收率为77%~110%,变异系数≤8%。 关键词:酶联免疫法;沙丁胺醇;前处理;饲料 中图分类号:S816.17 文献标识码:A 文章编号:1671-7236(2014)11-0179-05 沙丁胺醇(salbutamol,SAL)是一种人工合成的β-兴奋剂,临床上用作止喘药,可以起到松弛气管平滑肌的作用,对于支气管哮喘、肺气肿和哮喘性支气管炎等疾病有很好的治疗效果(陈新谦等,2007)。然而,该药物还具有对于营养重新分配的作用,能够提高饲料的转化率,故而常被非法用作饲料添加剂喂食猪、牛、羊等牲畜(邱阳生等,2002)。长期使用沙丁胺醇等β-兴奋剂类药物会使其在动物体内不断蓄积,从而给人类带来危害(Traynor 等,2003)。人服食了含有沙丁胺醇残留的动物源性食品后,可能出现肌肉震颤、心律失常、头疼、晕眩、恶心、呕吐等中毒症状,严重者可导致死亡(王建平,2003)。世界上很多国家都明确规定禁止在畜牧生产中使用沙丁胺醇,中国也于2002年颁布农业部第193号公公,其中明确规定,禁止使用沙丁胺醇及其盐、酯、制剂于食品动物,且在动物性食品中禁止检出(翟福丽等,2011)。由于饲料中的非法添加是沙丁胺醇在动物源性食品中留产生的根本原因,因此,从源头上对沙丁胺醇的滥用进行检测和控制具有非常重要的意义。目前,对于沙丁胺醇的检测,主要有酶联免疫分析法(Meng等,2010;Sheu 等,2009)、液/质联用分析法(LS/MS)(Suo 等,2014)、气/质联用分析法(GS/MS)(Khamta等,2009),其中前者主要用作筛 ( 收稿日期:2014-05-07 ) ( 作者简介:栗静雅(1989 一 ),女,河北人,硕士,研究方向:动物源性食品安全。 ) ( 通信作者:沈建忠(196 3 一),男,教授,研究方向:动物源病原生物耐药性和动物性食品安全风险评估。E-mail: sjz@ cau. edu. cn ) ( 基金项目:公益性行业(农业)科研专项(2012104003-5)。 ) 选方法,后两者主要用作确认方法(Wang 等,2007)。饲料按照配合方式可分为单一饲料和配合饲料(陈旭高,2011),配合饲料与单一饲料的基质效应相比较为复杂,因此本试验选用了2种配合饲料样本,旨在对酶联免疫法(ELISA)检测配合饲料中沙丁胺醇前处理方法的样品提取液条件进行优化,从而为饲料中沙丁胺醇的检测提供切实可行的参考。 1 材料与方法 1.立 材料 1.1.1 样品采集 空白粉末饲料样本和空白颗粒饲料样本均由中国农业大学兽药安全评价中心实验动物房提供。 1.1.2 主要试剂与仪器 沙丁胺醇抗体和沙丁胺醇包被抗原均由中国农业大学兽药安全评价中心实验室提供。沙丁胺醇标准品购自中国药品与生物制品检定所;辣根过氧化物酶标记二抗(HRP-IgG)购自 Jackson ImmunoResearch公司;磷酸氢二钠、磷酸二氢钾、氯化钠、氯化钾、N,N-二甲基甲酰胺(DMF)均购自北京化学试剂公司。 800B离心机购自上海安亭科学仪器厂;微孔板酶标仪购自 Thermo 公司;HY-4型调速涡旋仪购自国华分析仪器厂;微量移液器购自 Eppendorf公司;电子分析天平购自 Sartorius 公司。 1.2 方法 1.2.1 标准曲线的建立 间接竞争 ELISA 方法的操作流程参照王鹤佳等(2004)方法进行。精确配制浓度分别为0、0.1、0.3、0.9、2.7、8.1ng/mL的沙丁胺醇标准品稀释液进行平行点板,测定上述各浓度沙丁胺醇标准品对抗体的抑制率,以不同标准品 溶液的浓度值为横坐标,以相对吸光度 B/B。 为纵坐标(各浓度沙丁胺醇抑制时的 D450nm值为B值,无检测物标准品抑制时0浓度的标准品溶液的 D450nm值为B。值),绘制标准曲线。当B/B,值达到50%时的标准品浓度度ICso值,通过建立的标准曲线求得。 1.2.2 饲料样品前处理方法 准确称取空白粉末饲料样品和空白颗粒饲料样品样(1±0.02)g于50 mL离心管中,依次加入不同pH、不同离子强度、不同浓度有机溶液、不同体积的样品稀释液,置于调速涡旋仪上充分涡动1min,至饲料样品分散。将上述离心管置于离心机中,4000 r/min 离心10 min,取 50 pL 进行检测。 1.2.2.1 pH 按1.2.2所述前处理方法,分别用10 mL不同pH(6.0~8.0)的样本提取液对空白粉末饲料样本和空白颗粒饲料样本中添加的沙丁胺醇进行提取(沙丁胺醇添加浓度为0、5、10 pg/kg),通过 Origin Pro 8.5 计算出各浓度的添加回收率,取平均值,以平均添加回收率为纵坐标,pH为横坐标作图。 1.2.2.2 离子强度 本试验根据文献选取了0、0.02、0.04、0.06、0.08 mol/L 的 PBS缓冲溶液代表不同的离子强度,按1.2.2所述前处理方法,分别用10 mL的提取液对空白粉末饲料样本和空白颗粒饲料样本中添加的沙丁胺醇进行提取(沙丁胺醇添加浓度分别为0、5、10 ug/kg),通过 Origin Pro 8.5 计算出各浓度的添加回收率,取平均值,以平均添加回收率为纵坐标,PBS缓冲液浓度为横坐标作图。 1.2.2.3 有机溶剂浓度 按1.2.2所述前处理方法,分别用10 mL 系列浓度梯度(0~9%)的 DMF溶剂对空白粉末饲料样本和空白颗粒饲料样本中添加的沙丁胺醇进行提取(沙丁胺醇添加浓度分别为0、5、10 ug/kg),依据公式计算出各浓度的添加回收率,取平均值,以平均添加回收率为纵坐标,DMF浓度为横坐标作图。 1.2.2.4 样品稀释倍数 按1.2.2所述前处理方法,分别用 10、20、30、40mL(即样品稀释倍数分别为 10、20、30、40倍)上述优化后的样品提取液对空白粉末饲料样本和空白颗粒饲料样本中添加的沙丁胺醇进行提取(沙丁胺醇添加浓度分别为0、5、10 pg/kg),依据公式计算出各浓度的添加回收率,取平均值,以平均添加回收率为纵坐标,稀释倍数为横坐标作图。 1.2.3 检测限 检测限(LOD)是指某一分析方法 在给定的可靠程度内可从样品中检测待测物质的最小浓度或最小量。适量称取空白粉末饲料样本和空白颗粒饲料样本各20份,测定2种不同类型的饲料样本中沙丁胺醇的检测限。 检测限=空白样本均值+3×空白样本的标准差 1.2.4 添加回收率的计算 经上述前处理方法处理后,测定D450nm值,计算抑制率,通过1.2.1所得标准曲线计算沙丁胺醇含量,进而得到添加回收率。 添加回收率(%)=实际测定浓度/真实添加浓度×100% 1.2.5 实际饲料样本检测 选取最优的前处理条件检测不同类型和批次的饲料样本,通过对于ELISA 的变异系数和回收率来确认该前处理方法用于 ELISA 检测的可行性。添加浓度设置为0、5、10 pg/kg 3个梯度,每个样本平行测定3次,通过Excel 2007 计算平均值、标准差和变异系数。 2 结果与分析 2.1 标准曲线的建立 以不同标准品溶液浓度的对数值为横坐标,以相对吸光度 B/B。为纵坐标,使用四参参 logistic 函数拟合后的标准曲线见图1.由图1可知,标准曲线的ICso值为0.606 ng/mL,线性范围为0.221~1.658 ng/mL,R=0.9998。 图1 沙丁胺醇标准曲线 2.2 样品提取液优化 2.2.1 pH 由图2可知,pH从6.0到8.0的变化过程中,样品的添加回收率发生了显著的变化,当pH为7.5时,样本的回收率为102%~105%,变异系数为1.5%~2.9%,符合方法的准确度要求。因此,选择pH7.5作为最优提取液pH。 2.2.2 离子强度 由图3可知,回收率随着离子强度(以PBS缓冲液浓度表征)增加呈上升趋势,当PBS缓冲液浓度≥0.04 mol/L时回收率为70%~79%,基本满足要求,与此同时当 PBS缓冲液浓度 图2pH对回收率的影响 图3 离子强度对回收率的影响 低于0.04 mol/L时易出现假阴性,PBS缓冲液浓度高于 0.08 mol/L时易出现假阳性。因此,综合考虑上述22方面因素,选择PBS缓冲液浓度为0.06 mol/L的提取液体系,此时的添加回收率为81%~89%,变异系数为1.6%~2.5%。 2.2.3 有机溶剂浓度 由图4可知,虽然有机溶剂经常用于促进小分子物质的提取,但对于本试验而言,有机试剂的存在可能影响了抗体的吸附性或者使抗体发生了变性,样本添加回收率虽然能基本满足要求,但是稳定性达不到要求,变异系数较大。因此,选择不添加有机试剂的溶液作为样本提取液,此时添加回收率为76%~90%,变异系数为23%~3.3%。 图4 DMF浓度对回收率的影响 2.2.4 样品稀释倍数 由图5可知,样品稀释倍数从10到40的变化过程中,2种饲料样本的添加回收率表现相对平稳,说明针对本试验而言,稀释倍数的改变对于样本检测的准确度没有太大影响。因而,考虑到试验的简洁性及对于试验试剂的节约原则,选择10倍作为饲料样本的稀释倍数,此时的添加回收率为101%~108%,变异系数为1.9%~3.2%。 图5 稀释倍数对回收率的影响 2.3 检测限 测定空白粉末饲料样本和空白颗粒饲料样本各20份,取其平均值加3倍标准差来计算间接竞争 ELISA 方法的 LOD,均为 5.0 ng/mL。 2.4 实际饲料样本检测 由表1可知,在饲料样本检测中,批内添加回收率为79%~108%,相应的变异系数为2.5%~6.7%;批间添加回收率为77%~110%,相应的变异系数为2.2%~7.6%,当沙丁胺醇的添加浓度为 5、10 pg/kg 时,该方法的添加回收率为77%~110%,变异系数≤8%,满足兽药残留分析的检测要求,说明该前处理方法真实可靠。 3 讨论 沙丁胺醇是一种新型的瘦肉精药物,常被非法添加到饲料中用于饲喂猪、牛和羊等经济动物,用于非法提高动物的洞体瘦肉率。而沙丁胺醇的非法使用可造成动物体内药物的残留,从而对消费者的健康造成伤害。因此,对饲料中沙丁胺醇药物的测定非常必要。 样品前处理技术是兽药残留分析中至关重要的一环,它的优劣直接对检测效率和准确度造成影响(陈冬梅等,2009)。一个好的 ELISA 方法,要想在快速筛选中发挥作用,前处理方法必须简单、快速、省时省力、有机溶剂用量少且对操作人员无太多要求。饲料按照配合方式可分为单一饲料和配合饲料,配合饲料是养殖生产中最常用的一种饲料方式, 表1 沙丁胺醇在饲料样本中的回收率和变异系数 样本编号 添加加度(pg/kg) 批内试验(n=3) 批间试验(n=3) 回收率(%) 变异系数(%) 回收率(%) 变异系数(%) C 102.0±3.2 3.1 103.8±4.3 4.1 2 5 93.5±3.1 3.3 97.7±3.7 3.8 10 84.1±2.1 2.5 77.6±2.1 2.7 0 86.1±3.6 4.2 76.5±5.4 7.0 5 107.4±6.1 5.8 97.2±5.8 6.0 3 4 5 10 85.8±7.2 5.6 98.3±7.4 7.6 78.6±3.5 4.4 85.0±5.9 6.9 5 88.9±3.1 3.5 93.2±2.8 2.2 10 102.2±6.8 6.7 103.7±3.9 3.8 C 92.1±2.5 2.8 97.0±3.8 4.3 5 107.2±6.1 4.4 97.2±5.8 5.0 10 108.3±5.2 2.6 109.5±4.5 3.7 101.5±4.9 6.1 98.3±6.2 5.3 104.2±5.1 3.3 101.3±5.7 5.6 10 108.4±3.9 5.6 102.4±6.4 3.2 按形态划分主要分为粉末饲料和颗粒饲料。因此,本试验对这2种类型的配合饲料进行了前处理方法的研究,从而使建立的 ELISA 方法更具有广泛而实际的推广价值。 ELISA反应中,抗体与抗原通过范德华力、疏水力和氢键等次级作用力进行结合反应(王硕等,2011)。反应体系中的pH既可以影响这些次级作用力,又可以影响抗体蛋白质分子的解离状态,从而可能影响到整个反应体系的灵敏度。成品饲料的组分相对较复杂,因此通过调节提取液的 pH 来消除饲料的基质效应具有非常重要的意义。极端的pH环境不利于免疫分析的进行,因此,本试验中适当缩小了提取液 pH 的范围(6.0~8.0);研究发现当提取液的pH 为中性偏弱碱性(7.5)时,饲料样本中的沙丁胺醇可以被有效的提取,添加回收率为70%~120%,满足兽药残留分析的基本要求。这可能是由于 pH 在偏弱碱性时最接近动物体液环境,有利于抗原抗体的结合,与通常情况下免疫检测最佳的反应条件也相符。 PBS 缓冲液的离子强度是对 ELISA 体系有较大影响的一个重要因素,可对抗原抗体之间的次级作用力产生作用,因此 PBS 缓冲液的离子强度对于样品的提取同样可能产生重要的影响(Adrian 等,2009)。本试验采用 PBS提取液中的无机盐离子浓度表征离子强度。在一定的离子强度范围内,随着离子强度的增加,参与非特异性反应的电荷可被大量离子掩盖,因而可以降低非特异性吸附作用,减少假阴性结果的产生,但如果离子强度过高又会抑制抗原抗体之间的反应,从而造成假阳性结果的产生。 因此,本试验最终选择了离子强度为0.06 mol/L 的提取液体系。 在兽药残留分析中,样本基质中的药物经常需要用有机溶剂提取到溶液中才能进行分析,然而,提取液中的有机溶剂有可能对免疫分析产生一定的影响,超过一定含量的有机溶剂可能会干扰抗原抗体的特异性结合,从而影响到药物残留检测的准确性。针对于不同的抗原抗体反应,有机溶剂的影响作用大小并不完全相同,但是过高的有机溶剂含量肯定不适于免疫反应的进行,因此,本试验选取了有机溶剂含量为10%以内的范围进行了研究。研究发现:本试验所选用的抗原抗体对于有机溶剂的影响较为敏感,低含量的有机溶剂既可以使得抗原抗体结合的稳定性变差,这可能是有机溶剂的存在部分影响了抗体的吸附性或使抗体发生了变性。 对于饲料一类的固态样品,需要进行一定的稀释来转化为液态物质用于 ELISA检测,因此本试验决定对样品的稀释倍数对于样品提取效率的影响进行研究。稀释倍数的选择应该使抑制率数值在标准曲线的线性范围内,因此本试验选择了10至40倍的稀释倍数进行研究,结果表明,本试验所选用的反应体系线性良好,因而稀释倍数的改变对于样品提取效率和准确度影响不大,遵循试验的节约性和便捷性,选用了10倍的稀释倍数用于后续样本的检测。 综上所述,本本验最终选择了 pH 7.5、0.06 mol/L PBS 缓冲液作为最优样品稀释液对2种配合饲料样本进行10倍稀释,得到样本提取液:用于进行间接竞争 ELISA 检测分析,检测限达到 5.0 ng/mL。同时,研究发现,2种饲料样本对于前处理过程中各种试验条件的改变基本呈相同趋势,说明不同形态配合饲料的基质效应基本相同,前处理方法可以统一,试验所确定的前处理方法具有在实际生产中广泛应用的价值。 ( 参 考 文 献 ) ( 王建平.3 2 -兴奋剂酶联免疫吸附检测法的研究[D].北京:中国农业大学,2003. ) ( 2 王鹤佳,史为民,沈建忠,等.牛尿中玉米赤霉醇残留酶联免疫检测方法的研究[J]. 中 国兽医杂志,2004(11):9~11. ) ( 3 王硕,张鸿雁,王俊平.酶联免疫吸附分析方法 —— 基本原理及其在食品化学污染物检测中的应用[M] . 北京:科学出版社,2011. ) ( 4 付京花,徐民俊.克伦特罗替代品的种类及检测[J].中国畜牧兽 医,2009,36(8):197~199. ) ( 5 邱阳生,杨根海,何方洋.沙丁胺醇单克隆抗体的制备及其鉴 定[ J ].中国兽医科技,2002(10):25~26. ) ( 6 陈旭高.饲料产品的分类[J].湖南农业,2011(10):20. ) ( 7 陈新谦,金有豫,汤光.新编药物学[M] . 第16版.北京:人民卫生出版社,2007. ) ( 8 陈冬梅,陶燕飞,余欢,等.兽药残留分析中样品前处理技术研究进展[J].化学通报,2009(08):713~719. ) ( 9 翟福丽,赖克强,张衍亮,等.动物性食品中β兴奋剂残留概述[ J ] . 食品科学,2011(05):351~356. ) ( 1 0 A drian J,F o nt H, D iserens J, e t al. Ge n eration of broad specificityantibodies for sulfonamide antibiotics and developme n t of an en-zyme-linked immunosorbent assay (E L ISA) fo r th e an a lysis ofmilk samples [J]. Journal of Agricultura l and Food Chemistry, 2009, 5 7(2):385~394. ) ( 11 Khamta Y, P attarawarapan M,Na n gola S, et al. Development ofimmunochromatographic assay for the on - site d e te c tion of s a lbu- tamol[J ] .Journal of Immunoassay and Immunochemistry,2009, 30( 4) : 44 1~4 5 6. ) ( 12 Meng M , Zhang Y L,Lu S X , et al. Preparation of anti-salbutamolantibody based on a new designed immunogen and d evelopment ofa h eterologous indirect ELISA for d etection o f salbutamol residue J] . Ya o Xue Xue Bao,2010 , 45(4):442~450. ) ( 13 Sheu S,Lei Y,Tai Y, et a l . Screening of s albutamol r esidues inswine m eat a nd animal f eed b y a n e nzyme immunoassay in T a i-wan_ J ] . Analytica Chimica Acta,2009,654(2):148~153. ) ( 1 4 Suo D C,Zhao G L,Wang P L,et al. Simultaneous determinationof B-agonists and psychiatric drugs in feeds by LC-MS-MS[J] J ournal of Chromatographic Science,201 4 ,52(7):604~ 6 08. ) ( 15 Traynor I M , Crooks S,Bowers J,et a l . Detection of multi--ago- nist residues in liver matrix by use of a surfac e plasma r e sonance biosensor[J]. Analytica Chimica Acta,2003,483(1):187~ 1 91. ) ( 16 W ang J P , Shen J Z . Immunoaffinity chromatography for purifica-tion of salbutamol and c le n buterol f ollowed s creening a nd confir- mation by ELISA and GC- M S[J]. Food and A gricultural Immu - nology,2007,18(2):107~115. ) Study on Preparation Treatment for Salbutamol inFeed by Enzyme-linked Immunosorbent Assay LI Jing-yal,WANG Zhan-huil2,WANG Wen-jun,JIANG Hai-yangl2,SHEN Jian-zhong (1. College of Veterinary Medicine, China Agricultural University, Beijing 100193, China; 2. National Reference Laboratory for Residues of Veterinary Drugs, Beijing 100193, China;3.Beijing WDWK Biotechnology Co., Ltd., Beijing 100085, China) Abstract:Objective of the study was to develop a preparation treatment for salbutamol in feed by enzyme-linked immunosorbent assay (ELISA). The assay optimized the influence factor of the preparation and used to extract salbutamol residues infeed. The results showed that the inhibition concentration (ICso) for the developed ELISA was 0.606 ng/mL with the detectionrange of 0.221 to 1.658 ng/mL and R’ was 0. 9998. After optimization,pH 7.5,0.06 mol/L PBS with the dilution ratio of 10was selected to extract salbutamol residues in feed and the limit of detection (LOD) was 5.0 ng/mL in feed. The recoveriesranged from 77% to 110% for the spiked samples (5 and 10 ug/kg),and RSD was less than 8%. Key words:enzyme-linked immunosorbent assay (ELISA);salbutamol;preparation treatment;feed ?China Academic Journal Electronic Publishing House.All rights reserved. http://www.cnki.net 世界上很多国家都明确规定禁止在畜牧生产中使用沙丁胺醇,中国也于2002年颁布农业部第193号公告,其中明确规定,禁止使用沙丁胺醇及其盐、 酯、 制剂于食品动物,且在动物性食品中禁止检出 。由于饲料中的非法添加是沙丁胺醇在动物源性食品中残留产生的根本原因,因此,从源头上对沙丁胺醇的滥用进行检测和控制具有非常重要的意义。
确定




还剩3页未读,是否继续阅读?
北京维德维康生物技术有限公司为您提供《饲料中沙丁胺醇检测方案(试剂盒)》,该方案主要用于饲料中兽药检测,参考标准--,《饲料中沙丁胺醇检测方案(试剂盒)》用到的仪器有肉精沙 维德维康瘦肉精沙丁胺醇酶联免疫试剂盒 96/盒
相关方案
更多









