方案详情
文
二十多年前,已经有很多学者以白蛋白作为载体共价连接DT PA再与钆螯合合成一种大分子造影剂,但这些研究多集中在其作为血池性造影剂及评价血管生成的性能;白蛋白作为一种可以被多功能修饰的前体造影剂的特性尚未被充分开发。随着分子影像学的飞速发展,磁共振的高空间分辨率给阿尔茨海默病的显示带来了希望,同时也给磁共振的灵敏度带来了挑战。提高磁共振成像灵敏度给磁共振造影剂性能提出了更高的要求,同时制备出可以进行多功能修饰的磁共振造影剂前体也是分子影像学发展的需要。本文改进了BSA一(Gd—DTPA)n的制备及纯化方法,制备出既具备高弛豫特性又还存有多个可被修饰氨基的前体造影剂,并对其体内及体外特性进行初步表征。
方案详情

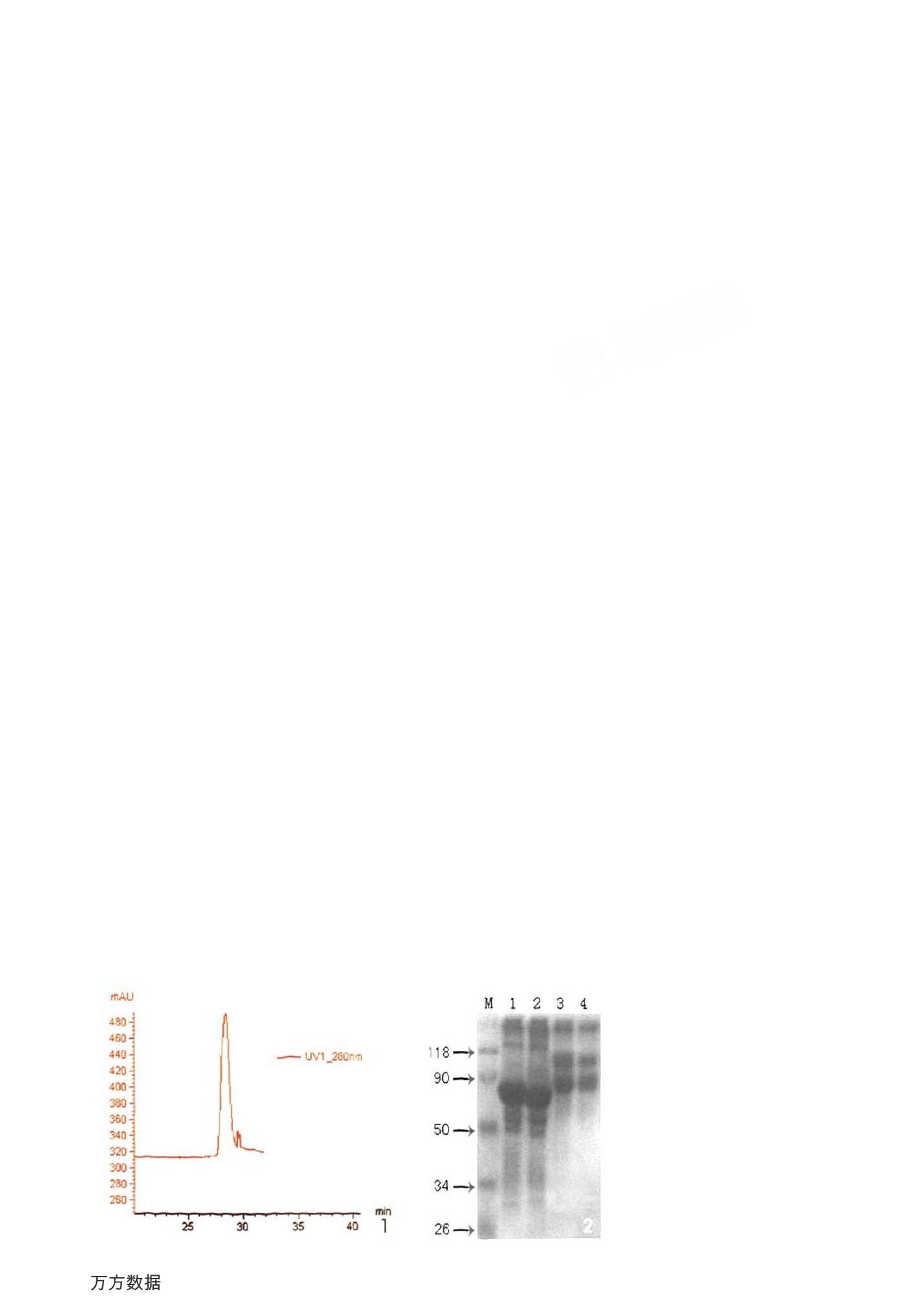
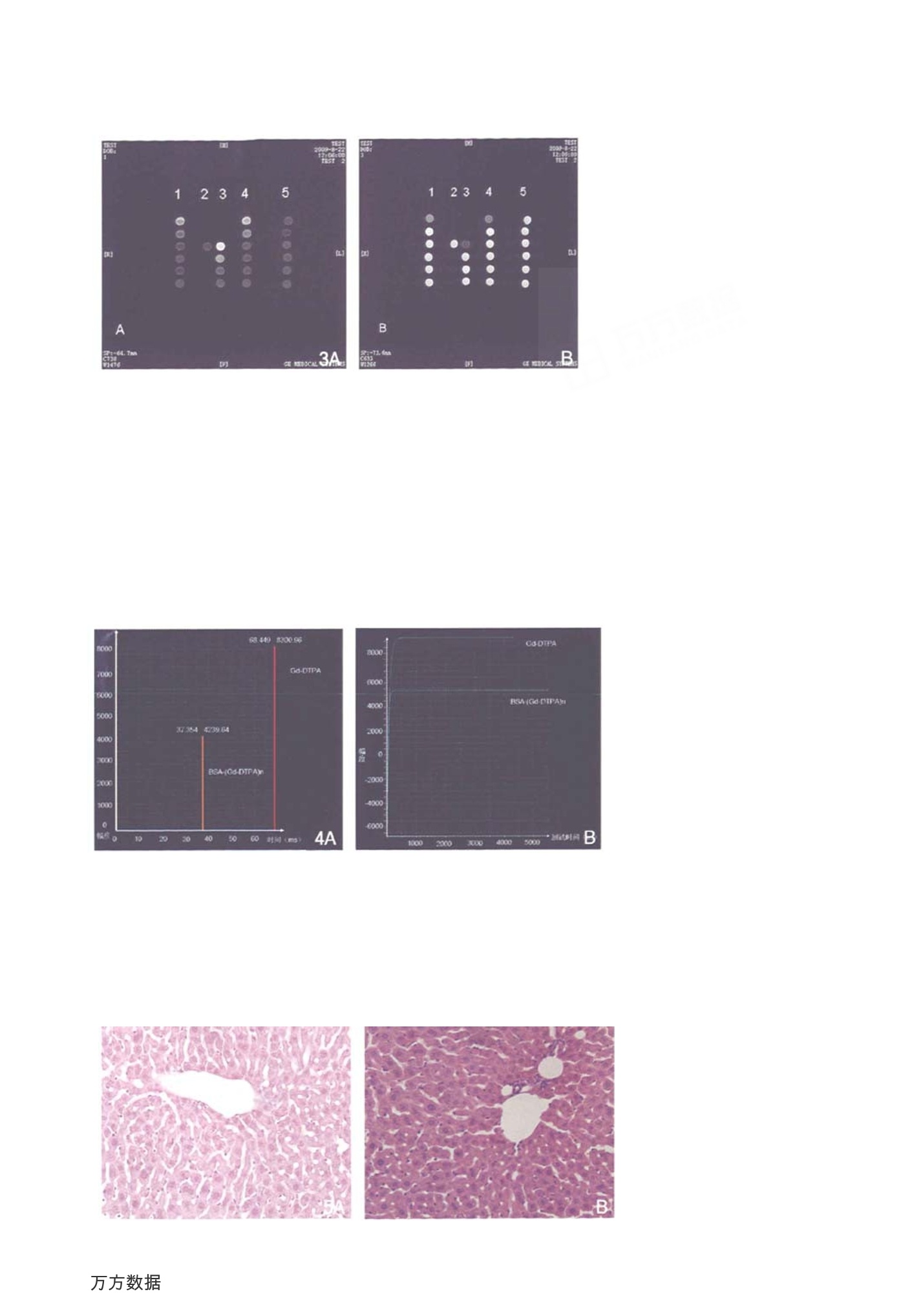
-46-实验研究LABORATORY STUDY 中国医学计算机成像杂志2010年第16卷第1期Chin1 Comput MedImag,2010 , 16(1)-47- 一种磁共振造影剂前体 BSA-(Gd-DTPA)n的制备、表征及体内外评价 李树平1.3 冯晓源 梁春敏? 何慧瑾1 孟庆刚 占昌友 李 瑾+ 顾 炳+ 佘振珏? 邱龙华' 杨 波 陈路平5 【摘要】目的:改进BSA-(Gd-DTPA)n制备及纯化方法,探讨其作为磁共振造影剂前体的优势及应用前景。方法: BSA 与二乙烯三胺五乙酸环酐反应生成 BSA-(DTPA)n,并与 GdCl 螯合生成 BSA-(Gd-DTPA)n。紫外光谱法鉴定其结构,并定量测定其中 DTPA 对 BSA 的偶联率。测定配合物体外弛豫时间Ti、Tz,分析其弛豫性能 R1、R2。小鼠急性毒性试验评价药物安全性。大鼠磁共振增强扫描评价其活体内代谢及分布情况。结果:本研究制得的 BSA-(Gd-DTPA)n配合物中n=26。体外弛豫性能R1约为7.00×10L·mmol-·ms,比小分子 Gd-DTPA 的弛象性能 (3.52×10L·mmol-·ms-')提高近1倍。大鼠磁共振增强扫描显示BSA- (Gd-DTPA)n和白蛋白一样具有长循环特性。结论:本实验改进方法可制备出磁共振造影剂前体BSA-(Gd-DTPA)n,该配合物具备长循环特性,且具有多个可供修饰的氨基,可作为一种潜在的磁共振造影剂前体。 【关键词】 磁共振造影剂前体;合成;表征;BSA-(Gd-DTPA)n 中图分类号:R981+.9文献标志码:A 文章编号:1006-5741(2010)-01-046-06 Synthesis,Characterization and Evaluation of BSA-(Gd-DTPA)nas a MRI Contrast Agent Precursor LIShu- ping, FENG Xiao-guan', LIANG Chan-min, HE Hui-jin', MENG Qing-gang',ZHANChang- you, LI Jin, GU Bing, SHE Zhen-jue, QIU Long-hud, YANG Bd', CHEN Lu- ping (Abstract】 Purpose: To improve the synthesis and purification methods of BSA-(Gd-DTPA), and toexplore its advantages and application prospect as a high - performance relaxation magnetic resonanceimaging agent precursor. Methods: Bovine serum albumin (BSA) reacted with diethylenetriamine pen-taacetic acid cyclic anhydride (DTPACA) under the condition pH= 9, and produced the conjugate BSA-(DTPA)n, GdCl was further chelated to the conjugate to produce BSA-(Gd-DTPA).BSA-(Gd-DT-PA) , was characterized and identified by UV spectroscopy.The coupling ratio of DTPA and BSA wasquantitatively determined by ICP/AES. The relaxation rates of R1/R2 were further analyzed by measur-ing the relaxation time Ti/T2 of the complex in vitro. The drug safety was evaluated by acute toxicitytest. The preliminary evaluation of its metabolism and distributions in vivo was done by magnetic reso-nance multi-phase enhanced scanning for multi- organs in rats. Results: In the obtained complex BSA -(Gd-DTPA) n, n= 26. The relaxation property R1 in vitro was about 7.00×10-3L·mmol·ms at ( 中国医学计算机成像杂志,2010,16:46-51 ) 作者单位:1复日大学附属华山医院放射科 2复旦大学医学院 3中国人民解放军第四五五医院 4复旦大学药学院 5上海纽迈电子科技有限公司 ( 通信地址:上海市乌鲁木齐中路12号,上海200040 ) ( 通信作者:冯晓源(电子邮箱 xyfeng@shmu.edu.cn) ) ( 基金项目:本课题受卫生部卫生行业科研专项项目(项目编号: 200802099)资助 ) Chin Comput Med Imag,2010, 16:46-51 1 Department of Radiology, Huashan Hospital, Fudan University ( 2 Fudan University School of Medicine ) ( 3No 445 Hospital,Chinese People's Liberation Army ) ( 4 Fudan University School of Pharmacy ) ( 5 Shanghai NIUMAG Eclectronic Technology Co.Ltd ) ( Address: 12 Middle Wulumuqi R d, Shanghai 200040, P.R.C. ) Address Correspondence to FENG Xiao- yua(nE- mail: xyfeng @shmu.edu.cn) Foundation Item: Scientific Research Program on Health Care, Ministry ofHealth (NO. 200802099) 0.5T in 32℃, about twice of the relaxation property of the small -molecule Gd-DTPA(3.52×10-3L·mmol-·ms). The enhanced MRI scans in SD rats showed that vessels were obviously enhanced at thesame time that the renal pelvis already had been filled by the contrast agent. This indicated that BSA -(Gd-DTPA)n had notable long-circulating characteristic as albumin, and this was conducive to its fullyintegration with the targeted lesions and displaying the vessels. Conclusion: The high relaxation per-formance magnetic resonance contrast agent precursor BSA-(Gd-DTPA), can be prepared and purifiedby the improved methods in this experiment, it has notable long - circulating characteristic, and hasmany amino- groups for modification, so it can be used as a potential MRI targeting contrast agent pre-cursor. 【Key words】 MRI contrast agent precursor;Synthesis; Characterization; BSA-(Gd-DTPA) 二十多年前,已经有很多学者以白蛋白作为载体共价连接 DTPA 再与钆螯合合成一种大分子造影剂,但这些研究多集中在其作为血池性造影剂及评价血管生成的性能上11-61;白蛋白作为一种可以被多功能修饰的前体造影剂的特性尚未被充分开发。随着分子影像学的飞速发展,磁共振的高空间分辨率给阿尔茨海默病的显示带来了希望望8J,同时也给磁共振的灵敏度带来了挑战。提高磁共振成像灵敏度给磁共振造影剂性能提出了更高的要求,同时制备出可以进行多功能修饰的磁共振造影剂前体也是分子影像学发展的需要9。本文改进了 BSA-(Gd-DTPA)n的制备及纯化方法,制备出既具备高弛豫特性又还存有多个可被修饰氨基的前体造影剂,并对其体内及体外特性进行初步表征。 方 法 1.仪器与试剂 1.1仪器:EXCITE Ⅱ 1.5T超导型磁共振扫描仪(美国GE公司);NMI20-Analyst/PQ001(上海纽迈电子科技有限公司)。AKTA explorer 100 中压层析系统(瑞典安发发西亚公司);P-4010电感耦合等离子体发射光谱仪。ALPHA1-2冻干机。显微镜、电泳仪、电泳槽、凝胶成像仪、脱色摇床、电磁恒温磁力搅拌器等。 1.2试剂:牛血清白蛋白(BSA, 电泳纯98%,SIGMA);二乙烯三胺五乙酸环酐 (DTPACA,分析纯, SIGMA); GdCls.6Hz0(分析纯, SIGMA);Sephadex G-15葡聚糖凝胶(瑞典AB公司)。其余试剂均为国产分析纯。 2.实验动物 磁共振成像实验选取 60 日龄 SPF 级 SD大鼠2只,体重约250g。急性毒性实验所用小鼠为昆明小白鼠,约18~20g,共18只。 3.BSA-(Gd-DTPA)n 及 Gd-DTPA 的制备、 鉴定及表征 3.1BSA-(Gd-DTPA)n及Gd-DTPA的制备及纯化:根据文献方法】并加以改进,称取 50mg 的BSA, 加人 1ml 的0.05mol/L,pH=9的磷酸缓冲液(PBS), 56mg 的 DTPACA 直接加人 BSA 溶液中,用 5mol/L 的 NaOH调节pH值,吏 pH值保持在6~7,25℃搅拌1h后,再加加与 DTPACA 等物质量的GdCls 溶液(用少量1mol/L 的盐酸溶液溶解),继续搅拌1h。反应液用 5mol/ L 的 NaOH调节pH值至pH=7.4,使未反应的游离Gd*沉淀,离心后除去沉淀,上清用 Sephadex G-15凝胶柱进行分离,用pH=7.4的 PBS作为流动相进行洗脱, 在 280nm处紫外监测洗脱过程,收集第一个峰的洗脱液,即为BSA-(Gd-DTPA)n偶联物的 PBS溶液,冻干后再以纯水作为流动相进行脱盐分离即得纯化的BSA-(Gd-DTPA)n偶联物。 3.2BSA 与 Gd-DTPA 偶联率的测定:采用高频电感等离子体发射光谱法 (ICP-AES)测量样品中Gd*的含量,并计算 Gd-DTPA 对蛋白质的偶联率。 3.3BSA-(Gd-DTPA) n 与 BSA的电泳图:采用SDS-PAGE 鉴定 BSA- (Gd-DTPA)n的分子量范围,方法如下[101:依次配制含聚丙烯酸胺7%的分离胶和5%的浓缩胶,样品干粉溶粉 PBS, 待浓缩胶干后上样BSA、BSA(Gd-DTPA) n 和 marker各 10ug,分离胶电泳以25mA恒流,浓缩胶电泳以 45mA恒流,电泳完立即置于固定液(500ml乙醇,100ml冰醋酸,400ml蒸馏水)中 50min,考马斯亮蓝染色 10min(0.29g考马斯亮蓝溶解在 250ml色色液中,在使用前边搅拌边加热至60℃,多次变换脱色液(250ml乙醇,80ml冰醋酸,加蒸馏水至1L),直至凝胶背景脱净为止。 4.BSA-(Gd-DTPA)n的弛豫性能 4.1BSA-(Gd-DTPA)n溶液的磁共振成像:取一定量 BSA-(Gd-DTPA)n配成浓度为 0.1mmol/L 的水溶液 2ml,再分别稀释10倍、100倍、1000倍,装入2mlEP 管中,对照为 0.5mol/L商品造影剂钆喷酸葡胺溶液液释500倍(即浓度为1mmol/L),再分别稀释10倍、100倍、1000倍、10000倍,装人 2mlEP管中行磁共振TW和TW成像,成像参数略。 4.2体外弛豫时间Ti的测定及R1的计算:准确称取一定量 BSA- (Gd-DTPA)n溶于1.5ml体积分数为20%的重水中,配制成 5mmol/L 的溶液。用微量移液器取 0.5ml置于 15mm 核磁品品管中,于0.5T NMI20- Analyst 和 PQ001核磁共振仪(配置15mm直径探头线圈,32℃)采采用反转恢复法测其纵向弛豫时间Ti,采样方式采用脚本采样;采用CPMG序列测量其横向弛豫T2,根据公式计算其R1及R2值。用同样方法测定配合物在0.725mmol/L牛血清白蛋白(BSA)溶液中的弛豫时间 T、T及R1、R2值。 5.小鼠急性毒性试验 配合物BSA- (Gd-DTPA)n以灭菌注射用水配制成水溶液,溶液 pH值调至7~8,以0.45um微孔滤膜滤除不溶机械杂质,注人数只安瓶瓶中分装,熔融封管,然后于 39.23×10*Pa, 120℃ 下消毒 30min,溶液均澄清透明,表明其热稳定性良好。无菌条件下取昆明种小白鼠,从小白鼠尾静脉一次注射不同剂量(0.05ml,0.10ml,0.15ml,0.20ml,0.25ml)的样品后于当时和周后观察其急性毒性,每个剂量均平行试验3次。0.25ml剂量组及对照组3只小鼠,处死解剖后取肝、肾组织行H-E染色。 6.BSA-(Gd-DTPA)26大鼠磁共振增强扫描 EXCITE Ⅱ 1.5T超导型磁共振扫描仪(美国GE公司),人腕关节线圈。FSPGR/T WI 序列, tR170ms,TE1.5ms。FOV=60mm,层厚/层间距=3.0/0.5mm,数据采集矩阵为128×128。实验选用 10%水合氯醛,作为大鼠的麻醉剂,腹腔注射,剂量为350~ 400mg/kg。造影剂的钆浓度为5mmol/L,每只大鼠约注射1ml。 结 果 1. BSA-(Gd-DTPA)26及 Gd-DTPA的鉴定及表征 1.1BSA 与 Gd-DTPA偶联率的测定及 BSA-(Gd-DTPA)26紫外扫描图:通过 ICP-AES 测得配合物中Gd 的含量为5.1%,通过换算得出 BSA 与Gd-DTPA平均偶联率 n=26,而白蛋白上总共有59个赖氨酸侧链氨基,据此可以推算平均每个白蛋白上尚残留23个赖氨酸侧链氨基,这些氨基可进一步进行修饰,比如连接靶向头基/荧光探针或者进行阳离子化等等。分离过程中获得的BSA-(Gd-DTPA)26在SephadexG-15葡聚糖凝胶柱上的凝胶色谱图见图1。 1.2BSA-(Gd-DTPA), 及 BSA 电泳图: SDS一聚丙烯酞胺凝胶电泳显示 BSA- (Gd-DTPA) n的分子量,如图2。样品分子量为67000左右, BSA-(Gd-DTPA))1n有两条条带,提示分子量介于70000~118000之间,是不同 n 值的混合物,26是不同n 值的平均值。其余较淡条带为少量杂质。 2.BSA-(Gd-DTPA)26的弛豫性能 2.1 BSA- (Gd-DTPA)26 溶液的磁共振成像:见图3。 2.2Ti寅演拟合曲线及R1的拟合曲线图:BSA-(Gd-DTPA)26 及Gd-DTPAT按照单组分反演拟合结果如图4,Tz的反演及拟合曲线略。通过测得样品的T、Tz值,我们可以计算得到样品溶液的弛豫率,计算公式如下11: 公式(1)中,R为弛豫率,i(i=1,2)为样品的弛豫时间类型, Ti 为样品的弛豫时间。另外,如果要计算溶液中溶质的浓度,我们需要知道溶液的浓度,单位为 图33BSA-(Gd-DTPA)26溶液及对照的TWI(A)和TzWI(B)成像。1、4、5列分别为钆双胺注射液, BSA-(Gd-DT-PA)26水溶液、钆喷酸葡胺、BSA水溶液,浓度从上到下依次为1、0.1、0.01、0.001、0.0001、0.00001mmol/ L; 3为BSA-(Gd-DTPA)26 水溶液,浓度从上到下依次为0.1、0.01、0.001、0.0001mmol/L;2列为双蒸水阴性对照。 mol/L,计算公式如下: 其中, To 为不同浓度溶液的弛豫时间, Tw 为纯水的弛豫时间,C为对应于弛豫率的样品浓度, ri 为溶质的弛豫率。由以上理论,根据已测得的相应数据,可以计算出样品及对照的R1、R2、r1、r2等弛豫率。在白蛋白溶液中,我们也近似的按照该公式,计算出对应的R1、R2、r1、r2等弛豫率。这里测得的纯水及白蛋白溶液的T1、Tz值分别为3802.06/ 2447.08、2294.4/ 792.48(表1)。 3.小鼠急性毒性试验 初步的急性毒性实验显示,各剂量组小鼠一周后均毛色光泽如初,无任何中毒症状,1周内无一死亡,其体重与对照组无区别。解剖后观察实验组小鼠的肝、肾均无明确可见的病理改变征象,与生理盐水对照组无显著性差异(图5)。 4.BSA-(Gd-DTPA)n大鼠磁共振增强扫描 SD 大鼠体内磁共振成像实验:肝肾平扫 TWI 表1 BSA-(Gd-DTPA)26及 Gd-DTPA 在不同溶液中的弛豫时间及弛豫率 化合物 溶剂 C(mmol/L) T(obsd/ms) R1/(L·mmol-·ms') T2(obsd/ms) R2/(L·mmol-1·ms-) BSA-(Gd-DTPA)26 H0 5mmol/L 37.35 5.30×10 23.64 8.38×10 Gd-DTPA H0 5mmol/L 68.45 2.87×10" 49.77 3.94×10 BSA-(Gd-DTPA)26 BSA 5mmol/L 28.20 7.00×10 14.17 13.86×10- Gd-DTPA BSA 5mmol/L 55.45 3.52×10 42.29 4.48×10' BSA:牛血清白蛋白(bovine serum albumin);DTPA:二乙烯三胺五乙酸(diethylenetriamine pentaacetic acid)。 图5 肝脏H-E染色(×40)。实 验组(A)与对照组(B)未见显著差 异,未见明显巨噬细胞增多。 轴位扫描,尾静脉注射 1ml BSA-(Gd-DTPA)26后分别于 1min、5min、10min 及 30min 后进行肝肾多期增强扫描。该实验初步评价了 BSA-(Gd-DTPA)n对肝脏、肾脏和腹主动脉MRI 信号的增强作用,并分析了其随时间的变化情况。图6、图7为静脉注射 BSA-(Gd-DTPA) 26大鼠肝脏和肾脏 MRI 信号强度随时间的变化情况。注射造影剂 BSA- (Gd-DTPA) 26 后,1min 内肝脏和腹主动脉就出现了明显的增强效果,在 整个成像过程中对肝脏信号增强始终保持升高的趋势,它对腹主动脉增强模式类似于长循环血池性造影剂,这是由于白蛋白的长循环特性决定的。BSA-(Gd-DTPA) n和Gd-DTPA具有非常相似的肾脏代谢模式,但与其又有所不同。注射造影剂后不久,肾脏就出现了明显的增强效果,一直到实验结束,肾盂内仍可见造影剂。可以在多个时间窗内同时看到肾盂与腹主动脉的增强。 图6 肝脏TW多期扫描图像。T WI 平扫(A)示肝脏及腹主动脉脉中等信号,增强后1min(B)可见肝脏及主动脉明显强化,5min(C)仍可见血管明显强化,提示其长循环特性。 图7肾脏平扫、多期增增扫描TW像及腹部冠状面增强 TW像。A为增强前 T W图像,注射造影剂 lmin 后(B),腹主动脉及肾脏可见强化;5min后(C)肾盂内和血管内同时可见明显高信号。以后10min(D)及30min(E)时间窗内仍可见肾盂及血管同时增强。45min(F)冠状面 TW像显示膀胱内可见造影剂充盈。 讨 论 本研究成功制备了大分子磁共振造影剂 BSA-(Gd+DTPA)n。制备过程中, pH值是影响合成结果及效率较为重要的因素。BSA 与 DTPA 的偶联是在碱性条件下进行的,在 pH=9的条件下,其偶合效率较高。由于 GdCl; 在中性或碱性条件下易生成Gd(OH)沉淀,阻碍钆的螯合,因此后续螯合钆的实验应在酸性条件下进行,本实验中用5mol/L 白 NaOH将pH值调至6~7,且用1mol/L的盐酸溶液溶解 GdCl,获得较好的螯合效果。由于 DTPACA具有两个环不,容易使两个蛋白质交联沉淀,从而影响与钆的进一步的螯合反应,因此控制 BSA与 DTPACA的比例在整个反应过程中也至为关键。太低的比例,偶联的 DTPA 太 少影响钆的螯合,从而影响造影剂的弛豫率;太高的比例,白蛋白上的赖氨酸侧链氨基反应完全,无法进行下一步的修饰。本实验采用控制 BSA 与 DTPACA的比例为1:50,获得较为合适的偶联率。同时,实验中应避免pH值太高或太低,否则白蛋白容易变性。本实验中BSA 与 Gd-DTPA 平均偶联率n=26,而白蛋白上总共有59个赖氨酸侧链氨基,据此可以推算平均每个白蛋白上尚残留23个赖氨酸侧链氨基,这些氨基可进一步进行修饰,比如连接靶向头基/荧光探针或者进行阳离子化等,这样 BSA-(Gd-DTPA)n 就可以作为靶向性磁共振造影剂的前体,进一步拓宽其应用范围;或者与装载治疗药物的纳米粒或其他载体系统连接,成为靶向病变的靶头,进而通过 MRI 监测药物的靶向性及体内分布。 实验中,通过 0.5T NMI20-Analyst 和 PQ001核磁共振仪分别测定了 BSA- (Gd-DTPA)26和Gd-DTPA 在32℃时的横向和纵向弛豫时间,分别得到了T和Tz的反演和拟合曲线,具体形象地反映了两种造影剂的弛豫特点,并且通过公式计算出两种造景剂在 5mmol/L时的弛豫率。公式1/ To=1/Tw+rixC, 是在忽略溶质分子相互作用的前提下得到的12,而且一般仅适用于稀溶液,本实验中溶液的浓度较稀,可以按照该公式来计算弛豫率,预实验中,根据不同浓度造影剂R1/R2值拟合的曲线呈线性关系,综合考虑,在误差允许的范围内,利用该公式计算造影剂的弛豫率是可信的。另外考虑到造影剂进入人体后,需通过血浆的存储和运输,与单纯的纯水的环境有所不同。因此,造影剂在纯水中的弛豫率不能完全代表其在人人血液中的弛像性能。血清白蛋白 (serumalbumin)是哺乳动物体内多种内源性和外源性物质的存储、转运蛋白,也是血浆中含量最丰富的具有许多生理功能的蛋白质之一。因此本研究在测定造影剂在纯水中的弛豫率外,还测定了造影剂在牛血清白蛋白溶液中的弛豫性能,对了解此类造影剂在体内的作用过程具有重要意义。考察过程中,仍沿用上述公式计算其弛豫率,但是该公式能否适用于造影剂的白蛋白溶液尚待进一步研究。 小鼠急性毒性实验表明造影剂在诊断所需剂量下毒性较低。但是不排除来自于体内其他金属离子或小分子配体的竞争配位,从而破坏了体内的生化平衡,导致一定的毒性,在应用于临床前,应考虑将其进行适当的修饰,使其达到在体内弛豫性能和安全性能的双重保障。 大鼠磁共共增强扫描初步揭示了BSA - (Gd_DTPA) n 的长循环性能,该性能有利于其多时相显示血管及分支,且有利于靶向造影剂靶向头基与病灶的充分结合。但是过长的半衰期势必会影响到非特异性背景的及时清除,给成像时机的选择带来一定的困难。后续的研究将进一步具体定量BSA- (Gd-DT-PA) n的血浆半衰期,从而为造影剂前体 BSA-(Gd-DTPA)n的优化提供一定的依据。 致 谢 本实验中造影剂弛豫率的测量得到上海纽迈电子 科技有限公司的鼎立协助,特此致谢。 ( 参考文献 ) ( 1.Schmiedl U, O gan MD, Moseley ME, et al. Comparison of the contrast - enhancing properties of albumin-(Gd-DTPA) andGd-DTPA at 2.0 T: and experimental study in r a ts. A JR, 1986,147:1263-1270 ) ( 2.Ogan MD, Schmiedl U, Moseley ME, et al. Albumin labeled with Gd - DTPA. An int r avascular contrast - enhancing agent fo r magnetic resonance blood pool imaging: pr e paration and cha r ac-terization. Invest Radiol,1987,22:665-671 ) ( 3.Daldrup- Link HE, Okuhata Y, O I e S, et al. Decrease in tumorapparent permeability- surface area product to a MRI m acro-molecular contrast medium following angiogenesis inhibition w i thcorrelations to c ytotoxic drug a c cumulation. Microcirculation,2004,11:387-396 ) ( 4.Wi XM, F e ng Y, Jeong EK, et a l. Tumor characterization with dynamic contrast enhanced magnetic r esonance imaging andbiodegradable macromolecular contrast agents in mice. PharmRes, 2009,26:2202-2208 ) ( 5.Rosen M A, S c hnall MD.Dynamic contrast- enhanced magnetic resonance imaging f o r assessing tumor vascularity a n d vasculareffects of targeted t herapies in renal cell carcinoma. C l in Ca n Res, 2007,13:770-776 ) ( 6.Turetschek K, Floyd E , Helbich T, et al . M R I assessment ofmicrovascular characteristics in experimental breast tumors using a new blood p ool c ontrast agent ( M S-325) wit h correlations to histopathology . J Magn Reson Imaging, 2001,14:237-242 ) ( 7.Li WS, LiZF, Jing FY, et al. Synthesis and evaluation of G d -DTPA - labeled arabinogalactans as p otential MRI contrast a -gents. Carbohydrate Research, 2008,343:685-694 ) ( 8.Ramakrishnan M, Wengenack TM, Kandimalla KK, e t al.Selectivecontrast enhancement of individual Alzheimer’s disease amyloidplaques using a polyamine a nd G d- DOTA con j ugated ant i bodyfragment against fibrillar AB42 for magnetic re s onance molecularimaging.Pharmaceutical R esearch, 2 008,25:1861-1872 ) ( 9.Jain TK, F oy SP, Erokwu B, e t a l . M agnetic resonance imagingof multifunctional p luronic stabilized iron - oxide nanoparticles intumor-bearing mice. B i omaterials, 2009,30:6748-6756 ) ( 10.赵永芳.生物化学技术原理及其应用.武汉:武汉大学出版社, 1994:324 ) ( 11. Koenig SH, Baglin C , Brown RD, et al. Magnetic fie l d depen- dence of solvent proton relaxation induced by Gd3+ and M n2+ complexes. Magn Reson Med ,1984,1:496-501 ) ( 12.Caravan P, P arigi G, C hasse JM, e t al. Albumin binding, relax- ivity, and water e xchange kinetics o f t he d iastereoisomers of MS-325, a gadolinium(III) - based magnetic resonance angiog-raphy contrast agent. Inorg Chem,2007,46:6632-6639 ) ( (收稿时间:2009.06.02;修回时间:2009.08.10) ) jin,l, MENG Qing-gang, ZHAN Chang-you, LI Jin, GU Bing, S H E Z he n - j u e , QIU Long-hua, YANG Bo, CHEN Lu-ping Shu-ping(复旦大学附属华山医院放射科,上海,200040;中国人民解放军第四五五 李树平,LI 医院),冯晓源,何慧瑾,邱龙华,FENG Xiao-yuan,HE Hui-jin,QIU Long-hua(复旦大学附属 华山医院放射科,上海,200040), 梁春敏,佘振珏,LIANG Chun-min, SHE Zhen-jue(复旦大学 医学院),, 孟庆刚,占昌友,李瑾,顾炳, MENG Qing-gang, ZHAN Chang-you, LI Jin, GU Bing(复旦大学药学院), 杨波, YANG Bo(中国人民解放军第四五五医院), 陈路平, CHEN Lu-ping(上海纽迈电子科技有限公司) 参考文献(12条) 1.Schmiedl U.Ogan MD. Moseley ME Comparison of the contrast-enhancing properties of albumin-(C-d-DTPA) and Gd-DTPA at 2.0 T:and experimental study in rats 1986 2.0gan MD. Schmiedl U.Museley ME Albumin labeled with Gd-DTPA.An intravascular contrast-enhancingagent for magnetic resonance blood pool imaging:preparation and characterization 1987 3. Daldrup-Link HE. Okuhata Y.OIe SDecreasee in tumor apparent permeability-surface area product to aMRImacromolecular contrast medium following angiogenesis inhibition with correlations to cytotoxicdrug accumulation 2004 4.Wi XM. Feng Y. Jeong EKTumor characterization with dynamic contrast enhanced magnetic resonanceimaging and biodegradable macromolecular contrast agents in mice 2009 5.Rosen MA. Schnall MD Dynamic contrast-emhanced magnetic resonanceimaging for assessing tumorvascularity and vascular effects of targeted therapies in renal cell carcinoma 2007 6.Turetschek K.Floyd E. Helbich T「MRIassessment of microvascular characteristics in experimentalbreast tumors using a new blood pool. contrast agent(MS-325)with correlations to histopathology2001 7.Li WS.Li ZF. Jing FY Synthesis and evaluation of Gd-DTPA-labeled arabinogalactans as potential MRIcontrast agents 2008 8.Ramakrishnan M. Wengenack TM.Kandimalla KK Selective contrast enhancement of individual Alzheimers disease amyloid plaques using a polyamine and Gd-DOTA conjugated antibody fragment against fibrillar AB 42 for magnetic resonance molecular imaging 2008 9.Jain TK. Foy SP. Erokwu B Magnetic resonance jimaging of multifunctionall ppluronic stabilized iron-oxide nanoparticles in tumor-bearing mice 2009 10.赵永芳生物化学技术原理及其应用 1994 11. Koenig SH. Baglin C. Brown RD Magnetic field dependence of solvent proton relaxation induced by Gd3+and Mn2 + complexes 1984 12. Caravan P.Parigi G. Chasse JM Albumin binding,relaxivity,and water exchange kinetics of the 本文链接: http://d.g.wanfangdata.com.cn/Periodical_zgyxjsjcx201001011.aspx 授权使用:同济大学图书馆(tjdxtsg), 授权号:851919b6-8973-47d5-a36a-9dbc00b59532 ( 下载时间:2010年7月23日 ) 数据
确定






还剩6页未读,是否继续阅读?
苏州纽迈分析仪器股份有限公司为您提供《一种磁共振造影剂前体BSAGdDTPA_n中制备、表征及体内外评价检测方案(核磁共振)》,该方案主要用于其他中制备、表征及体内外评价检测,参考标准--,《一种磁共振造影剂前体BSAGdDTPA_n中制备、表征及体内外评价检测方案(核磁共振)》用到的仪器有纽迈分析低场核磁共振成像分析仪-食品农业领域NMI20-015V-I
推荐专场
相关方案
更多
















