
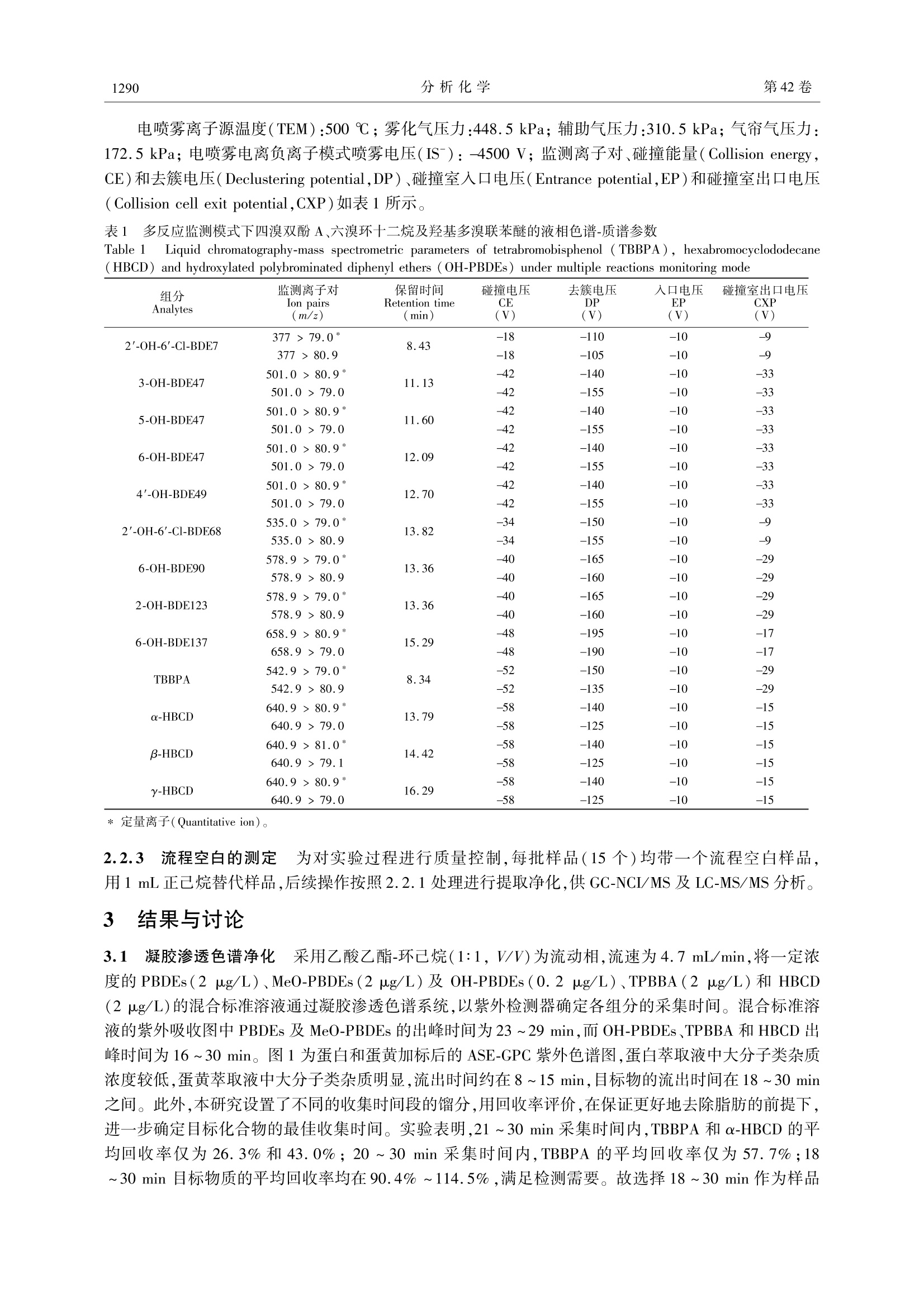
鸡蛋样品脂肪含量高,色素重,净化步骤多采用凝胶渗透色谱(Gel permeation chromatography,GPC),由蛋白和蛋黄加标后的ASE-GPC 紫外色谱图可以看出,蛋白萃取液中大分子类杂质浓度较低,蛋黄萃取液中大分子类杂质明显。
方案详情

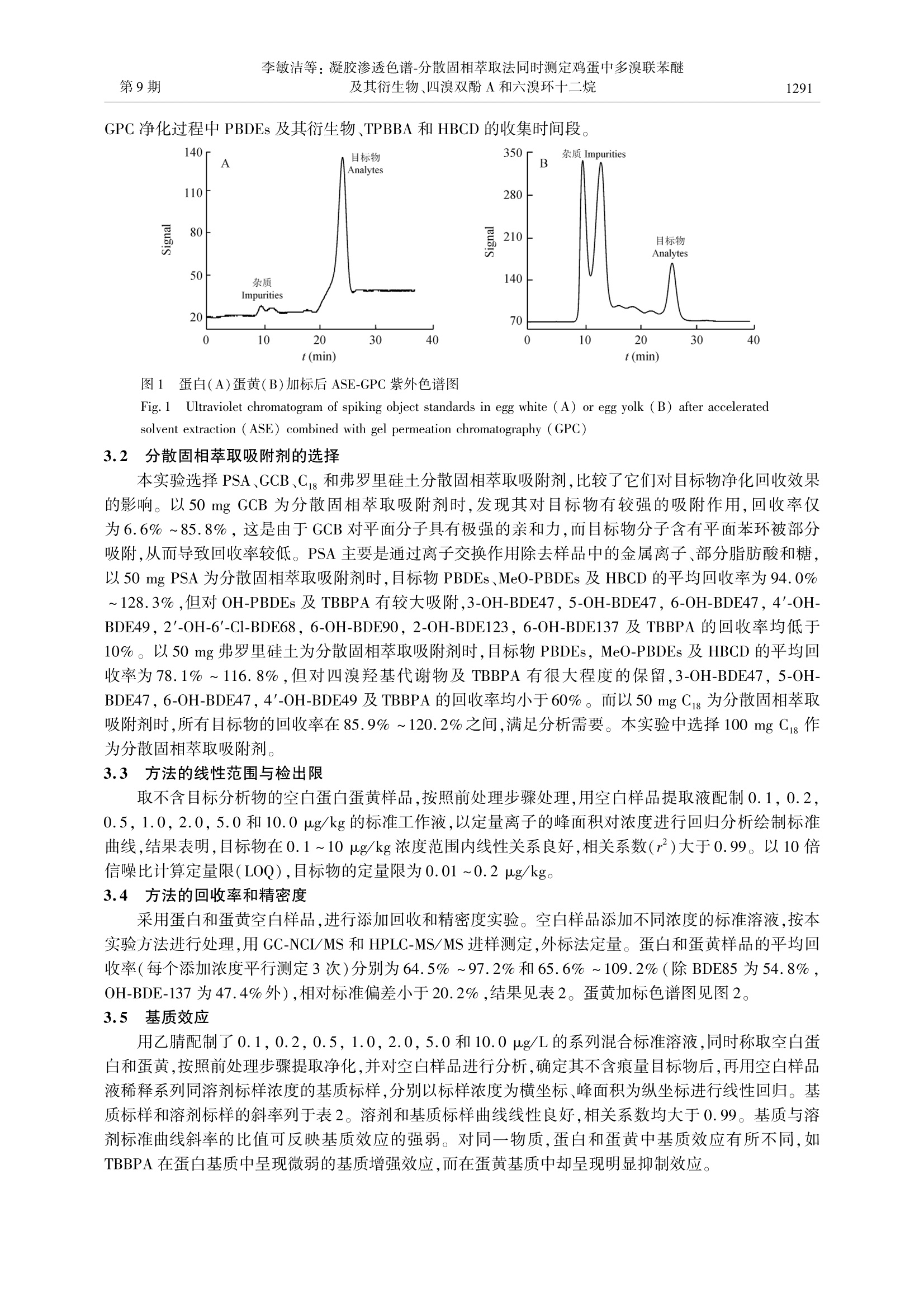
第42卷2014年9月分析化学(FENXI HUAXUE)石研究报告Chinese Journal of Analytical Chemistry第9期1288~1294 李敏洁等:凝胶渗透色谱-分散固相萃取法同时测定鸡蛋中多溴联苯醚及其衍生物、四溴双酚A 和六溴环十二烷第9期1289 This work was supported by the National Key Technology R&D Program (No.2012BAD29B03) DOI: 10.11895/j.issn. 0253-3820.140233 凝胶渗透色谱-分散固相萃取法同时测定鸡蛋中多溴联苯醚及其衍生物、四溴双酚A和六溴环十二烷 李敏洁 金芬* 杨莉莉 乌日娜 邵华 金茂俊三王静 (农业部农产品质量安全重点实验室,中国农业科学院农业质量标准与检测技术研究所,北京100081) 摘 要 建立了一种同时检测鸡蛋中四溴双酚 A(TBBP A)、六溴环十二烷(HBCD)和多溴联苯醚(PBDEs)及其衍生物羟基多溴联苯醚(OH-PBDEs)和甲氧基多溴联苯醚(MeO-PBDEs)的凝胶渗透色谱(GPC)-分散固相萃取(DSPE)-液相色谱-串联质谱(HPLC-MS/MS)和气相色谱-负化学源质谱(GC-NCI/MS)的检测方法。样品经正己烷、二氯甲烷(1:1,V/V)加速溶剂萃取,凝胶渗透色谱净化后,经100 mg 十八烷基键合硅胶(Cg)分散固相萃取吸附剂去除杂质,液相色谱-串联质谱和气相色谱-负化学源质谱方法测定,外标法定量。在蛋白和蛋黄样品中添加1.0或5.0 ug/kg 的目标物,其回收率分别为64.5%~97.2%和65.6%~109.2%(除 BDE-85 为54.8%,OH-BDE-137 为47.4%外),相对标准偏差小于20.2%,定量限为0.01~0.2 ug/kg 关键词 多溴联苯醚及其衍生物;四溴双酚 A;六溴环十二烷;鸡蛋;凝胶渗透色谱;分散固相萃取 引 言 多溴联苯醚(Polybrominated diphenyl ethers, PBDEs)、四溴双酚 A(Tetrabromobisphenol A, TBBP A)和六六环十二烷(Hexabromocyclododecane,HBCD)是目前广泛应用于电子设备、塑料、建筑材料、装饰材料及纺织品等的溴代阻燃剂(Brominated flame retardants, BFRs),近年来,人们逐渐注意到这三类溴代阻燃剂对环境及人类健康的影响。2009年,全球关于持久性有机污染物的《斯德哥尔摩公约》第四次缔约国大会上,商业化的五溴联苯醚及八溴联苯醚被列为全球控制和消减的持久性有机污染物(POPs),该公约提出在全球范围内禁止使用HBCD。现有研究表明,这三类阻燃剂普遍具有内分泌毒性、生殖毒性、肝脏毒性和神经毒性,威胁到人类的健康和生命安全。虽然目前对 PBDEs 在生物体内的代谢产物羟基代谢物(Hydroxylated polybrominated diphenyl ethers, OH-PBDEs)及甲氧基代谢物(Methoxylatedpolybrominated diphenyl ethers, MeO-PBDEs)的来源还有争议11~31,但 MeO-PBDEs 和 OH-PBDEs 可能具有更高的毒性[4,5],且在生物体内 OH-PBDEs 与 MeO-PBDEs 可以相互转化。人体血液中 MeO-PB-DEs 的含量高于 PBDEs61,因此有必要同时测定生物体内的 PBDEs、MeO-PBDEs 和 OH-PBDEs。 随着电子业的发展,环境中 BFRs 的污染报道也日益增加17.8J。PBDEs、TBBPA 和HBCD 三类溴代阻燃剂的辛醇/水分配系数(lgK)约为4.5~10.0,具有持久性和脂溶性,可通过生物富集作用累积在生物组织内,近年来关于三类溴代阻燃剂在生物组织中污染水平的报道日益增多[9~17]。动物性产品成为 BFRs 进入人体的重要途径之一[18,19」,根据文献[9]的风险评估报告,淡水鱼、肉和鸡蛋等富含脂质的食品是人类膳食摄入 PBDEs 的重要来源,其中淡水鱼占12%~98%,猪肉占1%~20%,而鸡蛋占1%~15%。电子垃圾回收区鸡蛋的艺PBDEs 和HBCD 检出浓度甚至高达14100 ng/g(脂肪重量,fat weight, fw)和350 ng/g (fw)。 鸡蛋样品脂肪含量高,色素重,目前常用的提取方法是索氏提取和超声提取,净化步骤多采用凝胶渗透色谱(Gel permeation chromatography,GPC)结合多层硅胶柱净化,或酸性硅胶柱结合酸性氧化铝柱净化,或直接采用多层硅胶柱净化等111,12,14」,前处理方法较为繁琐。而分散固相萃取法(Dispersive solidphase extraction,DSPE)具有简单、快速、廉价等特点,能有效去除有机酸、糖、色素及脂肪等杂质,然而,目前 PBDEs, MeO-PBDEs, OH-PBDEs, TBBPA 及 HBCD 同时检测方法未见报道。本研究建立了以加 ( 2014-03-11收稿;2014-05-14接受 ) ( 本文系国家科技支撑计划资助项目(No.2012BAD29B03) ) ( * E -mail: jinfenbj@ 163. com ) 速溶剂萃取(Accelerated solvent extraction,ASE)提取,GPC 及 DSPE 净化的快速前处理方法,结合液相色谱-串联质谱(LC-MS/MS)及气相色谱-负化学源质谱(GC-NCI/MS)检测包括 PBDEs, MeO-PBDEs 和OH-PBDEs, TBBPA 及 HBCD 在内的30种溴代阻燃剂方法。 2 实验部分 2.1 仪器与试剂 Varian-300气相色谱-质谱/质谱仪(美国瓦里安公司);安捷伦1200液相色谱仪(美国Agilent 公司);API5000三重四级杆串联质谱仪, Analyst 1.4.2工作软件(美国应用生物系统公司); ASE 300 加速溶剂萃取仪(美国戴安公司); NE-1101 旋转蒸发仪(日本 EYELA公司); FD-1A-50 冷冻干燥机(上海博医康实验仪器有限公司);凝胶渗透色谱净化系统(美国 J2 scientific 公司); GPC 凝胶材料为聚苯乙烯二乙烯基苯微球(美国 Bio-Rad公司);高速冷冻离心机(德国 Biofuge Stratos 公司); Milli-Q超纯水器(美国 Millipore 公司)。 二氯甲烷、正己烷(色谱级,美国 Fisher 公司);乙酸乙酯、环己烷、乙腈(农残级,美国 Honeywell 公司);N-丙基乙二胺吸附剂(Primary secondary amine, PSA)、石墨化碳黑(Graphitized carbon black,GCB)、十八烷基键合硅胶(Octadecyl bonded silica,Cjs)吸附剂(天津博纳艾杰尔公司);三硅酸二镁(Florisil,弗罗里硅土,美国 Sigma 公司)。 12种 PBDEs 混合标准(BDE-17,BDE-28, BDE-47, BDE-66,BDE-71,BDE-85, BDE-99,BDE-100,BDE-138,BDE-153,BDE-154,BDE-183,美国 AccuStandard 公司);5种MeO-PBDE 单标(2'-MeO-BDE-28,6-MeO-BDE-47,2'-MeO-BDE-68,6-MeO-BDE-85, 6-MeO-BDE-137, 美国 AccuStandard 公司);9种 OH-PBDE 单标(2'-OH-6'-Cl-BDE7,3-0H-BDE47,5-0H-BDE47,6-OH-BDE47,4'-OH-BDE49,2'-OH-6'-Cl-BDE68,6-OH-BDE90,2-OH-BDE123,6-OH-BDE137,美国 AccuStandard公司);3种HBCD(a-HB-CD, B-HBCD,y-HBCD),TBBPA(北京百灵威科技有限公司)。目标物纯度均≥98.5%。 2.2 实验方法 2.2.1 样品前处理 (1)提取称取1.0g(精确至0.01g)冻干蛋白粉或蛋黄粉,加入1.0g(精确至0.01 g)硅藻土混匀后,装入34 mL 的 ASE 萃取池中,以正己烷-二氯甲烷(1:1,V/V)混合溶剂,温度100℃,压力10.4 MPa, 预热5 min,静态提取 10 min,60%萃取池体积溶剂快速冲洗样品,氮气吹扫90s等条件进行加速溶剂萃取,收集全部萃取液。将萃取液转入 100 mL 旋转蒸发瓶中,30℃减压旋转蒸发浓缩至近干,转换溶剂为乙酸乙酯-环己烷(1:1,V/V)混合溶剂,定容至10 mL,过 0. 45 pm 尼龙膜后进行 GPC 净化。(2)净化 GPC 采用50g Bio-Beads S-X3(400 mm×30 mm)聚苯乙烯树脂凝胶色谱柱,流动相为乙酸乙酯-环己烷(1:1,V/V),流速4.7 mL/min。收集18~30 min 组分于 100 mL 旋转蒸发瓶中,在30℃以120 r/min 旋转蒸发至近干,用乙腈润洗3次转转K-D 浓缩管,并旋蒸至1 mL以下,用乙腈定容至1mL。用玻璃吸管将其转入装有 100 mg Cig 分散固相萃取吸附剂的10 mL 玻璃离心管中,高速涡旋1 min 后,在4℃以3000 r/min 离心5 min,上清液过0.22 pm 有机相滤膜后进行测定,其中 GC-NCI/MS 测定 PBDEs 和 MeO-PBDEs,LC-MS/MS测定 OH-PBDEs, TBBPA 和 HBCD 2.2.2 色谱和质谱条件 (1)GC-NCI/MS气相色谱条件 DB-5 MS UI(30 mx0.25 mm×0.25 pm)毛细管柱;载气为高纯氦气(≥99.999%),恒流,柱流量为1.0 mL/min;进样口温度:280℃;不分流进样,进样体积:1pL。程序升温:初始温度180℃,保持2 min; 以15℃/min 升至205℃,保持2 min;以3℃/min升至251℃,保持1 min; 以5℃ /min 升至310℃,保持10 min,共计 41.83 min。质谱条件:离子源温度:280℃;电离模式:负化学电离源(NCI),电子能量:70 eV;溶剂延迟时间:6.00 min;反应气:甲烷(≥99.999%),压力为 0.666 kPa;数据采集模式:选择离子监测(SIM)。12种PBDEs 和5种MeO-PBDEs 的监测离子为79.0和80.9,选择79.0做定量离子。(2)LC-MS/MS[S采用 XBrige Cig色谱柱(150 mmx2.1 mm,3.5 pm);柱温:40℃;进样体积:5pL。流动相A 为0.1%甲酸,流动相B为乙腈,流速为0.20 mL/min,梯度洗脱程序:0 min,60% B;0~5 min, 60%~70% B;5~15 min, 70%~90%B;15~17 min, 90%~95% B; 17~18 min, 95%~60% B; 18~23 min, 60% B。 电喷雾离子源温度(TEM):500℃;雾化气压力:448.5 kPa; 辅助气压力:310.5kPa;气帘气压力:172.5 kPa;电喷雾电离负离子模式喷雾电压(IS-):-4500V;监测离子对、碰撞能量(Collision energy,CE)和去簇电压(Declustering potential,DP)、碰撞室入口电压(Entrance potential,EP)和碰撞室出口电压(Collision cell exit potential,CXP)如表1所示。 表1 多反应监测模式下四溴双酚A、六溴环十二烷及羟基多溴联苯醚的液相色谱-质谱参数 Table11Liquid chromatography-mass spectrometric parameters of tetrabromobisphenol (TBBPA), hexabromocyclododecane(HBCD) and hydroxylated polybrominated diphenyl ethers (OH-PBDEs) under multiple reactions monitoring mode 组分 监测离子对 保留时间 碰撞电压 去簇电压 人口电压 碰撞室出口电压 Ion pairs Retention time CE DP EP CXP Analytes (m/z) (min) (V) (V) (V) (V) 2'-OH-6'-Cl-BDE7 377 > 79.0* 8.43 -18 -110 -10 -9 377>80.9 -18 -105 -10 -9 3-OH-BDE47 501.0>80.9" 11.13 -42 -140 -10 -33 501.0>79.0 -42 -155 -10 -33 5-OH-BDE47 501.0>80.9 11.60 -42 -140 -10 -33 501.0>79.0 -42 -155 -10 -33 6-OH-BDE47 501.0>80.9* 12.09 -42 -140 -10 -33 501.0>79.0 -42 -155 -10 -33 4'-OH-BDE49 501.0>80.9* 12.70 -42 -140 -10 -33 501.0>79.0 -42 -155 -10 -33 2'-OH-6'-Cl-BDE68 535.0>79.0 13.82 -34 -150 -10 -9 535.0>80.9 -34 -155 -10 -9 6-OH-BDE90 578.9 >79.0* 13.36 -40 -165 -10 -29 578.9> 80.9 -40 -160 -10 -29 2-0H-BDE123 578.9>79.0 13.36 -40 -165 -10 -29 578.9>80.9 -40 -160 -10 -29 6-OH-BDE137 658.9>80.9 15.29 -48 -195 -10 -17 658.9 >79.0 -48 -190 -10 -17 TBBPA 542.9>79.0* 8.34 -52 -150 -10 -29 542.9>80.9 -52 -135 -10 -29 a-HBCD 640.9>80.9* 13.79 -58 -140 -10 -15 640.9>79.0 -58 -125 -10 -15 B-HBCD 640.9>81.0* 14.42 -58 -140 -10 -15 640.9>79.1 -58 -125 -10 -15 Y-HBCD 640.9>80.9* 16.29 -58 -140 -10 -15 640.9>79.0 -58 -125 -10 -15 *定量离子(Quantitative ion)。 2.2.3 流程空白的测定 为对实验过程进行质量控制,每批样品(15个)均带一个流程空白样品,用1 mL正己烷替代样品,后续操作按照2.2.1处理进行提取净化,供 GC-NCI/MS 及 LC-MS/MS分析。 3 结果与讨论 3.1 凝胶渗透色谱净化 采用乙酸乙酯-环己烷(1:1,V/V)为流动相,流速为4.7 mL/min,将一定浓度的 PBDEs(2 pg/L)、MeO-PBDEs(2 ug/L)及 OH-PBDEs (0.2 ug/L)、TPBBA(2pg/L)和 HBCD(2ug/L)的混合标准溶液通过凝胶渗透色谱系统,以紫外检测器确定各组分的采集时间。混合标准溶液的紫外吸收图中 PBDEs 及 MeO-PBDEs 的出峰时间为23~29 min,而 OH-PBDEs、TPBBA 和 HBCD 出峰时间为16~30 min。图1为蛋白和蛋黄加标后的 ASE-GPC 紫外色谱图,蛋白萃取液中大分子类杂质浓度较低,蛋黄萃取液中大分子类杂质明显,流出时间约在8~15 min,目标物的流出时间在18~30 min之间。此外,本研究设置了不同的收集时间段的馏分,用回收率评价,在保证更好地去除脂肪的前提下,进一步确定目标化合物的最佳收集时间。实验表明,21~30 min 采集时间内,TBBPA和 α-HBCD 的平均回收率仅为26.3%和43.0%;20~30 min 采集时间内, TBBPA的平均回收率仅为 57.7%;18~30 min 目标物质的平均回收率均在90.4%~114.5%,满足检测需要。故选择18~30 min 作为样品 GPC 净化过程中 PBDEs 及其衍生物、TPBBA 和HBCD 的收集时间段。 图1 蛋白(A)蛋黄(B)加标后 ASE-GPC 紫外色谱图 Fig.1 Ultraviolet chromatogram of spiking object standards in egg white (A) or egg yolk (B) after acceleratedsolvent extraction (ASE) combined with gel permeation chromatography(GPC) 3.2 分散固相萃取吸附剂的选择 本实验选择 PSA、GCB、C和弗罗里硅土分散固相萃取吸附剂,比较了它们对目标物净化回收效果的影响。以50 mg GCB 为分散固相萃取吸附剂时,发现其对目标物有较强的吸附作用,回收率仅为6.6%~85.8%,这是由于 GCB 对平面分子具有极强的亲和力,而目标物分子含有平面苯环被部分吸附,从而导致回收率较低。PSA 主要是通过离子交换作用除去样品中的金属离子、部分脂肪酸和糖,以50 mg PSA 为分散固相萃取吸附剂时,目标物 PBDEs、MeO-PBDEs 及 HBCD 的平均回收率为 94.0%~128.3%,但对 OH-PBDEs 及 TBBPA 有较大吸附,3-OH-BDE47, 5-0H-BDE47, 6-0H-BDE47, 4'-OH-BDE49,2'-OH-6'-Cl-BDE68, 6-OH-BDE90, 2-OH-BDE123, 6-OH-BDE137 及 TBBPA的回收率均低于10%。以50 mg 弗罗里硅土为分散固相萃取吸附剂时,目标物 PBDEs, MeO-PBDEs 及 HBCD 的平均回收率为78.1%~116.8%,但对四溴羟基代谢物及 TBBPA 有很大程度的保留,3-OH-BDE47,5-OH-BDE47, 6-0H-BDE47, 4'-OH-BDE49 及 TBBPA 的回收率均小于60%。而以 50 mg C s为分散固相萃取吸附剂时,所有目标物的回收率在 85.9%~120.2%之间,满足分析需要。本实验中选择100 mg Cig 作为分散固相萃取吸附剂。 3.3 方法的线性范围与检出限 取不含目标分析物的空白蛋白蛋黄样品,按照前处理步骤处理,用空白样品提取液配制0.1,0.2,0.5,1.0,2.0,5.0和10.0 pg/kg 的标准工作液,以定量离子的峰面积对浓度进行回归分析绘制标准曲线,结果表明,目标物在0.1~10 ug/kg浓度范围内线性关系良好,相关系数(r)大于0.99。以10倍信噪比计算定量限(LOQ),目标物的定量限为0.01~0.2 pg/kg 3.4 方法的回收率和精密度 采用蛋白和蛋黄空白样品,进行添加回收和精密度实验。空白样品添加不同浓度的标准溶液,按本实验方法进行处理,用 GC-NCI/MS 和 HPLC-MS/MS进样测定,外标法定量。蛋白和蛋黄样品的平均回收率(每个添加浓度平行测定3次)分别为64.5%~97.2%和65.6%~109.2%(除 BDE85 为54.8%,OH-BDE-137 为47.4%外),相对标准偏差小于20.2%,结果见表2。蛋黄加标色谱图见图2。 3.5 基质效应 用乙腈配制了0.1,0.2,0.5,1.0,2.0,5.0和10.0 pg/L的系列混合标准溶液,同时称取空白蛋白和蛋黄,按照前处理步骤提取净化,并对空白样品进行分析,确定其不含痕量目标物后,再用空白样品液稀释系列同溶剂标样浓度的基质标样,分别以标样浓度为横坐标、峰面积为纵坐标进行线性回归。基质标样和溶剂标样的斜率列于表2。溶剂和基质标样曲线线性良好,相关系数均大于0.99。基质与溶剂标准曲线斜率的比值可反映基质效应的强弱。对同一物质,蛋白和蛋黄中基质效应有所不同,如TBBPA在蛋白基质中呈现微弱的基质增强效应,而在蛋黄基质中却呈现明显抑制效应。 表2蛋白和蛋黄中30种目标物的平均回收率和相对标准偏差(n=3) Table 2 Average recoveries, relative standard deviation of 30 analytes in egg white and egg yolk(n=3) 序号 添加水平 蛋白 Egg white 蛋黄 Egg yolk 分析物 Spiked 回收率 基质效应 回收率 基质效应 No. Analytes levels (ug/kg) Recoveries (%) RSD (%) Matrix effects Recoveries (%) RSD (%) Matrix effects 1 BDE-17 5.0 87.2 1.6 1.0 72.9 7.4 1.0 2 BDE-28 5.0 85.6 2.9 1.0 74.5 7.8 1.0 3 BDE-71 5.0 87.3 6.7 1.3 81.2 5.2 1.2 4 BDE-47 5.0 89.2 3.7 1.1 75.1 1.2 1.1 5 BDE-66 5.0 86.6 0.6 1.0 75.3 5.6 1.0 6 BDE-100 5.0 80.0 3.1 1.7 83.1 2.5 1.1 7 BDE-99 5.0 83.6 1.1 1.1 77.9 3.8 1.0 8 BDE-85 5.0 64.5 3.4 0.9 54.8 5.3 0.9 9 BDE-154 5.0 90.9 1.6 0.9 76.6 2.3 0.8 10 BDE-153 5.0 89.6 1.9 0.9 77.1 8.6 0.8 11 BDE-138 5.0 71.7 2.7 0.9 65.6 5.1 1.0 12 BDE-183 5.0 85.3 6.2 0.6 69.6 15.9 0.7 13 MeO-28 5.0 86.6 2.8 1.0 77.1 4.3 1.0 14 MeO-68 5.0 92.4 3.3 1.1 82.2 4.6 1.0 15 MeO-47 5.0 90.1 2.0 1.4 81.4 1.4 0.8 16 MeO-85 5.0 87.6 2.9 0.9 73.9 8.3 0.9 17 MeO-137 5.0 80.2 5.2 0.7 68.3 10.2 0.8 18 2'-OH-6'-Cl-BDE7 1.0 90.9 11.3 2.3 78.0 4.6 1.6 19 3-OH-BDE47 1.0 80.4 2.6 1.7 105.6 5.3 0.3 20 5-OH-BDE47 1.0 86.9 7.7 1.7 65.7 8.4 0.5 21 6-OH-BDE47 1.0 83.7 3.9 1.5 61.3 17.9 0.7 22 4'-OH-BDE49 1.0 88.7 6.0 1.6 72.3 5.6 0.9 23 2'-OH-6'-Cl-BDE68 1.0 89.3 11.1 1.3 71.2 4.5 0.7 24 6-OH-BDE90 1.0 86.0 9.8 1.1 89.0 5.9 0.8 25 2-OH-BDE123 1.0 86.0 9.8 1.1 89.0 5.9 0.8 26 6-0H-BDE137 1.0 68.0 20.2 3.6 实际样品分析 本研究测定了采自北京批发农贸市场、大型超市及农村等91个批次鸡蛋样品。PBDEs 在蛋白和蛋黄中的检出率分别为4.48%和10.45%, ZPBDEs 浓度水平分别为 0.40~1.86 ug/kg 和0.42~33.57 ug/kg; MeO-PBDEs 在蛋白和蛋黄中的检出率分别为1.49%和4.48%, ZMeO-PBDEs 浓度水平分别为0.46 ug/kg和0.46~13.57 pg/kg,其中 PBDEs 和 MeO-PBDEs在蛋黄中的检出种类及浓度大于蛋白。TBBPA 在蛋白和蛋黄中的检出率分别为50.55%和25.70%,浓度水平分别为0.02~1.27ug/kg和0.08~0.68 pg/kg。 a-HBCD, B-HBCD 和 y-HBCD 在蛋白中的检出率分别为23.08%,5.49%和89.01%,浓度水平分别为0~4.44 pg/kg,0.24~1.61 pg/kg和0.10~32.28 pg/kg;在蛋黄中的检出率分别为96.70%,18.68%和87.91%,含量分别为0.10~360.40 pg/kg, 0.22~4.16 ug/kg和0.20~71.20 pg/kg。而样品中未检出 OH-PBDEs。图3为典型蛋黄样品中目标物的色谱图。 22 图2 30 种 BFRs 的蛋黄加标总离子流色谱图(添加浓度为1pg/kg) (A. PBDEs 和 MeO-PBDEs;B. OH-PB-DEs, TBBPA 和 HBCD) Fig. 2 Total ion chromatograms of 1 ug/kg 30 BFRs in egg yolk (A. PBDEs and MeO-PBDEs; B. OH-PBDEs,TBBPA and HBCD) 峰号同表2(The peak numbers are the same as in Table 2)。 图3 典型蛋黄样品中目标物的色谱图(A.PBDEs 和 MeO-PBDEs;B. OH-PBDEs, TBBPA 和 HBCD) Fig.3 Chromatograms of objects in typical egg yolk sample (A. PBDEs and MeO-PBDEs; B. OH-PBDEs, TBB-PA and HBCD) 峰号同表2(The peak numbers are the same as in Table 2)。 References ( Erratico C A, Szeitz A, Bandiera S M. J. Chromatogr. B, 2010,878(19):1562-1568 ) 2Sun JT, Liu JY, Liu Y W, Jiang G B. Chemosphere, 2013, 92(3):322-328 ( 3 Qiu X, M ercado-Fe l iciano M , B igsby R M, H i tes R A . Environ. Health Perspect. , 2007, 115(7) : 105 2 -1058 ) ( 4 van Boxtel A L, Kamstra J H, Cenijn P H, P ieterse B, Wagner J M, A ntink M, K rab K, van der Burg B, M a rsh G , Brouwer A , L egler J. Environ. Sci . Technol., 2008, 4 2(5): 1 7 7 3-177 9 ) ( 5 Song R , D uarte T L , A l meida G M , Fa r mer P B , Cooke M S , Z h ang W, Shen g G, Fu J, J ones G D. T o xi c ol. Lett.,2009, 1 85(1):23-31 ) ( 6 Wang H S, C hen Z J, Ho K L , G e L C, D u J , G iesy J P, Wong M H, Wong C K. E n iron. I n t., 2012,4 7 :66-72 ) ( 7 H l ousková V , L a n ková D, Ka l achová K, Hra d ková P, Hajs l ová J, P u lk r abová J. Sci. Total. Env i r on., 2014, 461-470: 470-471 ) ( 8 L i n Y, Qiu X H, Zhao Y F , M a J, Yang Q Y, Zhu T. E nv i ron. Sci . Te c hnol., 2013, 47:1276 1 -12767 ) ( 9 Chan J K, Man Y B , W u S C, Wong M H. Sci. Total Environ., 2013, 463-464: 1 138-1146 ) ( 10 Labunska I, H arrad S, Santillo D, Johnston P, Yun L. E n wiron. Sci. T e chnol., 2 013, 47: 9258-9266 ) ( 1 1 Zheng X B, Wu JP , L u o X J , Zeng Y H, She Y Z, Mai B X. E n viron. I nt., 2012, 4 5:122-128 ) ( 12 Qin X F , Qin Z F, L i Y , Zhao Y X , Xia X J, Y a n S S , Ti a n M, Zh a o X R, X u X B, Yang Y J. J Enwi r on Sci-ch i na,2011,23(1): 1 33-138 ) ( 13 Covaci A, Roosens L , D irtu A C , Waegeneers N, O v ermeire I V , Neels H , Goeyens L. Sci. T ot al Environ., 2008,407(15): 4 387-4396 ) ( 14 Hu X , H u D, Song Q, L iJ , Wang P. Chemosphere, 2011, 82 (5):698-707 ) ( 15 HE Song-Jie, LI Ming-Yuan, J IN J un, W ANG Yi n g, HE Cha n g, BU Yun- J ie, TIAN Yang . Chinese J. Anal. Chem . , 2012, 40(10): 1 519-1523 ) ( 何松洁,李明圆,金军,王英,何畅,卜云洁,田旸.分析化学,2012,40(10):1519-1523 ) ( 16 Sjodin A, Wong LY, Jones R S, Park A, Zhang Y, Hodge C, Dip i etro E, M cC l ure C, Turner W, Need h am L L, Patte r - son D G Jr. Environ . Sci . Technol.,2008, 4 2(4): 1 3 77-1384 ) ( 17 Lankova D, L acina O, Pulkrabova J, Hajslova J . Talanta, 2013,117:318-325 ) ( 18 Rayne S, Ikonomou M G, A ntcliffe B. Enviro n . Sci. Tech n o.,2003,37:2847-2854 ) ( 19 Ni K, Lu Y, Wang T, K annan K, Xu L, Li O, W ang L, Liu S. Int. J . Hyg. Enviro n . Health, 2013,216(6) : 607-623 ) Determination of Polybrominated Diphenyl Ethers and Derivatives,Tetrabromobisphenol A, Hexabromocyclododecane in Egg Samples byGel Permeation Chromatography and Dispersive Solid Phase Extraction LI Min-Jie, JIN Fen", YANG Li-Li, WU Ri-Na, SHAO Hua, JIN Mao-Jun, WANG Jing (Key Lab of Agro-product Quality and Safety of Ministry of Agriculture, Institute of Quality Standards &Testing Technology for Agro-products, Chinese Academy of Agricultural Sciences, Beijing 100081, China) Abstract A stimulate method for determination of polybrominated diphenyl ethers (PBDEs) and derivatives(OH-PBDEs and MeO-PBDEs), tetrabromobisphenol A (TBBPA), hexabromocyclododecane (HBCD) inegg samples was developed by gel permeation chromatography (GPC) and dispersive solid phase extraction(DSPE) combined with liquid chromatography tandem mass spectrometric (HPLC-MS/MS) and gas chroma-tography-negative chemical ionization mass spectrometry (GC-NCI/MS). The analytes were extracted withmixture of hexane and dichloromethane (1:1, V/V) by accelerated solvent extraction (ASE), and purified by100 mg Cig dispersive solid phase extraction (SPE) sorbents followed with gel permeation chromatography(GPC), and then analyzed by liquid chromatography tandem mass spectrometric (HPLC-MS/MS) and gaschromatography-negative chemical ionization mass spectrometry (GC-NCI/MS), respectively. The quantita-tion was carried out external standard method. The recoveries of objects were 64.5%-97.2% and 65.6%-109.2% (except BDE85 was 54.8%, OH-BDE-137 was 47.4%) spiked at 1.0 pg/kg or 5.0 pug/kg in eggwhite and egg yolk, respectively. The relative standard deviations (RSDs) were less than 20.2%. The limitsof quantitation (LOQ) for the object were 0.01-0.2 ug/kg. Keywords Polybrominated diphenyl ethers and derivatives; Tetrabromobisphenol A; Hexabromocyclodode-cane; Egg; Gel permeation chromatography; Dispersive solid phase extraction (Received 11 March 2014; accepted 14 May 2014) 凝胶渗透色谱-分散固相萃取法同时测定鸡蛋中多溴联苯醚及其衍生物、 四溴双酚A和六溴环十二烷作者: 李敏洁,金芬,杨莉莉, 乌日娜,邵华,,金茂俊, 王静,LI Min-Jie,JJIN Fen, YANG Li-Li,WU Ri-Na,SHAO Hua, JIN Mao-Jun,WANG Jing作者单位: 农业部农产品质量安全重点实验室,中国农业科学院农业质量标准与检测技术研究所,北京100081刊名:分析化学ISTICISCIlPKU英文刊名: Chines:e Journal of Analytical Chemistry年,卷(期): 2014(9) 参考文献(19条) 1.Erratico C A;Szeitz A;Bandiera S M 查看详情 2010(19) 2. Sun J T;Liu JY;Liu Y W;Jiang G B 查看详情 2013(03) 3.Qiu X;Mercado-Feliciano M;Bigsby R M;Hites R A 查看情2007(07) 4. van Boxtel A L;Kamstra J H;Cenijn P H;Pieterse B Wagner J M Antink M Krab K van der Burg B Marsh G Brouwer A Legler J查看详情2008(05) 5. Song R;Duarte T L;Almeida G M;Farmer P B Cooke M S Zhang W Sheng G Fu J Jones G D 查看详情 2009(01) 6. Wang H S;Chen Z J;Ho K L;Ge L C Du J Giesy J P Wong M HWong CK 查看详情2012 7.Hlou?kova V;Lanková D;Kalachová K;Hradkova P Haj?lova J Pulkrabova J 查看详情 2014 8.Lin Y;Qiu X H;Zhao Y F;Ma J Yang Q Y Zhu T 查羊详情2013 9. Chan J K;Man Y B;Wu S C;Wong MH查看详情2013 10.Labunska I;Harrad S;Santillo D;Johnston P YunL 查看详情2013 11. Zheng X B;Wu J P;Luo X J;Zeng Y H SheYZMaiBX查看详情 2012 12. Qin X F;Qin Z F;Li Y;Zhao Y X Xia X J Yan S S Tian M Zhao X R Xu X B Yang Y J查看详情 2011(01) 13.Covaci A;Roosens L;Dirtu A C;Waegeneers N OvermeireIIV Neels H GoeyenssLL 查看详情2008(15) 14. Hu X;Hu D;Song Q;Li J Wang P 查看详情2011(05) 15.何松洁;李明圆;金军;王英何畅ir卜云洁田旸查看详情2012(10) 16.Sj?din A;Wong L Y;Jones R S;Park A Zhang Y Hodge C Dipietro E McClure C Turner W Needham L L Patter-son D G Jr 查看详情2008(04) 17. Lankova D;Lacina O;Pulkrabova J;Hajslova J 查看详情 2013 18.Rayne S;Ikonomou M G;Antcliffe B 查看详情2003 19.Ni K;Lu Y;Wang T;Kannan K Xu L Li Q Wang L Liu S 查看详情2013(06) 引用本文格式:李敏洁.金芬.杨莉莉.乌日娜.邵华.金茂俊.王静. LI Min-Jie. JIN Fen. YANG Li-Li.WU Ri-Na.SHAO Hua. JIN Mao-Jun.WANG Jing 凝胶渗透色谱-分散固相萃取法同时测定鸡蛋中多溴联苯醚及其衍生物、四溴双酚A和六溴环十二烷[期刊论文]-分析化学2014(9)
确定




还剩6页未读,是否继续阅读?
北京普立泰科仪器有限公司为您提供《豆制品及蛋制品中环境污染物检测方案 》,该方案主要用于蛋制品中环境污染物检测,参考标准--,《豆制品及蛋制品中环境污染物检测方案 》用到的仪器有J2 样品前处理平台
推荐专场
该厂商其他方案
更多















