方案详情
文
本研究中将使用结合TransOmics信息学软件的沃特世组学研究平台和采用离子淌度Tof MS (SYNAPT G2-S HDMS)的HILIC-UPLC分离可实现复杂生物混合物的多维分离,改善脂质分析中获取的信息。HDMS对照软件和TransOmics信息学软件可帮助实现生物样品之间的比较。
方案详情

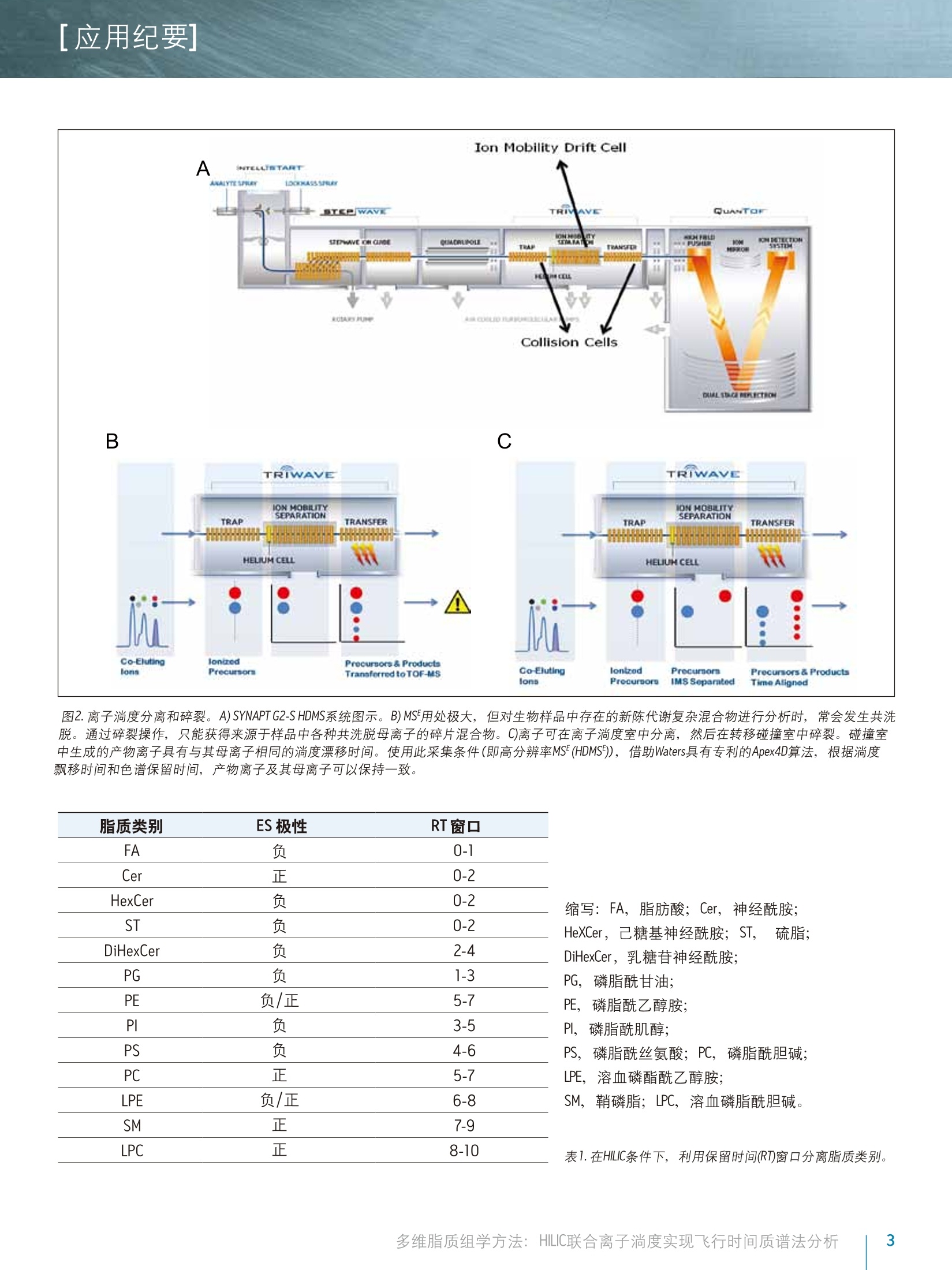
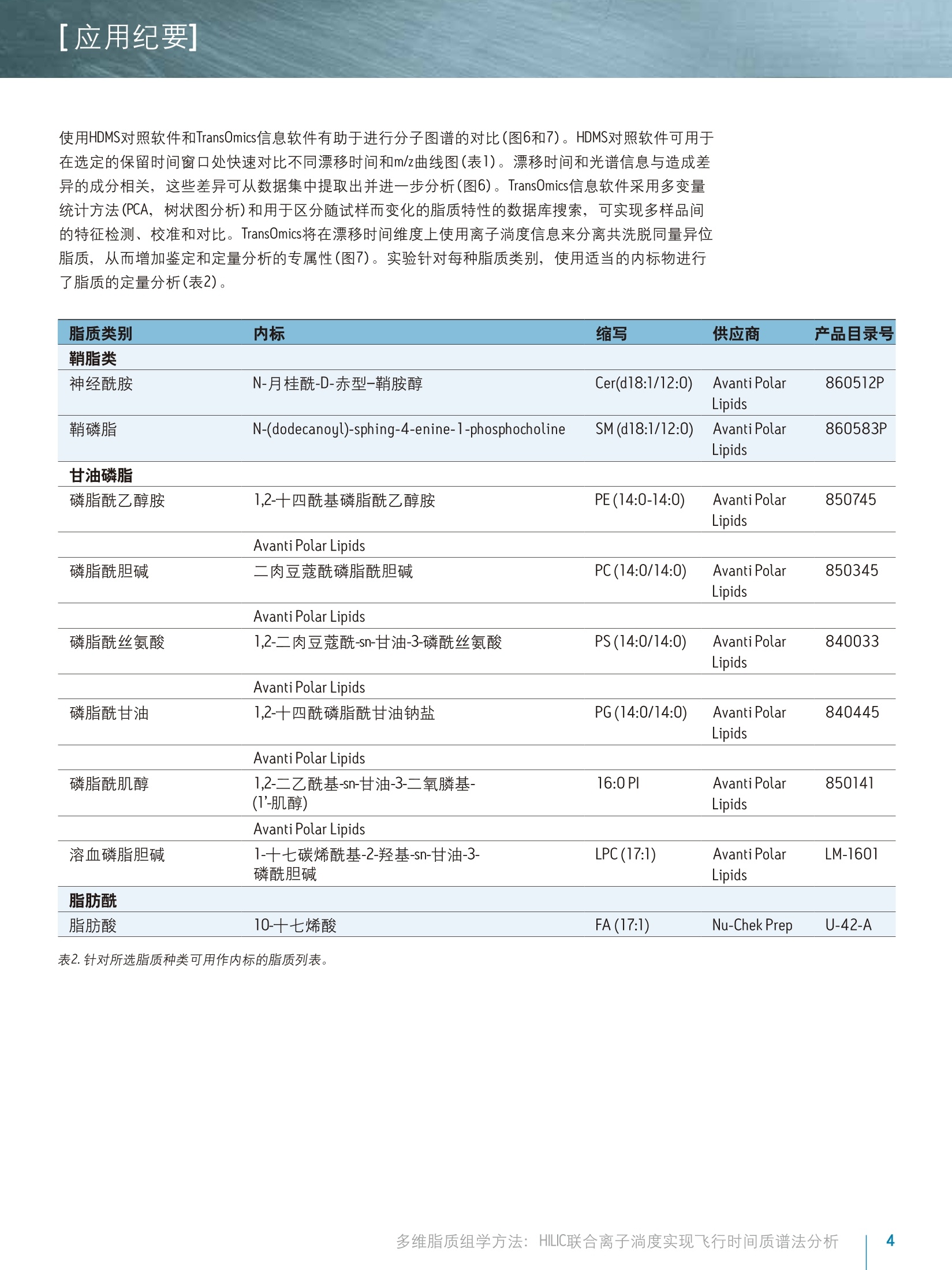
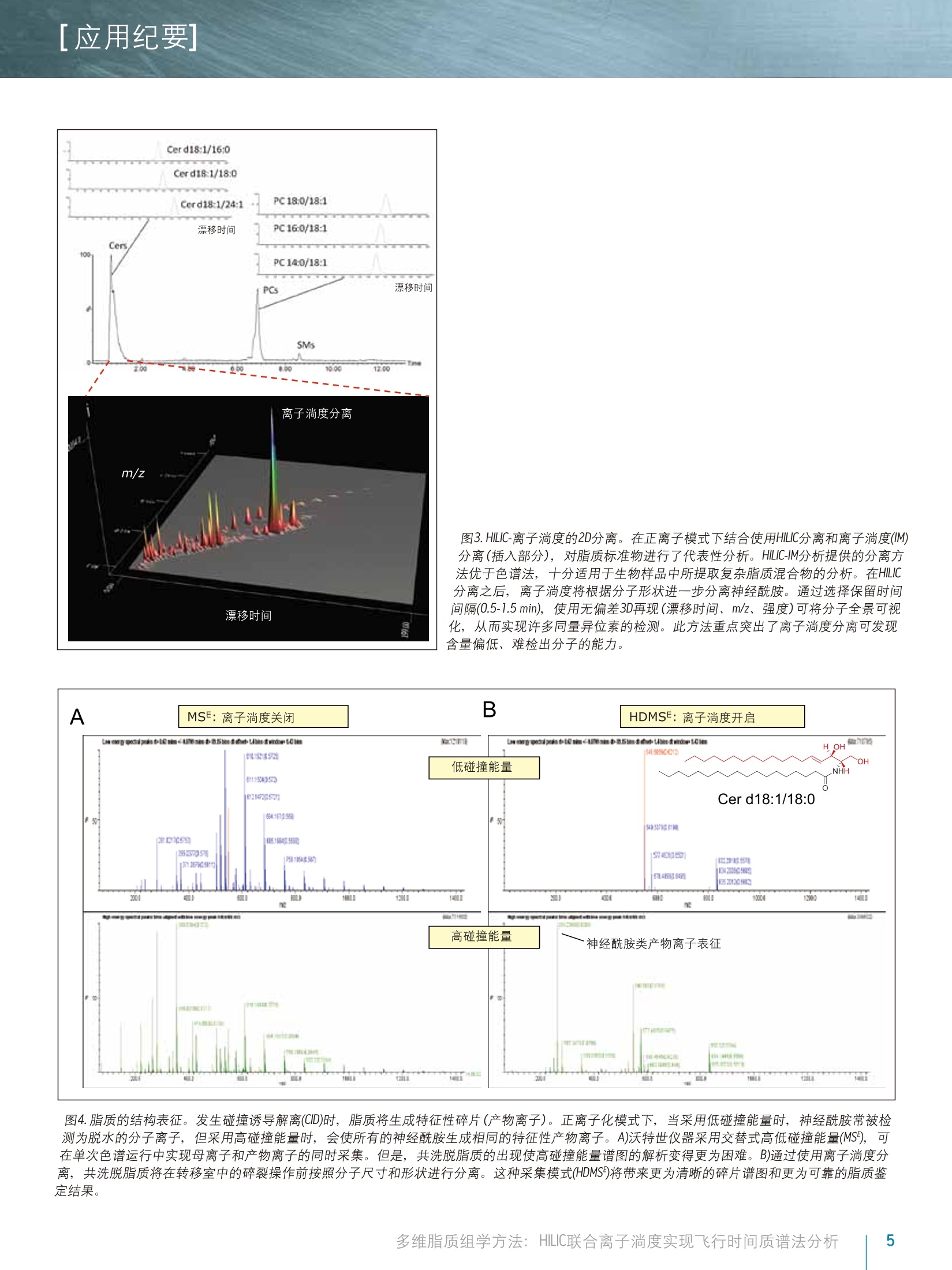
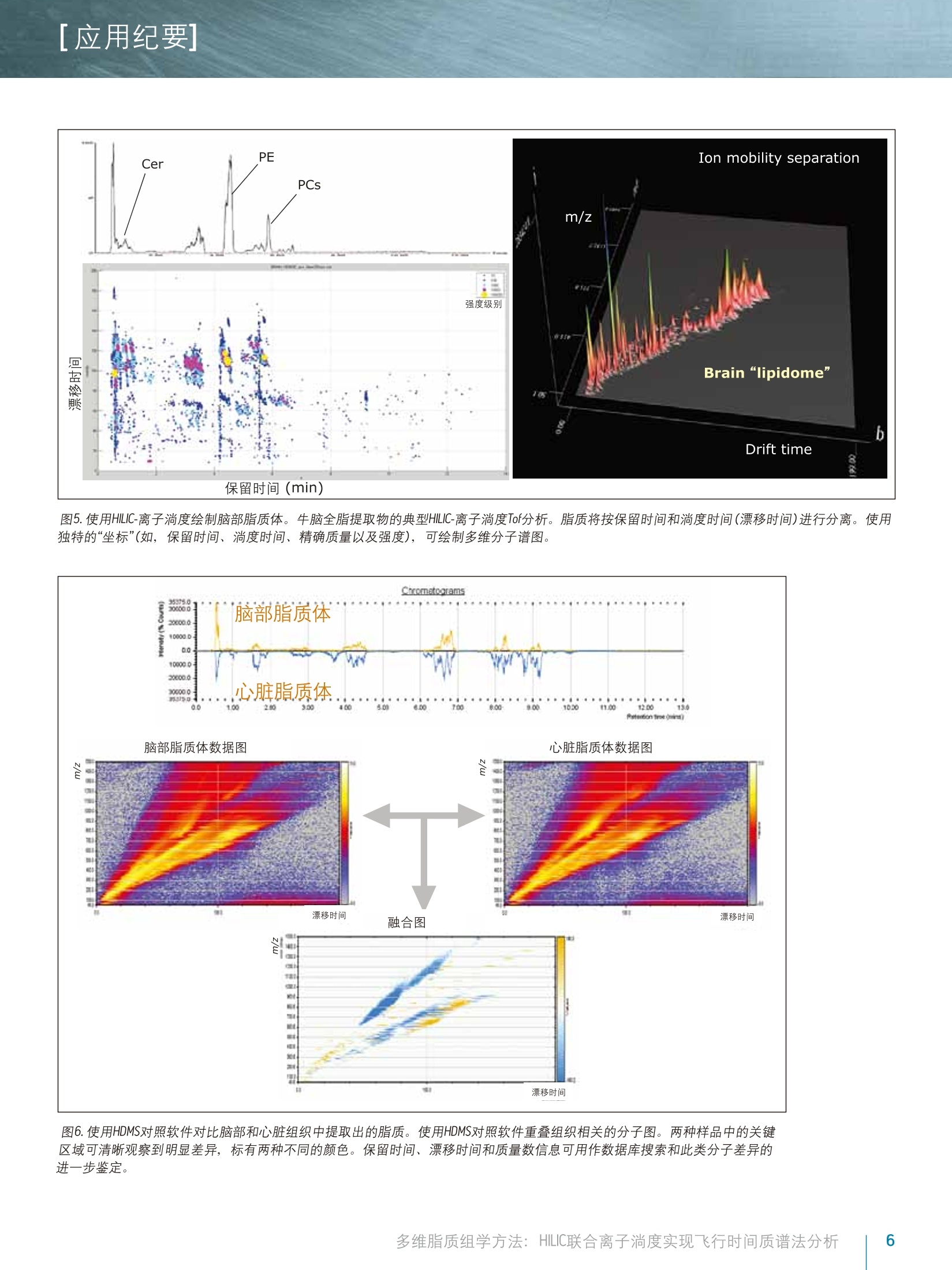
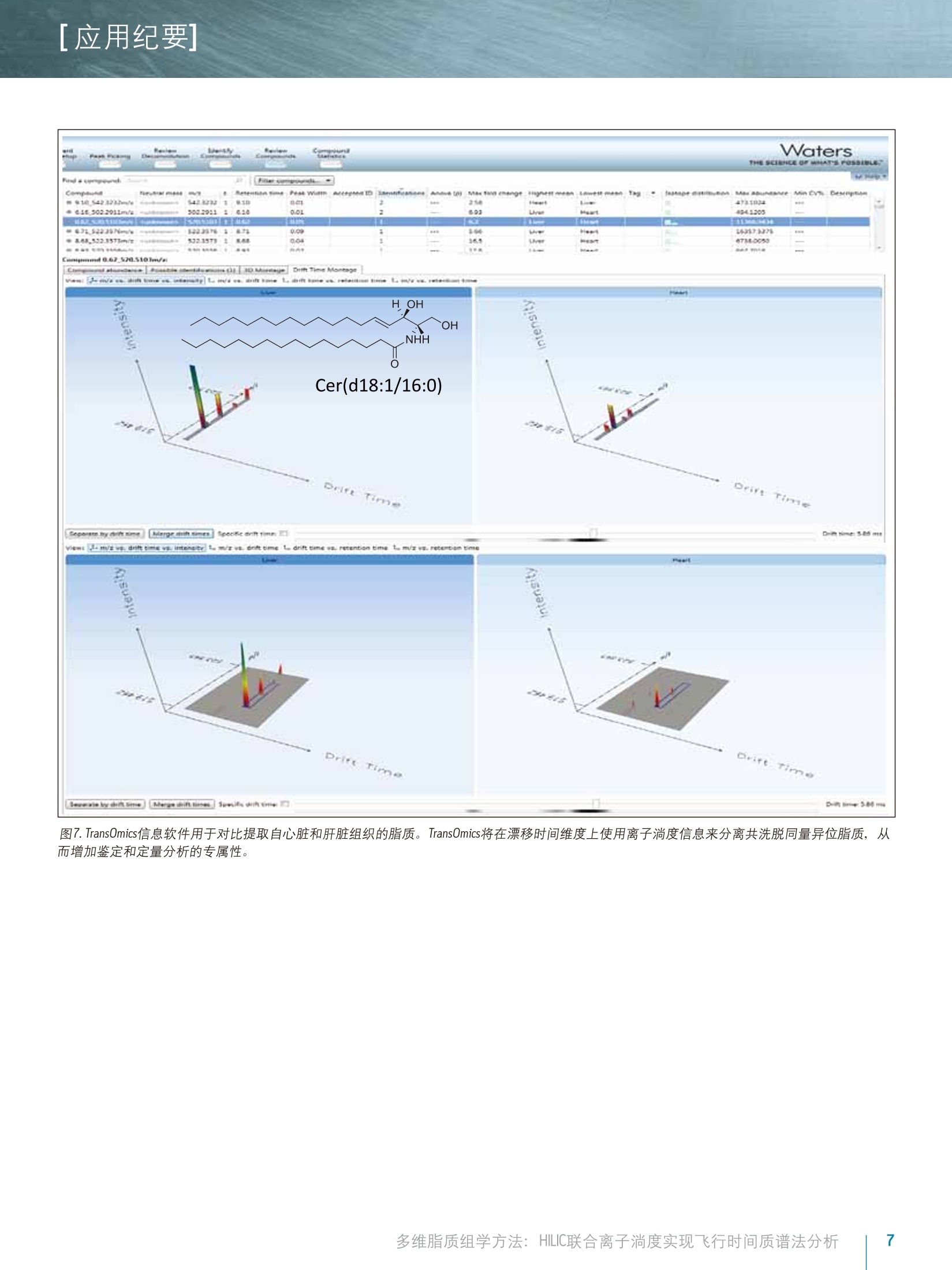
[应用纪要]THE SCIENCE OF WHAT'S POSSIBLE. [应用纪要] Waters 多维脂质组学方法:HILIC联合离子淌度实现飞行时间质谱法分析 Giuseppe Astarita, Jeremy Netto, Giorgis Isaac, Marc V. Gorenstein, Mark Ritchie, James Langridge 1沃特世公司(美国马萨诸塞州米尔福德市) ?沃特世亚太公司,新加坡 3沃特世公司(英国曼彻斯特) 应用优势 联合HILIC-UPLC@液相分离和气相离子淌度质谱法,可实现复杂混合物中脂质的多维表征,从而增强针对生物样品中脂质的分析性能。 沃特世解决方案 结合TransOmicsM信息学软件的组学研究平台ACQUITY UPLC系统 SYNAPT G2-S HDMSTM 关键词 脂质,脂质体,代谢组学,脂类组学,离子淌度光谱法,亲水作用色谱法(HILIC), HDMS对照, T-Wave"技术 综合脂质分析(脂质组学)的一个主要难题是生物样品中多类脂质的分离(图1)。使用单维色谱(例如反相或正相分离法)无法完成此种分离15。正相UPLC基于脂质类的极性头部基团实现分离,而反相UPLC则根据酰基链长度和双键的数量分离脂质1-6。亲水作用色谱法(HILIC)分离作为正相分离的替代方法,提供了更优质的MS兼容性,且使用的溶剂毒性更小4-6。最近,研究人员已提出一种使用HILIC和反向UPLC的二维分离法,在MS检测前最大程度实现脂质体的分离5.6。 除色谱法以外,离子淌度法也可根据尺寸和分子形状分离气相中的脂质离子78。本研究中将使用结合TransOmics信息学软件的沃特世(Waters@)组学研究平台和采用离子淌度Tof MS (SYNAPT G2-S HDMS)的HILIC-UPLC分离可实现复杂生物混合物的多维分离,改善脂质分析中获取的信息。HDMS对照软件和TransOmics信息学软件可帮助实现生物样品之间的比较。 图1.脂质的多样性。根据常见的结构基团(红色标出)对脂质进行分类,这些基团在HILIC中将表现出不同的色谱行为。 实验 样品描述 从牛脑、牛心和牛肝中提取的脂质标准品和总脂质均购自Avanti Polar Lipids公司。将非天然脂质加标入生物提取物中作为内标物(表2)。 UPLC条件 系统: ACQUITY UPLC 色谱柱: ACQUITY UPLC BEH HILIC2.1x100 mm 柱温: 30℃ 13.00 20.0 80.013.01 99.9016.00 99.9 流速: 0.5 mL/min 进样体积: 5pl MS条件 采用SYNAPT G2-S HDMS(图2)进行MS分析, 配置使用LC/HDMS模式的常规ESI源。分别优化毛细管电压为正(2.8kV)和负(1.9kV)离子模式。全程双通道采集数据,即低碰撞能量(6.0V)对应分子离子,高碰撞能量(20至35V)对应产物离子。 ( IMS气体: 氮 气, I M ST-Wave波速:900m/s,IMST-Wave波高:40V。 ) 数据采集和处理 ( TransOmics信息学软件和HDMS对照软件 ) 结果与讨论 实验中使用亲水作用色谱法(HILIC)分离脂质,配置ACQUITY UPLC BEH HILIC2.1x100mm, 1.7 um色谱柱,31以及采用高有机含量流动相(>80%乙腈)的反相溶剂系统(有机溶剂/水)。此UPLC法高度兼容ESI,根据脂质的极性性质(图3和表1)对其按类别进行分离。 除HILIC色谱法外,我们还利用SYNAPT G2-S HDMS质谱的离子淌度功能(图2A-C和图3)将脂质种类的鉴别深入至组成成分,此过程基于不同的尺寸和形状,即离子碰撞截面(Q)。7,8由于脂质离子迁移经过离子淌度室(在相对高压下充满氮气)时在气相中将以独特的形状存在,因此俱有不同不饱和度以及酰基长度的脂质离子将表现出不同的特征化迁移时间(图3和图5)。离子淌度分离在毫秒级时间内完成,是介于LC和MS两者之间的理想选择,其中上游LC分离的时间单位以秒计,而下游的Tof MS工作时间单位则以纳秒计(图2A和3)。LC/MC加入离子淌度后,峰容量以及信噪比均得以改善(图3)。 为获得更详细的结构信息,我们使用LC/MS对脂质进行了分析,在单独扫描中交替使用高低碰撞能量,从而获得单次分析运行中母离子和产物离子的信息(图2B和4A)。结合LC/MSE(HDMSF)的离子淌度分离可在IMS分离后裂解离子,提高了共洗脱脂质的专属性(图2C和4B)。由于脂质体的复杂性,离子淌度漂移时间的增加作为保留时间的一个正交测量,提供了关于脂质类别的补充信息,为脂质的鉴定和数据解析增添了更多的专属性(图4B)。 通过此款创新型技术方法,可针对多种动物组织中的脂质生成多维分子图谱。在这些图谱中,每个脂质都可由分子特性“坐标”的组合进行表征,包含保留时间,漂移时间,精确质量数,碎片离子和强度(图5)。这些特征突出了离子淌度分离同量异位脂质(即,质量相同的脂质)的能力。使用多维分子图谱将分子全景可视化,也可用于检测可能被忽略的脂质(图3和5)。 图2.离子淌度分离和和裂。A)SYNAPT G2-S HDMS系统图示。B)MS用处极大,但对生物样品中存在的新陈代谢复杂混合物进行分析时,常会发生共洗脱。通过碎裂操作,只能获得来源于样品中各种共洗脱母离子的碎片混合物。C)离子可在离子淌度室中分离,然后在转移碰撞室中碎裂。碰撞室中生成的产物离子具有与其母离子相离的淌度漂移时间。使用此采集条件(即高分辨率MSF(HDMS)),借助Waters具有专利的Apex4D算法,根据淌度飘移时间和色谱保留时间,产物离子及其母离子可以保持一致。 脂质类别 ES 极性 RT窗口 FA 负 0-1 Cer 正 0-2 HexCer 负 0-2 ST 负 0-2 DiHexCer 负 2-4 PG 负 1-3 PE 负/正 5-7 PI 负 3-5 PS 负 4-6 PC 正 5-7 LPE 负/正 6-8 SM 正 7-9 LPC 正 8-10 缩写:FA,脂肪酸; Cer, 神经酰胺; HeXCer, 己糖基神经酰胺; ST, 硫脂; DiHexCer,乳糖苷神经酰胺; PG,磷脂酰甘油; PE,磷脂酰乙醇胺; PI,磷脂酰肌醇; PS,磷脂酰丝氨酸;PC,磷脂酰胆碱; LPE,溶血磷酯酰乙醇胺; SM,鞘磷脂;LPC,溶血磷脂酰胆碱。 表1.在HILIC条件下,利用保留时间(RT)窗口分离脂质类别。 使用HDMS对照软件和TransOmics信息软件有助于进行分子图谱的对比(图6和7)。HDMS对照软件可用于在选定的保留时间窗口处快速对比不同漂移时间和m/z曲线图(表1)。漂移时间和光谱信息与造成差异的成分相关,这些差异可从数据集中提取出并进一步分析(图6)。TransOmics信息软件采用多变量统计方法(PCA,树状图分析)和用于区分随试样而变化的脂质特性的数据库搜索,可实现多样品间的特征检测、校准和对比。 TransOmics将在漂移时间维度上使用离子淌度信息来分离共洗脱同量异位脂质,从而增加鉴定和定量分析的专属性(图7)。实验针对每种脂质类别,使用适当的内标物进行了脂质的定量分析(表2)。 脂质类别 内标 缩写 供应商 产品目录号 鞘脂类 神经酰胺 N-月桂酰-D-赤型-鞘胺醇 Cer(d18:1/12:0) Avanti Polar 860512P Lipids 鞘磷脂 N-(dodecanoyl)-sphing-4-enine-1-phosphocholine SM (d18:1/12:0) AvantiPolar 860583P Lipids 甘油磷脂 磷脂酰乙醇胺 1,2-十四酰基磷脂酰乙醇胺 PE(14:0-14:0) Avanti Polar 850745 Lipids Avanti Polar Lipids 磷脂酰胆碱 二肉豆蔻酰磷脂酰胆碱 PC(14:0/14:0) Avanti Polar 850345 Lipids Avanti Polar Lipids 磷脂酰丝氨酸 1,2-二肉豆蔻酰-sn-甘油-3-磷酰丝氨酸 PS (14:0/14:0) Avanti Polar 840033Lipids Avanti Polar Lipids 磷脂酰甘油 1,2-十四酰磷脂甘甘油钠盐 PG(14:0/14:0) Avanti Polar 840445 Lipids Avanti Polar Lipids 磷脂酰肌醇 1,2-二乙酰基-sn-甘油-3-二氧膦基- 16:0PI Avanti Polar 850141 (1-肌醇) Lipids Avanti Polar Lipids 溶血磷脂胆碱 1-十七碳烯酰基-2-羟基-sn-甘油-3- LPC(17:1) Avanti Polar LM-1601 磷酰胆碱 Lipids 脂肪酰 脂肪酸 10-十七烯酸 FA(17:1) Nu-Chek Prep U-42-A 表2.针对所选脂质种类可用作内标的脂质列表。 图3.HILIC-离子淌度的2D分离。在正离子模式下结合使用HILIC分离和离子淌度(IM)分离(插入部分),对脂质标准物进行了代表性分析。 HILIC-IM分析提供的分离方法优于色谱法,十分适用于生物样品中所提取复杂脂质混合物的分析。在HILIC分离之后,离子淌度将根据分子形状进一步分离神经酰胺。通过选择保留时间间隔(0.5-1.5 min), 使用无偏差3D再现(漂移时间、m/z、强度)可将分子全景可视化,从而实现许多同量异位素的检测。此方法重点突出了离子淌度分离可发现含量偏低、难检出分子的能力。 图4.脂质的结构表征。发生碰撞诱导解离(CID)时,脂质将生成特征性碎片(产物离子)。正离子化模式下,当采用低碰撞能量时,神经酰胺常被检测为脱水的分子离子,但采用高碰撞能量时,会使所有的神经酰胺生成相同的特征性产物离子。A)沃特世仪器采用交替式高低碰撞能量(MS),可在单次色谱运行中实现母离子和产物离子的同时采集。但是,共洗脱脂质的出现使高碰撞能量谱图的解析变得更为困难。B)通过使用离子淌度分离,共洗脱脂质将在转移室中的碎裂操作前按照分子尺寸和形状进行分离。这种采集模式(HDMSF)将带来更为清晰的碎片谱图和更为可靠的脂质鉴定结果。 图5.使用HILIC-离子淌度绘制脑部脂质体。牛脑全脂提取物的典型HILIC-离子淌度Tof分析。脂质将按保留时间和淌度时间(漂移时间)进行分离。使用独特的“坐标”(如,保留时间、淌度时间、精确质量以及强度),可绘制多维分子谱图。 图6.使用HDMS对照软件对比脑部和心脏组织中提取出的脂质。使用HDMS对照软件重叠组织相关的分子图。两种样品中的关键区域可清晰观察到明显差异,标有两种不同的颜色。保留时间、漂移时间和质量数信息可用作数据库搜索和此类分子差异的进一步鉴定。 图7.TransOmics信息软件用于对比提取自心脏和肝脏组织的脂质。 TransOmics将在漂移时间维度上使用离子淌度信息来分离共洗脱同量异位脂质,从而增加鉴定和定量分析的专属性。 液相色谱、离子淌度和oa-Tof质谱的联用是一种多维分离策略,可详细分析过去无法分析的复杂生物混合物,提供更多的脂质组学分析详细信息。 ( ■HILIC根据脂质的极性进行分离,可提供稳定的保留时间 坐标。 ) ( 离子淌度根据脂质的不同尺寸和分子形状实现分离,提 供Q值(漂移时间坐标)。 ) ( ■ LC/MS联合离子淌度分离(HDMS)实现了同时采集准确的母离子和碎片离子信息,可提供结构信息并改善了实验的 专属性。 ) ( ■HILIC联合LC/HDMS使用独特的坐标绘制分子图,包含保留时间、漂移时间、准确的母离子和碎片离子质量数,以及强度。 ) ( HDMS对比软件和Trans0mics信息软件提供了信息解决方案, 采用多变量统计方法,以可扩展的方式对比大量的分子图,从而为脂质鉴定和生物解析增加更多的专属性和和靠性。 ) ( 1. R ainville PD, Stumpf CL, Shockcor JP, Plumb RS, Nicholson JK.Novel Application of Reversed-Phase UPLC-0aTOF-MS for Lipid Analysis in Com p lex Biological Mixtures: A New Tool for Lipidomics. JProteome Res. 2007 Feb;6(2):552-8 . ) ( 2. Lisa M, Cifkova E, Holcapek M. Lipidomic profiling of biological tissues usingoff-line two-dimensional high-performance liquid chromatography-mass spectrometry.J Chromatogr A. 2011 Aug 5; 1218(31 ) :5146-56.Epub2011 May 30. ) ( 3 . I saac G, McDonald S, A s tarita G. L i pid Separatio n : UPLC System for t he S eparation o f C o mplex Biological Total Lipid Extracts. Waters App l ication Note 7200041 0 7en. 2 011 S ept. ) ( 4 . N etto J, Wong S, R i t chie M, Torta F, Narayanaswamy P. A Definitive LipidomicsWorkflow for Human Plasma Utilizing Off-line Enrichment and Class SpecificSeparation of Phospholipids. Waters Application Note 720004521en. 2012 Dec. ) ( 5 .1 N ie H,LiuR, Yang Y, Bai Y, Guan Y, Qian D, Wang T , Li u H. Lipid profiling of rat peritoneal surface layers by online normal- and reversed-phase 2DLC QToF-MS. JLipid Res. 2 010 Sep; 51(9):2833-44. ) ( 6. Netto J D , Wong S, Ritch ie M. High Re s olution Sep a ration of P h osp h olipids Using a Novel Orthogonal Two-Dimensional UPLC/QTof MS System Configuration. Waters Application Note 720004546en. 2013 Jan. ) ( 7 . Shvartsburg AA, Isaac G, Leveque N, Smith RD, Metz TO. Separation and classification of lipids using differential ion mobility spectrometry. J Am Soc Mass Spectrom. 2011 Jul;2 2 (7):1146-55. Epub 2011 Apr 12. Erratum in:J Am Soc Mass Spectrom. 2011 Jul;22(7):1156. ) ( 8. Kliman M, May JC, Mc L ean JA. Lip i d analysis and lipidomics by structurallyselective ion mobility-mass spectrometry. Biochim Biophys Acta. 2011 Nov; 1 811(11):935-45. ) Waters THE SCIENCE OF WHAT'S POSSIBLE. 沃特世科技(上海)有限公司 Waters, ACQUITY UPLC, SYNAPT和 The Science of What’s Possible是沃特世公司的注册商标。TransOmics, T-Wave和HDMS是沃特世公司的商标。其他所有商标均归各自的拥有者所有。 成都:028-65545999 免费售后服务热线:800(400)8202676www.waters.com 多维脂质组学方法: HILIC联合离子淌度实现飞行时间质谱法分析
确定



还剩6页未读,是否继续阅读?
沃特世科技(上海)有限公司(Waters)为您提供《多维脂质组学方法:HILIC联合离子淌度Tof质谱分析》,该方案主要用于其他中--检测,参考标准--,《多维脂质组学方法:HILIC联合离子淌度Tof质谱分析》用到的仪器有ACQUITY UPLC 超高效液相色谱
推荐专场
相关方案
更多
该厂商其他方案
更多
















