方案详情
文
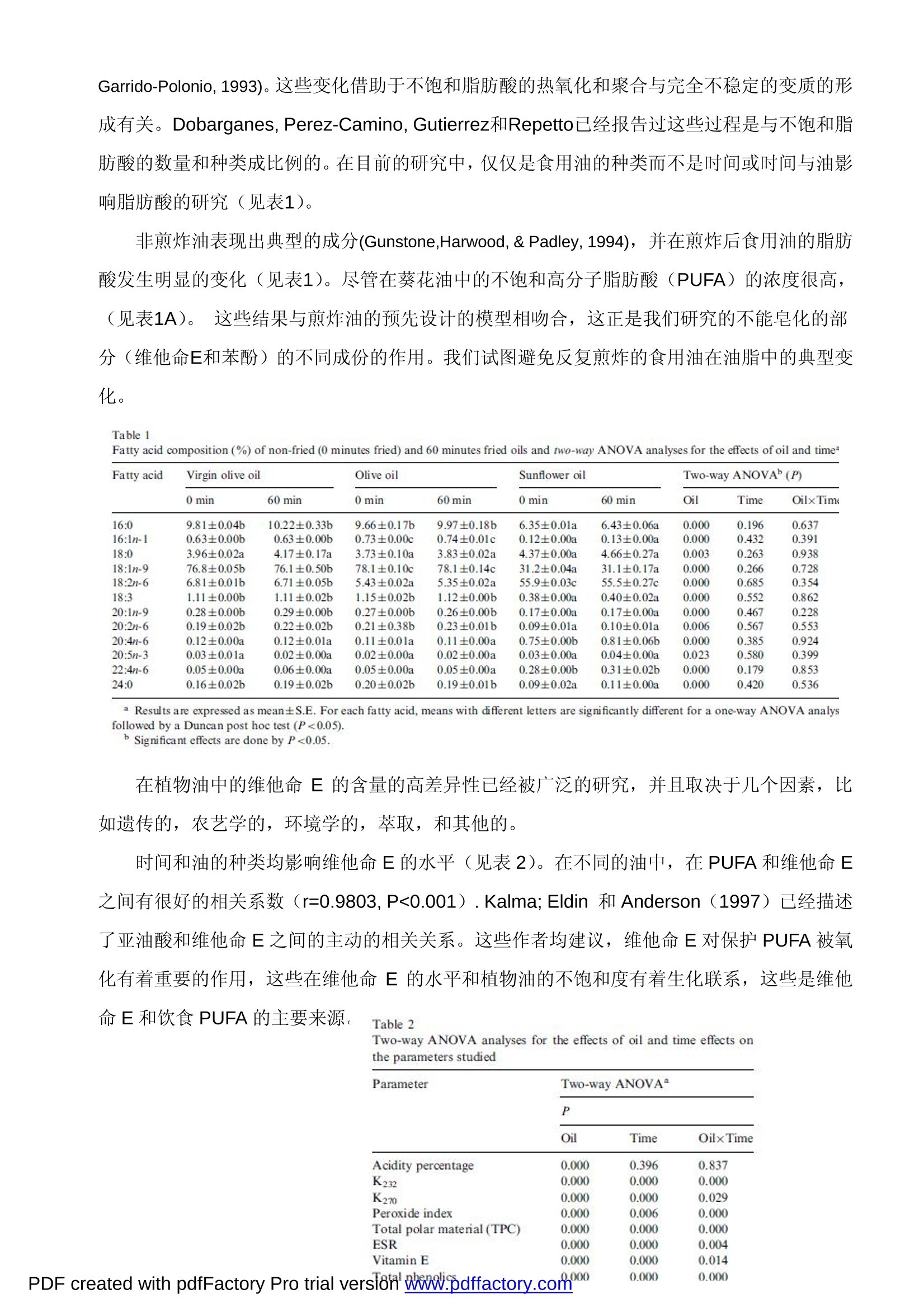
实验油为橄榄油、葵花油,对这两种油分别进行不同时间的煎炸,检测煎炸前后油中的抗氧化性及过氧化物质,并进行相互对比,得知油在不同煎炸时段,抗氧化性及过氧化物质存在变化。
地沟油是食用油通过反复煎炸后的产物,故地沟油的抗氧化性极低,并含有大量过氧化物。
MICRO-ESR电子自旋共振波谱仪正是建立在上述这个实践理论基础上,快速,便捷,准确的分析油品,并以此鉴别地沟油。
方案详情

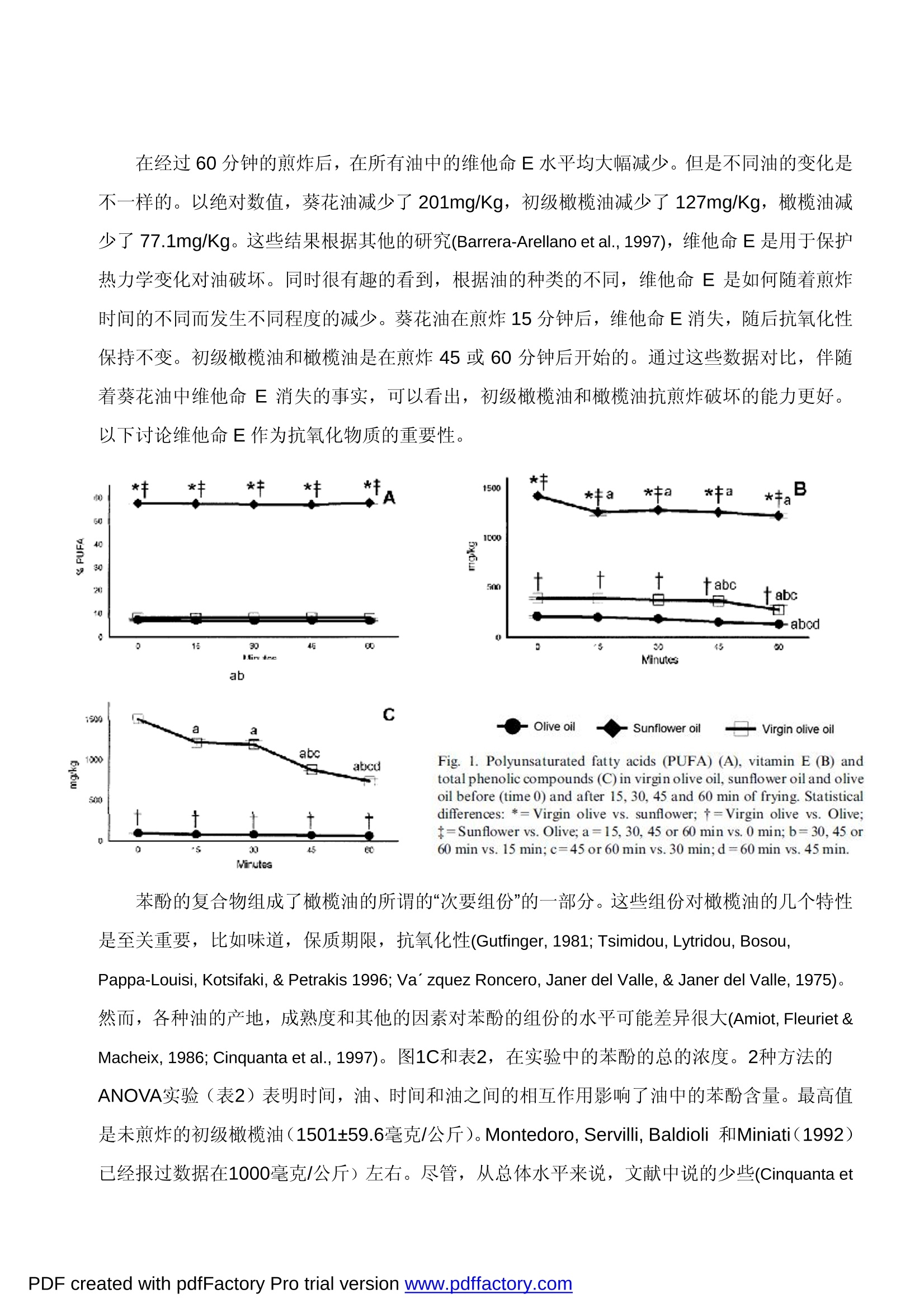
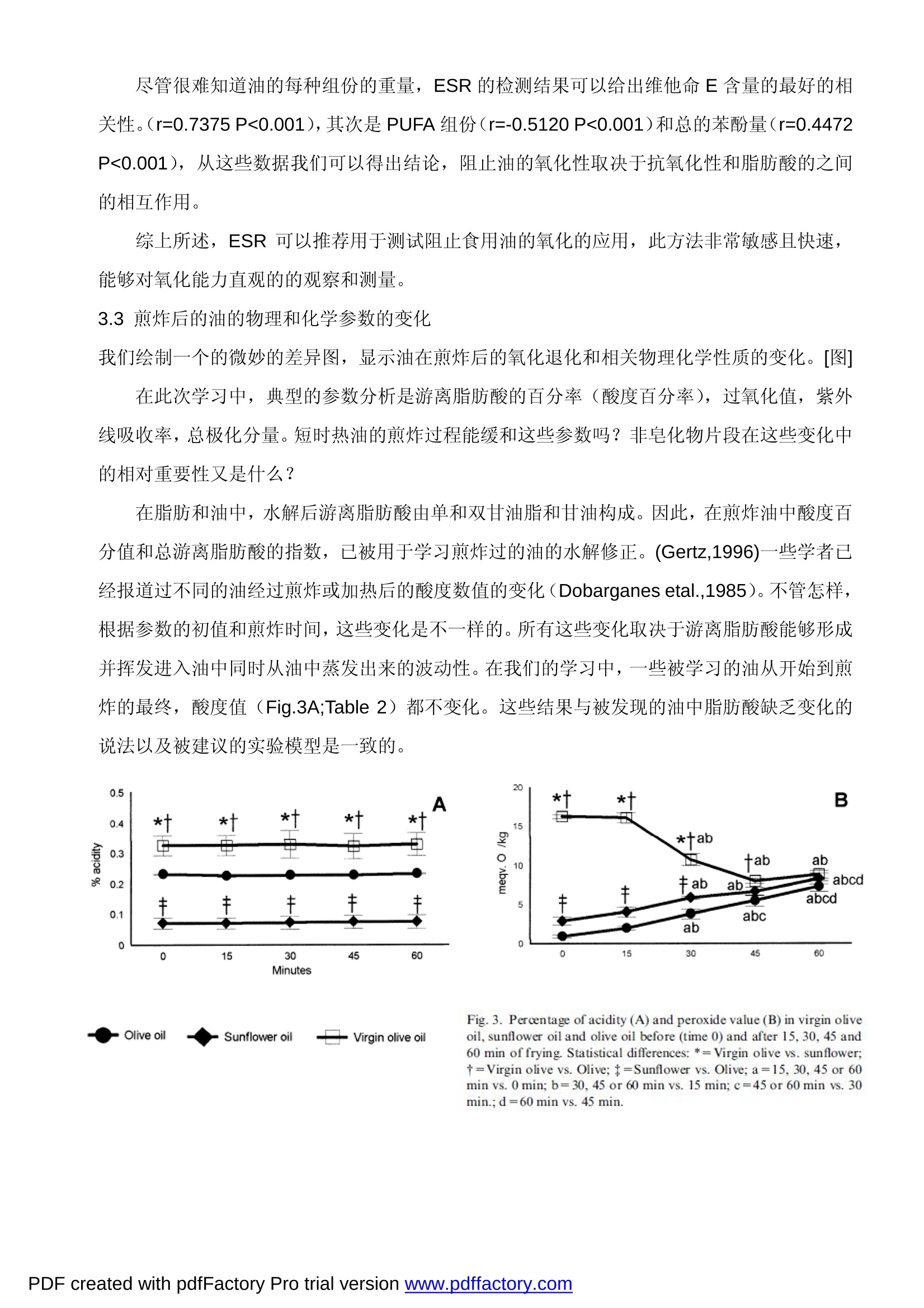
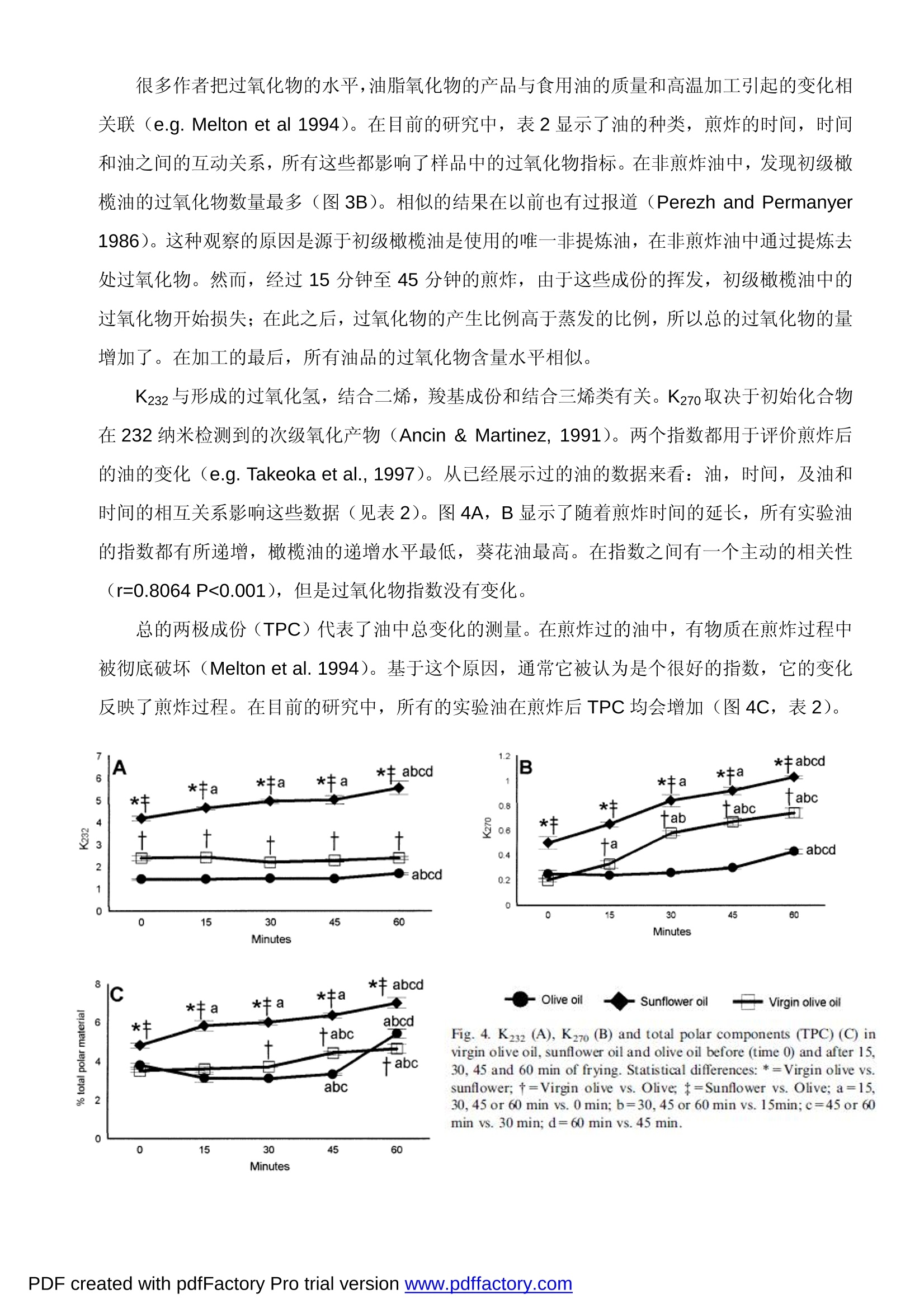
Chemists Society, 71, 877-880. Montedoro, G., Servilli, M., Baldioli, M., & Miniati,E. (1992). Simple and hydrolyzable phenolic compounds in virgin olive oil.2. Initial characterization of the hydrolyzable fraction. Journal of Agricultural and Food Chemistry, 40,1577-1580. MICRO-ESR 电子自旋共振波谱仪在地沟油检测中的应用 采用 MICRO-ESR 电子自旋共振波谱仪可测试橄榄油和葵花籽油反复煎炸后其中的苯酚和维他命E化合物的抗氧化能力的变化。 本实验采用煎炸油为实验模型,以食用油(橄榄油,葵花油)在煎炸前后的物理、化学变化作为研究对象。借助ESR 电子自旋共振波谱仪对以下几种食用油(橄榄油,葵花油)样品的进行分析:未煎炸的食用油、煎炸时间分别为15分钟,30分钟,45分钟,60分钟的食用油,通过测试橄榄油,葵花油成份中自由基的变化,能够确定橄榄油,葵花油的最高的抗氧化能力。 这个参数主要受维他命E的含量的影响,其次是油脂和苯酚的含量。所有烹饪过的食用油的抗氧化能力均会降低,葵花油在烹饪使用后的化学变化比橄榄油更多。食用油的抗氧化能力与极性的组份和紫外线指数有关联,但与过氧化物和酸值无关。MICRO-ESR 电子自旋共振波谱仪,可以快速,,灵敏的测试食用油的抗氧化能力。 1.介绍 在食品工业中,评价脂肪和食用油氧化的程度至关重要,因为检测食物腐败的主要依据是自由基变化引发的食品氧化性程度。众所周知,自由基可以直接反映出食品成份的氧化特性比如颜色,口味,香气,食品的营养价值,而这些则是食品质量控制的主要参数。 充分的自由基信息,对一些病理学的研究也很有帮助,如有的疾病对饮食中水果的摄入有严格的控制,要求多摄入富含抗氧化的维他命和酚醛树脂的水果。(Owen, Giacosa, Hull,Haubner, Spiegelhalder, & Bartsch, 2000)。 这就是研究食用油自由基变化的重要原因---用于评估食用油的化合物的组成及工艺流程如:煎炸对于食品营养的影响。 大量的研究发现,油脂经过加热和煎炸后测试与原先的分析数据相比有差异(Che Man &Jaswir,2000;Gertz, 1996;Takeoka, Fuli, &Dao,1997)。对油脂的营养成份产生影响的因素有:加热的温度、加热的次数、油脂的面积/体积、食物与油的比例、脂肪酸和油的抗氧化成份等(Melton, Jafar, Sykes,& Trigiano,1994)。 ESR 的测试方法对于评价煎炸对油品的影响非常有效。 所有测试中,油的化学变化均是由温度变化引起的。所有这些反应是由氧气,水份,金属的遗留,自由基引起的。这些过程可能降低了油的抗氧化能力,降低了它的稳定性,并产生了 新的物质从而降低了油的质量和营养价值。 目前这项研究的目标是评价酚醛树脂和维他命E的作用,在食用油中不能皂化的部分,及食用油(橄榄油和葵花油)的抗氧化能力。以高脂肪的短时煎炸过程作为食用油氧化性的实验模型。食用油的总的抗氧化性能是由电子自旋共振波谱仪 (ESR) 来评价的。这种方法用做对油脂的氧化性能的研究。 2.材料和方法 2.1材料 超市购买的初级橄榄油,橄榄油(初级橄榄油和提纯橄榄油的混合)和葵花油。 2.2实验过程 准备四个装有热油的3.5升铝制容器(容积 260x192x348)用来做煎炸实验。实验开始时,将同一一种油(初级橄榄油,橄榄油或葵花油),倒入四个锅内,使每个锅装入等量的3升油并被加热至180度。然后,将薯块(切成规则形状,40-50x10x10 毫米)加入到装有热油的煎锅中。15分钟后,1#锅停止加热并冷却到室温(加热15分钟的油);30分钟后,2#锅停止加热并冷却到室温(加热30分钟的油);45分钟后,3#锅停止加热并冷却到室温(加热45分钟的油);60分钟后,4#锅停止加热并冷却到室温(加热60分钟的油)。当煎锅在加热的状态时,薯块每7.5分钟被取出和加入,但是薯块和食用油的比例始终保持在500 克/3升的状态。这样做是为了避免油的体积,薯块在油中的煎炸时间,面积/体积的改变而对实验结果造成的影响。所有的食用油样品在分析前被过滤并保留在-20℃的冰箱内。 2.3确定脂肪酸的成分 根据 LEPAGE 和ROY 方法,脂肪酸甲酯形成了。为了获取非煎炸油和煎炸油的总脂肪酸的成份,用配有 FID 检测器的气-液相色谱进行脂肪酸分析。使用60米长32毫米外径的毛细管柱进行色谱测试,注入器和检测器分别保持在250℃和275℃。载气为氮气,其分配比例为29:1,程序升温(总的时间是40分钟)的设计如下:开始温度160℃,保持5分钟,依次6℃/分钟至190℃,4℃/分钟至220℃,2℃/分钟至230℃,保温12分钟,然后14℃/分钟回到160℃。 2.4维他命E的确定 样品中的维他命E的浓度由带有二极管阵列检测器的高性能 HPLC 来确定,在292纳米检测洗出液,流量在2毫升/分钟,洗出液是甲醇和水(99:1 v/v),样品处理是根据 Ueda 和Igarashi。维他命 E的检测峰由预先设定的标准的单个维他命E保留时间来定义,分析结果用 等量的维他命E 表示。 2.5苯酚的内容 根据 Vazquez-Roncero, Janer del Valleh 描述的方法(1973),总的苯酚可从油中萃取。总的酚类的浓度,以咖啡酸作为标准,用Folin-Ciocalteu 试剂计算。 2.6用MICRO-ESR 电子自旋共振波谱仪确定抗氧化能力 用MICRO-ESR电子自旋共振波谱仪测试自由基的抗氧化能力以确定食用油的总的抗氧化能力。在1毫升的油中加入4毫升的乙醇,在1750xg离心作用下5分钟,通过乙醇溶液的性能评估其抗氧化剂电位,以减少一个等效容积相当于0.5mM的galvinoxyl自由基乙醇溶液(2,6-di-tert-butyl-a-(3,5,di-tert-butyl 4-oxo 2,5,cyclohexadien-1-ylidene)-p-tolyloxy)。做好空间上的保护,保持共振稳定,合成自由基。自由基的数量保留5分钟,在混合后(当反应结束时), 通过ESR波谱的双重积分进行确定,并与样品溶液中乙醇被替代的控制反应相比较,根据Gardener,McPhail 和Duthie(1997)。光谱数据在BRUKER ECS 106上21℃从获取。 2.7物理与化学参数 酸度百分数从 AOCS Ac5-41 方法获取 (AOCS,,1993)。过氧化值通过 AOCS CD8-53方法获取(AOCS, 1993)。根据欧洲 EEC1991 的推荐的规则,在232纳米或270纳米(K232和K270)确定吸收率。 根据 IUPAC 的推荐(IUPAC,1992) 和参考 Dobarganes, Perez 和 Gutierrez 的修改,确定所有的极性元件(TPC)。 2.8实验数据的分析统计 每个数值取的均是6个样品的中值±S.E.M.。在不同油样的每个时间段,或是同一个油样中的不同时间,提交到一个单向的ANOVA。Duncan的测试是在不同的组群之间执行的。。-一个2向的ANOVA分析的执行确定油的影响和每个时间变量。Pearson的产品瞬间线性相关测试被用在所有变量中。以前,所有变量借助Levene测试被正常的和同质的测试。当一个变量被发现不正常,它是对数变换和被重新分析。AP的数值小于0.05的因素被考虑。数据分析采用了SPSS统计软件(SPSS for Windows, 6.1, 1994, SPSS Inc. Chicago, IL,USA)。 3.结果和讨论 3.1食用油的种类和煎炸过程的脂肪酸,维他命E和总苯酚的含量的影响 很多的作者已经描述了在不同的油脂部分在加热后或煎炸实验。(Che Man & Jaswir, 2000;Melton et al., 1994; Pe’rez-Camino,Ma'rquez-Ruiz, & Dobarganes, 1987; Sa’nchez-Muniz,Cuesta, & Garrido-Polonio, 1993)。这些变化借助于不饱和脂肪酸的热氧化和聚合与完全不稳定的变质的形成有关。Dobarganes, Perez-Camino, Gutierrez和Repetto已经报告过这些过程是与不饱和脂肪酸的数量和种类成比例的。在目前的研究中,仅仅是食用油的种类而不是时间或时间与油影响脂肪酸的研究(见表1)。 非煎炸油表现出典型的成分(Gunstone,Harwood, & Padley, 1994), 并在煎炸后食用油的脂肪酸发生明显的变化(见表1)。尽管在葵花油中的不饱和高分子脂肪酸(PUFA)的浓度很高,(见表1A)。这些结果与煎炸油的预先设计的模型相吻合,这正是我们研究的不能皂化的部分(维他命E和苯酚)的不同成份的作用。我们试图避免反复煎炸的食用油在油脂中的典型变化。 Table 1Fatty acid composition (%) of non-fried (0 minutes fried) and 60 minutes fried oils and two-way ANOVA analyses for the effects of oil and time Fatty acid Virgin olive oil Olive oil Sunflower oil Two-way ANOVA(P) 0 min 60 min 0 min 60min 0 min 60 min Oil Time OilxTime 16:0 9.81±0.04b 10.22±0.33b 9.66±0.17b 9.97±0.18b 6.35±0.01a 6.43±0.06a 0.000 0.196 0.637 16:1n-1 0.63±0.00b 0.63±0.00b 0.73±0.00c 0.74±0.01c 0.12±0.00a 0.13±0.00a 0.000 0.432 0.391 18:0 3.96±0.02a 4.17±0.17a 3.73±0.10a 3.83±0.02a 4.37±0.00a 4.66±0.27a 0.003 0.263 0.938 18:1n-9 76.8±0.05b 76.1±0.50b 78.1±0.10c 78.1±0.14c 31.2±0.04a 31.1±0.17a 0.000 0.266 0.728 18:2n-6 6.81±0.01b 6.71±0.05b 5.43±0.02a 5.35±0.02a 55.9±0.03c 55.5±0.27c 0.000 0.685 0.354 18:3 1.11±0.00b 1.11±0.02b 1.15±0.02b 1.12±0.00b 0.38±0.00a 0.40±0.02a 0.000 0.552 0.862 20:1n-9 0.28±0.00b 0.29±0.00b 0.27±0.00b 0.26±0.00b 0.17±0.00a 0.17±0.00a 0.000 0.467 0.228 20:2n-6 0.19±0.02b 0.22±0.02b 0.21±0.38b 0.23±0.01b 0.09±0.01a 0.10±0.01a 0.006 0.567 0.553 20:4n-6 0.12±0.00a 0.12±0.01a 0.11±0.01a 0.11±0.00a 0.75±0.00b 0.81±0.06b 0.000 0.385 0.924 20:5n-3 0.03±0.01a 0.02±0.00a 0.02±0.00a 0.02±0.00a 0.03±0.00a 0.04±0.00a 0.023 0.580 0.399 22:4n-6 0.05±0.00a 0.06±0.00a 0.05±0.00a 0.05±0.00a 0.28±0.00b 0.31±0.02b 0.000 0.179 0.853 24:0 0.16±0.02b 0.19±0.02b 0.20±0.02b 0.19±0.01b 0.09±0.02a 0.11±0.00a 0.000 0.420 0.536 Results are expressed as mean±S.E. For each fatty acid, means with different letters are significantly different for a one-way ANOVA analysfollowed by a Duncan post hoc test (P<0.05). Significant effects are done by P<0.05. 在植物油中的维他命E 的含量的高差异性已经被广泛的研究,并且取决于几个因素,比如遗传的,农艺学的,环境学的,萃取,和其他的。 时间和油的种类均影响维他命E的水平(见表2)。在不同的油中,在PUFA和维他命E 之间有很好的相关系数(r=0.9803,P<0.001). Kalma; Eldin 和 Anderson (1997) 已经描述了亚油酸和维他命E之间的主动的相关关系。这些作者均建议,维他命E对保护 PUFA 被氧化有着重要的作用,这些在维他命E 的水平和植物油的不饱和度有着生化联系,这些是维他 命E 和饮食 PUFA 的主要来源。 Table 2 Two-way ANOVA analyses for the effects of oil and time effects on Parameter Two-way ANOVA P Oil Time Oilx Time Acidity percentage 0.000 0.396 0.837 K232 0.000 0.000 0.000 K270 0.000 0.000 0.029 Peroxide index 0.000 0.006 0.000 Total polar material (TPC) 0.000 0.000 0.000 ESR 0.000 0.000 0.004 Vitamin E 0.000 0.000 0.014 000 0.000 0.000 PDF created with pdfFactory Pro trial verslon www.pdffactory.com" 在经过60分钟的煎炸后,在所有油中的维他命E水平均大幅减少。但是不同油的变化是不一样的。以绝对数值,葵花油减少了 201mg/Kg, 初级橄榄油减少了 127mg/Kg, 橄榄油减少了 77.1mg/Kg。这些结果根据其他的研究(Barrera-Arellano et al., 1997),维他命E是用于保护热力学变化对油破坏。同时很有趣的看到,根据油的种类的不同,维他命E是如何随着煎炸时间的不同而发生不同程度的减少。葵花油在煎炸15分钟后,维他命E消失,随后抗氧化性保持不变。初级橄榄油和橄榄油是在煎炸45 或60分钟后开始的。通过这些数据对比,伴随着葵花油中维他命E消失的事实,可以看出,初级橄榄油和橄榄油抗煎炸破坏的能力更好。以下讨论维他命E 作为抗氧化物质的重要性。 * * *丰 ** 60 21 10 C 1三 31DSiry+一ab3 4E ED 1500 C abc 1000 abcd 一 500 十 0 *5 30 45 EC Fig. 1. Polyunsaturated fatty acids (PUFA) (A). vitamin E (B) andtotal phenolic compounds (C) in virgin olive oil, sunflower oil and oliveoil before (time 0) and after 15, 30, 45 and 60 min of frying. Statisticaldifferences: *=Virgin olive vs. sunflower; t=Virgin olive vs. Olive;t=Sunflower vs. Olive; a=15. 30, 45 or 60 min vs. 0 min; b=30.45 or60 min vs. 15 min; c=45 or 60 min vs. 30 min;d=60 min vs. 45 min. Virutes 苯酚的复合物组成了橄榄油的所谓的“次要组份”的一部分。这些组份对橄榄油的几个特性是至关重要,,比如味道,保质期限,抗氧化性(Gutfinger, 1981; Tsimidou, Lytridou, Bosou,Pappa-Louisi, Kotsifaki, & Petrakis 1996; Va’zquez Roncero, Janer del Valle, & Janer del Valle, 1975)。然而,各种油的产地,成熟度和其他的因素对苯酚的组份的水平可能差异很大(Amiot, Fleuriet &Macheix, 1986; Cinquanta et al., 1997)。图1C和表2,在实验中的苯酚的总的浓度。2种方法的ANOVA实验(表2)表明时间,油、时间和油之间的相互作用影响了油中的苯酚含量。最高值是未煎炸的初级橄榄油(1501±59.6毫克/公斤). Montedoro, Servilli, Baldioli 和Miniati(1992)已经报过数据在1000毫克/公斤)左右。尽管,从总体水平来说,文献中说的少些(Cinguanta et al., 1997; Gutfinger, 1981), 尽管在初级橄榄油的提炼过程中删除了几乎全部苯酚的组份。 (Akasbi,Shoeman, & Saari, 1993), 但是苯酚还是可以在橄榄油中找到,因为商业上的橄榄油是初级橄榄油和提炼橄榄油混合物(EEC 1991)。 煎炸的过程降低了苯酚的含量,或许因为温度破坏了这些分子,或因为他们是用来保护油的氧化性而发生的。油中的这些组份随着时间的推移消失了,结果是在储藏过程中水解或氧化了(Cinquanta et al., 1997; Cortesi, Azzolini, Rovellini, & Fedeli, 1995)。 3.2食用油的抗氧化能力,细微组份的作用和煎炸过程的影响 很多的研究被开发来阐述食用油的氧化稳定性是化学成份的函数。总的说来,它假设高分子不饱和脂肪酸的高水平,伴随着抗氧化的低水平,促进了油的氧化敏感性。很多的方法用于评价油的氧化稳定性并对比了几种组份的抗氧化活动(Baldioli et al., 1996)。然而,据我们所知,没有人用电子自旋共振波谱仪ESR来研究食用油的总抗氧化性或煎炸过程中他们的稳定性。 ESR仪器在波谱分析上有一系列的优势,并且另有一些方法用来测量抗氧化性。 Galvinoxyl自由基不能任意的从\-一个大的基质范围提取H-原子,因此,各种反应是仅有的有效的H-原子提供者(抗氧化的分子一个本质的条件)。除此之外, galvinoxyl自由基有一个良好定义的频谱,并且好于其他在氧化过程中的中间的自由基。的确,这项技术非常敏感,允许在亚分子水平上检测,而且适用于浑浊的或重颜色的溶液(Gardener et al 1997)。 在目前的研究中,我们发现时间,油及油和时间之间的相互作用影响油的抗氧化能力(见表2)。油具有的最大的总的抗氧化能力(见表2),在煎炸之前和多次煎炸之后,是初级橄榄油和葵花油,约为橄榄油的两倍。在所有的研究过的油中,煎炸的过程降低了油的抗氧化能力。我们观察到一个非常有趣的现象,这两种油(初级橄榄油和葵花油),有着非常不同的脂肪酸成份但是随着时间却有着相同的反映。然而,初级橄榄油和橄榄油的脂肪酸没有不同,但在ESR 的分析化验中显示出不同。 有趣的是葵花油的 ESR 数值随着时间却保持不变。可能维他命E的使用(这种油在这个参数上降低最多)允许这种油在研究过程中保持抗氧化性。 有着最高维他命E数值/或苯酚组份的油,显示出最高的抗氧化性。除此之外,有一点非常重要:尽管脂肪酸在煎炸过程中没有被改性,由于葵花油丧失了维他命 E/或初级橄榄油中的苯酚组份,这个过程降低了油的抗氧化性。 PDF created with pdfFactory Pro trial version www.pdffactory.coman olive all 尽管很难知道油的每种组份的重量, ESR 的检测结果可以给出维他命E含量的最好的相关性。(r=0.7375 P<0.001),其次是 PUFA组份(r=-0.5120 P<0.001)和总的苯酚量(r=0.4472P<0.001),从这些数据我们可以得出结论,阻止油的氧化性取决于抗氧化性和脂肪酸的之间的相互作用。 综上所述, ESR 可以推荐用于测试阻止食用油的氧化的应用,此方法非常敏感且快速,能够对氧化能力直观的的观察和测量。 3.3煎炸后的油的物理和化学参数的变化 我们绘制一个的微妙的差异图,显示油在煎炸后的氧化退化和相关物理化学性质的变化。[图]在此次学习中,典型的参数分析是游离脂肪酸的百分率(酸度百分率),过氧化值,紫外线吸收率,总极化分量。短时热油的煎炸过程能缓和这些参数吗?非皂化物片段在这些变化中的相对重要性又是什么? 在脂肪和油中,水解后游离脂肪酸由单和双甘油脂和甘油构成。因此,在煎炸油中酸度百分值和总游离脂肪酸的指数,,已被用于学习煎炸过的油的水解修正。(Gertz,1996)一些学者已经报道过不同的油经过煎炸或加热后的酸度数值的变化(Dobarganes etal.,1985)。不管怎样,根据参数的初值和煎炸时间,这些变化是不一样的。所有这些变化取决于游离脂肪酸能够形成并挥发进入油中同时从油中蒸发出来的波动性。在我们的学习中,一些被学习的油从开始到煎炸的最终,酸度值 (Fig.3A;Table 2)都不变化。这些结果与被发现的油中脂肪酸缺乏变化的说法以及被建议的实验模型是一致的。 Fig.3. Percentage of acidity (A) and peroxide value (B) in virgin oliveoil, sunflower oil and olive oil before (time 0) and after 15, 30, 45 and60 min of frying. Statistical differences: *=Virgin olive vs. sun flower;t=Virgin olive vs. Olive; t=Sunflower vs. Olive; a=15, 30, 45 or 60min vs. 0 min; b=30, 45 or 60 min vs. 15 min; c=45 or 60 min vs. 30min.; d=60 min vs. 45 min. 很多作者把过氧化物的水平,油脂氧化物的产品与食用油的质量和高温加工引起的变化相关联 (e.g. Melton et al 1994)。在目前的研究中,表2显示了油的种类,煎炸的时间,时间和油之间的互动关系,所有这些都影响了样品中的过氧化物指标。在非煎炸油中,发现初级橄榄油的过氧化物数量最多(图3B)。相似的结果在以前也有过报道 (Perezh and Permanyer1986)。这种观察的原因是源于初级橄榄油是使用的唯一非提炼油,在非煎炸油中通过提炼去处过氧化物。然而,经过15分钟至45分钟的煎炸,由于这些成份的挥发,初级橄榄油中的过氧化物开始损失;在此之后,过氧化物的产生比例高于蒸发的比例,所以总的过氧化物的量增加了。在加工的最后,所有油品的过氧化物含量水平相似。 K232与形成的过氧化氢,结合二烯,羧基成份和结合三烯类有关。K270取决于初始化合物在232纳米检测到的次级氧化产物 (Ancin & Martinez, 1991)。两个指数都用于评价煎炸后的油的变化 (e.g. Takeoka et al., 1997)。从已经展示过的油的数据来看:油,时间,及油和时间的相互关系影响这些数据(见表2)。图4A,B显示了随着煎炸时间的延长,所有实验油的指数都有所递增,橄榄油的递增水平最低,,葵花油最高。在指数之间有一个主动的相关性(r=0.8064 P<0.001),但是过氧化物指数没有变化。 总的两极成份(TPC)代表了油中总变化的测量。在煎炸过的油中,有物质在煎炸过程中被彻底破坏 (Melton et al. 1994)。基于这个原因,通常它被认为是个很好的指数,它的变化反映了煎炸过程。在目前的研究中,所有的实验油在煎炸后TPC均会增加(图4C,表2)。 Fig. 4. K232 (A), K270 (B) and total polar components (TPC) (C) invirgin olive oil, sunflower oil and olive oil before (time 0) and after 15,30, 45 and 60 min of frying. Statistical differences: *=Virgin olive Vs.sunflower; t=Virgin olive vs. Olive; t=Sunflower vs. Olive; a=15,30, 45 or 60 min vs. 0 min; b=30, 45 or 60 min vs. 15min;c=45 or 60min vs. 30 min; d=60 min vs. 45 min. 在葵花油中还发现绝对的最高值和增加量。根据 Takeoka et al (1997),所有富含不饱和脂肪酸的油均比饱和脂肪酸的油产生更多的极性成份。尽管提及的关于非煎炸油的这个论点是真实的,但在煎炸60分钟后发生了变化。结果是,橄榄油和初级橄榄油二者不饱和度及脂肪酸成份均相等,但相比之下(表1),橄榄油的 TPC更高。 以上描述表明,不能皂化的两种油本身就有一些不同之处。有很多论文提及,抗氧化物的有效性在延迟的油中恶化。Barrera-Are-Llano et al (1997) 发现在两种不同的维他命E的组份的葵花油中, TPC 也不同。正如我们的研究,橄榄油和初级橄榄油也是如此。 在 TPC 和过氧化物指数或酸性中,没有发现他们之间的任何相关性。然而,在K232(r=0.6529 P<0.001) 和K270(r=0.5301 P<0.001)之间有相关性, ESR对K232和K270的相关性比 TPC(r=0.3913 P<0.001)的更好。这些结果证明在短时间的煎炸后, K232,K270 和TPC是油中成份变化的很好的表征。 总结,在这里作为一个模型,在煎炸的过程中测试食用油的抗氧化能力,所有的被测试的油的抗氧化能力均有降低。葵花油比橄榄油和初级橄榄油的物理化学变化降低的更多。我们有趣的发现,食用油的抗氧化性主要取决于油中的抗氧化物数量的存在。最后证明,,电子自旋共振波谱仪 ESR 是一种非常快速和灵敏的检测食用油抗氧化能力的方法和手段。 ( 参考文献: ) ( Akasbi , M . , Shoeman, D. W., & Saari Csallany, A. (1993). High-performance l iquid chromatography of selected phenoliccompounds in olive oils. Journal of the American Oil Chemists Society, 70, 367-370. ) ( Amiot, M. T., Fleuriet, A., & Macheix, J.T. (1986). Importance and evolution of phenolic compounds in olive during growthand maturation. Journal of Agricultural and Food Chemistry, 34, 823-826. ) ( Ancin, M. C., & Marti’nez, M. T. (1991). Estudio de la degradacio'n de los aceites de oliva sometidos a fritura. I .Determinacio'n estadi'stica del para' metro que mejor cuantifica esta degradacio'n. Grasas y Aceites, 42,22-31. ) ( AOCS (1993). Official methods and recommended practices of the American Oi l Chemists Society (3rd ed). Chamaing, Illinois: AOCS. ) ( Baldioli, M., Servilli, M., Perretti, G., & Montedoro , G. F. (1996). Antioxidant activity of tocopherols and phenolic compoundsof virgin olive oil. Journal of the American Oil Chemists Society, 73, 1589-1593. ) ( Barrera-Arellano, D., Marquez-Ruiz, G., & Dobarganes, M. C. (1997). A simple procedure to evaluate the performance offats and oils at frying temperatures. Grasas y Aceites,48,231-235. ) Chase,G. W., Akoh, C. C., & Eitenmiller, R. R. (1994). Analysis of tocopherols in vegetable oils by high performance liquidchromatography, comparison of fluorescence and evaporative light-scattering detection. Journal of the American Oil CheMan, Y. B., & Jaswir, l. (2000). Effect of rosemary and sage extracts on frying performance of refined, bleached anddeodorized (RBD) palm olein during deep-fat frying. Food Chemistry, 69, 301-307. Cimato, A. (1990). Effect of agronomic factors on virgin olive oil quality. Olivae, 31, 20-31. Cinquanta, L., Esti, M., & La Notte, E. (1997). Evolution of phenolic compounds in virgin olive oil during storage. Journal ofthe American Oil Chemists Society, 74, 1259-1264. Cortesi, N., Azzolini, M., Rovellini, P., & Fedeli, E. (1995).I componenti minori polari degli oli vergini di oliva: ipotesi distructuttura mediante LC-MS. Rivista Italiana di Sostanze Gras, 43,1802-1807. Dobarganes, M. C., Pe’rez, M. C., & Gutie’rrez, R. (1984). Me’todos anali'ticos de aplicacio'n en grasas calentadasl,Determinacio'ne'steres meti'licos no alterados. Grasas y Aceites, 35,172-177. Dobarganes, M. C., Pe’rez-Camino, M. C., Gutie’rrez, R., & Repetto, M.(1985). Aceites calentados, Estudios de toxididadcro'nica. I. Evaluacio'n qui'mica de las muestras. Grasas y Aceites, 36,30-34. Donelli, J. K., & Robinson,D. S. (1995). Free radicals in foods. Free Radical Research, 22, 147-176. EEC. (1991). Diario oficial de las comunidades Europeas Anexes l, IV,V, and IX.Gardener,P. T., McPhail, D. B., & Duthie,G. G. (1998). Electron spin resonance spectroscopic assessment of the antioxidant potential of teas in aqueous andorganic media. Journal of the Science of Food and Agriculture, 76,257-262. Gertz, C. (1996). Chemical changes of oils and fats at elevated temperatures. In B. M. Bell (Ed.), Fat in the diet (pp.15-21).Bridgwater, England: Barnes and Associates.Gordon, M. H., & Kourimska,L.(1995). The effects of antioxidantson changes in oils during heating and deep frying. Journal of the Science of Food and Agriculture, 68, 347-353. Gunstone, F. D., Harwood, J. L., & Padley, F. B. (1994). The lipid handbook (2nd ed.). London, UK: Chapman & Hall.Gutfinger,T.(1981). Polyphenols in olive oils. Journal of the American Oil Chemists Society, 58, 966-968. IUPAC.(1992). Standard methods for the analysis of oils, fats and derivatives (7th revised ed. 1st Supplement). Oxford,UK: Blackwell. Kalmal-Eldin, A., & Andersson, R. (1997). A multivariate study on the correlation between tocopherol content and fatty acidcomposition in vegetable oils. Journal of the American Oil Chemists Society,74,375-380. Lepage, G., & Roy, C. C. (1986). Direct transesterification of all classes of lipids in one-step reaction. Journal of LipidResearch, 27, 114-120. Manzi, P., Panfili, G., Esti, M., & Pizzoferrato, L. (1998). Natural antioxidants in the unsaponifiable fraction of virgin oliveoils from different cultivars. Journal of the Science of Food and Agriculture,77, 115-120. Melton, S. L., Jafar, S., Sykes, D., & Trigiano, M. K. (1994). Review of stability measurements for frying oils and fried foodflavor. Journal of the American Oil Chemists Society, 71,1301-1308. Mousa, Y. M., Gerasopoulos, D., Metzidakis, 1., & Kiritsakis, A. (1996). Effect of altitude on fruit and oil qualitycharacteristics of“Mastoides”olives. Journal of the Science of Food and Agriculture, 71,345-350. Owen, R. W., Giacosa, A., Hull, W. E., Haubner, R., Spiegelhalder, B., & Bartsch, H. (2000). The antioxidant/anticancerpotential of phenolic compounds isolated from olive oil. European Journal of Cancer, 36, 1235-1247. Pe’rez, F., & Permanyer, J. J.(1986). Estudio de las alteraciones termooxidativas de los aceites vegetales: aceite de olivavirgen y aceite de girasol refinado. Grasas y Aceites, 37, 29-32. Pe'rez-Camino, M. C., Marquez-ruiz, G., & Dobarganes, M. C. (1987). Alteracio'n de grasas usadas en fritura, IComportamiento de aceites de oliva y girasol en freidoras dome' sticas. Grasas y Aceites, 38,307-312. Sa'nchez-Muniz, F. J., Cuesta, C., & Garrido-Polonio, C. (1993). Sunflower oil used for frying: combination of column, gasand highperformance size-exclusion chromatography for its evaluation. Journal of the American Oil Chemists' Society, 70,235-240. Severini, C., Romani, S., Dall’Aglio, G., Provere, P., Conte, L., & Lerici, C. R. (1997). High pressure effects on lipidoxidation of extra virgin olive oils and seed oils. Italian Journal of Food Science, 3, 183-191. Takeoka, G. R., Fuli, G. H., & Dao, L. T.(1997). Effect of heating on the characteristics and chemical composition ofselected frying oils and fats. Journal of Agricultural and Food Chemistry, 45,3244-3249. Tsimidou, M., Lytridou, M., Boskou, D., Pappa-Louisi, A., Kotsifaki, F., & Petrakis, C. (1996). On the determination of minorphenolic acids of virgin olive oil by RP-HPLC. Grasas y Aceites, 47, 151-157. Ueda, T., & Igarashi,O. (1990). Determination of vitamin E in biological specimens and foods by HPLC, Pretreatment ofSamples and extraction of tocopherols. Journal of Micronutrient Ana' lisis, 7, 79-96. Va'zquez-Roncero, A., Janer del Valle, C., & Janer del Valle, M. L. (1973). Determinacio'n de los polifenoles totales delaceite de oliva.Grasas y Aceites, 24,350-355. Va'zquez-Roncero, A., Janer del Valle, C., & Janer del Valle,M.L.(1975). Polyphenols content and stability of olive oils.Grasas y Aceites,26, 14-18. PDF created with pdfFactory Pro trial version www.pdffactory.com
确定







还剩9页未读,是否继续阅读?
上海加美华科贸有限公司为您提供《橄榄油、葵花油中脂肪酸和维他命E化合物检测方案 》,该方案主要用于食用植物油中理化分析检测,参考标准--,《橄榄油、葵花油中脂肪酸和维他命E化合物检测方案 》用到的仪器有微型电子自旋共振波谱仪
推荐专场
相关方案
更多