方案详情
文
采用酸性和碱性介质评价不同pH值对超级崩解剂性能的影响及其对药物溶出的影响。使用高溶性(扑热息痛)和难溶性(卡马西平)药物作为模型化合物,制备药物压片和药物-崩解剂压片用于溶出实验。在与溶出介质接触时,由于崩解剂的快速水合能力,致密表面上存在溶胀的SSG或CCS层。
方案详情

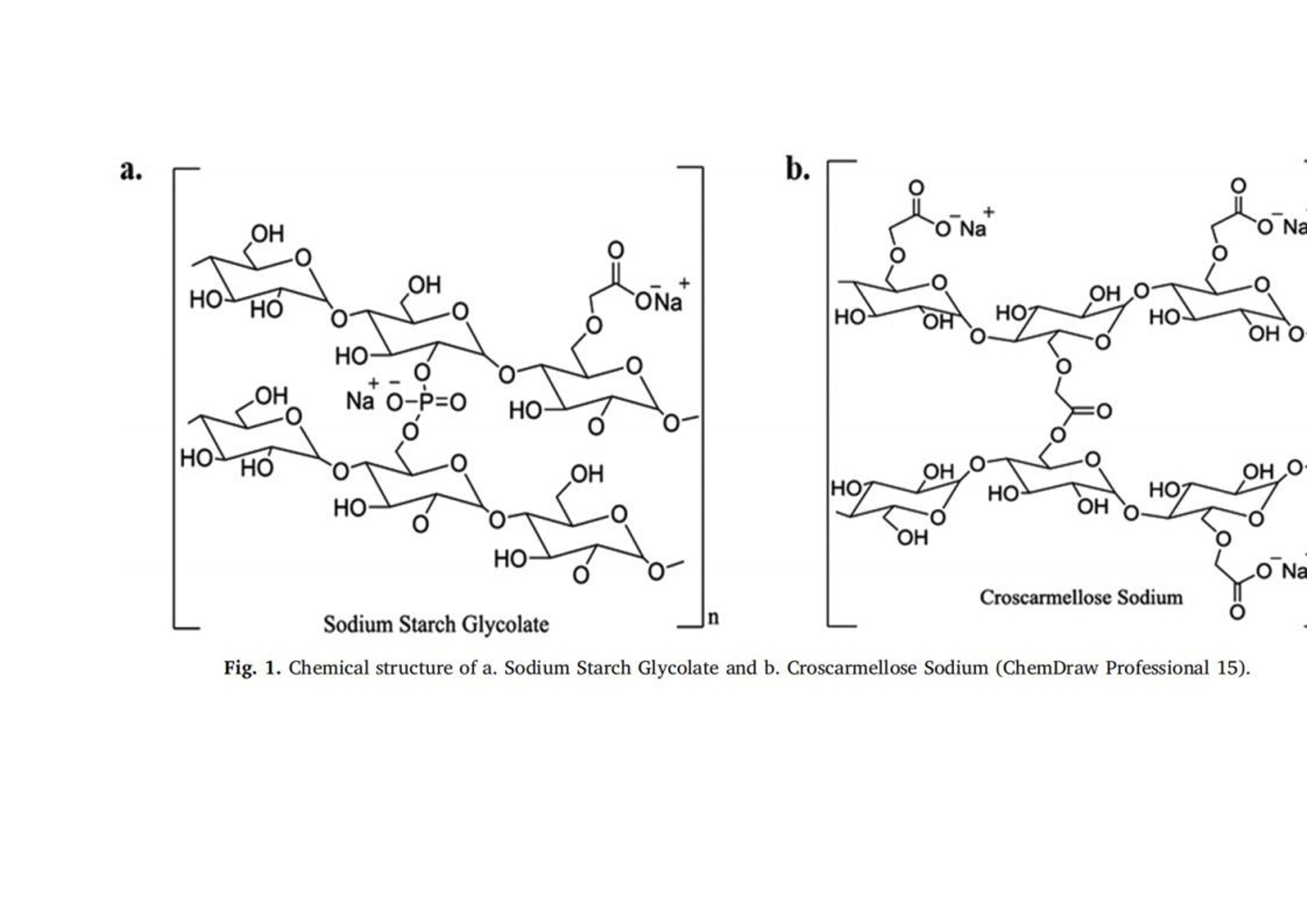
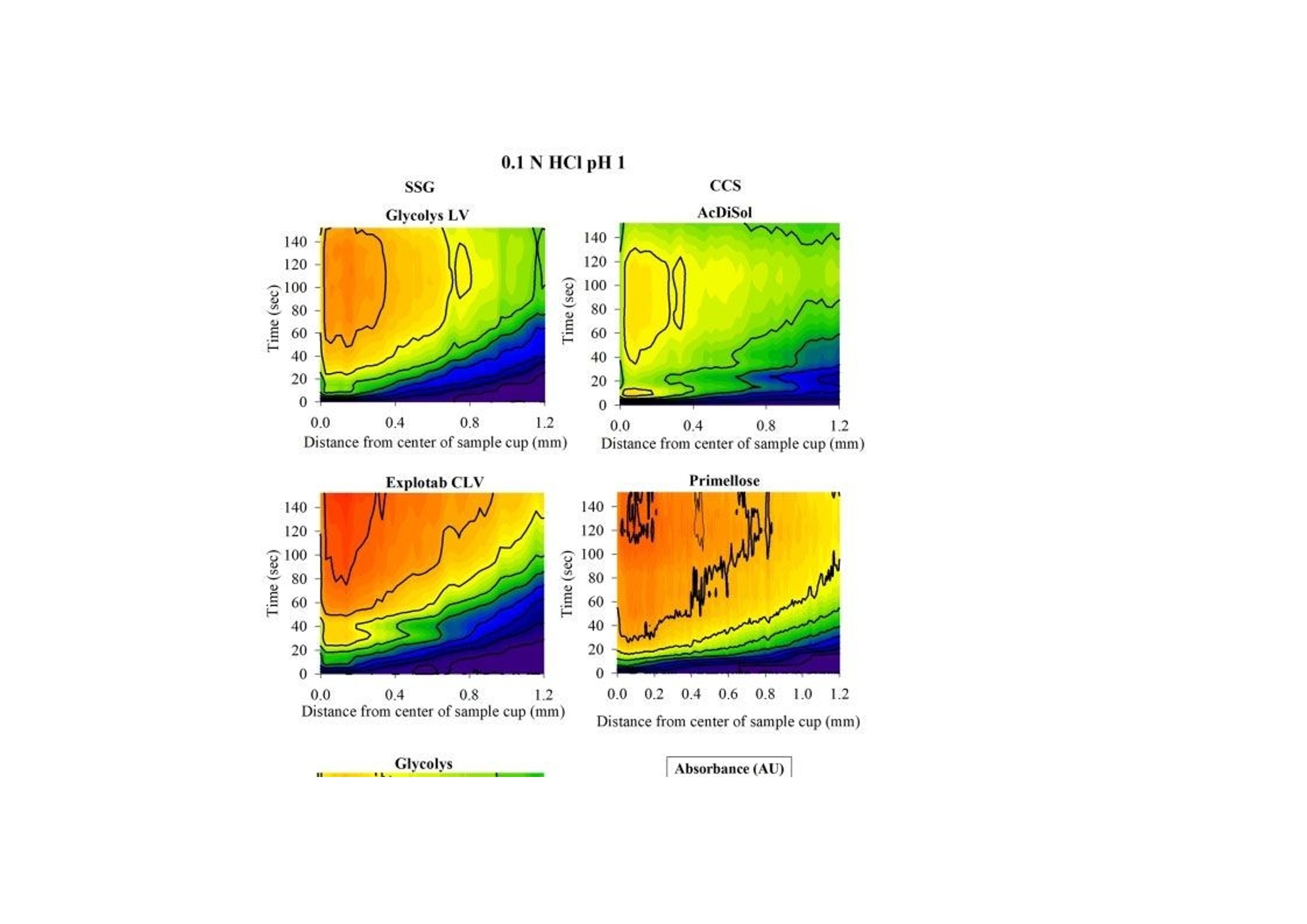
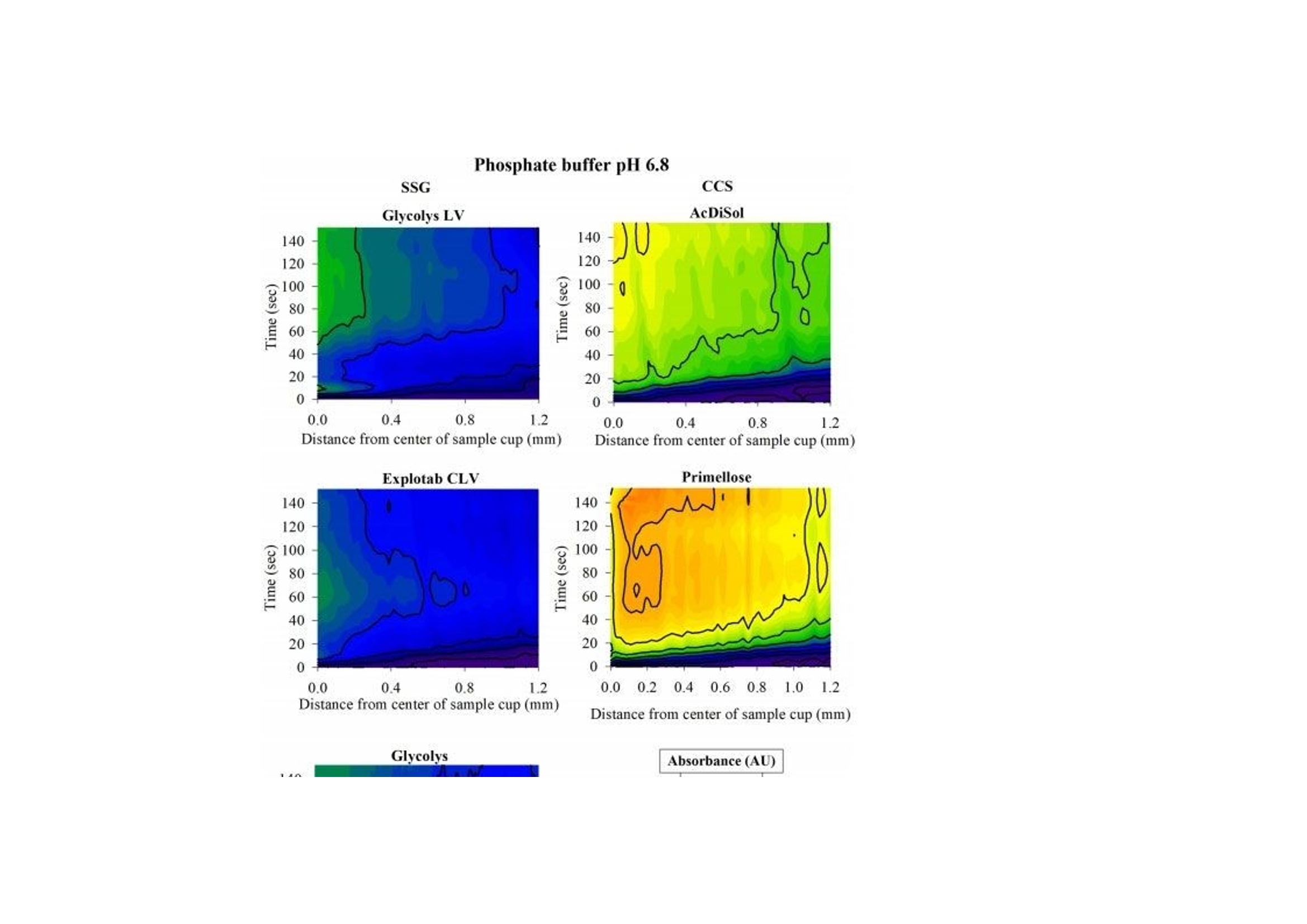
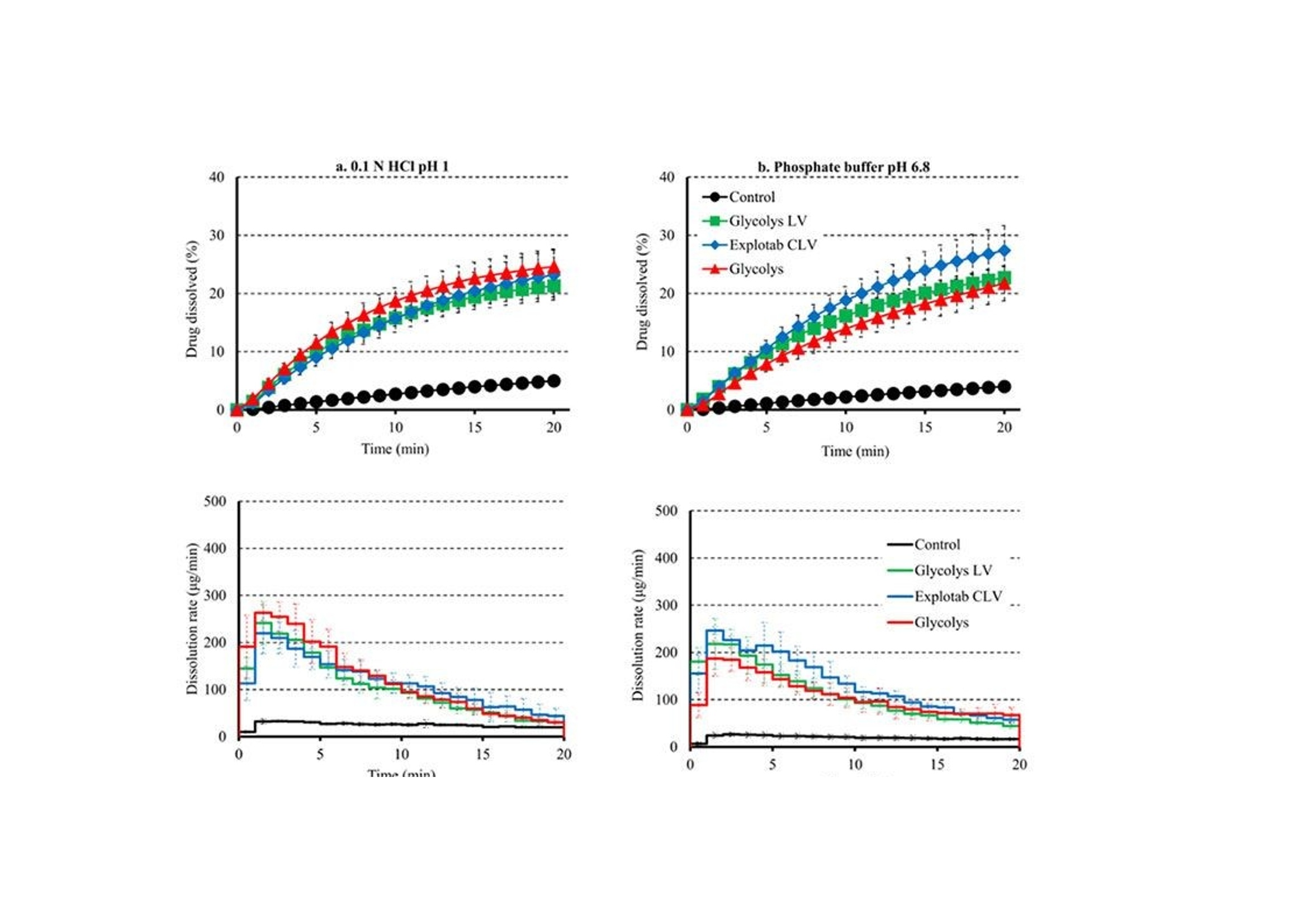
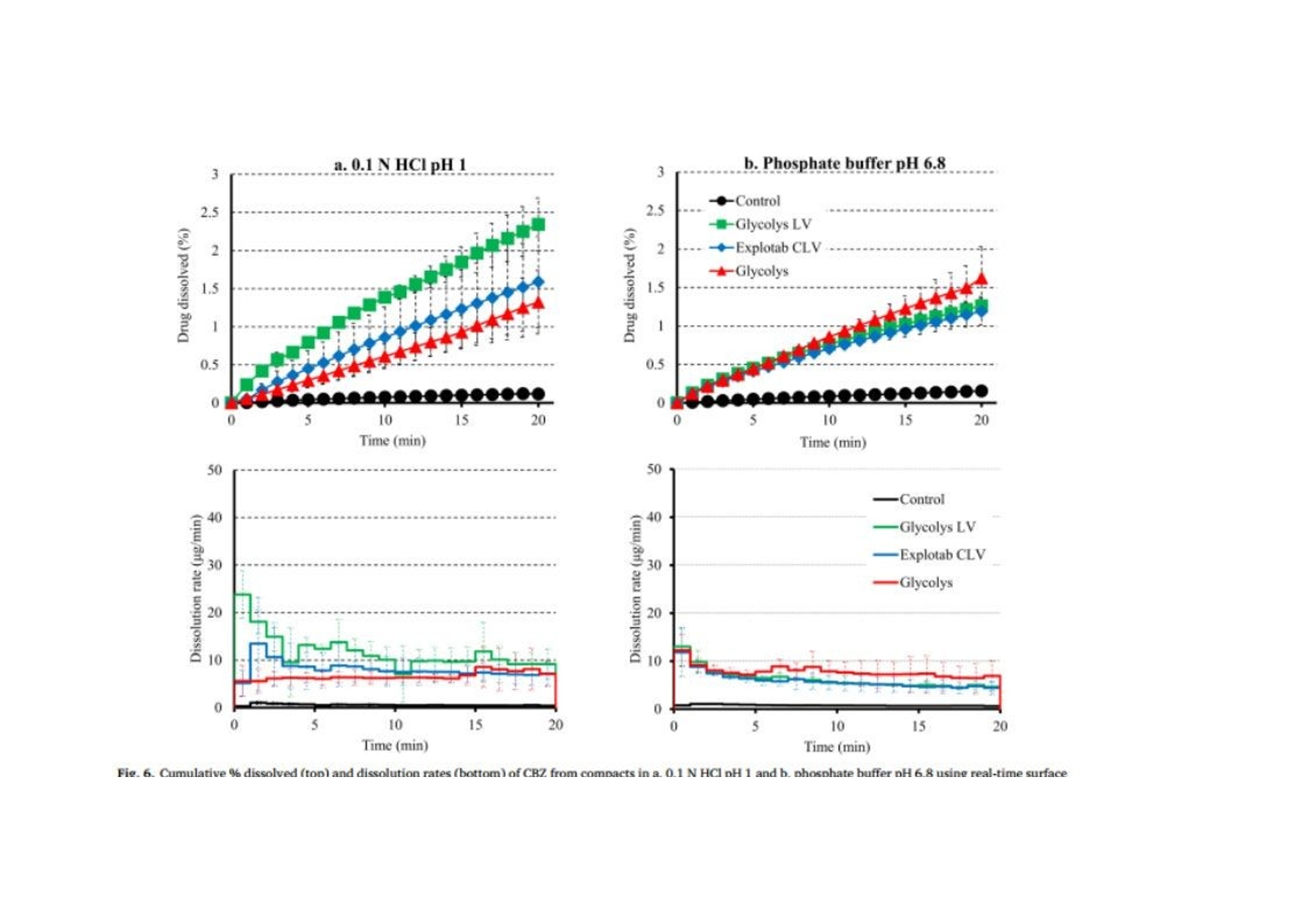
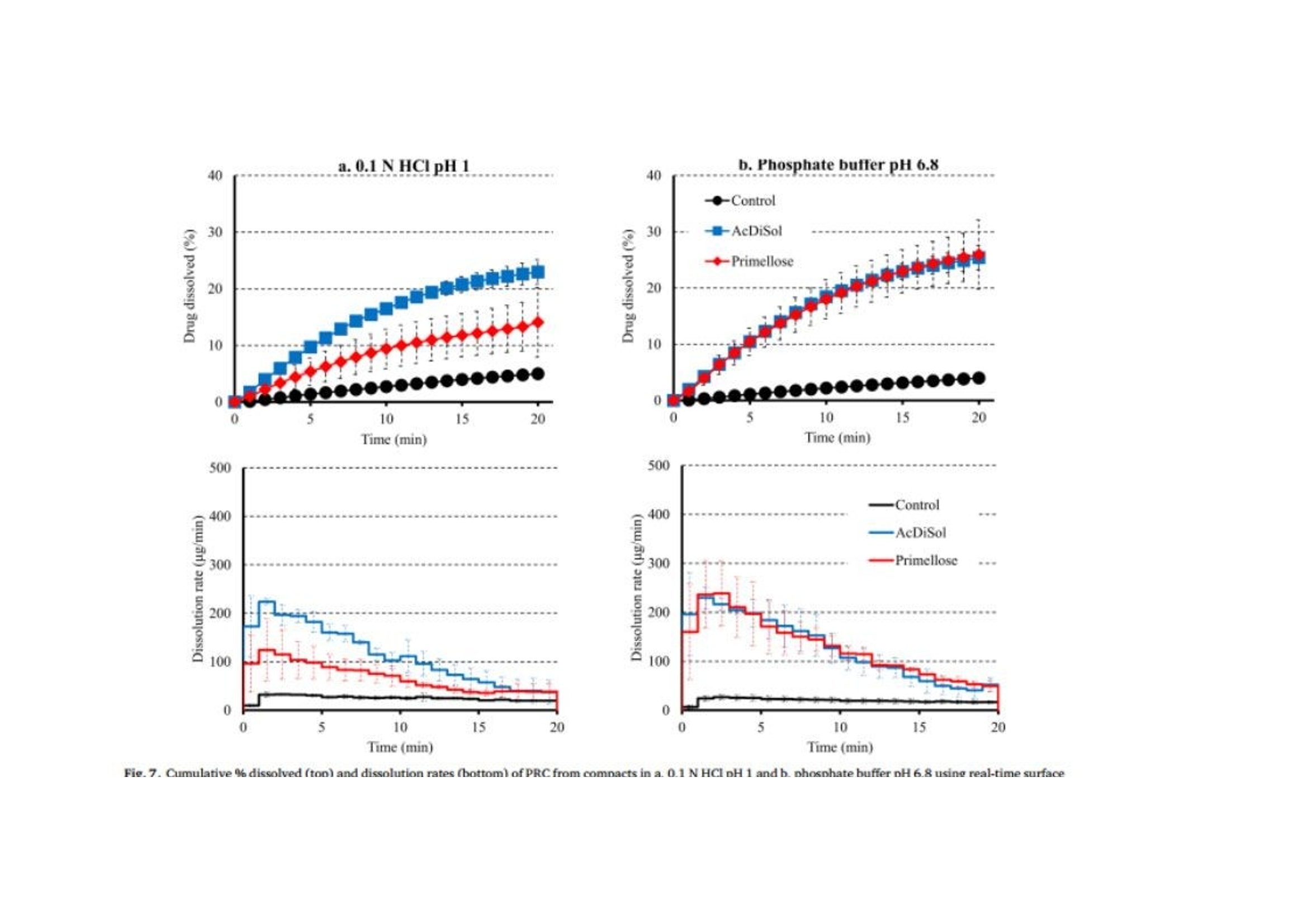
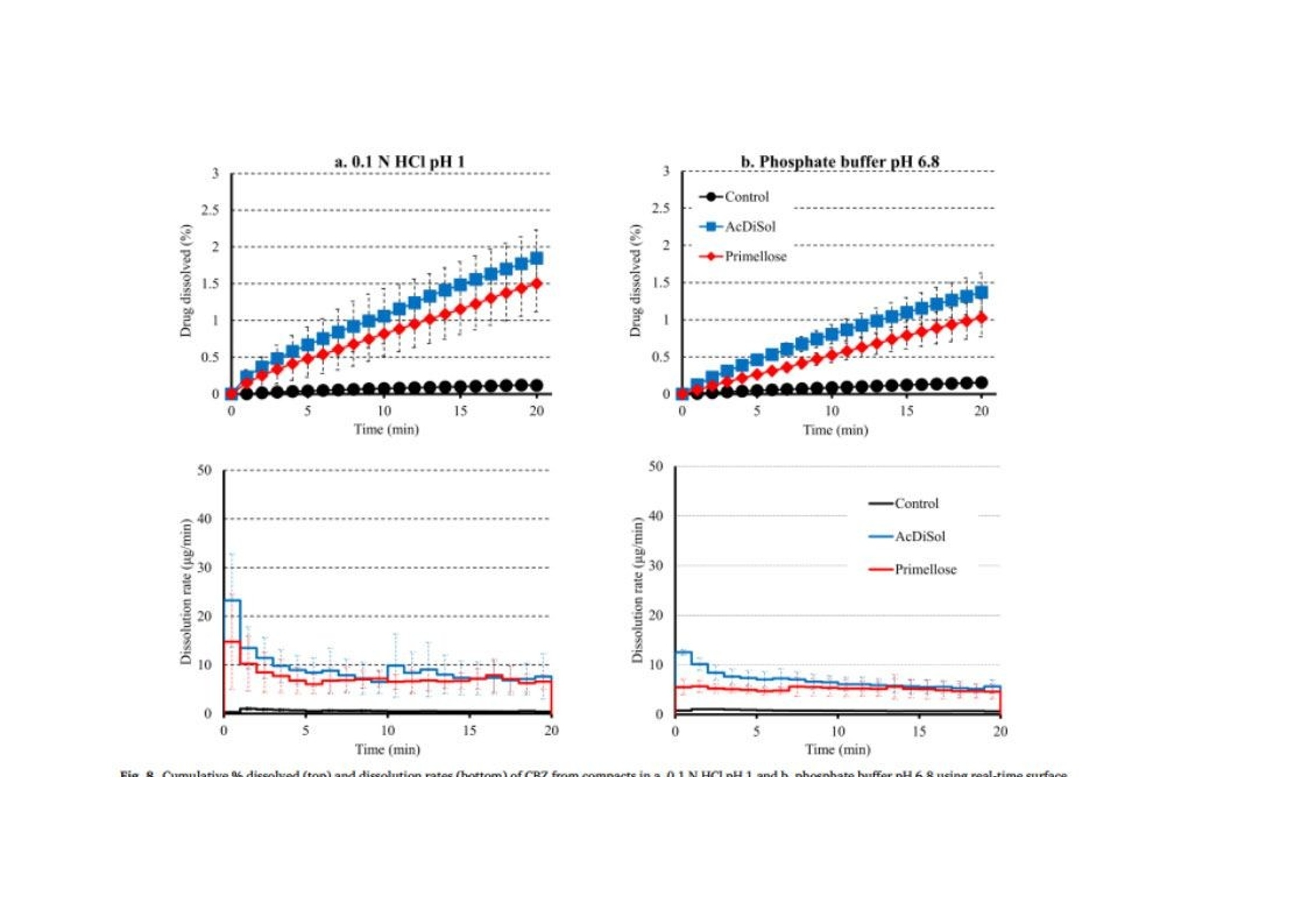
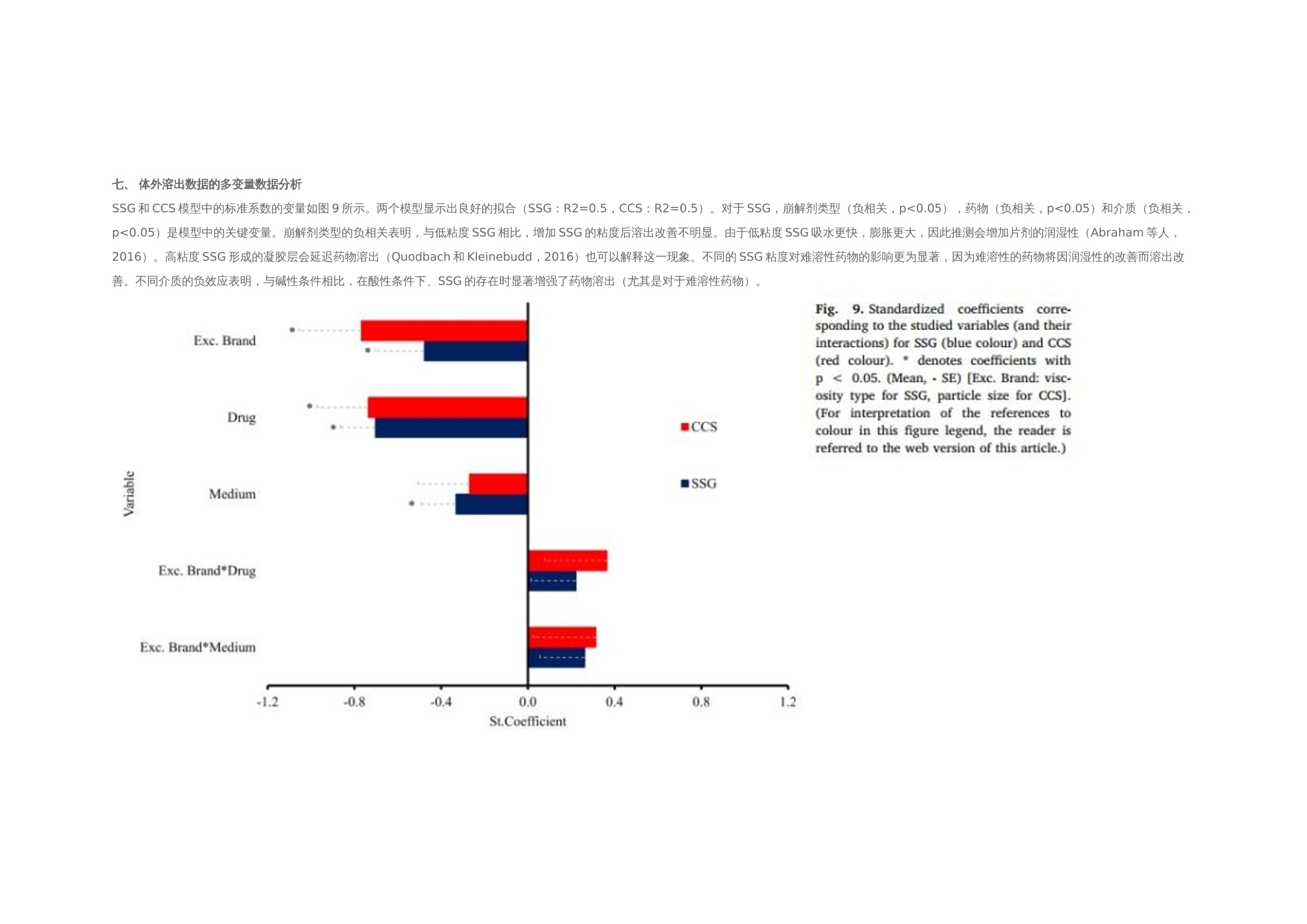
翻译:工业药剂发烧友审核:华溶应用中心表面紫外成像用于表征超级崩解剂及其对药物溶出的影响一.摘要超级崩解剂是速释制剂中用于促进片剂快速崩解的关键辅料,因此了解超级崩解剂差异对产品性能的影响非常重要。目前的研究使用表面溶出紫外成像考察了超级崩解剂关键材料属性(羧甲淀粉钠(SSG)的粘度、交联羧甲基纤维素钠(CCS)的粒度分布(PSD))对其性能(溶胀)和药物溶出的影响。采用酸性和碱性介质评价不同pH值对超级崩解剂性能的影响及其对药物溶出的影响。使用高溶性(扑热息痛)和难溶性(卡马西平)药物作为模型化合物,制备药物压片和药物-崩解剂压片用于溶出实验。在与溶出介质接触时,由于崩解剂的快速水合能力,致密表面上存在溶胀的SSG或CCS层。超级崩解剂的溶胀行为取决于崩解剂的关键材料属性和介质的pH值。由于改善了润湿或崩解,与不使用超级崩解剂相比,药物溶出更快。随着SSG粘度或CCS粒径的增加,药物溶出的改善不太明显。与酸性条件相比,在研究的超级崩解剂存在的情况下,高溶性药物在碱性条件下的溶出稍迅速,这是由于崩解剂增加水合能力,并且药物通过膨胀的崩解剂结构快速释放。对于难溶性药物观察到相反的情况。多元数据分析的使用揭示了崩解剂对药物溶出度的影响二.介绍关键材料属性的确定和控制对于药物的生产与质量的QBD理念很重要。口服固体剂型中超级崩解剂的存在对于片剂快速崩解和改善药物溶出至关重要。羧甲淀粉钠(SSG)和交联羧甲基纤维素钠(CCS)(分别为淀粉和纤维素的聚合物)通常用作片剂制造中的超级崩解剂。超级崩解剂促进片剂崩解的主要机制是溶胀(Quodbach和Kleinebudd,2016)。膨胀是指超级崩解剂颗粒与水接触时的体积膨胀(Quodbach和Kleinebudd,2016)。SSG和CCS是钠盐,在酸性条件下以中性形式存在,在碱性条件下以离子化形式存在。它们源自天然聚合物,经过天然聚合物链的两个主要修饰步骤(羧甲基化和交联化),以提高崩解剂功能(Quodbach和Kleinebudd,2016)。首先,羧甲基化增加了聚合物的亲水性,并允许水进入崩解剂(Zhao和Augsburger,2006)。其次,由于天然聚合物是部分可溶的,其溶出可能会增加介质的粘度,聚合物链的交联有助于降低聚合物的可溶含量。SSG通过磷酸基团交联(Edge和Miller,2005),而CCS通过酯基团交联(Guest,2005)(图1)。与天然聚合物相比,SSG和CCS作为片剂崩解剂的优异性能归因于这两个改性步骤。试验证明了与水接触后SSG和CCS的变大和快速膨胀,SSG和CCS的体积中值直径(平均体积尺寸)增加(SSG与水接触时为123μm,干粉为35μm;CCS接触水时为92μm,而干粉为45μm)和液体吸水量增加,(SSG和CCS在120秒内吸水分别为16g/g和10g/g)Zhao和Augsburger,2005)。尽管SSG和CCS的结构相似,但是它们的膨胀(SSG的三维膨胀,CCS的二维膨胀)存在差异(Rojas等人,2012;Zhao和Augsburger,2005)和它们的不同交联方式(SSG中的磷酸基团与CCS中的酯基团相比,聚合物链之间的间距更大)(Rojar等人,2012)。分子特性(取代度、交联度)、颗粒性质(粒度分布(PSD))和水平已被确定为SSG和CCS影响产品性能的潜在关键材料属性(Zarmpi等人,2017)。增加SSG和CCS的取代度会导致更快的吸水率和溶胀,但需要确定最佳值,因为高羧甲基化程度可能会导致介质粘度增加(Zarnpi等人,2017)。据报道,当增加SSG和CCS的交联度、粒径或水平时,会出现更大的溶胀和更快的崩解(Zarmpi等人,2017)。超级崩解剂的存在或差异对生物药性能的影响尚不清楚。胃肠道因素可能影响超级崩解剂的性能,因为pH值是最有影响的SSG和CCS的电离模式。酸性辅料在酸性介质中的水合能力低于在碱性介质中电离状态的水合能力(酸性和碱性介质是根据生理pH范围定义的(Sjogren等人,2014)),这导致酸性条件下的膨胀减少(Zhao和Augsburger,2005)。SSG在水中和pH =1的0.1M HCl中的体积增加百分比分别为251%和43%,CCS分别为104%和51%(Zhao和Augsburger,2005)。超级崩解剂对产品性能的影响也与药物性质有关。阳离子药物与CCS羧基的相互作用会影响常规药物分析。在样品处理过程中,含有CCS的片剂配方可能会损失活性药物成分(API),因为据报道,由于带电药物-崩解剂相互作用,存在CCS的溶液中药物(二甲双胍(Huang等人,2006)、依司他普仑(Larsen和Melander,2012))的回收率较低。阳离子药物从含有SSG和CCS的速释片剂中溶出的延迟也归因于带电药物-辅料相互作用(Balasubramaniam等人,2008)。目前评估超级崩解剂性能和差异的方法包括测定:制剂的崩解时间、粉末/片剂的吸水量、超级崩解剂的膨胀体积、片剂崩解过程中的力(片剂内部的崩解力必须超过粘附力)、药物的溶出速率、以及片剂崩解后产生的颗粒的大小(Quodbach和Kleinebudd,2016)。实时表面溶出紫外成像目前用于制药领域,提供了关于崩解/溶出现象的特别信息。紫外溶出成像在QbD方法中很有价值,因为它提供了对药物溶出初始阶段表面状态的机理理解和早期药物发现中新药候选的表征(Kuentz,2015;Niederquell和Kuentz)。该技术利用集成有UV-vis摄像机和小型流通池,以及一个注入层流下溶出介质的泵(Ostergaard等人,2014)。通过测量流通池的光透射率,在空间和时间上表征溶出物质,并有助于识别药物固有溶出速率、表面溶胀/崩解/溶出现象、浓度梯度和微环境pH变化(Gordon等人,2013)。通过使用实时表面溶出成像,对原料药(Ostergaard等人,2014)、崩解剂(Pajander等人,2012)及其相互作用(Colombo等人,2015;Hiew等人,2018)的溶出行为进行了深入研究。本研究目的是评估具有不同关键材料属性的崩解剂的崩解性能以及崩解剂的差异对药物溶出的影响和作用。使用实时表面溶出紫外成像进行崩解剂表征和崩解剂存在与否时的药物溶出情况研究。通过选择三种不同粘度类型的SSG和两种不同PSD的CCS,研究了辅料差异对辅料溶胀和药物溶出的影响。使用高溶性[扑热息痛;BCSIII类(Kalantzi等人,2006)]和难溶性(卡马西平;BCS II类(Kovacevic等人,2009))药物来评估崩解剂差异和药物特性对药物溶出的相互作用。在酸性和碱性介质中进行研究,以评估pH值对超级崩解剂溶胀和药物溶出的作用。三.材料与方法3.1 材料原料药:对乙酰氨基酚(PRC,I型)从Fischer Scientific(英国)获得。卡马西平(CBZ,III型)购自Fagron(英国)。辅料:SSG品牌:Glycolys LV[低粘度(60分钟时水溶液的粘度=10.8cP)]和Glycolys[高粘度(60 min时水溶液粘度=20.9cP))](Roquette,法国)、Explotab CLV[低粘度(60分钟时水溶液的粘度=12.7cP)](JRS Pharma,USA)以及CCS品牌:AcDiSol[低粒径(dso=74.2 um)](FMC,USA)、Primellose[高粒径(do=109.8 um)](DFE Pharma,Germany) 。化学品:盐酸36.5%-38%,HPLC级甲醇从Sigma Aldrich(英国)获得。氯化钠、氢氧化钠、磷酸二氢钾购自Fisher Scientific(英国)。水为超纯(Milli-Q)实验室级。过滤器:聚四氟乙烯(PTFE)13 mm过滤器0.45μm孔径购自Fisher Scientific(英国)。3.2 仪器赛托利斯BP 210 D天平(英国Sartorius有限公司)、梅特勒-托利多Seven Compact S210型 pH计(瑞士梅特勒·托莱多)、VortexGenie 2涡旋混合器(美国科学工业公司)、安捷伦科技1100系列HPLC(四元泵(G1311A)、自动采样器(G1313A)、柱温箱(G1316A)、二极管阵列检测器(G1329A)和Chemstation软件(美国安捷伦科技公司)、Actipix SDI300溶出成像系统(英国Paraytec有限公司)与流通池(推荐华溶DS-7CP流池法溶出系统)、Quickset小扭矩螺丝刀(英国Torqueleader)、Actipress 316不锈钢压力机(英国Paraytec LtD)。3.3 方法3.3.1 体外溶出介质根据欧洲药典(pH Fur 2014)中描述的方法制备介质( pH=1的0.1MHCl、pH 6.8磷酸盐缓冲液)。3.3.2 压片对于崩解剂表征,将20mg每种崩解剂倒入片剂中(不锈钢圆柱体,内径2mm,高度:2.4mm),并使用手动压片机以75cNm的恒定扭矩压实5分钟(Pajander等人,2012)。为了进行溶出研究,制备了纯原料药(扑热息痛(PRC)、卡马西平(CBZ))的压片以及原料药-超级崩解剂的压片。将10 mg API(PRC,CBZ)倒入片剂中,并使用手动压片机在75 cNm的恒定扭矩下制备纯API压块(药物压块)5分钟(Pajander等人,2012)。使用手动压片机在75 cNm的恒定扭矩下制备具有API-超级崩解剂压块(药物崩解剂压块),持续5分钟(Pajander等人,2012)。3.3.3 体外实时表面溶出紫外成像使用Actipix SDI300表面溶出成像系统和流通池进行实时表面溶出UV成像。流通池由装有石英池(7 mm高、4 mm宽、62 mm长)和聚醚醚酮(PEEK)样品架的滤筒组成。光源是脉冲氙灯,带滤波器(检测波长±10nm)用于选择适宜的波长。溶出介质通过注射泵注入池内。温度控制单元用于保持恒定温度。紫外成像仪的检测面积为9mm x 7mm(1280像素x1024像素),像素大小为7um x 7um。仪器的详细描述已在之前介绍(Longet等人,2019年:Ostergaard等人,2014年)。对于崩解剂的表征,在254nm下,在37°C、pH=1的0.1MHCl和pH为6.8的磷酸盐缓冲液中,在静止条件进行5分钟的实验。在280nm下,使用1mL/min的流速在37℃、pH=1的0.1MHCl和pH6.8的磷酸盐缓冲液中进行药物压片和药物-辅料压片的体外药物溶出实验20分钟。对于两种崩解剂表征实验和体外药物溶出研究,在流通池中充满溶出介质,没有药片时,记录了黑暗(灯关闭时持续10s)和标准状态(灯打开时持续10秒)的图像。开始数据收集,60秒后暂停数据记录,并将药片引入池内。用溶出介质冲洗系统,以避免流通池中出现气泡,并恢复数据采集。使用Actipix D100软件,版本1.8.50805(英国Paraytec有限公司)将指定量化区域内的像素强度转换为吸光度值。在体外药物溶出实验中,在UV图像的量化区域中存在溶胀崩解剂(SSG和CCS品牌)导致光的散射或物理阻挡的增加(Long等人,2019)。在这些情况下,每隔1分钟收集洗脱样品,通过PTFE 0.45μm孔径过滤器过滤流出物样品,并通过HPLC进行分析。之前对每种药物进行了一式三份的过滤器吸附研究,并确认所研究药物在所用过滤器上没有吸附问题。所有实验一式三份。3.3.4 色谱条件通过HPLC分析溶出样品(流出物收集)。HPLC分析程序是对PRC(Gao等人,2014)和CBZ(Vertzoni等人,2006)已发表方法的修改。两种药物均使用反相Spherisorb(Waters)C18柱(250 x 4.6 mm,5μm)。对于PRC,流动相为甲醇和水20:80(v/v),温度保持在20℃。进样体积为20μL,检测波长为257nm。对于CBZ,流动相由甲醇和水60:40(v/v)组成,温度保持在25℃。进样体积为100μL,检测波长为285nm。两种药物的流速均设定为1mL/min(等度)。PRC和CBZ的洗脱时间分别为6分钟和4分钟。根据标准曲线进行药物定量。标准品由溶于甲醇(PRC:2mg/mL,CBZ:1mg/mL)的药物浓缩储备溶液制备。PRC和CBZ的校准曲线范围分别为10-300μg/mL和0.5-50μg/mL。3.3.5 体外溶出数据处理对于溶胀超级崩解剂行为的表征,由于i.所研究聚合物的不溶性和ii.无法获得崩解剂浓度梯度的定量数据,记录的高吸光度值可能归因于溶胀聚合物对光的吸收或散射,或未溶出聚合物颗粒对光的物理阻挡(Pajander等人,2012)。通过吸光度作为离片剂中心的距离的函数,只能获得溶胀速率和程度的定性信息。使用Actipix D100软件版本1.8.50805(英国Paraytec有限公司)根据像素强度自动计算吸光度值(Abs)(图像区域尺寸:4.6 mm×1.3 mm)。使用SigmaPlot 13.0描述所研究SSG和CCS在 pH=1的0.1MHCl和pH 6.8的磷酸盐缓冲液中的溶胀行为(吸光度值作为与片剂中心距离的函数)的分类梯度图(其中z变量沿x和y方向的变化通过颜色变化来说明)(美国Systat软件公司)。根据样品中测得的药物浓度(基于HPLC分析数据)和片剂中的药物量计算药物溶出的累积百分比。构建了作为时间函数的药物累积溶出百分比的溶出曲线。根据样品中测得的药物浓度(基于HPLC分析数据)和溶出实验的已知流速,计算实验期间每1分钟间隔的药物溶出速率(ug/min)。绘制了描述药物溶出速率随时间变化的曲线图(间隔1分钟),并在采样间隔的中间点显示了溶出率的标准偏差(SD)。使用梯形法计算的截至最后实验时间(20分钟)的溶出曲线下面积(AUC)用于表征药物溶出。根据E.(1)计算每种超级崩解剂对药物溶出的相对影响(RE)。其中AUCC和AUCT分别是对照和试验的片剂的溶出曲线下的面积。进行了两组比较:在第一组(第1组)中,检测了在各个介质里药物片剂与药物-辅料压片片剂的溶出的差异,将药物压片和药物-辅料压片的溶出曲线的AUC作为对照溶出曲线和测试溶出曲线,在第二组(第2组)中,以酸性和碱性条件下的溶出曲线的AUC分别作为对照溶出曲线和试验溶出曲线,研究了每个药物-辅料压片的片剂在酸性和碱性情况下药物溶出的差异。辅料对药物溶出影响的风险评估通过对溶出曲线AUC的RE(设定参考范围标准-20%-25%)(FDA,2002年)进行评估(选择该范围是为了评估口服给药后药物暴露的差异;即生物等效性研究)。崩解剂对溶出曲线的AUC的RE超出这些值(RE<-20%或RE>25%)被认为对口服药物性能可能至关重要。3.3.6 体外溶出数据的多变量数据分析通过使用XLSTAT软件(美国微软公司)的多元线性回归(MLR),辅料RE对药物溶出的影响与辅料关键材料属性(如SSG的粘度、CCS的PSD)、药物水溶性和介质(酸性、碱性)特性相关。在SSG(模型1)和CCS(模型2)存在下,构建了崩解剂对溶出曲线AUC的RE的两个模型。两种模型的因素评估很明确,包括:i.药物水溶性[0:难溶性,1:高溶性;基于化合物的BCS(生物制药分类系统)分类(高溶性:BCSⅠ类和III类;难溶性:BCSII类和IV类)(FDA,2017)]。ii.介质(0:酸性,1:碱性)。iii.辅料特性(0:低崩解特性,1:高崩解性能;SSG黏度大小以及CCS的粒度。使用溶出曲线AUC对应的辅料RE作为响应。所选的交互因素包括每种辅料型号与每种药物的水溶性和介质特性(酸性、碱性)。根据拟合程度与方差扩大因子(VIF)评估生成的MLR模型。高R2值和VIF值<5表明自变量之间缺乏多重共线性的成功模型(Montgomery和Peck,1992)。标准系数用于表示每个变量的方向(正或负)和程度。通过p值评估变量95%置信区间的显著性(p<0.05被认为是模型中最显著的(Montgomery和Peck,1992))。四.结果与讨论用实时表面溶出紫外成像表征超级崩解剂的溶胀行为。所研究的崩解剂类型和型号先前已根据SSG的粘度和CCS的PSD进行了表征(Zarmpi等人,2019)。Glycolys LV(10.8 cP)和Explotab CLV(12.7 cP)的水溶液60分钟后的粘度低于Glycolyss(20.9 cP),因为它们的交联度更高,可溶性物质含量更低(Shah和Augsburger,2001)。与Primellose(d10:21.8μm,d50:52.2μm,d90:109.8μm)相比,AcDiSol由更小的颗粒组成(d10:12.8μm,d50:31.9μm,D60:74.2μm),因此确定了不同CCS的PSD的差异。表面溶出UV成像用于研究SSG和CCS在缓冲液中的溶胀性能,崩解剂与溶出介质接触时的溶胀UV图像见图1。所研究的超级崩解剂在 pH= 1的0.1 MHCL条件下的溶胀行为随时间和距离片剂中心的关系如图2所示。强信号位置表明存在密集膨胀的聚合物结构(Colombo等,2015),因为记录的高吸光度归因于膨胀的超级崩解剂的光散射或未溶出的颗粒对光的物理阻碍(如前文所述)。无论崩解剂型号或种类如何,所有研究的超级崩解剂在距片剂中心1.2 mm的距离处,在约20-40秒的时间内膨胀,证明了崩解剂的快速膨胀。对于SSG,与Glycolys LV和Explotab CLV (Abs1.2-1.6 AU)相比,Glycolys表现出较低的吸光度值(Abs1.0-1.2 AU),这可能是由于高粘度品牌的可溶性含量较高(Shah和Augsburger,2001)。对于CCS,与AcDiSol (Abs1.0-1.2 AU)相比,Primellose (Abs1.4-1.6 AU)的较高吸光度值可归因于较大颗粒对光的明显物理阻塞(Van Eerdenbrugh等人。2011)。在pH为6.8的磷酸盐缓冲液中,所研究的超级崩解剂的溶胀行为随时间和距离片剂中心的函数如图3所示。与 pH=1的0.1MHCl(20-40 s)相比,观察到pH 6.8的磷酸盐缓冲液中的崩解剂溶胀稍快(<20 s),这是由于在碱性介质中崩解剂是电离形式存在(Zhao and Augsburer,2005)以及有较高的液体摄取量(pH=1的0.1MHCl介质:2分钟后SSG和CCS的液体摄取约为5 g/g;在碱性介质中崩解剂以电离形式溶胀:2分钟后SSG和CCS的液体摄取分别为18 g/g和10 g/g(Zhao和Augsburger,2005))。在pH为6.8的磷酸盐缓冲液中的吸光度值(SSG:0.6-1.2 AU,CCS:1.0-1.4 AU)低于pH=1的0.1MHCl介质(SSG:1.0-1.6 AU, CCS:1.0-1.6 AU)。我们假设,与酸性介质相比,碱性介质中的较低吸光度与磷酸盐缓冲液pH6.8中崩解剂电离形式的较高膨胀性能有关。因为膨胀聚合物链的间距越高(Rojas et al.,2012),光的散射或物理阻挡就越少。在研究的SSG中未观察到吸光度值的差异(Abs=0.6-1.0AU)。对于CCS,与Primellose(Abs 1.2-1.4 AU)相比,AcDiSol(Abs 1.0-1.2 AU)的吸光度值较低,这是因为其粒径较低[24]。与CCS相比,SSG在pH 6.8的磷酸盐缓冲液中的较低吸收值可以表明SSG的更大的溶胀,这是由于两种崩解剂交联类型(SSG为磷酸基,CCS为酯基)的差异以及在与模拟肠液接触时的膨胀尺寸类型的差异(SSG的三维膨胀(半球状颗粒)和CCS的二维膨胀(纤维状颗粒)差异(Rojar等人,2012年)。在研究介质中观察到的崩解剂性能差异表明,预测胃和小肠之间的崩解差异(由于这两个内环境的pH值不同),并可能影响产品性能和药物生物利用度。五、测定SSG差异对药物溶出的影响5.1 高溶药物(PRC)图4显示了在 pH=1的0.1MHCl介质和pH为6.8的磷酸盐缓冲液中,PRC药物的压缩物(对照)和药物- SSG压缩物的溶出曲线和溶出速率。在两种介质中,约5%的PRC在20分钟内从药物中溶出。药物-SSG压片在20min内溶出的百分比有所增长:在pH=1的0.1MHCl介质中(在Glycolys LV、Explotab CLV和Glycolyss存在下,分别为21%、23%和25%的药物溶出)和在pH为6.8的磷酸盐缓冲液中(在Glycolys LV、Explotab CLV和Glyclys存在下,溶出的药物分别为22%、27%和21%)。在所研究的两种介质中的实验期间,PRC从药物压块中的溶出速率都很慢(HCl介质和6.8介质中,20min时溶出速率分别约为20μg/min和17μg/min)。在所研究的介质中,药物- SSG压片中的药物溶出速率比药物压片中的药物溶出速度更快,特别是在早期时间点(1-5 min)。在崩解剂存在下PRC的溶出速率增加,(在两种介质中5分钟时,含Glycolys LV、Explotab CLV和Glycolyss的压块的溶出速率约为200μg/min)。这可以通过崩解剂快速水合和溶胀(崩解剂在前40秒内在距片剂中心1.2 mm的距离处溶胀)来解释。这改善了片剂的润湿(Onuki等人,2018)。与药物压块相比,崩解也可能有助于药物更快的从药物-崩解剂压块中溶出。与药物压块相比,药物-崩解剂压制的片剂更快的崩解有助于药物更快的溶出,因为在每次实验结束后,仅在药物-崩解剂压片的表面观察到了颗粒的扩散。溶出曲线的AUC比较表明,与药物压片的溶出相比,药物-崩解剂压片的药物溶出更完全(RE>25%)(图5a)。未观察到所研究SSG类型在酸性和碱性条件下PRC药物从药物-SSG压块中溶出的差异(Glycolys LV、Explotab CLV和Glycolyss的RE分别约为5%、20%和20%)。观察到的微小REs表明,SSG的溶胀性能的pH依赖可能不会显著影响高溶性药物在酸性和碱性条件下的溶出。5.2 难溶药物(CBZ)CBZ从药物压块与药物-SSG压块在HCl和pH 6.8介质中的溶出曲线和溶出速率如图6所示。在20分钟内,HCl和pH 6.8介质中约0.1%的CBZ从药物压块中溶出。在pH=1的HCl中,在Glycolys LV、Explotab CLV和Glycolyss存在下,分别在20分钟内溶出2.3%、1.6%和1.3%。不同药物-崩解剂压片之间,pH 6.8介质、20分钟CBZ溶出百分比相似(含Glycolys LV、Explotab CLV、Glycolyss的药物-崩解剂压片:约1.5%的CBZ溶出)。在两种介质中,药物从药物压块中的溶出速度都很慢(在HCl和6.8中,20分钟时的溶出速度约为0.5 ug/min)。在SSG存在下,CBZ溶出加快,尤其是在早期时间点(1-5分钟),这可能是由于崩解剂快速膨胀或片剂崩解(如PRC中所解释的)。在HCl介质中,在Glycolys LV、Explotab CLV和Glycolyss存在下,5min时,CBZ从药物-崩解剂压块中的溶出速率分别为13μg/min、8.6μg/min和6.2μg/min。与低粘度型号(Glycolys LV、Explotab CLV)相比,Glycolyss存在时溶出的药物量较低,这可能是因为高粘度Glycolyse使压块周围凝胶的粘度增加所致(Quodbach和Kleinebudd,2016)。含低粘度和高粘度SSG品牌的压块的CBZ溶出速率的显著差异在后期逐渐减小。在pH 6.8的磷酸盐缓冲液中,与没有崩解剂相比,CBZ的溶出速度加快,三种药物-崩解剂压片的溶出速率相似(在所研究的三种SSG存在的情况下,5min时,CBZ溶出速率约为7μg/min)。与无崩解剂相比,有崩解剂的CBZ溶出更完全(RE>25%)(图5a)。观察了酸性和碱性条件下药物-辅料压片的药物溶出度差异。对于低粘度崩解剂(Glycolys LV和Explotab CLV),酸性和碱性条件下溶出曲线AUC的RE为负值(Glycoys LV和expltab CLV的RE分别为-45%和-20%),表明与pH=1的HCl介质相比,pH为6.8的磷酸盐缓冲液中CBZ溶出的改善不明显。尽管在碱性条件下聚合物吸水更快,由于超级崩解剂的电离作用,在碱性条件下比酸性条件下膨胀得更大(Rojas等人,2012),片剂顶部高度膨胀层的存在可能会对难溶性药物的释放增加物理或扩散屏障(Long等人,2019)。溶出曲线的比较表明,在pH 6.8的磷酸盐缓冲液中的溶出略为完全(REs为30%)。溶出曲线AUC上的正RE可能与Glycolys的凝胶效应(Quodbach和Kleinebudd,2016)以及在pH=1的HCl介质中观察到的CBZ溶出较慢(与其他两种崩解剂相比)有关。六.测定CCS差异对药物溶出的影响6.1 高溶药物(PRC)PRC从药物压块(对照)和药物-CCS压块在pH=1的HCl和pH 6.8磷酸盐缓冲液中的溶出曲线和溶出速率如图7所示。与无崩解剂的RPC药物压片的溶出相比(20 min:5%),有崩解剂存在时,0.1N HCl(AcDiSol:23%,Primellose:14%)和pH为6.8的磷酸盐缓冲液(AcDiSol:25%,Primellose:26%)。与在两种介质中不存在崩解剂相比,崩解剂存在时药物溶出速度更快,这可能是由于CCS的亲水性和溶胀性而导致润湿或崩解增强所致(Quodbach和Kleinebudd,2016)。在0.1N HCl的早期时间点观察到所研究药物-CCS压块的溶出速率的差异,因为与AcDiSol(5min:182μg/min)相比,可能是由于在压块表面顶部存在较大的崩解剂颗粒(Primellose)。在pH 6.8的磷酸盐缓冲液中,在含有AcDiSol和Primellose的药物-CCS压块之间观察到类似的药物溶出(在两种CCS型号存在下,5分钟的溶出速率约为200μg/min)。在后续的时间点,在两种介质中均存在CCS的情况下,PRC的溶出率逐渐降低,并且所研究的CCS型号之间的药物溶出差异减小。药物和药物-CCS压片的溶出曲线的AUC比较显示,含有崩解剂的片剂的溶出明显更彻底(RE>25%)(图5b)。如AcDiSol在酸性和碱性条件下的溶出曲线AUC上的RE(RE=10%)所揭示的,未观察到酸性和碱性状态下药物-AcDiSol压片的药物溶出差异。与0.1 N HCl介质(RE=97%)相比,在pH 6.8的磷酸盐缓冲液中,药物-Primellose压片的溶出明显更完全,这可能是因为在0.1 N HCl中存在较大的崩解剂颗粒。6.2 难溶药物(PRC)CBZ在0.1 N HCl 和pH 6.8磷酸盐缓冲液中从药物压片和药物-CCS压片中的溶出曲线和溶出速率如图8所示。含AcDiSol和Primellose的压块在0.1N HCl中的CBZ溶出度分别达到约1.8%和1.5%,在pH 6.8磷酸盐缓冲液中的CBZ溶出度分别为1.3%和1.0%。在溶出早期时间点,崩解剂的快速膨胀导致药物-CCS压块的溶出速度比两组介质中的药物压块更快。与 AcDiSol存在下的溶出相比(酸、碱介质溶出分别为:9μg/min与7ug/min),Primellose存在下的溶出偏慢(酸、碱介质溶出分别为:7μg/min and 5ug/min)。可能是由于在压片的表面的顶部存在较大的崩解剂颗粒(Primellose)。在所研究的崩解剂型号之间的后期时间点的药物溶出差异在变小。在崩解剂的存在下,在两种实验条件下,与对照样品相比,药物溶出明显更完全(RE>25%)(图5b)。与碱性条件相比,CCS的存在时,CBZ的在酸性条件下溶出增强更为明显(AcDiSol和Primellose在酸性和碱性条件下的溶出曲线AUC的RE分别为-30%和-20%)。崩解剂在酸性介质中更快的吸水(Rojas等人,2012)预计会导致更快的药物溶出,这是由于改进的片剂的润湿性,但这并没有被观察到,因为片剂表面顶部的溶胀层可能会产生物理或扩散屏障,延迟药物释放(Long等人,2019)。对于不含崩解剂的溶出实验,在某些情况下,仅在前3分钟观察到较高的变异性(变异系数(CV%)>20%),在随后的时间点观察到较低的变异性。对于崩解剂存在的溶出实验,确定了变异性增加的情况(早期和晚期时间点分别为15%<70%和15%<50%),这可能与物理混合有关(Koester等人,2003a,b;Zarnpi等人,2019)。在未来的研究中,随着重复次数的增加,物理混合的过程参数可以进一步优化。七.体外溶出数据的多变量数据分析SSG和CCS模型中的标准系数的变量如图9所示。两个模型显示出良好的拟合(SSG:R2=0.5,CCS:R2=0.5)。对于SSG,崩解剂类型(负相关,p<0.05),药物(负相关,p<0.05)和介质(负相关,p<0.05)是模型中的关键变量。崩解剂类型的负相关表明,与低粘度SSG相比,增加SSG的粘度后溶出改善不明显。由于低粘度SSG吸水更快,膨胀更大,因此推测会增加片剂的润湿性(Abraham等人,2016)。高粘度SSG形成的凝胶层会延迟药物溶出(Quodbach和Kleinebudd,2016)也可以解释这一现象。不同的SSG粘度对难溶性药物的影响更为显著,因为难溶性的药物将因润湿性的改善而溶出改善。不同介质的负效应表明,与碱性条件相比,在酸性条件下、SSG的存在时显著增强了药物溶出(尤其是对于难溶性药物)。对于CCS,崩解剂类型(负效应,p<0.05)和药物(负作用,p<0.05)是模型中的关键变量,增加CCS的粒径对药物溶出的改善不太明显,这可能是由于较大崩解剂颗粒形成了药物溶出的物理或扩散屏障。CCS的存在改善了润湿与崩解,促进难溶性药物的溶出。多变量数据分析表明,CCS差异可能对药物溶出的初始阶段至关重要。八.总结超级崩解剂的差异以及互换性对口服固体制剂的性能具有较大影响,因为药物制剂中超级崩解剂的存在直接影响药物溶出。在这项研究中,使用表面紫外成像可以对SSG和CCS溶胀及其对药物出的影响进行半定性分析。证实了SSG和CCS的快速溶胀能力,这取决于关键材料属性和溶出介质的pH。这些结果表明,在口服固体剂型中,SSG和CCS不应被认为是可互换的。超级崩解剂在含有高规格和难溶性化合物的压块中的存在导致两种药物的溶出速度显著加快,这可能是由于亲水崩解剂增强了片剂的润湿或崩解。在口服药物开发中需要仔细考虑具有不同材料属性的崩解剂的影响,因为不同的崩解剂关键材料属性会影响药物的溶出程度(低粘度SSG或低粒度CCS观察到明显的溶出增强,尤其是对于难溶性的药物)。揭示了超级崩解剂的潜在生物制药意义,发现药物水溶性和介质特性之间的相互作用可能影响产品性能(由于崩解剂增加了水合能力,高溶性药物在碱性介质中的药物溶出速度比酸性介质快;难溶性药物:与酸性介质相比,碱性介质中药物溶出速度慢,这可能是由于片剂表面顶部存在高度溶胀的崩解剂结构)。SSG粘度、CCS粒度、药物水溶性以及超级崩解剂差异被认为是影响药物性能的关键生物制药因素。结论是:崩解剂的差异对口服固体制剂的性能具有挑战性,并且当在口服固体制剂开发中需要改变崩解剂类型/型号时,这是需要慎重考虑的因素。九.参考文献略如需原文,请联系小编(15012941165)
确定


















还剩24页未读,是否继续阅读?
深圳市华溶分析仪器有限公司 为您提供《表面紫外成像用于表征超级崩解剂及其对药物溶出的影响》,该方案主要用于化药制剂中含量测定检测,参考标准--,《表面紫外成像用于表征超级崩解剂及其对药物溶出的影响》用到的仪器有华溶自动取样溶出系统DS-1206AT
推荐专场
相关方案
更多
该厂商其他方案
更多















