本研究的目的是通过IVIVC分析评价,使用美国药典(USP)装置3开发GLZ缓释(MR)片剂的溶出度方法。评价了各种溶出度参数,以建立GLZ片剂的体外溶出测定方法。
方案详情

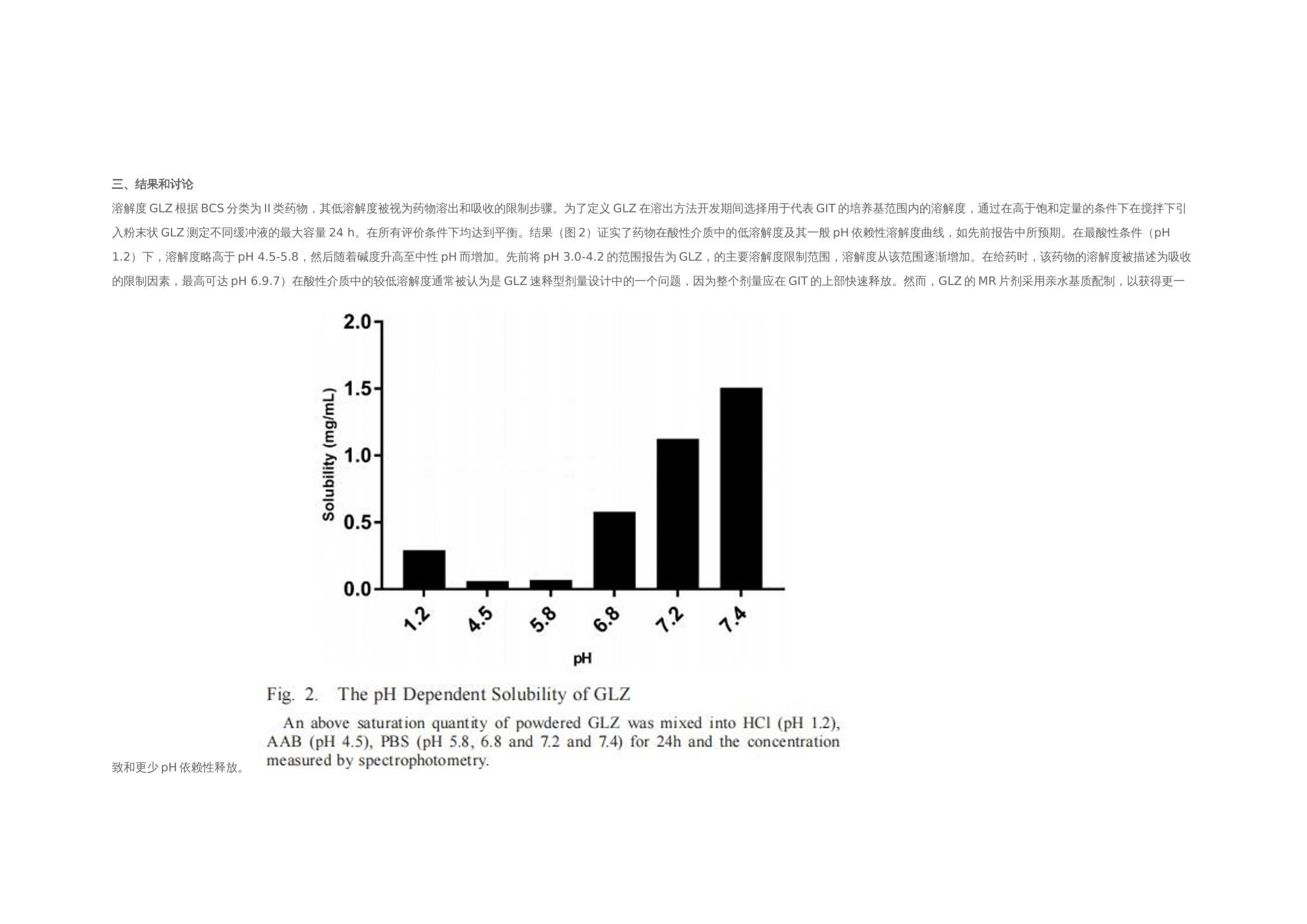
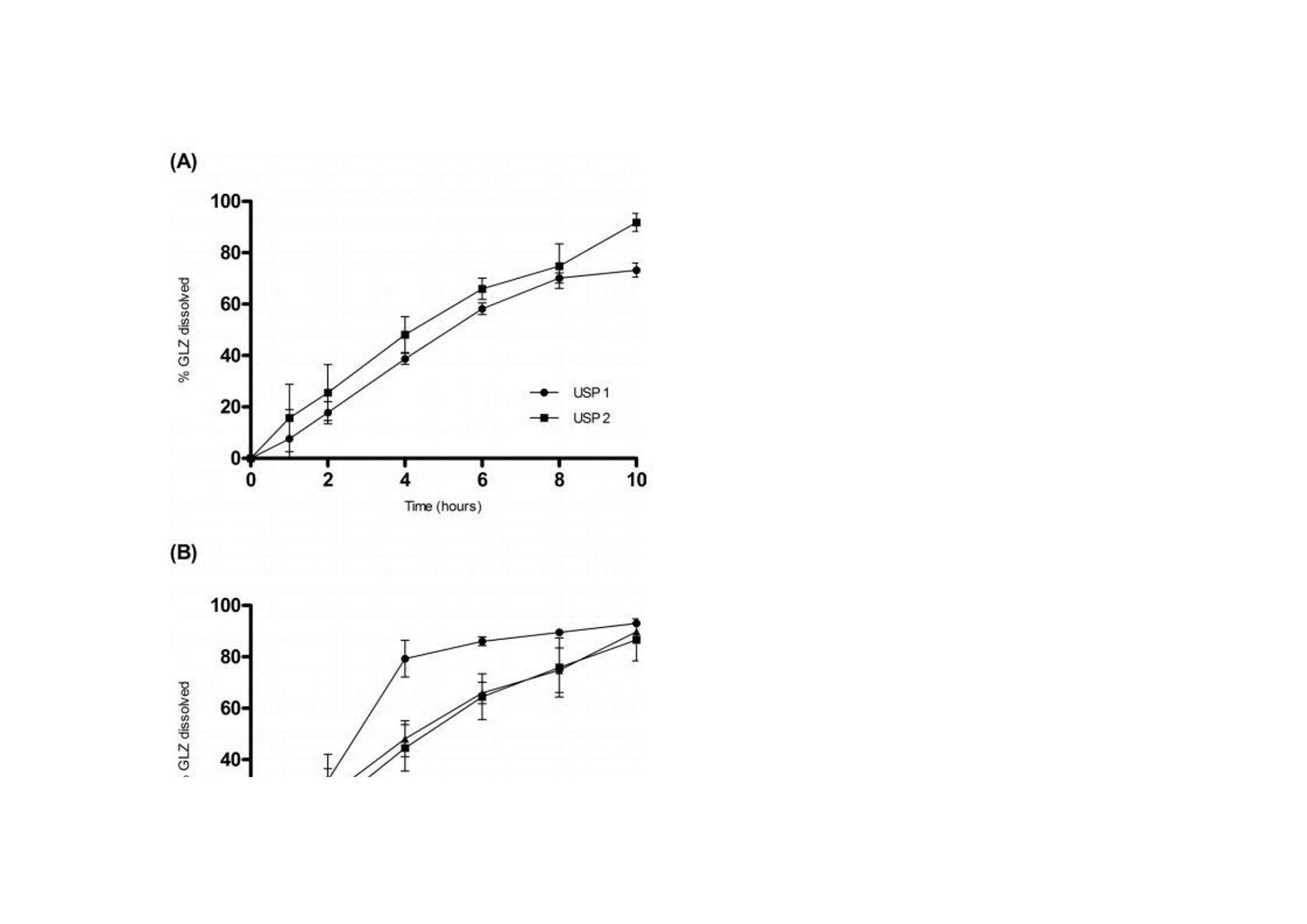
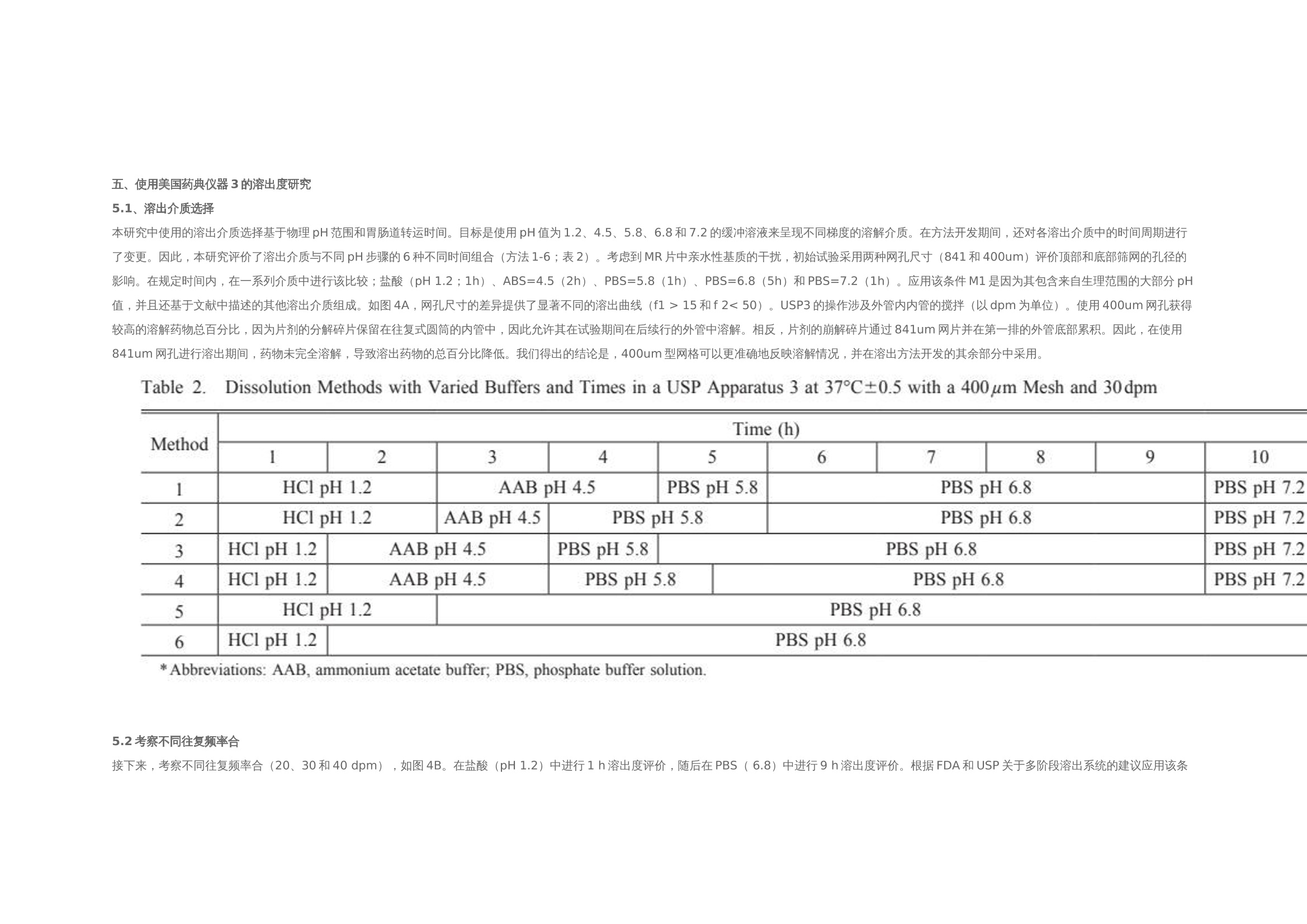
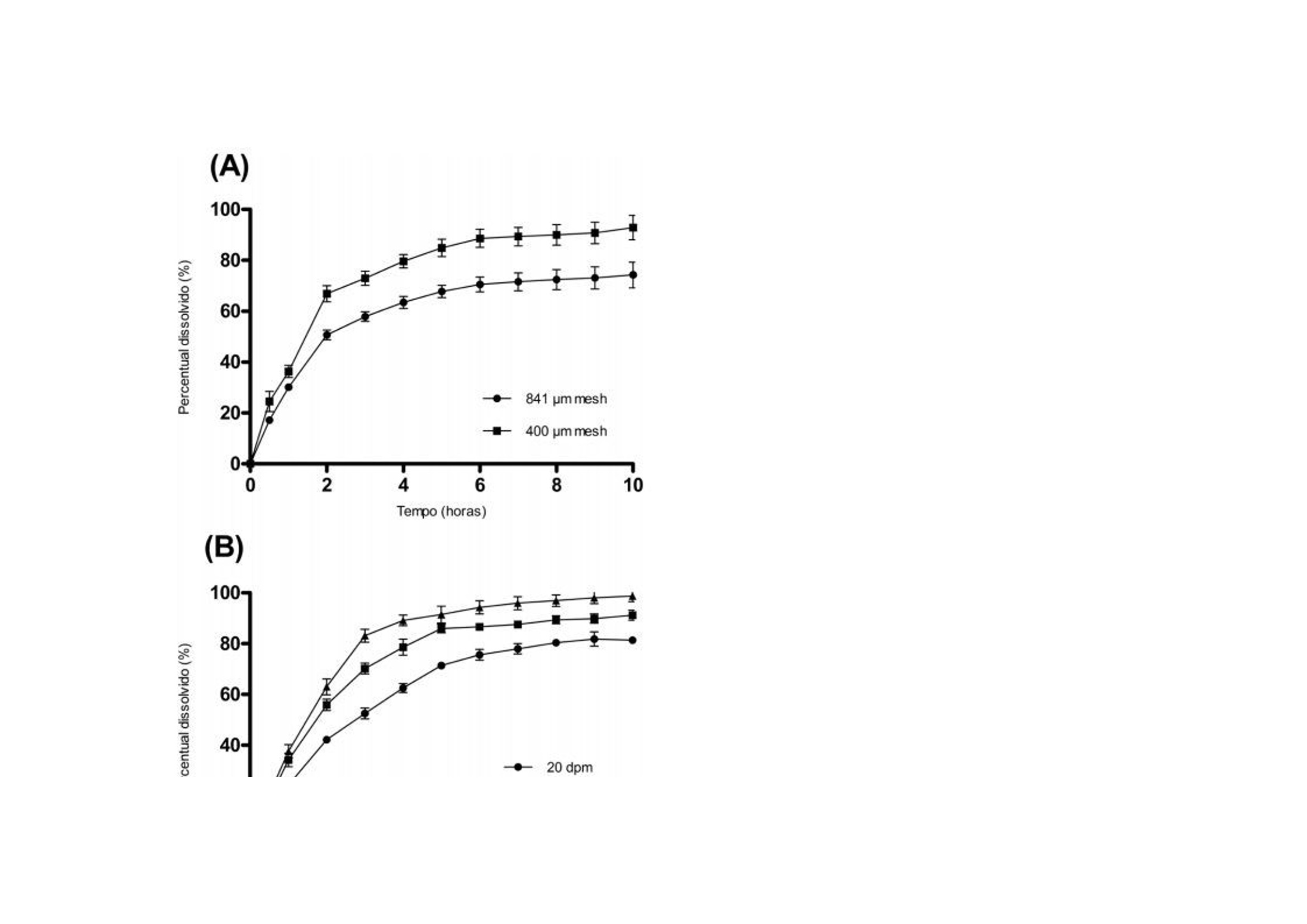
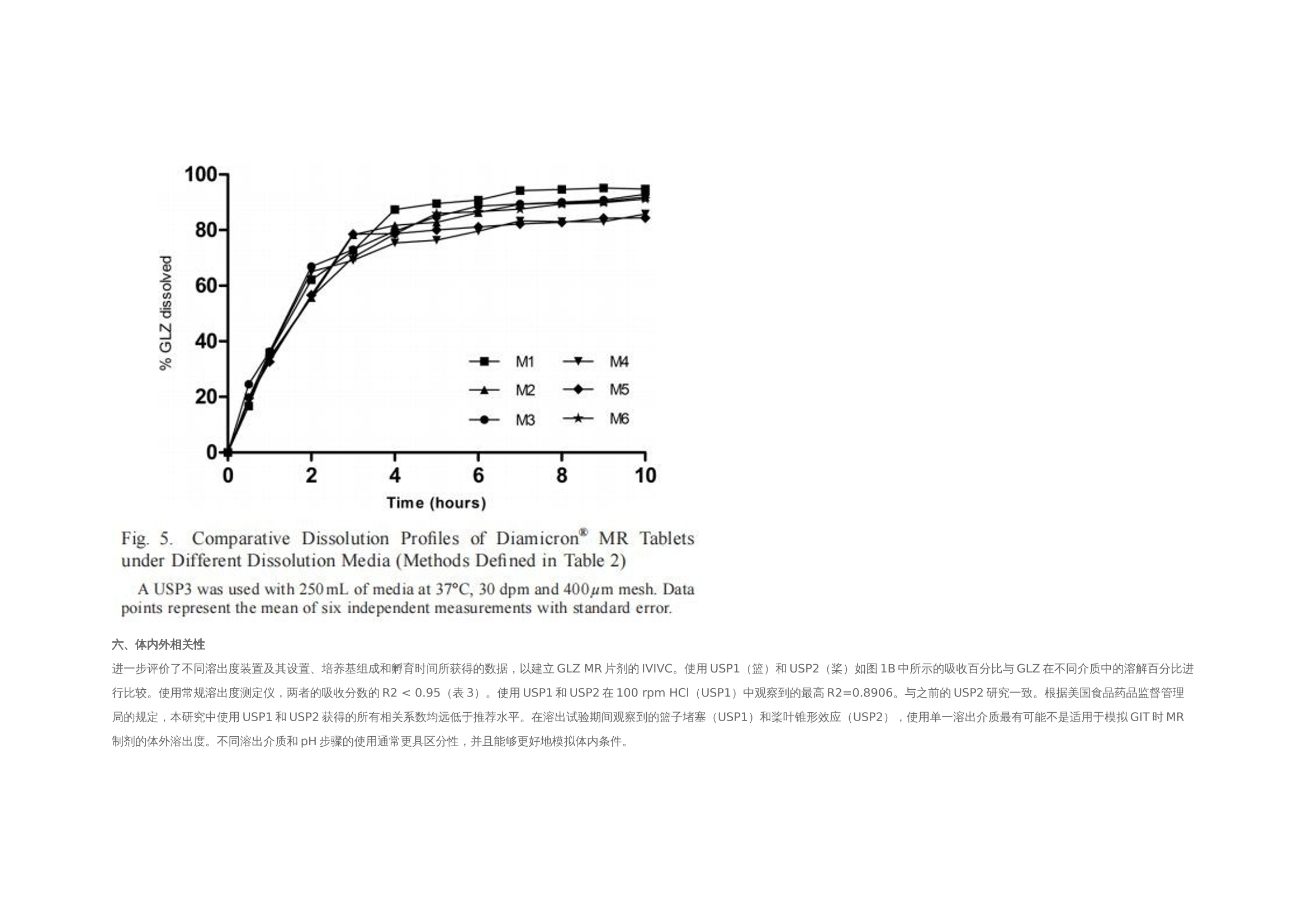
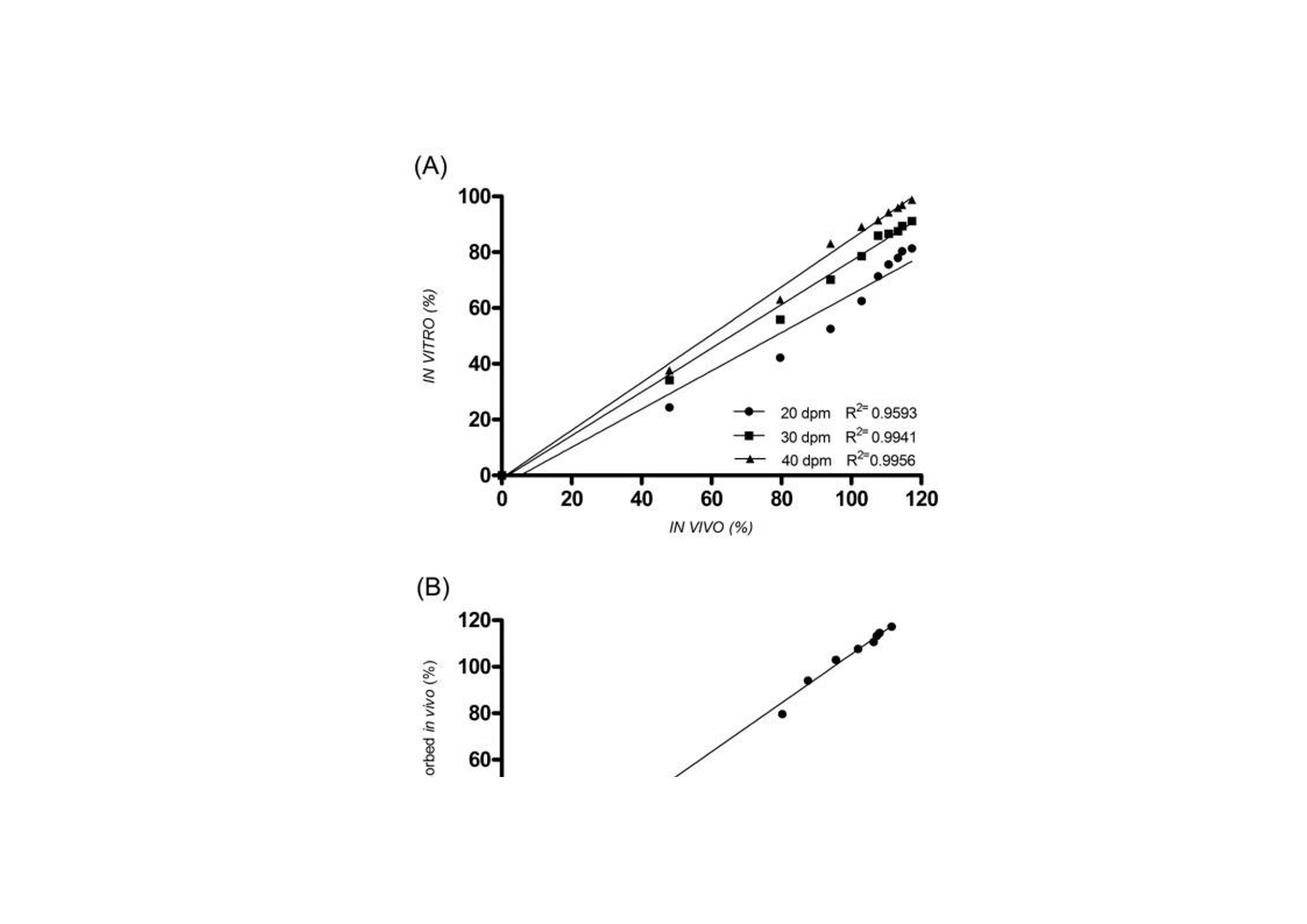
翻译:华溶-覃海娜审核:华溶-段云剑使用往复筒法开发具有体内外相关性的格列齐特缓释片的溶出度方摘要 格列齐特(GLZ)是第二代降血糖药物,用于治疗糖尿病型糖尿病。GLZ的低溶解度被认为药物溶出和吸收的速率限制步骤,因此基于具有区分力的溶出试验可预测其体内行为应导致相关的体外-体内相关性(IVIVC)。本研究的目的是通过IVIVC分析评价,使用美国药典(USP)装置3开发GLZ缓释(MR)片剂的溶出度方法。评价了各种溶出度参数,以建立GLZ片剂的体外溶出测定方法。最终溶出条件(称为方法3)在10h的总时间内使用了400um筛网和30dip/min的频率,包括在盐酸介质(pH 1.2)中的1h、在醋酸盐缓冲溶液(pH 4.5)中的2h、在磷酸盐缓冲溶液(pH 5.8)中的1h、在磷酸盐缓冲溶液(pH 6.8)中5h和磷酸盐缓冲溶液(pH 7.2)中1h。计算的点对点IVIVC(R2为0.9970)显著大于其他方法。方法3的稳健性表明其可用于药物等效性研究和GLZ的质量控制分析。一.简介格列齐特 (GLZ) 是一种第二代低血糖药物,广泛用于治疗非胰岛素依赖型糖尿病。1) 它通过刺激胰腺原代细胞分泌胰岛素发挥作用,并增加这些细胞对葡萄糖的敏感性。GLZ的一些化学性质如表1所示。该药物是一种弱酸性化合物,具有高度亲脂性,根据生物医学分类系统(BCS)分类为II类药物,溶解度低,渗透性高。GLZ的pH依赖性溶解度被认为是其在胃肠道中缓慢吸收的相关因素。为改善其可用性,将药物缓释片与亲水性基质配制,以获得活性药物成分在24h内的更一致和更少pH依赖性释放特征。制剂可在餐前、餐中或餐后给药。 溶出度是评价剂型质量、指导药物开发的重要工具,也可用于生物等效研究。在溶出方法开发期间,应评估体外参数,如表面活性剂的存在、pH、离子强度和培养基体积。溶出度测定仪器的选择对于建立溶出度测定方法也起着关键作用。美国药典装置3(往复筒)专门设计用于缓释片的溶出度评估,因为它可以模拟缓释片在GIT中发生的理化和机械变化。17-19此外,与美国药典第1号和第2号仪器相比,该仪器显示出更优越的流体动力学控制,并在仪器参数方面提供了许多选项,例如溶媒、pH和搅拌速率。 为了描述剂量形式的体外特征与体内反应之间的关系,使用预测数学模型定义体外-体内相关性(IVIVC)水平。A级IVIVC是可达到的最高相关水平,代表体外溶出度和体内吸收之间的点对点关系。这种相关性被认为比其他相关水平更具信息性,从监管角度来看是有用的。由于其与特定缓释片剂量形式暴露于体内的条件具有更大的相似性,因此使用USP3号装置似乎更合适,并且已被证明对开发生物相关溶出度方法具有前景。考虑到GLZ的低溶解度可能是其溶解和吸收的限速步骤,对GLZ的溶解和吸收进行了预测。基于使用生物相关介质的溶出度试验的体内行为应导致更相关的IVIVC。文献描述了使用美国药典装置2的GLZ-MR片剂的IVIVC,并建议美国药典装置3可能应用于GLZ-MR片剂。在此,我们使用USP装置3评价不同溶出度参数,以开发GLZ MR片剂的方法,并基于IVIVC报告了一种溶出度方法,该方法与GLZ模拟和质量控制的进一步研究中的潜在用途高度相关。据我们所知,这是第一份使用USP装置3描述GLZ MR片剂点对点IVIVC的报告。二.实验2.1化学品和试剂 GLZ参比标准品(纯度98%)购自Sigma-Aldrich(圣保罗,巴西)。从Tedia(巴西里约热内卢)获得盐酸、氯化钠、氢氧化钠、磷酸二氢钾和乙酸铵。含30 mg GLZ的GLZ-MR片剂在当地药店购买,由Diamicron®MR(菌落编号:3002512、巴西施维雅、巴西里约热内卢)和Azukon®MR(细菌编号BM202063,Torrent制药公司,里约热内卢,巴西)。Diamicron®MR的辅料为磷酸氢钙、羟丙甲纤维素、硬脂酸镁、麦芽糊精和二氧化硅,而Azukon®MR由磷酸氢钙、羟丙甲纤维素、聚维酮、硬脂酸镁、一水乳糖和二氧化硅组成。所有过滤程序均使用0.45个聚偏二氯乙烯过滤器过滤器(米利克斯米利博尔,圣保罗,巴西)。水通过Milli - Q水净化系统(Millipore,Bedford按照USP所述制备缓冲液。2.2样品测定方法 通过添加过量的GLZ粉末(约在37°C下使用低速磁力搅拌(50rpm)将50mg)添加至含10mL不同介质的烧杯中24小时。烧杯顶部覆盖有密封膜,以防止污染和蒸发。样品经过过滤、稀释,用紫外-可见分光光度计(Vankel, 50, Varian Inc., Palo Alto, CA, usa)在230 nm处测定浓度。30)评估介质为:盐酸(pH 1.2);醋酸盐缓冲液(ABS;pH 4.5);pHs值为5.8、6.8、7.2和7.4的磷酸盐缓冲液(PBS值)。使用浓度2.5、5.0、10.0、12.5和15.0(μ g/mL)制备各条件下的五级校准曲线。全部测量一式三份。2.2.1使用USP装置1和2(篮式和桨式)进行溶出度研究 使用旋转篮式(USP装置1;USP1)和旋转桨叶(美国药典装置2;USP2)在Hanson Research SR6溶出度测定仪(Hanson Research Corp.,美国加利福尼亚州查茨沃斯).溶出条件包括900 mL培养基(盐酸pH 1.2;PBS=6.8和7.4),转速为100转/分,温度为37±0.5°C,持续10小时。在第1、2、4、6、8和10h使用10μ m导管过滤器抽取5mL等分试样,根据药典通过紫外分光光度法进行体积稀释和GLZ分析。制备浓度为0.6、2.5、7.5、12.5、15.0 mL的五水平曲线,所有测量均一式三份。制备各条件下的五级校准曲线,全部测量一式三份。2.2.2使用USP装置3(往复式圆筒)对30mg GLZ MR片剂进行溶出度研究(Diamicron®MR,参比产品;使用往复式圆筒装置(美国药典第3部分(USP3);生物制品瓦里安公司,CA,美国)在37±0.5℃的250ml介质中进行。比较了顶部和底部筛网的两种筛目尺寸(841μm和400μm)。还评价了20、30和40次浸渍/分钟(dpm)的不同搅拌条件。溶液和pH步骤在pH 1.2-7.2的生理范围内变化。该系列缓冲液包括HCl(pH 1.2)该系列缓冲液由HCl (pH 1.2)、ABS (pH 4.5)和PBS (pH 5.8、6.8或7.2)组成。使用5s的排水时间和保持浸渍时间对仪器进行编程。在不更换介质的情况下,每小时手动收集5 mL等分试样。取样时,将圆筒置于溶出介质上方30 s。采集后,过滤样品(0.45 M膜),体积稀释,测定上述溶解药物的百分比。根据校准曲线计算GLZ的累积百分比。在6份重复样品中进行实验,并将最终条件应用于GLZ的类似制剂。从先前报告的药代动力学研究中获得了空腹条件下GLZ的体外-体内相关性生物利用度数据。使用瓦格纳- Nelson16,25,31的数值反卷积法估计药物吸收(公式1). 采用这种具有一级吸收和消除的分布模型,因为它是最适合单室drugs25)的模型,并且已证明能够充分描述药代动力学格列齐特的特征。其中Ct为规定时间(t)的血浆浓度,Ke为消除速率常数。AUC0 →t是从0到时间t的曲线下面积,AUC0 →inf是从0到无穷大的曲线下面积。GLZ MR片剂的血浆浓度(ng/mL)和吸收分数(%)见图1(A)。根据溶出度结果获得体外溶出药物的百分比。基于使用微软Office Excel® 2010(微软公司,美国华盛顿州雷德蒙德)进行的线性系统分析的IVIVC。使用体外溶出速率与药物体内吸收之间的点对点关系(1至10 h)比较体内和体外数据。根据已公布的美国食品药品监督管理局(FDA)指南,对点对点IVIVC(A级)进行了研究。统计分析计算装置1、2和3中溶解的GLZ的累积量,同时考虑培养基的不替换。使用线性回归分析的平均值计算相关系数(R)(微软公司,美国华盛顿州雷蒙德)。使用单因素ANOVA(GraphPad棱镜5.0软件,GraphPad,美国加利福尼亚州拉荷拉)比较了GLZ的溶出曲线。)根据p值评价相似性和差异,其中p > 0.05表示相似性,p<0.05表示统计学差异。使用差异(f1)和相似性(f2)因子进一步评价数据,监管机构广泛采用这些因子来指示溶出曲线之间的相似性。溶出曲线之间的数值超出f1=0至5和f2=50至100的规定范围之外的值表示溶解剖面之间的差异。三.结果和讨论溶解度GLZ根据BCS分类为II类药物,其低溶解度被视为药物溶出和吸收的限制步骤。为了定义GLZ在溶出方法开发期间选择用于代表GIT的培养基范围内的溶解度,通过在高于饱和定量的条件下在搅拌下引入粉末状GLZ测定不同缓冲液的最大容量24 h。在所有评价条件下均达到平衡。结果(图2)证实了药物在酸性介质中的低溶解度及其一般pH依赖性溶解度曲线,如先前报告中所预期。在最酸性条件(pH 1.2)下,溶解度略高于pH 4.5-5.8,然后随着碱度升高至中性pH而增加。先前将pH 3.0-4.2的范围报告为GLZ,的主要溶解度限制范围,溶解度从该范围逐渐增加。在给药时,该药物的溶解度被描述为吸收的限制因素,最高可达pH 6.9.7)在酸性介质中的较低溶解度通常被认为是GLZ速释型剂量设计中的一个问题,因为整个剂量应在GIT的上部快速释放。然而,GLZ的MR片剂采用亲水基质配制,以获得更一致和更少pH依赖性释放。四.使用USP装置1和2进行的溶出度研究到目前为止描述了GLZ的单一官方溶出度方法用于英国药典中的IR片剂。该方法建议在100转/分和900 mL PBS(pH 7.4)下使用USP2。这些参数最初适用于检测GLZ片剂的MR制剂。USP1和USP2的比较(图3A),在10小时内测定GLZ MR片剂的溶出曲线。与达到约95%最终水平的USP1相比,使用USP2时一致观察到更高百分比的溶解药物。USP1的溶出曲线平台约为77%(f1= 20.93)。篮法与桨法之间的差异可能与基质片剂与篮式装置的相互作用有关。先前关于使用USP1评价含亲水性基质的药物配方(如本文研究的GLZMR片剂)的报告表明,剂量基质形式的水化和溶胀可堵塞保留篮,可能破坏溶出的流体动力学,从而降低溶解药物的总百分比。 由于GLZ在USP2中的溶出度较高以及药物释放速率与培养基组成的相关性,在USP2中测定了三种不同培养基的溶出曲线,维持了其他变量(图3b)。培养基组成反映了那些最常用于鉴别溶出方法的组成,并且代表了胃和小肠状况的生物相关模拟,其中GLZ的大部分吸收发生在胃和小肠条件下。在初始采样时间点1 h,所有三种培养基的溶出水平均相等,2 h内无显著差异。值得一提的是,在盐酸中观察到溶出药物百分比出现统计学显著性较大增加,在HCl (pH 1.2;与pH 6.8 (f1=48.29;f2 = 37.40)和PBS pH值7.4 (f1 = 39.41; f2 = 39.85)。在两种ph值下,溶解的GLZ在PBS中的分布在整个时间过程中表现出相似的模式,最终达到的百分比略低于HCl。Priya和Murthy5)在其GLZ-MR片剂研究中观察到相同的行为,并报告GLZ-MR片剂在供试缓冲液中的溶解度结果与释放速率之间无特定相关性。因此,这表明辅料可能对GLZ-MR片剂的溶解度和溶出速率产生影响,尤其是在酸性介质中。此外,该观察结果与Harrower8的报告一致)这表明GLZ-MR片剂的溶出度由制剂控制。该信息是我们研究中溶出度pH步骤组成的重要指南。 根据搅拌速率和药物制剂,USP装置2可能存在一些缺点,例如本研究中观察到的锥状现象。这种现象的特征是在溶出容器底部形成锥形,由研究药物的可见颗粒组成,由系统的弱搅拌能力引起。这些颗粒不会适当溶解,可降低剂量形式溶出的总百分比。因此,有必要评估GLZ -MR片的其他溶出装置,例如专门设计用于MR剂量形式的装置3。尽管USP1和USP2未显示出反映体内条件的理想流体动力学条件,但其用于评价不同溶出介质中的使用对我们的研究很重要。它提供了对GLZ-MR剂量形式溶出曲线的理解,指导了我们对溶出介质组成、pH步骤和使用USP3仪器使用的每种介质的时间周期的定义。‍‍五.使用美国药典仪器3的溶出度研究‍‍5.1溶出介质选择 本研究中使用的溶出介质选择基于物理pH范围和胃肠道转运时间。目标是使用pH值为1.2、4.5、5.8、6.8和7.2的缓冲溶液来呈现不同梯度的溶解介质。在方法开发期间,还对各溶出介质中的时间周期进行了变更。因此,本研究评价了溶出介质与不同pH步骤的6种不同时间组合(方法1-6;表2)。考虑到MR片中亲水性基质的干扰,初始试验采用两种网孔尺寸(841和400um)评价顶部和底部筛网的孔径的影响。在规定时间内,在一系列介质中进行该比较;盐酸(pH 1.2;1h)、ABS=4.5(2h)、PBS=5.8(1h)、PBS=6.8(5h)和PBS=7.2(1h)。应用该条件M1是因为其包含来自生理范围的大部分pH值,并且还基于文献中描述的其他溶出介质组成。如图4A,网孔尺寸的差异提供了显著不同的溶出曲线(f1 > 15和f 2< 50)。USP3的操作涉及外管内内管的搅拌(以dpm为单位)。使用400um网孔获得较高的溶解药物总百分比,因为片剂的分解碎片保留在往复式圆筒的内管中,因此允许其在试验期间在后续行的外管中溶解。相反,片剂的崩解碎片通过841um网片并在第一排的外管底部累积。因此,在使用841um网孔进行溶出期间,药物未完全溶解,导致溶出药物的总百分比降低。我们得出的结论是,400um型网格可以更准确地反映溶解情况,并在溶出方法开发的其余部分中采用。5.2考察不同往复频率合 接下来,考察不同往复频率合(20、30和40 dpm),如图4B。在盐酸(pH 1.2)中进行1 h溶出度评价,随后在PBS( 6.8)中进行9 h溶出度评价。根据FDA和USP关于多阶段溶出系统的建议应用该条件,其中溶出通常采用1或2 h耐酸步骤,然后采用碱性步骤加磷酸盐缓冲溶液进行基本步骤,长达12 h。此外,这种情况常见于MR制剂中经常被引用。随着往复速率的增加,观察到溶解药物增加。20 dpm的浸没率在溶出结束时呈现出较低的药物溶出百分比,其平台未达到80%的药物溶出,表示溶出不完全。此外,认为20 dpm时的溶出度与30 dpm有统计学差异(f1= 20.82;f2=43.21;p > 0.001)和40 dpm(f 1= 28.90;f2=33.52;p > 0.001)。30和40 dpm无显著性差异 (f1 = 10.21;F=54.98;p > 0.05)。30和40 dpm均显示药物总溶解百分比大于90%。尽管两小时后40dpm的绝对水平高,但选择30dpm的浸没率用于使用不同介质/pH评价GLZ-MR片剂在USP3中的溶出度,以提供更温和的搅动,这可能更具区分性。 确定筛网尺寸和搅拌速率后,评价了溶出介质与不同pH步骤的六种不同时间组合(方法1-6;表2);(图5). 如前所述,选择这些介质来代表生理pH范围和胃肠道传输时间。溶出方法(包括在HCl(pH 1.2)中的1小时或2小时)分别约35%和58%的GLZ溶出。一般而言,观察到在HCl(pH 1.2)和AAB(pH 4.5)介质中的时间决定了GLZ的最终溶解百分比。这些方法之间的一致性差异是酸性步骤的持续时间。M1、M2、M3和M6在统计学上相似(f1≤5;f2 > 50;p < 0.05)。M4和M5的药物溶出百分比均较低,其溶出平台也未达到85%。此外,这两种方法与M1和M3相比具有统计学差异(分别为p < 0.001和p < 0.01),因此未选择用于进一步研究。还值得注意的是,在M1和M2中酸性步骤中使用2小时导致在溶解第3小时结束时几乎80%的药物溶解。总体而言,基于最终溶出度百分比和溶出曲线形状相似性,M1、M2、M3和M6似乎适合评价GLZ-MR片剂。然而,使用USP3进一步细化理想溶出条件需要与生物利用度数据相关。六.体内外相关性进一步评价了不同溶出度装置及其设置、培养基组成和孵育时间所获得的数据,以建立GLZ MR片剂的IVIVC。使用USP1(篮)和USP2(桨)如图1B中所示的吸收百分比与GLZ在不同介质中的溶解百分比进行比较。使用常规溶出度测定仪,两者的吸收分数的R2 < 0.95(表3)。使用USP1和USP2在100 rpm HCl(USP1)中观察到的最高R2=0.8906。与之前的USP2研究一致。根据美国食品药品监督管理局的规定,本研究中使用USP1和USP2获得的所有相关系数均远低于推荐水平。在溶出试验期间观察到的篮子堵塞(USP1)和桨叶锥形效应(USP2),使用单一溶出介质最有可能不是适用于模拟GIT时MR制剂的体外溶出度。不同溶出介质和pH步骤的使用通常更具区分性,并且能够更好地模拟体内条件。我们的重点转向采用USP3和浸没速率对IVIVC的影响,如图6 a,表明三种速率中每种速率的关系数均较高(R > 0.95)。2如前所述,选择30 dpm的浸没速率进行进一步研究,以产生物理搅动的最低水平和温和的溶出条件。根据不同溶出度方法1-6的图(表3),每种方法还显示GLZ MR 片具有高度相关性。最终,方法3呈现最高的相关系数(R = 0.9970;图26 b)在本研究中进行的所有溶出度试验中,因此,选择其作为我们确定GLZ MR片剂IVIVC的最佳溶出度条件。MR格列齐特片剂具有约100%的生物利用度、线性药代动力学和单室模型,见图1A. 在口服给药后的前6小时内观察到血浆浓度升高,随后在第6至12小时达到平台期。我们的体外溶出度研究也证实了这一规律。明确观察到体内吸收分数和体外溶解分数曲线重叠,并通过建立点对点IVIVC(A级)反映,表明溶出试验条件能够模拟体内性能。结果还证明了USP3模拟能够模拟MR剂型GIT条件的能力,以及该装置用于开发GLZ-MR剂量形式的体外溶出试验的适用性。最后,使用USP3(方法3,30 dpm,400um)将具有最高IVIVC的溶出度方法应用于Azukon®MR30 mg(一种类似制剂),以验证该方法在GLZ-MR剂量形式的质量控制和药物等效性分析中的应用潜力。参比与相似MR片剂的溶出曲线之间的相似性见图7. 在10 h结束时(f1=6.26和f2=65.74),从Azukon®MR片剂中溶出的GLZ百分比达到95.45% ±2.95,证实了其药物等效性,并证实了使用USP3仪器用于MR-GLZ剂量形式的溶出方法的适用性。七.结论USP3是建立GLZ-MR剂型IVIVC最合适的仪器。在使用该仪器执行的所有方法中,我们观察到高水平的溶解药物(Q > 85%)获得高的相关系数(R2 > 0.95)。最终溶出条件为在30dpm的搅拌速率下,在一系列由HCl(pH 1.2;1h),ABS(pH 4.5;2h),PBS值(pH 5.8;1h),PBS(6.8 pH;5 h)和PBS(pH 7.2;提供了与pH步骤在GIT中的体外等同性。该方法显示了最高相关系数(R2=0.9970),并提供了点对点IVIVC(A级)。开发稳健的溶出度方法用于MR剂量形式的GLZ在药物等效性研究和质量控制方面具有潜在的应用价值。八.参考文献
确定
















还剩20页未读,是否继续阅读?
深圳市华溶分析仪器有限公司 为您提供《使用往复筒法开发具有体内外相关性的格列齐特缓释片的溶出度方法》,该方案主要用于化药制剂中含量测定检测,参考标准--,《使用往复筒法开发具有体内外相关性的格列齐特缓释片的溶出度方法》用到的仪器有华溶自动往复筒法溶出系统DS-BIOAT
推荐专场
相关方案
更多
该厂商其他方案
更多















