方案详情
文
背景
细菌培养基的光密度( OD) 测定是微生物学中使用的
一种常见技术。 研究人员主要依靠分光光度计来进行
这些测定, 然而实际上这个测定是基于培养基的光散
射量而不是光吸收量。 在其标准配置中, 分光光度计
并未对光散射测定进行优化, 这通常会导致仪器间所
测得吸光度上的差异。
方法
该研究调查了不同的分光光度计光学配置对在分批培
养基中生长的大肠杆菌JM109光密度测定的影响。
分光光度计检测包括了使用阵列检测的反向光学系
统、 基于单色器的传统系统以及一种配备积分球配件
( ISA) 的单色器系统。 在每个仪器上测定OD600生
长曲线, 同时, 对McFarland进行CFU/mL计数来进一
步对每个光学系统进行鉴定。
结果
来自相同光学配置类别的分光光度计其OD数据是相当
的。 用反向光学系统测定较高OD时数据变化更大,
这是由较低杂散光所导致。 基于单色器的系统测试较
高OD时准确度较高, 主要是因为与来自反向光学系统
的多色光相比, 单色光具有更好的杂散光去除能力。
然而, 反向光学系统测定OD时却有具有良好的动态
范围。 使用ISA产生出的数据与用其它系统产生出的
数据不同, 这是因为其具有捕捉几乎所有前向散射光
的能力。 而对McFarland标准品的测定确认了这些现
象。
结论
分光光度计进行可靠的光散射测定的能力在很大程度
上取决于其光学配置; 因此, 具有不同光学配置的分
光光度计会呈现出不同的OD测定值。 理想状态下, 高
度散射样品( 如细胞培养基) 的吸光度是使用ISA进
行测定的, 目的是为了捕捉几乎所有的散射光。 培养
基生长可使用OD600测定, 然而每当改变分光光度计
时, 就应该计算和应用一个换算因数。
方案详情

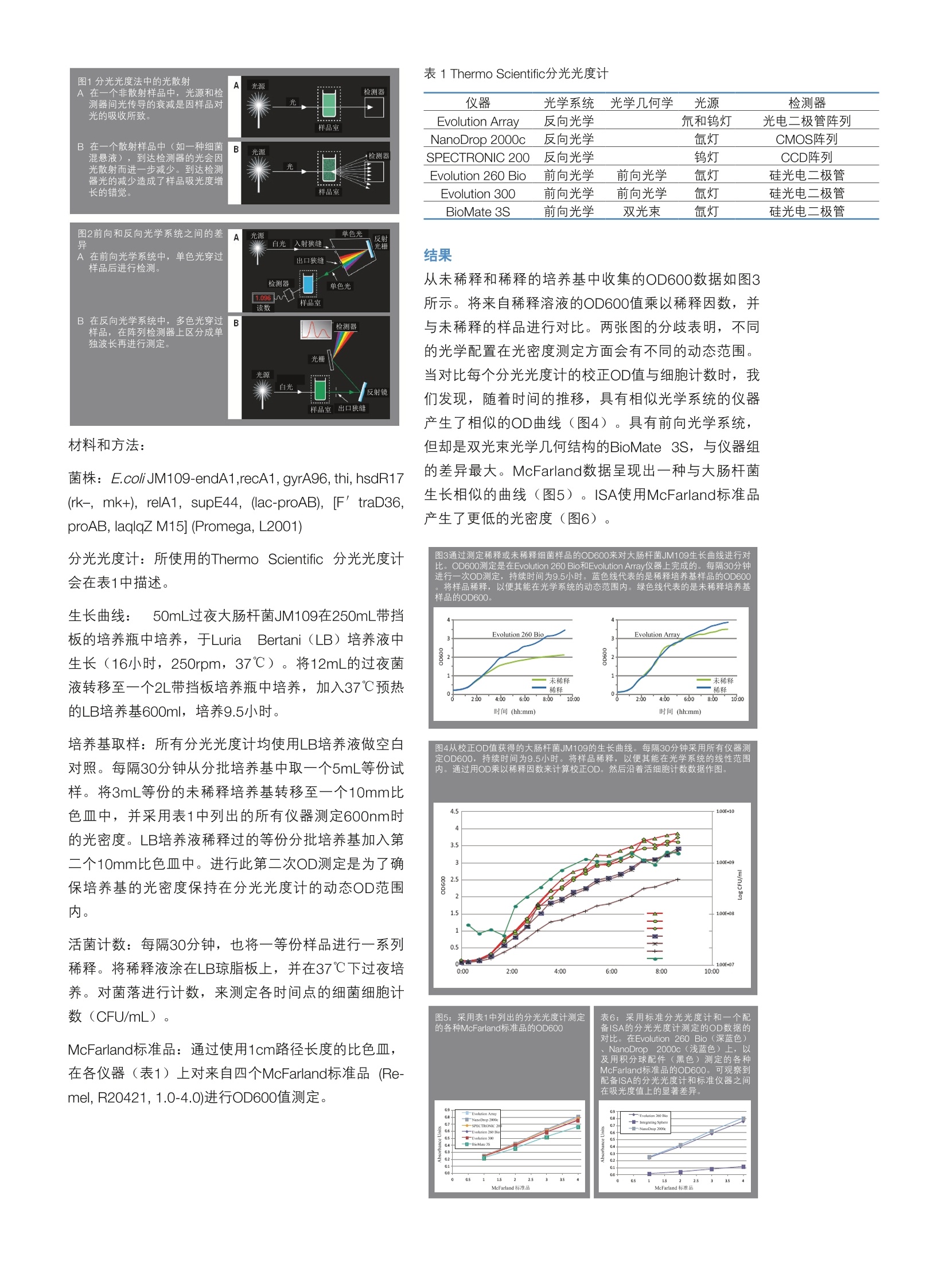
Brian C. Matlock1, Richard W. Beringerl, David L. Ash1, Michael W. Allen?andAndrew F. Page 1ThermoFisher Scientific, UV-Vis/Fluor-Molecular Spectroscopy, Wilmington, DE.ThermoFisher Scientific,UV-Vis/Fluor-Molecular Spectroscopy, Madison, Wl. 背景 细菌培养基的光密度(OD)测定是微生物学中使用的一种常见技术。研究人员主要依靠分光光度计来进行这些测定,然而实际上这个测定是基于培养基的光散射量而不是光吸收量。在其标准配置中,分光光度计并未对光散射测定进行优化,这通常会导致仪器间所测得吸光度上的差异。 方法 该研究调查了不同的分光光度计光学配置对在分批培养基中生长的大肠杆菌JM109光密度测定的影响。分光光度计检测包括了使用阵列检测的反向光学系统、基于单色器的传统系统以及一种配备积分球配件(ISA)的单色器系统。在每个仪器上测定OD600生长曲线,同时,对McFarland进行CFU/mL计数来进一步对每个光学系统进行鉴定。 结果 来自相同光学配置类别的分光光度计其OD数据是相当的。用反向光学系统测定较高OD时数据变化更大,这是由较低杂散光所导致。基于单色器的系统测试较高OD时准确度较高,主要是因为与来自反向光学系统的多色光相比,单色光具有更好的杂散光去除能力。然而,反向光学系统测定OD时却有具有良好的动态范围。使用ISA产生出的数据与用其它系统产生出的数据不同,这是因为其具有捕捉几乎所有前向散射光的能力。而对McFarland标准品的测定确认了这些现象。 结论 分光光度计进行可靠的光散射测定的能力在很大程度上取决于其光学配置;因此,具有不同光学配置的分光光度计会呈现出不同的OD测定值。理想状态下,高度散射样品(如细胞培养基)的吸光度是使用ISA进行测定的,目的是为了捕捉几乎所有的散射光。培养 基生长可使用OD600测定,然而每当改变分光光度计时,就应该计算和应用一个换算因数。 引言 培养基中细菌生长(迟缓期、对数生长期、稳定生长期和衰亡期)各个阶段都能记录下来,其中对数期被认为是细菌分裂最快的阶段(1)。使用分光光度计测定细菌培养基在600nm (OD600)时的光密度,从而监控细菌生长一直是微生物学中的一种核心技术。使用细菌OD600的三种更为常见的应用如下: (a)在细菌表达蛋白质时,找到诱导蛋白的最佳时间,(b)用于最小抑菌浓度(MIC)实验的接种体浓度的确定和标准化,和(c)收获和制备感受态细胞的最佳时间的确定。研究人员继续依靠分光光度计进行这些OD测定。然而,光密度不是一个吸光度指标,而是细菌混悬液的一种光散射指标,将其自身作为吸光度显示(图1)。分光光度计光学配置对光密度测定的影响得到了很好的记录(2-4)。具有不同光学配置的仪器对同一细菌混悬液测定得到了不同的光密度。分光光度计光学配置上的差异对观察到的差异影响最大。前向光学系统采用单色光来进行吸光度的测定,而反向光学系统则利用多色辐射进行测定,光在其穿过样品后再区分成单独波长(图2)。前向光学系统的一些要素导致了测得OD值上的差异: (a)样品与检测器之间的距离, (b)聚光透镜的尺寸和焦距大小不同,和(c)检测器的面积和灵敏度(5)。尽管现在都知道不同的光学配置会产生不同的OD值,但是研究人员仍继续关注在不同分光光度计间发现的OD值差异。在本研究中,我们分析了多种光学配置分光光度计测出的OD值差异。我们在分批培养基中培养大肠杆菌JM109,并监控OD达9.5小时。在测定之前稀释培养基,并将由于不同分光光度计光学元件差异造成的不同OD值进行换算。 材料和方法: 菌株: E.coliJM109-endA1,recA1, gyrA96, thi, hsdR17(rk-, mk+), relA1, supE44, (lac-proAB), [F'traD36,proAB, laqlqZ M15] (Promega, L2001) 分光光度计:所使用的Thermo Scientific 分光光度计会在表1中描述。 生长曲线: 50mL过夜大肠杆菌JM109在250mL带挡板的培养瓶中培养,于Luria Bertani(LB)培养液中生长(16小时, 250rpm, 37℃)。将12mL的过夜菌液转移至一个2L带挡板培养瓶中培养,加入37℃预热的LB培养基600ml,培养9.5小时。 培养基取样:所有分光光度计均使用LB培养液做空白对照。每隔30分钟从分批培养基中取一个5mL等份试样。将3mL等份的未稀释培养基转移至一个10mm比色皿中,并采用表1中列出的所有仪器测定600nm时的光密度。LB培养液稀释过的等份分批培养基加入第二个10mm比色皿中。进行此第二次OD则定是为了确保培养基的光密度保持在分光光度计的动态OD范围内。 活菌计数:每隔30分钟,也将一等份样品进行一系列稀释。将稀释液涂在LB琼脂板上, 并在37℃下过夜培养。对菌落进行计数,来测定各时间点的细菌细胞计数(CFU/mL)。 McFarland标准品:通过使用1cm路径长度的比色皿,在各仪器(表1)上对来自四个McFarland标准品 (Re-mel, R20421, 1.0-4.0)进行OD600值测定。 表1 Thermo Scientific分光光度计 仪器 光学系统 光学几何学 光源 检测器 Evolution Arrav 反向光学 氘和钨灯 光电二极管阵列 NanoDrop 2000c 反向光学 氙灯 CMOS阵列 SPECTRONIC 200 反向光学 钨灯 CCD阵列 Evolution 260 Bio 前向光学 前向光学 氙灯 硅光电二极管 Evolution 300 前向光学 前向光学 氙灯 硅光电二极管 BioMate 3S 前向光学 双光束 氙灯 硅光电二极管 结果 从未稀释和稀释的培养基中收集的OD600数据如图3所示。将来自稀释溶液的OD600值乘以稀释因数,并与未稀释的样品进行对比。两张图的分歧表明,不同的光学配置在光密度测定方面会有不同的动态范围。当对比每个分光光度计的校正OD值与细胞计数时,我们发现,随着时间的推移,具有相似光学系统的仪器产生了相似的OD曲线(图4)。具有前向光学系统,但却是双光束光学几何结构的BioMate 3S,与仪器组的差异最大。McFarland数据呈现出一种与大肠杆菌生长相似的曲线(图5)。ISA使用McFarland标准品产生了更低的光密度(图6)。 图3通过测定稀释或未稀释细菌样品的OD600来对大肠杆菌JM109生长曲线进行对 比。OD600测定是在Evolution 260 Bio和Evolution Array仪器上完成的。每隔30分钟 图4从校正OD值获得的大肠杆菌JM109的生长曲线。每隔30分钟采用所有仪器测定OD600,持续时间为9.5小时。将样品稀释,以便其能在光学系统的线性范围内。通过用OD乘以稀释因数来计算校正OD。然后沿着活细胞计数数据作图。 结论 ·计算OD测定值时,确定您所用分光光度计的光密度性能和动态范围是至关重要的。为获得有关生长曲线的最准确信息,稀释细胞混悬液是很重要的。 ( ·OD测定在很大程度上取决于光学系统和几何学。对于相同的混悬液,具有不同光学系统和配置的分光 光度计会读出不同的OD值。例如,在反向光学系统 Evolution Array和前向光学系统,双光束BioMate 3S 之间有实质性的分歧。 ) ( 。积分球配件(ISA)可捕捉几乎所有的前向散射光, 从而产生了更低的光密度。这是因为通常看起来被样品吸收的散射光实际上是被ISA配件所收集。 ISA对测定高度散射溶液中分析成分的吸光度是理想之选;然而,在测定细胞混悬液的光密度时,其是无 效的。 ) ·最后,我们提出了如何计算一个可用于使OD数据标准化,以便能在不同分光光度计间进行适当比较的换算因数。值得注意的是,这个换算因数是针对一种特定的有机体,因为微粒的尺寸和形状会影响换算因数。 ( 参考文献 ) ( 1. Daniel R. Caldwell, M icrobial P hysiology and Meta-bolism (Wm. C . B rown Publishers, 1 995), 55-59 ) ( 2. Arthur L. Koch. , “Turbidity Measurements o f Bac- terial Cultures i n Some Available Commercial I n stru- ments,” A n alytical Biochemistry 38 (1970): 252-59 ) ( 3. Arthur L. Koch, “Theory of the Angular Dependenceof Light Scattered by Bacteria and Similar-sized Bi o -logical Objects,” Journal o f Theoretical Biology 1 8(1968) : 133-56 ) ( 4. J.V. Lawrence a nd S. M aier, “Correction for the I n-herent Error in Optical Density Readings,” Ap p liedand Environmental Microbiology Feb. (1977):482-8 4 ) ( 5. Gordon Bain. “Measuring Turbid Samples and Tur-bidity wit h UV-Visible Spectrophotometers,” Ther- mo Scientific Technical Note 51811. ) @2016赛默飞世尔科技。版权所有。所有商标属于赛默飞世尔科技及其子公司。规格、条款和定价或按情况改变。不是所有的国家都能购买到所有的产品。欲知详情,请咨询您当地的销售代表。 赛默飞世尔科技 S CIENTIFIC 热线电话:ales.cad@thermofisher.comwww.thermofisher.comSCIENTIFICPart of Thermo Fisher Scientific 引言培养基中细菌生长( 迟缓期、 对数生长期、 稳定生长期和衰亡期) 各个阶段都能记录下来, 其中对数期被认为是细菌分裂最快的阶段( 1)。 使用分光光度计测定细菌培养基在600nm( OD600) 时的光密度, 从而监控细菌生长一直是微生物学中的一种核心技术。使用细菌OD600的三种更为常见的应用如下:( a)在细菌表达蛋白质时, 找到诱导蛋白的最佳时间,( b) 用于最小抑菌浓度( MIC) 实验的接种体浓度的确定和标准化, 和( c) 收获和制备感受态细胞的最佳时间的确定。 研究人员继续依靠分光光度计进行这些OD测定。 然而, 光密度不是一个吸光度指标, 而是细菌混悬液的一种光散射指标, 将其自身作为吸光度显示( 图1)。 分光光度计光学配置对光密度测定的影响得到了很好的记录( 2-4)。 具有不同光学配置的仪器对同一细菌混悬液测定得到了不同的光密度。分光光度计光学配置上的差异对观察到的差异影响最大。 前向光学系统采用单色光来进行吸光度的测定,而反向光学系统则利用多色辐射进行测定, 光在其穿过样品后再区分成单独波长( 图2)。 前向光学系统的一些要素导致了测得OD值上的差异:( a) 样品与检测器之间的距离,( b) 聚光透镜的尺寸和焦距大小不同, 和( c) 检测器的面积和灵敏度( 5)。 尽管现在都知道不同的光学配置会产生不同的OD值, 但是研究人员仍继续关注在不同分光光度计间发现的OD值差异。 在本研究中, 我们分析了多种光学配置分光光度计测出的OD值差异。 我们在分批培养基中培养大肠杆菌JM109, 并监控OD达9.5小时。 在测定之前稀释培养基, 并将由于不同分光光度计光学元件差异造成的不同OD值进行换算。 材料和方法:菌株: E.coli JM109-endA1,recA1, gyrA96, thi, hsdR17(rk–, mk+), relA1, supE44, (lac-proAB), [F′ traD36,proAB, laqlqZ M15] (Promega, L2001)分光光度计: 所使用的Thermo Scientific 分光光度计会在表1中描述。生长曲线: 50mL过夜大肠杆菌JM109在250mL带挡板的培养瓶中培养, 于Luria Bertani(LB) 培养液中生长(16小时, 250rpm, 37℃ )。 将12mL的过夜菌液转移至一个2L带挡板培养瓶中培养, 加入37℃预热的LB培养基600ml, 培养9.5小时。培养基取样: 所有分光光度计均使用LB培养液做空白对照。 每隔30分钟从分批培养基中取一个5mL等份试样。 将3mL等份的未稀释培养基转移至一个10mm比色皿中, 并采用表1中列出的所有仪器测定600nm时的光密度。 LB培养液稀释过的等份分批培养基加入第二个10mm比色皿中。 进行此第二次OD测定是为了确保培养基的光密度保持在分光光度计的动态OD范围内。活菌计数: 每隔30分钟, 也将一等份样品进行一系列稀释。 将稀释液涂在LB琼脂板上, 并在37℃下过夜培养。 对菌落进行计数, 来测定各时间点的细菌细胞计数(CFU/mL)。McFarland标准品: 通过使用1cm路径长度的比色皿,在各仪器(表1) 上对来自四个McFarland标准品 (Remel, R20421, 1.0-4.0)进行OD600值测定。 结果从未稀释和稀释的培养基中收集的OD600数据如图3所示。 将来自稀释溶液的OD600值乘以稀释因数, 并与未稀释的样品进行对比。 两张图的分歧表明, 不同的光学配置在光密度测定方面会有不同的动态范围。当对比每个分光光度计的校正OD值与细胞计数时, 我们发现, 随着时间的推移, 具有相似光学系统的仪器产生了相似的OD曲线(图4)。 具有前向光学系统,但却是双光束光学几何结构的BioMate 3S, 与仪器组的差异最大。 McFarland数据呈现出一种与大肠杆菌生长相似的曲线( 图5)。 ISA使用McFarland标准品产生了更低的光密度(图6)。 结论• 计算OD测定值时, 确定您所用分光光度计的光密度性能和动态范围是至关重要的。 为获得有关生长曲线的最准确信息, 稀释细胞混悬液是很重要的。• OD测定在很大程度上取决于光学系统和几何学。 对于相同的混悬液, 具有不同光学系统和配置的分光光度计会读出不同的OD值。 例如, 在反向光学系统Evolution Array和前向光学系统, 双光束BioMate 3S之间有实质性的分歧。• 积分球配件(ISA) 可捕捉几乎所有的前向散射光,从而产生了更低的光密度。 这是因为通常看起来被样品吸收的散射光实际上是被ISA配件所收集。 ISA对测定高度散射溶液中分析成分的吸光度是理想之选; 然而, 在测定细胞混悬液的光密度时, 其是无效的。• 最后, 我们提出了如何计算一个可用于使OD数据标准化, 以便能在不同分光光度计间进行适当比较的换算因数。 值得注意的是, 这个换算因数是针对一种特定的有机体, 因为微粒的尺寸和形状会影响换算因数。
确定


还剩1页未读,是否继续阅读?
武汉沃孚科技有限公司为您提供《细菌中光密度测定检测方案(紫外分光光度计)》,该方案主要用于生物发酵中表征检测,参考标准--,《细菌中光密度测定检测方案(紫外分光光度计)》用到的仪器有赛默飞紫外可见分光光度计Evolution 260
推荐专场
相关方案
更多