方案详情
文
柱后 TFA-Fix 技术和抑制器离子交换的方法,经过实验验证,表明两种方法都具有降低流动相中 TFA 对多肽的质谱抑制作用,提高样品在 MS 上的灵敏度。采用双三元液相色谱系统,充分利用双泵的功能,同时进行样品分析和柱后自动试剂添加,大大提高多肽样品在 MS 上的灵敏度。
方案详情

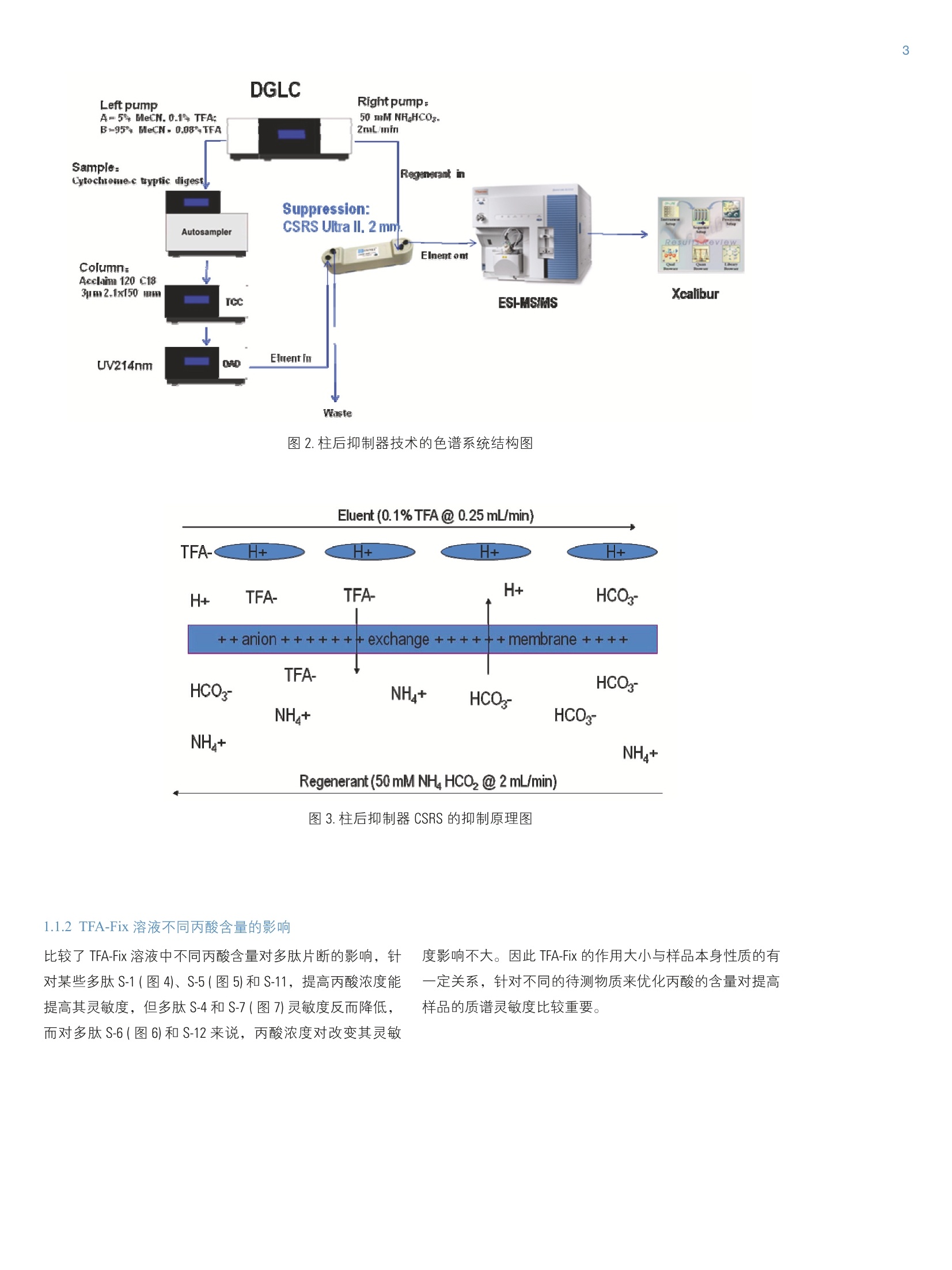
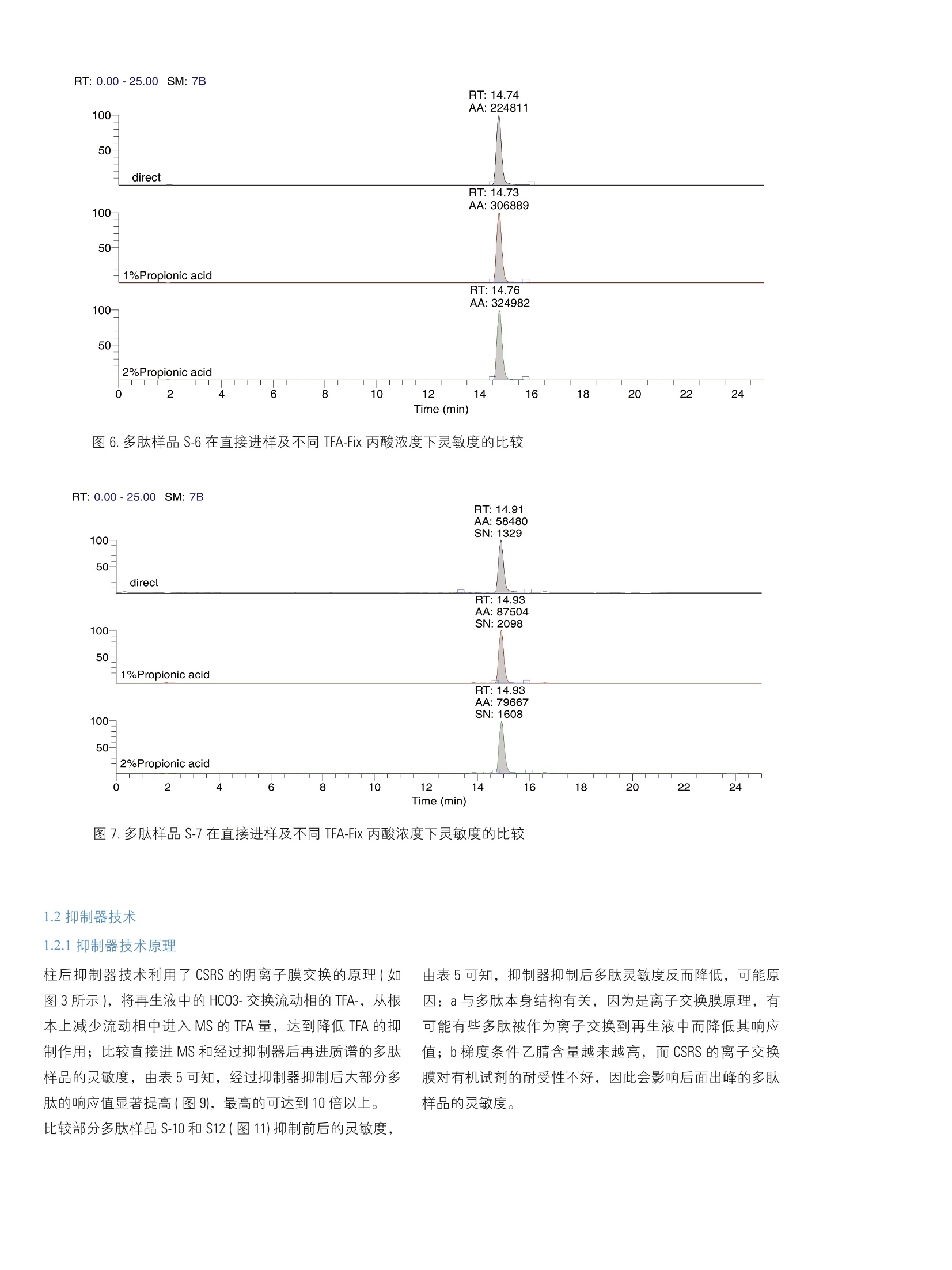
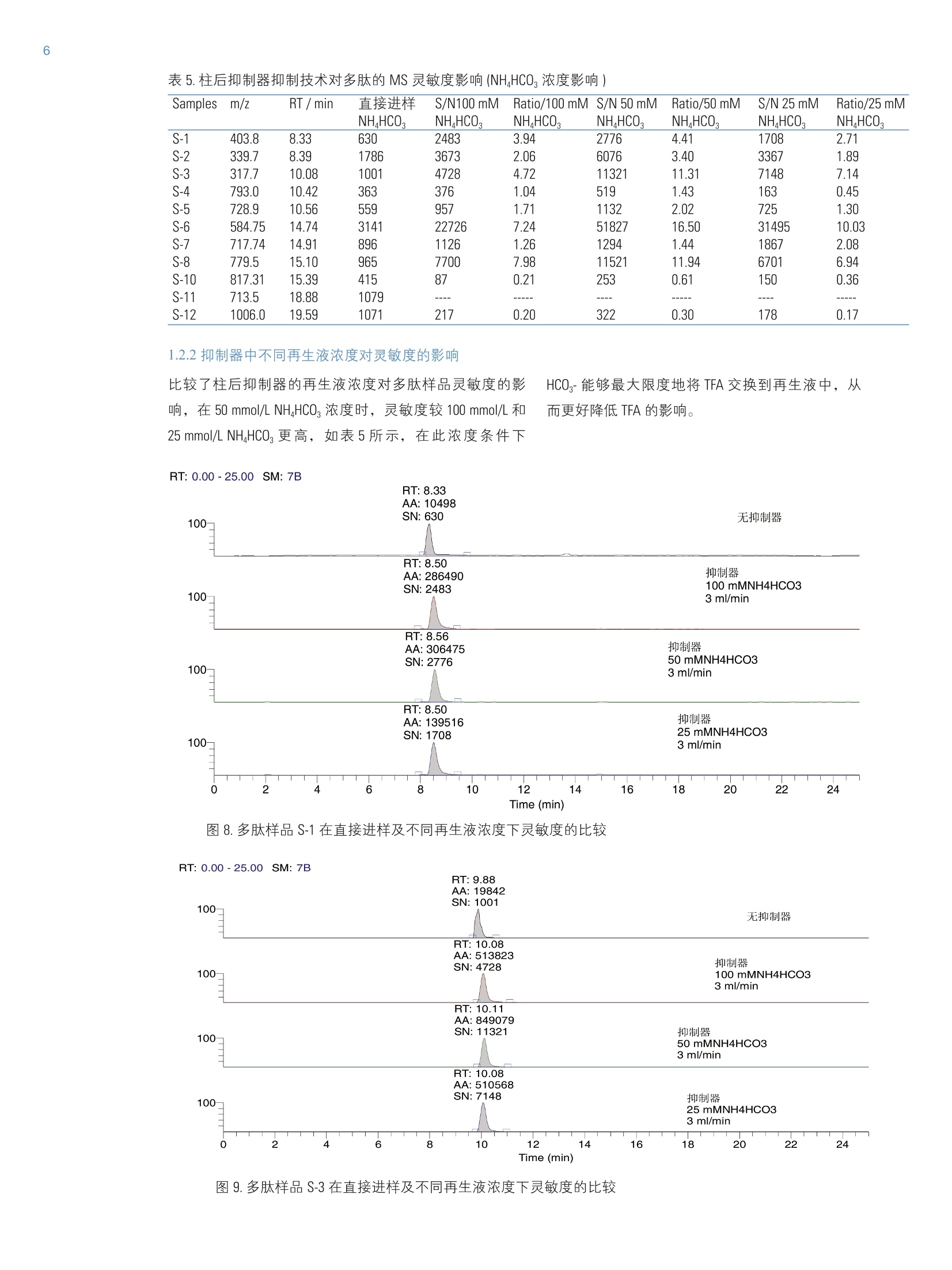
2 RT: 0.00-25.00 SM: 7B ThermoFisherSCIENTIFIC 引言 在反相色谱分离多肽和蛋白质的实验中,使用三氟乙酸(TFA) 作为离子对试剂是常见的手段,流动相中的三氟乙酸通过与疏水键合相和残留的极性表面以多种模式相互作用,来改善峰形、克服峰展宽和拖尾问题。同时反相色谱与电喷雾质谱联用已成为多肽和蛋白质的分子量测定和结构分析的重要工具,但是含有三氟乙酸的流动相对质谱离子的产生具有抑制作用,,一定程度上降低了液质联用技术的灵敏性和分析可靠性。 目前常用的方法是降低流动相中 TFA 浓度,达到降低这种抑制作用,但是也会造成色谱分析质量的降低;而如果用甲酸代替 TFA, 会造成色谱分离柱效降低,达不到理想的分离效果。 本文采用双三元液相色谱系统(DGLC), 充分利用双泵的优势,将两个泵分别作为流动相的输液泵和柱后溶液的传输泵,实现与质谱的全自动连接。采用 TFA-Fix 技术或者抑制器技术降低流动相中 TFA 对 MS的离子产生的抑制作用,尤其是柱后抑制器技术大大提高了多肽样品在质谱上的灵敏度。 仪器: Ultimate DGP 3600 系列,包括带有在线脱气单元的双三元梯度泵 DGP-3600RS、自动进样器 WPS-3000TRS、柱温箱 TCC-3000RS、检测器 DAD-3000RS 和 MS TSQ Vantage。仪器连接装置见图1。色谱质谱条件见表1 A 5 色谱柱: Acclaim C18, 2.1 mm×150 mm, 分辨率: Q1Peak Width 0.7 FWHM 结果与讨论 1.1柱后TFA-Fix 技术 1.1.1 柱后 TFA-Fix 技术原理 丙酸的沸点高于TFA, 在ESI过程中, TFA先挥发,丙酸和分子离子形成的离子对稳定性较差,倾向于形成丙酸根和准分子离子,降低 TFA的离子抑制效应,提高样品在质谱中的灵敏度而不用改变LC 的条件和分离效果。实验过程中以细胞色素C的酶解多肽作为样品进行分析,比较了直接进样和柱后加入丙酸/异丙醇后多肽的在 MS上的灵敏度,由表4可知,多肽样品的灵敏度平均提高1.23倍,最高达到1.77倍。 图2.柱后抑制器技术的色谱系统结构图 1.1.2 TFA-Fix 溶液不同丙酸含量的影响 比较了 TFA-Fix 溶液中不同丙酸含量对多肽片断的影响,针对某些多肽S-1(图4)、S-5(图5)和S-11,提高丙酸浓度能提高其灵敏度,但多肽 S-4和S-7(图7)灵敏度反而降低,而对多肽 S-6(图6)和S-12来说,丙酸浓度对改变其灵敏 度影响不大。因此 TFA-Fix 的作用大小与样品本身性质的有一定关系,针对不同的待测物质来优化丙酸的含量对提高样品的质谱灵敏度比较重要。 表4. TFA-Fix技术对多肽的 MS灵敏度(S/N)影响: Samples m/z RT/min S/N/直接进样 S/N /1% 丙酸 Ratio/1%丙酸 S/N/2% 丙酸 Ratio/2% 丙酸 S-1 403.8 8.33 447 483 1.08 643 1.44 S-2 339.7 8.39 1793 2052 1.14 2190 1.22 S-4 793.0 10.42 2391 2908 1.22 387 0.16 S-5 728.9 10.56 483 482 1.00 717 1.48 S-6 584.75 14.74 2137 2984 1.40 3021 1.41 S-7 717.74 14.91 1329 2098 1.58 1608 1.21 S-8 779.5 15.10 782 799 1.02 1383 1.77 S-10 817.31 15.39 502 616 1.23 721 1.44 S-11 713.5 18.88 810 1135 1.40 1211 1.50 S-12 1006.0 19.59 1269 1564 1.23 1550 1.22 RT: 0.00-25.00:SM: 7B 图4.多肽样品S-1 在直接进样及不同 TFA-Fix 丙酸浓度下灵敏度的比较 图5.多肽样品 S-5在直接进样及不同 TFA-Fix 丙酸浓度下灵敏度的比较 图6.多肽样品 S-6 在直接进样及不同 TFA-Fix 丙酸浓度下灵敏度的比较 图7.多肽样品S-7 在直接进样及不同 TFA-Fix 丙酸浓度下灵敏度的比较 1.2.1抑制器技术原理 柱后抑制器技术利用了 CSRS 的阴离子膜交换的原理(如图3所示),将再生液中的 HC03-交换流动相的 TFA-,从根本上减少流动相中进入 MS 的 TFA量,达到降低 TFA的抑制作用;比较直接进MS 和经过抑制器后再进质谱的多肽样品的灵敏度,由表5可知,经过抑制器抑制后大部分多肽的响应值显著提高(图9),最高的可达到10倍以上。比较部分多肽样品 S-10 和S12(图11)抑制前后的灵敏度, 由表5可知,抑制器抑制后多肽灵敏度反而降低,可能原因:a与多肽本身结构有关,因为是离子交换膜原理,有可能有些多肽被作为离子交换到再生液中而降低其响应值;b梯度条件乙腈含量越来越高,而 CSRS 的离子交换膜对有机试剂的耐受性不好,因此会影响后面出峰的多肽样品的灵敏度。 表5.柱后抑制器抑制技术对多肽的MS 灵敏度影响 (NH,HCO,浓度影响) NHHCO, NHHCO, NH,HCO: NHHCO: NHHCO: NH,HCO: NHHCO, 403.8 8.33 630 2483 3.94 2776 4.41 1708 2.71 339.7 8.39 1786 3673 2.06 6076 3.40 3367 1.89 317.7 10.08 1001 4728 4.72 11321 11.31 7148 7.14 793.0 10.42 363 376 1.04 519 1.43 163 0.45 728.9 10.56 559 957 1.71 1132 2.02 725 1.30 584.75 14.74 3141 22726 7.24 51827 16.50 31495 10.03 717.74 14.91 896 1126 1.26 1294 1.44 1867 2.08 779.5 15.10 965 7700 7.98 11521 11.94 6701 6.94 S-10 817.31 15.39 415 87 0.21 253 0.61 150 0.36 S-11 713.5 18.88 1079 ---- ---- ---- S-12 1006.0 19.59 1071 217 0.20 322 0.30 178 0.17 1.2.2抑制器中不同再生液浓度对灵敏度的影响 比较了柱后抑制器的再生液浓度对多肽样品灵敏度的影响,在50 mmol/L NH,HCO, 浓度时,灵敏度较100mmol/L 和25 mmol/L NH,HCO,更高,如表5所示,在此浓度条件下 HCO,-能够最大限度地将 TFA交换到再生液中,从而更好降低 TFA 的影响。 RT: 0.00-25.00SM: 7B Time (min) 图8.多肽样品S-1在直接进样及不同再生液浓度下灵敏度的比较 图9.多肽样品 S-3在直接进样及不同再生液浓度下灵敏度的比较 图10.多肽样品 S-6在直接进样及不同再生液浓度下灵敏度的比较 图11.多肽样品S-12在直接进样及不同再生液浓度下灵敏度的比较 1.2.3抑制器中不同再生液流速对灵敏度的影响比较了柱后抑制器的再生液流速对灵敏度的影响,随着流 速的增加,灵敏度有降低的趋势(如图12和图13所示),所以一般推荐 1ml/min 作为最佳再生液的流速。 表6.柱后抑制器抑制技术对多肽的 MS 灵敏度影响(再生液流速影响): Samples m/z RT/min 直接进样 S/N/ Ratio/ S/N/ Ratio/ S/N/ Ratio/ 3ml/min 3ml/min 2ml/min 2ml/min 1ml/min 1ml/min S-1 403.8 8.33 630 2305 3.66 2648 4.20 2760 4.38 S-2 339.7 8.39 1786 2793 1.56 4955 2.77 4995 2.80 S-3 317.7 9.88 1001 3357 3.35 6072 6.07 7548 7.54 S-4 793.0 10.42 363 376 1.02 417 1.15 517 1.42 S-5 728.9 10.56 559 808 1.45 1095 1.96 1208 2.16 S-6 584.75 14.74 3141 34546 11.00 36376 11.58 41788 13.30 S-7 717.74 14.91 896 976 1.09 1705 1.90 2182 2.44 S-8 779.5 15.10 965 5992 6.21 9112 9.44 10366 10.74 S-10 817.31 15.39 415 56 0.13 109 0.26 129 0.31 S-11 713.5 18.88 1079 S-12 1006.0 19.59 1071 228 0.21 238 0.22 285 0.27 Time (min) 图12.多肽样品S-1在直接进样及不同再生液流速下灵敏度的比较 图13.多肽样品 S-6在直接进样及不同再生液流速下灵敏度的比较 总结 柱后 TFA-Fix 技术和抑制器离子交换的方法,经过实验验证,表明两种方法都具有降低流动相中 TFA 对多肽的质谱抑制作用,提高样品在 MS 上的灵敏度。采用双三元液相色谱系统,充分利用双泵的功能,同时进行样品分析和柱 后自动试剂添加,大大提高多肽样品在 MS 上的灵敏度。但是针对某些多肽样品可能反而降低其在MS上的灵敏度,因此我们还需要做更细致工作来对这些技术作更深入的研究,以扩大这项技术的应用范围。 ( [1] Wilson Z. Shou, Wang Naidong. Simple means to alleviate s ensitivity loss by trifluoroacetic acid (TFA) mobile p hases i n thehydrophilic interaction chromatography-electrospray tandem masss s pectrometric (HILIC-ESI/MS/MS) bioanalysis of basic compounds. Journal of Chromatography B, 2005,825:186-192 ) ( [2] Thomas M. A n nesley. Ion Suppression in Mass Spectrometry.Clinical Chemistry,2003,49(7) : 104 1 -1044. ) [3] Alex Apffel, Stenven Fisher, Gerson Goldberg, Paul C. Goodley,Frank E. Kuhlmann. Enhanced sensitivity for peptide mappingwith electrospray Liquid chromatography-mass spectrometryin the presence of signal suppression due to trifluoroacetoc acid-containing mobile phase. Journal of chromatography A, 1995,712:177-190 在反相色谱分离多肽和蛋白质的实验中,使用三氟乙酸 (TFA) 作为离子对试剂是常见的手段,流动相中的三氟乙酸 通过与疏水键合相和残留的极性表面以多种模式相互作 用,来改善峰形、克服峰展宽和拖尾问题。同时反相色谱 与电喷雾质谱联用已成为多肽和蛋白质的分子量测定和结 构分析的重要工具,但是含有三氟乙酸的流动相对质谱离 子的产生具有抑制作用,一定程度上降低了液质联用技术 的灵敏性和分析可靠性。 目前常用的方法是降低流动相中 TFA 浓度, 达到降低这种 抑制作用,但是也会造成色谱分析质量的降低;而如果用 甲酸代替 TFA, 会造成色谱分离柱效降低,达不到理想的分 离效果。 本文采用双三元液相色谱系统 (DGLC),充分利用双泵的优 势,将两个泵分别作为流动相的输液泵和柱后溶液的传输 泵,实现与质谱的全自动连接。采用 TFA-Fix 技术或者抑制 器技术降低流动相中 TFA 对 MS 的离子产生的抑制作用, 尤其是柱后抑制器技术大大提高了多肽样品在质谱上的灵 敏度。 测试条件一 仪器:Ultimate DGP 3600 系列,包括带有在线脱气单元的双 三元梯度泵 DGP-3600RS、自动进样器 WPS-3000TRS、柱温 箱 TCC-3000RS、检测器 DAD-3000RS 和 MS TSQ Vantage。仪 器连接装置见图 1。色谱质谱条件见表 1
确定






还剩7页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《细胞色素 C (Cytochrome C digest) 的溶液配制:将 1.6 nmol/L 的 固体样品溶解于 200 μl 流动相 A 溶液中,得到 8 pmol/L 的待 测样品溶液中术降低 流动相中三氟乙酸 (TFA) 对多肽质谱信号抑制作用检测方案(液相色谱仪)》,该方案主要用于其他中术降低 流动相中三氟乙酸 (TFA) 对多肽质谱信号抑制作用检测,参考标准--,《细胞色素 C (Cytochrome C digest) 的溶液配制:将 1.6 nmol/L 的 固体样品溶解于 200 μl 流动相 A 溶液中,得到 8 pmol/L 的待 测样品溶液中术降低 流动相中三氟乙酸 (TFA) 对多肽质谱信号抑制作用检测方案(液相色谱仪)》用到的仪器有赛默飞DGLC双三元液相色谱
推荐专场
相关方案
更多
该厂商其他方案
更多
















