本应用介绍了用于分析三文鱼和牛肉中的多环芳烃 (PAH) 残留物的多残留方法的开发与验证。该方法使用液相萃取以及 Agilent Captiva EMR-Lipid 净化,并通过 GC/MS/MS 进行分析。使用固/液萃取 (SoLE) 对三文鱼或牛肉样品进行萃取,再通过 Captiva EMR-Lipid 净化。然后使用异辛烷对净化的样品洗脱液进行反萃取,以在 GC/MS/MS 分析之前去除水。在两步法 SoLE 中使用乙酸乙酯和乙腈的混合物,改善了脂质食品基质中 PAH 的萃取效率。Agilent Captiva EMR-Lipid 过滤柱能够实现对样品基质的高效选择性净化,并采用三文鱼和牛肉样品对开发的方法进行了验证。结果表明,所有检测的 PAH 化合物均获得了满足欧盟委员会规定(回收率50%–120%)的可接受的回收率结果,RSD 低于 20%,且三文鱼和牛肉样品中浓度为 1–500 ng/g 的分析物的校准曲线 R2 高于 0.99。通过重量法测得,三文鱼和牛肉样品中基质共萃取残留物的去除效率分别为 60% 和 92%。
方案详情

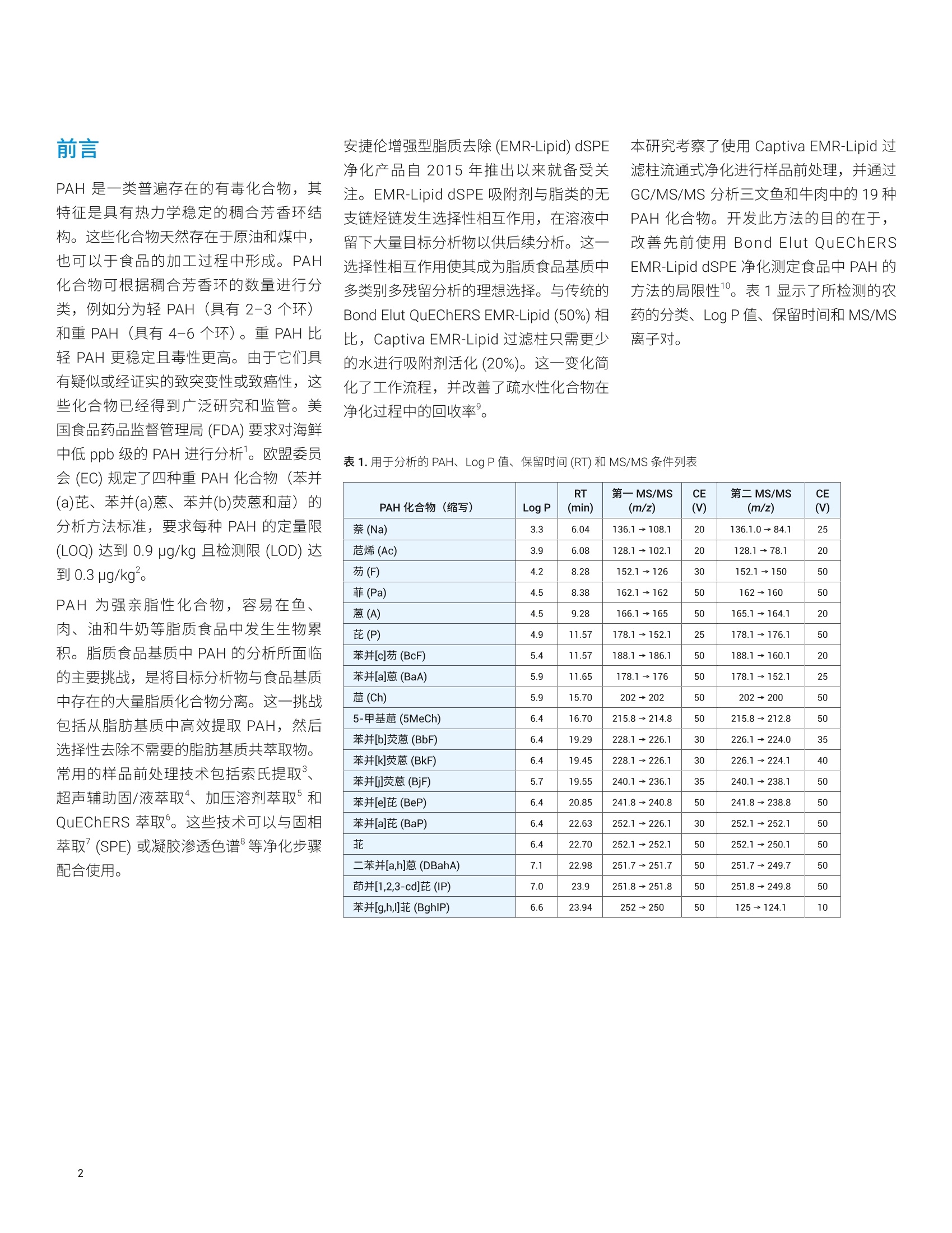
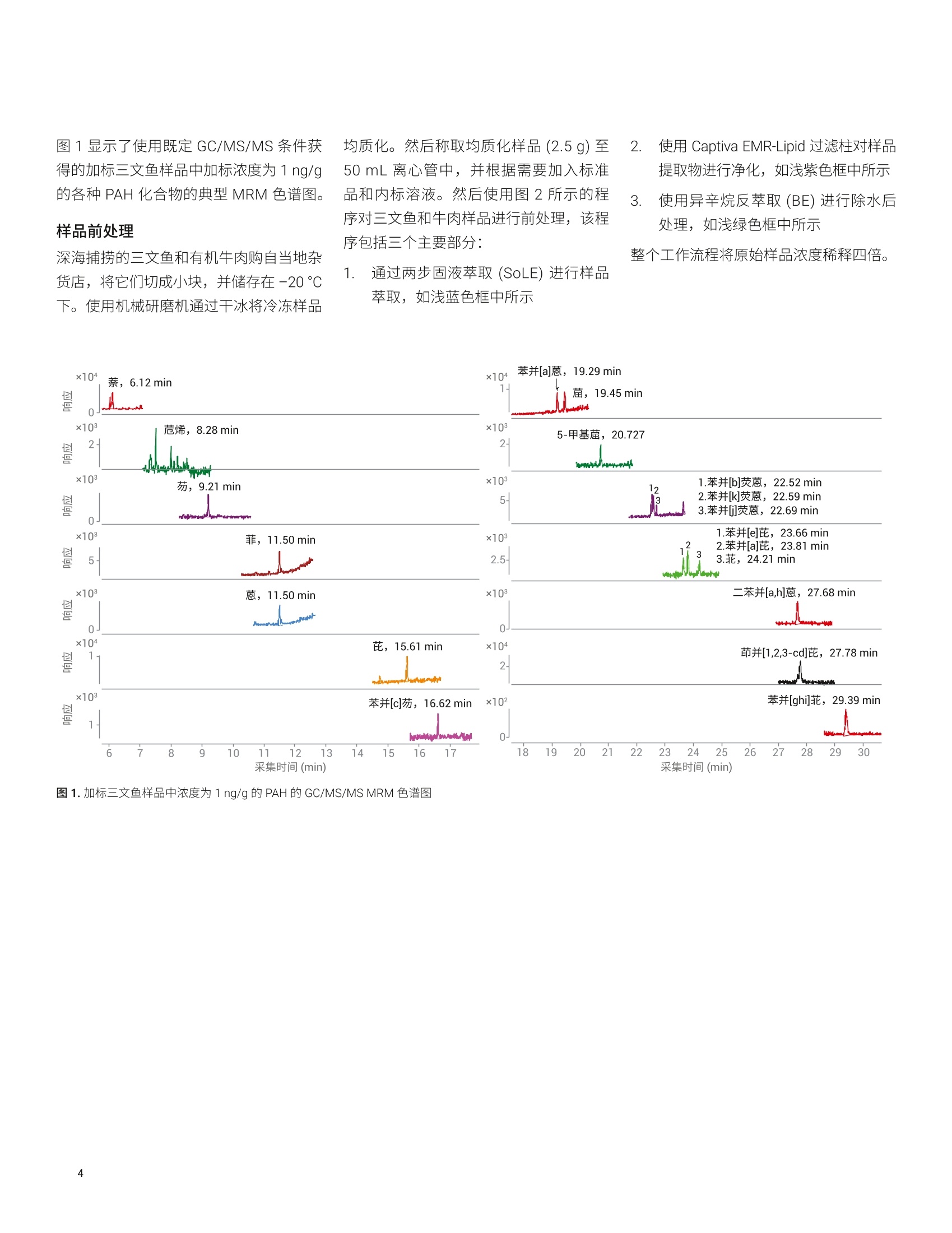
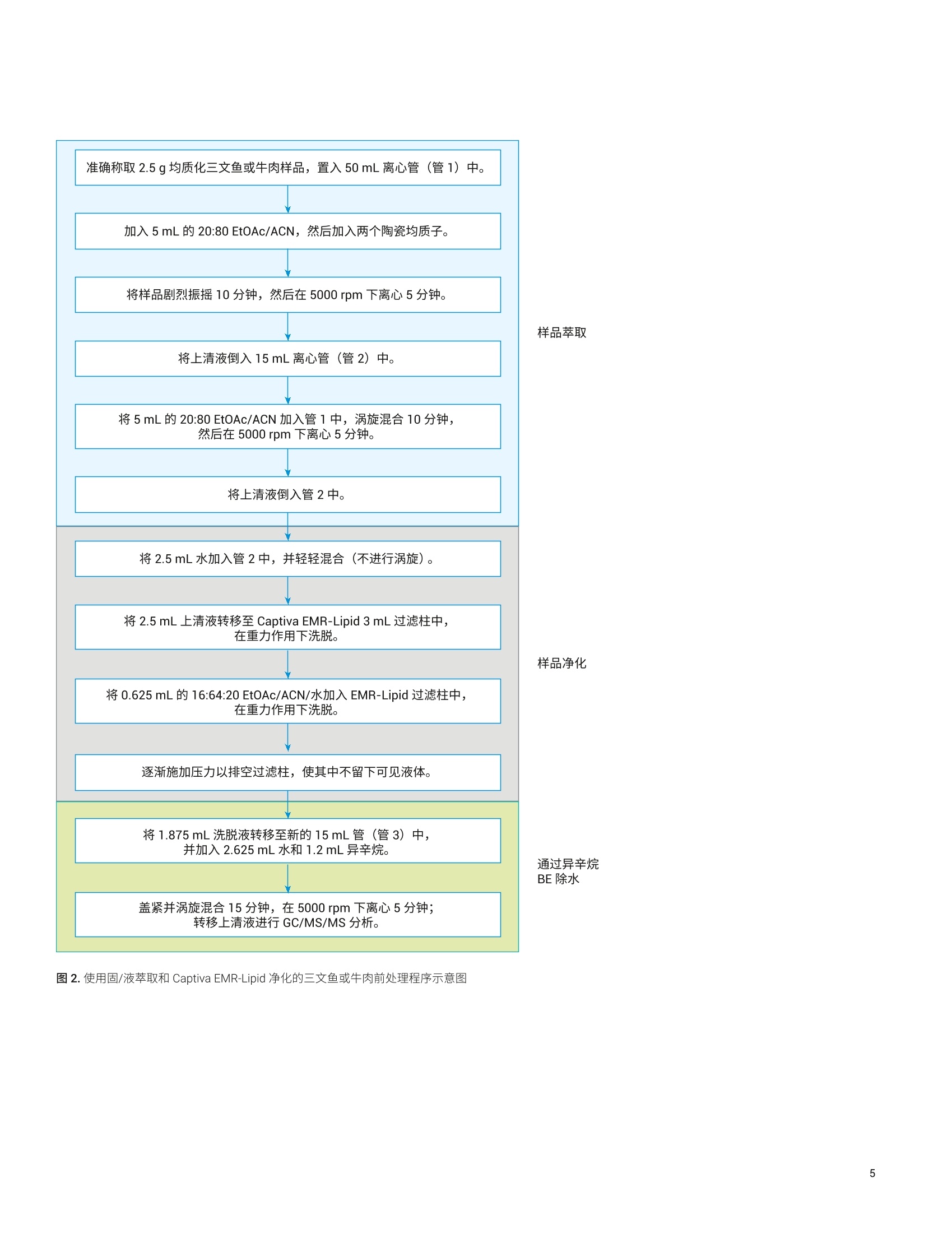
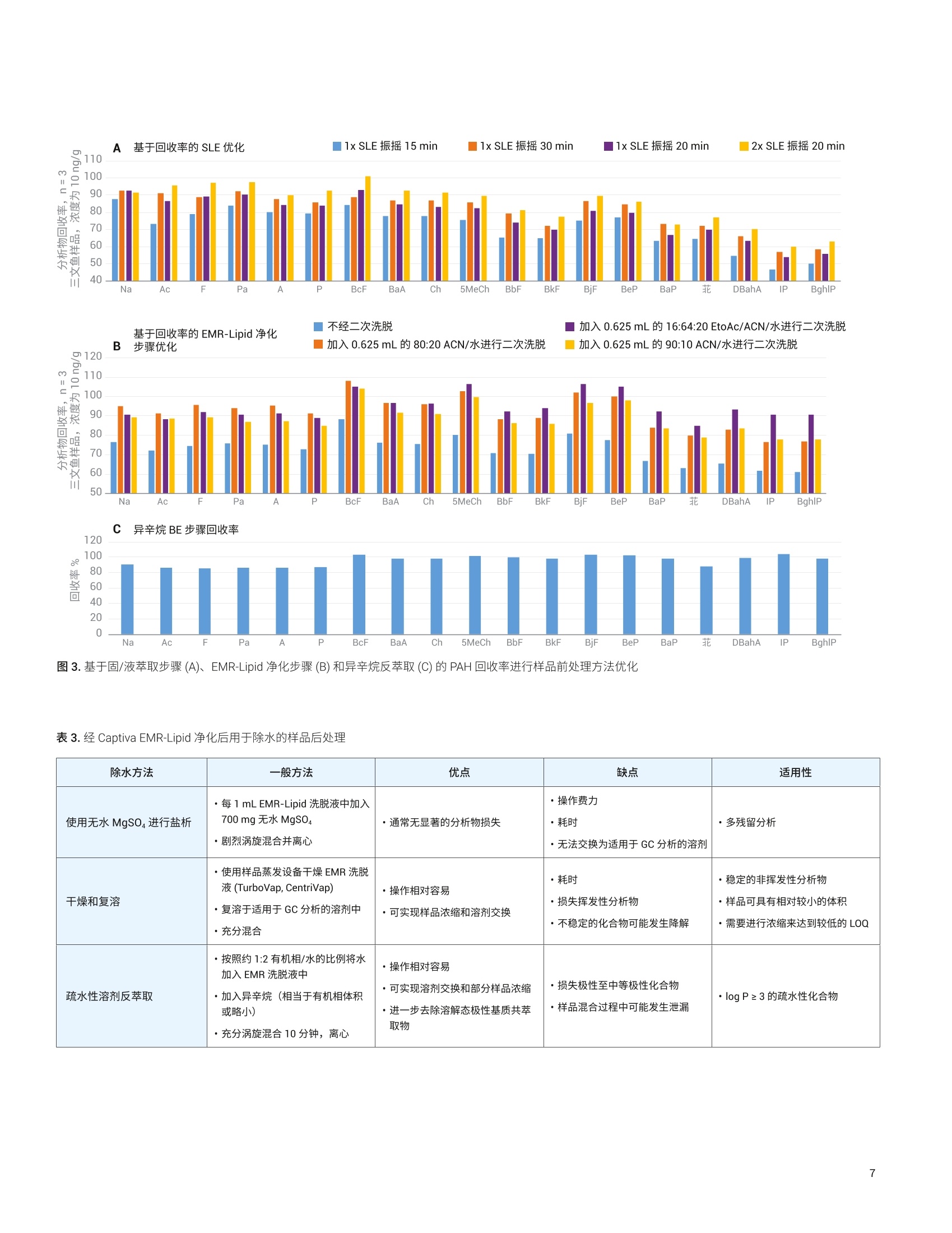
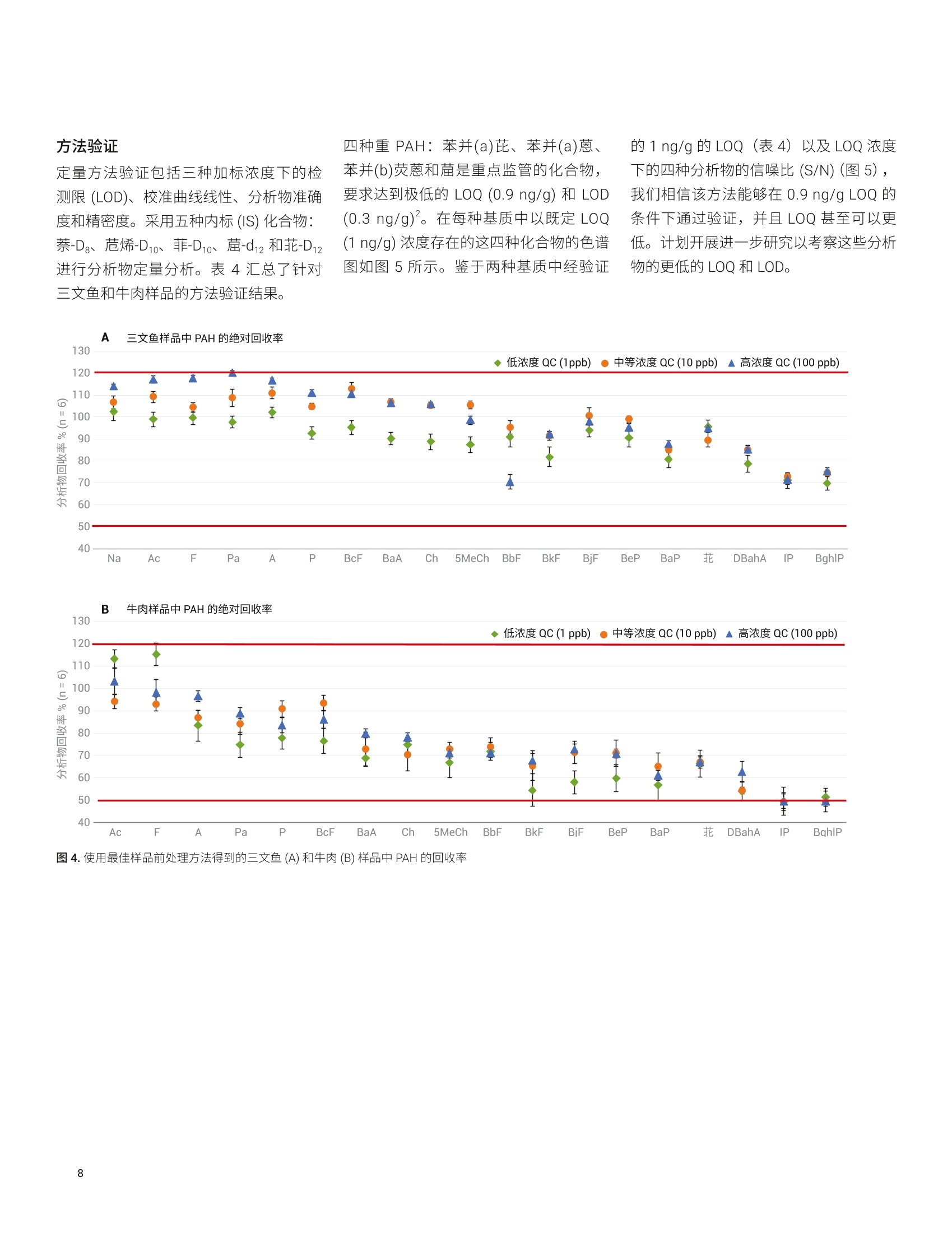
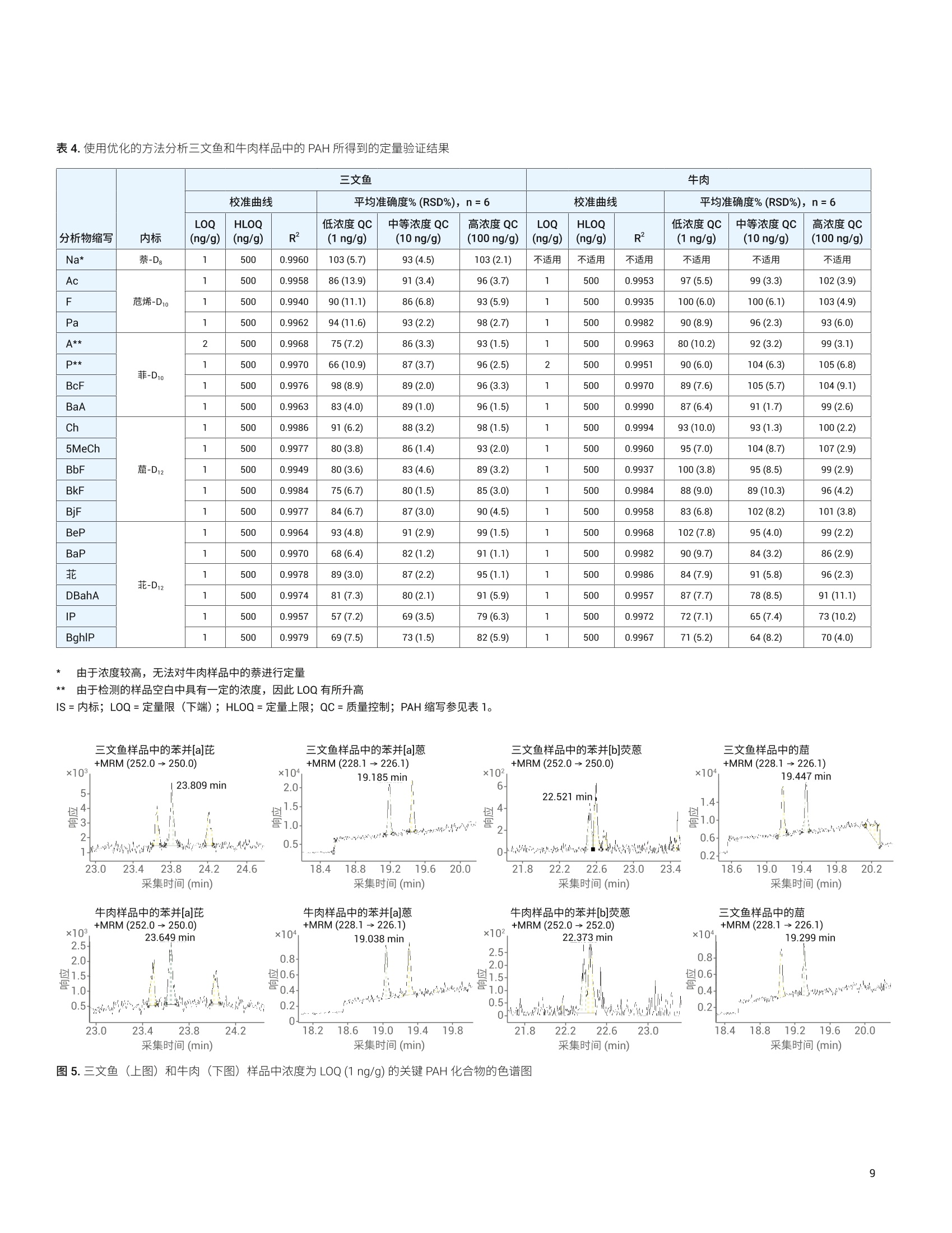
Limian Zhao 和 Diana Wong 测定三文鱼和牛肉中的19种多环芳烃化合物 使用 Captiva EMR-Lipid 净化并通过 GC/MS/MS 进行分析 本应用简报介绍了用于分析三文鱼和牛肉中的多环芳烃 (PAH)残留物的多残留方法的开发与验证。该方法使用液相萃取以及 Agilent Captiva EMR-Lipid 净化,并通过 GC/MS/MS 进行分析。使用固/液萃取 (SoLE) 对三文鱼或牛肉样品进行萃取,再通过 Captiva EMR-Lipid 净化。然后使用异辛烷对净化的样品洗脱液进行反萃取,以在 GC/MS/MS 分析之前去除水。在两步法 SoLE 中使用乙酸乙酯和乙腈的混合物,改善了脂质食品基质中 PAH 的萃取效率。Agilent Captiva EMR-Lipid 过滤柱能够实现对样品基质的高效选择性净化,并采用三文鱼和牛肉样品对开发的方法进行了验证。结果表明,所有检测的 PAH 化合物均获得了满足欧盟委员会规定(回收率50%-120%)的可接受的回收率结果, RSD 低于20%,且三文鱼和牛肉样品中浓度为1-500 ng/g 的分析物的校准曲线R²高于0.99。通过重量法测得,三文鱼和牛肉样品中基质共萃取残留物的去除效率分别为60%和 92%。 前言 PAH 是一类普遍存在的有毒化合物,其特征是具有热力学稳定的稠合芳香环结构。这些化合物天然存在于原油和煤中,也可以于食品的加工过程中形成。 PAH化合物可根据稠合芳香环的数量进行分类,例如分为轻 PAH (具有2-3个环)和重 PAH(具有4-6个环)。重 PAH 比轻 PAH 更稳定且毒性更高。由于它们具有疑似或经证实的致突变性或致癌性,这些化合物已经得到广泛研究和监管。美国食品药品监督管理局(FDA)要求对海鲜中低 ppb 级的 PAH 进行分析。欧盟委员会(EC)规定了四种重 PAH 化合物(苯并(a)芘、苯并(a)蒽、苯并(b)荧蒽和菌)的分析方法标准,要求每种 PAH 的定量限(LOQ)达到 0.9 pg/kg 且检测限(LOD) 达到 0.3 pg/kg。 PAH 为强亲脂性化合物,,2容易在鱼、肉、油和牛奶等脂质食品中发生生物累积。脂质食品基基中 PAH的分析所面临的主要挑战,是将目标分析物与食品基质中存在的大量脂质化合物分离。这一挑战包括从脂肪基质中高效提取 PAH,然后选择性去除不需要的脂肪基质共萃取物。常用的样品前处理技术包括索氏提取、超声辅助固/液萃取“、加压溶剂萃取和QuEChERS 萃取°。这些技术可以与固相萃取(SPE) 或凝胶渗透色谱等净化步骤配合使用。 安捷伦增强型脂质去除 (EMR-Lipid) dSPE净化产品自2015年推出以来就备受关注。EMR-Lipid dSPE 吸附剂与脂类的无支链烃链发生选择性相互作用,在溶液中留下大量目标分析物以供后续分析。这一选择性相互作用使其成为脂质食品基质中多类别多残留分析的理想选择。与传统的Bond Elut QuEChERS EMR-Lipid (50%)相比, Captiva EMR-Lipid 过滤柱只需更少的水进行吸附剂活化(20%)。这一变化简化了工作流程,并改善了疏水性化合物在净化过程中的回收率。 本研究考察了使用 Captiva EMR-Lipid 过滤柱流通式净化进行样品前处理,并通过GC/MS/MS 分析三文鱼和牛肉中的19种PAH 化合物。开发此方法的目的在于,改善先前使用 Bond Elut QuEChERSEMR-Lipid dSPE 净化测定食品中 PAH 的方法的局限性1。表1显示了所检测的农药的分类、LogP值、保留时间和 MS/MS离子对。 PAH化合物(缩写) Log P RT(min) 第一MS/MS(m/z) CE(V) 第二 MS/MS(m/z) CE(V) 萘 (Na) 3.3 6.04 136.1→108.1 20 136.1.0→84.1 25 烯(Ac) 3.9 6.08 128.1→102.1 20 128.1→78.1 20 芴 (F) 4.2 8.28 152.1→126 30 152.1→150 50 菲 (Pa) 4.5 8.38 162.1→162 50 162→160 50 蒽(A) 4.5 9.28 166.1→165 50 165.1→164.1 20 芘(P) 4.9 11.57 178.1→152.1 25 178.1→176.1 50 苯并[c]芴 (BcF) 5.4 11.57 188.1→186.1 50 188.1→160.1 20 苯并[a]蒽(BaA) 5.9 11.65 178.1→176 50 178.1→152.1 25 (Ch) 5.9 15.70 202→202 50 202→200 50 5-甲基 (5MeCh) 6.4 16.70 215.8→214.8 50 215.8→212.8 50 苯并[b]荧蒽(BbF) 6.4 19.29 228.1→226.1 30 226.1→224.0 35 苯并[k]荧蒽 (BkF) 6.4 19.45 228.1→226.1 30 226.1→224.1 40 苯并[j]荧蒽(BjF) 5.7 19.55 240.1→236.1 35 240.1→238.1 50 苯并[e]芘(BeP) 6.4 20.85 241.8→240.8 50 241.8→238.8 50 苯并[a]芘(BaP) 6.4 22.63 252.1→226.1 30 252.1→252.1 50 菲 6.4 22.70 252.1→252.1 50 252.1→250.1 50 二苯并[a,h]蒽(DBahA) 7.1 22.98 251.7→251.7 50 251.7→249.7 50 茚并[1,2,3-cd]芘 (IP) 7.0 23.9 251.8→251.8 50 251.8→249.8 50 苯并[g,h,]莊(BghlP) 6.6 23.94 252-250 50 125→124.1 10 化学品与试剂 ( PAH 和内标来自 Ultra-Scientific (NorthKingstown, R I, USA) 或安捷伦。 HPLC级乙腈(ACN)、丙酮和乙酸乙酯 (EtOAc)购自 H oneywell (Muskegon, MI, USA) 。 试剂级异辛烷购自 Sigma - Aldrich (St. Louis, MO, USA)。 ) 溶液与标准品 用丙酮配制两种浓度分别为2000 pg/mL和500 pg/mL 的 PAH储备液。用丙酮由储备液制得浓度为 4 ug/mL 的工作溶液。然后每天用丙酮新鲜配制浓度为1 pg/mL 的加标溶液以用于样品加标。用丙酮配制包含五种浓度为 20 pg/mL的内标化合物的内标工作溶液。两种工作溶液均置于棕色玻璃样品瓶中,在4°℃的冰箱中储存一个月。 配制 20:80 EtOAc/ACN 萃取齐剂和16:64:20 ACN/EtOAc/水洗脱溶液,室温储存。 仪器与材料 将 Agilent 7890B 气相色谱系统与 Agilent7000D三重四极杆 GC/MS 联用开展研究。气相色谱系统配备电子气路控制(EPC)、支持风冷的多模式进样口(MMI)、Agilent 7693A 自动液体进样器 (ALS)以及基于辅助 EPC 模块控制的吹扫 Ultimate 接头的反吹系统。采用 Agilent MassHunter工作站软件进行数据采集和分析。 ( 仪器条件 ) ( Centra CL3R 离心机 (Thermo IEC, MA,USA) ) ( GC/MS/MS 仪器条件基于先前发表的方法确定1 。 表2列出了 GC/MS/MS 操作条件。 ) ( Multi Reax 试管振荡器 (Heidolph, Schwabach, Germany) ) ( 2010 G eno/Grinder (Metuchen, NJ, USA) ) ( 移液管和重复用移液器 (Eppendorf, NY,USA) ) ( 安捷伦正压48孔处理装置(PPM-48) (部件号5191-4101) ) ( Captiva EMR-Lipid 过滤柱, 3mL,300mg(部件号5190-1003) ) ( 陶瓷均质子(部件号5992-9312) ) 表 2.7890B 和 7000D GC/MS/MS条件 参数 值 色谱柱1 J&W DB-EUPAH UI, 30 mx0.25 mm,0.25 pm(部件号122-9632UI), 前多模式进样口至辅助EPC4 色谱柱2 J&W Silcotek 去活管线,1.36mx0.15 mm,0pm (部件号160-7625-5),辅助 EPC 4 至MSD 载气 氦气 模式 恒流 色谱柱1流速 1.1063 mL/min 色谱柱2流速 1.942 mL/min 进样量 2pL脉冲不分流 进样口衬管 4mm内径超高惰性细径单锥衬管,带玻璃毛(部件号5190-2293) 柱温箱升温程序 80℃保持1分钟, 以25°C/min 升至200℃, 然后以8℃/min 升至335℃, 保持9.325分钟 最高柱温箱温度 340°C 运行时间 32分钟 反吹条件 后运行 2 min 柱温箱温度335℃ 辅助 EPC 压力 50 psi, 进样口压力2 psi 传输线温度 320°C 离子源温度 EI离子源,320℃ 四极杆温度 150℃ 数据监测 动态 MRM 模式 溶剂延迟 3 min 图1显示了使用既定 GC/MS/MS条件获得的加标三文鱼样品中加标浓度为1 ng/g的各种 PAH 化合物的典型 MRM 色谱图。 样品前处理 深海捕捞的三文鱼和有机牛肉购自当地杂货店,将它们切成小块,并储存在-20℃下。使用机械研磨机通过干冰将冷冻样品 均质化。然后称取均质化样品(2.5g)至50mL离心管中,并根据需要加入标准品和内标溶液。然后使用图2所示的程序对三文鱼和牛肉样品进行前处理,该程序包括三个主要部分: 1.通过两步固液萃取 (SoLE) 进行样品萃取,如浅蓝色框中所示 2. 使用 Captiva EMR-Lipid 过滤柱对样品提取物进行净化,如浅紫色框中所示 3. 使用异辛烷反萃取(BE)进行除水后处理,如浅绿色框中所示 整个工作流程将原始样品浓度稀释四倍。 图2.使用固/液萃取和 Captiva EMR-Lipid 净化的三文鱼或牛肉前处理程序示意图 基质共萃取物去除效率评估 对样品共萃取物残留进行重量测定,由此考察基质去除率。利用失重测定法来测定共萃取物残留量°,研究样品萃取和净化程序的基质去除率。基于1mL最终样品提取物(n=2) 来采集共萃取物残留重量,在适用的情况下校正稀释倍数,并利用平均重量确定基质去除率(%)。 也可基于1mL样品干燥后剩余的残留物的量直观观察 Captiva EMR 的净化效率。 方法验证 在三文鱼和牛肉样品的分析物回收率、定量准确度和精密度、定量限 (LOQ)和校准曲线线性方面对优化的样品前处理方法进行验证。三文鱼和牛肉样品的校准曲线浓度包括1、2、5、10、20、50、100、250、400和500 ng/g。根据校准曲线对三种浓度的三文鱼或牛肉 QC 样品进行定量分析,且n=6。这三种QC样品分别是低浓度(1 ng/g)、中等浓度(10 ng/g)和高浓度(100 ng/g)样品。由保留时间和MRM 离子对确定分析物鉴定和定量结果。 EMR-Lipid 吸附剂和产品 EMR-Lipid 吸附剂使用新型化学键合相,它结合了体积排阻与疏水相互作用,可提供较高的脂质去除选择性和效率。仅含有无支链烃链的类脂分子能够进入EMR-Lipid吸附剂孔中,并通过疏水相互作用得以保留。不含类脂结构的目标分析物无法进入吸附剂孔中,因此留在溶液中以供后续分析。因此, EMR-Lipid 吸附剂可以将脂质与其他目标分析物分开,提供较高的分析物回收率和脂质去除效率。 样品前处理优化 样品前处理方法优化包括三个阶段: 1. SoLE 2. Captiva EMR-Lipid 净化 3. 用于除水的后处理 萃取步骤对于实现脂肪基质中疏水性 PAH化合物的高回收率至关重要。样品萃取的挑战在于 PAH 分析物的高疏水性和脂质食品基质的复杂性。鉴于 SoLE 先前在萃取油基质中疏水性农药方面的成功应用°,直接使用 SoLE 和 20:80 EtOAc/ACN 萃取溶剂作为初步方案。针对分析物回收率对萃取时间和多次 SoLE 进行优化,结果如图3A所示。结果表明,萃取时间越长,PAH 萃取回收率越高。另外,与一步法SoLE相比,两步法SoLE 提高了萃取效率。因此,使用两步法 SoLE 作为最佳萃取方法,该方法采用5mL萃取溶剂,并在每一步振摇10分钟。 然后研究了 EMR-Lipid 过滤柱净化的分析物回收率。由于 PAH 化合物具有非常强的亲脂性(重 PAH 尤其如此),因此使用二次洗脱对于获得良好的洗脱回收率非常重要。结果(图3B)表明,二次洗脱能够使洗脱回收率平均提高约20%-25%。此外,使用更强的溶剂 (16:64:20EtOAc/ACN/水)可实现重 PAH的最佳洗脱。 对样品萃取和 EMR-Lipid 净化进行优化后,考察了用于除水的后处理步骤。用于在 GC/MS/MS 分析之前除水的 EMR-Lipid后处理方法主要有三种: 使用无水 MgSO, 进行盐析 干燥和复溶 疏水性溶剂反萃取 (BE) 表3分别列出了这三种后处理程序的一般方法、优缺点和适用性。由于 PAH 是一类强疏水性化合物,因此非常适合采用疏水性溶剂反萃取法。该方法可实现溶剂转换和部分浓缩,并且对于轻 PAH 和重 PAH 化合物均适用。因此,在 CaptivaEMR-Lipid 净化后使用异辛烷溶剂 BE除水。图 3C 显示了异辛烷 BE 步骤的回收率。 使用这种优化的方法,在三种加标浓度下采集整个方法的分析物回收率:三文鱼和牛肉样品中加标浓度均为 1 ng/g、10ng/g 和100 ng/g (n=6)。尽管不同基质间存在差异,但两种基质中不同加标浓度的所有 PAH分析物的回收率均处于可接受的限值范围(50%-120%)。 图3.基于固/液萃取步骤(A)、EMR-Lipid 净化步骤(B)和异辛烷反萃取 (C)的 PAH 回收率进行样品前处理方法优化 表3.经 Captiva EMR-Lipid 净化后用于除水的样品后处理 除水方法 一般方法 优点 缺点 适用性 使用无水 MgSO, 进行盐析 ·每1 mL EMR-Lipid 洗脱液中加入700mg 无水MgSOa ·剧烈涡旋混合并离心 ·通常无显著的分析物损失 ·操作费力 ·耗时 ·无法交换为适用于 GC分析的溶剂 ·多残留分析 干燥和复溶 ·使用样品蒸发设备干燥 EMR 洗脱液(TurboVap, CentriVap) ·复溶于适用于 GC 分析的溶剂中·充分混合 ·操作相对容易 ·可实现样品浓缩和溶剂交换 ·耗时 ·损失挥发性分析物 ·不稳定的化合物可能发生降解 ·稳定的非挥发性分析物 ·样品可具有相对较小的体积 ·需要进行浓缩来达到较低的 LOQ 疏水性溶剂反萃取 ·按照约1:2有机相/水的比例将水加入EMR洗脱液中 ·加入异辛烷(相当于有机相体积或略小) ·充分涡旋混合10分钟,离心 ·操作相对容易 ·可实现溶剂交换和部分样品浓缩·进一步去除溶解态极性基质共萃取物 ·损失极性至中等极性化合物 ·样品混合过程中可能发生泄漏 · log P≥3的疏水性化合物 方法验证 定量方法验证包括三种加标浓度下的检测限(LOD)、校准曲线线性、分析物准确度和精密度。采用五种内标 (IS)化合物:萘-Dg、烯-D10、菲-D10、茼-d12和和-D12进行分析物定量分析。表4汇总了针对三文鱼和牛肉样品的方法验证结果。 四种重 PAH: 苯并(a)芘、苯并(a)蔥、苯并(b)荧蒽和菌是重点监管的化合物,要求达到极低的 LOQ (0.9 ng/g) 和LOD(0.3 ng/g)。在每种基质中以既定 LOQ(1ng/g) 浓度存在的这四种化合物的色谱图如图5所示。鉴于两种基质中经验证 的 1 ng/g 的 LOQ(表4))I以及 LOQ 浓度下的四种分析物的信噪比(S/N)(图5),我们相信该言法能够在 0.9 ng/g LOQ的条件下通过验证,并且 LOQ 甚至可以更低。计划开展进一步研究以考察这些分析物的更低的 LOQ和 LOD。 表4.使用优化的方法分析三文鱼和牛肉样品中的 PAH 所得到的定量验证结果 分析物缩写 内标 三文鱼 牛肉 校准曲线 平均准确度%(RSD%), n=6 校准曲线 平均准确度%(RSD%), n=6 LOQ(ng/g) HLOQ(ng/g) R 低浓度 QC(1ng/g) 中等浓度 QC(10ng/g) 高浓度QC(100ng/g) LOQ(ng/g) HLOQ(ng/g) R² 低浓度 QC (1 ng/g) 中等浓度 QC (10 ng/g) 高浓度 QC(100ng/g) Na* 萘-D 1 500 0.9960 103(5.7) 93(4.5) 103(2.1) 不适用 不适用 不适用 不适用 不适用 不适用 Ac 烯-D10 1 500 0.9958 86(13.9) 91(3.4) 96(3.7) 1 500 0.9953 97(5.5) 99(3.3) 102(3.9) F 1 500 0.9940 90(11.1) 86(6.8) 93 (5.9) 1 500 0.9935 100(6.0) 100(6.1) 103(4.9) Pa 1 500 0.9962 94 (11.6) 93(2.2) 98(2.7) 1 500 0.9982 90(8.9) 96(2.3) 93(6.0) A** 菲-D1o 2 500 0.9968 75(7.2) 86(3.3) 93(1.5) 1 500 0.9963 80(10.2) 92(3.2) 99 (3.1) D** 1 500 0.9970 66(10.9) 87 (3.7) 96(2.5) 2 500 0.9951 90(6.0) 104(6.3) 105(6.8) BcF 1 500 0.9976 98(8.9) 89(2.0) 96(3.3) 1 500 0.9970 89(7.6) 105(5.7) 104(9.1) BaA 1 500 0.9963 83(4.0) 89(1.0) 96(1.5) 1 500 0.9990 87(6.4) 91(1.7) 99(2.6) Ch -D12 1 500 0.9986 91 (6.2) 88(3.2) 98(1.5) 1 500 0.9994 93(10.0) 93(1.3) 100(2.2) 5MeCh 1 500 0.9977 80(3.8) 86(1.4) 93(2.0) 1 500 0.9960 95(7.0) 104(8.7) 107 (2.9) BbF 1 500 0.9949 80(3.6) 83(4.6) 89(3.2) 1 500 0.9937 100(3.8) 95(8.5) 99(2.9) BkF 1 500 0.9984 75(6.7) 80(1.5) 85(3.0) 1 500 0.9984 88(9.0) 89(10.3) 96(4.2) BjF 1 500 0.9977 84(6.7) 87(3.0) 90(4.5) 1 500 0.9958 83(6.8) 102(8.2) 101(3.8) BeP 花-D12 1 500 0.9964 93(4.8) 91(2.9) 99(1.5) 1 500 0.9968 102(7.8) 95(4.0) 99(2.2) BaP 1 500 0.9970 68(6.4) 82(1.2) 91 (1.1) 1 500 0.9982 90(9.7) 84(3.2) 86(2.9) 1 500 0.9978 89(3.0) 87(2.2) 95 (1.1) 1 500 0.9986 84(7.9) 91(5.8) 96(2.3) DBahA 1 500 0.9974 81(7.3) 80(2.1) 91(5.9) 1 500 0.9957 87(7.7) 78(8.5) 91(11.1) IP 1 500 0.9957 57(7.2) 69(3.5) 79(6.3) 1 500 0.9972 72(7.1) 65(7.4) 73(10.2) BghlP 1 500 0.9979 69(7.5) 73(1.5) 82(5.9) 1 500 0.9967 71 (5.2) 64(8.2) 70(4.0) 由于浓度较高,无法对牛肉样品中的萘进行定量 **日由于检测的样品空白中具有一定的浓度,因此 LOQ有所升高 IS=内标; LOQ=定量限(下端); HLOQ=定量上限;QC=质量控制; PAH缩写参见表1。 图5.三文鱼(上图)和牛肉(下图)样品中浓度为 LOQ (1 ng/g) 的关键 PAH 化合物的色谱图 基质净化度评估 对三文鱼和牛肉样品最终提取物中的样品基质残留以及通过净化实现的基质残留去除率进行考察。图6显示了干燥样品残留物的外观以及实际残留物重量。基于未净化和经过 EMR-Lipid 净化的样品之间干燥残留物重量的差异, EMR-Lipid 净化使三文鱼样品的基质去除率达到60%,使牛肉样品的基质去去率达到92%。 开发并验证了一种采用固液萃取和 CaptivaEMR-Lipid 过滤柱净化对三文鱼和牛肉中的 PAH 进行多残留分析的简单、稳定且可靠的方法。对该方法进行优化以改善萃取效率并在 Captiva EMR-Lipid 过滤柱上实现完全洗脱,然后用异辛烷反萃取进行除水和溶剂交换。定量分析结果表明,所有检测的 PAH均获得了可接受的平均回收率(50%-120%)和优异的重现性,平均RSD 低于 20%,符合EC合格标准。此外,对于欧盟委员会规定的四种关键PAH, 该方法有望实现更低的 LOQ。结果表明,经优化的方法为三文鱼和牛肉中 PAH 的多残留分析提供了高效基质净化、优异的分析回收率和精确的结果。 三文鱼 牛肉 未净化 (mg/mL粗提物, n=2) 5.64 2.75 Captiva EMR-Lipid 净化 残留物 (mg/mL最终提取物, n=2) 2.24 0.21 基质残留去除率(%) 60 92 图6.通过残留物重量和外观评估基质残留去除率 ( 参考文献 ) ( 1. U.S. F ood and Drug Administration,2010. Protocol for Interpretation andUse of Sensory Testing and AnalyticalChemistry Results for Re-OpeningOil - Impacted Areas Closed toSeafood Harvesting Due to theDeepwater Horizon Oil Spill, h ttp://www.fda.gov/food/ucm217601.htm ) 2. European Commission Regulation(EC) 836/2011, Official Journal of theEuropean Union 2011, 215,9 3. Takigami, H.;et al. Brominatedflame retardants and otherpolyhalogenated compounds inindoor air and dust from two housesin Japan. Chemosphere 2009, 76,270-277 4. Viegas, O.;et al.A comparisonof the extraction procedures andquantification methods for thechromatographic determination ofpolycyclic aromatic hydrocarbonsin charcoal grilled meat and fishTalanta 2012, 88,677-683 ( 5. Stapleton, H. M.;et al.Determinationof polybrominated diphenyl ethers in environmental standard reference materials. Analytical and bioanalytical chemistry 2007, 387,2365-2379 ) 6. Forsberg, N. D.; Wilson, G. R.;Anderson, K. A. Determination ofparent and substituted polycyclicaromatic hydrocarbons in high-fatsalmon using a modified QuEChERSextraction, dispersive SPE andGC-MS. Journal of agricultural andfood chemistry 2011,59,8108-8116 ( 7. S verko, E.; et al. Dechlorane plus levels in sediment of the lower GreatLakes. Environmental science & technology 2008, 42,361-366 ) ( 8. Saito, K.; et al. Development of a n accelerated solvent extraction and gel permeation chromatographyanalytical method for measuringpersistent organohalogencompounds in adipose and organtissue analysis. Chemosphere 2004, 57,373-381 ) ( 9. Zhao, L. Determination of Multiclass, Multiresidue Pesticides i n Olive Oil by Captiva EMR-Lipid Cleanup and GC/MS/MS (利用 Captiva EMR-Lipid 净化和 GC/MS/MS 对橄榄油中的多类别多残留农药进行测定), 安捷伦科技公司应用简报,出版号 5994-0405EN ) ( 10. Lucas, D.; Zhao, L.增强型脂质去除 产品对三文鱼的 PAH分析,安捷伦科技公司应用简报,出版号5991- 6088CHCN, 2015 ) ( 11. Szelewski , M . ; Quimby, B. D.使用安捷 伦智氢洁离子源和增强型 PAH 分析仪优化 PAH 分析,安捷伦科技公司应用简报,出版号5991-3003CHCN ) 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线:800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com ( 本文中的信息、说明和指标如有变更,恕不另行通知。 ) 本应用介绍了用于分析三文鱼和牛肉中的多环芳烃 (PAH) 残留物的多残留方法的开发与验证。该方法使用液相萃取以及 Agilent Captiva EMR-Lipid 净化,并通过 GC/MS/MS 进行分析。使用固/液萃取 (SoLE) 对三文鱼或牛肉样品进行萃取,再通过 Captiva EMR-Lipid 净化。然后使用异辛烷对净化的样品洗脱液进行反萃取,以在 GC/MS/MS 分析之前去除水。在两步法 SoLE 中使用乙酸乙酯和乙腈的混合物,改善了脂质食品基质中 PAH 的萃取效率。Agilent Captiva EMR-Lipid 过滤柱能够实现对样品基质的高效选择性净化,并采用三文鱼和牛肉样品对开发的方法进行了验证。结果表明,所有检测的 PAH 化合物均获得了满足欧盟委员会规定(回收率50%–120%)的可接受的回收率结果,RSD 低于 20%,且三文鱼和牛肉样品中浓度为 1–500 ng/g 的分析物的校准曲线 R2 高于 0.99。通过重量法测得,三文鱼和牛肉样品中基质共萃取残留物的去除效率分别为 60% 和 92%。
确定






还剩10页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《三文鱼和牛肉中多环芳烃化合物-萘 (Na)检测方案(气质联用仪)》,该方案主要用于水产品中环境污染物检测,参考标准--,《三文鱼和牛肉中多环芳烃化合物-萘 (Na)检测方案(气质联用仪)》用到的仪器有Agilent GC 7890B 气相色谱仪
推荐专场
相关方案
更多
该厂商其他方案
更多
















