方案详情
文
FEI 公司是包括冷冻电镜 (cryo-EM) 在内的高性能透射、扫描电镜和
聚焦离子束显微镜领域的领导者,其在 2016 年成为 Thermo Fisher
的一部分。我们领先的电镜工作流程提供微米,纳米和皮米尺度的图
像和信息。
方案详情

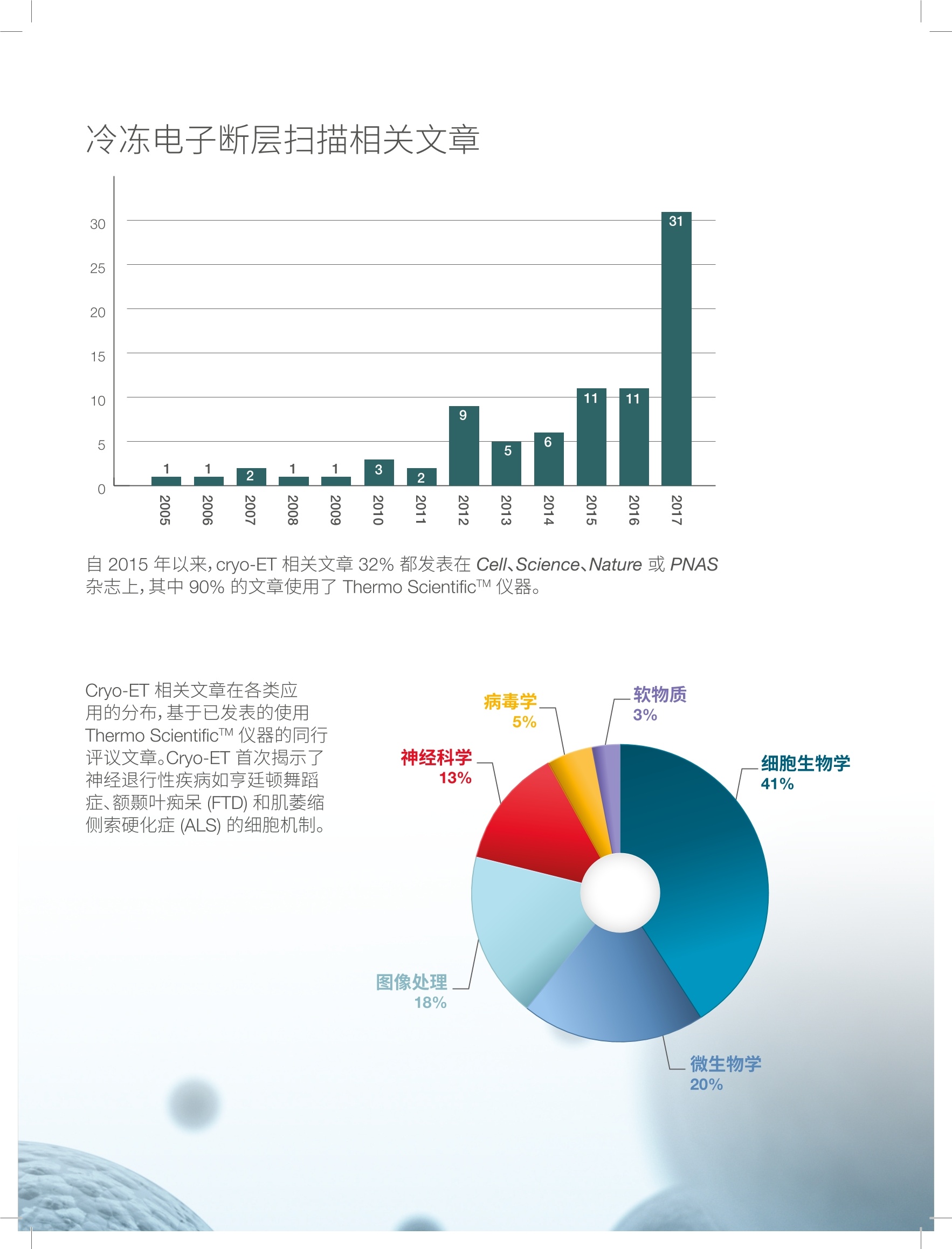
thermoscientific 冷冻电子断层扫描 精选参考指南 关于 Thermo Fisher Scientific 作为科学服务领域的世界领导者,我们提供革命性的显微镜技术和应用服务,致力于帮助我们的客户找到有意义的答案,加速突破性发现,提高生产力,并最终改变世界。 FEI 公司是包括冷冻电镜 (cryo-EM) 在内的高性能透射、扫描电镜和聚焦离子束显微镜领域的领导者,其在2016年成为 Thermo Fisher的一部分。我们领先的电镜工作流程提供微米,纳米和皮米尺度的图像和信息。 ( 封面图像: ) ( 冷冻电子 断层 扫描 成 像揭示 了 HeL a 细 胞 在 其 自然 环 境中各种组成的分子 结构 。感谢来 自 德 国 M a r ti ns r ie d 市马 克 斯 普朗 克 生 物 化学研究 所分子结构 生物 学系 ) ( J. M ah amid 博士提供 数据 。 ) 简介 2017年诺贝尔化学奖表彰了 Jacques Dubochet、Joachim Frank和 Richard Henderson 三位科学家的开创性工作,他们在冷冻电镜(cryo-EM) 领域的突破性成就帮助拓宽了这项技术在结构生物学领域的应用范围。 获奖者们曾使用 Thermo ScientificTM 的仪器,这些仪器可以让世界各地的科学家在他们日常研究中得到高分辨率的蛋白质结构三维图像。ThermoFisher 耗费数十年时间致力于发展服务结构生物学领域的硬件、软件、自动化和探测器等技术,将现代冷冻电镜变为现实。 近年来,单颗粒冷冻电镜成为新兴的结构生物学主流技术,该技术可以测定近原子分辨率的蛋白和蛋白复合物三维结构。但单颗粒冷冻电镜仅能 分析高度纯化分离出来的蛋白质,通过平均来确定其三维结构,缺乏与其细胞环境的联系。冷冻电子断层扫描成像技术恰好填补了这一空白,能够观察功能细胞环境中的蛋白质。如此便可观察蛋白质与其他细胞成分的关系以及相互作用,这给细胞生物学带来了曙光,其最终目标就是了解细胞内的每个分子-他们的结构,功能,位置和相互作用。 冷冻电子断层扫描 (cryo-ET) 能够最大限度保留结构信息,同时能够达到纳米级的分辨率。该技术在细胞内部采集三维快照,并在其拥挤的生理环境中观察蛋白质复合物。这种细胞内部的高分辨率三维图像为细胞功能提供了新的见解,并阐明了天然蛋白质复合物的排列和结构。该技术填补了光学显微镜和近原子分辨率的单颗粒冷冻电镜之间的空白。 采用 cryo-ET 进行细胞成像的3大原因 1.通过玻璃化处理同时保持分子和结构的完整性 2.让研究正在工作中的蛋白质变为可能,从而揭示其功能性相互作用 3.无须标记,无须固定,提供纳米级三维成像,揭示细胞内部运作方式 在进行冷冻电镜成像前,必须先使用冷冻聚焦离子束 (cryo-FIB)显微镜将细胞减薄到150-300 nm, 使其能够用于透射电镜成像。 三维断层扫描 有关冷冻断层扫描工作流程的详情,请参阅第16页 冷冻电子断层扫描相关文章 自2015年以来, cryo-ET 相关文章32%都发表在 Cell、Science、Nature 或 PNAS杂志上,其中90%的文章使用了 Thermo ScientificTM 仪器。 Cryo-ET 相关文章在各类应用的分布,基于已发表的使用Thermo ScientificTM 仪器的同行评议文章。Cryo-ET 首次揭示了神经退行性疾病如亨廷顿舞蹈症、额颞叶痴呆 (FTD) 和肌萎缩侧索硬化症 (ALS) 的细胞机制。 病毒学 .软物质 3% 5% 神经科学 .细胞生物学 13% 41% .18% 20% 推荐评论 四位 cryo-ET 讨论了近期的技术进展,鼓励细胞生物学家尝试 cryo-ET。不仅涵盖了样品制备和光电联用 (CLEM) 技术,还包括美国国立健康研究院共同基金拨款设立的全新冷冻电镜使用和培训中心。 Marx V., 2018“Calling all cell biologists to try cryo-ET”Nature Methods 15:575-578. doi: 10.1038/s41592-018-0079-y Nature 将冷冻电子断层扫描 (cryo-ET) 作为 2016年“Method to Watch 值得关注的方法”。Cryo-ET通过冷冻样品获得纳米级的大分子复合物信息,有利于细胞超微结构成像。 Doerr, A. 2017“Cryo-electron tomography” Nature Methods 14: 34. doi: 10.1038/nmeth.4115 合著者 Grant Jensen 喜欢引用物理学家兼诺贝尔奖得主 Richard Feynman 的话,后者曾在一次访谈中说:“很多生物学问题都很容易解决,只要你能看到它”(Marx 2018)。文章作者们介绍了如何利用 cryo-ET来诠释细胞生物学问题,包括与荧光成像的联用。 ( Oikonomou C .M., Jensen G.J. 2 0 17“Cel l u lar e le ctro n ) cryotomography: towards structural biology in situ” ( A n nu a l Revi e w of B io ch emi st ry 8 6 : 873 - 896 . ) ( d o i : 10 .1 146 /a nn u rev -bioc he m - 06 1 51 6- 0 447 4 1 ) Cryo-ET 是获得诺贝尔奖的冷冻电镜(cryo-EM)的分支科学,后者在纯化的大分子结构测定领域带来了分辨率的革命。文章作者们介绍了 cryo-ET如何通过原位研究揭示所谓的“分子社会学”,以及通过对未受干扰的细胞环境内重要分子组装和机器进行三维成像来揭示其机理的潜力。 Beck M., Baumeister W. 2016“Cryo-Electron Tomography:can it reveal themolecular sociology of cells in atomic detail?"Trends in Cell Biology 26(11):825-837. doi: 10.1016/i.tcb.2016.08.006 Cryo-ET 的样本需要经过减薄,以便在透射电镜(TEM) 中成像。Narayan 和 Subramaniam 介绍说“纳米级细胞成像技术正在经历一场平静的革革命“纳米级细胞成像技术正在经历一场平静的革命”,即通过聚焦离子束 (FIB) 减薄。FIB减薄技术源自于材料科学和半导体领域,现在已应用于超精细结构成像。这篇文章深入讨论了使用 FIB 进行离子减薄的技术,也选取了几个亚细胞器结构成像的实例,探索细胞机制潜在的宿主-病原体相互作用。 ( Narayan K. , Subramani a m S. 2015 ) ( “F o cused io n bea m s in b i ol ogy” ) ( Nature M e thods 12( 11): 1 02 1-1 0 31. do i: 10 . 1 0 3 8 /nm e th. 3 62 3 ) Asano S., Engel B.D., Baumeister W. 2016“In Situ Cryo-Electron Tomography: A Post-Reductionist Approach toStructural Biology”J Mol Biol. 428(2 Pt A):332-343.doi: 10.1016/i.imb.2015.09.030 ( Baker L.A., Grange M., Gr u newald K . 2017“ Ele c tr o n c ryo- t o m o gr a p hy c a ptu res m a c r o mo lecula r co m p l ex e s i n na t i vee nvi ronm ent s” Cu rr O pin St ru c t B iol . 4 6: 1 49- 15 6. doi : 1 0 . 10 1 6 / j. s bi . 2 0 1 7 . 0 8 . 0 0 5 ) ( Bu r baum L ., Schaff e r M., Engel B.D.,Mahamid J., AlbertS., Dan e v R., Bau m eister W ., Plitzko J. M . 2017“Ch arti ng m ol e cu la r la nd s ca p es usin g c r yo - e le ct ro n tom og r a ph y " Mi cro scopy T oday 2 5 (3 ):2 6- 31. d o i: 10. 10 17 /S 155 1 92 9 5 170 0038 4 ) ( Chlanda P., Krijn s e L ocker J. 2017 “T he s leepi ng b eau t y kis s ed aw ake : n e w me th od s in el e ctron mi c ro scopy t o s t u d y ce llu lar m emb r a n e s ” B ioc hemical Jo u rnal 474: 1 04 1 -105 3 . do i : 1 0 . 10 4 2 /BCJ2 0 1 609 90 ) ( Collado J . , Fernandez-Busnadiego R. 2 017 “Dec i ph e ri ng the m ole cular ar chi tec t u r e o f m em brane co n t ac t s i t e s by cr y o -elec tr on t o mog rap h y”B B A - Molec u l a r Ce l l R esearc h 1 8 64(9) : 1 5 07 - 1512. d oi: 1 0 . 1 0 1 6 / j. b b amcr.2 0 1 7 .03 . 0 0 9 ) ( Dubrovsky A., Sorrentino S. , H a rapin J., Sapra K.T., M eda l ia O. 2015“Devel o pm ents in cry o- elec tro n to m ogr a p h y for i n s i tu str u c t ural a n a ly s i s ” Ar c h iv es o f B io che mistr y an d B iop h ys i c s 5 8 1 : 78- 85 . d oi : 1 0 .1 0 1 6 / i .a b b. 2 0 15.04.0 0 6 ) ( Irobalieva R.N., Martins B., Medalia O. 2016“Ce l l ul ar s tructu ral bio logy a s revealed by cryo-e l ect r on to m o g raphy "J C e l l Sc ie nc e 1 29: 4 6 9-476. d o i : 1 0. 1242 /i cs . 1 71 9 67 ) Kizilyaprak C., Daraspe J., Humbel B.M. 2014 "Focused ion beam scanning electron microscopy in biology"JMicroscopy 254(3):109-114.doi: 10.1111/jmi.12127 Medeiros J.M., Bock D., Weiss G.L., Kooger R., Wepf R.A., and Pilhofer M. 2018“Robust workflow and instrumentation for cryo-focused ion beam milling of samples for electron cryotomography”Ultramicroscopy 190, 1-11. doi: 10.1016/i.ultramic.2018.04.002 Lucic V., Rigort A., Baumeister W. 2013“Cryo-electrontomography: the challenge of doing structural biology in situ"J. Cell Biol. 202, 407-419.doi: 10.1083/icb.201304193 ( Oikonomou C . M., Jensen G.J. 2016“A new view int o the prok a r yot i c c el l biol og y f r o m el ect ron c ry o t o mo graphy” N ature Re v iews Mic r ob io lo gy 1 4: 2 0 5 -220.d o i: 1 0 .1 03 8/n r m icro . 2 01 6 . 7 ) ( Orlov I ., Myasnikov A .G., Andronov L., Natchia r S.K., K h atterH. , Beinsteiner B . , Menetret J.F . , Hazemann l., Mohideen K . , Tazibt K ., Tabaron i R . , Kr a tzat H., Djabeur N . , B ruxellesT., Raivoniaina F., de P ompe o L., T o rchy M., Billas I.,Urzhumtsev A., Klaholz B.P. 2017 “The i n t eg rativ e r o l e o f c r y o e lect r o n m i cros c op y i n m ol ecular and ce l l u lar st ruct u r a l bi o lo g y " B iol C e l l 10 9 : 81 - 9 3. do i : 1 0 .1 11 1 /boc. 2 016 0 004 2 ) ( Rigort A. , Plit z k o J.M. 2015 “ C r y o-foc u sed -i on-beam appl i c ati ons i n struct u ral bi o l og y ” A rchives of Biochemistry and B iophysics 581: 1 2 2-130. d o i : 1 0 .1 0 16 / i.ab b .2 0 1 5. 0 2 . 00 9 ) ( Villa E. , S c haffe r M., Pli t zko J.M., Baumeister W. 2013 “O p enin g w i ndo ws in t o t he c e ll : foc us ed- i on - beam m i l l i ng forc ryo -ele c t r on t o m o gra phy” Cu rr Op in S t ru ct B iol. 23 : 7 7 1 -77 7. do i: 1 0 .1 0 16 / j .s b i . 2 013.0 8.006 ) ( Wagner J ., Schaffer M., Ferna n dez-Busn a diego R . 2017 “Cry o -e l ect r o n tomo graphy -t he c el l bio l ogy th at c ame i n fro m t h e co ld"F EB S L e t te r s 5 9 1: 2520 -2 533. d o i : 1 0 . 1 0 0 2/ 1 8 73 -3468 . 1 2 7 57 ) 细胞生物学 高分辨率冷冻电子断层扫描技术能够避免化学固定之类传统制样技术导致的人为干扰,对完全水合条件下的细胞形态进行成像。为了解复杂的生物机制,需要在保持细胞环境的情况下以纳米级分辨率对细胞内的蛋白质结构和复合物进行三维成像。采用相关光电联用 (CLEM) 方法可以先通过荧光显微镜锁定标记的蛋白质,然后通过冷冻电镜进行更高分辨率的成像。 交通必须持续流动,才能保持城市的运转。细胞也是如此。货物被包裹在一个叫做高尔基体的结构中的囊泡里运输到细胞各处。处些囊泡覆有一种叫做 COPI 的蛋白质,此蛋白质控制通过高尔基体的囊泡运输。哺乳动物 COPI 的结构是在细胞外进行的实验中发现的。研究人员现已通过使用冷冻电子断层扫描对衣藻中的 COPI 进行研究,以了解 COPI 在其原生环境中的结构。他们发现其外观与哺乳动物的 COPI 类似。他们还注意到,当囊泡(图中显示为浅粉/浅蓝/浅绿)通过高尔基体的不同部分(绿色/紫红色/蓝色/紫色)时,它们的大小、膜厚度和货物发生了变化,但其 COPI 包层的结构保持不变。此方法可以更清楚地看到 COPI 和 COPI 包膜囊泡在细胞内的活动。 资料来源: Lux Fatimathas, BPoD (10 April 2018) Bykov Y.S., Schaffer M., Dodonova S.O., Albert S., Plitzko J.M.,Baumeister W., Engel B.D., Briggs J.A.G.2017“The structure of the COPI coatdetermined within the cell" Elife 6: e32493. doi: 10.7554/eLife.32493 绿藻为设计快速生长农作物提供线索 由普林斯顿大学领衔对藻类生长机制中一个至关重要的环节进行了研究,其最终目标是籍此改善农作物的生长。在这幅图像中,研究人员采用了冷冻电子断层扫描技术对称为淀粉核的藻类结构进行成像,该结构能够富集二氧化碳以便于被光合成酶(紫色)获得。绿管内的黄色细管被认为是用于将碳和其他材料送入淀粉核。 资料来源: Yasemin Saplakoglu, Princeton University (21 Sep 2017) Freeman Rosenzweig E.S., Xu B., Kuhn Cuellar L., Engel B.D., Mackinder L.C.M., Konikas M.C.2017“The eukaryotic CO2-concentrating organelle is liquid-likeand exhibits dynamic reorganization”Cell 171:148-163. doi: 10.1016/j.cell.2017.08.008 Albert S., Schaffer M., Beck F., Mosalaganti S., Asano S., Thomas H.F., Plitzko J.M., Beck M., Baumeister W.,and Engel B.D.2017“Proteasomes tether to two distinct sites at the nuclear pore complex”PNAS 114, 13726-13731.doi: 10.1073/PNAS.1716305114 Engel B.D., Schaffer M., Kuhn Cuellar L., Villa E., Plitzko J.M., Baumeister W. 2015"Native architecture of theChlamydomonas chloroplast revealed by in situ cryo-electron tomography”Elife 4. pii: e04889. doi: 10.7554/eLife.04889.001 Engel B.D., Schaffer M., Albert S., Asano S., Plitzko J.M., Baumeister W. 2015“In situ structural analysis of Golgiintracisternal protein arrays”PNAS 112(36):11264-11269.doi: 10.1073/pnas.1515337112 Hagen C., Dent K.C.,Zeev-Ben-Mordehai T., Grange M., Bosse J.B., Whittle C., Klupp B.G., Siebert C.A.,Vasishtan D., Bauerlein F.J.B., Cheleski J., Werner S., Guttmann P., Henzler K., Demmerle J., Adler B.,Koszinowski U., Schermelleh L., Schneider G., Equist L.W., Plitzko J.M., Mettenleiter T.C., Grunewald K. 2015“Structural basis of vesicle formation at the inner nuclear membrane”Cell 163: 1692-1701.doi: 10.1016/i.cell.2015.11.029 Jasnin M., Ecke M., Baumeister W., Gerisch G. 2016“Actin organization in cells responding to a performated surface,revealed by live imaging and cryo-electron tomography”Structure 24(7): 1031-1043.doi: 10.1016/j.str.2016.05.004 Mosalaganti S., Kosinski J., Albert S., Schaffer M., Plitzko J.M., Baumeister W., Engel B.D., Beck M. 2018“In situ architecture of the algal nuclear pore complex”bioRxiv 232017. doi: 10.1101/232017 Pfeffer S., Dudek J., Schaffer M., Ng B.G., Albert S., Plitzko J.M., Baumeister W., Zimmerman R., Freeze H.H.,Engel B.D., Forster F. 2017 "Dissecting the molecular organization of the translocon-associated protein complex"Nature Communications 8: 14516.doi: 10.1038/ncomms14516 Swulius M.T., Nguyen L.T.,Ladinsky M.S., Ortega D.R., Aich S., Mishra M., and Jensen G.J.(2018) “Structure ofthe fission yeast actomyosin ring during constriction”PNAS 115, E1455-E1464. doi: 10.1073/pnas.1711218115 感谢来自德国 Martinsried 市马克斯普朗克生物化学研究所分子结构生物学系J. Mahamid 博士提供数据。 冷冻电子断层扫描首次 揭示了细胞核在其天然 未受干扰环境中的样貌 此技术揭示出,蛋白质纤维使细胞核成为周围最坚硬的细胞器。冷冻电子断层扫描成像揭示了 HeLa 细胞在其自然环境中各种组成的分子结构。 资料来源:Sarah Everts, C&EN (29 Feb 2016Vol. 94 Issue 9) Mahamid J., Pfeffer S., Schaffer M., Villa E.,Danev R., Cueller L.K., Forster F., Hyman A.A., Plitzko J.M.,Baumeister W. 2016“Visualizing the molecular sociology at theHeLa cell nuclear periphery” Science 351: 969-972.doi: 10.1126/science.aad8857 分子如何调节神经行为?答案在于神经元以及神经通信的分子机制。单颗粒分析(SPA) 破解了高度纯化蛋白质的结构,而冷冻电子断层扫描 (cryo-ET) 则打开了进入细胞的窗口,有助于在分子级别上了解蛋白质在其自然环境中的功能。 蛋白聚集体导致停转 运动神经元疾病(或 ALS)中所涉及的蛋白质聚集物已经被证实会引起正常蛋白质降解所需分子机器的停转。 蛋白质聚集体是神经退行性病变的标志。这种聚集体结构的高分辨率照片提供了一个前所未有的视角,让我们了解这些蛋白质是如何破坏重要的细胞功能的。 Poly(GA) 和 Poly(Q) 聚集体机理对比的详情请分别参见 Guo 等人发表的文章 (Cell, 2018) 和 Bauerlein 发表的文章 (Cell, 2017),将在下一部分中进行重点介绍。 Poly(GA) 和 Poly(Q) 聚集体毒性机理存在明显差异。图像版权所有 ◎2018 Elsevier Inc. Gruber A., Hornburg D., Antonin M., Krahmer N., Collado J., Schaffer M., Zubaite G., Luchtenborg C., Sachsenheimer T.,Brugger B., Mann M., Baumeister W., Hartl U. F, Hipp M. S., Ferneandez-Busnadiego R. 2018“Molecular and structuralarchitecture of polyQ aggregates in yeast" PNAS 115, E3446-E3453. doi: 10.1073/pnas.1717978115 Shahmoradian S.H., Genoud C., Graff-Meyer A., Hench J., Moors T., Schweighauser G., Wang J., Goldie K.N., Suetterlin R.,Castano-Diez D., et al.2017“Lewy pathology in Parkinson's disease consists of a crowded organellar membranous medley”BioRxiv.doi: 10.1101/137976 ALS 二肽重复带缠绕蛋白酶体? 在神经元中, ALS/FTD 聚甘氨酸-丙氨酸多肽聚集成一个密集的扭曲带网络。这些条带能隔离细胞的大部分蛋白酶体。许多被捕获的蛋白酶体被冻结在催化过渡状态。 资料来源:Daisuke Ito. ALZ Forum.02 Feb 2018 Guo Q., Lehmer, C., Martinez-Sanchez A., Rudack T., Beck F, Hartmann, H., Perez-Berlanga M., Frottin F., Hipp M.S., Hartl F.U., et al.2018“/n Situ Structure of NeuronalC9orf72 Poly-GA Aggregates Reveals Proteasome Recruitment”Cell 172, 696-705.e12.doi: 10.1016/.cell.2017.12.030 神经元内一个聚集体的3D 渲染图: poly-GA丝带(红色)、26S蛋白酶体(绿色)、核糖体(黄色)、TRiC/CCT伴侣蛋白(紫色)。图像版权所有C 2018 Elsevier Inc. 大脑中的野草 阿尔兹海默症、帕金森症和亨廷顿氏舞蹈症等神经退行性疾病的共同特征是病人神经细胞中毒性蛋白沉淀的积累。一旦这些聚集体出现,它们就开始像杂草一样繁殖。这些沉积物是否以及如何损伤神经细胞并导致其死亡,在很大程度上仍无法解释。详细了解这些蛋白质聚集体的三维结构将有助于研究人员员解这一难题。 资料来源:MPIof Biochemistry, 07 Sept 2017 Bauerlein F.J.B., Saha l., Mishra A., Kalemanov M., Martinez-Sanchez A., Klein R., Dudanova l., Hipp M.S., Hartl F.U., Baumeister W., et al.2017 “In SituArchitecture and Cellular Interactions of PolyQ Inclusions”Cell 171, 179-187.e10.doi: 10.1016/i.cell.2017.08.009 图像版权所有 ◎ 2017 Elsevier Inc. 基于不同突触功能的超微结构的原位分析 这幅图像是冷冻电子断层扫描得到的海马神经元间兴奋性突触的三维图像。不同的结构被渲染成了不同的颜色,更方便观察突触的结构,其中包括突触前膜(浅黄色)和突触后膜(蓝绿色)、ER内质网和核内体(橙色)、线粒体(外部:金色和浅粉色)、微管(黄色)、核糖体(蓝绿色)、肌动蛋白丝(红色)、假定的突触前粘附分子(洋红)和突触后粘附分子(黄色)、假定的谷氨酸受体(红色)、与突触后膜相连的突触后密集区蛋白丝(蓝色)或远离突触后膜的突触后密集区蛋白丝(紫色)以及致密核心囊泡(紫色)和不同大小的突触囊泡。 Tao C.-L., Liu Y.-T., Sun R., Zhang B., Qi L., Shivakoti S., Tian C.-L., Zhang P.,Lau P.M., Zhou Z.H., et al.2018“Differentiation and characterization of excitatory andinhibitory synapses by cryo-electron tomography and correlative microscopy”JNeurosci1548-17.doi: 10.1523/JNEUROSCI.1548-17.2017 微生物学 我们如何对抗细菌耐药性?细菌入侵者是如何在宿主体内感染并存活的呢?微生物学涵盖了从细胞生物学和免疫学到遗传学和进化论等许多跨学科层面。冷冻电子断层扫描 (cryo-ET) 让我们能够在原位从诸多层面去观察原核细胞,包括从细胞膜和"细胞骨架"形成到亚细胞组织的诸多层面、鞭毛转子复合体运动性及其发病机理。 冷冻电子断层扫描揭示了细菌细胞是如何重组成一个更J:复杂的植物或动物细胞,有一个红色的像细胞核一样的腔室和较小的淡蓝色的核糖体。正在繁殖的病毒有深蓝色的头部和粉红色的尾巴。图像由 Vorrapon Chaikeeratisak、Kanika Khanna、AxelBrilot 和 Katrina Nguyen 提供。 被 DNA 充气的前芽孢(左图)和由于缺乏 DNA 而泄气的前芽孢的冷冻电子图像。图像版权所有C2018 Elsevier Inc. 将标准培养基内完整的噬菌蛭弧菌细胞通过冲入式冷冻再用冷冻电子断层扫描进行成像。将通过连续倾转得到的图像进行三维重构。图中显示了重构后的一个切片(左图),以及可见细胞结构的一个片段(右图)。图像版权所有 C 2016 Elsevier Inc. Bock D., Medeiros J.M., Tsao H.-F., Penz T., Weiss G.L., Aistleitner K., Horn M., and Pilhofer M. 2017 "In situ architecture,function, and evolution of a contractile injection system”Science 357, 713-717. doi: 10.1126/science.aan7904 Boedeker C., Schuler M., Reintjes G., Jeske O., Teeseling M.C.F. van., Jogler M., Rast P., Borchert D., Devos D.P., KucklickM., Schaffer M., Kolter R., Niftrik L van, Engelmann S., Amann R., Rohde M., Engelhardt H., Jogler C. 2017“Determining thebacterial cell biology of Planctomycetes”Nature Communications 8: 14853.doi: 10.1038/ncomms14853 Chetrit D., Hu B., Christie P.J., Roy C.R., and Liu J. 2018."A unique cytoplasmic ATPase complex defines the Legionellapneumophila type lV secretion channel”Nature Microbiology 3, 678-686. doi: 10.1038/s41564-018-0165-z Cohen E.J., Ferreira J.L., Ladinsky M.S., Beeby M., and Hughes K.T.2017“Nanoscale-length control of the flagellar driveshaftrequires hitting the tethered outer membrane”Science 356, 197-200. doi: 10.1126/science.aam6512 Wang J., Brackmann M., Castano-Diez D., Kudryashev M., Goldie K.N., Maier T., Stahlberg H., and Basler M. 2017“Cryo-EM structure of the extended type VI secretion system sheath-tube complex”Nature Microbiology 2, 1507-1512. doi: 10.1016/j.cell.2015.01.037 细菌如何传递蛋白 ⅢI型沙门氏菌分泌机制的完整结构解释了细菌如何将蛋白质运送到真核细胞内。图像版权所有 C 2017Elsevier Inc. 沙门氏菌以及许多其他细菌性病原体使用一种类似纳米注射器状的装置将毒性蛋白释放到目标人类细胞内。[...]“该装置类似一个螫刺,它会将现成的细菌蛋白注入到哺乳动物细胞内,以期强占它们以供病原体使用”,评论自该论文的资深共同作者 Jorge Galan,他是耶鲁大学 Lucille P.Markey 微生物发病机理教席教授。对这种结构的了解可以帮助研究人员设计新的抗感染策略,以对抗各种细菌病原体,如沙门氏菌、假单胞菌、大肠杆菌、鼠疫杆菌和衣原体。 资料来源:耶鲁大学参考文献: Hu et al., Cell 168,1065, 2017. Hu B., Lara-Tejero M., Kong Q., Galán J.E., and Liu J. (2017) “In Situ Molecular Architecture of the Salmonella Type III Secretion Machine”Cell 168, 1065-1074.e10.doi: 10.1016/j.cell.2017.02.022 综述 病毒学 病毒粒子是微型高效的基因传递机器。基础研究最常见的主攻方向是了解疾病和病毒进化,目标是预防埃博拉和艾滋病之类的病毒性疾病。病毒也被用来进行有益的基因治疗以操纵细胞。最明显的病毒检测和识别方法是直接显示病原体。利用冷冻电子断层扫描对某些不可培养病毒的形态进行解析,以提供足够的分类特征。Cryo-ET 提供了结构构象的信息,有助于理解扰乱病毒功能的新机制,从而为未来抗病毒药物的开发提供依据。 病毒衣壳灵活性的结构启示 病毒衣壳是包裹病毒毒传物质的蛋白质结构。之前对HIV-1衣壳的结构研究依赖重组、交联或突变的衣壳蛋白质。Mattei 等人最新报道了从完整的病毒粒子经过冷冻电子断层扫描得的 HIV-1衣壳亚纳米分辨率结构。这些结构证实了衣壳的空心圆锥形状,并且可以明确每个衣壳六聚体和五聚体在晶格结构内的具体位置。这些结构还揭示了衣壳的灵活本质,这可能有助于其适应与宿主细胞因子的相互作用。 资料来源:Mattei, et al.Science 254, 1434,2016 在前所未有的高分辨率下深入了解 HIV:绿色和红色的 CA 蛋白结构形成了病毒基因组的锥形保护膜。图像由EMBL实验室的Simone Mattei提供。绿色和红色 CA 保护结构组成了病毒基因组的锥形防护外壳。图像提供者: Simone Mattei,EMBL。 Bharat T.A.M., Kureisaite-Ciziene D., Hardy G.G., Yu E.W., Devant J.M., Hagen W.J.H., Brun Y.V., Briggs J.A.G., and Lowe J. 2017“Structure of the hexagonal surface layer on Caulobacter crescentus cells”Nature Microbiology 2,17059. doi: 10.1038/nmicrobiol.2017.59 Gallagher J.R., Torian U., McCraw D.M., and Harris A.K.2017“Structural studies of influenza virus RNPs by electron microscopyindicate molecular contortions within NP supra-structures”J. Structural Biology 197, 294-307. doi: 10.1016/j.jsb.2016.12.007 Wan W., Kolesnikova L., Clarke M., Koehler A., Noda T., Becker S., and Briggs J.A.G.2017“Structure and assembly of theEbola virus nucleocapsid”Nature 551, 394-397. doi: 10.1038/nature24490 Mattei S., Glass B., Hagen W.J.H., Krausslich H.-G., and Briggs J.A.G.2016"The structure and flexibility of conical HIV-1 capsidsdetermined within intact virions” Science 354, 1434-1437. doi: 10.1126/science.aah4972 重点介绍文章 Mattei S., Glass, B., Hagen W.J.H., Krausslich H.G., and Briggs J.A.G.2016“The structure andflexibility of conical HIV-1 capsids determined within intact virions”Science 354,1434-1437.doi: 10.1126/science.aah4972 冷冻电子断层扫描成像揭示了 HeLa 细胞在其自然环境中各种组成的分子结构。感谢来自德国Martinsried 市马克斯普朗克生物化学研究所分子结构生物学系J. Mahamid 博士提供数据。 推动原位细胞生物学和结构生物学的发展 冷冻电子断层扫描可以让研究人员对蛋白在其功能性细胞环境中进行研究并且可以对无法纯化的超分子结构进行解析。Thermo Scientific"Aquilos" Cryo-FIB 是首个专门用于在对生物样品进行冷冻电镜高分辨率电子断层成像前对其进行冷冻减薄的 cryo-DualBeam"冷冻双束(聚焦离子束/扫描电子显微镜)系统。Cryo-ET能以前所未有的高分辨率对细胞超微结构进行三维成像,同时保持细胞结构完整性,有助于加快对细胞内整个运作方式的了解。 详见 thermofisher.com/EM-life-sciences Thermo Fisher Scientific 及其子公司的财产。 冷冻断层扫描工作流程 Cryo-ET无须标记、无须固定,能对细胞内部运作进行纳米级分辨率的三维成像。除此之外,它还可以对细胞内部进行三维成像,以及对蛋白复合体在其天然环境进行成像。采用光电联用 (CLEM) 方法可以先通过荧光显微镜锁定标记的蛋白,然后通过冷冻电镜进行更高分辨率的成像。许多细胞对电子透射显微镜来说都太厚了,电子无法穿透他们,因此必须先使用冷冻聚焦离子束显微镜 (cryo-FIB) 将玻璃化细胞进行离子减薄,然后再置于透射电镜下进行成像。 A-通过玻璃化制备样本 常规培养方法制备的细胞在碳膜金载网上生长,然后用制冷剂(通常是液态乙烷)进行冲入式冷冻。样本中的水由于冷冻速度快而不会结晶,从而可以避免通常慢速冷冻过程中会出现的分子级破坏(由形成的冰晶导致)。 B-荧光定位 将样本转移到冷冻荧光光学显微镜上,鉴定出感兴趣的结构区域。专用的冷冻光镜平台会使样品在冷冻荧光成像期间保持在其玻璃化状态。 C-离子减薄 专用 cryo-FIB 在玻璃态温度(约-170℃)下制备一个均匀的lamella(薄层)。 D-冷冻透射电镜成像 在冷冻电子断层成像过程中,样品以已知的轴向增量进行一系列倾转。然后,将得到的不同倾转角度的投影图像通过反向投影过程进行组合计算,从而生成三维断层扫描体。 E-重构和可视化 以细胞结构为特征的三维断层图可以通过多种方式进行区域划分和着色,以增强其可视性。在三维电子断层照片中还可以对感兴趣的结构提取相对较小的子数据集,并对其进行图像处理。 推荐文献资料 Schaffer M., Engel B.D., Laugks T., Mahamid J., Plitzko J.M., Baumeister W. 2015"Cryo-focused Ion Beam Sample Preparation for Imaging Vitreous Cells by Cryo-electron Tomography”Bio Protoc 5(17) pii: e1575. doi:10.21769/BioProtoc.1575 Schaffer M., Mahamid J.,Engel B.D., Laugks T., Beumeister W., Plitzko W. 2016“Optimized cryo-focused ion beam sample preparation aimed at in situ structural studiesof membrane proteins” J Struct Biol. 197(2):73-82. doi: 10.1016/j.jsb.2016.07.010 Arnold J., Mahamid J., Lucic V., de Marco A., Fernandez J.J., Laugks T., Mayer T.,Hyman A., Baumeister W., Plizko J. 2016“Site-Specific Cryo-Focused Ion BeamSample Preparation Guided by 3D Correlative Microscopy”Biophys J 1 110(4): 860-869.doi: 10.1016/j.bpj.2015.10.053 游动中的精子细胞 Ium 活动 动力蛋白马达 当时 抑制动力蛋白马达 .现在 从梨状四膜虫纤毛中分离出的30S动 力蛋白的电子显微照片。Gibbons 和 Rowe,1965年。 这些鞭毛的结构和行为直到电子显微镜的出现才得以揭示。利用 Cryo-ET 技术对游动的海胆精子细胞的活动鞭毛进行了成像。图像版权所有◎2018作者,保留部分权利;AAAS 独家许可。没有美国政府原创作品的所有权。 Lin J., and Nicastro D. 2018“Asymmetric distribution and spatial switching of dynein 备注 上海 上海市浦东新区新金桥路27号3,6,7号楼 邮编201206 电话021-68654588*2570 生命科学产品和服务业务 上海市长宁区仙霞路99号21-22楼 邮编200051 电话021-61453628/021-61453637 电子显微镜产品及服务业务 上海市浦东新区张江高科技园区 盛夏路399号8&9号楼 邮编201210 电话8621 80125200 南京 南京市中央路201号南京国际广场南楼1103室 邮编210000 电话021-68654588*2901 广州 广州国际生物岛寰宇三路36、38号合景星辉广 场北塔204-206单元 邮编510000 电话020-82401600 成都 成都市临江西路1号锦江国际大厦1406室 邮编610041 电话028-65545388*5300 西安 西安市高新区科技路38号林凯国际大厦 1006-08单元 邮编710075 电话029-84500588*3801 昆明 云南省昆明市五华区三市街6号柏联广场写字 楼908单元 邮编650021 电话0871-63118338*7001 赛默飞世尔科技在全国有共21个办事处。本资料中的信息,说明和技术指标如有变更,恕不另行通知。 ThermoFisherSCIENTIFIC Ben Engel提供 冷冻电子断层扫描冷冻电子断层扫描 (cryo-ET) 能够最大限度保留结构信息,同时能够达到纳米级的分辨率。该技术在细胞内部采集三维快照,并在其拥挤的生理环境中观察蛋白质复合物。这种细胞内部的高分辨率三维图像为细胞功能提供了新的见解,并阐明了天然蛋白质复合物的排列和结构。该技术填补了光学显微镜和近原子分辨率的单颗粒冷冻电镜之间的空白。采用 cryo-ET 进行细胞成像的 3 大原因:1. 通过玻璃化处理同时保持分子和结构的完整性2. 让研究正在工作中的蛋白质变为可能,从而揭示其功能性相互作用3. 无须标记,无须固定,提供纳米级三维成像,揭示细胞内部运作方式在进行冷冻电镜成像前,必须先使用冷冻聚焦离子束 (cryo-FIB)显微镜将细胞减薄到 150-300 nm,使其能够用于透射电镜成像。
确定


















还剩18页未读,是否继续阅读?
赛默飞世尔科技电子显微镜为您提供《冷冻电子断层扫描中cryo-ET精选参考指南检测方案(透射电镜)》,该方案主要用于其他中cryo-ET精选参考指南检测,参考标准--,《冷冻电子断层扫描中cryo-ET精选参考指南检测方案(透射电镜)》用到的仪器有Krios G4冷冻透射电子显微镜(cryo-TEM)
推荐专场
相关方案
更多
















