方案详情
文
结合了单克隆抗体 (mAb) 特异性与细胞毒性分子效能的抗体药物偶联物 (ADC) 已获得了越来越多的关注,它作为一种极具前景的方法可用于实现选择性更强的癌症治疗。由于潜在药物结合位点众多且在这些位点中的占位形式多样,因此 ADC 与未修饰的生物治疗抗体相比具有更高复杂性与异质性。为获得 ADC 分子的完全表征,本研究进行肽谱分析实验以获得关于 ADC 结合位点的详细位点特异性信息。本应用简报介绍了结合采用 Agilent AssayMAP Bravo 样品前处理平台的自动化蛋白质酶解、采用高分辨率精确质量数 Agilent 6550 iFunnel Q-TOF 系统的 LC/MS 分析以及 Agilent BioConfirm 软件的 ADC 肽谱分析工作流程。T-DM1 获得的序列覆盖率为 98.7%。采用药物偶联物可鉴定出 29 个以上的赖氨酸位点。
方案详情

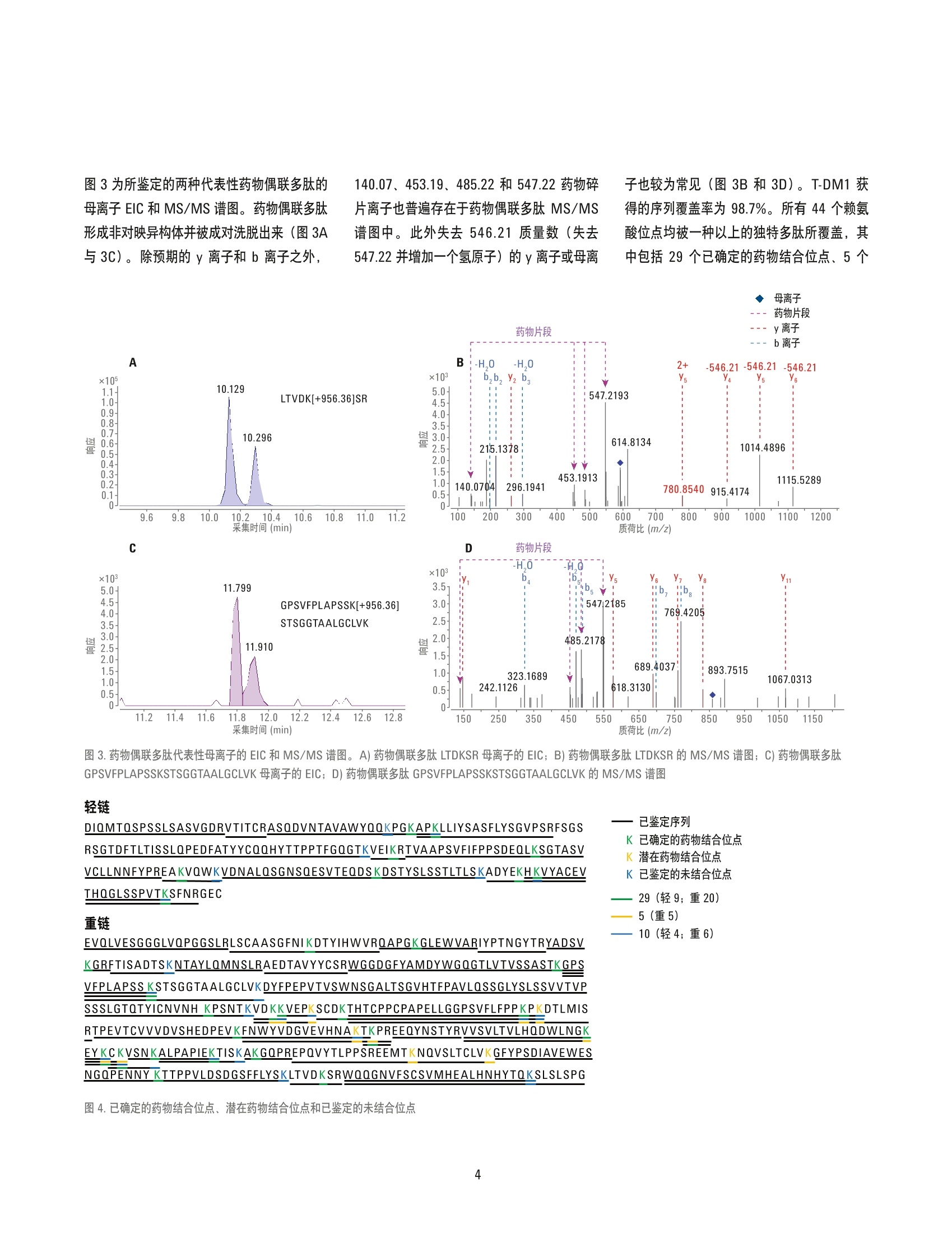
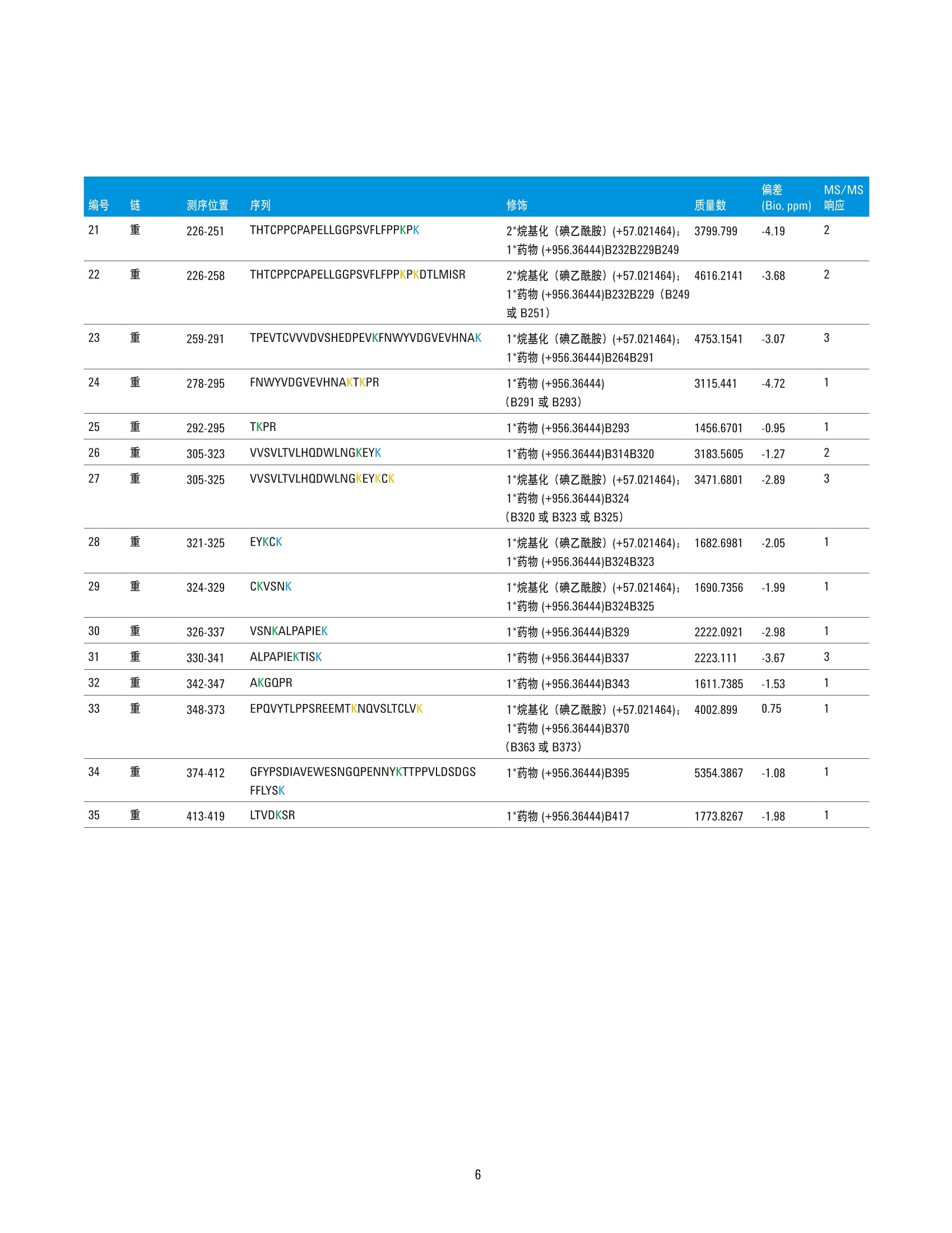
分析抗体-药物偶联物的药物结合位点利用自动化样品前处理与 LC/MS 分析 应用简报 作者 前言 Jing Chen 安捷伦科技公司 1232 Fourier Drive, Suite 100,Madison, WI 53717, USA Alex Zhu 安捷伦科技公司 ( 2850 C enterville Road, ) 结合了单克隆抗体(mAb) 特异性与细胞毒性分子效能的抗体药物偶联物 (ADC) 已获得了越来越多的关注,它作为一种极具前景的方法可用于实现选择性更强的癌症治疗。由于潜在药物结合位点众多且在这些位点中的占位形式多样,因此 ADC 与未修饰的生物治疗抗体体比具有更高复杂性与异质性。为获得 ADC 分子的完全表征,本研究进行肽谱分析实验以获得关于ADC 结合位点的详细位点特异性信息。本应用简报介绍了结合采用 Agilent AssayMAPBravo 样品前处理平台的自动化蛋白质酶解、采用高分辨率精确质量数 Agilent 6550iFunnel Q-TOF 系统的 LC/MS 分析以及 Agilent BioConfirm 软件的 ADC 肽谱分析工作流程。T-DM1 获得的序列覆盖率为98.7%。采用药物偶联物可鉴定出29个以上的赖氨酸位点。 Wilmington, DE 19808, USA Agilent Technologies 试剂与化学品 胰蛋蛋酶来自安捷伦科技公司 (Santa Clara,CA)。 Eppendorf 96 孔 PCR 板购自 Eppendorf(Hauppauge,NY), 其他所有化学品均购自Sigma-Aldrich (St.Louis, MO)。 自动化胰蛋白酶酶解 采用去离子(DI) 水将冻干的 T-DM1 和赫赛汀复溶制成 20 mg/mL 的溶液,然后分为若干等份并在使用前始终于-80°C下储存。在 Agilent AssayMAP Bravo 工作台(Santa Clara, CA) 上采用溶液内酶解方案:单板1.0版进行抗体酶解,该方案为控制AssayMAP Bravo 的蛋白样品前处理工作台软件中的一部分。简而言之,先将T-DM1和赫赛汀分别稀释至1.5 mg/mL, 随后将10pLT-DM1分别移取至96孔 Eppendorf PCR板第一列的每个孔中(位置A1-H1),并将10 uL赫赛汀分别取取至96孔板第二列的第一个孔中(位置A2)。将10 pL 20 mM二硫苏糖醇 (DTT) 溶于 50%2,2,2-三氟乙醇(TFE)中;将100mM 碳酸氢铵缓冲液加入样品中并使用内置帕尔帖的加热/冷却器于60°℃下在台板上温育一小时。随后,向每个孔中加入 10 pL 50 mM 碘安并胺并于室温下在台板上避光温育30分钟。最后,用20pL 50mM碳酸氢铵缓冲液稀释样品,向其中加入30 pL10 pg/mL 胰蛋白酶并混匀,并于37℃下在台板上温育两小时。 使用配备安捷伦双喷射流 ESI 离子源的Agilent 6550 iFunnel Q-TOF (Santa Clara,CA) 与 Agilent 1290 Infinity UHPLC 系统(Waldbronn, Germany) 联用进行 LC/MS分析。表1和表2列出了所采用的 LC/MS参数。每次运行的总进样量为1.5 ug。 脱酰氨基化 (N): +0.9840 连接药物 (K): +956.3644 所有已鉴定的多肽均已经过 MS/MS谱图的确认。 数据分析 在鉴定 ADC 结合位点时,首先利用分子特征提取(MFE) 对化合物进行提取,随后利用 Agilent MassHunter BioConfirm 软件(B.07.00版)与具有以下修饰的 ADC 序列进行匹配: 对于已鉴定的35种药物偶联多肽,峰面积由从仅 MS 数据中所提取的母离子(M、M+H,M+2H) 的 EIC 积分得出。%CV 根据峰面积(n=8)计算得出。 表1.液相色谱参数 参数 Agilent 1290 Infinity 液相色谱系统 色谱柱 Agilent ZORBAX Eclipse Plus C18, RRHD, 2.1×100 mm, 1.8 pm 样品恒温箱 5°C 流动相A 0.1%甲酸的水溶液 流动相B 0.1%甲酸的乙腈溶液 梯度 时间 (min) %B 0-16 5-50 16-18 50-90 18-19 90 后运行时间 3 min 柱温 55°C 流速 0.5 mL/min 表2.质谱参数 参数 Agilent 6550 Q-TOF LC/MS 系统 离子模式 正离子模式 离子源 安捷伦双喷射流 干燥气温度 150°C 干燥气流速 13 L/min 鞘气温度 250°C 鞘气流速 12 L/min 雾化器 35 psi 毛细管电压 3500 V 喷嘴电压 250 V 碎裂电压 250V Oct RF Vpp 750V MS采集模式 扩展动态范围, 2 GHz;用于药物结合位点鉴定的采用自动MS/MS模式;用于 重现性评估的采用仅 MS 模式 MS 范围 300-2000 m/z 结果与讨论 为了鉴定 T-DM1的药物结合位点,本文中采用 AssayMAP Bravo 自动化样品前处理技术对 ADC 及其相应 mAb 赫赛汀进行还原、烷基化与酶解。然后通过 Agilent 6550 Q-TOF与 Agilent 1290 Infinity LC 联用对以上样品进行分析。原始数据经 Agilent BioConfirm软件进行处理后可用于药物偶联多肽的鉴定(图1). T-DM1 和赫赛汀的基峰色谱图 (BPC) 中显示出相似峰形,而 T-DM1色谱图的后半部分则显示出额外的峰(图2A)。由于已知DM1会在547.22处产生强碎片离子,因此可从MS/MS谱图中提取出该离子的EIC。 图 1.使用 Agilent AssayMAP Bravo 和 Agilent 1290 Infinity LC/MS 系统的 ADC 肽谱分析工作流程 图2.酶解 T-DM1 和赫赛汀的基峰色谱图 (A)以及来自 MS/MS 谱图的 547.22处的提取离子色谱图(B) 图3为所鉴定的两种代表性药物偶联多肽的母离子 EIC 和 MS/MS 谱图。药物偶联多肽形成非对映异构体并被成对洗脱出来(图3A与3C)。除预期的y离子和b离子之外, 母离子 图3.药物偶联多肽代表性母离子的 EIC 和 MS/MS 谱图。A)药物偶联多肽 LTDKSR 母离子的 EIC; B)药物偶联多肽 LTDKSR 的 MS/MS谱图; C)药物偶联多肽GPSVFPLAPSSKSTSGGTAALGCLVK 母离子的 EIC; D)药物偶联多肽 GPSVFPLAPSSKSTSGGTAALGCLVK 的 MS/MS 谱图 轻链 已鉴定序列 DIQMTOSPSSLSASVGDRVTITCRASODVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSRSGTDFTLTISSLOPEDFATYYCQQHYTTPPTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALOSGNSOESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC K 已确定的药物结合位点 K潜在药物结合位点 K 已鉴定的未结合位点 29(轻9;重20) 5(重5) 重链 10(车4;重6) EVOLVESGGGLVOPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRYADSVKGRFTISADTSKNTAYLOMNSLRAEDTAVYYCSRWGGDGFYAMDYWGOGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLOSSGLYSLSSVVTVPSSSLGTOTYICNVNH KPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNY KTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG 潜在药物结合合点(根据MS 和 MS/MS可鉴定出独特的药物偶联多肽,但无法在多肽的多个赖氨酸位点中定位精确结合位点)以及10个未结合位点(未发现结合证据)(图4)。 表3列出了具有已确定的药物结合位点、潜在的药物结合位点以及未证实发生结合的位点的35种独特的药物偶联多肽,位点分别以绿色、橙色和蓝色标记。 表3.已鉴定的独特药物偶联多肽。已确定的药物结合位点标记为绿色。潜在药物结合位点标记为橙色,其具体结合位点无法根据 MS/MS确定。未结合的赖氨酸氨基标记为蓝色 偏差 MS/MS 编号 链 测序位置 序列 修饰 质量数 (Bio,ppm) 响应 21 重 226-251 THTCPPCPAPELLGGPSVFLFPPKPK 2*烷基化(碘乙酰胺) (+57.021464); 3799.799 -4.19 2 1*药物 (+956.36444)B232B229B249 22 重 226-258 THTCPPCPAPELLGGPSVFLFPPKPKDTLMISR 2*烷基化(碘乙酰胺)(+57.021464); 4616.2141 -3.68 2 1*药物(+956.36444)B232B229(B249 或B251) 23 重 259-291 TPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAK 1*烷基化(碘乙酰胺)(+57.021464);4753.1541 -3.07 3 1*药物 (+956.36444)B264B291 24 重 278-295 FNWYVDGVEVHNAKTKPR 1*药物 (+956.36444) 3115.441 -4.72 1 (B291 或 B293) 25 重 292-295 TKPR 1*药物(+956.36444)B293 1456.6701 -0.95 1 26 重 305-323 VVSVLTVLHQDWLNGKEYK 1*药物(+956.36444)B314B320 3183.5605 -1.27 2 27 重 305-325 VVSVLTVLHQDWLNGKEYKCK 1*烷基化(碘乙酰胺) (+57.021464); 3471.6801 -2.89 3 1*药物 (+956.36444)B324 (B320 或 B323或 B325) 28 重 321-325 EYKCK 1*烷基化(碘乙酰胺)(+57.021464);11682.6981 -2.05 1 1*药物 (+956.36444)B324B323 29 重 324-329 CKVSNK 1*烷基化(碘乙酰胺) (+57.021464);11690.7356 -1.99 1 1*药物 (+956.36444)B324B325 30 重 326-337 VSNKALPAPIEK 1*药物 (+956.36444)B329 2222.0921 -2.98 1 31 重 330-341 ALPAPIEKTISK 1*药物(+956.36444)B337 2223.111 -3.67 3 32 重 342-347 AKGOPR 1*药物 (+956.36444)B343 1611.7385 -1.53 1 33 重 348-373 EPOVYTLPPSREEMTKNQVSLTCLVK 1*烷基化(碘乙酰胺) (+57.021464); 4002.899 0.75 1 1*药物 (+956.36444)B370 (B363 或 B373) 34 重 374-412 GFYPSDIAVEWESNGQPENNYKTTPPVLDSDGS 1*药物(+956.36444)B395 5354.3867 -1.08 1 FFLYSK 35 重 413-419 LTVDKSR 1*药物(+956.36444)B417 1773.8267 -1.98 1 为评估工作流程的重现性,将“仅 MS模式”下采集的35种已鉴定药物偶联多肽的母离子 EIC 进行提取与积分。图5A为两种代表性药物偶联多肽8次重复运行后的EIC叠加图。图5B 为信号强度不同的四种代表性多肽8次重复运行后的峰面积积分图。在全部35种独特药物偶联多肽中,22种的CV%介于5%-10%之间(平均7.79%),9 种的 CV%介于10%-20%之间(平均12.29%),而剩余4种由于信号强度较低,CV%高于20%(图5C)。 结论 本文开发出一种用于深入表征抗体药物偶联物的集成化肽谱分析工作流程。实验结果证明, 针对 T-DM1 使用 Agilent AssayMAPBravo 系统可实现稳定而可重现的自动化胰蛋白酶溶液内酶解。利用 Agilent 6550iFunnel Q-TOF LC/MS 系统可实现出色的质量精度与灵敏度,从而确保全面的序列覆盖与精确的多肽鉴定。 Agilent MassHunterBioConfirm 软件可实现自动化数据提取、序 列匹配与药物结合位点鉴定。T-DM1获得的序列覆盖率为98.7%。所鉴定的多肽涵盖了全部44个赖氨酸位点。44个位点中的29个被确定为药物结合位点。所鉴定的额外多肽涵盖了5个位点,但无法清晰确定多肽修饰的精确位点。其余10个赖氨酸位点的药物结合情况无法得到证实。 图5.肽谱分析工作流程的重现性。A)两种已鉴定药物偶联多肽的8个母离子 EIC叠加图; B)4种代表性药物偶联多肽 EIC 积分峰面积散点图; C)%CV 小于10%、10%-20%以及大于20%的多肽数量饼图 查找当地的安捷伦客户中心:www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) www.agilent.com/chem/bioconfirm 联系我们: 仅限研究使用。 不可用于诊断目的。 LSCA-China_800@agilent.com 本文中的信息、说明和指标如有变更,恕不另行通知。 在线询价: ◎安捷伦科科(中国)有限公司,2015 2015年11月9日,中国出版 www.agilent.com/chem/erfq-cn 5991-6389CHCN Agilent Technologies 前言结合了单克隆抗体 (mAb) 特异性与细胞毒性分子效能的抗体药物偶联物 (ADC) 已获得了越来越多的关注,它作为一种极具前景的方法可用于实现选择性更强的癌症治疗。由于潜在药物结合位点众多且在这些位点中的占位形式多样,因此 ADC 与未修饰的生物治疗抗体相比具有更高复杂性与异质性。为获得 ADC 分子的完全表征,本研究进行肽谱分析实验以获得关于 ADC 结合位点的详细位点特异性信息。本应用简报介绍了结合采用 Agilent AssayMAP Bravo 样品前处理平台的自动化蛋白质酶解、采用高分辨率精确质量数 Agilent 6550 iFunnel Q-TOF 系统的 LC/MS 分析以及 Agilent BioConfirm 软件的 ADC 肽谱分析工作流程。T-DM1 获得的序列覆盖率为 98.7%。采用药物偶联物可鉴定出 29 个以上的赖氨酸位点。结论本文开发出一种用于深入表征抗体药物偶联物的集成化肽谱分析工作流程。实验结果证明,针对 T-DM1 使用 Agilent AssayMAP Bravo 系统可实现稳定而可重现的自动化胰蛋白酶溶液内酶解。利用 Agilent 6550 iFunnel Q-TOF LC/MS 系统可实现出色的质量精度与灵敏度,从而确保全面的序列覆盖与精确的多肽鉴定。Agilent MassHunter BioConfirm 软件可实现自动化数据提取、序列匹配与药物结合位点鉴定。T-DM1 获得的序列覆盖率为 98.7%。所鉴定的多肽涵盖了全部 44 个赖氨酸位点。44 个位点中的 29 个被确定为药物结合位点。所鉴定的额外多肽涵盖了 5 个位点,但无法清晰确定多肽修饰的精确位点。其余 10 个赖氨酸位点的药物结合情况无法得到证实。
确定






还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《抗体-药物偶联物中药物结合位点检测方案(液相色谱仪)》,该方案主要用于其他中其他检测,参考标准--,《抗体-药物偶联物中药物结合位点检测方案(液相色谱仪)》用到的仪器有Agilent 1290 Infinity II 液相色谱系统、Agilent AssayMAP Bravo 蛋白质样品前处理平台、Agilent 1290 Infinity II Multisampler
推荐专场
该厂商其他方案
更多
























